Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение сродства связывания (KD) радиомеченных антител к обездвиженным антигенам
В этой статье
Резюме
Здесь описан способ определения сродства связывания (KD) радиомеченных антител к обездвиженным антигенам. KD - константа равновесной диссоциации, которая может быть определена из эксперимента по связыванию насыщения путем измерения общего, специфического и неспецифического связывания радиомеченого антитела в различных концентрациях с его антигеном.
Аннотация
Определение сродства связывания (KD) является важным аспектом характеристики радиомеченных антител (rAb). Как правило, сродство связывания представлено константой диссоциации равновесия, KD, и может быть рассчитано как концентрация антитела, при которой половина сайтов связывания антител занята в равновесии. Этот метод может быть обобщен на любое радиомаркированное антитело или другие белковые и пептидные каркасы. В отличие от клеточных методов, выбор иммобилизованных антигенов особенно полезен для подтверждения сродства связывания после длительного хранения антител, различения связывающего сродства фрагмента антигенсвязывающей области (Fab) в биспецифических конструкциях антител и определения того, есть ли изменчивость экспрессии антигена между различными клеточными линиями. Этот метод включает иммобилизацию фиксированного количества антигена в определенные скважины на бьющейся 96-луночной пластине. Затем неспецифическое связывание было заблокировано во всех скважинах бычьим сывороточным альбумином (BSA). Впоследствии rAb добавляли в градиент концентрации ко всем скважинам. Был выбран диапазон концентраций, позволяющих rAb достичь насыщения, т.е. концентрации антитела, при которой все антигены непрерывно связаны rAb. В назначенных лунках без иммобилизованного антигена может быть определено неспецифическое связывание rAb. Путем вычитания неспецифического связывания из общего связывания в лунках с иммобилизованным антигеном можно определить специфическое связывание rAb с антигеном. KD rAb был рассчитан на основе полученной кривой связывания насыщения. В качестве примера, сродство связывания определяли с использованием радиомаркированного амивантамаба, биспецифического антитела к рецептору эпидермального фактора роста (EGFR) и белкам цитоплазматического мезенхимально-эпителиального перехода (cMET).
Введение
Радиомеченные антитела (rAb) имеют множество применений в медицине. В то время как большинство из них используются в онкологии в качестве визуальных и терапевтических агентов, существуют приложения визуализации для воспаления, связанного с ревматологией, кардиологии и неврологии1. Визуализация rAbs обладает высокой чувствительностью к обнаружению поражений и может помочь в выборе пациента для лечения 2,3,4,5. Они также используются для терапии из-за их специфичности для соответствующих антигенов. В стратегии, известной как тераностика, один и тот же rAb используется как для визуализации, так и для лечения6.
В идеале, антитело, выбранное для радиомаркировки, уже доказало высокое сродство связывания и специфичность с использованием методов без радиомеблирования. Радиомаркировка антител может быть достигнута путем прямой химической модификации антител радионуклидом, который образует стабильные ковалентные связи (например, радиойод), или косвенно путем конъюгации с хелаторами, которые впоследствии координируются с радиометаллами 7,8. Прямая радиомаркировка, такая как с радиоактивным йодом, специфически модифицирует остатки тирозина и гистидина на антителе. Если эти остатки важны для связывания антигенов, то эта радиоконъюгация изменит сродство связывания. И наоборот, существует несколько установленных протоколов для конъюгации и косвенной радиомаркировки антител. Например, общим хелатором, используемым для связывания циркония-89 (89Zr) для ПЭТ-визуализации антител, является p-изотиоцианатобензил-десферриоксамин (DFO), который случайным образом конъюгируется с остатками лизина антитела 9,10. Если в антигенсвязывающей области есть остатки лизина, конъюгация в этих местах может стерически препятствовать связыванию антигена и, следовательно, ставить под угрозу связывание антитело с антигеном. Таким образом, различные методы радиоконъюгации, используемые для косвенной или прямой радиомаркировки антител, могут потенциально влиять на иммунореактивность, определяемую как способность радиоконъюгата антитела связываться со своим антигеном 7,11. Методы конъюгации, специфичные для сайта, могут обойти это ограничение, но эти методы требуют разработки антител для включения дополнительных остатков цистеина или опыта в ферментативных реакциях на углеводных остатках 12,13,14,15,16. После того, как антитело помечено радиоактивным путем, важно проверить, сохраняется ли иммунореактивность как часть характеристики rAb. Одним из способов измерения иммунореактивности является определение сродства связывания rAb.
Целью данного протокола является описание процесса определения сродства связывания для rAbs с использованием установленного анализа насыщения радиолигандами для количественной оценки связывания rAb-антигена. Связующая тенденция показана на рисунке 1. Количество связанного антигена будет увеличиваться по мере добавления большего количества rAb к фиксированному количеству иммобилизованного антигена. Как только все антигенсвязывающие сайты будут насыщены, будет достигнуто плато, и добавление большего количества rAbs не повлияет на количество связанного антигена. В этой модели константа равновесной диссоциации (KD) представляет собой концентрацию антитела, занимающего половину рецепторов антигена17. KD представляет собой то, насколько хорошо антитело связывается со своей мишенью с более низким KD, соответствующим более высокому сродству связывания. Ранее сообщалось, что идеальный rAb должен иметь KD 1 наномоляр или менее18. Тем не менее, более поздние rAbs были разработаны с KD в низком наномолярном диапазоне и считаются подходящими для неинвазивных приложений визуализации 19,20,21,22. Другим параметром, который может быть определен в анализе насыщения радиолигандов rAbs, является Bmax, который соответствует максимальному количеству антигенсвязывающего. Bmax может быть использован для расчета количества молекул антигена, если это необходимо.

Рисунок 1: Репрезентативная кривая связывания насыщенности. Процент связывания антигена строится на фоне увеличения концентрации антител, добавленных к фиксированному количеству антигена. Всплывающие окна демонстрируют привязку в различных точках. Показаны концентрация и связывание, соответствующие KD и Bmax, соответственно. Эта фигура была создана с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Этот анализ особенно важен для конструкций биспецифических антител с радиомаркированной маркировкой для определения KD для каждого фрагмента антигенсвязывающей области (Fab) меченого радиоактивными биспецифическими антителами, связывающимися с их соответствующими антигенами. Этот протокол может быть использован для определения KD каждого fab-плеча отдельно на иммобилизованных антигенах, чтобы независимо охарактеризовать, было ли затронуто сродство связывания каждой руки Fab для его соответствующего антигена после радиоконъюгации. Этот протокол демонстрируется использованием радиомаркированного амивантамаба, биспецифического антитела к рецептору эпидермального фактора роста (EGFR) и белкам цитоплазматического мезенхимально-эпителиального перехода (cMET)19. В качестве примеров19 также использовались радиомаркированные однорукие антитела, где одно плечо Fab связывается с EGFR (α-EGFR) или с cMET (α-cMET), а другое плечо Fab является контролем изотипа. Этот протокол также подходит для любого радиомаркированного антитела с известным антигеном, которое может быть иммобилизовано. В этом протоколе серия разбавления rAb добавляется к фиксированному количеству иммобилизованного антигена в назначенных скважинах, специфичных для каждого Fab-плеча rAb. rAb также добавляют в лунки, которые были заблокированы только бычьим сывороточным альбумином (BSA), без антигена, для определения неспецифического связывания. Для определения специфического связывания из общего связывания rAb вычитают неспецифическое связывание с иммобилизованным антигеном. Полученная кривая связывания насыщения затем используется для определения KD, как описано выше.
Одним из преимуществ этого метода является более высокая воспроизводимость при использовании очищенных антигенов по сравнению с использованием клеточных линий в качестве источника антигенов, учитывая, что уровни экспрессии антигенов могут быть затронуты во время клеточной культуры и что различные клеточные линии имеют переменные уровни экспрессии антигенов. В случае радиомаркированных биспецифических антител клеточные линии, которые экспрессируют только один из антигенов без другого, могут быть недоступны, что делает характеристику сродства связывания отдельных рукавов Fab очень сложной. Примечательно, что ключевым преимуществом метода анализа насыщения радиолигандами перед методами без радиомечания является специфическая характеристика сродства связывания rAb без вклада несопряженной фракции rAb. Насколько известно авторам, в настоящее время не существует методов очистки, отделяющих rAb от его родительского неконъюгированного антитела. Учитывая относительно небольшие размеры хелатора и радионуклида, их вклад в общую молекулярную массу rAb незначителен по размерам исключающей хроматографии. Таким образом, продукт, полученный в результате любой техники радиомаркировки, почти всегда представляет собой смесь rAb и его родительского неконъюгированного антитела. Характеристика сродства связывания с использованием радиомаркированного анализа насыщения гарантирует, что тестируемый продукт является исключительно rAb.
протокол
ПРИМЕЧАНИЕ: Графическое представление протокола приведено на рисунке 2 .
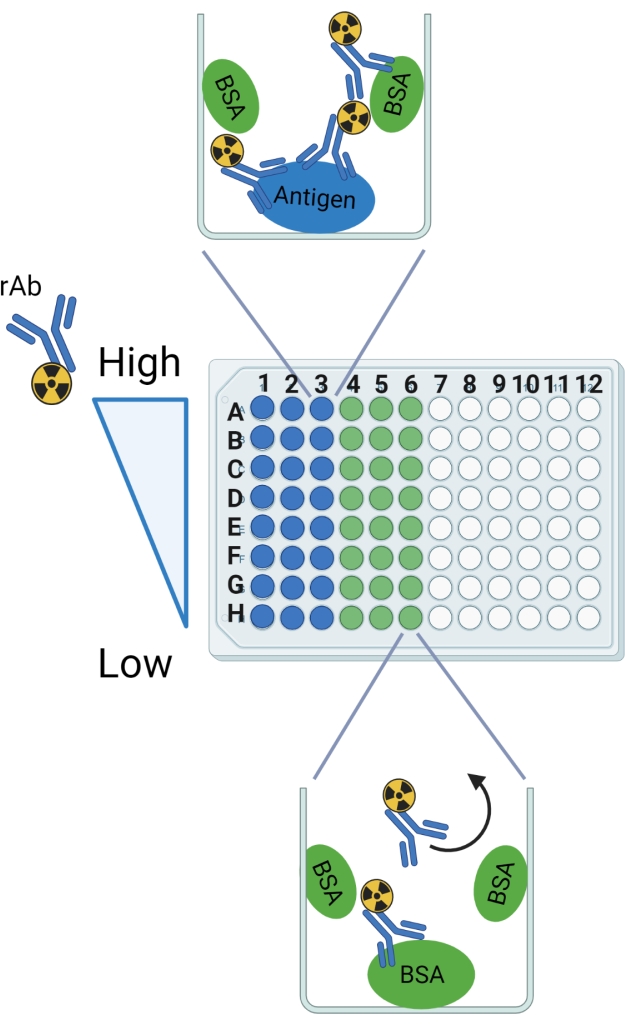
Рисунок 2: Схема протокола. Метки рядов и столбцов указаны в качестве руководства для установки бьющейся плиты из 96 скважин. Ожидаемое связывание показано в примере хорошо для антигена и BSA. Изогнутая стрелка обозначает rAb, который, как ожидается, будет вымыт из скважин только с BSA. Эта фигура была создана с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
1. Подготовка буфера
- Готовят 50 мл иммобилизационного буфера (водный раствор 50 мМNa2CO3; рН = 9,0).
- Взвесьте 191 мг NaHCO3 и 23,9 мг Na2CO3 на бумаге для взвешивания и переложите в коническую трубку объемом 50 мл. Добавьте 40 мл воды 18 МОм и вихрь для растворения. При необходимости отрегулируйте pH до 9,0, прежде чем довести общий объем до 50 мл с водой 18 МОм.
- Приготовьте приблизительно 200 мл промывочного буфера (фосфатно-буферный физиологический раствор (PBS), содержащий 0,05% Tween-20), добавив 200 мл PBS, а затем 100 мкл Tween-20 в бутылку 250 мл.
- Готовят 50 мл связывающего буфера (PBS, содержащий 0,05% Tween-20 и 0,1% бычьего сывороточного альбумина (BSA)).
- Взвесьте 50 мг BSA на бумаге для взвешивания и переложите в коническую трубку объемом 50 мл. Добавьте в пробирку 50 мл PBS, а затем 25 мкл Tween-20. Вихрь аккуратно перемешать.
- Подготовьте 50 мл блокирующего буфера (3% BSA в PBS).
- Взвесьте 1,5 г BSA на бумаге для взвешивания и переложите в коническую трубку объемом 50 мл. Добавьте 50 мл PBS и осторожно перемешайте.
ПРИМЕЧАНИЕ: Все буферы рекомендуется хранить до 1 недели при температуре 4 °C для достижения наилучших результатов.
- Взвесьте 1,5 г BSA на бумаге для взвешивания и переложите в коническую трубку объемом 50 мл. Добавьте 50 мл PBS и осторожно перемешайте.
2. Иммобилизация антигена
- Разбавляют антиген в иммобилизационном буфере до концентрации 5 мкг/мл.
- Добавьте 100 мкл на лунку антигена на дно 24 скважин бьющейся 96-луночной плоскодонной пластины в массиве 8 х 3 (столбцы 1-3 для рядов A-H). Накройте пластину уплотнительной лентой.
ПРИМЕЧАНИЕ: Убедитесь, что поверхность плиты скважины была обработана для максимальной адсорбции смешанных гидрофобных и гидрофильных доменов. Эти предварительно обработанные пластины коммерчески доступны. - Инкубировать при 4 °C в течение ночи.
- На следующий день вымойте тарелку 3 раза с буфером для стирки.
- Быстро переверните пластину в раковине, чтобы избавиться от жидкости, и постучите пластиной по куче бумажных полотенец, чтобы удалить лишнюю жидкость.
- Используя многоканальную пипетку, добавьте 300 мкл на лунку промывочного буфера в скважины, содержащие антиген. Удалите жидкость, как описано в разделе 2.4.1. Повторите этап стирки в общей сложности три раза.
3. Блокировка неспецифических сайтов с помощью BSA
- Используя многоканальную пипетку, добавьте 300 мкл на скважину блокирующего буфера к 24 скважинам с антигенным покрытием и 24 пустым скважинам 96-луночного листа (столбцы 1-6 для рядов A-H).
- Инкубировать пластину в течение 1 ч при температуре окружающей среды.
- Промывайте пластину с 300 мкл на лунку промывочного буфера в общей сложности три раза. Обратитесь к шагу 2.4 для подробного описания промывки пластины.
4. Последовательное разбавление и добавление раствора rAb
ВНИМАНИЕ: Следующие шаги связаны с радиоактивностью. Шаги должны выполняться только теми, кто прошел подготовку по радиационной безопасности. Исследователи должны удвоить перчатки и выполнить шаги с адекватным экранированием.
- Синтезируют исследуемый rAb с помощью метода выбора. RAbs, использованные в качестве примера, были синтезированы, как описано ранее19.
ПРИМЕЧАНИЕ: Этот протокол фокусируется на характеристике rAb после радиомаркировки. - Сделайте 8 x 3-кратных последовательных разведений (предназначенных для рядов A-H на пластине) rAb в буфере связывания.
ПРИМЕЧАНИЕ: Концентрации серийных разбавлений будут варьироваться для каждого rAb. Подробности обсуждаются в разделе Обсуждение. Если коэффициент разрежения изменяется, объем, необходимый для каждого разбавления, должен быть пересчитан, чтобы обеспечить достаточный объем для 1) связывания rAb в каждой скважине, 2) посева следующего разбавления и 3) аликвотирования стандартного раствора rAb для гамма-счета для измерения радиоактивности общего rAb, добавленного к каждой скважине.- Рассчитать объем запаса rAb необходимо для получения 1,2 мл раствора первой концентрации (маркировка как А).
- Добавьте 800 мкл связывающего буфера в микроцентрифужные трубки с маркировкой B, C, D, ... до Н. Добавить 1,2 мл минус объем, рассчитанный на этапе 4.2.1 связующего буфера, в микроцентрифужную трубку с маркировкой А.
- Добавить объем запаса rAb, рассчитанный в пункте 4.2.1, к трубке А. Осторожно перемешайте, а затем раскрутите вниз, используя мини-микроцентрифугу, чтобы собрать всю жидкость на дне трубки.
- Добавьте 400 мкл из пробирки А в пробирку В. Вихрь для смешивания, а затем вращения вниз с помощью мини-микроцентрифуги. Повторите добавление от B к C, C к D, ..., G к H.
- Добавьте 100 мкл на лунку каждого разбавления в три скважины, обездвиженные антигеном, и три лунки, заблокированные только BSA. Например, добавьте разбавление А в скважины А1-А3 (антиген) и А4-А6 (БСА).
- Добавляют 100 мкл каждого разведения в микроцентрифужные пробирки с маркировкой A std - H std. Сохраните эти трубки в качестве стандартов rAb для анализа в гамма-счетчике.
- Инкубировать пластину в течение 1 ч при 37 °C с мягким раскачиванием.
5. Промывка пластин и анализ радиоактивности
- Маркировка микроцентрифужных трубок для каждой скважины (от А1 до А6, от В1 до В6 ... через Н1-Н6). При желании используйте два разных цветных маркера для цветовых кодов образцов - один для скважин, покрытых антигеном, и один для скважин только с BSA.
- Аспирируйте rAb из каждой скважины с помощью вакуумного аспиратора.
- Используя многоканальную пипетку, добавьте 300 мкл промывочного буфера в каждую скважину. Аспирируйте буфер стирки. Повторите стирку в общей сложности пять раз.
- Разбейте колодцы на соответствующие микроцентрифужные трубы.
- Подсчитайте радиоактивность в лампах с помощью гамма-счетчика. Сначала подсчитайте трубки с антигеном (H1, H2, H3 до A1, A2, A3), а затем только с BSA (H4, H5, H6 до A4, A5, A6). Чтобы свести к минимуму помехи, отдельно подсчитайте стандарты для каждого разбавления (от H std до A std) в разное время.
6. Анализ данных
ПРИМЕЧАНИЕ: Дополнительные файлы содержат соответствующие шаблоны электронных таблиц и статистического анализа для анализа и построения данных.
- В электронной таблице рассчитайте общую, конкретную и неконкретную привязку для каждого образца (см. шаблон электронной таблицы, вложенный в качестве дополнительного файла).
- Рассчитайте "Связанную активность" как количество в минуту (CPM) образца (полученного из гамма-счетчика), деленное на CPM соответствующего стандарта. Вычислите "% Bound" как связанное действие, умноженное на 100.
- Рассчитать "Общую связанность, моль/л", умножив "% связанной" на концентрацию (моль/л) добавленного rAb. Рассчитать "Total Bound, mol", умножив "Total Bound, mol/L" на объем rAb, добавленный в литрах (0,0001 л).
- Рассчитайте "Специфическое связывание, моль", вычитая "Total Bound, mol" разбавлений BSA из разведений антигена таким образом, чтобы A1 соответствовал A4, A2 - A5, A3 - A6, B1 - B4 и т.д.
- Рассчитайте «Неспецифическое связывание, моль», вычитая «Специфическое связывание, моль» из «Общее связывание, моль» для каждой лунки.
- В программном обеспечении для построения графиков статистического анализа постройте концентрацию добавленного rAb (нмоль/л) на оси X по сравнению с связыванием (моль) на оси Y. Создайте отдельные группы для построения в трех экземплярах общего связывания, конкретного связывания и неспецифического связывания. Выполните нелинейный анализ соответствия, выбрав следующие параметры в используемом программном обеспечении (Таблица материалов; см. шаблон статистического анализа, прикрепленный в качестве дополнительного файла).
- Выберите Новый анализ. В разделе Анализ XY выберите Нелинейная регрессия (соответствие кривой). Убедитесь, что все данные выбраны в разделе Анализ каких наборов данных?, а затем нажмите кнопку ОК.
- На вкладке Модель в разделе Привязка - Насыщенность выберите Один сайт - Конкретная привязка. На вкладке Уверенность выберите Определить «неоднозначные» соответствия. Оставьте все остальные параметры по умолчанию и нажмите кнопку ОК.
ПРИМЕЧАНИЕ: Это позволит рассчитать KD и Bmax для общей, конкретной и неспецифической привязки. KD специфического связывания представляет собой KD в нмоль/л rAb, связанного с антигеном.
Результаты
Этот метод рассчитывает сродство связывания (KD) для rAb на основе анализа связывания насыщения, где различные концентрации rAb были добавлены к фиксированному количеству иммобилизованного антигена. Кривая связывания должна следовать за логарифмическим ростом, где он изначально кр...
Обсуждение
В рамках разработки rAbs важно обеспечить, чтобы rAb связывался конкретно со своей целью с высоким сродством связывания. Определение сродства связывания может информировать о том, влияет ли иммунореактивность rAb на радиоконъюгацию через анализ насыщения радиолигандами с использованием ?...
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Авторы благодарят 3D Imaging за производство [89Zr]Zr-оксалата и доктора Шери Мурс из Janssen Pharmaceuticals за предоставление антител.
Материалы
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
Ссылки
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены