Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Determinación de la afinidad de unión (KD) de anticuerpos radiomarcados a antígenos inmovilizados
En este artículo
Resumen
Aquí, se describe un método para determinar la afinidad de unión (KD) de los anticuerpos radiomarcados a los antígenos inmovilizados. KD es la constante de disociación de equilibrio que se puede determinar a partir de un experimento de unión a la saturación midiendo la unión total, específica e inespecífica de un anticuerpo radiomarcado a varias concentraciones de su antígeno.
Resumen
La determinación de la afinidad de unión (KD) es un aspecto importante de la caracterización de los anticuerpos radiomarcados (rAb). Típicamente, la afinidad de unión está representada por la constante de disociación de equilibrio, KD, y se puede calcular como la concentración de anticuerpos a la que la mitad de los sitios de unión de anticuerpos están ocupados en equilibrio. Este método se puede generalizar a cualquier anticuerpo radiomarcado u otros andamios de proteínas y péptidos. A diferencia de los métodos basados en células, la elección de antígenos inmovilizados es particularmente útil para validar las afinidades de unión después del almacenamiento a largo plazo de anticuerpos, distinguir las afinidades de unión de fragmentos de brazos de región de unión a antígenos (Fab) en construcciones de anticuerpos biespecíficos y determinar si hay variabilidad en la expresión de antígenos entre diferentes líneas celulares. Este método consiste en inmovilizar una cantidad fija de antígeno en pozos específicos en una placa rompible de 96 pocillos. Luego, se bloqueó la unión inespecífica en todos los pocillos con albúmina sérica bovina (BSA). Posteriormente, el rAb se agregó en un gradiente de concentración a todos los pozos. Se eligió un rango de concentraciones para permitir que el rAb alcance la saturación, es decir, una concentración de anticuerpos en la que todos los antígenos están unidos continuamente por el rAb. En pozos designados sin antígeno inmovilizado, se puede determinar la unión inespecífica del rAb. Al restar la unión inespecífica de la unión total en los pocillos con antígeno inmovilizado, se puede determinar la unión específica del rAb al antígeno. La KD del rAb se calculó a partir de la curva de unión de saturación resultante. Como ejemplo, la afinidad de unión se determinó utilizando amivantamab radiomarcado, un anticuerpo biespecífico para el receptor del factor de crecimiento epidérmico (EGFR) y las proteínas de transición mesenquimal-epitelial citoplasmática (cMET).
Introducción
Los anticuerpos radiomarcados (rAb) tienen una variedad de usos en medicina. Si bien la mayoría se utilizan en oncología como agentes terapéuticos y de imágenes, existen aplicaciones de imágenes para la inflamación relacionada con la reumatología, la cardiología y la neurología1. Imaging rAbs tiene una alta sensibilidad para detectar lesiones y tiene el potencial de ayudar en la selección del paciente para el tratamiento 2,3,4,5. También se utilizan para la terapia debido a su especificidad para sus respectivos antígenos. En una estrategia conocida como teranóstica, se utiliza el mismo rAb tanto para la imagen como para el tratamiento6.
Idealmente, el anticuerpo elegido para el radiomarcado es uno que ya ha demostrado tener una alta afinidad y especificidad de unión utilizando métodos no radiomarcados. El radiomarcado de anticuerpos se puede lograr a través de la modificación química directa de anticuerpos con un radionúclido que forma enlaces covalentes estables (por ejemplo, yodo radioactivo), o indirectamente a través de la conjugación con quelantes que posteriormente se coordinan con radiometales 7,8. El radiomarcado directo, como con yodo radioactivo, modifica específicamente los residuos de tirosina e histidina en el anticuerpo. Si estos residuos son importantes para la unión de antígenos, entonces esta radioconjugación alteraría la afinidad de unión. Por el contrario, existen múltiples protocolos establecidos para la conjugación y el radiomarcado indirecto de anticuerpos. Por ejemplo, un quelante común utilizado para unir zirconio-89 (89Zr) para la obtención de imágenes PET de anticuerpos es el p-isotiocianatobencil-deferoxamina (DFO), que se conjuga aleatoriamente con residuos de lisina del anticuerpo 9,10. Si hay residuos de lisina en la región de unión al antígeno, la conjugación en estos sitios podría dificultar estéricamente la unión al antígeno y, por lo tanto, comprometer la unión anticuerpo-antígeno. Así, los diferentes métodos de radioconjugación utilizados para el radiomarcado indirecto o directo de anticuerpos pueden afectar potencialmente a la inmunorreactividad, definida como la capacidad del anticuerpo radioconjugado para unirse a su antígeno 7,11. Los métodos de conjugación específicos del sitio pueden eludir esta limitación, pero estas técnicas requieren ingeniería de anticuerpos para incorporar residuos adicionales de cisteína o experiencia en reacciones enzimáticas en residuos de carbohidratos 12,13,14,15,16. Una vez que un anticuerpo está radiomarcado, es importante probar si la inmunorreactividad se retiene como parte de la caracterización del rAb. Una forma de medir la inmunorreactividad es determinar la afinidad de unión del rAb.
El propósito de este protocolo es describir un proceso para determinar la afinidad de unión para rAbs utilizando un ensayo de saturación de radioligando establecido para cuantificar la unión a rAb-antígeno. La tendencia de enlace se describe en la Figura 1. La cantidad de antígeno unido aumentará a medida que se agregue más rAb a una cantidad fija de antígeno inmovilizado. Una vez que todos los sitios de unión a antígenos estén saturados, se alcanzará una meseta, y agregar más rAbs no tendrá ningún efecto sobre la cantidad de antígeno unido. En este modelo, la constante de disociación de equilibrio (KD) es la concentración de anticuerpo que ocupa la mitad de los receptores de antígeno17. El KD representa qué tan bien se une un anticuerpo a su objetivo con un KD más bajo que corresponde a una afinidad de unión más alta. Anteriormente se informó que un rAb ideal debería tener un KD de 1 nanomolar o menos18. Sin embargo, los rAbs más recientes se han desarrollado con KD en el rango nanomolar bajo, y se consideran adecuados para aplicaciones de imágenes no invasivas 19,20,21,22. Otro parámetro que se puede determinar en el ensayo de saturación de radioligandos de rAbs es Bmax, que corresponde a la cantidad máxima de unión a antígenos. Bmax se puede utilizar para calcular el número de moléculas de antígeno si es necesario.

Figura 1: Curva de unión de saturación representativa. El porcentaje de antígeno unido se traza contra el aumento de las concentraciones de anticuerpos agregados a una cantidad fija de antígeno. Las ventanas emergentes muestran la vinculación en varios puntos. Se muestran la concentración y la unión correspondientes a KD y Bmáx., respectivamente. Esta figura fue creada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
Este ensayo es particularmente importante para las construcciones de anticuerpos biespecíficos radiomarcados para determinar la KD para cada fragmento de región de unión al antígeno (Fab) del brazo de anticuerpos biespecíficos radiomarcados con sus respectivos antígenos. Este protocolo se puede utilizar para determinar la KD de cada brazo Fab por separado en antígenos inmovilizados para caracterizar de forma independiente si la afinidad de unión de cada brazo Fab por su respectivo antígeno se vio afectada después de la radioconjugación. Este protocolo se demuestra mediante el uso de amivantamab radiomarcado, un anticuerpo biespecífico para el receptor del factor de crecimiento epidérmico (EGFR) y las proteínas de transición mesenquimal-epitelial citoplasmática (cMET)19. Los anticuerpos radiomarcados de un solo brazo, donde un brazo Fab se une a EGFR (α-EGFR) o a cMET (α-cMET) y el otro brazo Fab es un control de isotipo, también se utilizaron como ejemplos19. Este protocolo también es apropiado para cualquier anticuerpo radiomarcado con un antígeno conocido que pueda ser inmovilizado. En este protocolo, se agrega una serie de dilución del rAb a una cantidad fija de antígeno inmovilizado en pozos designados específicos para cada brazo Fab del rAb. El rAb también se agrega a los pocillos que solo han sido bloqueados con albúmina sérica bovina (BSA), sin antígeno, para determinar la unión inespecífica. Para determinar la unión específica, la unión inespecífica al antígeno inmovilizado se resta de la unión total de rAb. La curva de unión de saturación resultante se utiliza para determinar KD, como se describió anteriormente.
Una ventaja de este método es una mayor reproducibilidad cuando se utilizan antígenos purificados en comparación con el uso de líneas celulares como fuente de antígenos, dado que los niveles de expresión de antígenos podrían verse afectados durante el cultivo celular y que las diferentes líneas celulares tienen niveles variables de expresión de antígenos. En el caso de los anticuerpos biespecíficos radiomarcados, las líneas celulares que solo expresan uno de los antígenos sin el otro pueden no estar disponibles, lo que haría que la caracterización de la afinidad de unión de los brazos Fab individuales sea muy difícil. En particular, la ventaja clave del método de ensayo de saturación de radioligando sobre los métodos no radiomarcados es la caracterización específica de la afinidad de unión del rAb sin la contribución de la fracción no conjugada del rAb. Según el mejor conocimiento de los autores, actualmente no existen técnicas de purificación para separar el rAb de su anticuerpo no conjugado padre. Dado el tamaño relativamente pequeño del quelante y el radionúclido, su contribución al peso molecular total del rAb es insignificante en cromatografía de exclusión de tamaño. Por lo tanto, el producto generado a partir de cualquier técnica de radiomarcado es casi siempre una mezcla del rAb y su anticuerpo no conjugado padre. La caracterización de la afinidad de unión mediante el ensayo de saturación radiomarcado garantiza que el producto que se está probando sea únicamente el rAb.
Protocolo
NOTA: Consulte la Figura 2 para obtener una representación gráfica del protocolo.
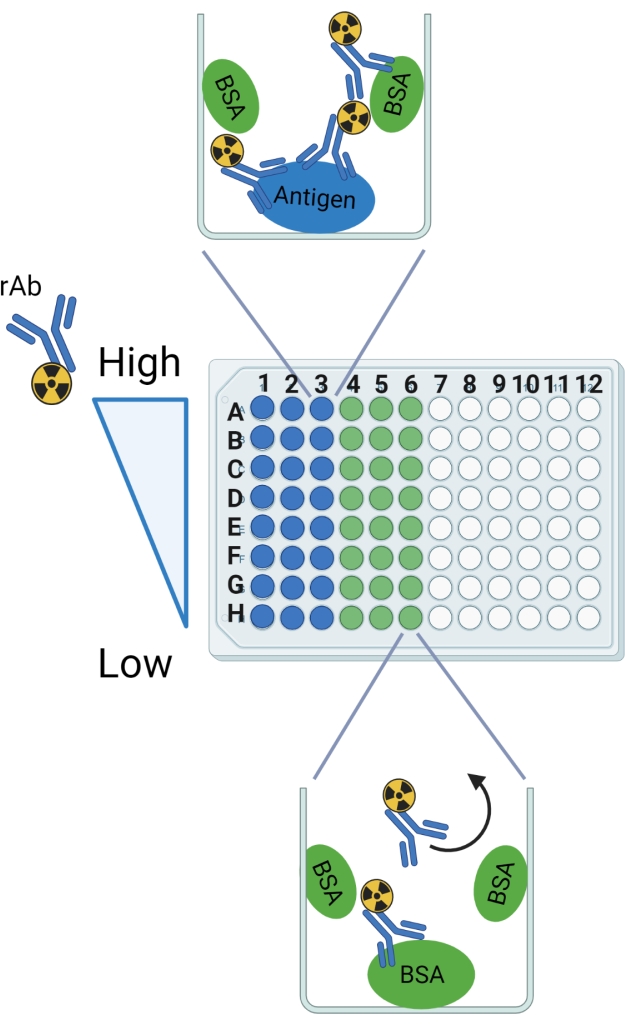
Figura 2: Esquema del protocolo. Las etiquetas de fila y columna se indican como una guía para configurar la placa rompible de 96 pocillos. La unión anticipada se muestra en un pozo de ejemplo para el antígeno y el BSA. La flecha curva designa el rAb que se espera que sea lavado de los pozos con BSA solamente. Esta figura fue creada con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
1. Preparación del búfer
- Preparar 50 mL de tampón de inmovilización (solución acuosa de 50 mM Na2CO3; pH = 9.0).
- Pesar 191 mg de NaHCO3 y 23,9 mg de Na2CO3 sobre papel de pesaje y transferir a un tubo cónico de 50 ml. Agregue 40 ml de agua de 18 MΩ y vórtice para disolver. Ajuste el pH a 9.0 si es necesario antes de llevar el volumen total a 50 ml con 18 MΩ de agua.
- Prepare aproximadamente 200 ml de tampón de lavado (solución salina tamponada con fosfato (PBS) que contiene 0.05% Tween-20) agregando 200 ml de PBS y luego 100 μL de Tween-20 a una botella de 250 ml.
- Preparar 50 ml de tampón de unión (PBS que contiene 0,05% tween-20 y 0,1% de albúmina sérica bovina (BSA)).
- Pesar 50 mg de BSA sobre papel de pesaje y transferir a un tubo cónico de 50 ml. Agregue 50 ml de PBS y luego 25 μL de Tween-20 al tubo. Vórtice suavemente para mezclar.
- Preparar 50 ml de tampón de bloqueo (3% BSA en PBS).
- Pesar 1,5 g de BSA sobre papel de pesaje y transferir a un tubo cónico de 50 ml. Agregue 50 ml de PBS y vórtice suavemente para mezclar.
NOTA: Se recomienda que todos los búferes se almacenen durante un máximo de 1 semana a 4 °C para obtener los mejores resultados.
- Pesar 1,5 g de BSA sobre papel de pesaje y transferir a un tubo cónico de 50 ml. Agregue 50 ml de PBS y vórtice suavemente para mezclar.
2. Inmovilización de antígenos
- Diluir el antígeno en tampón de inmovilización para alcanzar una concentración de 5 μg/ml.
- Agregue 100 μL por pocillo de antígeno al fondo de 24 pocillos de una placa rompible de fondo plano de 96 pocillos en una matriz de 8 x 3 (columnas 1-3 para las filas A-H). Cubra la placa con cinta de sellado.
NOTA: Asegúrese de que la superficie de la placa del pozo haya sido tratada para maximizar la adsorción de dominios hidrófobos e hidrófilos mixtos. Estas placas pretratadas están disponibles comercialmente. - Incubar a 4 °C durante la noche.
- Al día siguiente, lave el plato 3x con tampón de lavado.
- Invierta la placa rápidamente en el fregadero para desechar el líquido y golpee la placa con una pila de toallas de papel para eliminar el exceso de líquido.
- Usando una pipeta multicanal, agregue 300 μL por pocillo de tampón de lavado a los pozos que contienen el antígeno. Retire el líquido como se describe en 2.4.1. Repita el paso de lavado un total de tres veces.
3. Bloqueo de sitios no específicos con BSA
- Usando una pipeta multicanal, agregue 300 μL por pozo de tampón de bloqueo a los 24 pozos recubiertos de antígenos y 24 pozos vacíos de la placa de 96 pocillos (columnas 1-6 para las filas A-H).
- Incubar la placa durante 1 h a temperatura ambiente.
- Lave la placa con 300 μL por pocillo de tampón de lavado un total de tres veces. Consulte el paso 2.4 para obtener una descripción detallada del lavado de la placa.
4. Diluciones en serie y adición de la solución rAb
PRECAUCIÓN: Los siguientes pasos implican radiactividad. Los pasos solo deben ser realizados por personas con capacitación en seguridad radiológica. Los investigadores deben doble guante y realizar pasos con el blindaje adecuado.
- Sintetizar el rAb bajo investigación utilizando el método de elección. Los rAbs utilizados como ejemplo fueron sintetizados como se describió anteriormente19.
NOTA: Este protocolo se centra en la caracterización de un rAb una vez radiomarcado. - Haga diluciones en serie de 8 x 3 veces (designadas para filas A-H en la placa) del rAb en el tampón de unión.
NOTA: Las concentraciones de las diluciones en serie variarán para cada rAb. Los detalles se discuten en la sección Discusión. Si el factor de dilución cambia, el volumen necesario para cada dilución debe recalcularse para asegurar un volumen suficiente para 1) la unión del rAb en cada pozo, 2) la siembra de la siguiente dilución y 3) la alícuota de una solución estándar de rAb para el conteo gamma para medir la radiactividad del rAb total agregado a cada pozo.- Calcular el volumen de stock de rAb necesario para hacer una solución de 1,2 ml de la primera concentración (etiqueta como A).
- Añadir 800 μL de tampón de unión a los tubos de microcentrífuga etiquetados como B, C, D, ... a H. Añadir 1,2 ml menos el volumen calculado en el paso 4.2.1 del tampón de unión a un tubo de microcentrífuga etiquetado como A.
- Añadir el volumen de rAb de stock calculado en 4.2.1 al tubo A. Vórtice suavemente para mezclar y luego girar hacia abajo usando una mini microcentrífuga para recoger todo el líquido en la parte inferior del tubo.
- Añadir 400 μL del tubo A al tubo B. Vórtice para mezclar y luego girar hacia abajo usando una mini microcentrífuga. Repita la adición de B a C, C a D, ..., G a H.
- Agregue 100 μL por pocillo de cada dilución a tres pocillos inmovilizados con antígeno y tres pocillos bloqueados solo con BSA. Por ejemplo, agregue dilución A a los pocillos A1-A3 (antígeno) y A4-A6 (BSA).
- Añadir 100 μL de cada dilución a los tubos de microcentrífuga etiquetados como A std - H std. Guarde estos tubos como estándares de rAb para ser ensayados en el contador gamma.
- Incubar la placa durante 1 h a 37 °C con balanceo suave.
5. Lavar las placas y probar la radiactividad
- Etiquete los tubos de microcentrífuga para cada pozo (A1 a A6, B1 a B6 ... a través de H1-H6). Use dos marcadores de colores diferentes para codificar muestras de colores si lo desea: uno para pozos recubiertos con antígeno y otro para pozos con BSA solamente.
- Aspire el rAb de cada pozo usando un aspirador de vacío.
- Usando una pipeta multicanal, agregue 300 μL de tampón de lavado a cada pozo. Aspira el tampón de lavado. Repita el lavado un total de cinco veces.
- Rompa los pozos en los tubos de microcentrífuga apropiados.
- Cuente la radiactividad en los tubos usando un contador gamma. Cuente primero los tubos con el antígeno (H1, H2, H3 a A1, A2, A3), y luego aquellos con BSA solamente (H4, H5, H6 a A4, A5, A6). Para minimizar la interferencia, cuente por separado los estándares para cada dilución (H std a A std) en un momento diferente.
6. Análisis de datos
NOTA: Los archivos complementarios contienen las correspondientes plantillas de hoja de cálculo y análisis estadístico para analizar y trazar los datos.
- En una hoja de cálculo, calcule el enlace total, específico e inespecífico para cada muestra (consulte la plantilla de hoja de cálculo adjunta como archivo complementario).
- Calcule "Actividad enlazada" como los recuentos por minuto (CPM) de la muestra (obtenidos del contador gamma) divididos por el CPM del estándar apropiado. Calcule "% bound" como actividad enlazada multiplicada por 100.
- Calcule "Total Bound, mol/L" multiplicando "% Bound" con la concentración (mol/L) del rAb añadido. Calcule "Total Bound, mol" multiplicando "Total Bound, mol/L" con el volumen de rAb añadido en litros (0.0001 L).
- Calcule "Specific Binding, mol" restando "Total Bound, mol" de las diluciones de BSA de las diluciones de antígenos de tal manera que A1 se empareje con A4, A2 con A5, A3 con A6, B1 con B4, etc.
- Calcule "Unión inespecífica, mol" restando "Unión específica, mol" de "Unión total, mol" para cada pozo.
- En el software de trazado de análisis estadístico, grafique la concentración de rAb añadido (nmol/L) en el eje x frente a la unión (mol) en el eje y. Cree grupos separados para trazar por triplicar el enlace total, el enlace específico y el enlace no específico. Realice un análisis de ajuste no lineal seleccionando los siguientes parámetros en el software utilizado (Tabla de materiales; consulte la plantilla de análisis estadístico adjunta como archivo complementario).
- Seleccione Nuevo análisis. En Análisis XY, seleccione Regresión no lineal (ajuste de curva).. Asegúrese de que todos los datos estén seleccionados en ¿Analizar qué conjuntos de datos? y, a continuación, seleccione Aceptar.
- En la ficha Modelo , en Enlace - Saturación, seleccione Un sitio - Enlace específico. En la pestaña Confianza , seleccione Identificar ajustes 'ambiguos'. Deje todos los demás parámetros como predeterminados y seleccione Aceptar.
NOTA: Esto calculará KD y Bmax para el enlace total, específico y no específico. La KD de la unión específica es la KD en nmol/L del rAb unido al antígeno.
Resultados
Este método calcula la afinidad de unión (KD) para un rAb basado en el ensayo de unión a la saturación donde se agregaron diferentes concentraciones de rAb a una cantidad fija de antígeno inmovilizado. La curva de unión debe seguir el crecimiento logarítmico donde inicialmente es empinado y luego se estanca a medida que el antígeno está saturado. Para garantizar que el KD determinado sea preciso, las concentraciones de rAb deben ser lo suficientemente altas como para alcanzar la saturación...
Discusión
Como parte del desarrollo de rAbs, es importante asegurarse de que un rAb se una específicamente a su objetivo con alta afinidad de unión. La determinación de la afinidad de unión puede informar si la inmunorreactividad del rAb se ve afectada por la radioconjugación a través del ensayo de saturación de radioligando utilizando antígeno inmovilizado. La determinación de la unión de rAb a BSA se puede utilizar para cuantificar la unión inespecífica para medir la unión específica al antígeno inmovilizado con m...
Divulgaciones
Los autores no tienen conflictos de intereses.
Agradecimientos
Los autores agradecen a 3D Imaging por la producción de [89Zr]Zr-oxalato y a la Dra. Sheri Moores de Janssen Pharmaceuticals por proporcionar anticuerpos.
Materiales
| Name | Company | Catalog Number | Comments |
| Bovine Serum Albumin (BSA) | Sigma-Aldrich | A9647 | |
| Gamma Counter | Hidex | Hidex Automatic Gamma Counter | |
| GraphPad Prism Software | GraphPad | version 9.2; used for statistical analyses in this study | |
| Immuno Breakable MaxiSorp 96-well plates | Thermo Scientific | 473768 | |
| Microplate Sealing Tape | Corning | 4612 | |
| Microsoft Excel | Microsoft | ||
| Phosphate Buffered Saline (PBS) | Gibco | 14190144 | |
| Sodium Bicarbonate | JT Baker | 3506-01 | |
| Sodium Carbonate | Sigma-Aldrich | S7795 | |
| Tween-20 | Sigma-Aldrich | P7949 |
Referencias
- Krecisz, P., Czarnecka, K., Krolicki, L., Mikiciuk-Olasik, E., Szymanski, P. Radiolabeled Peptides and Antibodies in Medicine. Bioconjugate Chemistry. 32 (1), 25-42 (2021).
- Dun, Y., Huang, G., Liu, J., Wei, W. ImmunoPET imaging of hematological malignancies: From preclinical promise to clinical reality. Drug Discovery Today. 27 (4), 1196-1203 (2022).
- Lohrmann, C., et al. Retooling a Blood-Based Biomarker: Phase I assessment of the high-affinity CA19-9 antibody HuMab-5B1 for immuno-pet imaging of pancreatic cancer. Clinical Cancer Research. 25 (23), 7014-7023 (2019).
- Pandit-Taskar, N., et al. A phase I/II study for analytic validation of 89Zr-J591 immunoPET as a molecular imaging agent for metastatic prostate cancer. Clinical Cancer Research. 21 (23), 5277-5285 (2015).
- Rousseau, C., et al. Initial clinical results of a novel immuno-PET theranostic probe in human epidermal growth factor receptor 2-negative breast cancer. Journal of Nuclear Medicine. 61 (8), 1205-1211 (2020).
- Moek, K. L., et al. Theranostics using antibodies and antibody-related therapeutics. Journal of Nuclear Medicine. 58 (2), 83-90 (2017).
- Chomet, M., van Dongen, G., Vugts, D. J. State of the art in radiolabeling of antibodies with common and uncommon radiometals for preclinical and clinical immuno-PET. Bioconjugate Chemistry. 32 (7), 1315-1330 (2021).
- Kumar, K., Ghosh, A. Radiochemistry, production processes, labeling methods, and immunoPET imaging pharmaceuticals of Iodine-124. Molecules. 26 (2), 414 (2021).
- Vosjan, M. J., et al. Conjugation and radiolabeling of monoclonal antibodies with zirconium-89 for PET imaging using the bifunctional chelate p-isothiocyanatobenzyl-desferrioxamine. Nature Protocols. 5 (4), 739-743 (2010).
- Zeglis, B. M., Lewis, J. S. The bioconjugation and radiosynthesis of 89Zr-DFO-labeled antibodies. Journal of Visualized Experiments: JoVE. (96), e52521 (2015).
- Wei, W., et al. ImmunoPET: concept, design, and applications. Chemical Reviews. 120 (8), 3787-3851 (2020).
- Tavaré, R., et al. An effective immuno-PET imaging method to monitor CD8-dependent responses to immunotherapy. Cancer Research. 76 (1), 73-82 (2016).
- Tavaré, R., et al. Engineered antibody fragments for immuno-PET imaging of endogenous CD8+ T cells in vivo. Proceedings of the National Academy of Sciences. 111 (3), 1108-1113 (2014).
- Zeglis, B. M., et al. Chemoenzymatic strategy for the synthesis of site-specifically labeled immunoconjugates for multimodal PET and optical imaging. Bioconjugate Chemistry. 25 (12), 2123-2128 (2014).
- Zeglis, B. M., et al. Enzyme-mediated methodology for the site-specific radiolabeling of antibodies based on catalyst-free click chemistry. Bioconjugate Chemistry. 24 (6), 1057-1067 (2013).
- Kristensen, L. K., et al. Site-specifically labeled 89Zr-DFO-trastuzumab improves immuno-reactivity and tumor uptake for immuno-PET in a subcutaneous HER2-positive xenograft mouse model. Theranostics. 9 (15), 4409-4420 (2019).
- Maguire, J. J., Kuc, R. E., Davenport, A. P., Davenport, A. P. . Radioligand binding assays and their analysis. in Receptor Binding Techniques. , 31-77 (2012).
- Davenport, A. P., Russell, F. D., Mather, S. J. Radioligand bindsing assays: theory and practice. Current Directions in Radiopharmaceutical Research and Development. , 169-179 (1996).
- Cavaliere, A., et al. Development of [89Zr]ZrDFO-amivantamab bispecific to EGFR and c-MET for PET imaging of triple negative breast cancer. European Journal of Nuclear Medicine and Molecular Imaging. 48 (2), 383-394 (2021).
- Marquez, B. V., et al. Evaluation of (89)Zr-pertuzumab in breast cancer xenografts. Molecular Pharmaceutics. 11 (11), 3988-3995 (2014).
- Marquez-Nostra, B. V., et al. Preclinical PET imaging of glycoprotein non-metastatic melanoma B in triple negative breast cancer: feasibility of an antibody-based companion diagnostic agent. Oncotarget. 8 (61), 104303-104314 (2017).
- Ghai, A., et al. Development of [(89)Zr]DFO-elotuzumab for immunoPET imaging of CS1 in multiple myeloma. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1302-1311 (2021).
- McKnight, B. N., et al. Imaging EGFR and HER3 through (89)Zr-labeled MEHD7945A (Duligotuzumab). Scientific Reports. 8 (1), 1-13 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados