A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التصوير المقطعي بالإصدار البوزيتروني القلبي عالي الدقة / التصوير المقطعي المحوسب للحيوانات الصغيرة
In This Article
Summary
هنا ، نقدم بروتوكول تصوير تجريبي لتحديد وظيفة القلب ومورفولوجيته باستخدام التصوير المقطعي بالإصدار البوزيتروني عالي الدقة / التصوير المقطعي المحوسب للحيوانات الصغيرة. يتم النظر في كل من الفئران والجرذان ، ومناقشة المتطلبات المختلفة لعوامل تباين التصوير المقطعي المحوسب للنوعين.
Abstract
يعد التصوير المقطعي بالإصدار البوزيتروني (PET) والتصوير المقطعي المحوسب (CT) من بين أكثر تقنيات التصوير التشخيصي استخداما ، وكلاهما يعمل في فهم وظيفة القلب والتمثيل الغذائي. في الأبحاث قبل السريرية ، يتم استخدام ماسحات ضوئية مخصصة ذات حساسية عالية ودقة مكانية زمانية عالية ، مصممة للتعامل مع المتطلبات التكنولوجية الصعبة التي يفرضها حجم القلب الصغير ومعدلات ضربات القلب المرتفعة جدا للفئران والجرذان. في هذه الورقة ، تم وصف بروتوكول تصوير القلب ثنائي النمط PET / CT لنماذج الفئران التجريبية و / أو الفئران لأمراض القلب ، من إعداد الحيوانات والحصول على الصور وإعادة بنائها إلى معالجة الصور والتصور.
على وجه الخصوص ، يسمح فحص 18 F-labeled fluorodeoxyglucose ([18F] FDG) - PET بقياس وتصور استقلاب الجلوكوز في الأجزاء المختلفة من البطين الأيسر (LV). الخرائط القطبية هي أدوات ملائمة لعرض هذه المعلومات. يتكون جزء التصوير المقطعي المحوسب من إعادة بناء ثلاثية الأبعاد للقلب بأكمله (4D-CT) باستخدام بوابات بأثر رجعي بدون خيوط تخطيط القلب الكهربائي (ECG) ، مما يسمح بالتقييم المورفولوجي الوظيفي ل LV والقياس الكمي اللاحق لأهم معلمات وظيفة القلب ، مثل الكسر القذفي (EF) وحجم السكتة الدماغية (SV). باستخدام ماسح ضوئي مدمج PET / CT ، يمكن تنفيذ هذا البروتوكول ضمن نفس تحريض التخدير دون الحاجة إلى إعادة وضع الحيوان بين الماسحات الضوئية المختلفة. وبالتالي ، يمكن اعتبار التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب كأداة شاملة للتقييم المورفولوجي الوظيفي والتمثيل الغذائي للقلب في العديد من النماذج الحيوانية الصغيرة لأمراض القلب.
Introduction
نماذج الحيوانات الصغيرة مهمة للغاية لتعزيز فهم أمراض القلب والأوعية الدموية 1,2. أحدثت أدوات التصوير التشخيصي غير الغازية ثورة في الطريقة التي ننظر بها إلى وظيفة القلب في العقود الماضية ، سواء في الإعدادات السريرية أو قبل السريرية. فيما يتعلق بنماذج الحيوانات الصغيرة لأمراض القلب ، تم تطوير أدوات تصوير محددة بدقة زمانية مكانية عالية جدا. وبالتالي ، يمكن لهذه الأدوات أن تتطابق مع الحاجة إلى تحديد كمي دقيق لمعلمات عضلة القلب الأيضية والحركية ذات الصلة على قلوب الفئران والجرذان الصغيرة جدا وسريعة الحركة في نماذج مرضية محددة ، مثل قصور القلب (HF)3 أو احتشاء عضلة القلب (MI)4. وهناك عدة طرائق متاحة لهذا الغرض، ولكل منها نقاط قوتها وضعفها. التصوير بالموجات فوق الصوتية (الولايات المتحدة) هو الطريقة الأكثر استخداما نظرا لمرونته الكبيرة ودقته الزمنية العالية جدا وتكلفته المنخفضة نسبيا. ازداد اعتماد تصوير القلب الأمريكي في الحيوانات الصغيرة بشكل كبير منذ ظهور الأنظمة التي تستخدم مجساتذات تردد فائق 5,6 ، تتميز بدقة مكانية أقل من 50 ميكرومتر.
من بين العيوب الرئيسية للولايات المتحدة لتصوير القلب 3D بالكامل هي الحاجة إلى مسح خطي على طول محور القلب عن طريق تركيب المسبار على مرحلة ترجمة آلية لإنشاء مجموعة كاملة من الصور الديناميكية B-mode للقلب كله7. في النهاية ، يؤدي هذا الإجراء (بعد التسجيل المكاني والزماني الدقيق للصور التي تم الحصول عليها في كل موضع مسبار) إلى صورة 4D بدقة مكانية مختلفة بين الاتجاهات داخل الطائرة وخارجها. تحدث نفس مشكلة الدقة المكانية غير المنتظمة في التصوير بالرنين المغناطيسي للقلب (CMR) ،8 والذي لا يزال يمثل المعيار الذهبي في التصوير الوظيفي للقلب. يمكن الحصول على التصوير الحقيقي 3D الخواص بدلا من ذلك باستخدام كل من التصوير المقطعي المحوسب (CT) والتصوير المقطعي بالإصدار البوزيتروني (PET)9. يوفر التصوير المقطعي بالإصدار البوزيتروني أداة حساسة للغاية من حيث إشارة الصورة لكل كمية من المسبار المحقون (في نطاق النانومولية) ، على الرغم من أنه يعاني من انخفاض الدقة المكانية مقارنة بالتصوير المقطعي المحوسب أو الرنين المغناطيسي أو الولايات المتحدة. الميزة الرئيسية ل PET هي قدرته على عرض الآليات الخلوية والجزيئية الكامنة وراء الفيزيولوجيا المرضية للجهاز. على سبيل المثال ، يسمح فحص التصوير المقطعي بالإصدار البوزيتروني بعد حقن [18F] FDG بإعادة بناء خريطة 3D لاستقلاب الجلوكوز في الجسم. من خلال الجمع بين هذا مع الحصول على البيانات الديناميكية (أي التي تم حلها بمرور الوقت) ، يمكن استخدام النمذجة الحركية للتتبع لحساب الخرائط البارامترية لمعدلات الأيض لامتصاص الجلوكوز (MRGlu) ، والتي ستوفر معلومات مهمة حول صلاحية عضلة القلب10.
يتطلب التصوير المقطعي المحوسب كميات كبيرة من عوامل التباين الخارجية (CA) بتركيزات عالية (تصل إلى 400 مجم من اليود لكل مل) لتوفير تعزيز قابل للقياس لمكونات الأنسجة ذات الصلة (على سبيل المثال ، الدم مقابل العضلات) ، ولكنه يتفوق في الدقة المكانية والزمانية ، خاصة عند استخدام أحدث أجهزة التصوير المقطعي المحوسب الدقيقة المصممة لتصوير الحيوانات الصغيرة. 11 نموذج المرض النموذجي الذي يمكن فيه تطبيق التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب للقلب هو التقييم التجريبي لاحتشاء عضلة القلب وفشل القلب والاستجابة ذات الصلة للعلاج. من الطرق الشائعة لإحداث MI في الحيوانات الصغيرة عن طريق الربط الجراحي للشريان التاجي الأمامي الأيسر النازل (LAD)12,13 ثم تقييم طوليا لتطور المرض وإعادة تشكيل القلب في الأيام اللاحقة4. ومع ذلك ، فإن التقييم المورفولوجي الوظيفي الكمي للقلب في الحيوانات الصغيرة ينطبق إلى حد كبير أيضا على نماذج الأمراض الأخرى ، مثل تقييم تأثير الشيخوخة على وظيفة القلب14 أو التعبير المتغير للمستقبلات في نماذج السمنة15. لا يقتصر بروتوكول التصوير المقدم على أي نموذج مرض معين ، وبالتالي ، يمكن أن يكون ذا أهمية واسعة في العديد من سياقات البحث قبل السريري مع القوارض الصغيرة.
في هذه الورقة ، نقدم بروتوكولا تجريبيا من البداية إلى النهاية لتصوير القلب باستخدام PET / CT متكامل للحيوانات الصغيرة. على الرغم من أن البروتوكول المقدم مصمم لماسح ضوئي متكامل ثنائي النمط محدد ، إلا أنه يمكن إجراء أجزاء PET و CT من الإجراء الموصوف بشكل مستقل على ماسحات ضوئية منفصلة من جهات تصنيع مختلفة. في الماسح الضوئي PET / CT المستخدم ، يتم تنظيم تسلسل العمليات في سير عمل مبرمج مسبقا. الفروع الرئيسية لكل سير عمل هي واحد أو أكثر من بروتوكولات الاستحواذ. يمكن أن يحتوي كل بروتوكول اكتساب على فرع واحد أو أكثر لبروتوكولات معالجة مسبقة محددة، وفي المقابل، يمكن أن يكون لكل بروتوكول معالجة مسبقة فرع واحد أو أكثر لبروتوكولات إعادة بناء محددة. يتم وصف كل من إعداد الحيوان على سرير التصوير وإعداد العوامل الخارجية التي سيتم حقنها أثناء إجراءات التصوير. بعد الانتهاء من إجراء الحصول على الصور ، يتم توفير أمثلة على إجراءات التحليل الكمي للصور بناء على أدوات البرامج المتاحة بشكل شائع. تم تصميم البروتوكول الرئيسي خصيصا لنماذج الماوس ؛ على الرغم من أن الفأر لا يزال أكثر الأنواع استخداما في هذا المجال ، إلا أننا نعرض أيضا تكيفا لبروتوكول تصوير الفئران في نهاية البروتوكول الرئيسي. يتم عرض النتائج التمثيلية لكل من الفئران والجرذان ، مما يدل على نوع الناتج الذي يمكن توقعه مع الإجراءات الموصوفة. يتم إجراء مناقشة مستفيضة في نهاية هذه الورقة للتأكيد على إيجابيات وسلبيات التقنية ، والنقاط الحرجة ، وكذلك كيف يمكن استخدام مقتفيات الإشعاع PET المختلفة دون أي تعديل تقريبا على الخطوات التحضيرية واكتساب / إعادة البناء.
Protocol
تم إجراء التجارب على الحيوانات وفقا للتوصيات الواردة في دليل رعاية واستخدام المختبر للمبادئ التوجيهية الدولية بشأن التعامل مع المختبر ، التي يتطلبها التوجيه الأوروبي (التوجيه 86/609 / EEC لعام 1986 والتوجيه 2010/63 / UE) والقوانين الإيطالية (D.Lgs. 26/2014).
1. إعداد بروتوكولات التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب وسير العمل
ملاحظة: البروتوكول المقدم هنا مصمم خصيصا لتصوير القلب لنماذج الفئران. قد ينطوي العمل مع الفئران على بعض التعديلات على البروتوكول الفعلي ، ويرجع ذلك أساسا إلى الحجم الأكبر للحيوان (أثقل 10 مرات تقريبا). تم ذكر التعديلات الخاصة بتصوير الفئران على وجه التحديد في الخطوات ؛ إذا لم يتم ذكر أي تعديلات ، فيمكن استخدام نفس الخطوات لتصوير الماوس للفئران.
- افتح واجهة المستخدم الرسومية (GUI) للماسح الضوئي PET/CT (انظر جدول المواد) وإنشاء مجموعة من البروتوكولات الجديدة (بما في ذلك معلمات الحصول على البيانات والمعالجة المسبقة وإعادة بناء الصور): (ط) أ التصوير المقطعي بالإصدار البوزيتروني الديناميكي، (ب) أ جرعة منخفضة من التصوير المقطعي المحوسب لتصحيح التوهين (سي تي إيه سي) بدون عامل تباين ، و (iii) أ التصوير المقطعي المحوسب Cine-CT المحسن بالتباين.
ملاحظة: يعد إنشاء بروتوكولات جديدة (أي تعليمات برمجية محددة للتصوير المقطعي) لمراحل الاكتساب والمعالجة المسبقة وإعادة البناء عملية مباشرة. في حالة حدوث مشكلة ، يمكن للمستخدم العثور على معلومات أكثر تفصيلا في دليل مستخدم واجهة المستخدم الرسومية.- بالنسبة لفحص التصوير المقطعي بالإصدار البوزيتروني، افتح علامة التبويب بروتوكول في الماسح الضوئي (GUI) وقم بإنشاء ثلاثة بروتوكولات جديدة ( للاكتساب والمعالجة المسبقة وإعادة البناء) باستخدام المعلمات التالية:
- بالنسبة لبروتوكول الاستحواذ: اضبط إجمالي وقت المسح الضوئي بمقدار 3600 ثانية وموضع السرير الفردي. احفظ هذا البروتوكول باسم مناسب للاستيراد اللاحق إلى سير العمل. افعل الشيء نفسه أيضا لجميع البروتوكولات التالية في النقاط التالية.
- بالنسبة لبروتوكول المعالجة المسبقة للماوس: حدد نافذة طاقة 250-750 keV (EW) وقم بتمكين التصحيحات التالية: الاضمحلال الإشعاعي ، والصدف العشوائي ، والوقت الميت. اضبط بروتوكول التأطير (أي التقسيم الديناميكي للبيانات الأولية) على النحو التالي: 8 × 5 ثانية ، 8 × 10 ثوان ، 3 × 40 ثانية ، 2 × 60 ثانية ، 2 × 120 ثانية ، 10 × 300 ثانية (= 3600 ثانية). بالنسبة للفئران ، حدد نافذة طاقة 350-750 keV (EW) ، باستخدام نفس الإطار المستخدم في بروتوكول الماوس.
- بالنسبة لبروتوكول إعادة البناء: حدد خوارزمية تعظيم توقع المجموعة الفرعية المرتبة ثلاثية الأبعاد عالية الجودة (3D-OSEM-MC) المستندة إلى مونت كارلو ، مع 8 مجموعات فرعية و 8 تكرارات ، مع تمكين التطبيع والتصحيح الكمي وتصحيح التوهين المقطعي.
- بالنسبة للفحص بالأشعة المقطعية بجرعة منخفضة لتصحيح التوهين (CTAC) ، استخدم المعلمات التالية:
- بالنسبة لبروتوكول الاستحواذ : إطار واحد ، وضع سرير مفرد ، مسح كامل ؛ إعدادات الأنبوب: 80 كيلو فولت ، تيار منخفض (جرعة منخفضة) ؛ 576 مشاهدة بزاوية تزيد عن 360 درجة ، مع 34 مللي ثانية من وقت التعرض لكل عرض (وقت مسح 20 ثانية) ؛ نوع الدوران: مستمر ، وضع الحساسية: حساسية عالية.
- لبروتوكول المعالجة المسبقة : حجم فوكسل 240 ميكرومتر ، مستعرض FOV: الجرذ ، FOV المحوري: 100٪.
- بالنسبة لبروتوكول إعادة الإعمار : نافذة التصفية: ناعمة ، حجم voxel: قياسي ، تمكين تصلب الشعاع والتصحيح المسبق للحلقة ، تعطيل تصحيح ما بعد القطع الأثرية الحلقة.
- بالنسبة للفحص بالأشعة المقطعية المسور المحسن بالتباين ، قم بإنشاء ثلاثة بروتوكولات جديدة (للاكتساب والمعالجة المسبقة وإعادة البناء) بالإعدادات التالية:
- بالنسبة لبروتوكول الاستحواذ للماوس: تعيين إطار واحد ، وضع سرير واحد ، مسح كامل ؛ إعدادات الأنبوب: 65 كيلو فولت ، تيار كامل (ضوضاء منخفضة) ؛ 8000 مشاهدة بزاوية تزيد عن 360 درجة ، مع 15 مللي ثانية من وقت التعرض لكل عرض (وقت مسح 120 ثانية) ؛ نوع الدوران: مستمر ، وضع الحساسية: حساسية عالية. بالنسبة للفئران ، قم بتعيين معلمات بروتوكول الاستحواذ على النحو التالي: جهد أنبوب 80 كيلو فولت ، 16000 مشاهدة على 360 درجة ، مع وقت تعرض 12 مللي ثانية لكل عرض (وقت مسح 192 ثانية).
- بالنسبة لبروتوكول المعالجة المسبقة للماوس: حدد حجم فوكسل 120 ميكرومتر ؛ مجال الرؤية المستعرض (FOV): الماوس ؛ مجال الرؤية المحوري: 50٪. بالنسبة للفئران ، حدد حجم فوكسل 240 ميكرومتر ؛ مجال الرؤية المستعرض (FOV): الجرذ ؛ FOV المحوري: 50 ٪.
- لبروتوكول إعادة الإعمار : نوافذ التصفية: ناعمة ، حجم فوكسل: قياسي ؛ تمكين تصلب الشعاع والتصحيح المسبق للحلقة ، وتعطيل تصحيح ما بعد القطع الأثرية الحلقية.
- افتح علامة التبويب سير العمل في واجهة المستخدم الرسومية ، وأنشئ سير عمل جديدا ، مضيفا البروتوكولات التي تم إنشاؤها للتو: الخطوات 1.1.1.1-1.1.1.3 ل PET ، الخطوات 1.1.2.1. -1.1.2.3. ل CTAC، والخطوات 1.1.3.1. -1.1.3.3. للتصوير المقطعي المسور ، بالترتيب المحدد. في كلتا الحالتين، تأكد من أن البروتوكولات متداخلة بالترتيب التالي: الاستحواذ | المعالجة المسبقة | إعادة الإعمار.
ملاحظة: إطارات التصوير المقطعي بالإصدار البوزيتروني الديناميكية ذات المدد <5 ثوان لالتقاط ذروة وظيفة الإدخال الشرياني بشكل أفضل في بداية فحص التصوير المقطعي بالإصدار البوزيتروني ممكنة ولكن لا يوصى بها لأن ذلك قد يؤدي إلى صور صاخبة بدقة كمية منخفضة. في الخطوة 1.1.2.2 ، استخدمنا حجم "Rat" لمجال الرؤية المستعرض. يستخدم هذا بشكل شائع لكل من الجرذان والفئران في CTAC.
- بالنسبة لفحص التصوير المقطعي بالإصدار البوزيتروني، افتح علامة التبويب بروتوكول في الماسح الضوئي (GUI) وقم بإنشاء ثلاثة بروتوكولات جديدة ( للاكتساب والمعالجة المسبقة وإعادة البناء) باستخدام المعلمات التالية:
2. إعداد الحيوانات للتصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب
ملاحظة: بالنسبة للبروتوكول الحالي ، تم صيام جميع الحيوانات بين عشية وضحاها.
- تخدير الفأر باستخدام إيزوفلوران 3٪ -4٪ (v / v) في غرفة الحث في البداية ، ثم الحفاظ على 1٪ -2٪ (v / v) إيزوفلوران.
- وزن الماوس وقياس نسبة السكر في الدم القاعدية لمراقبة حالة الحيوان. لأخذ عينة الدم المطلوبة ، استخدم مقصا حادا وقم بعمل قطع صغير عند طرف الذيل ، ثم قم بتدليك الذيل برفق لجمع قطرة من الدم (~ 1 ميكرولتر) مباشرة على شريط الاختبار.
- المضي قدما في إدخال الوصول الوريدي على مستوى الوريد الذيلي باستخدام فراشة 29 غرام للفأر و 24 غرام للفئران.
- لتنفيذ تقنية القنية ، استخدم التسخين المتزامن (عادة ، تحت مصباح التدفئة) وتطهير النقطة التي يتم فيها إدخال الإبرة لتوسيع الأوعية في الوريد. بعد القنية ، ثبت الفراشة بشريط حريري على الذيل لإبقائها في مكانها أثناء العملية.
ملاحظة: الصيام مطلوب لدراسات [18F] FDG. قد تنطوي أدوات التتبع المختلفة على تحضير مختلفة ، لكن المناقشة المستفيضة حول هذا الموضوع تخرج عن نطاق البروتوكول الحالي. بقدر ما يتعلق الأمر ب [18F] FDG ، فإن تجنب الصيام يؤدي إلى توزيع حيوي مختلف تماماللتتبع 16.
- لتنفيذ تقنية القنية ، استخدم التسخين المتزامن (عادة ، تحت مصباح التدفئة) وتطهير النقطة التي يتم فيها إدخال الإبرة لتوسيع الأوعية في الوريد. بعد القنية ، ثبت الفراشة بشريط حريري على الذيل لإبقائها في مكانها أثناء العملية.
- قم بتشغيل نظام التخدير (إيزوفلوران 1٪ -2٪ ، 0.8 لتر / دقيقة O 2 للماوس و 1-1.2 لتر / دقيقة للفئران) المتصل بماسح PET-CT وانقل الماوس إلى السرير.
- ضع الماوس في وضع ضعيف ، ورأسه أولا ، على سرير الماسح الضوئي للتصوير المقطعي PET-CT ، وضع أنفه في قناع الأنف للتخدير وسد رأس الماوس برفق على القناع بشريط لاصق.
- ثبت الأطراف العلوية والسفلية للماوس على سرير الماسح الضوئي لمنع أي حركات لا إرادية أثناء إجراءات التصوير ، والتي قد تؤدي إلى قطع أثرية للحركة.
- راقب درجة حرارة الجسم ومعدل التنفس باستخدام مسبار المستقيم ووسادة التنفس ، على التوالي.
3. إعداد جرعة التتبع PET
- بالنسبة للفئران ، ارسم 10 ميجابايت من [18F] FDG بحجم 100-150 ميكرولتر باستخدام حقنة الأنسولين (1 مل). بالنسبة للفئران ، ارسم جرعة أعلى من 15 ميجابايت في 0.20-0.25 مل.
ملاحظة: تجنب النشاط العالي لأن الماسح الضوئي PET الذي تمت مناقشته في هذا البروتوكول له حساسية عالية جدا ويتطلب فقط قدرا متواضعا من النشاط للحصول على صور عالية الجودة. - إذا كان التركيز الأصلي للمقتفي في القارورة مرتفعا جدا ، فاستخدم المحلول الفسيولوجي (0.9٪ وزن / فولت كلوريد الصوديوم) لتخفيف جرعة التتبع إلى تركيز 50-100 ميجابايت / مل.
- استخدم معاير جرعة PET لقياس النشاط الفعلي في المحقنة. قم بالتعليق على نشاط الحقن المسبق ووقت القياس حيث سيتم استخدام هذه القيم لاحقا باستخدام وحدات إدخال محددة لواجهة المستخدم الرسومية للماسح الضوئي PET.
4. إعداد عامل التباين CT
- ارسم 0.2 مل لكل 20 جم من وزن الماوس من عامل تباين مستحلب الدهون المعالج باليود في حقنة سعة 1 مل. الحد من حجم الحقن إلى 0.5 مل من CA للفئران أثقل. في حالة استخدام iomeprol ، اضبط معدل الحقن للفئران على 10 مل / ساعة (~ 0.17 مل / دقيقة) وحدد حجم الحقن إلى 0.5 مل.
- بالنسبة للفئران ، اسحب 2.3-3 مل من iomeprol ، مخفف إلى تركيز 200 مجم / مل ، في حقنة سعة 5 مل.
ملاحظة: في حالة عدم توفر مستحلب الدهون للحيوانات الصغيرة CA ، يمكن استخدام iomeprol مع الحقن المستمر عن طريق مضخة حقنة ، كما هو موضح أدناه. - قم بتوصيل المحقنة بمضخة المحقنة ، واضبط المضخة على حجم المحقنة الفعلي وقطرها.
- قم بتوصيل المحقنة بأنبوب CA والإبرة ، وقم بملء الأنبوب مسبقا باستخدام CA.
- اضبط معدل الحقن على 24 مل / ساعة (= 0.4 مل / دقيقة) ، مما يحد من الحقن إلى حجم أقصى يبلغ 2 مل.
ملاحظة: من الممكن أيضا استخدام CA لتجمع الدم على أساس مستحلب الدهون المعالج باليود في الفئران ، على الرغم من التكلفة العالية نسبيا لهذا الإجراء بسبب الحجم الأكبر لحقنة واحدة. إذا كان هذا الخيار مفضلا (على سبيل المثال ، لتبسيط البروتوكول عن طريق تجنب مضخة المحقنة) ، فيمكن استخدام الإجراء التالي:
- بالنسبة للفئران ، اسحب 2.3-3 مل من iomeprol ، مخفف إلى تركيز 200 مجم / مل ، في حقنة سعة 5 مل.
- ارسم 7.5 مل لكل كيلوغرام من وزن الجسم من عامل تباين مستحلب الدهون المعالج باليود في حقنة سعة 5 مل. الحد من حجم الحقن إلى 2 مل من CA أيضا للفئران أثقل.
5. محاذاة الحيوانات والعمليات الأولية قبل التصوير
- عند تجميد الحيوان على سرير التصوير ، قم بإنشاء دراسة جديدة على واجهة المستخدم الرسومية المقطعية. أضف معرف اسم الدراسة في الوحدة النمطية لاسم الدراسة وحدد سير عمل التصوير المحفوظ مسبقا من القائمة المنسدلة.
- حدد الجزء التشريحي المناسب مع معلومات الحيوان / العينة | الجزء التشريحي | تحديد المواقع القلبية والحيوانية حسب معلومات الحيوان / العينة | تحديد المواقع | مستلق / الرأس أولا. قم بالتعليق على وزن الحيوان بالجرام للوحدة المقابلة: معلومات الحيوان / العينة | وزن الحيوان.
ملاحظة: جميع المعلومات الأخرى في هذا القسم اختيارية ، ولكن من المفيد توفير أكبر قدر ممكن من المعلومات المطلوبة للعثور عليها في رأس DICOM لصور إعادة البناء ، وبالتالي تسهيل الاستعلام اللاحق عن البيانات. - حدد النويدات المشعة في معلومات مسح التصوير المقطعي بالإصدار البوزيتروني | F18 لدراسات [18F] FDG وغيرها من المركباتالموسومة F ؛ تعديل إذا تم استخدام متتبعات أخرى (على سبيل المثال ، [13N] NH3). اكتب أيضا اسم المتتبع في معلومات فحص التصوير المقطعي بالإصدار البوزيتروني | سيتم الإبلاغ عن وحدة اسم التتبع مثل هذا الاسم في رأس DICOM عند الانتهاء من إعادة بناء الصورة.
ملاحظة: المعلومات حول وقت حقن التتبع والنشاط والحجم إلزامية ولكن يمكن تقديمها لاحقا أثناء الحصول على PET. - في معلومات التصوير المقطعي المحوسب ، اكتب جميع المعلومات المتاحة المتعلقة بعامل التباين.
ملاحظة: كل هذه المعلومات اختيارية ولكنها يمكن أن تسهل الاستعلام عن البيانات اللاحقة إذا تم توفيرها. - اضغط على إجراء الفحص وانتظر حتى يتم فتح علامة تبويب أخرى من واجهة المستخدم الرسومية ، مما يسمح بتحديد موضع الحيوان وتحديد مواصفات خيارات المسح الأخرى.
- حدد نوع معايرة التصوير المقطعي المحوسب في معايرة التصوير المقطعي المحوسب | استخدم معايرة التصوير المقطعي المحوسب الافتراضية.
- في قسم إعداد الدراسة ، حدد كل بروتوكول مسح ضوئي من القائمة المنسدلة، وحدد خانة الاختيار انتظر تأكيد المستخدم قبل هذا الفحص .
ملاحظة: هذه الخطوة مهمة للغاية ، لأنها ستضع الماسح الضوئي في وضع الاستعداد في انتظار إدخال المستخدم قبل بدء مرحلة الاستحواذ المقابلة. بالنسبة لفحص التصوير المقطعي بالإصدار البوزيتروني ، سيسمح ذلك بمزامنة حقن التتبع وبدء فحص التصوير المقطعي بالإصدار البوزيتروني الفعلي ؛ بالنسبة لفحص CTAC ، سيسمح للمستخدم بإغلاق الغطاء (التدريع) قبل انبعاث الأشعة السينية أثناء الفحص بالأشعة المقطعية (سيتم إجهاض الدراسة تلقائيا إذا كان الغطاء مفتوحا قبل بدء الفحص بالأشعة المقطعية) ؛ بالنسبة لفحص Cine-CT ، سيسمح هذا التوقف المؤقت للمستخدم ببدء بروتوكول ضخ CA ومسح بيانات التصوير المقطعي المحوسب مع التأخير المطلوب. - لتحديد المواقع الحيوانية ، قم بتشغيل وحدة التحكم في المحرك باستخدام المفتاح الموجود في الجزء الأيمن من واجهة المستخدم الرسومية.
ملاحظة: سيؤدي هذا إلى تشغيل ليزر التمركز على سرير الحيوان وتمكين أزرار محاذاة السرير اليدوية الموضوعة على جانب الماسح الضوئي. - استخدم أزرار محاذاة السرير اليدوية لتحريك صدر الحيوان على علامات الليزر. تحقق بعناية من كل من المحاذاة الطولية والعمودية للحيوان.
- بمجرد وضع الحيوان في الموضع الصحيح وفقا لليزر المركزي ، اضغط على إيقاف تشغيل الليزر لحفظ الموضع الحالي المميز بالليزر ، والذي سيتم نقله إلى مركز ماسحات التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب خلال مراحل الاستحواذ المقابلة. بعد ذلك ، قم بإيقاف تشغيل وحدة التحكم في المحرك.
6. التصوير المقطعي بالإصدار البوزيتروني
- اضغط على بدء الاستحواذ لنقل الحيوان إلى الماسح الضوئي PET FOV. سيبقى الذيل والقنية خارج مجال الرؤية للسماح بحقن التتبع. سيبقى الماسح الضوئي في وضع الخمول حتى يضغط المستخدم على الزر متابعة .
- تحضير المحقنة مع جرعة تتبع PET معايرة.
- ابدأ عملية الاستحواذ بالضغط على زر المتابعة وابدأ في حقن المقتفي في القنية في غضون 5 ثوان من بدء الفحص (الشكل 1).
ملاحظة: ستكون مدة الحقن ~ 20-25 ثانية. - ضع المحقنة في معاير جرعة PET لقياس النشاط المتبقي في المحقنة. قم بالتعليق على النشاط الفعلي ووقت القياس.
- في علامة التبويب شاشة الأجهزة في واجهة المستخدم الرسومية للماسح الضوئي، استخدم الزر تحديث معلومات متتبع PET لإدراج الوقت الفعلي المحقون والنشاط ووحدة التخزين.
- أثناء الفحص ، تحقق من المعلمات الفسيولوجية للحيوان بشكل دوري.
- أثناء الفحص ، قم بقياس نسبة السكر في الدم كما هو موضح في الخطوة 2.2 في النقاط الزمنية التالية: 5 دقائق و 20 دقيقة و 40 دقيقة و 60 دقيقة بعد بداية فحص التصوير المقطعي بالإصدار البوزيتروني.
- بعد قياس نسبة السكر في الدم ، ضع شريط الاختبار في عداد جاما وقم بإجراء قياس النشاط لمدة 60 ثانية. تسجيل الوقت الفعلي الذي تم فيه قياس النشاط ، وتصحيح الاضمحلال الإشعاعي ، مع أخذ وقت حقن التتبع كوقت مرجعي. قم بتحويل قيم النشاط المسجلة إلى تركيز نشاط (Bq / mL) من خلال النظر في متوسط حجم الدم البالغ 1 ميكرولتر في شريط اختبار الجلوكوز (أي باستخدام المعادلة [1]):
Cالدم (ر) =الدم (ر) / 0.001 مل [Bq / مل] (1)
حيث الدم (t) هو النشاط المقاس المصحح للاضمحلال لعينةالدم في شريط الاختبار ، معبرا عنه ب Bq.
ملاحظة: يمكن إجراء بدء فحص التصوير المقطعي بالإصدار البوزيتروني وحقن التتبع بواسطة نفس المشغل باستخدام جهاز التحكم المحمول الخاص بالتصوير المقطعي المحوسب الموجود على الطاولة الجانبية للماسح الضوئي بالقرب من موقع المشغل أثناء الحقن. يسمح بتأخيرات أطول بين بدء الفحص وبداية الحقن ، ولكن سيظل بعض الإطارات المعاد بناؤها في بداية التسلسل الديناميكي فارغا. يوصى بتجنب التأخير الذي يزيد عن 10 ثوان (أي يؤدي إلى إطارين فارغين مع البروتوكول الحالي).

الشكل 1: حقن متتبع التصوير المقطعي بالإصدار البوزيتروني. يتم تنفيذ هذه العملية مباشرة بعد بدء فحص التصوير المقطعي بالإصدار البوزيتروني. الحيوان داخل مجال رؤية PET (الرأس أولا ، مع ذيله مرئي على جانب المشغل). اختصار: PET = التصوير المقطعي بالإصدار البوزيتروني. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
7. الأشعة المقطعية
- قبل حقن عامل التباين CT ، ابدأ فحص CTAC مباشرة بعد إغلاق غطاء الماسح الضوئي والضغط على الزر " متابعة" في واجهة المستخدم الرسومية. في نهاية هذا الاستحواذ القصير جدا ، استخدم الإجراءات التالية لضمان التحسين المناسب لتجمع الدم عن طريق حقن CA قبل الاستحواذ باستخدام نفس الوصول إلى الأوعية الدموية المستخدم لحقن متتبع PET.
- مستحلب الدهون المعالج باليود CA:
- بعد الانتهاء من فحص CTAC ، قم بحقن مستحلب الدهون المعالج باليود CA باستخدام القنية المتصلة بالفعل بالوريد الخلفي للفأر. مدة الحقن النموذجية هي في حدود 30-60 ثانية.
- ابدأ التصوير مباشرة بعد الانتهاء من الحقن. اضغط على متابعة في واجهة المستخدم الرسومية للماسح الضوئي لبدء اكتساب Cine-CT.
- مضخة Iomeprol / حقنة:
- إذا تم استخدام الأشعة السينية CA العادية ، مثل iomeprol ، استخدم مضخة حقنة تسمح بالحقن البطيء بمعدل ثابت.
- بالنسبة للفئران ، اضبط معدل حقن CA على 10 مل / ساعة (~ 0.17 مل / دقيقة) عن طريق الحد من حجم الحقن إلى 0.5 مل. باستخدام هذا الإعداد ، أوقف الحقن بعد ~ 3 دقائق. بالنسبة للفئران ، اضبط المضخة على معدل 24 مل / ساعة (= 0.4 مل / دقيقة) وحدد حجم الحقن إلى 2 مل. باستخدام هذا الإعداد ، أوقف الحقن بعد 5 دقائق.
- قم بتوصيل الإبرة المتصلة بأنبوب CA بقنية الوريد الذيلي ، مما يضمن ملء كل من الأنبوب والإبرة مسبقا ب CA.
- ابدأ الحقن. أغلق غطاء الماسح الضوئي واستعد لفحص Cine-CT.
- اضغط على زر المتابعة على واجهة المستخدم الرسومية للتصوير المقطعي بعد 60 ثانية من بداية الحقن للفئران وبعد 90 ثانية من بداية الحقن للفئران ، بحيث يبدأ اكتساب Cine-CT. سيتوقف حقن CA تقريبا في نفس الوقت الذي يتم فيه إكمال الفحص بالأشعة المقطعية Cine-CT للفئران وعند الانتهاء للفئران.
- مستحلب الدهون المعالج باليود CA:
- عند الانتهاء من فحص Cine-CT ، افصل الحيوان عن نظام المراقبة الفسيولوجية وقم بإزالة قنية الوريد الذيل. اعتمادا على البروتوكول الفعلي ، يتم استرداد الحيوانات أو القتل الرحيم بعد إجراء التصوير الموصوف. في الحالة الأولى ، يتم إيقاظ الحيوانات في أقفاصها في بيئة دافئة تحت مصباح الأشعة تحت الحمراء. تتم مراقبتها حتى الاستيقاظ التام ، مع أخذ 15/30 دقيقة بعد التخدير الغازي. في حالة البروتوكولات التي تتطلب على سبيل المثال ، حصاد الأنسجة في نهاية إجراء التصوير ، يتم القتل الرحيم للحيوانات باستخدام جرعة زائدة مخدرة في غرفة الحث (5٪ إيزوفلوران) ، وفقا للملحق السادس من D.Lgs. 26/2014.
ملاحظة: في حالة 18نويدة مشعة قائمة على F كما نوقش في هذا البروتوكول ، فإن 24 ساعة بعد حقن التتبع كافية للوصول إلى مستوى من النشاط الإشعاعي المتبقي على جسم الحيوان يكون آمنا لجميع الأغراض العملية.
8. إعادة بناء صور القلب 4DCT باستخدام البوابات القلبية التنفسية الداخلية
ملاحظة: عند الانتهاء من دراسة التصوير ، يتم إجراء إعادة بناء PET و CT القياسية تلقائيا. ومع ذلك ، يجب إجراء إعادة بناء تسلسل التصوير المقطعي المحوسب للقلب 4D (Cine) يدويا ويتطلب بعض تفاعل المستخدم. تتم مناقشة هذا النوع الخاص من إعادة البناء ، وهو إلزامي لتحليل التصوير المقطعي المحوسب للقلب المورفولوجي الوظيفي اللاحق ، في هذا القسم.
- افتح وحدة بوابات القلب في واجهة المستخدم الرسومية الخاصة ب tomogragh وحدد دراسة التصوير المراد تحليلها.
- حدد منطقة الاهتمام (ROI) على الصور الشعاعية للحيوان المعروض (الشكل 2) لبناء منحنى حركة قلبية يعتمد على الوقت ، ويمثل إشارة البوابة - الكيموغرام. حرك عموديا عائد الاستثمار المستطيل المرسوم مسبقا بحيث يتم تحديد كل من قمة القلب والحجاب الحاجز. ثم حدد تحليل إشارة البوابة. ستعرض واجهة المستخدم الآن إشارة البوابة على كل من المجال الزمني ومجال التردد.
- في الرسم البياني الأول لمجال التردد ، حدد نطاق التردد التنفسي من خلال تسليط الضوء على المجموعة الأولى من قمم طيف التردد (راجع الشكل 3 للحصول على مثال الطيف).
- في الرسم البياني الثاني لمجال التردد ، حدد نطاق تردد حركة القلب ، مع إبراز ثاني أكثر قمة حدة.
- في المرحلة التالية ، لاحظ إشارة بوابة المجال الزمني مع علامات ملونة (نقاط) متراكبة ، تظهر قمم التنفس المحددة وقمم تقلص القلب. إذا كانت مواضع العلامة تتناسب بشكل جيد مع قمم الجهاز التنفسي والقلب لإشارة البوابة الأصلية ، فانتقل إلى المرحلة التالية. خلاف ذلك:
- إذا كان شكل إشارة البوابة مختلفا تماما عن الشكل 3 ، فارجع إلى الخطوة 8.2 وحدد عائد استثمار آخر.
- إذا كان شكل إشارة البوابة مشابها بشكل معقول للشكل الموضح في الشكل 3 ، فارجع إلى الخطوة 8.3 والخطوة 8.4 وحدد نطاقات تردد مختلفة على طيف إشارة البوابات.
- في المرحلة التالية ، حدد ما لا يقل عن أربع بوابات قلبية.
ملاحظة: تتكون إعادة بناء Cine-CT النموذجية من 8-12 بوابة قلبية. - حدد نافذة الجهاز التنفسي المناسبة باستخدام القائمة المنسدلة: نافذة الجهاز التنفسي | 20٪ -80٪.
ملاحظة: سيحتفظ هذا بنسبة 60٪ من البيانات المكتسبة في إعادة الإعمار ، باستثناء مرحلة ذروة الإلهام ، وبالتالي تحسين حدة جدران عضلة القلب المعاد بناؤها في كل مرحلة قلبية. - قم بإجراء إعادة الإعمار لتحويل صور Cine-CT المسورة بأثر رجعي إلى تنسيق DICOM ، وجاهزة للاستيراد إلى البرنامج للتحليل الوظيفي اللاحق.
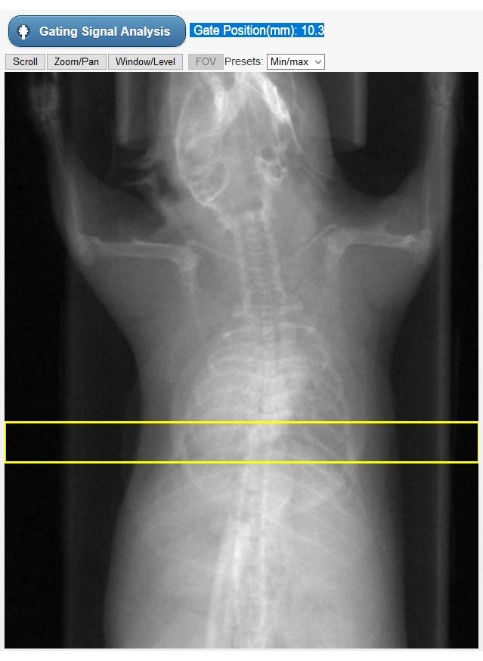
الشكل 2: أداة اختيار عائد الاستثمار للبوابات الجوهرية. تظهر هذه الصورة في واجهة المستخدم الرسومية للتصوير المقطعي أثناء مرحلة إعادة بناء Cine-CT. يجب على المستخدم تحديد موضع عائد الاستثمار (المستطيل الأصفر) الذي يتم الحصول على إشارة البوابة الجوهرية (kymogram) من توقعات التصوير المقطعي المحوسب الخام. الكائن الدائري الشكل المتراكب على صندوق الحيوان هو وسادة الجهاز التنفسي المستخدمة فقط للمراقبة الفسيولوجية أثناء الدراسة. الاختصارات: عائد الاستثمار = منطقة الاهتمام ؛ CT = التصوير المقطعي المحوسب ؛ واجهة المستخدم الرسومية = واجهة المستخدم الرسومية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
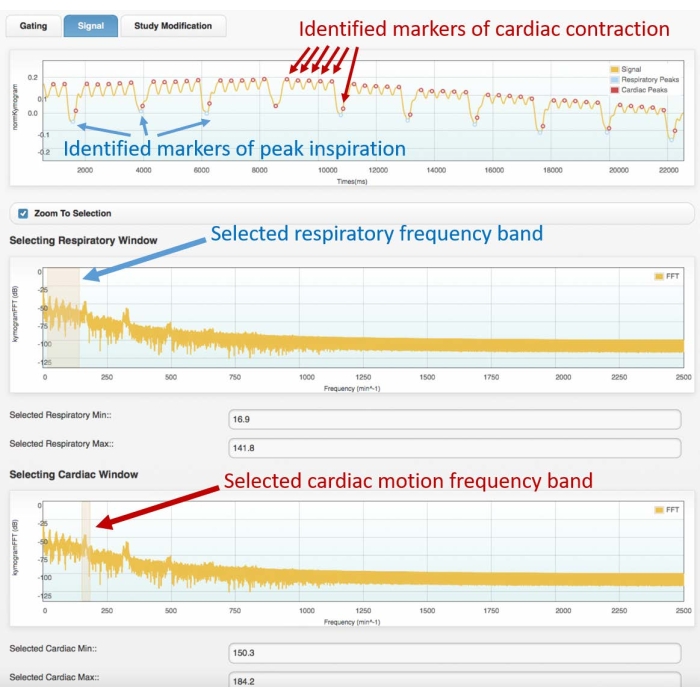
الشكل 3: مثال إشارة البوابة (الإطار العلوي) وطيف التردد المقابل (المركز والأسفل). الصور التي تم الحصول عليها باستخدام وحدة بوابات القلب لبرنامج Atrium. يجب على المستخدم تحديد نطاقات التردد المناسبة لكل من الجهاز التنفسي (الإطار المركزي) وحركة القلب (الإطار السفلي). سيسمح ذلك بتحديد علامات الجهاز التنفسي والقلب على إشارة البوابة ، والتي يجب فحصها من قبل المستخدم قبل الشروع في إعادة بناء 4D. سيؤدي التحديد السيئ للقمم أو التعيين الخاطئ (على سبيل المثال ، الجهاز التنفسي إلى القلب ، أو العكس) إلى إعادة بناء غير صحيحة. تم الحصول على البيانات المعروضة من تحليل فحص 4D Cine-CT لفأر Wistar ذكر بالغ سليم (507 جم) تم حقنه ب 2 مل من iomeprol ، 200 mg / mL ، بمعدل 0.4 مل / دقيقة لمدة 5 دقائق (يتم تكبير الرسم البياني في الأعلى على أول 22 ثانية من الاستحواذ للسماح بتصور أفضل لحركة القلب والجهاز التنفسي المحددة). اختصار: CT = التصوير المقطعي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
9. تحليل القلب PET
ملاحظة: يوضح هذا القسم كيفية إجراء تحليل حركي لبيانات FDG الديناميكية [18F] للبطين الأيسر للحيوان الصغير. يعتمد التحليل على برنامج Carimas. لا يقصد من الإرشادات أدناه أن تكون بديلا لدليل مستخدم البرنامج17. يعتمد الإجراء المعروض أدناه على تحليل Patlak الرسومي لبيانات PET الديناميكية18. ارجع إلى قسم المناقشة للحصول على تفاصيل حول هذا التحليل.
- افتح صور DICOM الخاصة بفحص التصوير المقطعي بالإصدار البوزيتروني الديناميكي.
- حدد وحدة HeartPlugin .
- قم بتكبير الصورة على قلب الفأر / الجرذ ، وحدد الإطار الزمني الأخير (أو ما يعادله ، مجموع آخر ثلاثة إلى خمسة أطر زمنية) التي تم غسل معظم نشاط تجمع الدم لها بالفعل.
- اتبع التعليمات التي تظهر على الشاشة لإعادة توجيه الصورة على طول المحور الرئيسي لقلب الحيوان (المحور القصير والمحور الرأسي والأفقي الطويل). قم بذلك بشكل تفاعلي عن طريق تحريك العلامات المعروضة لقاعدة القلب والقمة (الشكل 4).
- حدد أداة التجزئة .
ملاحظة: بشكل افتراضي، يتم تمكين التجزئة التلقائية، مما يؤدي إلى نتائج موثوقة في معظم الحالات. - إذا كانت نتيجة التجزئة التلقائية غير مقبولة ، فقم بتحسين شكل عضلة القلب المجزأة و / أو تجويف الجهد المنخفض عن طريق تمكين الوضع اليدوي (تم تعطيل بحث عائد الاستثمار).
- في أداة النمذجة ، حدد النموذج الحركي المناسب لاستخدامه لتحليل PET الديناميكي. في هذه الحالة، حدد رسومي | Patlak لتمكين تحليل مخطط Patlak لحساب معدل الأيض لامتصاص الجلوكوز (MRGlu) لكل قطاع قلبي.
- في أداة polarmap ، حدد العدد الصحيح لشرائح القلب المعروضة. في هذه الحالة ، حدد 17 شريحة.
- الآن ، اضغط على زر Fit لإجراء إجراء التركيب لتحليل Patlak.
- في نهاية إجراء التركيب ، لاحظ الخريطة القطبية المعروضة لقيم Ki (أي ميل الانحدار الخطي المعبر عنه ب mL / [mL × min]).
- باستخدام قيم Ki لكل قطاع موضح في جدول ، احسب MRGlu باستخدام المعادلة (2):
MRGlu = (Ki × PGlu) / LC (2)
حيث PGlu هي قيمة مشتقة من عينة الدم لتركيز الجلوكوز في البلازما (مليمول / لتر) ، والثابت المقطوع (LC) هو معامل تجريبي يستخدم للتعويض عن الفرق في الامتصاص بين الجلوكوز الطبيعي و FDG. انظر، على سبيل المثال، Ng et al.22 للاطلاع على القيم النموذجية للثابت المقطوع في ظروف تجريبية مختلفة.
ملاحظة: قبل البدء في تحليل PET ، من الممارسات الجيدة فحص التسلسل الديناميكي لوحدات تخزين PET بصريا داخل أداة برنامج تحليل PET. هذا ضروري لاستبعاد حركة الحيوانات العيانية بين الأطر الزمنية أثناء الدراسة. في حالة وجود حركة ، يجب إجراء التسجيل المناسب للصور (خارج نطاق هذا البروتوكول) قبل التحليل ، إن أمكن.
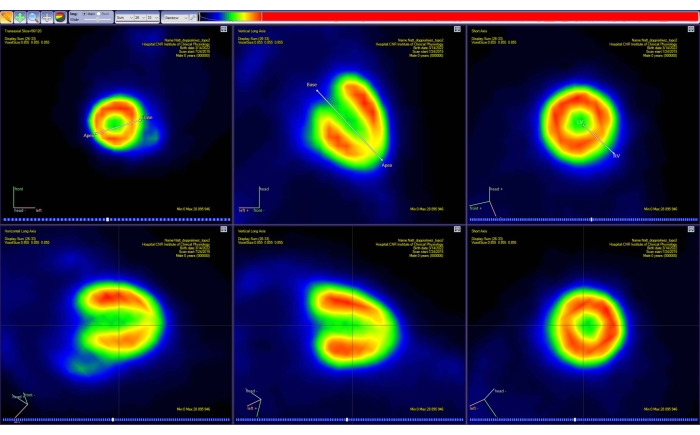
الشكل 4: أداة إعادة التوجيه لبرنامج تحليل PET. يظهر إسقاط قطعتين مستقيمتين بسيطتين في مساحة 3D على كل من المستويات القياسية الثلاثة (عبر المحور ، الإكليلي ، والسهمي). يسمح الجزء الأول للمستخدم بتحديد قاعدة القلب والقمة ، بينما يسمح الجزء الثاني باختيار الجانبين الأيسر والأيمن من القلب. ينتج عن هذه الخطوة صورة PET جديدة (محصورة) (الصف السفلي) ، مع إعادة توجيه القلب على طول تمثيل AHA القياسي. تم الحصول على الصور باستخدام Carimas من فأر CD-1 بالغ يتمتع بصحة جيدة يزن 51 جراما وتم حقنه ب 10 ميجابايت من [18F] FDG. الاختصارات: PET = التصوير المقطعي بالإصدار البوزيتروني ؛ AHA = جمعية القلب الأمريكية ؛ FDG = فلوروديوكسي جلوكوز. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
10. تحليل القلب Cine-CT
ملاحظة: يوضح هذا القسم كيفية إجراء التحليل الكمي لصورة القلب Cine-CT لجمع البيانات الكمية العالمية لوظيفة القلب. يعتمد التحليل على برنامج Osirix MD. لا يقصد من الإرشادات أدناه أن تكون بديلا لدليل مستخدم Osirix24.
- قم بتحميل صور DICOM الخاصة بفحص Cine-CT في البرنامج.
- افتح مجموعة البيانات الديناميكية باستخدام عارض 4D المدمج.
- باستخدام أداة الإصلاح متعدد المستويات 3D (MPR) ، أعد توجيه بيانات الصورة على طول المحور القصير (الشكل 5).
- تصدير البيانات المعاد توجيهها إلى DICOM ، مما يضمن تصدير بيانات 4D بالكامل ، مع الحفاظ على سمك الشريحة (مثل الأصل) وعمق بت الصورة (16 بت لكل فوكسل)
- افتح صور 4D MPR المصدرة باستخدام عارض 4D.
- حدد إطارا زمنيا يتوافق مع نهاية الانبساط. تصفح جميع الأطر الزمنية باستخدام شريط تمرير الوقت على شريط الأدوات الرئيسي للتأكد من تحديد المرحلة القلبية الصحيحة.
- في هذا الإطار الزمني ، اختر أداة التعليق التوضيحي المضلع المغلق وحدد يدويا جدار الشغاف ل LV.
- افعل الشيء نفسه مع 10-20 شريحة من القاعدة إلى القمة ، مع التأكد من أن جميع عائد الاستثمار لها نفس الاسم (على سبيل المثال ، LVENDO).
- في قائمة عائد الاستثمار، حدد حجم عائد الاستثمار | قم بإنشاء عائد استثمار مفقود لإنشاء عائد الاستثمار على جميع شرائح المحور القصير عن طريق استيفاء عائد الاستثمار المرسوم يدويا.
- في قائمة عائد الاستثمار، حدد حجم عائد الاستثمار | حساب الحجم لحساب حجم مجموعة عائد الاستثمار بنفس اسم عائد الاستثمار.
- تصفح الأطر الزمنية وحدد مرحلة تتوافق مع نهاية الانقباض (حجم الجهد المنخفض الأصغر) وكرر الخطوات من 10.7 إلى 10.10 أعلاه.
- احسب حجم الشوط (SV) وكسر القذف باستخدام المعادلتين (3) و (4):
SV = EDV - ESV [مل] (3)
EF = 100 × SV/EDV [٪] (4)
حيث EDV هو حجم نهاية الانبساطي و ESV هو الحجم الانقباضي النهائي.
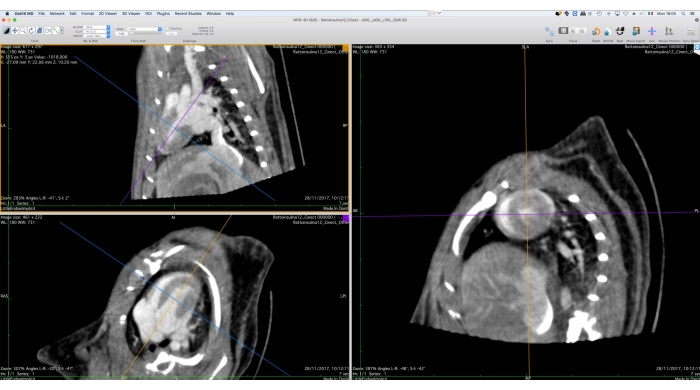
الشكل 5: واجهة رسومية لأداة الإصلاح متعدد المستويات. تستخدم هذه الأداة لإعادة توجيه بيانات Cine-CT للتحليل الوظيفي اللاحق. يجب على المستخدم تدوير وترجمة المحاور المرجعية على الجانب الأيسر من الشاشة بحيث يظهر عرض المحور القصير للقلب على اليمين. في نهاية هذا الإجراء ، يمكن للمستخدم تصدير الصور المعاد توجيهها كمجموعة ملفات DICOM. تم الحصول على الصور باستخدام Osirix MD وتشير إلى ذكر فأر Wistar بالغ سليم (507 جم) تم حقنه ب 2 مل من iomeprol ، 200 مجم / مل ، بمعدل 0.4 مل / دقيقة لمدة 5 دقائق ، أعيد بناؤه باستخدام Filtered BackProjection بحجم فوكسل 0.24 مم3. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
في هذا القسم ، يتم عرض النتائج النموذجية لكل من تحليل التصوير المقطعي بالإصدار البوزيتروني والتصوير المقطعي المحوسب باتباع الإجراءات الموضحة حتى الآن. يوضح الشكل 6 نتائج التجزئة التلقائية لتجويف عضلة القلب والجهد المنخفض لفحص التصوير المقطعي بالإصدار البوزيتروني [18
Discussion
يركز البروتوكول المقدم في هذه الورقة على إجراء تجريبي نموذجي لأبحاث القلب والأوعية الدموية الانتقالية على نماذج الحيوانات الصغيرة لإصابات القلب باستخدام التصوير المقطعي بالإصدار البوزيتروني / التصوير المقطعي المحوسب عالي الدقة. تشير النتائج المقدمة إلى القيمة الكمية والنوعية العالية ...
Disclosures
تلقت دانييل بانيتا منحا للبحث والتطوير لأجهزة التصوير المقطعي المحوسب الدقيقة من Inviscan Sas.
Acknowledgements
تم دعم هذا البحث جزئيا من قبل مشروع "GUTMOM" JPI-HDHL-INTIMIC: سمنة الأمهات والخلل المعرفي في النسل: دور السبب والنتيجة لميكروبيوم الأمعاء والوقاية الغذائية المبكرة (المشروع رقم. INTIMIC-085 ، وزارة التعليم الإيطالية ، الجامعة ومرسوم البحث رقم 946/2019).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
References
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841 (2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362 (2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82 (2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31 (2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053 (2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89 (2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206 (2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7 (2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- . Carimas User Manual Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022)
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -. P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591 (2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532 (2014).
- Kim, D. -. Y., Cho, S. -. G., Bom, H. -. S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine Available from: https://www.medilumine.com/technical-resources (2019)
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783 (2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D., Grupen, C., Buvat, I. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. , 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603 (2016).
- Lee, C. -. L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T., Kuntner-Hannes, C., Haemisch, Y. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. , 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003 (2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved