JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
소형 동물을 위한 고해상도 심장 양전자 방출 단층 촬영/컴퓨터 단층 촬영
요약
여기에서는 소형 동물을위한 고해상도 양전자 방출 단층 촬영 / 컴퓨터 단층 촬영을 사용하여 심장 기능 및 형태를 정량화하기위한 실험 이미징 프로토콜을 제시합니다. 마우스와 쥐 모두 고려되어 두 종에 대한 컴퓨터 단층 촬영 조영제의 다양한 요구 사항을 논의합니다.
초록
양전자 방출 단층 촬영 (PET)과 컴퓨터 단층 촬영 (CT)은 가장 많이 사용되는 진단 영상 기술 중 하나이며 둘 다 심장 기능과 신진 대사를 이해하는 데 도움이됩니다. 전임상 연구에서는 고감도 및 높은 시공간 해상도를 가진 전용 스캐너가 사용되어 생쥐와 쥐의 작은 심장 크기와 매우 높은 심박수로 인한 까다로운 기술 요구 사항에 대처하도록 설계되었습니다. 이 논문에서는 동물 준비 및 이미지 획득 및 재구성에서 이미지 처리 및 시각화에 이르기까지 심장 질환의 실험 마우스 및/또는 쥐 모델을 위한 바이모달 심장 PET/CT 이미징 프로토콜에 대해 설명합니다.
특히, 18 F- 표지 된 플루오로 데 옥시 글루코스 ([18F] FDG) -PET 스캔은 좌심실 (LV)의 다른 세그먼트에서 포도당 대사의 측정 및 시각화를 허용합니다. 극좌표 지도는 이 정보를 표시하는 편리한 도구입니다. CT 부분은 심전도(ECG) 리드가 없는 후향적 게이팅을 사용하여 전체 심장의 시간 분해 3D 재구성(4D-CT)으로 구성되어 LV의 형태 기능 평가와 박출률(EF) 및 뇌졸중 부피(SV)와 같은 가장 중요한 심장 기능 매개변수의 후속 정량화를 허용합니다. 통합 PET/CT 스캐너를 사용하여 이 프로토콜은 다른 스캐너 간에 동물을 재배치할 필요 없이 동일한 마취 유도 내에서 실행할 수 있습니다. 따라서 PET / CT는 심장 질환의 여러 작은 동물 모델에서 심장의 형태 기능 및 대사 평가를위한 포괄적 인 도구로 볼 수 있습니다.
서문
작은 동물 모델은 심혈관 질환 1,2에 대한 이해를 높이는 데 매우 중요합니다. 비침습적 진단 영상 도구는 지난 수십 년 동안 임상 및 전임상 환경 모두에서 심장 기능을 보는 방식에 혁명을 일으켰습니다. 심장 질환의 작은 동물 모델에 관한 한, 매우 높은 시공간 해상도로 특정 이미징 도구가 개발되었습니다. 따라서, 이러한 기기는 심부전 (HF)3 또는 심근 경색 (MI)4와 같은 특정 질병 모델에서 마우스 및 래트의 매우 작고 매우 빠르게 움직이는 심장에 대한 관련 대사 및 운동 심근 파라미터의 정확한 정량화의 필요성과 일치 할 수있다. 이 목적을 위해 각각 고유한 강점과 약점이 있는 여러 양식을 사용할 수 있습니다. 초음파(미국) 이미징은 뛰어난 유연성, 매우 높은 시간 해상도 및 상대적으로 저렴한 비용으로 인해 가장 널리 사용되는 방식입니다. 작은 동물에서 미국 심장 영상의 채택은 공간 해상도가 50μm 미만인 초고주파 5,6의 프로브를 사용하는 시스템의 출현 이후 상당히 증가했습니다.
완전 3D 심장 영상에 대한 미국의 주요 단점 중 하나는 전체 심장의 동적 B 모드 이미지의 전체 스택을 생성하기 위해 전동 변환 스테이지에 프로브를 장착하여 심장 축을 따라 선형 스캔이 필요하다는것입니다 7. 결국, 이 절차는 (각 프로브 위치에서 획득한 이미지의 정확한 공간 및 시간 등록 후) 평면 내 방향과 평면 외부 방향 사이에 서로 다른 공간 해상도를 갖는 4D 이미지를 발생시킵니다. 동일한 불균일 공간 해상도 문제가 심장 MR(CMR)에서도 발생하며,8 이는 여전히 심장의 기능적 영상에서 황금 표준을 나타냅니다. 실제 등방성 3D 이미징은 대신 컴퓨터 단층 촬영 (CT)과 양전자 방출 단층 촬영 (PET)을 모두 사용하여 얻을 수 있습니다 9. PET는 CT, MR 또는 US에 비해 공간 분해능이 감소하더라도 주입된 프로브의 양(나노몰 범위)당 이미지 신호 측면에서 매우 민감한 도구를 제공합니다. PET의 주요 장점은 장기의 병태생리학의 기초가 되는 세포 및 분자 메커니즘을 표시하는 능력입니다. 예를 들어, [18F]FDG 주입 후 PET 스캔을 통해 신체의 포도당 대사에 대한 3D 지도를 재구성할 수 있습니다. 이를 동적(즉, 시간 분해) 데이터 획득과 결합함으로써, 추적자 키네틱 모델링은 포도당 흡수의 대사율(MRGlu)의 파라메트릭 맵을 계산하는데 사용될 수 있으며, 이는 심근 생존력에 대한 중요한 정보를 제공할 것이다(10).
CT는 관련 조직 구성 요소(예: 혈액 대 근육)의 측정 가능한 향상을 제공하기 위해 고농도(mL당 최대 400mg의 요오드)에서 상당한 양의 외부 조영제(CA)가 필요하지만 특히 소형 동물 이미징용으로 설계된 최첨단 마이크로 CT 스캐너를 사용할 때 공간 및 시간 해상도가 뛰어납니다. 11 심장 PET/CT가 적용될 수 있는 전형적인 질병 모델은 심근경색 및 심부전 및 치료에 대한 관련 반응의 실험적 평가이다. 작은 동물에서 MI를 유도하는 일반적인 방법은 좌측 전방 하행 (LAD) 관상 동맥(12,13)의 외과 적 결찰에 의한 다음 질병의 진행 및 후속 날의 심장 리모델링을 종단 적으로 평가하는 것입니다4. 그럼에도 불구하고, 작은 동물에서 심장의 정량적 형태기능적 평가는 심장 기능14에 대한 노화의 영향의 평가 또는 비만 모델에서의 변경된 수용체 발현(15)과 같은 다른 질병 모델에도 대체로 적용될 수 있다. 제시된 이미징 프로토콜은 주어진 질병 모델에 국한되지 않으므로 작은 설치류를 사용한 전임상 연구의 여러 맥락에서 가장 광범위한 관심을 가질 수 있습니다.
이 논문에서는 작은 동물 통합 PET/CT를 사용한 심장 영상의 시작부터 끝까지 실험 프로토콜을 제시합니다. 제시된 프로토콜이 특정 바이모달 통합 스캐너용으로 설계되었음에도 불구하고 설명된 절차의 PET 및 CT 부분은 다른 제조업체의 개별 스캐너에서 독립적으로 수행될 수 있습니다. 사용 중인 PET/CT 스캐너에서 작업 순서는 사전 프로그래밍된 워크플로로 구성됩니다. 각 워크플로의 주요 분기는 하나 이상의 획득 프로토콜입니다. 각각의 획득 프로토콜은 특정 전처리 프로토콜에 대해 하나 이상의 브랜치를 가질 수 있고, 이어서 각각의 전처리 프로토콜은 특정 재구성 프로토콜에 대해 하나 이상의 브랜치를 가질 수 있다. 영상화 베드 상의 동물의 준비 및 영상화 절차 동안 주입될 외부 작용제의 제제 둘 모두가 기재되어 있다. 이미지 획득 절차가 완료된 후, 일반적으로 사용 가능한 소프트웨어 툴을 기반으로 한 정량적 이미지 분석을 위한 예제 절차가 제공됩니다. 기본 프로토콜은 마우스 모델을 위해 특별히 설계되었습니다. 마우스가이 분야에서 가장 많이 사용되는 종으로 남아 있지만, 우리는 또한 주 프로토콜의 끝에서 쥐 이미징을위한 프로토콜의 적응을 보여줍니다. 마우스와 래트 모두에 대한 대표적인 결과가 표시되며, 설명된 절차에서 예상할 수 있는 출력 유형을 보여줍니다. 이 논문의 끝 부분에서는 기술의 장단점, 임계점, 준비 및 획득 / 재구성 단계를 거의 수정하지 않고 다양한 PET 방사성 추적자를 사용할 수있는 방법을 강조하기 위해 철저한 논의가 이루어집니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물 실험은 유럽 지침 (1986 년 지침 86 / 609 / EEC 및 지침 2010 / 63 / UE) 및 이탈리아 법률 (D.Lgs. 26 / 2014)에서 요구하는 실험실 동물 취급에 관한 국제 지침의 실험실 동물 관리 및 사용 가이드의 권장 사항에 따라 수행되었습니다.
1. PET/CT 영상 프로토콜 및 워크플로우 설정
참고: 여기에 제시된 프로토콜은 마우스 모델의 심장 영상을 위해 특별히 설계되었습니다. 쥐와 함께 일하는 것은 주로 동물의 크기가 더 크기 때문에 (약 10 배 더 무겁기 때문에) 실제 프로토콜에 약간의 수정을 의미 할 수 있습니다. 래트 영상화에 대한 변형은 상기 단계에서 구체적으로 언급되고; 수정이 언급되지 않은 경우, 마우스 이미징에 대한 동일한 단계가 쥐에 대해 사용될 수 있습니다.
- PET/CT 스캐너의 그래픽 사용자 인터페이스(GUI)를 엽니다( 재료 표)을 클릭하고 새 프로토콜 집합(데이터 수집, 전처리 및 이미지 재구성을 위한 매개 변수 포함)을 만듭니다. (i) a 동적 PET 스캔, (ii) a 저선량 CT 스캔 감쇠 보정용(증권 시세 표시기) 조영제 없이, 및 (iii) 대비 강화 시네-CT 스캔.
참고: 수집, 전처리 및 재구성 단계를 위한 새로운 프로토콜(즉, 단층 촬영을 위한 특정 소프트웨어 지침)을 만드는 것은 간단한 프로세스입니다. 문제가 발생하면 GUI 사용 설명서에서 더 자세한 정보를 찾을 수 있습니다.- PET 스캔의 경우 스캐너(GUI)의 프로토콜 탭을 열고 다음 매개변수를 사용하여 세 개의 새 프로토콜 ( 수집, 전처리 및 재구성용)을 만듭니다.
- 획득 프로토콜의 경우: 총 스캔 시간 3,600초와 싱글 베드 위치를 설정합니다. 나중에 워크플로로 가져올 수 있도록 이 프로토콜을 적절한 이름으로 저장합니다. 다음 사항의 모든 다음 프로토콜에 대해서도 동일한 작업을 수행합니다.
- 마우스용 전처리 프로토콜의 경우: 250-750keV 에너지 창(EW)을 선택하고 방사성 붕괴, 무작위 우연의 일치 및 부동 시간과 같은 보정을 활성화합니다. 프레이밍 프로토콜(즉, 원시 데이터의 동적 분할)을 8 x 5초, 8 x 10초, 3 x 40초, 2 x 60초, 2 x 120초, 10 x 300초(= 3,600초)로 설정합니다. 쥐의 경우 마우스 프로토콜과 동일한 프레임을 사용하여 350-750keV 에너지 창(EW)을 선택합니다.
- 재구성 프로토콜의 경우: 정규화, 정량적 보정 및 CT 감쇠 보정이 활성화된 상태에서 8개의 하위 집합과 8개의 반복이 있는 고품질 몬테카를로 기반 3D 주문 부분 집합 기대 최대화(3D-OSEM-MC) 알고리즘을 선택합니다.
- 감쇠 보정 (CTAC)을위한 저선량 CT 스캔의 경우 다음 매개 변수를 사용하십시오.
- 획득 프로토콜의 경우: 단일 프레임, 싱글 베드 위치, 전체 스캔; 튜브 설정: 80kV, 저전류(저선량); 360°에서 576회 조회, 보기당 34ms의 노출 시간(20초 스캔 시간); 회전 유형: 연속, 감도 모드: 고감도.
- 전처리 프로토콜의 경우: 240μm 복셀 크기, 횡단 FOV: Rat, 축 방향 FOV: 100%.
- 재구성 프로토콜의 경우: 필터 창: 부드러움, 복셀 크기: 표준, 빔 경화 및 링 사전 보정 활성화, 링 아티팩트 사후 보정 비활성화.
- 대비가 강화된 게이트 CT 스캔의 경우 다음 설정을 사용하여 세 가지 새 프로토콜( 획득, 전처리 및 재구성용)을 만듭니다.
- 마우스용 획득 프로토콜의 경우: 단일 프레임, 싱글 베드 위치, 전체 스캔 설정, 튜브 설정: 65kV, 최대 전류(저잡음); 360°에서 8,000회 조회, 보기당 노출 시간 15ms(스캔 시간 120초), 회전 유형: 연속, 감도 모드: 고감도. 쥐의 경우 수집 프로토콜 매개 변수를 다음과 같이 설정하십시오 : 80kV 튜브 전압, 360 °에서 16,000보기, 보기 당 12ms 노출 시간 (192 초 스캔 시간).
- 마우스에 대한 전처리 프로토콜의 경우: 120μm 복셀 크기 선택; 횡단 시야(FOV): 마우스; 축 방향 FOV: 50%. 쥐의 경우, 240 μm 복셀 크기를 선택하십시오; 횡단 시야 (FOV) : 쥐; 축 방향 FOV : 50 %.
- 재구성 프로토콜의 경우: 필터 창: 부드러움, 복셀 크기: 표준; 빔 경화 및 링 사전 보정을 활성화하고 링 아티팩트 사후 보정을 비활성화합니다.
- GUI에서 워크플로 탭을 열고 방금 만든 프로토콜(PET의 경우 1.1.1.1-1.1.1.3단계, 1.1.2.1단계)을 추가하여 새 워크플로 를 만듭니다. -1.1.2.3. CTAC 및 단계 1.1.3.1의 경우. -1.1.3.3. 게이트 CT의 경우 주어진 순서대로. 두 경우 모두 프로토콜이 다음 순서로 중첩되어 있는지 확인합니다. 획득 | 전처리 | 재건.
참고: PET 스캔 시작 시 동맥 입력 기능의 피크를 더 잘 캡처하기 위해 지속 시간이 <5초인 동적 PET 프레임이 가능하지만 정량적 정확도가 감소하여 노이즈가 있는 이미지로 이어질 수 있으므로 권장하지 않습니다. 1.1.2.2단계에서는 횡단 FOV에 "쥐" 크기를 사용했습니다. 이것은 CTAC에서 쥐와 마우스 모두에게 일반적으로 사용됩니다.
- PET 스캔의 경우 스캐너(GUI)의 프로토콜 탭을 열고 다음 매개변수를 사용하여 세 개의 새 프로토콜 ( 수집, 전처리 및 재구성용)을 만듭니다.
2. PET/CT 영상을 위한 동물 준비
참고: 본 프로토콜의 경우, 모든 동물을 밤새 금식시켰다.
- 처음에 유도 챔버에서 3%-4%(v/v) 이소플루란으로 마우스를 마취한 다음 1%-2%(v/v) 이소플루란으로 유지합니다.
- 마우스의 무게를 측정하고 기저 혈당을 측정하여 동물의 상태를 모니터링합니다. 필요한 혈액 샘플을 채취하려면 날카로운 가위를 사용하여 꼬리 끝을 약간 자른 다음 꼬리를 부드럽게 마사지하여 테스트 스트립에 직접 혈액 방울 (~ 1 μL)을 수집합니다.
- 마우스의 경우 29G 나비, 쥐의 경우 24G를 사용하여 꼬리 정맥 수준에서 정맥 접근을 진행합니다.
- 캐뉼레이션 기술을 수행하려면 동시 가열 (일반적으로 가열 램프 아래)을 사용하고 정맥의 혈관 확장을 위해 바늘이 삽입되는 지점을 소독하십시오. 캐뉼레이션 후 나비를 실크 리본으로 꼬리에 고정하여 절차 중에 제자리에 고정하십시오.
참고: [18F]FDG 연구를 위해서는 금식이 필요합니다. 다른 추적자는 다른 동물 준비를 포함 할 수 있지만이 주제에 대한 철저한 논의는 현재 프로토콜의 범위를 벗어납니다. [18F]FDG에 관한 한, 단식을 피하는 것은 매우 다른 추적자 생체 분포로 이어집니다16.
- 캐뉼레이션 기술을 수행하려면 동시 가열 (일반적으로 가열 램프 아래)을 사용하고 정맥의 혈관 확장을 위해 바늘이 삽입되는 지점을 소독하십시오. 캐뉼레이션 후 나비를 실크 리본으로 꼬리에 고정하여 절차 중에 제자리에 고정하십시오.
- PET-CT 스캐너에 연결된 마취 시스템 (이소 플루 란 1 % -2 %, 마우스의 경우 0.8 L / min O 2 및 쥐의 경우 1-1.2 L / min)을 켜고 마우스를 침대로 옮깁니다.
- 마우스를 PET-CT 단층 촬영기의 스캐너 베드에 먼저 앙와위 위치에 놓고 마취를 위해 코 마스크에 코를 넣고 접착 테이프로 마우스 머리를 마스크에 부드럽게 차단합니다.
- 마우스의 상지와 하지를 스캐너 베드에 고정하여 이미징 절차 중 움직임으로 이어질 수 있는 비자발적 움직임을 방지합니다.
- 직장 프로브와 호흡 베개를 사용하여 체온과 호흡수를 각각 모니터링합니다.
3. PET 추적자 용량 준비
- 마우스의 경우 인슐린 주사기 (100mL)로 10-150μL의 부피로 1MBq의 [18F] FDG를 추출합니다. 쥐의 경우 0.20-0.25 mL에 15 MBq의 고용량을 섭취하십시오.
알림: 이 프로토콜에서 설명하는 PET 스캐너는 감도가 매우 높고 고품질 이미지를 얻기 위해 적당한 양의 활동이 필요하므로 더 높은 활동을 피하십시오. - 바이알에 있는 추적자의 원래 농도가 너무 높으면 생리학적 용액(0.9% w/v NaCl)을 사용하여 추적자 용량을 50-100MBq/mL의 농도로 희석합니다.
- PET 용량 교정기를 사용하여 주사기의 실제 활동을 측정하십시오. 주입 전 활동 및 측정 시간은 나중에 PET 스캐너 GUI의 특정 입력 모듈을 사용하여 사용되므로 주석을 달아줍니다.
4. CT 조영제 준비
- 요오드화 지질 에멀젼 조영제의 마우스 무게 20g 당 0.2mL를 1mL 주사기에 넣습니다. 더 무거운 마우스의 경우 주입량을 0.5mL의 CA로 제한하십시오. iomeprol을 사용하는 경우 마우스의 주입 속도를 10mL/h(~0.17mL/분)로 설정하고 주입량을 0.5mL로 제한합니다.
- 쥐의 경우 2.3-3mL의 iomeprol을 200mg / mL의 농도로 희석하여 5mL 주사기에 넣습니다.
참고: 소동물 지질 에멀젼 CA를 사용할 수 없는 경우 아래에 설명된 대로 주사기 펌프를 통해 연속 주입하는 iomeprol을 사용할 수 있습니다. - 주사기를 주사기 펌프에 연결하고 실제 주사기 크기와 직경에 맞게 펌프를 설정합니다.
- 주사기를 CA 튜브와 바늘에 연결하고 튜브에 CA를 미리 채 웁니다.
- 주입 속도를 24mL/h(= 0.4mL/분)로 설정하여 주입을 최대 부피를 2mL로 제한합니다.
참고: 요오드화 지질 에멀젼을 기반으로 한 혈액 풀 CA를 사용하는 것은 단일 주사의 더 큰 부피로 인해 이 절차의 상대적으로 높은 비용에도 불구하고 쥐에서도 가능합니다. 이 옵션이 선호되는 경우(예를 들어, 시린지 펌프를 피함으로써 프로토콜을 단순화하기 위해), 다음 절차가 사용될 수 있다: If this option preferred (e.g., the control the protocol by avoid the syringe pump), the following procedure can be the following proceeding: If this option preferred (e.g.g., the control the protocol, Avoid the syringe pump), the following procedure can be the following proceeding:
- 쥐의 경우 2.3-3mL의 iomeprol을 200mg / mL의 농도로 희석하여 5mL 주사기에 넣습니다.
- 요오드화 지질 에멀젼 조영제의 체중 kg 당 7.5mL를 5mL 주사기에 넣습니다. 더 무거운 쥐의 경우에도 주사량을 2mL의 CA로 제한하십시오.
5. 이미징 전 동물 정렬 및 예비 작업
- 이미징 베드에 동물을 고정시키면 단층 촬영 GUI에서 새로운 연구를 만듭니다. 스터디 이름 모듈에 스터디 이름 식별자를 추가하고 드롭다운 메뉴에서 이전에 저장한 이미징 워크플로우를 선택합니다.
- 동물/표본 정보가 있는 적절한 해부학적 부분 선택 | 해부학 적 부분 | 동물/표본 정보에 의한 심장 및 동물 위치 | 포지셔닝 | 앙와위/머리 먼저. 해당 모듈에 대한 동물 무게(그램)에 주석을 달기: 동물/표본 정보 | 동물 무게.
참고: 이 섹션의 다른 모든 정보는 선택 사항이지만 재구성 이미지의 DICOM 헤더에서 찾을 수 있도록 요청된 정보를 최대한 많이 제공하여 후속 데이터 쿼리를 용이하게 하는 것이 유용합니다. - PET 스캔 정보에서 방사성 핵종 선택 | [18F] FDG 연구 및 다른 18F- 표지 화합물에 대한 F18; 다른 추적자(예: [13N]NH3)가 사용되는 경우 수정합니다. PET 스캔 정보에 추적자의 이름도 기재하십시오. 이 이름의 추적기 이름 모듈은 이미지 재구성이 완료되면 DICOM 헤더에 보고됩니다.
참고: 추적기 주입 시간, 활동 및 부피에 대한 정보는 필수이지만 나중에 PET 획득 중에 제공될 수 있습니다. - CT 스캔 정보에 조영제와 관련하여 사용 가능한 모든 정보를 작성하십시오.
참고: 이 모든 정보는 선택 사항이지만 제공된 경우 후속 데이터 쿼리를 용이하게 할 수 있습니다. - 스캔 수행 을 누르고 GUI의 다른 탭이 열릴 때까지 기다렸다가 동물 위치 지정 및 다른 스캔 옵션 지정을 허용합니다.
- CT 보정에서 CT 보정 유형 선택 | 기본 CT 보정을 사용합니다.
- 연구 준비 섹션의 드롭다운 메뉴에서 각 검사 프로토콜을 선택하고 이 검사 전에 사용자 확인 대기 확인란을 선택합니다.
참고: 이 단계는 해당 획득 단계를 시작하기 전에 스캐너가 사용자 입력을 기다리는 대기 상태가 되므로 매우 중요합니다. PET 스캔의 경우 추적자 주입과 실제 PET 스캔 시작의 동기화가 가능합니다. CTAC 스캔의 경우 CT 스캔 중 X- 레이가 방출되기 전에 사용자가 뚜껑을 닫을 수 있습니다 (CT 스캔이 시작되기 전에 뚜껑이 열려 있으면 연구가 자동으로 중단됩니다). Cine-CT 스캔의 경우이 일시 중지를 통해 사용자는 필요한 지연으로 CA 주입 프로토콜 및 CT 데이터 스캔을 시작할 수 있습니다. - 동물 포지셔닝의 경우 GUI의 왼쪽 창에 있는 스위치를 사용하여 모터 제어 모듈을 켭니다.
알림: 이렇게 하면 동물 침대의 센터링 레이저가 켜지고 스캐너 측면에 있는 수동 침대 정렬 버튼이 활성화됩니다. - 수동 침대 정렬 버튼을 사용하여 동물의 가슴을 레이저 마크로 이동합니다. 동물의 세로 및 수직 정렬을주의 깊게 확인하십시오.
- 센터링 레이저에 따라 동물이 올바른 위치에 배치되면 레이저 끄기를 눌러 해당 획득 단계에서 PET 및 CT 스캐너의 중심으로 이동할 현재 레이저 표시 위치를 저장합니다. 그런 다음 모터 제어 모듈을 끕니다.
6. 애완 동물 스캔
- 획득 시작을 눌러 동물을 PET 스캐너 FOV로 이동합니다. 꼬리와 캐뉼러는 추적자 주입을 허용하기 위해 FOV 외부에 남아 있습니다. 스캐너는 사용자가 계속 단추를 누를 때까지 유휴 상태로 유지됩니다.
- 보정 된 PET 추적자 용량으로 주사기를 준비하십시오.
- 계속 버튼을 눌러 수집을 시작하고 스캔 시작 후 5초 이내에 캐뉼러에 트레이서 주입을 시작합니다(그림 1).
알림: 주입 시간은 ~ 20-25 초입니다. - 주사기를 PET 용량 캘리브레이터에 넣고 주사기 내의 잔류 활성을 측정하였다. 실제 활동과 측정 시간에 주석을 추가합니다.
- 스캐너 GUI의 하드웨어 모니터 탭에서 PET 추적기 정보 업데이트 버튼을 사용하여 실제 주입된 시간, 활동 및 볼륨을 삽입합니다.
- 스캔하는 동안 동물의 생리적 매개 변수를 주기적으로 확인하십시오.
- 스캔하는 동안 PET 스캔 시작 후 5분, 20분, 40분 및 60분 시점에서 2.2단계에 설명된 대로 혈당을 측정합니다.
- 혈당 측정 후 테스트 스트립을 감마 카운터에 넣고 60 초 동안 활동 측정을 수행하십시오. 활동 측정이 수행된 실제 시간을 기록하고 추적자 주입 시간을 기준 시간으로 사용하여 방사성 붕괴를 수정합니다. 포도당 테스트 스트립에서 1μL의 평균 혈액량을 고려하여 기록된 활성 값을 활성 농도(Bq/mL)로 변환합니다(즉, 방정식 [1] 사용).
C 혈액 (t) =혈액 (t) / 0.001 mL [Bq / mL] (1)
여기서혈액(t)은 Bq로 표시되는 테스트 스트립에서 혈액 샘플의 부패 보정 측정된 활동입니다.
알림: PET 스캔 시작 및 추적 주사는 주입 중에 작업자 부위에 가까운 스캐너의 측면 테이블에 놓인 단층 촬영기의 모바일 제어 장치를 사용하여 동일한 작업자가 수행할 수 있습니다. 스캔 시작과 주입 시작 사이의 더 긴 지연이 허용되지만 동적 시퀀스의 시작 부분에서 일부 재구성된 프레임은 공백으로 유지됩니다. 10초보다 큰 지연(즉, 현재 프로토콜에서 두 개의 빈 프레임으로 이어짐)을 피하는 것이 좋습니다.

그림 1: PET 추적기 주입. 이 작업은 PET 스캔 시작 직후에 수행됩니다. 동물은 PET 시야 안에 있습니다 (머리가 먼저이고 꼬리가 운전자 측에 보임). 약어 : PET = 양전자 방출 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
7. 전산화 단층 촬영
- CT 조영제를 주입하기 전에 스캐너 덮개를 닫고 GUI의 계속 버튼을 누른 직후 CTAC 스캔을 시작하십시오. 이 매우 짧은 획득이 끝나면 PET 추적자 주입에 사용되는 동일한 혈관 접근을 사용하여 획득 전에 CA를 주입하여 혈액 풀의 적절한 향상을 보장하기 위해 다음 절차를 사용합니다.
- 요오드화 지질 에멀젼 CA:
- CTAC 스캔의 완료 후, 마우스 꼬리 정맥에 이미 연결된 캐뉼라를 사용하여 요오드화 지질 에멀젼 CA를 주입한다. 일반적인 주입 지속 시간은 30-60 초 정도입니다.
- 주입이 완료된 직후 이미징을 시작하십시오. 스캐너 GUI에서 계속 을 눌러 Cine-CT 수집을 시작합니다.
- 이오메프롤/주사기 펌프:
- iomeprol과 같은 일반 X선 CA를 사용하는 경우 일정한 속도로 천천히 주입할 수 있는 주사기 펌프를 사용하십시오.
- 마우스의 경우 주입량을 0.5mL로 제한하여 CA의 주입 속도를 10mL/h(~0.17mL/분)로 설정합니다. 이 설정으로 ~3분 후에 주입을 중지합니다. 쥐의 경우 펌프를 24mL/h(= 0.4mL/분)의 속도로 설정하고 주입량을 2mL로 제한합니다. 이 설정으로 5 분 후에 주입을 중지하십시오.
- CA 튜브에 부착된 바늘을 꼬리 정맥의 캐뉼라에 연결하여 튜브와 바늘이 모두 CA로 미리 채워져 있는지 확인합니다.
- 주입을 시작하십시오. 스캐너 덮개를 닫고 Cine-CT 스캔을 준비합니다.
- 마우스의 경우 주사 시작부터 60초 후, 쥐의 경우 주사 시작부터 90초 후에 단층 촬영기의 GUI에서 계속 버튼을 누르면 Cine-CT 획득이 시작됩니다. CA 주사는 마우스에 대한 Cine-CT 스캔 완료와 거의 동시에 그리고 쥐에 대한 완료시 중단됩니다.
- 요오드화 지질 에멀젼 CA:
- Cine-CT 스캔이 완료되면 생리 모니터링 시스템에서 동물을 분리하고 꼬리 정맥 캐뉼라를 제거하십시오. 실제 프로토콜에 따라, 동물은 기재된 영상화 절차 후에 회수되거나 안락사된다. 첫 번째 경우, 동물들은 적외선 램프 아래 따뜻한 환경에서 새장에서 깨어납니다. 그들은 완전히 깨어날 때까지 모니터링되며 기체 마취 후 15/30 분이 걸립니다. 예를 들어, 이미징 절차가 끝날 때 조직 수확을 요구하는 프로토콜의 경우, D.Lgs. 26/2014의 부록 VI에 따라 유도 챔버 (5 % 이소 플루 란)에서 마취 과다 복용을 사용하여 동물을 안락사시킵니다.
참고 :이 프로토콜에서 논의 된 18개의 F 기반 방사성 핵종의 경우, 추적 주사 후 24 시간은 모든 실용적인 목적에 안전한 동물의 몸에 잔류 방사능 수준에 도달하기에 충분합니다.
8. 내인성 심폐 게이팅을 이용한 심장 4DCT 영상 재구성
알림: 영상 연구가 완료되면 표준 PET 및 CT 재구성이 자동으로 수행됩니다. 그럼에도 불구하고 4D (Cine) 심장 CT 시퀀스의 재구성은 수동으로 수행해야하며 일부 사용자 상호 작용이 필요합니다. 후속 형태 기능성 심장 CT 분석에 필수적인이 특별한 유형의 재구성은이 섹션에서 논의됩니다.
- 단층 촬영 GUI의 심장 게이팅 모듈을 열고 분석할 영상 연구를 선택합니다.
- 표시된 동물의 방사선 사진(그림 2)에서 관심 영역(ROI)을 선택하여 게이팅 신호인 키모그램을 나타내는 시간 종속 심장 운동 곡선을 만듭니다. 심장 정점과 다이어프램이 모두 선택되도록 미리 그려진 직사각형 ROI를 수직으로 이동합니다. 그런 다음 게이팅 신호 분석을 선택합니다. 이제 사용자 인터페이스는 시간 도메인과 주파수 도메인 모두에서 게이팅 신호를 표시합니다.
- 첫 번째 주파수 영역 그래프에서 주파수 스펙트럼의 첫 번째 피크 그룹을 강조 표시하여 호흡 주파수 대역을 선택합니다(스펙트럼의 예는 그림 3 참조).
- 두 번째 주파수 영역 그래프에서 심장 운동 주파수 대역을 선택하여 두 번째로 선명한 피크를 강조 표시합니다.
- 다음 단계에서는 색상 마커(점)가 겹쳐진 시간 영역 게이팅 신호를 관찰하여 식별된 호흡 피크와 심장 수축 피크를 보여줍니다. 마커 위치가 원래 게이팅 신호의 호흡 및 심장 피크와 잘 맞으면 다음 단계로 진행합니다. 그렇지 않으면:
- 게이팅 신호의 모양이 그림 3에 표시된 것과 너무 다른 경우 8.2단계로 돌아가서 다른 ROI를 선택합니다.
- 게이팅 신호의 모양이 그림 3에 표시된 것과 상당히 유사하면 8.3단계와 8.4단계로 돌아가서 게이팅 신호 스펙트럼에서 다른 주파수 대역을 선택합니다.
- 다음 단계에서는 최소 4 개의 심장 게이트를 선택하십시오.
알림: 일반적인 Cine-CT 재구성은 8-12 개의 심장 게이트로 구성됩니다. - 드롭다운 메뉴를 사용하여 적절한 호흡 창을 선택합니다: 호흡 창 | 20%-80%.
참고 : 이것은 피크 영감 단계를 제외하고 재구성에서 획득 한 데이터의 60 %를 유지하므로 각 심장 단계에서 재구성 된 심근 벽의 선명도가 향상됩니다. - 재구성을 수행하여 회급적으로 게이트된 Cine-CT 이미지를 DICOM 형식으로 변환하고 후속 기능 분석을 위해 소프트웨어로 가져올 수 있습니다.
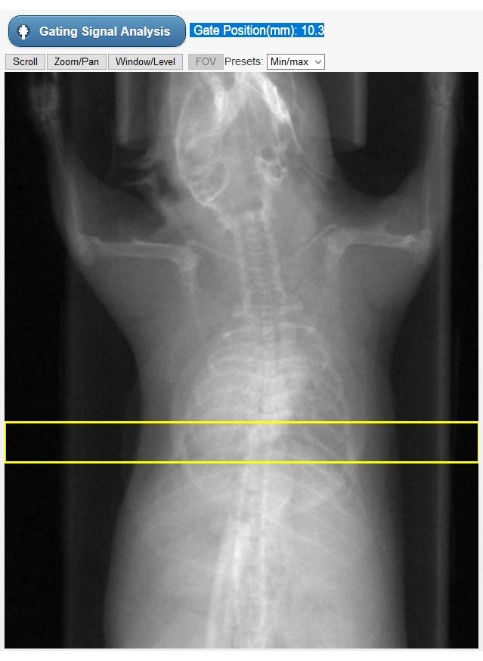
그림 2: 내장 게이팅을 위한 ROI 선택 도구. 이 이미지는 Cine-CT 재구성 단계에서 단층 촬영기의 GUI에 표시됩니다. 사용자는 원시 CT 투영에서 고유 게이팅 신호(키모그램)를 얻을 수 있는 ROI(노란색 직사각형)의 위치를 선택해야 합니다. 동물 가슴에 겹쳐진 원형 물체는 연구 중 생리적 모니터링에만 사용되는 호흡 베개입니다. 약어 : ROI = 관심 영역; CT = 컴퓨터 단층 촬영; GUI = 그래픽 사용자 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
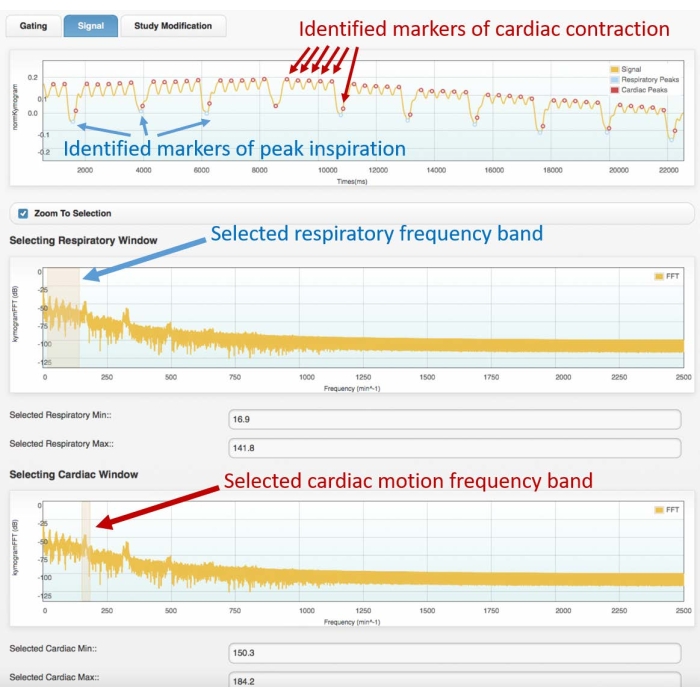
그림 3: 게이팅 신호(상단 프레임) 및 해당 주파수 스펙트럼(중앙 및 하단)의 예. 아트리움 소프트웨어의 심장 게이팅 모듈로 얻은 이미지. 사용자는 호흡(중앙 프레임)과 심장 운동(하단 프레임) 모두에 적합한 주파수 대역을 선택해야 합니다. 이를 통해 게이팅 신호에서 호흡기 및 심장 마커를 식별 할 수 있으며 4D 재구성을 진행하기 전에 사용자가 확인해야합니다. 피크의 잘못된 식별 또는 잘못된 할당 (예 : 호흡기에서 심장으로 또는 그 반대)은 잘못된 재건으로 이어질 것입니다. 표시된 데이터는 건강한 성인 남성 Wistar 쥐 (507g)의 4D Cine-CT 스캔 분석에서 얻은 것입니다 2mL의 iomeprol, 200mg / mL를 5 분 동안 0.4mL / 분의 속도로 주사했습니다 (상단의 그래프는 확인 된 심장 및 호흡 운동을보다 잘 시각화 할 수 있도록 획득의 처음 22 초에서 확대됩니다). 약어 : CT = 컴퓨터 단층 촬영. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
9. 애완 동물 심장 분석
참고: 이 섹션에서는 작은 동물 좌심실의 동적 [18F]FDG 데이터의 동역학 분석을 수행하는 방법을 보여줍니다. 분석은 Carimas 소프트웨어를 기반으로 합니다. 아래 지침은 소프트웨어 사용 설명서17을 대체하기 위한 것이 아닙니다. 아래에 제시된 절차는 동적 PET 데이터18의 Patlak 그래픽 분석을 기반으로합니다. 이 분석에 대한 자세한 내용은 토론 섹션을 참조하십시오.
- 동적 PET 스캔의 DICOM 이미지를 엽니다.
- 하트플러그인 모듈을 선택합니다.
- 마우스/쥐 심장의 이미지를 확대하고 대부분의 혈액 풀 활동이 이미 씻겨 나간 마지막 시간 프레임(또는 이와 동등한 마지막 3-5개 시간 프레임의 합)을 선택합니다.
- 화면의 지시에 따라 동물 심장의 주축(짧은 축, 세로 및 가로 긴 축)을 따라 이미지 방향을 변경합니다. 심장 기저부와 정점에 대해 표시된 마커를 이동하여 대화식으로 수행합니다(그림 4).
- 세그멘테이션 도구를 선택합니다.
참고: 기본적으로 자동 세분화가 활성화되어 대부분의 경우 신뢰할 수 있는 결과를 얻을 수 있습니다. - 자동 분할의 결과가 허용되지 않는 경우 수동 모드 (ROI 검색 비활성화됨)를 활성화하여 분할된 심근 및/또는 LV 공동의 모양을 구체화합니다.
- 모델링 도구에서 동적 PET 분석에 사용할 적절한 키네틱 모델을 선택합니다. 이 경우 그래픽 | Patlak은 각 심장 부문에 대한 포도당 흡수(MRGlu)의 대사율 계산을 위한 Patlak 플롯 분석을 가능하게 한다.
- 폴라맵 도구에서 표시된 하트 세그먼트의 정확한 수를 선택합니다. 이 경우 17개의 세그먼트를 선택합니다.
- 이제 피팅 버튼을 눌러 Patlak 해석의 피팅 절차를 수행합니다.
- 피팅 절차가끝나면 Ki 값의 표시된 극좌표 맵(즉, mL/[mL × min]으로 표시되는 선형 회귀의 기울기)을 관찰합니다.
- 표에 표시된 각 섹터에 대한Ki 값을 사용하여 식 (2)를 사용하여 MRGlu를 계산합니다.
MR글루 =(Ki × PGlu) / LC (2)
여기서 PGlu 는 혈장 포도당 농도 (mmol / L)의 혈액 샘플 파생 값이고 덩어리 상수 (LC)는 정상 포도당과 FDG 간의 흡수 차이를 보상하는 데 사용되는 경험적 계수입니다. 예를 들어, 다양한 실험 조건에서 집중 상수의 전형적인 값에 대해서는 Ng et al.22 를 참조하십시오.
참고: PET 분석을 시작하기 전에 PET 분석 소프트웨어 도구 내에서 PET 볼륨의 동적 시퀀스를 육안으로 검사하는 것이 좋습니다. 이것은 연구 중 시간 프레임 사이의 거시적 동물 움직임을 배제하는 데 필요합니다. 모션이 있는 경우 가능하면 분석 전에 적절한 이미지 등록(이 프로토콜의 범위를 벗어남)을 수행해야 합니다.
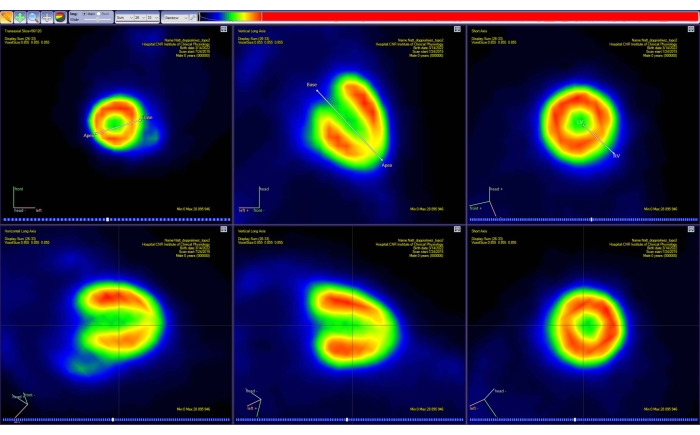
그림 4: PET 분석 소프트웨어의 방향 전환 도구. 3D 공간에서 두 개의 단순 선 세그먼트의 투영은 세 개의 표준 평면(횡축, 관상 및 시상) 각각에 표시됩니다. 첫 번째 세그먼트는 사용자가 심장 기저부와 정점을 선택할 수 있도록 하고 두 번째 세그먼트는 심장의 왼쪽과 오른쪽을 선택할 수 있도록 합니다. 이 단계를 수행하면 표준 AHA 표현에 따라 심장의 방향이 변경된 새로운(보간된) PET 이미지(맨 아래 줄)가 생성됩니다. 이미지는 체중이 51g이고 10MBq의 [18F]FDG를 주사한 건강한 성인 남성 CD-1 마우스로부터 카리마스로 획득하였다. 약어 : PET = 양전자 방출 단층 촬영; AHA = 미국 심장 협회; FDG = 플루오로 데 옥시 글루코오스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
10. 시네 CT 심장 분석
알림: 이 섹션에서는 Cine-CT 심장 영상의 정량 분석을 수행하여 심장 기능의 글로벌 정량 데이터를 수집하는 방법을 보여줍니다. 분석은 Osirix MD 소프트웨어를 기반으로 합니다. 아래 지침은 Osirix 사용 설명서24를 대체하기 위한 것이 아닙니다.
- 소프트웨어에 Cine-CT 스캔의 DICOM 이미지를 로드합니다.
- 내장된 4D 뷰어로 동적 데이터세트를 엽니다.
- 3D MPR(다중 평면 개혁) 도구를 사용하여 짧은 축을 따라 이미지 데이터의 방향을 변경합니다(그림 5).
- 방향이 변경된 데이터를 DICOM으로 내보내 전체 4D 데이터를 슬라이스 두께(원본과 동일) 및 이미지 비트 심도(복셀당 16비트)로 내보냅니다.
- 4D 뷰어를 사용하여 내보낸 4D MPR 이미지를 엽니다.
- 이완기 종료에 해당하는 기간을 선택하십시오. 기본 도구 모음의 시간 슬라이더로 모든 시간 프레임을 탐색하여 올바른 심장 단계가 선택되었는지 확인합니다.
- 이 시간 프레임에서 닫힌 다각형 주석 도구를 선택하고 LV의 심내벽을 수동으로 묘사합니다.
- 베이스에서 정점까지 10-20개의 슬라이스에 대해 동일한 작업을 수행하여 모든 ROI가 동일한 이름(예: LVENDO)을 갖도록 합니다.
- ROI 메뉴에서 ROI 볼륨 | 누락된 ROI를 생성하여 수동으로 그린 ROI를 보간하여 모든 단축 슬라이스에서 ROI를 생성합니다.
- ROI 메뉴에서 ROI 볼륨 | 볼륨 계산 - ROI 이름이 동일한 ROI 그룹의 볼륨을 계산합니다.
- 시간 프레임을 탐색하고 수축기 말기(더 작은 LV 볼륨)에 해당하는 단계를 선택하고 위의 10.7-10.10단계를 반복합니다.
- 스트로크 부피(SV)와 배출률은 방정식 (3)과 (4)를 사용하여 계산합니다.
SV = EDV - ESV [mL] (3)
EF = 100 × SV/EDV [%] (4)
여기서 EDV는 이완기 말 부피이고 ESV는 수축기 말 부피입니다.
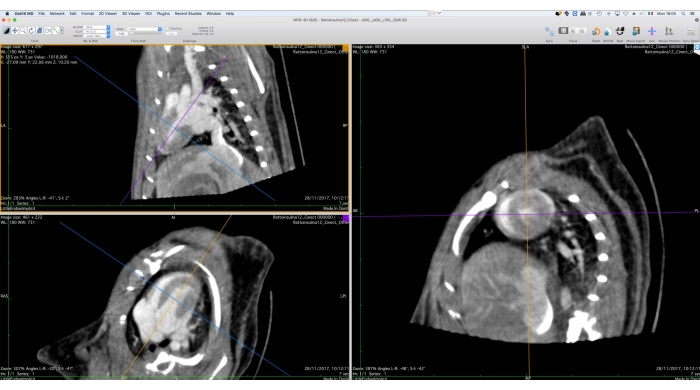
그림 5: 다중 평면 개혁 도구의 그래픽 인터페이스. 이 도구는 후속 기능 분석을 위해 Cine-CT 데이터의 방향을 변경하는 데 사용됩니다. 사용자는 심장의 단축 보기가 오른쪽에 표시되도록 화면 왼쪽의 참조 축을 회전하고 변환해야 합니다. 이 절차의 끝에서 사용자는 방향이 변경된 이미지를 DICOM 파일 세트로 내보낼 수 있습니다. 이미지는 Osirix MD로 얻었으며 건강한 성인 남성 Wistar 쥐 (507g)에게 2mL의 iomeprol, 200mg / mL를 5 분 동안 0.4mL / 분의 속도로 주사하고 복셀 크기가 0.24mm3 인 필터링 된 백 프로젝션으로 재구성했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
이 섹션에서는 지금까지 설명한 절차에 따라 PET 및 CT 분석 모두에 대한 일반적인 결과를 보여줍니다. 도 6 은 대조군(건강한) CD-1 마우스의 [18F]FDG PET 스캔의 자동 심근 및 LV 캐비티 분할의 결과를 나타낸다. 재구성된 이미지에서 우심실이 항상 보이는 것은 아니지만, 미국 심장 협회(AHA) 권장 사항에 따라 표준 섹터를 신뢰할 수 있는 식별에 필요한 대로 DICOM 헤더를 ?...
Access restricted. Please log in or start a trial to view this content.
토론
이 논문에 제시된 프로토콜은 고해상도 PET/CT 영상을 사용하여 심장 손상의 작은 동물 모델에 대한 중개 심혈관 연구를 위한 일반적인 실험 절차에 중점을 둡니다. 제시된 결과는 PET 및 Cine-CT 이미지의 높은 양적 및 질적 가치를 나타내며 포도당 대사, 모양 및 수축 역학에 관한 전체 심장의 기능적 및 구조적 정보를 제공합니다. 또한 얻은 모든 이미지는 3D, 시간 해상도 및 현재 등방성 픽셀 간격입...
Access restricted. Please log in or start a trial to view this content.
공개
Daniele Panetta는 Inviscan Sas로부터 마이크로 CT 기기의 R&D에 대한 보조금을 받았습니다.
감사의 말
이 연구는 JPI-HDHL-INTIMIC "GUTMOM"프로젝트 : 자손의 모성 비만 및인지 기능 장애 : GUT MicrobiOMe의 인과 관계 역할 및 조기식이 예방 (프로젝트 번호. INTIMIC-085, 이탈리아 교육부, 대학 및 연구 법령 번호 946/2019).
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
참고문헌
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841(2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362(2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82(2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31(2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053(2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89(2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206(2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7(2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Carimas User Manual. , Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022).
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , San Francisco, CA. (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591(2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532(2014).
- Kim, D. -Y., Cho, S. -G., Bom, H. -S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine. , Available from: https://www.medilumine.com/technical-resources (2019).
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783(2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. Grupen, C., Buvat, I. , Springer. Berlin, Heidelberg. 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603(2016).
- Lee, C. -L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. Kuntner-Hannes, C., Haemisch, Y. , Springer. Cham, Switzerland. 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003(2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유