È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Tomografia cardiaca ad emissione di positroni ad alta risoluzione/tomografia computerizzata per piccoli animali
In questo articolo
Riepilogo
Qui, presentiamo un protocollo sperimentale di imaging per la quantificazione della funzione cardiaca e della morfologia utilizzando la tomografia ad emissione di positroni ad alta risoluzione / tomografia computerizzata per piccoli animali. Vengono considerati sia i topi che i ratti, discutendo i diversi requisiti degli agenti di contrasto della tomografia computerizzata per le due specie.
Abstract
La tomografia ad emissione di positroni (PET) e la tomografia computerizzata (TC) sono tra le tecniche di diagnostica per immagini più utilizzate ed entrambe servono a comprendere la funzione cardiaca e il metabolismo. Nella ricerca preclinica vengono impiegati scanner dedicati con elevata sensibilità e alta risoluzione spazio-temporale, progettati per far fronte ai severi requisiti tecnologici posti dalle piccole dimensioni del cuore e dalle frequenze cardiache molto elevate di topi e ratti. In questo articolo, viene descritto un protocollo di imaging PET/CT cardiaco bimodale per modelli sperimentali di malattie cardiache su topi e/o ratti, dalla preparazione degli animali e dall'acquisizione e ricostruzione delle immagini all'elaborazione e visualizzazione delle immagini.
In particolare, la scansione18 fluorodesossiglucosio marcata F ([18F]FDG)-PET consente la misurazione e la visualizzazione del metabolismo del glucosio nei diversi segmenti del ventricolo sinistro (LV). Le mappe polari sono strumenti utili per visualizzare queste informazioni. La parte TC consiste in una ricostruzione 3D risolta nel tempo dell'intero cuore (4D-CT) utilizzando il gating retrospettivo senza elettrocardiografia (ECG), consentendo la valutazione morfofunzionale del ventricolo sinistro e la successiva quantificazione dei più importanti parametri della funzione cardiaca, quali la frazione di eiezione (EF) e il volume dell'ictus (SV). Utilizzando uno scanner PET/CT integrato, questo protocollo può essere eseguito all'interno della stessa induzione anestesiologica senza la necessità di riposizionare l'animale tra diversi scanner. Quindi, la PET / CT può essere vista come uno strumento completo per la valutazione morfofunzionale e metabolica del cuore in diversi piccoli modelli animali di malattie cardiache.
Introduzione
I piccoli modelli animali sono estremamente importanti per il progresso della comprensione delle malattie cardiovascolari 1,2. Gli strumenti di diagnostica per immagini non invasivi hanno rivoluzionato il modo in cui guardiamo alla funzione cardiaca negli ultimi decenni, sia in ambito clinico che preclinico. Per quanto riguarda i piccoli modelli animali di malattie cardiache, sono stati sviluppati strumenti di imaging specifici con risoluzione spaziotemporale molto elevata. Pertanto, tali strumenti possono soddisfare la necessità di una quantificazione accurata dei parametri miocardici metabolici e cinetici rilevanti sui cuori molto piccoli e in rapido movimento di topi e ratti in specifici modelli di malattia, come l'insufficienza cardiaca (HF) 3 o l'infarto miocardico (MI) 4. A tale scopo sono disponibili diverse modalità, ognuna con i propri punti di forza e di debolezza. L'imaging a ultrasuoni (US) è la modalità più utilizzata grazie alla sua grande flessibilità, risoluzione temporale molto elevata e costo relativamente basso. L'adozione dell'imaging cardiaco statunitense nei piccoli animali è aumentata considerevolmente dall'avvento dei sistemi che utilizzano sonde ad altissima frequenza5,6, con risoluzioni spaziali inferiori a 50 μm.
Tra i principali svantaggi di US per l'imaging cardiaco completamente 3D c'è la necessità di scansioni lineari lungo l'asse cardiaco montando la sonda su uno stadio di traslazione motorizzato per creare una pila completa di immagini dinamiche B-mode dell'intero cuore7. Alla fine, questa procedura dà origine (dopo un'accurata registrazione spaziale e temporale delle immagini acquisite in ciascuna posizione della sonda) a un'immagine 4D con diverse risoluzioni spaziali tra le direzioni in-plane e out-of-plane. Lo stesso problema di risoluzione spaziale non uniforme si verifica nella RM cardiaca (CMR),8 che rappresenta ancora il gold standard nell'imaging funzionale del cuore. L'imaging 3D isotropo reale può invece essere ottenuto utilizzando sia la tomografia computerizzata (TC) che la tomografia ad emissione di positroni (PET)9. La PET fornisce uno strumento molto sensibile in termini di segnale di immagine per quantità di sonda iniettata (nell'intervallo nanomolare), anche se soffre di una risoluzione spaziale ridotta rispetto a CT, MR o US. Il principale vantaggio della PET è la sua capacità di mostrare i meccanismi cellulari e molecolari alla base della fisiopatologia dell'organo. Ad esempio, una scansione PET dopo l'iniezione di [18F]FDG consente la ricostruzione di una mappa 3D del metabolismo del glucosio nel corpo. Combinando questo con l'acquisizione dinamica dei dati (cioè risolta nel tempo), la modellazione cinetica del tracciante può essere utilizzata per calcolare mappe parametriche dei tassi metabolici di assorbimento del glucosio (MRGlu), che forniranno importanti informazioni sulla vitalità miocardica10.
La TC richiede volumi significativi di agenti di contrasto esterni (CA) ad alte concentrazioni (fino a 400 mg di iodio per ml) per fornire un miglioramento misurabile dei componenti tissutali rilevanti (ad esempio, sangue rispetto al muscolo), ma eccelle nella risoluzione spaziale e temporale, specialmente quando si utilizzano scanner micro-CT all'avanguardia progettati per l'imaging di piccoli animali. 11 Un tipico modello di malattia in cui può essere applicata la PET/TC cardiaca è la valutazione sperimentale dell'infarto miocardico e dell'insufficienza cardiaca e la relativa risposta alla terapia. Un modo comune di indurre l'infarto miocardico nei piccoli animali è la legatura chirurgica dell'arteria coronaria discendente anteriore sinistra (LAD)12,13 e quindi valutando longitudinalmente la progressione della malattia e il rimodellamento cardiaco nei giorni successivi4. Tuttavia, la valutazione morfofunzionale quantitativa del cuore in piccoli animali è ampiamente applicabile anche per altri modelli di malattia, come la valutazione dell'effetto dell'invecchiamento sulla funzione cardiaca14 o l'alterata espressione del recettore in modelli di obesità15. Il protocollo di imaging presentato non è limitato a nessun modello di malattia e, quindi, potrebbe essere di più ampio interesse in diversi contesti di ricerca preclinica con piccoli roditori.
In questo articolo, presentiamo un protocollo sperimentale start-to-end per l'imaging cardiaco utilizzando PET / CT integrata per piccoli animali. Anche se il protocollo presentato è progettato per uno specifico scanner integrato bimodale, le parti PET e CT della procedura descritta potrebbero essere eseguite indipendentemente su scanner separati di diversi produttori. Nello scanner PET/CT in uso, la sequenza di operazioni è organizzata in un flusso di lavoro preprogrammato. I rami principali di ogni flusso di lavoro sono uno o più protocolli di acquisizione; Ogni protocollo di acquisizione può avere uno o più rami per protocolli di pre-elaborazione specifici e, a sua volta, ogni protocollo di pre-elaborazione può avere uno o più rami per protocolli di ricostruzione specifici. Vengono descritte sia la preparazione dell'animale sul letto di imaging che la preparazione degli agenti esterni da iniettare durante le procedure di imaging. Dopo il completamento della procedura di acquisizione delle immagini, vengono fornite procedure di esempio per l'analisi quantitativa delle immagini basate su strumenti software comunemente disponibili. Il protocollo principale è specificamente progettato per i modelli di mouse; Anche se il topo rimane la specie più utilizzata in questo campo, mostriamo anche un adattamento del protocollo per l'imaging dei ratti alla fine del protocollo principale. Risultati rappresentativi sono mostrati sia per i topi che per i ratti, dimostrando il tipo di output che ci si potrebbe aspettare con le procedure descritte. Alla fine di questo articolo viene fatta una discussione approfondita per sottolineare i pro e i contro della tecnica, i punti critici, nonché come diversi radiotraccianti PET potrebbero essere utilizzati con quasi nessuna modifica alle fasi preparatorie e di acquisizione / ricostruzione.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Gli esperimenti sugli animali sono stati eseguiti in conformità con le raccomandazioni contenute nella Guida per la cura e l'uso degli animali da laboratorio delle Linee guida internazionali sulla manipolazione degli animali da laboratorio, richieste dalla Direttiva Europea (Direttiva 86/609/CEE del 1986 e Direttiva 2010/63/UE) e dalle leggi italiane (D.Lgs. 26/2014).
1. Impostazione dei protocolli di imaging PET/CT e del flusso di lavoro
NOTA: Il protocollo qui presentato è specificamente progettato per l'imaging cardiaco di modelli murini. Lavorare con i ratti potrebbe implicare alcune modifiche al protocollo attuale, principalmente a causa delle dimensioni maggiori dell'animale (circa 10 volte più pesante). Le modifiche per l'imaging dei ratti sono specificamente menzionate nei passaggi; Se non vengono menzionate modifiche, è possibile utilizzare gli stessi passaggi per l'imaging del mouse per i ratti.
- Aprire l'interfaccia utente grafica (GUI) dello scanner PET/CT (vedere Tabella dei materiali) e creare una serie di nuovi protocolli (comprensivi di parametri per l'acquisizione dei dati, la pre-elaborazione e la ricostruzione delle immagini): (i) a scansione PET dinamica, ii) a TAC a basso dosaggio per la correzione dell'attenuazione (CTAC) senza mezzo di contrasto, e iii) un scansione Cine-CT con contrasto migliorato.
NOTA: La creazione di nuovi protocolli (cioè istruzioni software specifiche per il tomografo) per le fasi di acquisizione, pre-elaborazione e ricostruzione è un processo semplice; in caso di problemi, l'utente può trovare informazioni più dettagliate nel manuale utente della GUI.- Per la scansione PET, aprire la scheda Protocollo dello scanner (GUI) e creare tre nuovi protocolli (per l'acquisizione, la pre-elaborazione e la ricostruzione) con i seguenti parametri:
- Per il protocollo di acquisizione : impostare il tempo di scansione totale di 3.600 s e la posizione del letto singolo. Salvare questo protocollo con un nome corretto per la successiva importazione nel flusso di lavoro. Fai lo stesso anche per tutti i prossimi protocolli nei seguenti punti.
- Per il protocollo di pre-elaborazione per il mouse: selezionare una finestra di energia (EW) di 250-750 keV e abilitare le seguenti correzioni: decadimento radioattivo, coincidenze casuali e tempi morti. Impostare il protocollo di framing (ovvero la suddivisione dinamica dei dati grezzi) come segue: 8 x 5 s, 8 x 10 s, 3 x 40 s, 2 x 60 s, 2 x 120 s, 10 x 300 s (= 3.600 s). Per ratto, selezionare una finestra di energia (EW) da 350-750 keV, utilizzando la stessa inquadratura del protocollo del mouse.
- Per il protocollo di ricostruzione: selezionare l'algoritmo 3D-OSEM-MC (3D Ordered Subset Expectation Maximization) di alta qualità, basato su Monte Carlo, con 8 sottoinsiemi e 8 iterazioni, con normalizzazione, correzione quantitativa e correzione dell'attenuazione CT abilitata.
- Per la scansione TC a basso dosaggio per la correzione dell'attenuazione (CTAC), utilizzare i seguenti parametri:
- Per il protocollo di acquisizione : single frame, posizione letto singolo, full-scan; impostazioni del tubo: 80 kV, bassa corrente (bassa dose); 576 viste su 360°, con 34 ms di tempo di esposizione per vista (tempo di scansione 20 s); Tipo di rotazione: continua, modalità di sensibilità: alta sensibilità.
- Per il protocollo di pre-elaborazione: dimensione voxel 240 μm, FOV trasversale: ratto, FOV assiale: 100%.
- Per il protocollo di ricostruzione : finestra del filtro: liscia, dimensione voxel: standard , abilitare l'indurimento del fascio e la precorrezione dell'anello, disabilitare la correzione post artefatto dell'anello.
- Per la scansione CT gated con contrasto avanzato, creare tre nuovi protocolli (per l'acquisizione, la pre-elaborazione e la ricostruzione) con le seguenti impostazioni:
- Per il protocollo di acquisizione per mouse: impostare frame singolo, posizione letto singolo, scansione completa; impostazioni del tubo: 65 kV, corrente piena (basso rumore); 8.000 visualizzazioni su 360°, con 15 ms di tempo di esposizione per vista (tempo di scansione 120 s); tipo di rotazione: continua, modalità sensibilità: alta sensibilità. Per rat, impostare i parametri del protocollo di acquisizione come segue: tensione del tubo 80 kV, 16.000 visualizzazioni su 360°, con tempo di esposizione di 12 ms per vista (tempo di scansione 192 s).
- Per il protocollo di pre-elaborazione per il mouse: selezionare la dimensione del voxel 120 μm; campo visivo trasversale (FOV): mouse; FOV assiale: 50%. Per il ratto, selezionare una dimensione del voxel di 240 μm; campo visivo trasversale (FOV): ratto; FOV assiale: 50%.
- Per il protocollo di ricostruzione : finestre del filtro: lisce, dimensioni voxel: standard; Abilita l'indurimento del fascio e la precorrezione dell'anello, disabilita la correzione post artefatto dell'anello.
- Aprire la scheda Workflow nella GUI, e creare un nuovo workflow, aggiungendo i protocolli appena creati: steps 1.1.1.1-1.1.1.3 for PET, steps1.1.2.1. -1.1.2.3. per CTAC e i passaggi 1.1.3.1. -1.1.3.3. per CT gated, nell'ordine indicato. In entrambi i casi, assicurarsi che i protocolli siano nidificati con l'ordine seguente: Acquisizione | Pre-elaborazione | Ricostruzione.
NOTA: I telai PET dinamici con durate <5 s per catturare meglio il picco della funzione di input arterioso all'inizio della scansione PET sono possibili, ma non sono raccomandati in quanto ciò può portare a immagini rumorose con precisione quantitativa ridotta. Nel passaggio 1.1.2.2, abbiamo usato la dimensione "Ratto" per il FOV trasversale. Questo è comunemente usato sia per i ratti che per i topi in CTAC.
- Per la scansione PET, aprire la scheda Protocollo dello scanner (GUI) e creare tre nuovi protocolli (per l'acquisizione, la pre-elaborazione e la ricostruzione) con i seguenti parametri:
2. Preparazione animale per l'imaging PET/TC
NOTA: Per il presente protocollo, tutti gli animali sono stati digiunati durante la notte.
- Anestetizzare il topo con isoflurano al 3%-4% (v/v) in una camera di induzione inizialmente, e poi mantenere con isoflurano all'1%-2% (v/v).
- Pesare il topo e misurare la glicemia basale per monitorare le condizioni dell'animale. Per prelevare il campione di sangue richiesto, utilizzare forbici affilate e fare un piccolo taglio sulla punta della coda, quindi massaggiare delicatamente la coda per raccogliere una goccia di sangue (~ 1 μL) direttamente sulla striscia reattiva.
- Procedere con l'inserimento di un accesso venoso a livello della vena caudale utilizzando una farfalla da 29 G per il topo e 24 G per il ratto.
- Per eseguire la tecnica di incannulamento, utilizzare il riscaldamento simultaneo (in genere, sotto una lampada riscaldante) e la disinfezione del punto in cui viene inserito l'ago per la vasodilatazione della vena. Dopo l'incannulamento, fissare la farfalla con un nastro di seta alla coda per tenerla in posizione durante la procedura.
NOTA: Il digiuno è richiesto per [18studi F]FDG. Diversi traccianti potrebbero comportare una diversa preparazione animale, ma una discussione approfondita su questo argomento è al di fuori dello scopo del presente protocollo. Per quanto riguarda [18F]FDG, evitare il digiuno porta a una biodistribuzione del tracciante molto diversa16.
- Per eseguire la tecnica di incannulamento, utilizzare il riscaldamento simultaneo (in genere, sotto una lampada riscaldante) e la disinfezione del punto in cui viene inserito l'ago per la vasodilatazione della vena. Dopo l'incannulamento, fissare la farfalla con un nastro di seta alla coda per tenerla in posizione durante la procedura.
- Accendere il sistema di anestesia (isoflurano 1%-2%, 0,8 L/min O 2 per il topo e 1-1,2 L/min per il ratto) collegato allo scanner PET-CT e trasferire il mouse sul letto.
- Posizionare il mouse in posizione supina, a testa in giù, sul letto dello scanner del tomografo PET-CT, mettendo il naso nella maschera nasale per l'anestesia e bloccando delicatamente la testa del mouse alla maschera con nastro adesivo.
- Fissare gli arti superiori e inferiori del mouse sul letto dello scanner per evitare movimenti involontari durante le procedure di imaging, che possono portare a artefatti di movimento.
- Monitorare la temperatura corporea e la frequenza respiratoria utilizzando rispettivamente una sonda rettale e un cuscino respiratorio.
3. Preparazione della dose del tracciante PET
- Per i topi, aspirare 10 MBq di [18F]FDG in un volume di 100-150 μL con una siringa da insulina (1 ml). Per i ratti, prelevare una dose più elevata di 15 MBq in 0,20-0,25 ml.
NOTA: evitare un'attività più elevata poiché lo scanner PET discusso in questo protocollo ha una sensibilità molto elevata e richiede solo una modesta quantità di attività per ottenere immagini di alta qualità. - Se la concentrazione originale del tracciante nel flaconcino è troppo elevata, utilizzare una soluzione fisiologica (0,9% p/v di NaCl) per diluire la dose del tracciante ad una concentrazione di 50-100 MBq/ml.
- Utilizzare il calibratore della dose in PET per misurare l'attività effettiva nella siringa. Annotare l'attività di preiniezione e il tempo di misurazione poiché questi valori verranno utilizzati in seguito utilizzando moduli di input specifici della GUI dello scanner PET.
4. Preparazione del mezzo di contrasto CT
- Aspirare 0,2 mL per 20 g di peso del topo di mezzo di contrasto emulsione lipidica iodata in una siringa da 1 mL. Limitare il volume di iniezione a 0,5 mL di CA per topi più pesanti. Se si utilizza iomeprol, impostare la velocità di iniezione per i topi a 10 mL/h (~0,17 mL/min) e limitare il volume di iniezione a 0,5 mL.
- Per i ratti, aspirare 2,3-3 ml di iomeprolo, diluito ad una concentrazione di 200 mg/ml, in una siringa da 5 ml.
NOTA: Se l'emulsione lipidica CA per piccoli animali non è disponibile, è possibile utilizzare iomeprolo con iniezione continua per mezzo di una pompa a siringa, come discusso di seguito. - Collegare la siringa alla pompa della siringa e impostare la pompa per le dimensioni e il diametro effettivi della siringa.
- Collegare la siringa al tubo e all'ago CA e preriempire il tubo con il CA.
- Impostare la velocità di iniezione su 24 ml/h (= 0,4 ml/min), limitando l'iniezione a un volume massimo di 2 ml.
NOTA: L'uso di CA del pool sanguigno basato su emulsione lipidica iodata è possibile anche nei ratti, nonostante il costo relativamente elevato di questa procedura a causa del volume maggiore di una singola iniezione. Se si preferisce questa opzione (ad esempio, per semplificare il protocollo evitando la pompa a siringa), è possibile utilizzare la seguente procedura:
- Per i ratti, aspirare 2,3-3 ml di iomeprolo, diluito ad una concentrazione di 200 mg/ml, in una siringa da 5 ml.
- Aspirare 7,5 mL per kg di peso corporeo di mezzo di contrasto di emulsione lipidica iodata in una siringa da 5 ml. Limitare il volume di iniezione a 2 mL di CA anche per ratti più pesanti.
5. Allineamento degli animali e operazioni preliminari prima dell'imaging
- Dopo l'immobilizzazione dell'animale sul letto di imaging, creare un nuovo studio sulla GUI del tomografo. Aggiungi un identificatore del nome dello studio nel modulo Nome studio e seleziona il flusso di lavoro di imaging precedentemente salvato dal menu a discesa.
- Selezionare la parte anatomica corretta con informazioni su animale/campione | Parte anatomica | Posizionamento cardiaco e animale in base alle informazioni su animali/campioni | Posizionamento | Supino/Prima la testa. Annotare il peso dell'animale in grammi per il modulo corrispondente: Informazioni su animali/campioni | Peso animale.
NOTA: Tutte le altre informazioni contenute in questa sezione sono facoltative, ma è utile fornire il più possibile le informazioni richieste per trovarle nell'intestazione DICOM delle immagini di ricostruzione, facilitando così la successiva interrogazione dei dati. - Selezionare il radionuclide nelle informazioni di scansione PET | F18 per [18 studi F]FDG e altri 18composti marcati F; modificare se vengono utilizzati altri traccianti (ad esempio, [13N]NH3). Scrivi anche il nome del tracciante nelle informazioni di scansione PET | Il modulo nome tracciante come questo nome verrà riportato nell'intestazione DICOM al termine della ricostruzione dell'immagine.
NOTA: Le informazioni sul tempo, l'attività e il volume di iniezione del tracciante sono obbligatorie, ma potrebbero essere fornite successivamente durante l'acquisizione della PET. - Nelle informazioni della scansione TC, scrivere tutte le informazioni disponibili relative all'agente di contrasto.
NOTA: Tutte queste informazioni sono facoltative ma potrebbero facilitare la successiva interrogazione dei dati, se fornita. - Premere Esegui scansione e attendere l'apertura di un'altra scheda della GUI, consentendo il posizionamento degli animali e la specifica di altre opzioni di scansione.
- Selezionare il tipo di calibrazione CT in Calibrazione CT | Utilizzare la calibrazione CT predefinita.
- Nella sezione Preparazione allo studio , selezionare ciascun protocollo di scansione dal menu a discesa e selezionare la casella di controllo Attendi conferma utente prima di eseguire la scansione .
NOTA: Questo passaggio è molto importante, in quanto metterà lo scanner in standby in attesa dell'input dell'utente prima di iniziare la fase di acquisizione corrispondente. Per la scansione PET, ciò consentirà la sincronizzazione dell'iniezione del tracciante e l'avvio effettivo della scansione PET; per la scansione CTAC, consentirà all'utente di chiudere il coperchio (schermatura) prima dell'emissione di raggi X durante la scansione TC (lo studio verrà automaticamente interrotto se il coperchio è aperto prima dell'inizio della scansione TC); per la scansione Cine-CT, questa pausa consentirà all'utente di avviare il protocollo di infusione CA e la scansione dei dati TC con il ritardo richiesto. - Per il posizionamento degli animali, accendere il modulo di controllo motore utilizzando l'interruttore nel riquadro sinistro della GUI.
NOTA: Questo accenderà i laser di centraggio sul letto degli animali e abiliterà i pulsanti di allineamento manuale del letto posizionati sul lato dello scanner. - Utilizzare i pulsanti di allineamento manuale del letto per spostare il petto dell'animale sui segni laser. Controllare attentamente sia l'allineamento longitudinale che verticale dell'animale.
- Una volta che l'animale è posto nella posizione corretta in base al laser di centraggio, premere Spegni il laser per salvare la posizione corrente marcata al laser, che deve essere spostata al centro degli scanner PET e CT durante le fasi di acquisizione corrispondenti. Successivamente, spegnere il modulo di controllo del motore.
6. Scansione PET
- Premere Start acquisition per spostare l'animale sul FOV dello scanner PET. La coda e la cannula rimarranno all'esterno del FOV per consentire l'iniezione del tracciante. Lo scanner rimarrà inattivo finché l'utente non preme il pulsante Continua .
- Preparare la siringa con la dose calibrata del tracciante PET.
- Avviare l'acquisizione premendo il pulsante Continue e iniziare a iniettare il tracciante nella cannula entro 5 secondi dall'inizio della scansione (Figura 1).
NOTA: La durata dell'iniezione sarà ~20-25 s. - Inserire la siringa nel calibratore della dose in PET per misurare l'attività residua nella siringa. Annotare l'attività effettiva e il tempo di misurazione.
- Nella scheda Monitor hardware della GUI dello scanner, utilizzare il pulsante Aggiorna informazioni tracciatore PET per inserire il tempo, l'attività e il volume effettivamente iniettati.
- Durante la scansione, controllare periodicamente i parametri fisiologici dell'animale.
- Durante la scansione, misurare la glicemia come spiegato nel passaggio 2.2 nei seguenti punti temporali: 5 min, 20 min, 40 min e 60 min dopo l'inizio della scansione PET.
- Dopo la misurazione della glicemia, inserire la striscia reattiva nel contatore gamma ed eseguire la misurazione dell'attività per 60 s. Registrare il momento effettivo in cui è stata eseguita la misurazione dell'attività e correggere il decadimento radioattivo, prendendo il tempo di iniezione del tracciante come tempo di riferimento. Convertire i valori di attività registrati in concentrazione di attività (Bq / ml) considerando un volume medio di sangue di 1 μL nella striscia reattiva del glucosio (cioè, usando l'equazione [1]):
Sangue C (t) = Asangue (t) / 0,001 ml [Bq / mL] (1)
dove A sangue(t) è l'attività misurata corretta per il decadimento del campione disangue nella striscia reattiva, espressa in Bq.
NOTA: L'avvio della scansione PET e l'iniezione del tracciante possono essere eseguiti dallo stesso operatore utilizzando il dispositivo di controllo mobile del tomografo posto sul tavolo laterale dello scanner vicino al sito dell'operatore durante l'iniezione. Sono consentiti ritardi più lunghi tra l'inizio della scansione e l'inizio dell'iniezione, ma alcuni fotogrammi ricostruiti all'inizio della sequenza dinamica rimarranno vuoti. Si raccomanda di evitare ritardi superiori a 10 s (ad esempio, portando a due frame vuoti con il protocollo corrente).

Figura 1: Iniezione del tracciante PET. Questa operazione viene eseguita subito dopo l'avvio della scansione PET. L'animale si trova all'interno del campo visivo del PET (testa in giù, con la coda visibile sul lato dell'operatore). Abbreviazione: PET = tomografia ad emissione di positroni. Fare clic qui per visualizzare una versione ingrandita di questa figura.
7. Scansioni TC
- Prima di iniettare il mezzo di contrasto CT, avviare la scansione CTAC subito dopo aver chiuso il coperchio dello scanner e aver premuto il pulsante Continua sulla GUI. Al termine di questa brevissima acquisizione, utilizzare le seguenti procedure per garantire il corretto potenziamento del pool sanguigno iniettando il CA prima dell'acquisizione utilizzando lo stesso accesso vascolare impiegato per l'iniezione del tracciante PET.
- Emulsione lipidica iodata CA:
- Dopo il completamento della scansione CTAC, iniettare l'emulsione lipidica iodata CA utilizzando la cannula già collegata alla vena della coda del topo. La durata tipica dell'iniezione è nell'ordine di 30-60 s.
- Iniziare l'imaging subito dopo il completamento dell'iniezione. Premere Continua sulla GUI dello scanner per avviare l'acquisizione Cine-CT.
- Pompa iomeprolo/siringa:
- Se viene utilizzata una CA a raggi X normale, come iomeprolo, utilizzare una pompa a siringa che consenta un'iniezione lenta a velocità costante.
- Per i topi, impostare la velocità di iniezione del CA su 10 mL/h (~ 0,17 mL/ min) limitando il volume di iniezione a 0,5 mL. Con questa impostazione, interrompere l'iniezione dopo ~3 minuti. Per i ratti, impostare la pompa su una velocità di 24 ml/h (= 0,4 ml/ min) e limitare il volume di iniezione a 2 ml. Con questa impostazione, interrompere l'iniezione dopo 5 minuti.
- Collegare l'ago collegato al tubo CA alla cannula della vena caudale, assicurandosi che sia il tubo che l'ago siano preriempiti con CA.
- Iniziare l'iniezione. Chiudere il coperchio dello scanner e prepararsi per la scansione Cine-CT.
- Premere il pulsante Continua sulla GUI del tomografo dopo 60 s dall'inizio dell'iniezione per i topi e dopo 90 s dall'inizio dell'iniezione per i ratti, in modo che venga avviata l'acquisizione Cine-CT. L'iniezione di CA si interromperà all'incirca contemporaneamente al completamento della scansione Cine-CT per i topi e al completamento per i ratti.
- Emulsione lipidica iodata CA:
- Al termine della scansione Cine-CT, scollegare l'animale dal sistema di monitoraggio fisiologico e rimuovere la cannula della vena caudale. A seconda del protocollo effettivo, gli animali vengono recuperati o eutanizzati dopo la procedura di imaging descritta. Nel primo caso, gli animali vengono svegliati nelle loro gabbie in un ambiente caldo sotto una lampada a infrarossi. Vengono monitorati fino al completo risveglio, impiegando 15/30 minuti dopo l'anestesia gassosa. In caso di protocolli che richiedono, ad esempio, la raccolta di tessuti al termine della procedura di imaging, gli animali vengono eutanizzati mediante sovradosaggio di anestetico in camera di induzione (isoflurano al 5%), come da Allegato VI del D.Lgs. 26/2014.
NOTA: Nel caso di 18radionuclidi a base F come discusso in questo protocollo, 24 ore dopo l'iniezione del tracciante sono sufficienti per raggiungere un livello di radioattività residua sul corpo dell'animale che è sicuro per tutti gli scopi pratici.
8. Ricostruzione delle immagini 4DCT cardiache mediante gating cardiorespiratorio intrinseco
NOTA: Al termine dello studio di imaging, viene eseguita automaticamente la ricostruzione standard di PET e TC. Tuttavia, la ricostruzione della sequenza cardio CT 4D (Cine) deve essere eseguita manualmente e richiede una certa interazione da parte dell'utente. Questo particolare tipo di ricostruzione, obbligatoria per la successiva analisi TC cardiaca morfo-funzionale, è discussa in questa sezione.
- Aprire il modulo di gating cardiaco della GUI del tomogenh e selezionare lo studio di imaging da analizzare.
- Selezionare una regione di interesse (ROI) sulle radiografie dell'animale visualizzato (Figura 2) per costruire una curva di movimento cardiaco dipendente dal tempo, che rappresenta il segnale di gating: il cimogramma. Spostare verticalmente il ROI rettangolare predisegnato in modo tale da selezionare sia l'apice cardiaco che il diaframma. Quindi, selezionare Analisi del segnale di gating. L'interfaccia utente mostrerà ora il segnale di gating sia nel dominio del tempo che nel dominio della frequenza.
- Nel primo grafico nel dominio della frequenza, selezionare la banda di frequenza respiratoria evidenziando il primo gruppo di picchi dello spettro di frequenza (fare riferimento alla Figura 3 per uno spettro di esempio).
- Nel secondo grafico nel dominio della frequenza, selezionare la banda di frequenza del movimento cardiaco, evidenziando il secondo picco più nitido.
- Nella fase successiva, osservare il segnale di gating nel dominio del tempo con marcatori di colore (punti) sovrapposti, che mostrano i picchi respiratori identificati e i picchi di contrazione cardiaca. Se le posizioni dei marcatori si adattano bene ai picchi respiratori e cardiaci del segnale di gating originale, procedere alla fase successiva. Altrimenti:
- Se la forma del segnale di gating è troppo diversa da quella visualizzata nella Figura 3, tornare al passaggio 8.2 e selezionare un altro ROI.
- Se la forma del segnale di gating è ragionevolmente simile a quella mostrata nella Figura 3, tornare al passaggio 8.3 e al passaggio 8.4 e selezionare bande di frequenza diverse sullo spettro del segnale di gating.
- Nella fase successiva, selezionare un minimo di quattro porte cardiache.
NOTA: La tipica ricostruzione Cine-CT consiste in 8-12 porte cardiache. - Selezionare la finestra respiratoria corretta utilizzando il menu a discesa: Finestra respiratoria | 20%-80%.
NOTA: Questo manterrà il 60% dei dati acquisiti nella ricostruzione, escludendo la fase di picco di inspirazione e, quindi, migliorando la nitidezza delle pareti miocardiche ricostruite in ogni fase cardiaca. - Eseguire la ricostruzione per convertire le immagini Cine-CT retrospettivamente gate in formato DICOM, pronte per essere importate nel software per la successiva analisi funzionale.
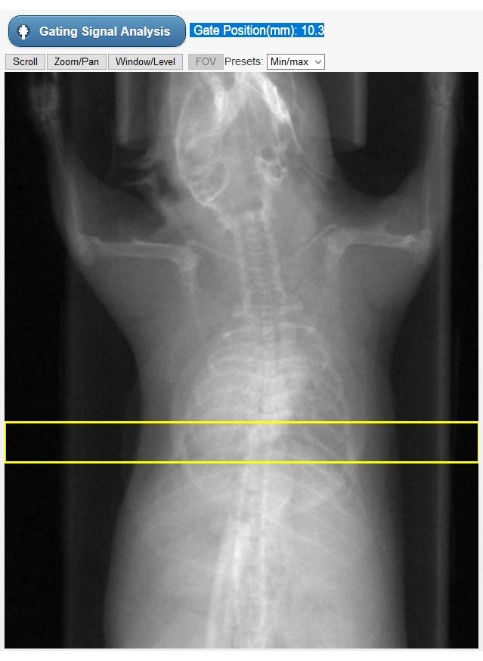
Figura 2: Strumento di selezione del ROI per il gating intrinseco. Questa immagine viene mostrata nella GUI del tomografo durante la fase di ricostruzione Cine-CT. L'utente deve selezionare la posizione del ROI (rettangolo giallo) su cui si ottiene il segnale di gating intrinseco (cimogramma) dalle proiezioni TC grezze. L'oggetto di forma circolare sovrapposto al torace animale è il cuscino respiratorio utilizzato solo per il monitoraggio fisiologico durante lo studio. Abbreviazioni: ROI = regione di interesse; CT = tomografia computerizzata; GUI = interfaccia utente grafica. Fare clic qui per visualizzare una versione ingrandita di questa figura.
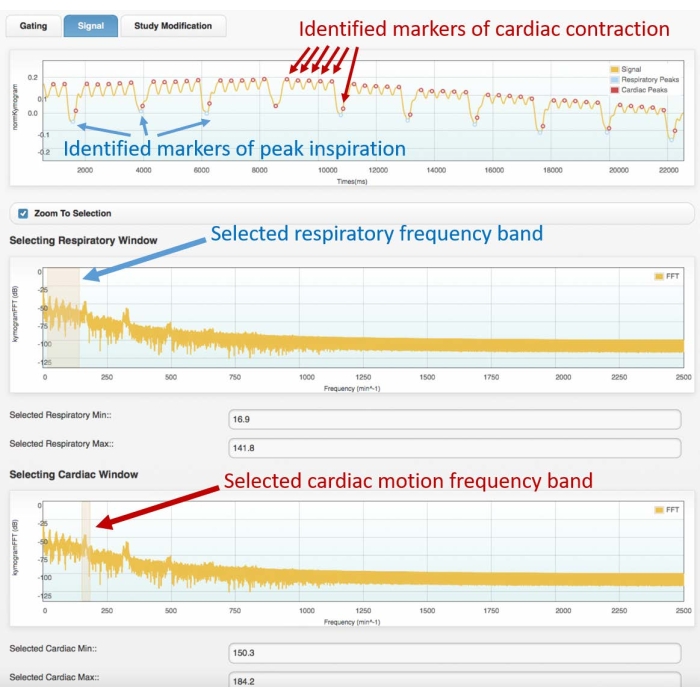
Figura 3: Esempio di segnale di gating (frame superiore) e spettro di frequenza corrispondente (centro e fondo). Immagini ottenute con il modulo di gating cardiaco del software Atrium. L'utente deve selezionare le bande di frequenza appropriate sia per il movimento respiratorio (frame centrale) che cardiaco (frame inferiore). Ciò consentirà l'identificazione dei marcatori respiratori e cardiaci sul segnale di gating, che dovrà essere controllato dall'utente prima di procedere con la ricostruzione 4D. Una cattiva identificazione dei picchi o un'assegnazione errata (ad esempio, da respiratorio a cardiaco o viceversa) porteranno a una ricostruzione errata. I dati mostrati sono stati ottenuti dall'analisi di una scansione Cine-CT 4D di un ratto Wistar maschio adulto sano (507 g) iniettato con 2 ml di iomeprolo, 200 mg / ml, alla velocità di 0,4 ml / min per 5 minuti (il grafico in alto è ingrandito sui primi 22 s di acquisizione per consentire una migliore visualizzazione del movimento cardiaco e respiratorio identificato). Abbreviazione: CT = tomografia computerizzata. Fare clic qui per visualizzare una versione ingrandita di questa figura.
9. Analisi cardiaca PET
NOTA: Questa sezione mostra come eseguire un'analisi cinetica dei dati dinamici [18F]FDG del ventricolo sinistro del piccolo animale. L'analisi si basa sul software Carimas. Le istruzioni riportate di seguito non intendono sostituire il manuale utente del software17. La procedura presentata qui di seguito si basa sull'analisi grafica Patlak dei dati dinamici PET18. Fare riferimento alla sezione Discussione per i dettagli relativi a questa analisi.
- Aprire le immagini DICOM della scansione PET dinamica.
- Selezionare il modulo HeartPlugin .
- Ingrandisci l'immagine sul cuore del topo / ratto e seleziona l'ultimo intervallo di tempo (o equivalentemente, la somma degli ultimi tre-cinque intervalli di tempo) per il quale la maggior parte dell'attività del pool di sangue è già stata cancellata.
- Seguire le istruzioni visualizzate sullo schermo per riorientare l'immagine lungo l'asse principale del cuore dell'animale (asse corto, verticale e orizzontale lungo). Esegui questa operazione in modo interattivo spostando i marcatori visualizzati per la base cardiaca e l'apice (Figura 4).
- Seleziona lo strumento Segmentazione .
NOTA: per impostazione predefinita, la segmentazione automatica è abilitata, che produce risultati affidabili nella maggior parte dei casi. - Se il risultato della segmentazione automatica non è accettabile, perfezionare la forma del miocardio segmentato e/o della cavità BT abilitando la modalità manuale (ricerca ROI disabilitata).
- Nello strumento di modellazione , selezionare il modello cinetico appropriato da utilizzare per l'analisi dinamica della PET. In questo caso, selezionare Grafico | Patlak per consentire l'analisi del diagramma di Patlak per il calcolo del tasso metabolico di assorbimento del glucosio (MRGlu) per ciascun settore cardiaco.
- Nello strumento mappa polare , selezionare il numero corretto di segmenti cardiaci visualizzati. In questo caso, selezionare 17 segmenti.
- Ora, premere il pulsante Fit per eseguire la procedura di fitting dell'analisi Patlak.
- Al termine della procedura di adattamento, osservare la mappa polare visualizzata dei valori Ki (cioè la pendenza della regressione lineare espressa in mL/[mL × min]).
- Utilizzando i valori Ki per ciascun settore mostrato in una tabella, calcolare la MRGlu utilizzando l'equazione (2):
MR Glu = (Ki × PGlu)/LC (2)
dove PGlu è un valore derivato dal campione di sangue della concentrazione plasmatica di glucosio (mmol / L) e la costante concentrata (LC) è un coefficiente empirico utilizzato per compensare la differenza di assorbimento tra glucosio normale e FDG. Vedi, ad esempio, Ng et al.22 per i valori tipici della costante concentrata in varie condizioni sperimentali.
NOTA: Prima di iniziare l'analisi PET, è buona norma ispezionare visivamente la sequenza dinamica dei volumi PET all'interno dello strumento software di analisi PET. Ciò è necessario per escludere il movimento macroscopico degli animali tra i tempi durante lo studio. Se è presente un movimento, la corretta registrazione dell'immagine (al di fuori dell'ambito di questo protocollo) deve essere effettuata prima dell'analisi, se possibile.
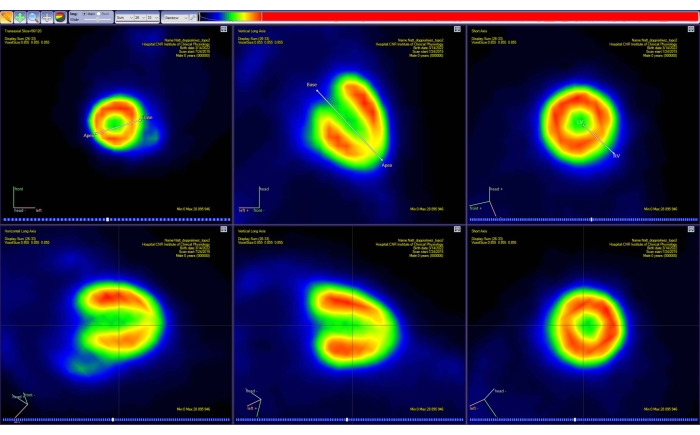
Figura 4: Strumento di riorientamento del software di analisi PET. La proiezione di due semplici segmenti di linea nello spazio 3D viene mostrata su ciascuno dei tre piani standard (transassiale, coronale e sagittale). Il primo segmento consente all'utente di selezionare la base cardiaca e l'apice, mentre il secondo consente di selezionare i lati sinistro e destro del cuore. Questo passaggio si traduce in una nuova immagine PET (interpolata) (riga inferiore), con il cuore riorientato lungo la rappresentazione AHA standard. Le immagini sono state ottenute con Carimas da un topo CD-1 maschio adulto sano del peso di 51 g e iniettato con 10 MBq di [18F]FDG. Abbreviazioni: PET = tomografia ad emissione di positroni; AHA = American Heart Association; FDG = fluorodesossiglucosio. Fare clic qui per visualizzare una versione ingrandita di questa figura.
10. Analisi cardiaca Cine-CT
NOTA: questa sezione mostra come eseguire un'analisi quantitativa dell'immagine cardiaca Cine-CT per raccogliere dati quantitativi globali della funzione cardiaca. L'analisi si basa sul software Osirix MD. Le istruzioni riportate di seguito non intendono sostituire il manuale utente di Osirix24.
- Caricare le immagini DICOM della scansione Cine-CT nel software.
- Aprire il set di dati dinamico con il visualizzatore 4D incorporato.
- Utilizzando lo strumento Riforma multiplanare 3D (MPR), riorientare i dati dell'immagine lungo l'asse corto (Figura 5).
- Esportare i dati riorientati in DICOM, assicurandosi che tutti i dati 4D vengano esportati, con spessore della sezione conservato (uguale all'originale) e profondità di bit dell'immagine (16 bit per voxel)
- Aprire le immagini MPR 4D esportate utilizzando il visualizzatore 4D.
- Selezionare un intervallo di tempo corrispondente alla diastole finale. Sfoglia tutti gli intervalli di tempo con il cursore temporale sulla barra degli strumenti principale per assicurarti che sia selezionata la fase cardiaca corretta.
- In questo lasso di tempo, selezionare lo strumento di annotazione poligonale chiuso e delineare manualmente la parete endocardica del ventricolo sinistro.
- Fai lo stesso per 10-20 fette dalla base all'apice, assicurandoti che tutti i ROI abbiano lo stesso nome (ad esempio, LVENDO).
- Nel menu ROI , selezionare ROI Volume | Genera ROI mancanti per generare i ROI su tutte le sezioni dell'asse corto mediante interpolazione dei ROI disegnati manualmente.
- Nel menu ROI , selezionare ROI Volume | Calcola volume per calcolare il volume del gruppo ROI con lo stesso nome ROI.
- Sfogliare gli intervalli di tempo e selezionare una fase corrispondente alla sistole finale (volume LV più piccolo) e ripetere i passaggi 10.7-10.10 precedenti.
- Calcolare il volume della corsa (SV) e la frazione di eiezione utilizzando le equazioni (3) e (4):
SV = EDV - ESV[mL] (3)
EF = 100 × SV/EDV [%] (4)
dove EDV è il volume diastolico finale e ESV è il volume sistolico finale.
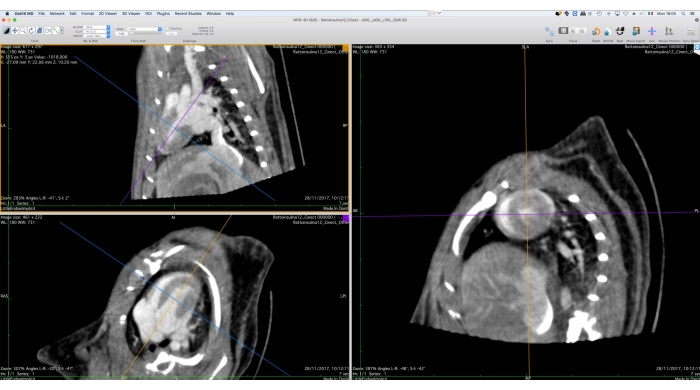
Figura 5: Interfaccia grafica dello strumento di riforma multiplanare. Questo strumento viene utilizzato per il riorientamento dei dati Cine-CT per la successiva analisi funzionale. L'utente deve ruotare e traslare gli assi di riferimento sul lato sinistro dello schermo in modo tale che la vista dell'asse corto del cuore sia visualizzata sulla destra. Al termine di questa procedura, l'utente può esportare le immagini riorientate come set di file DICOM. Le immagini sono state ottenute con Osirix MD e si riferiscono a un ratto Wistar maschio adulto sano (507 g) iniettato con 2 ml di iomeprolo, 200 mg/ml, ad una velocità di 0,4 ml/min per 5 minuti, ricostruito con Filtered BackProjection con una dimensione del voxel di 0,24 mm3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Access restricted. Please log in or start a trial to view this content.
Risultati
In questa sezione, i risultati tipici sono mostrati sia per l'analisi PET che TC seguendo le procedure descritte finora. La Figura 6 mostra i risultati della segmentazione automatica della cavità miocardica e LV della scansione PET [18F]FDG di un topo CD-1 di controllo (sano). Anche se il ventricolo destro non è sempre visibile nelle immagini ricostruite, gli assi di orientamento basati sull'intestazione DICOM possono essere utilizzati per discriminare correttamente il setto int...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il protocollo presentato in questo articolo si concentra su una tipica procedura sperimentale per la ricerca cardiovascolare traslazionale su piccoli modelli animali di danno cardiaco utilizzando l'imaging PET / TC ad alta risoluzione. I risultati presentati sono indicativi dell'alto valore quantitativo e qualitativo delle immagini PET e Cine-CT, fornendo informazioni sia funzionali che strutturali di tutto il cuore per quanto riguarda il suo metabolismo del glucosio, la forma e la dinamica della sua contrazione. Inoltre...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Daniele Panetta ha ricevuto sovvenzioni per la ricerca e sviluppo di strumentazione micro-CT da Inviscan Sas.
Riconoscimenti
Questa ricerca è stata supportata in parte dal Progetto JPI-HDHL-INTIMIC "GUTMOM": Maternal obesity and cognitive dysfunction in the offspring: Causa-effect role of the GUT MicrobiOMe and early dietary prevention (progetto n. INTIMIC-085, Decreto del Ministero dell'Istruzione, dell'Università e della Ricerca n. 946/2019).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
Riferimenti
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841(2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362(2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82(2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31(2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053(2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89(2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206(2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7(2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- Carimas User Manual. , Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022).
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , San Francisco, CA. (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591(2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532(2014).
- Kim, D. -Y., Cho, S. -G., Bom, H. -S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine. , Available from: https://www.medilumine.com/technical-resources (2019).
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783(2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. Grupen, C., Buvat, I. , Springer. Berlin, Heidelberg. 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603(2016).
- Lee, C. -L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. Kuntner-Hannes, C., Haemisch, Y. , Springer. Cham, Switzerland. 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003(2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon