A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
טומוגרפיה של פליטת פוזיטרונים לבביים ברזולוציה גבוהה/טומוגרפיה ממוחשבת לבעלי חיים קטנים
In This Article
Summary
כאן אנו מציגים פרוטוקול הדמיה ניסיוני לכימות תפקוד הלב והמורפולוגיה באמצעות טומוגרפיה של פליטת פוזיטרונים ברזולוציה גבוהה/טומוגרפיה ממוחשבת לבעלי חיים קטנים. גם עכברים וגם חולדות נחשבים, דנים בדרישות השונות של חומרי ניגוד טומוגרפיה ממוחשבת עבור שני המינים.
Abstract
טומוגרפיה של פליטת פוזיטרונים (PET) וטומוגרפיה ממוחשבת (CT) הן בין טכניקות ההדמיה האבחנתיות הנפוצות ביותר, ושתיהן משמשות להבנת תפקוד הלב וחילוף החומרים. במחקר פרה-קליני נעשה שימוש בסורקים ייעודיים בעלי רגישות גבוהה ורזולוציה מרחבית-טמפורלית גבוהה, שנועדו להתמודד עם הדרישות הטכנולוגיות התובעניות שמציבים גודל הלב הקטן וקצב הלב הגבוה מאוד של עכברים וחולדות. במאמר זה מתואר פרוטוקול הדמיית PET/CT לבבי בימודאלי עבור מודלים ניסיוניים של עכברים ו/או חולדות של מחלות לב, החל מהכנת בעלי חיים ורכישת תמונה ושחזורה וכלה בעיבוד תמונה והדמיה.
בפרט, סריקת 18 פלואורודאוקסיגלוקוז ([18F]FDG)-PET עם תווית F מאפשרת מדידה והדמיה של חילוף החומרים של הגלוקוז במקטעים השונים של החדר השמאלי (LV). מפות Polar הן כלים נוחים להצגת מידע זה. חלק ה-CT מורכב משחזור תלת-ממדי של הלב כולו (4D-CT) באמצעות גטינג רטרוספקטיבי ללא מוליכי אלקטרוקרדיוגרפיה (ECG), מה שמאפשר הערכה מורפופונקציונלית של ה-LV וכימות לאחר מכן של הפרמטרים החשובים ביותר של תפקוד הלב, כגון שבר פליטה (EF) ונפח שבץ (SV). באמצעות סורק PET/CT משולב, פרוטוקול זה יכול להתבצע באותה אינדוקציה של הרדמה ללא צורך במיקום מחדש של החיה בין סורקים שונים. לפיכך, ניתן לראות ב-PET/CT כלי מקיף להערכה מורפופונקציונלית ומטבולית של הלב במספר מודלים של בעלי חיים קטנים של מחלות לב.
Introduction
מודלים של בעלי חיים קטנים חשובים ביותר לקידום ההבנה של מחלות לב וכלי דם 1,2. כלי הדמיה אבחוניים לא פולשניים חוללו מהפכה באופן שבו אנו מסתכלים על תפקוד הלב בעשורים האחרונים, הן במסגרות קליניות והן במסגרות פרה-קליניות. בכל הנוגע למודלים של בעלי חיים קטנים של מחלות לב, פותחו כלי הדמיה ספציפיים ברזולוציה מרחבית גבוהה מאוד. לפיכך, מכשירים כאלה יכולים להתאים לצורך בכימות מדויק של הפרמטרים המטבוליים והקינטיים הרלוונטיים על לבבות קטנים מאוד ומהירים מאוד של עכברים וחולדות במודלים ספציפיים של מחלות, כגון אי ספיקת לב (HF)3 או אוטם שריר הלב (MI)4. מספר אופנים זמינים למטרה זו, כל אחד עם נקודות החוזק והחולשה שלו. הדמיית אולטרסאונד (ארה"ב) היא השיטה הנפוצה ביותר בשל גמישותה הרבה, רזולוציה טמפורלית גבוהה מאוד ועלות נמוכה יחסית. אימוץ הדמיית הלב בארה"ב בבעלי חיים קטנים גדל במידה ניכרת מאז הופעתן של מערכות המשתמשות בגששים בתדר גבוה במיוחד 5,6, הכוללות רזולוציות מרחביות מתחת ל-50 מיקרומטר.
בין החסרונות העיקריים של US להדמיית לב תלת-ממדית מלאה הוא הצורך בסריקות ליניאריות לאורך ציר הלב על ידי הרכבת הגשושית על שלב תרגום ממונע כדי ליצור ערימה מלאה של תמונות דינמיות במצב B של כל הלב7. בסופו של דבר, הליך זה יוצר (לאחר רישום מרחבי וזמני מדויק של התמונות הנרכשות בכל מיקום בדיקה) תמונה 4D עם רזולוציות מרחביות שונות בין הכיוונים במישור ומחוץ למישור. אותה בעיה של רזולוציה מרחבית לא אחידה מתרחשת ב-MR לבבי (CMR),8 שעדיין מייצג את תקן הזהב בהדמיה התפקודית של הלב. ניתן להשיג במקום זאת הדמיה תלת-ממדית איזוטרופית אמיתית באמצעות טומוגרפיה ממוחשבת (CT) וטומוגרפיה של פליטת פוזיטרונים (PET)9. PET מספק כלי רגיש מאוד מבחינת אות תמונה לכל כמות של גשושית מוזרקת (בתחום הננומולר), למרות שהוא סובל מרזולוציה מרחבית מופחתת בהשוואה ל-CT, MR או US. היתרון העיקרי של PET הוא יכולתו להציג את המנגנונים התאיים והמולקולריים העומדים בבסיס הפתופיזיולוגיה של האיבר. לדוגמה, סריקת PET לאחר הזרקה של [18F]FDG מאפשרת שחזור של מפה תלת-ממדית של חילוף החומרים של הגלוקוז בגוף. על ידי שילוב זה עם רכישת נתונים דינמית (כלומר, נפתרה בזמן), ניתן להשתמש במידול קינטי עוקב כדי לחשב מפות פרמטריות של קצבי חילוף החומרים של ספיגת גלוקוז (MRGlu), אשר יספקו מידע חשוב על כדאיות שריר הלב10.
CT דורש כמויות משמעותיות של חומרי ניגוד חיצוניים (CA) בריכוזים גבוהים (עד 400 מ"ג יוד למ"ל) כדי לספק שיפור מדיד של מרכיבי הרקמה הרלוונטיים (למשל, דם לעומת שריר), אך הוא מצטיין ברזולוציה מרחבית וטמפורלית, במיוחד בעת שימוש בסורקי מיקרו-CT משוכללים המיועדים להדמיית בעלי חיים קטנים. 11 מודל מחלה טיפוסי שבו ניתן ליישם את ה-PET/CT הלבבי הוא הערכה ניסיונית של אוטם שריר הלב ואי ספיקת לב ותגובה קשורה לטיפול. דרך נפוצה לגרום MI בבעלי חיים קטנים היא על ידי קשירה כירורגית של העורק הכלילי הקדמי השמאלי (LAD)12,13 ולאחר מכן הערכה אורכית של התקדמות המחלה ושיפוץ הלב בימים שלאחרמכן 4. עם זאת, ההערכה המורפופונקציונלית הכמותית של הלב בבעלי חיים קטנים ישימה במידה רבה גם עבור מודלים אחרים של מחלות, כגון הערכת השפעת ההזדקנות על תפקוד הלב14 או ביטוי קולטן שונה במודלים של השמנת יתר15. פרוטוקול ההדמיה המוצג אינו מוגבל לכל מודל מחלה נתון, ולכן יכול להיות בעל העניין הרחב ביותר במספר הקשרים של מחקר פרה-קליני עם מכרסמים קטנים.
במאמר זה אנו מציגים פרוטוקול ניסיוני מתחילתו ועד סופו להדמיית לב באמצעות PET/CT משולב בבעלי חיים קטנים. למרות שהפרוטוקול המוצג מיועד לסורק משולב בימודאלי ספציפי, ניתן לבצע את חלקי ה- PET וה- CT של ההליך המתואר באופן עצמאי בסורקים נפרדים מיצרנים שונים. בסורק PET/CT שבשימוש, רצף הפעולות מאורגן בזרימת עבודה מתוכנתת מראש. הענפים העיקריים של כל זרימת עבודה הם פרוטוקול רכישה אחד או יותר; לכל פרוטוקול רכישה יכול להיות ענף אחד או יותר עבור פרוטוקולי עיבוד מקדים ספציפיים, ובתורו, לכל פרוטוקול קדם-עיבוד יכול להיות ענף אחד או יותר עבור פרוטוקולי שחזור ספציפיים. מתוארים הן הכנת בעל החיים על מיטת ההדמיה והן הכנת החומרים החיצוניים שיוזרקו במהלך הליכי ההדמיה. לאחר השלמת הליך רכישת התמונה, ניתנים הליכים לדוגמה לניתוח תמונה כמותי המבוסס על כלי תוכנה נפוצים. הפרוטוקול הראשי תוכנן במיוחד עבור דגמי עכברים; אף על פי שהעכבר נותר המין הנפוץ ביותר בתחום זה, אנו מראים גם התאמה של הפרוטוקול להדמיית חולדות בסוף הפרוטוקול הראשי. תוצאות מייצגות מוצגות הן עבור עכברים והן עבור חולדות, ומדגימות את סוג הפלט שניתן לצפות עם ההליכים המתוארים. בסוף מאמר זה נערך דיון מעמיק כדי להדגיש את היתרונות והחסרונות של הטכניקה, נקודות קריטיות, כמו גם כיצד ניתן להשתמש ברדיו-טראקרים שונים של PET כמעט ללא שינוי בשלבי ההכנה והרכישה/שחזור.
Protocol
ניסויים בבעלי חיים בוצעו בהתאם להמלצות במדריך לטיפול ושימוש בחיות מעבדה של ההנחיות הבינלאומיות לטיפול בחיות מעבדה, הנדרשות על ידי הדירקטיבה האירופית (הנחיה 86/609/EEC משנת 1986 ודירקטיבה 2010/63/UE) והחוקים האיטלקיים (D.Lgs. 26/2014).
1. הגדרת פרוטוקולי הדמיה PET/CT וזרימת עבודה
הערה: הפרוטוקול המוצג כאן תוכנן במיוחד להדמיית לב של דגמי עכברים. עבודה עם חולדות עשויה לרמוז על שינויים מסוימים בפרוטוקול עצמו, בעיקר בגלל הגודל הגדול יותר של החיה (בערך פי 10 יותר כבד). השינויים להדמיית חולדות מוזכרים במפורש בשלבים; אם לא מוזכרים שינויים, ניתן להשתמש באותם שלבים להדמיית עכבר עבור חולדות.
- פתח את ממשק המשתמש הגרפי (GUI) של סורק PET/CT (ראה טבלת חומרים) וליצור קבוצה של פרוטוקולים חדשים (כולל פרמטרים לרכישת נתונים, עיבוד מקדים ושחזור תמונה): (i) a סריקת PET דינמית, (2) א סריקת CT במינון נמוך לתיקון הנחתה (CTAC) ללא חומר ניגוד, ו-(3) א סריקת Cine-CT משופרת לניגודיות.
הערה: יצירת פרוטוקולים חדשים (כלומר, הוראות תוכנה ספציפיות עבור הטומוגרף) לשלבי הרכישה, העיבוד המקדים והשחזור היא תהליך פשוט; במקרה של בעיות, המשתמש יכול למצוא מידע מפורט יותר במדריך למשתמש של GUI.- עבור סריקת PET, פתח את הכרטיסיה פרוטוקול של הסורק (GUI) וצור שלושה פרוטוקולים חדשים ( לרכישה, עיבוד מקדים ושחזור) עם הפרמטרים הבאים:
- עבור פרוטוקול הרכישה: הגדר זמן סריקה כולל של 3,600 שניות ומיקום מיטת יחיד. שמור פרוטוקול זה בשם מתאים לייבוא הבא לזרימת העבודה. בצע את אותו הדבר גם עבור כל הפרוטוקולים הבאים בנקודות הבאות.
- עבור פרוטוקול עיבוד מקדים לעכבר: בחר חלון אנרגיה של 250-750 keV (EW) והפעל את התיקונים הבאים: דעיכה רדיואקטיבית, צירופי מקרים אקראיים וזמן מת. הגדר את פרוטוקול המסגור (כלומר, פיצול דינמי של הנתונים הגולמיים) כדלקמן: 8 x 5 שניות, 8 x 10 שניות, 3 x 40 שניות, 2 x 60 שניות, 2 x 120 שניות, 10 x 300 שניות (= 3,600 שניות). עבור חולדה, בחר חלון אנרגיה של 350-750 keV (EW), תוך שימוש באותו מסגור כמו עבור פרוטוקול העכבר.
- עבור פרוטוקול השחזור: בחר את האלגוריתם האיכותי המבוסס על מונטה קרלו למקסום ציפיות תת-קבוצה (3D-OSEM-MC), עם 8 תת-קבוצות ו-8 איטרציות, עם נורמליזציה, תיקון כמותי ותיקון הנחתת CT מופעלים.
- עבור סריקת CT במינון נמוך לתיקון הנחתה (CTAC), השתמש בפרמטרים הבאים:
- עבור פרוטוקול הרכישה : מסגרת אחת, מיקום מיטת יחיד, סריקה מלאה; הגדרות צינור: 80 kV, זרם נמוך (מינון נמוך); 576 תצוגות מעל 360°, עם זמן חשיפה של 34 אלפיות השנייה לכל צפייה (זמן סריקה של 20 שניות); סוג סיבוב: רציף, מצב רגישות: רגישות גבוהה.
- עבור פרוטוקול עיבוד מקדים: גודל ווקסל 240 מיקרומטר, FOV רוחבי: חולדה, FOV צירי: 100%.
- עבור פרוטוקול השחזור : חלון מסנן: חלק, גודל ווקסל: סטנדרטי, הפעל הקשחת קרן ותיקון טבעת מראש, השבת את הטבעת לאחר התיקון.
- עבור סריקת CT מגודרת עם שיפור ניגודיות, צור שלושה פרוטוקולים חדשים (לרכישה, עיבוד מקדים ושחזור) עם ההגדרות הבאות:
- עבור פרוטוקול הרכישה עבור העכבר: להגדיר מסגרת אחת, מיקום מיטה אחת, סריקה מלאה; הגדרות צינור: 65 kV, זרם מלא (רעש נמוך); 8,000 צפיות מעל 360°, עם זמן חשיפה של 15 אלפיות השנייה לכל תצוגה (זמן סריקה של 120 שניות); סוג סיבוב: רציף, מצב רגישות: רגישות גבוהה. עבור חולדה, הגדר את הפרמטרים של פרוטוקול הרכישה באופן הבא: מתח צינור 80 kV, 16,000 צפיות מעל 360°, עם זמן חשיפה של 12 אלפיות השנייה לכל צפייה (זמן סריקה של 192 שניות).
- עבור פרוטוקול עיבוד מקדים לעכבר: בחר גודל ווקסל של 120 מיקרומטר; שדה ראייה רוחבי (FOV): עכבר; FOV צירי: 50%. עבור חולדה, בחר גודל ווקסל של 240 מיקרומטר; שדה ראייה רוחבי (FOV): חולדה; FOV צירי: 50%.
- עבור פרוטוקול השחזור : חלונות מסנן: חלק, גודל ווקסל: סטנדרטי; הפעל הקשחת קרן ותיקון טבעת מראש, השבת את הטבעת לאחר התיקון.
- פתח את הכרטיסיה זרימת עבודה בממשק המשתמש הגרפי (GUI) וצור זרימת עבודה חדשה, תוך הוספת הפרוטוקולים שנוצרו זה עתה: שלבים 1.1.1.1-1.1.1.3 עבור PET, שלבים 1.1.2.1. -1.1.2.3. עבור CTAC, ושלבים 1.1.3.1. -1.1.3.3. עבור CT מגודר, בסדר הנתון. בשני המקרים, ודא שהפרוטוקולים מקוננים לפי הסדר הבא: רכישה | עיבוד מקדים | שחזור.
הערה: מסגרות PET דינמיות עם משכי זמן <5 שניות כדי ללכוד טוב יותר את שיא פונקציית הקלט העורקי בתחילת סריקת PET אפשריות אך אינן מומלצות מכיוון שהדבר עלול להוביל לתמונות רועשות עם דיוק כמותי מופחת. בשלב 1.1.2.2, השתמשנו בגודל "חולדה" עבור FOV רוחבי. זה נפוץ גם לחולדות וגם לעכברים ב-CTAC.
- עבור סריקת PET, פתח את הכרטיסיה פרוטוקול של הסורק (GUI) וצור שלושה פרוטוקולים חדשים ( לרכישה, עיבוד מקדים ושחזור) עם הפרמטרים הבאים:
2. הכנת בעלי חיים להדמיית PET/CT
הערה: עבור הפרוטוקול הנוכחי, כל בעלי החיים היו בצום לילה.
- הרדימו את העכבר עם 3%-4% (v/v) איזופלוראן בתא אינדוקציה בתחילה, ולאחר מכן שמרו עם 1%-2% (v/v) איזופלוראן.
- שקול את העכבר ומדוד את הגליקמיה הבסיסית כדי לפקח על מצב החיה. כדי לקחת את דגימת הדם הנדרשת, השתמש במספריים חדים ובצע חתך קטן בקצה הזנב, ולאחר מכן עסה בעדינות את הזנב כדי לאסוף טיפת דם (~ 1 μL) ישירות על רצועת הבדיקה.
- המשך עם החדרת גישה ורידית ברמה של הווריד caudal באמצעות 29 G פרפר עבור עכבר ו 24 G עבור חולדה.
- כדי לבצע את טכניקת הקנולציה, השתמש בחימום בו זמנית (בדרך כלל, תחת מנורת חימום) וחיטוי של הנקודה שבה המחט מוחדרת להרחבת כלי הדם של הווריד. לאחר הצינור, לתקן את הפרפר עם סרט משי לזנב כדי לשמור אותו במקומו במהלך ההליך.
הערה: צום נדרש עבור [18F]FDG. מעקבים שונים עשויים לכלול הכנה שונה של בעלי חיים, אך דיון מעמיק בנושא זה הוא מחוץ לתחום הפרוטוקול הנוכחי. מבחינת [18F]FDG, הימנעות מצום מובילה לפיזור ביולוגי שונה מאודשל עוקבים 16.
- כדי לבצע את טכניקת הקנולציה, השתמש בחימום בו זמנית (בדרך כלל, תחת מנורת חימום) וחיטוי של הנקודה שבה המחט מוחדרת להרחבת כלי הדם של הווריד. לאחר הצינור, לתקן את הפרפר עם סרט משי לזנב כדי לשמור אותו במקומו במהלך ההליך.
- הפעל את מערכת ההרדמה (איזופלורן 1%-2%, 0.8 ליטר/דקה O 2 לעכבר ו-1-1.2 ליטר/דקה לחולדה) המחוברת לסורק PET-CT והעבר את העכבר למיטה.
- מניחים את העכבר במצב שכיבה, ראש ראשון, על מיטת הסורק של טומוגרף PET-CT, מכניסים את אפו למסכת האף להרדמה וחוסמים בעדינות את ראש העכבר למסכה עם סרט דבק.
- קבץ את הגפיים העליונות והתחתונות של העכבר על מיטת הסורק כדי למנוע תנועות לא רצוניות במהלך הליכי ההדמיה, מה שעלול להוביל לתוצרי תנועה.
- עקוב אחר טמפרטורת הגוף וקצב הנשימה באמצעות בדיקה רקטלית וכרית נשימה, בהתאמה.
3. הכנת מינון מעקב PET
- עבור עכברים, ציירו 10 MBq של [18F]FDG בנפח של 100-150 μL עם מזרק אינסולין (1 מ"ל). עבור חולדות, יש לשאוב מינון גבוה יותר של 15 MBq ב-0.20-0.25 מ"ל.
הערה: הימנע מפעילות גבוהה יותר מכיוון שסורק PET הנדון בפרוטוקול זה הוא בעל רגישות גבוהה מאוד ודורש רק כמות צנועה של פעילות כדי להשיג תמונות באיכות גבוהה. - אם הריכוז המקורי של העקיבה בבקבוקון גבוה מדי, השתמש בתמיסה פיזיולוגית (0.9% w/v NaCl) כדי לדלל את מינון העקיבה לריכוז של 50-100 MBq/mL.
- השתמש בכיול מינון PET כדי למדוד את הפעילות בפועל במזרק. הוסף הערות לפעילות קדם-ההזרקה ולזמן המדידה מכיוון שערכים אלה ישמשו מאוחר יותר באמצעות מודולי קלט ספציפיים של ממשק המשתמש הגרפי של סורק PET.
4. הכנת חומר ניגוד CT
- צייר 0.2 מ"ל לכל 20 גרם של משקל העכבר של חומר ניגוד תחליב שומנים יוד לתוך מזרק 1 מ"ל. הגבל את נפח ההזרקה ל-0.5 מ"ל של CA עבור עכברים כבדים יותר. אם אתם משתמשים ב-iomeprol, הגדירו את קצב ההזרקה לעכברים ל-10 מ"ל/שעה (~0.17 מ"ל/דקה) והגבילו את נפח ההזרקה ל-0.5 מ"ל.
- עבור חולדות, ציירו 2.3-3 מ"ל של יומפרול, מדולל לריכוז של 200 מ"ג/מ"ל, לתוך מזרק של 5 מ"ל.
הערה: אם תחליב שומנים של בעלי חיים קטנים CA אינו זמין, ניתן להשתמש ביומפרול עם הזרקה רציפה באמצעות משאבת מזרק, כפי שיפורט להלן. - חברו את המזרק למשאבת המזרק, וקבעו את המשאבה לגודל ולקוטר המזרק בפועל.
- חבר את המזרק לצינורות CA ולמחט, ומלא מראש את הצינורות ב- CA.
- הגדר את קצב ההזרקה ל-24 מ"ל/שעה (= 0.4 מ"ל/דקה), והגביל את ההזרקה לנפח מרבי של 2 מ"ל.
הערה: שימוש ב-CA של מאגר הדם על בסיס תחליב שומנים עם יוד אפשרי גם בחולדות, למרות העלות הגבוהה יחסית של הליך זה בשל הנפח הגדול יותר של זריקה בודדת. אם אפשרות זו מועדפת (למשל, כדי לפשט את הפרוטוקול על ידי הימנעות ממשאבת המזרק), ניתן להשתמש בהליך הבא:
- עבור חולדות, ציירו 2.3-3 מ"ל של יומפרול, מדולל לריכוז של 200 מ"ג/מ"ל, לתוך מזרק של 5 מ"ל.
- צייר 7.5 מ"ל לכל ק"ג של משקל גוף של חומר ניגוד תחליב שומנים יוד לתוך מזרק 5 מ"ל. הגבל את נפח ההזרקה ל -2 מ"ל של CA גם עבור חולדות כבדות יותר.
5. יישור בעלי חיים ופעולות מקדימות לפני ההדמיה
- עם אימוביליזציה של החיה על מיטת ההדמיה, צור מחקר חדש על הטומוגרף GUI. הוסף מזהה שם מחקר במודול שם המחקר ובחר את זרימת העבודה של ההדמיה שנשמרה בעבר מהתפריט הנפתח.
- בחר את החלק האנטומי המתאים עם מידע על בעלי חיים/דגימה | חלק אנטומי | מיקום הלב ובעלי החיים לפי מידע על בעלי חיים/דגימות | מיצוב | שכיבה / ראש ראשון. הוסף הערות למשקל החיה בגרמים עבור המודול המתאים: מידע על בעלי חיים/דגימה | משקל בעלי חיים.
הערה: כל המידע האחר בסעיף זה הוא אופציונלי, אך כדאי לספק כמה שיותר מהמידע המבוקש כדי למצוא אותו בכותרת DICOM של תמונות השחזור, ובכך להקל על שאילתת הנתונים הבאה. - בחר את הרדיונוקלידים במידע על סריקת PET | F18 עבור [18 מחקרי F]FDG ו-18תרכובות אחרות המסומנות ב-F; לשנות אם נעשה שימוש בעוקבים אחרים (לדוגמה, [13N]NH3). כתוב גם את שם העקיבה בפרטי סריקת PET | מודול שם מעקב כשם זה ידווח בכותרת DICOM עם השלמת שחזור התמונה.
הערה: המידע על זמן ההזרקה, הפעילות והנפח של ההזרקה הוא חובה, אך ניתן לספק אותו מאוחר יותר במהלך רכישת PET. - בפרטי סריקת ה- CT, כתוב את כל המידע הזמין לגבי חומר הניגוד.
הערה: כל המידע הזה הוא אופציונלי, אך הוא יכול להקל על שאילתת נתונים לאחר מכן, אם הוא מסופק. - לחץ על בצע סריקה והמתן לפתיחת כרטיסייה נוספת של ממשק המשתמש הגרפי, כדי לאפשר מיקום בעלי חיים ומפרט של אפשרויות סריקה אחרות.
- בחר סוג כיול CT בכיול CT | השתמש בכיול CT המוגדר כברירת מחדל.
- במקטע הכנה ללימוד , בחר כל פרוטוקול סריקה מהתפריט הנפתח, וסמן את תיבת הסימון המתן לאישור המשתמש לפני סריקה זו .
הערה: שלב זה חשוב מאוד, מכיוון שהוא יכניס את הסורק למצב המתנה לקלט המשתמש לפני תחילת שלב הרכישה המתאים. עבור סריקת PET, הדבר יאפשר את הסנכרון של הזרקת המעקב והתחלת סריקת PET בפועל; עבור סריקת CTAC, היא תאפשר למשתמש לסגור את המכסה (סיכוך) לפני פליטת קרני רנטגן במהלך סריקת ה- CT (המחקר יבוטל באופן אוטומטי אם המכסה פתוח לפני תחילת סריקת ה- CT); עבור סריקת Cine-CT, השהיה זו תאפשר למשתמש ליזום את פרוטוקול עירוי CA וסריקת נתוני CT עם ההשהיה הנדרשת. - למיקום בעלי חיים, הפעל את מודול בקרת המנוע באמצעות המתג בחלונית השמאלית של ממשק המשתמש הגרפי.
הערה: פעולה זו תפעיל את הלייזרים המרכוזיים על מיטת בעלי החיים ותפעיל את לחצני יישור המיטה הידניים הממוקמים בצד הסורק. - השתמש בכפתורי יישור המיטה הידניים כדי להזיז את החזה של החיה על סימני הלייזר. בדוק היטב הן את היישור האורכי והן את היישור האנכי של החיה.
- לאחר הצבת בעל החיים במיקום הנכון בהתאם ללייזר המרכוז, לחץ על כבה את הלייזר כדי לשמור את המיקום הנוכחי המסומן בלייזר, אשר יועבר למרכז סורקי PET ו- CT במהלך שלבי הרכישה המתאימים. לאחר מכן, כבה את מודול בקרת המנוע.
6. סריקת PET
- לחץ על התחל רכישה כדי להעביר את החיה לסורק PET FOV. הזנב והצינורית יישארו מחוץ ל-FOV כדי לאפשר הזרקת עקבות. הסורק יישאר לא פעיל עד שהמשתמש ילחץ על לחצן המשך .
- הכינו את המזרק עם מינון מעקב PET מכויל.
- התחל את הרכישה על-ידי לחיצה על לחצן המשך והתחל להזריק את העקיבה לצינורית תוך 5 שניות מתחילת הסריקה (איור 1).
הערה: משך ההזרקה יהיה ~ 20-25 שניות. - שים את המזרק בכיול מינון PET כדי למדוד את הפעילות השיורית במזרק. הוסף הערות לפעילות בפועל ולזמן המדידה.
- בכרטיסיה צג חומרה של ממשק המשתמש הגרפי של הסורק, השתמש בלחצן עדכן מידע מעקב PET כדי להוסיף את הזמן, הפעילות ואמצעי האחסון שהוזרקו בפועל.
- במהלך הסריקה, בדוק את הפרמטרים הפיזיולוגיים של החיה מעת לעת.
- במהלך הסריקה, מדוד את הגליקמיה כפי שהוסבר בשלב 2.2 בנקודות הזמן הבאות: 5 דקות, 20 דקות, 40 דקות ו-60 דקות לאחר תחילת סריקת PET.
- לאחר מדידת הגליקמיה, שים את רצועת הבדיקה בדלפק הגמא ובצע את מדידת הפעילות במשך 60 שניות. רשום את הזמן בפועל שבו בוצעה מדידת הפעילות, ותקן עבור דעיכה רדיואקטיבית, תוך לקיחת זמן הזרקת המעקב כזמן ייחוס. המירו את ערכי הפעילות שנרשמו לריכוז פעילות (Bq/mL) על ידי התחשבות בנפח דם ממוצע של 1 μL ברצועת בדיקת הגלוקוז (כלומר, באמצעות משוואה [1]):
C דם(t) =דם(t)/0.001 מ"ל [Bq/mL] (1)
כאשרדם(t) הוא הפעילות הנמדדת המתוקנת של דגימת הדם ברצועת הבדיקה, המתבטאת ב- Bq.
הערה: התחלת סריקת PET והזרקת המעקב יכולות להתבצע על ידי אותו מפעיל באמצעות מכשיר השליטה הנייד של הטומוגרף הממוקם על השולחן הצדדי של הסורק קרוב לאתר המפעיל במהלך ההזרקה. עיכובים ארוכים יותר בין תחילת הסריקה לתחילת ההזרקה מותרים, אך חלק מהמסגרת המשוחזרת בתחילת הרצף הדינמי תישאר ריקה. מומלץ להימנע מעיכובים הגדולים מ-10 שניות (כלומר, להוביל לשתי מסגרות ריקות עם הפרוטוקול הנוכחי).

איור 1: הזרקה של עוקב PET. פעולה זו מבוצעת מיד לאחר תחילת סריקת ה- PET. החיה נמצאת בתוך שדה הראייה של PET (ראש ראשון, כאשר זנבו גלוי בצד המפעיל). קיצור: PET = טומוגרפיה של פליטת פוזיטרונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
7. סריקות CT
- לפני הזרקת חומר הניגוד CT, התחל את סריקת ה- CTAC מיד לאחר סגירת מכסה הסורק ולחיצה על לחצן המשך בממשק המשתמש הגרפי. בסוף רכישה קצרה מאוד זו, השתמש בהליכים הבאים כדי להבטיח שיפור נאות של מאגר הדם על ידי הזרקת CA לפני הרכישה באמצעות אותה גישה וסקולרית המשמשת להזרקת מעקב PET.
- תחליב שומנים עם יוד CA:
- לאחר השלמת סריקת ה- CTAC, יש להזריק את תחליב השומנים היוד CA באמצעות הצינורית שכבר מחוברת לווריד זנב העכבר. משך ההזרקה הטיפוסי הוא בסדר גודל של 30-60 שניות.
- התחל את ההדמיה מיד לאחר השלמת ההזרקה. לחץ על המשך בממשק המשתמש הגרפי של הסורק כדי להתחיל את רכישת Cine-CT.
- משאבת Iomeprol/מזרק:
- אם נעשה שימוש ב- CA רנטגן רגיל, כגון iomeprol, השתמש במשאבת מזרק המאפשרת הזרקה איטית בקצב קבוע.
- עבור עכברים, הגדר את קצב ההזרקה של CA ל-10 מ"ל/שעה (~0.17 מ"ל/דקה) על ידי הגבלת נפח ההזרקה ל-0.5 מ"ל. עם הגדרה זו, להפסיק את ההזרקה לאחר ~ 3 דקות. עבור חולדות, הגדר את המשאבה לקצב של 24 מ"ל/שעה (= 0.4 מ"ל לדקה) והגבל את נפח ההזרקה ל -2 מ"ל. עם הגדרה זו, להפסיק את ההזרקה לאחר 5 דקות.
- חבר את המחט המחוברת לצינור CA לצינורית של וריד הזנב, כדי להבטיח שגם הצינור וגם המחט ימולאו מראש ב- CA.
- התחל את ההזרקה. סגור את מכסה הסורק והתכונן לסריקת Cine-CT.
- לחץ על לחצן המשך בממשק המשתמש הגרפי של הטומוגרף לאחר 60 שניות מתחילת ההזרקה לעכברים ולאחר 90 שניות מתחילת ההזרקה לחולדות, כך שרכישת Cine-CT תתחיל. הזרקת CA תיפסק בערך באותו זמן כמו השלמת סריקת Cine-CT עבור עכברים ועם השלמתה עבור חולדות.
- תחליב שומנים עם יוד CA:
- עם השלמת סריקת Cine-CT, נתק את החיה ממערכת הניטור הפיזיולוגית והסר את צינורית וריד הזנב. בהתאם לפרוטוקול בפועל, בעלי חיים משוחזרים או מורדמים לאחר הליך ההדמיה המתואר. במקרה הראשון, בעלי חיים מתעוררים בכלובים שלהם בסביבה חמה תחת מנורת אינפרא אדום. הם מנוטרים עד התעוררות מלאה, לוקח 15/30 דקות לאחר הרדמה גזית. במקרה של פרוטוקולים הדורשים למשל, קצירת רקמות בסוף הליך ההדמיה, בעלי חיים מומתים באמצעות מנת יתר של חומר הרדמה בתא אינדוקציה (5% איזופלורן), לפי נספח VI של D.Lgs. 26/2014.
הערה: במקרה של 18רדיונוקלידים מבוססי F כפי שנדון בפרוטוקול זה, 24 שעות לאחר הזרקת העקיבה מספיקים כדי להגיע לרמה של רדיואקטיביות שיורית בגוף החיה שהיא בטוחה לכל המטרות המעשיות.
8. שחזור של תמונות 4DCT הלב באמצעות gating cardiorespiratory פנימי
הערה: עם השלמת מחקר ההדמיה, שחזור PET ו- CT סטנדרטי מבוצע באופן אוטומטי. עם זאת, השחזור של רצף 4D (Cine) CT קרדיואקטיבי חייב להתבצע באופן ידני ודורש אינטראקציה מסוימת עם המשתמש. סוג מיוחד זה של שחזור, חובה לניתוח CT לב מורפו-תפקודי הבא, נדון בסעיף זה.
- פתח את מודול ה- gating הלבבי של ממשק המשתמש הגרפי של הטומוגרה ובחר את מחקר ההדמיה לניתוח.
- בחר אזור עניין (ROI) ברדיוגרפים של החיה המוצגת (איור 2) לבניית עקומת תנועה לבבית תלוית זמן, המייצגת את אות הגידור - הקימוגרמה. הזז אנכית את ה- ROI המלבני המצויר מראש באופן כזה שגם נקודת השיא של הלב וגם הסרעפת נבחרו. לאחר מכן, בחר ניתוח אותות Gating. ממשק המשתמש יציג כעת את אות ה- gating הן בתחום הזמן והן בתחום התדרים.
- בגרף תחום התדרים הראשון, בחר את תחום התדרים הנשימתיים על-ידי הדגשת קבוצת הפסגות הראשונה של ספקטרום התדרים (עיין באיור 3 לקבלת ספקטרום לדוגמה).
- בגרף תחום התדרים השני, בחר את רצועת תדרי התנועה של הלב, תוך הדגשת השיא השני החד ביותר.
- בשלב הבא, שימו לב לאות ה-gating של תחום הזמן עם סמני צבע (נקודות) על גבי, המראים את פסגות הנשימה המזוהות ואת פסגות התכווצות הלב. אם מיקומי הסמן מתאימים היטב לפסגות הנשימה והלב של אות ההנעה המקורי, המשך לשלב הבא. אחרת:
- אם צורת אות ה-gating שונה מדי מזו המוצגת באיור 3, חזור לשלב 8.2 ובחר החזר השקעה אחר.
- אם צורת אות ה-gating דומה במידה סבירה לזו המוצגת באיור 3, חזור לשלב 8.3 ולשלב 8.4 ובחר תחומי תדרים שונים בספקטרום האותות של ה-gating.
- בשלב הבא, בחר מינימום של ארבעה שערי לב.
הערה: שחזור Cine-CT טיפוסי מורכב מ-8-12 שערי לב. - בחר את חלון הנשימה המתאים באמצעות התפריט הנפתח: חלון נשימתי | 20%-80%.
הערה: זה ישמור על 60% מהנתונים שנרכשו בשחזור, לא כולל שלב ההשראה השיא, ובכך לשפר את החדות של קירות שריר הלב המשוחזרים בכל שלב לב. - בצע שחזור כדי להמיר את תמונות Cine-CT המגודרות בדיעבד לפורמט DICOM, מוכן לייבוא לתוכנה לצורך ניתוח פונקציונלי לאחר מכן.
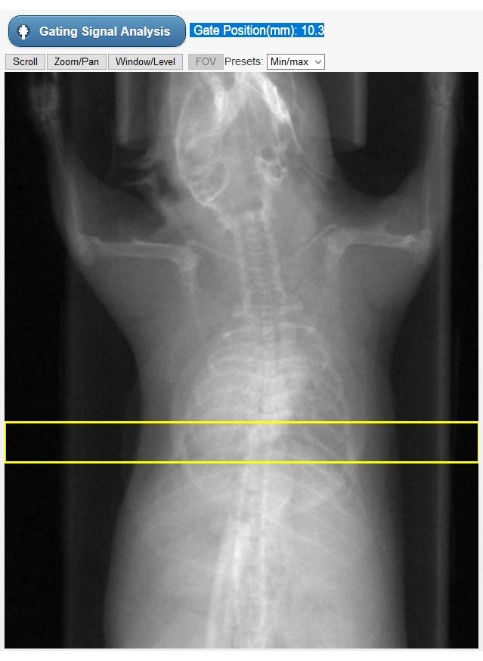
איור 2: כלי לבחירת ROI עבור gating פנימי. תמונה זו מוצגת בממשק המשתמש הגרפי של הטומוגרף במהלך שלב שחזור Cine-CT. על המשתמש לבחור את מיקום ה- ROI (מלבן צהוב) שעליו מתקבל אות ההטיה הפנימי (קימוגרמה) מתחזיות ה- CT הגולמיות. האובייקט בצורת מעגל המוצמד לחזה החיה הוא כרית הנשימה המשמשת רק לניטור פיזיולוגי במהלך המחקר. קיצורים: ROI = אזור עניין; CT = טומוגרפיה ממוחשבת; GUI = ממשק משתמש גרפי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
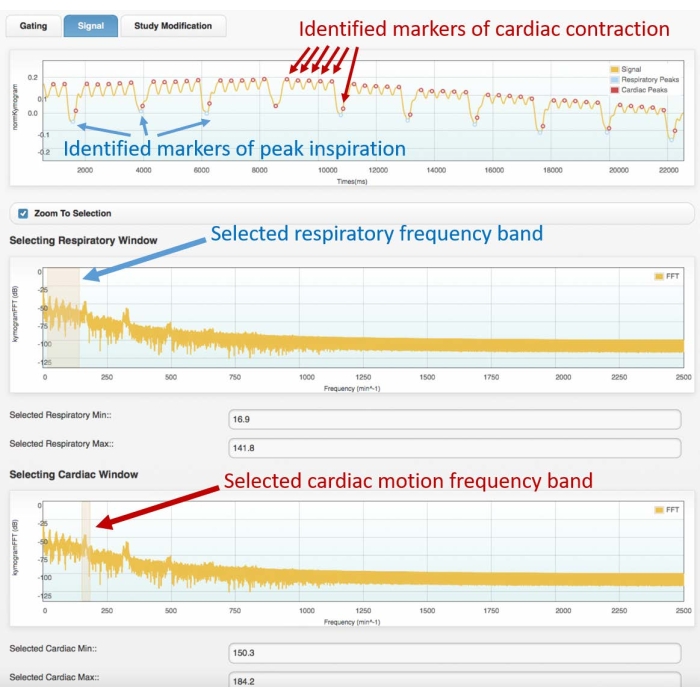
איור 3: דוגמה לאות גטינג (מסגרת עליונה) וספקטרום תדרים תואם (מרכז ותחתון). תמונות שהתקבלו עם מודול gating הלב של תוכנת אטריום. על המשתמש לבחור את רצועות התדרים המתאימות הן לתנועה נשימתית (מסגרת מרכזית) והן לתנועה לבבית (מסגרת תחתונה). זה יאפשר זיהוי של סמנים נשימתיים ולבביים על האות gating, אשר חייב להיבדק על ידי המשתמש לפני שתמשיך עם שחזור 4D. זיהוי לקוי של הפסגות או הקצאה שגויה (למשל, נשימה ללב, או להיפך) יוביל לשחזור שגוי. הנתונים המוצגים התקבלו מניתוח של סריקת Cine-CT 4D של חולדת Wistar זכרית בריאה ובוגרת (507 גרם) שהוזרקה עם 2 מ"ל של iomeprol, 200 מ"ג/מ"ל, בקצב של 0.4 מ"ל/דקה למשך 5 דקות (הגרף למעלה מוגדל על 22 השניות הראשונות של הרכישה כדי לאפשר הדמיה טובה יותר של תנועת הלב והנשימה המזוהה). קיצור: CT = טומוגרפיה ממוחשבת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
9. ניתוח לב PET
הערה: סעיף זה מראה כיצד לבצע ניתוח קינטי של נתונים דינמיים [18F]FDG של החדר השמאלי בעל החיים הקטנים. הניתוח מבוסס על תוכנת Carimas. ההוראות שלהלן אינן אמורות להוות תחליף למדריך למשתמש של התוכנה17. ההליך המוצג להלן מבוסס על הניתוח הגרפי Patlak של נתוני PETדינמיים 18. עיין בסעיף הדיון לקבלת פרטים אודות ניתוח זה.
- פתח את תמונות DICOM של סריקת PET דינמית.
- בחר את מודול HeartPlugin .
- התקרב לתמונה בלב העכבר/חולדה, ובחר את מסגרת הזמן האחרונה (או שווה ערך, את הסכום של שלוש עד חמש מסגרות הזמן האחרונות) שעבורה רוב פעילות בריכת הדם כבר נשטפה החוצה.
- בצע את ההוראות שעל המסך כדי לכוון מחדש את התמונה לאורך הציר הראשי של לב החיה (ציר קצר, ציר אנכי ואופקי ארוך). עשו זאת באופן אינטראקטיבי על-ידי הזזת הסמנים המוצגים לבסיס הלב ולנקודת השיא (איור 4).
- בחרו בכלי פילוח .
הערה: כברירת מחדל, פילוח אוטומטי מופעל, מה שמניב תוצאות מהימנות ברוב המקרים. - אם תוצאת הפילוח האוטומטי אינה מקובלת, שכלל את הצורה של שריר הלב המקוטע ו/או חלל ה-LV על-ידי הפעלת המצב הידני (ROI Search Disabled).
- בכלי המידול , בחר את המודל הקינטי המתאים שישמש לניתוח PET דינמי. במקרה זה, בחר גרפי | Patlak כדי לאפשר את ניתוח העלילה Patlak לחישוב קצב חילוף החומרים של ספיגת גלוקוז (MRGlu) עבור כל מגזר לב.
- בכלי מפת קוטב , בחר את המספר הנכון של מקטעי הלב המוצגים. במקרה זה, בחר 17 מקטעים.
- כעת, לחץ על כפתור ההתאמה כדי לבצע את הליך ההתאמה של ניתוח Patlak.
- בסוף הליך ההתאמה, התבונן במפה הקוטבית המוצגת של ערכיK i (כלומר, השיפוע של הרגרסיה הליניארית המתבטאת ב-mL/[mL × min]).
- באמצעות ערכי Ki עבור כל סקטור המוצגים בטבלה, חשב אתMR Glu באמצעות משוואה (2):
MR Glu = (Ki × PGlu)/LC (2)
כאשרP Glu הוא ערך שמקורו בדגימת דם של ריכוז הגלוקוז בפלזמה (mmol/L), והקבוע הגושי (LC) הוא מקדם אמפירי המשמש לפיצוי על ההבדל בספיגה בין גלוקוז רגיל ל-FDG. ראו, למשל, Ng et al.22 עבור ערכים אופייניים של קבוע גושים בתנאי ניסוי שונים.
הערה: לפני תחילת ניתוח PET, מומלץ לבדוק באופן חזותי את הרצף הדינמי של אמצעי אחסון PET בתוך כלי התוכנה לניתוח PET. זה הכרחי כדי לא לכלול תנועה מקרוסקופית של בעלי חיים בין מסגרות זמן במהלך המחקר. אם קיימת תנועה, יש לבצע רישום תמונה תקין (מחוץ לתחום פרוטוקול זה) לפני הניתוח, במידת האפשר.
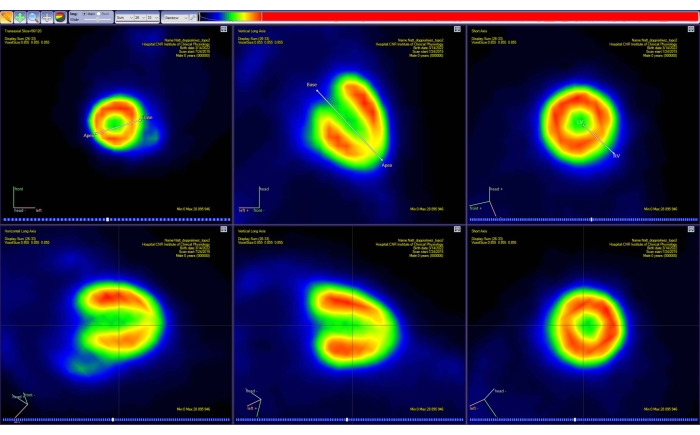
איור 4: כלי כיוון מחדש של תוכנת ניתוח PET. ההטלה של שני מקטעי קו פשוטים במרחב תלת-ממדי מוצגת בכל אחד משלושת המישורים הסטנדרטיים (טרנסאקסיאלי, קורונלי וסגיטאלי). הקטע הראשון מאפשר למשתמש לבחור את בסיס הלב ואת apex, ואילו השני מאפשר לבחור את הצד השמאלי והימני של הלב. שלב זה יוצר תמונת PET חדשה (אינטרפולציה) (שורה תחתונה), כאשר הלב מכוון מחדש לאורך ייצוג AHA הסטנדרטי. תמונות התקבלו עם Carimas מעכבר CD-1 זכר בוגר בריא במשקל 51 גרם והוזרק לו 10 MBq של [18F]FDG. קיצורים: PET = טומוגרפיה של פליטת פוזיטרונים; AHA = איגוד הלב האמריקאי; FDG = פלואורודאוקסיגלוקוז. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
10. ניתוח לב Cine-CT
הערה: סעיף זה מראה כיצד לבצע ניתוח כמותי של תמונת הלב Cine-CT כדי לאסוף נתונים כמותיים גלובליים של תפקוד הלב. הניתוח מבוסס על תוכנת Osirix MD. ההוראות שלהלן לא נועדו להוות תחליף למדריך למשתמש של Osirix24.
- טען את תמונות ה- DICOM של סריקת Cine-CT בתוכנה.
- פתח את ערכת הנתונים הדינמית עם מציג ה- 4D המובנה.
- באמצעות הכלי רפורמציה רב-פלנטרית תלת-ממדית (MPR), כיוון מחדש של נתוני התמונה לאורך הציר הקצר (איור 5).
- ייצא את הנתונים המכוונים מחדש ל- DICOM, כדי להבטיח שכל נתוני ה- 4D ייוצאו, עם עובי פרוסה משומר (זהה למקור) ועומק סיביות תמונה (16 סיביות לווקסל)
- פתח את תמונות ה- 4D MPR המיוצאות באמצעות מציג ה- 4D.
- בחר מסגרת זמן המתאימה לדיאסטולה הסופית. דפדף בין כל מסגרות הזמן באמצעות מחוון הזמן בסרגל הכלים הראשי כדי לוודא ששלב הלב הנכון נבחר.
- במסגרת זמן זו, בחר את כלי ביאור המצולע הסגור ותחם ידנית את הקיר האנדוקרדיאלי של LV.
- עשו את אותו הדבר עבור 10-20 פרוסות מהבסיס ועד לפסגה, כדי להבטיח שלכל ה-ROIs יהיה אותו שם (למשל, LVENDO).
- בתפריט החזר על ההשקעה , בחר ROI Volume | צור ROIs חסרים כדי ליצור את ה- ROIs על כל פרוסות הציר הקצרות על ידי אינטרפולציה של ה- ROIs המצוירים באופן ידני.
- בתפריט החזר על ההשקעה , בחר ROI Volume | נפח מחשוב כדי לחשב את הנפח של קבוצת החזר ההשקעה עם אותו שם ROI.
- דפדף בין מסגרות הזמן ובחר פאזה המתאימה ל- end-systole (נפח LV קטן יותר) וחזור על שלבים 10.7-10.10 לעיל.
- חישוב נפח הקו (SV) ושבר הפליטה באמצעות משוואות (3) ו- (4):
SV = EDV - ESV[mL] (3)
EF = 100 × SV/EDV [%] (4)
כאשר EDV הוא הנפח הדיאסטולי הסופי ו- ESV הוא הנפח הסיסטולי הסופי.
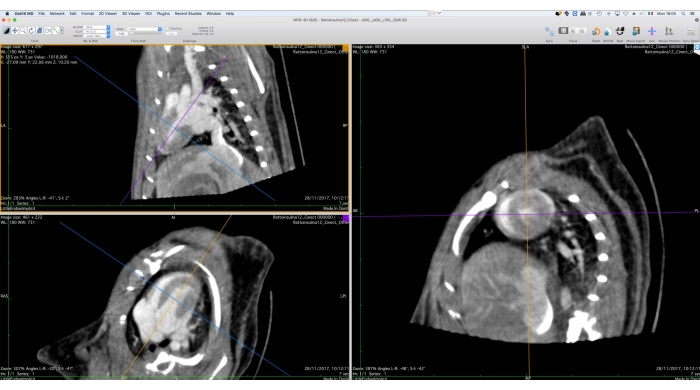
איור 5: ממשק גרפי של כלי הרפורמציה הרב-פלנטרית. כלי זה משמש לשינוי כיוון של נתוני Cine-CT לניתוח פונקציונלי לאחר מכן. המשתמש יסובב ויתרגם את צירי הייחוס בצד שמאל של המסך באופן שתצוגת הציר הקצר של הלב תוצג בצד ימין. בסוף הליך זה, המשתמש יכול לייצא את התמונות המכוונות מחדש כערכת קבצים DICOM. התמונות התקבלו עם Osirix MD ומתייחסות לחולדה Wistar זכר בוגר בריא (507 גרם) שהוזרק לו 2 מ"ל של iomeprol, 200 מ"ג/מ"ל, בקצב של 0.4 מ"ל/דקה למשך 5 דקות, שוחזר עם BackProjection מסונן עם גודל ווקסל של 0.24 מ"מ3. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
תוצאות
בסעיף זה, תוצאות אופייניות מוצגות הן עבור ניתוח PET והן עבור CT בהתאם להליכים שתוארו עד כה. איור 6 מציג את התוצאות של סגמנטציה אוטומטית של חלל שריר הלב ו-LV של סריקת ה-PET [18F]FDG של עכבר CD-1 בקרה (בריא). למרות שהחדר הימני לא תמיד נראה בתמונות המשוחזרות, ניתן להשתמש בצירי הכיוון ה?...
Discussion
הפרוטוקול המוצג במאמר זה מתמקד בהליך ניסויי טיפוסי למחקר קרדיווסקולרי תרגומי על מודלים של פגיעות לב בבעלי חיים קטנים באמצעות הדמיית PET/CT ברזולוציה גבוהה. התוצאות המוצגות מעידות על הערך הכמותי והאיכותי הגבוה של תמונות PET ו- Cine-CT, המספקות מידע תפקודי ומבני של הלב כולו לגבי חילוף החומרים של ה?...
Disclosures
דניאלה פאנטה קיבלה מענקים עבור R&D של מכשור מיקרו-CT מ- Inviscan Sas.
Acknowledgements
מחקר זה נתמך בחלקו על ידי פרויקט "גוטמום" JPI-HDHL-INTIMIC: השמנת יתר אימהית ותפקוד קוגניטיבי לקוי בצאצאים: תפקיד הגורם-תוצאה של מיקרוביומיאום המעי ומניעה תזונתית מוקדמת (פרויקט מס' INTIMIC-085, משרד החינוך האיטלקי, אוניברסיטה וצו מחקר מס' 946/2019).
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
References
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841 (2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362 (2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82 (2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31 (2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053 (2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89 (2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206 (2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7 (2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- . Carimas User Manual Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022)
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -. P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591 (2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532 (2014).
- Kim, D. -. Y., Cho, S. -. G., Bom, H. -. S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine Available from: https://www.medilumine.com/technical-resources (2019)
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783 (2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D., Grupen, C., Buvat, I. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. , 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603 (2016).
- Lee, C. -. L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T., Kuntner-Hannes, C., Haemisch, Y. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. , 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003 (2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved