このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
小動物用高分解能心臓陽電子放出断層撮影/コンピュータ断層撮影
要約
ここでは、小動物を対象とした高解像度陽電子放射断層撮影/コンピュータ断層撮影法を用いて心機能と形態を定量化するための実験的イメージングプロトコルを紹介します。マウスとラットの両方を検討し、2つの種に対するコンピューター断層撮影造影剤の異なる要件について議論します。
要約
陽電子放出断層撮影(PET)とコンピューター断層撮影(CT)は、最も採用されている画像診断技術の一つであり、どちらも心機能と代謝を理解するのに役立ちます。前臨床研究では、マウスやラットの心臓サイズが小さく、心拍数が非常に高いことによる厳しい技術的要件に対応するために、高感度と高時空間分解能を備えた専用スキャナーが採用されています。この論文では、動物の準備と画像の取得と再構成から画像処理と視覚化まで、心臓病の実験マウスおよび/またはラットモデルのためのバイモーダル心臓PET / CTイメージングプロトコルについて説明します。
特に、18 F標識フルオロデオキシグルコース([18F]FDG)-PETスキャンは、左心室(LV)のさまざまなセグメントにおけるグルコース代謝の測定と視覚化を可能にします。極座標地図は、この情報を表示するための便利なツールです。CT部分は、心電図(ECG)リードなしのレトロスペクティブゲーティングを使用した心臓全体の時間分解3D再構成(4D-CT)で構成されており、LVの形態機能評価と、その後の駆出率(EF)や脳卒中量(SV)などの最も重要な心機能パラメータの定量化を可能にします。統合されたPET/CTスキャナーを使用すると、このプロトコルは、異なるスキャナー間で動物を再配置することなく、同じ麻酔誘導内で実行できます。したがって、PET / CTは、心臓病のいくつかの小動物モデルにおける心臓の形態機能および代謝評価のための包括的なツールと見なすことができます。
概要
小動物モデルは、心血管疾患の理解を進める上で極めて重要である1,2.非侵襲的な画像診断ツールは、臨床と前臨床の両方の設定で、過去数十年で心機能の見方に革命をもたらしました。心臓病の小動物モデルに関する限り、非常に高い時空間分解能を持つ特定のイメージングツールが開発されています。したがって、このような機器は、心不全(HF)3や心筋梗塞(MI)4などの特定の疾患モデルにおいて、マウスおよびラットの非常に小さく非常に動きの速い心臓に関する関連する代謝および運動心筋パラメータの正確な定量化の必要性に一致させることができます。この目的のためにいくつかのモダリティが利用可能であり、それぞれに長所と短所があります。超音波(US)イメージングは、その優れた柔軟性、非常に高い時間分解能、および比較的低コストにより、最も広く使用されているモダリティです。小動物における米国の心臓画像の採用は、50μm未満の空間分解能を特徴とする超高周波5,6のプローブを使用するシステムの出現以来、大幅に増加しています。
完全な3D心臓イメージングのための米国の主な欠点の中には、プローブを電動トランスレーションステージに取り付けて心臓全体の動的Bモード画像のフルスタックを作成することにより、心臓軸に沿って線形スキャンする必要があることです7。最終的に、この手順は、(各プローブ位置で取得された画像の正確な空間的および時間的登録後に)面内方向と面外方向の間で異なる空間分解能を持つ4D画像を生み出します。不均一な空間分解能の同じ問題は、心臓MR(CMR)8 でも発生し、心臓の機能イメージングにおけるゴールドスタンダードを表しています。代わりに、コンピューター断層撮影(CT)と陽電子放出断層撮影(PET)の両方を使用して、実際の等方性3Dイメージングを取得できます9。PETは、CT、MR、またはUSと比較して空間分解能が低下しているにもかかわらず、注入されたプローブの量あたりの画像信号(ナノモル範囲)に関して非常に感度の高いツールを提供します。PETの主な利点は、臓器の病態生理の根底にある細胞および分子メカニズムを表示できることです。たとえば、[18F]FDGの注射後のPETスキャンにより、体内のグルコース代謝の3Dマップを再構築できます。これを動的(すなわち、時間分解)データ取得と組み合わせることにより、トレーサー動態モデリングを使用して、グルコース取り込みの代謝率(MRGlu)のパラメトリックマップを計算することができ、これは心筋生存率に関する重要な情報を提供する10。
CTは、関連する組織成分(血液対筋肉など)の測定可能な増強を提供するために、高濃度(mLあたり最大400mgのヨウ素)で大量の外部造影剤(CA)を必要としますが、特に小動物イメージング用に設計された最先端のマイクロCTスキャナーを使用する場合、空間的および時間的分解能に優れています。11心臓PET / CTを適用できる典型的な疾患モデルは、心筋梗塞と心不全の実験的評価、および関連する治療への反応です。小動物でMIを誘導する一般的な方法は、左前下行(LAD)冠状動脈12,13の外科的結紮を行い、その後の数日間の疾患の進行と心臓リモデリングを縦断的に評価することです4。それにもかかわらず、小動物における心臓の定量的形態機能評価は、心機能に対する加齢の影響の評価14または肥満モデルにおける受容体発現の変化の評価など、他の疾患モデルにも大部分適用可能である15。提示されたイメージングプロトコルは、特定の疾患モデルに限定されないため、小さなげっ歯類を用いた前臨床研究のいくつかのコンテキストで最も幅広い関心事になる可能性があります。
本稿では、小動物統合PET/CTを用いた心臓イメージングの開始から終了までの実験プロトコルを提示する。提示されたプロトコルは特定のバイモーダル統合スキャナー用に設計されていますが、説明されている手順のPET部分とCT部分は、異なるメーカーの別々のスキャナーで独立して実行できます。使用中のPET/CTスキャナーでは、一連の操作は事前にプログラムされたワークフローで編成されています。各ワークフローの主なブランチは、1つ以上の取得プロトコルです。各収集プロトコルは、特定の前処理プロトコル用の1つ以上の分岐を持つことができ、次に、各前処理プロトコルは、特定の再構成プロトコル用の1つ以上の分岐を持つことができます。画像化床上での動物の調製および画像化手順の間に注入される外用剤の調製の両方が記載されている。画像取得手順の完了後、一般的に入手可能なソフトウェアツールに基づく定量的画像解析の手順例が提供される。メインプロトコルは、マウスモデル用に特別に設計されています。マウスはこの分野で最も使用されている種であり続けていますが、メインプロトコルの最後にラットイメージングのためのプロトコルの適応も示します。代表的な結果がマウスおよびラットの両方について示され、記載された手順で予想される出力のタイプを示す。この論文の最後には、この技術の長所と短所、重要なポイント、および準備および取得/再構築の手順をほとんど変更せずにさまざまなPET放射性トレーサーを使用する方法を強調するために、徹底的な議論が行われます。
プロトコル
動物実験は、欧州指令(1986年の指令86/609/EECおよび指令2010/63/UE)およびイタリアの法律(D.Lgs.26/2014)によって要求される実験動物の取り扱いに関する国際ガイドラインの実験動物の世話と使用に関するガイドの推奨事項に従って実施されました。
1. PET/CTイメージングプロトコルとワークフローのセットアップ
注:ここで紹介するプロトコルは、マウスモデルの心臓イメージング用に特別に設計されています。ラットでの作業は、主に動物のサイズが大きい(約10倍重い)ため、実際のプロトコルにいくつかの変更を加えることを意味する可能性があります。ラットイメージングのための変更は、ステップで具体的に言及されています。改変が言及されていない場合、マウスイメージングのための同じステップをラットに使用することができる。
- PET/CT スキャナーのグラフィカルユーザーインターフェイス (GUI) を開きます ( 材料表)をクリックし、一連の新しいプロトコル(データ取得、前処理、および画像再構成のパラメータを含む)を作成します。 ダイナミックPETスキャン、(ii) a 低線量CTスキャン 減衰補正用(ティッカー)造影剤なし、および(iii)a 造影剤増強シネCTスキャン.
注意: 取得、前処理、および再構築フェーズ用の新しいプロトコル(つまり、断層撮影用の特定のソフトウェア命令)の作成は簡単なプロセスです。問題が発生した場合、ユーザーはGUIユーザーマニュアルでより詳細な情報を見つけることができます。- PETスキャンでは、スキャナー(GUI)の[プロトコル]タブを開き、次のパラメータを使用して3つの新しいプロトコル(取得、前処理、再構築用)を作成します。
- 取得プロトコルの場合:合計スキャン時間とシングルベッド位置を3,600秒に設定します。このプロトコルを適切な名前で保存し、後でワークフローにインポートします。次のすべてのプロトコルについても同じことを行います。
- マウスの前処理プロトコルの場合:250〜750 keVのエネルギーウィンドウ(EW)を選択し、次の補正を有効にします:放射性崩壊、ランダムな一致、およびデッドタイム。フレーミングプロトコル(つまり、生データの動的分割)を次のように設定します:8 x 5秒、8 x 10秒、3 x 40秒、2 x 60秒、2 x 120秒、10 x 300秒(= 3,600秒)。ラットの場合、マウスプロトコルと同じフレーミングを使用して、350〜750 keVのエネルギーウィンドウ(EW)を選択します。
- 再構成プロトコルの場合:正規化、定量的補正、CT減衰補正を有効にした、8つのサブセットと8つの反復で、高品質のモンテカルロベースの3D順序サブセット期待値最大化(3D-OSEM-MC)アルゴリズムを選択します。
- 減衰補正(CTAC)のための低線量CTスキャンでは、次のパラメータを使用します。
- 取得プロトコルの場合:シングルフレーム、シングルベッド位置、フルスキャン、チューブ設定:80 kV、低電流(低線量)、360°で576ビュー、ビューあたり34ミリ秒の露光時間(20秒のスキャン時間)。回転タイプ:連続、感度モード:高感度。
- 前処理プロトコルの場合:240 μmボクセルサイズ、横方向FOV:ラット、軸方向FOV:100%。
- 再構築プロトコルの場合:フィルターウィンドウ:スムーズ、ボクセルサイズ:標準、ビーム硬化とリング事前修正を有効にし、リングアーチファクト事後補正を無効にします。
- 造影ゲートCTスキャンでは、次の設定で3つの新しいプロトコル(取得、前処理、再構成)を作成します。
- マウスのアクイジションプロトコルの場合:シングルフレーム、シングルベッド位置、フルスキャン、チューブ設定:65 kV、フル電流(低ノイズ)、360°で8,000ビュー、ビューあたり15 msの露光時間(スキャン時間120秒)、回転タイプ:連続、感度モード:高感度。ラットの場合、取得プロトコルパラメータを次のように設定します:80 kVチューブ電圧、360°で16,000ビュー、ビューあたり12ミリ秒の露光時間(スキャン時間192秒)。
- マウスの前処理プロトコルの場合:120 μmボクセルサイズ、横視野(FOV):マウス、軸方向FOV:50%を選択します。ラットの場合は、240 μmのボクセルサイズ、横方向の視野(FOV):ラット、軸方向の視野:50%を選択します。
- 再構築プロトコルの場合:フィルターウィンドウ:スムーズ、ボクセルサイズ:標準;ビーム硬化とリング事前補正を有効にし、リングアーチファクト事後補正を無効にします。
- GUI で [ワークフロー(Workflow)] タブを開き、新しいワークフローを作成して、作成したプロトコルを追加します(PETの場合はステップ1.1.1.1-1.1.1.3、ステップ1.1.2.1)。-1.1.2.3.CTAC の場合、およびステップ 1.1.3.1 です。-1.1.3.3.ゲート付きCTの場合、指定された順序で。どちらの場合も、プロトコルが次の順序でネストされていることを確認します。 取得 |前処理 |再建。
注:PETスキャンの開始時に動脈入力機能のピークをより適切にキャプチャするために、持続時間が<5秒の動的PETフレームが可能ですが、定量的精度が低下したノイズの多い画像につながる可能性があるため、お勧めしません。ステップ1.1.2.2では、横方向FOVに「ラット」サイズを使用しました。これは、CTACのラットとマウスの両方に一般的に使用されます。
- PETスキャンでは、スキャナー(GUI)の[プロトコル]タブを開き、次のパラメータを使用して3つの新しいプロトコル(取得、前処理、再構築用)を作成します。
2. PET / CTイメージングのための動物の準備
注:現在のプロトコルでは、すべての動物を一晩絶食させました。
- 最初に誘導チャンバーで3%〜4%(v / v)のイソフルランでマウスを麻酔し、次に1%〜2%(v / v)のイソフルランで維持します。.
- マウスの体重を量り、基礎血糖を測定して動物の状態を監視します。必要な血液サンプルを採取するには、鋭利なハサミを使用して尾の先端に小さな切り込みを入れ、尾を優しくマッサージして、テストストリップに直接血液の滴(~1 μL)を収集します。
- マウスの場合は29 G、ラットの場合は24 Gのバタフライを使用して、尾静脈の高さで静脈アクセスを挿入します。
- カニューレ挿入技術を実行するには、同時加熱(通常は加熱ランプの下)と静脈の血管拡張のために針が挿入されるポイントの消毒を使用します。カニューレ挿入後、蝶をシルクリボンで尾に固定して、処置中に所定の位置に保ちます。
注:断食は[18F] FDG研究に必要です。トレーサーが異なれば動物の準備も異なるかもしれませんが、このトピックに関する徹底的な議論は本プロトコルの範囲外です。[18F]FDGに関する限り、絶食を避けることは非常に異なるトレーサーの生体分布につながります16。
- カニューレ挿入技術を実行するには、同時加熱(通常は加熱ランプの下)と静脈の血管拡張のために針が挿入されるポイントの消毒を使用します。カニューレ挿入後、蝶をシルクリボンで尾に固定して、処置中に所定の位置に保ちます。
- PET-CTスキャナーに接続された麻酔システム(イソフルラン1%-2%、マウスの場合は0.8 L / minO 2、ラットの場合は1-1.2 L / min)の電源を入れ、マウスをベッドに移します。
- マウスを仰臥位に置き、PET-CT断層撮影装置のスキャナーベッドに頭を最初に置き、麻酔のために鼻を鼻マスクに入れ、マウスの頭を粘着テープでマスクにそっとブロックします。
- マウスの上肢と下肢をスキャナーベッドに固定して、モーションアーチファクトにつながる可能性のあるイメージング手順中の不随意運動を防ぎます。
- 直腸プローブと呼吸枕を使用して、それぞれ体温と呼吸数を監視します。
3.PETトレーサーの投与量の準備
- マウスの場合、インスリン注射器(1 mL)を使用して100〜150 μLの容量で10 MBqの[18F]FDGを引き出します。ラットの場合、0.20〜0.25 mLで15 MBqの高用量を引き出します。.
注意: このプロトコルで説明されているPETスキャナーは感度が非常に高く、高品質の画像を取得するために適度なアクティビティしか必要としないため、より高いアクティビティは避けてください。 - バイアル内のトレーサーの元の濃度が高すぎる場合は、生理学的溶液(0.9% w / v NaCl)を使用して、トレーサー用量を50〜100 MBq / mLの濃度に希釈します。
- PET用量校正器を使用して、シリンジ内の実際の活動を測定します。プリインジェクションのアクティビティと測定時間に注釈を付けると、これらの値は後でPETスキャナーGUIの特定の入力モジュールを使用して使用されます。
4. CT造影剤の調製
- ヨード化脂質エマルジョン造影剤のマウス体重20 gあたり0.2 mLを1 mLシリンジに引き込みます。より重いマウスの注射量を0.5mLのCAに制限します。イオメプロールを使用する場合は、マウスの注射速度を10 mL / h(~0.17 mL / min)に設定し、注射量を0.5 mLに制限します。.
- ラットの場合、200 mg / mLの濃度に希釈した2.3〜3 mLのイオメプロールを5 mLの注射器に引き込みます。.
注:小動物脂質エマルジョンCAが利用できない場合は、以下で説明するように、シリンジポンプによる連続注入を備えたiomeprolを使用できます。 - シリンジをシリンジポンプに接続し、実際のシリンジのサイズと直径に合わせてポンプを設定します。
- シリンジをCAチューブとニードルに接続し、チューブにCAを事前に充填します。
- 注入速度を24 mL / h(= 0.4 mL / min)に設定し、注入を最大容量2 mLに制限します。
注:ヨウ素化脂質エマルジョンに基づく血液プールCAの使用は、1回の注射の量が多いため、この手順のコストが比較的高いにもかかわらず、ラットでも可能です。このオプションが好ましい場合(例えば、シリンジポンプを回避してプロトコルを簡素化するため)、以下の手順を採用することができる:
- ラットの場合、200 mg / mLの濃度に希釈した2.3〜3 mLのイオメプロールを5 mLの注射器に引き込みます。.
- ヨード化脂質エマルジョン造影剤の体重1kgあたり7.5mLを5mLシリンジに引き込みます。より重いラットに対しても、注射量を2mLのCAに制限します。.
5.イメージング前の動物の位置合わせと予備操作
- イメージングベッドに動物を固定したら、断層撮影GUIで新しい研究を作成します。試験名モジュールに 試験 名識別子を追加し、ドロップダウンメニューから以前に保存したイメージングワークフローを選択します。
- 動物/標本情報で適切な解剖学的部品を選択してください |解剖学的部分 | 動物/検体情報による心臓および動物の位置決め |ポジショニング |仰臥位/頭が最初。対応するモジュールの動物の体重にグラム単位で注釈を付けます: 動物/標本情報 |動物の体重。
注: このセクションの他のすべての情報はオプションですが、再構築イメージの DICOM ヘッダーで検索するために、要求された情報をできるだけ多く提供しておくと、後続のデータ クエリが容易になります。 - PETスキャン情報で放射性核種を選択 | [18F] FDG研究およびその他の 18のF標識化合物のためのF18。他のトレーサー([13N]NH3など)が使用されている場合は変更します。PETスキャン情報にトレーサーの名前も記入 してください|この名前のトレーサー名 モジュールは、画像の再構成の完了時にDICOMヘッダーに報告されます。
注意: トレーサー注入時間、活性、および量に関する情報は必須ですが、PET取得時に後で提供できます。 - CTスキャン情報に、造影剤に関する入手可能なすべての情報を書き込みます。
注: この情報はすべてオプションですが、指定した場合、後続のデータ クエリが容易になります。 - [スキャンの実行]を押して、GUIの別のタブが開くのを待ち、動物の位置決めと他のスキャンオプションの指定を可能にします。
- CTキャリブレーションでCTキャリブレーションタイプを選択する |デフォルトのCTキャリブレーションを使用します。
- 試験の準備セクションで、ドロップダウンメニューから各スキャンプロトコルを選択し、このスキャンの前にユーザーの確認を待つチェックボックスをオンにします。
注:この手順は、対応する取得フェーズを開始する前に、スキャナーをスタンバイ状態にしてユーザー入力を待機するため、非常に重要です。PETスキャンの場合、これによりトレーサー注入と実際のPETスキャン開始の同期が可能になります。CTACスキャンの場合、CTスキャン中にX線が放出される前に、ユーザーは蓋を閉じる(シールドする)ことができます(CTスキャンの開始前に蓋が開いている場合、研究は自動的に中止されます)。Cine-CTスキャンの場合、この一時停止により、ユーザーは必要な遅延でCA注入プロトコルとCTデータスキャンを開始できます。 - 動物の位置決めには、GUIの左側のペインにあるスイッチを使用して 、モーター制御 モジュールのスイッチをオンにします。
注意: これにより、動物ベッドのセンタリングレーザーがオンになり、スキャナーの側面に配置された手動ベッドアライメントボタンが有効になります。 - 手動のベッドアライメントボタンを使用して、動物の胸をレーザーマークに移動します。動物の縦方向と垂直方向の両方の位置合わせを注意深く確認してください。
- 動物がセンタリングレーザーに従って正しい位置に置かれたら、 レーザーのスイッチ を押して、対応する取得段階でPETおよびCTスキャナーの中心に移動する現在のレーザーマーク位置を保存します。その後、モーター制御モジュールのスイッチを切ります。
6.PETスキャン
- [ 取得の開始 ]を押して、動物をPETスキャナーFOVに移動します。尾部とカニューレはFOVの外側に留まり、トレーサー注射を可能にします。スキャナーは、ユーザーが [ 続行 ] ボタンを押すまでアイドル状態のままになります。
- 校正されたPETトレーサー用量でシリンジを準備します。
- 続行ボタンを押して取得を開始し、スキャン開始から5秒以内にカニューレへのトレーサーの注入を開始します(図1)。
注:注入時間は~20-25秒です。 - シリンジをPET用量校正器に入れて、シリンジ内の残留活性を測定します。実際のアクティビティと測定時間に注釈を付けます。
- スキャナーGUIの [ハードウェアモニター ]タブで、[ PETトレーサー情報の更新 ]ボタンを使用して、実際に注入された時間、アクティビティ、および量を挿入します。
- スキャン中は、動物の生理学的パラメータを定期的に確認してください。
- スキャン中に、手順2.2で説明されているように、PETスキャンの開始後5分、20分、40分、および60分の時点で血糖を測定します。
- 血糖の測定後、テストストリップをガンマカウンターに入れ、60秒間活性測定を行います。活動測定が行われた実際の時間を記録し、トレーサー注入時間を基準時間として放射性崩壊を補正します。グルコーステストストリップの平均血液量1 μLを考慮して、記録された活性値を活性濃度(Bq/mL)に変換します(つまり、式[1]を使用します)。
C血中 = A血液 (t)/0.001 mL [Bq/mL] (1)
ここで、A血液(t)は、テストストリップ内の血液サンプルの崩壊補正測定活性であり、Bqで表されます。
注:PETスキャンの開始とトレーサー注入は、注入中にオペレーターの部位に近いスキャナーの側面テーブルに配置された断層撮影装置のモバイル制御装置を使用して、同じオペレーターが実行できます。スキャン開始からインジェクションの開始までの遅延は長くなりますが、動的シーケンスの開始時に再構築されたフレームの一部は空白のままになります。10秒を超える遅延(つまり、現在のプロトコルで2つの空白フレームにつながる)を避けることをお勧めします。

図1:PETトレーサーの注入。 この操作は、PETスキャンの開始直後に実行されます。動物はPETの視野内にあります(頭を最初に、尾がオペレーター側に見えます)。略称:PET =陽電子放出断層撮影。 この図の拡大版を表示するには、ここをクリックしてください。
7.CTスキャン
- CT造影剤を注入する前に、スキャナーの蓋を閉じてGUIの 続行 ボタンを押した直後にCTACスキャンを開始します。この非常に短い取得の最後に、以下の手順を採用して、PETトレーサーの注入に使用されるのと同じ血管アクセスを使用して取得前にCAを注射することにより、血液プールの適切な増強を確実にします。
- ヨード化脂質エマルションCA:
- CTACスキャンの完了後、マウスの尾静脈にすでに接続されているカニューレを使用してヨウ素化脂質エマルジョンCAを注入します。典型的な注入時間は30〜60秒のオーダーです。
- 注入が完了した直後にイメージングを開始します。スキャナー GUI の [続行 ] を押して、Cine-CT の取得を開始します。
- イオメプロール/シリンジポンプ:
- イオメプロールなどの通常のX線CAを使用する場合は、一定の速度でゆっくりと注入できるシリンジポンプを使用してください。
- マウスの場合、注射量を0.5 mLに制限して、CAの注射速度を10 mL/h(~0.17 mL/分)に設定します。この設定では、~3分後に注入を停止します。ラットの場合、ポンプを24 mL / h(= 0.4 mL / min)の速度に設定し、注入量を2 mLに制限します。.この設定で、5分後に注入を停止します。
- CAチューブに取り付けられた針を尾静脈のカニューレに接続し、チューブと針の両方にCAが事前に充填されていることを確認します。
- 注射を開始します。スキャナーの蓋を閉めて、Cine-CTスキャンの準備をします。
- マウスの場合は注射開始から60秒後、ラットの場合は注射開始から90秒後に断層撮影のGUIの続行ボタンを押すと、Cine-CTの取得が開始されます。CAの注射は、マウスの場合はCine-CTスキャンの完了とほぼ同時に停止し、ラットの場合は完了時に停止します。
- ヨード化脂質エマルションCA:
- Cine-CTスキャンが完了したら、動物を生理学的モニタリングシステムから切り離し、尾静脈カニューレを取り外します。 実際のプロトコールに応じて、動物は、記載された画像化手順の後に回収または安楽死のいずれかである。最初のケースでは、動物は赤外線ランプの下の暖かい環境でケージ内で目覚めます。それらは完全に目覚めるまで監視され、ガス麻酔後15/30分かかります。例えば、イメージング手順の最後に組織を採取する必要があるプロトコルの場合、動物は、D.Lgs.26/2014の附属書VIに従って、誘導チャンバー(5%イソフルラン)で麻酔薬の過剰摂取を使用して安楽死させます。
注:このプロトコルで説明されている 18のFベースの放射性核種の場合、トレーサー注射の24時間は、すべての実用的な目的に安全な動物の体の残留放射能のレベルに達するのに十分です。
8. 内因性心肺ゲーティングを用いた心臓4DCT画像の再構成
注意: 画像検査が完了すると、標準のPETおよびCT再構成が自動的に実行されます。それにもかかわらず、4D(Cine)カーディオCTシーケンスの再構築は手動で実行する必要があり、ユーザーの操作が必要です。その後の形態機能心臓CT分析に必須のこの特別なタイプの再建については、このセクションで説明します。
- トモグラフのGUIの心臓同期モジュールを開き、解析する画像スタディを選択します。
- 表示された動物のX線写真(図2)で関心領域(ROI)を選択して、ゲーティング信号を表す時間依存の心運動曲線(キモグラム)を作成します。心臓の頂点と横隔膜の両方が選択されるように、事前に描画された長方形のROIを垂直に移動します。次に、 [ ゲーティング信号解析] を選択します。ユーザインターフェースには、時間領域と周波数領域の両方でゲーティング信号が表示されます。
- 最初の周波数領域グラフで、周波数スペクトルのピークの最初のグループを強調表示して呼吸周波数帯域を選択します(スペクトルの例については 図3 を参照してください)。
- 2番目の周波数領域グラフで、心臓運動周波数帯域を選択し、2番目に鋭いピークを強調表示します。
- 次のフェーズでは、カラーマーカー(ドット)を重ね合わせて時間領域ゲーティング信号を観察し、識別された呼吸ピークと心臓収縮ピークを示します。マーカーの位置が元のゲーティング信号の呼吸および心臓のピークとうまく適合する場合は、次のフェーズに進みます。然も無くば:
- ゲーティング信号の形状が 図3に表示されているものと大きく異なる場合は、手順8.2に戻り、別のROIを選択します。
- ゲーティング信号の形状が図3に示すものとかなり類似している場合は、ステップ 8.3とステップ8.4に戻り、ゲーティング信号スペクトルで異なる周波数帯域を選択します。
- 次のフェーズでは、少なくとも4つの心臓ゲートを選択します。
注:典型的なCine-CT再構成は、8〜12個の心臓ゲートで構成されています。 - ドロップダウンメニューを使用して適切な呼吸ウィンドウを選択します: 呼吸ウィンドウ| 20%-80%。
注:これにより、ピーク吸気の段階を除いて、再構成で取得したデータの60%が保持されるため、各心臓相で再建された心筋壁の鮮明さが向上します。 - 再構成を実行して、遡及的にゲートされたCine-CT画像をDICOM形式に変換し、後続の機能分析のためにソフトウェアにインポートできるようにします。
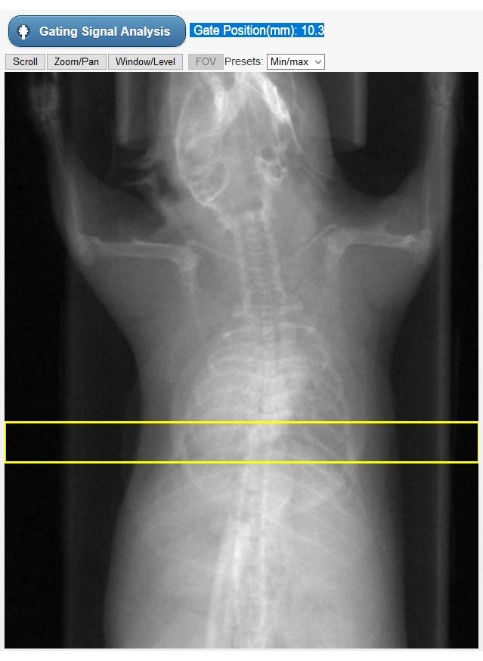
図2:組み込みゲーティングのROI選択ツール この画像は、Cine-CT再構成フェーズ中に断層撮影装置のGUIに表示されます。ユーザーは、生のCT投影から固有のゲーティング信号(カイモグラム)を取得するROI(黄色の長方形)の位置を選択する必要があります。動物の胸部に重ね合わされた円形の物体は、研究中の生理学的モニタリングにのみ使用される呼吸枕です。略語:ROI =関心領域。CT =コンピュータ断層撮影;GUI = グラフィカル ユーザー インターフェイス。 この図の拡大版を表示するには、ここをクリックしてください。
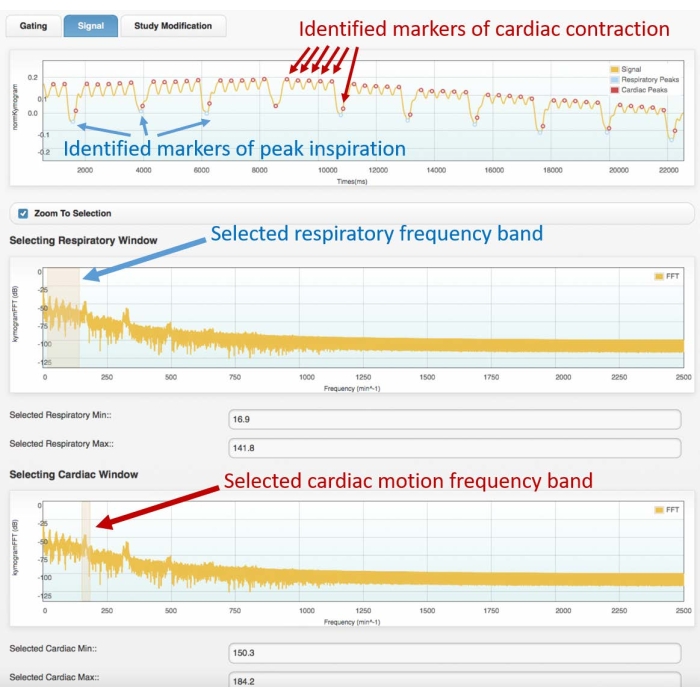
図3:ゲート信号の例(上のフレーム)と対応する周波数スペクトル(中央と下部)。 アトリウムソフトウェアの心臓同期モジュールで得られた画像。ユーザーは、呼吸(センターフレーム)と心臓運動(下部フレーム)の両方に適切な周波数帯域を選択する必要があります。これにより、ゲーティング信号上の呼吸器マーカーと心臓マーカーの識別が可能になり、4D再構成を進める前にユーザーが確認する必要があります。ピークの識別不良または誤った割り当て(例:.、呼吸器から心臓へ、またはその逆)は、誤った再建につながります。示されているデータは、健康な成体の雄のWistarラット(507 g)に2 mLのイオメプロール、200 mg / mLを0.4 mL / minの速度で5分間注射した4D Cine-CTスキャンの分析から得られたものです(上のグラフは、識別された心臓と呼吸の動きをよりよく視覚化できるように、取得の最初の22秒でズームインされています)。略語:CT =コンピュータ断層撮影。 この図の拡大版を表示するには、ここをクリックしてください。
9.PET心臓分析
注:このセクションでは、小動物の左心室の動的[18F]FDGデータの速度論的分析を実行する方法を示します。分析はカリマスソフトウェアに基づいています。以下の手順は、ソフトウェアユーザーマニュアル17に代わるものではありません。以下に提示する手順は、動的PETデータ18のPatlakグラフィカル分析に基づいている。この分析の詳細については、「ディスカッション」セクションを参照してください。
- ダイナミックPETスキャンのDICOM画像を開きます。
- ハートプラグインモジュールを選択します。
- マウス/ラットの心臓の画像を拡大し、血液プール活動のほとんどがすでに洗い流されている最後の時間枠(または同等に、最後の3〜5つの時間枠の合計)を選択します。
- 画面の指示に従って、動物の心臓の主軸(短軸、垂直、水平長軸)に沿って画像の向きを変更します。心臓の基部と頂点に表示されたマーカーを動かして、これをインタラクティブに行います(図4)。
- セグメンテーションツールを選択します。
注: デフォルトでは、自動セグメンテーションが有効になっており、ほとんどの場合、信頼性の高い結果が得られます。 - 自動セグメンテーションの結果が受け入れられない場合は、 手動モード (ROI検索無効)を有効にして、セグメント化された心筋および/またはLV腔の形状を調整してください。
- モデリングツールで、動的PET解析に使用する適切なキネティックモデルを選択します。この場合は、[グラフィカル |パトラックは、各心臓セクターのグルコース取り込みの代謝率(MRGlu)を計算するためのパトラックプロット分析を可能にします。
- ポーラマップツールで、表示される心臓セグメントの正しい数を選択します。この場合、17 個のセグメントを選択します。
- 次に、[フィット]ボタンを押して、Patlak解析の フィット 手順を実行します。
- フィッティング手順の最後に、表示されたKi 値の極座標マップ(つまり、線形回帰の傾きをmL/[mL × min]で表します)。
- 表に示されている各セクターのKi値を使用して、式 (2) を使用してMRGluを計算します。
MRGlu = (Ki × PGlu)/LC (2)
ここで、PGlu は血漿グルコース濃度(mmol / L)の血液サンプル由来の値であり、集中定数(LC)は、正常なグルコースとFDGの取り込みの差を補償するために使用される経験係数です。例えば、様々な実験条件における集中定数の典型的な値については、Ngら22 を参照されたい。
注意: PET分析を開始する前に、PET分析ソフトウェアツール内でPETボリュームの動的シーケンスを視覚的に検査することをお勧めします。これは、研究中の時間枠間の巨視的な動物の動きを除外するために必要です。動きが存在する場合は、可能であれば、分析前に適切な画像登録(このプロトコルの範囲外)を実行する必要があります。
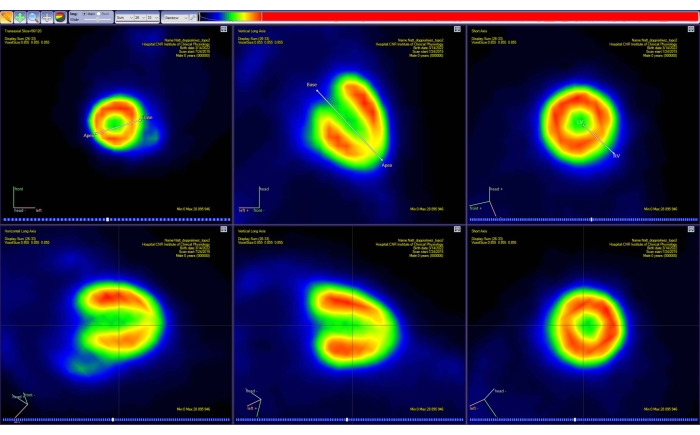
図4:PET分析ソフトウェアの方向転換ツール。 3D 空間における 2 つの単純な線分の投影は、3 つの標準平面 (経軸、冠状、矢状) のそれぞれに表示されます。最初のセグメントでは、ユーザーは心臓の基部と頂点を選択でき、2番目のセグメントでは心臓の左側と右側を選択できます。このステップにより、新しい(補間された)PET画像(下の行)が作成され、心臓は標準のAHA表現に沿って再配置されます。画像は、体重51 gの健康な成人男性CD-1マウスからカリマスで取得され、10 MBqの[18F]FDGを注射しました。略語:PET =陽電子放出断層撮影;AHA = アメリカ心臓協会;FDG =フルオロデオキシグルコース。 この図の拡大版を表示するには、ここをクリックしてください。
10.シネCT心臓分析
注:このセクションでは、Cine-CT心臓画像の定量分析を実行して、心機能のグローバルな定量データを収集する方法を示します。分析はOsirix MDソフトウェアに基づいています。以下の手順は、Osirixユーザーマニュアル24に代わるものではありません。
- Cine-CTスキャンのDICOM画像をソフトウェアにロードします。
- ビルトインの4Dビューアで動的データセットを開きます。
- 3D多面変形(MPR)ツールを使用して、短軸に沿って画像データの向きを変更します(図5)。
- 方向を変えたデータをDICOMにエクスポートし、スライスの厚さ(オリジナルと同じ)と画像のビット深度(ボクセルあたり16ビット)を維持しながら、4Dデータ全体がエクスポートされるようにします。
- エクスポートされた4D MPR画像を4Dビューアで開きます。
- 拡張末期に対応する時間枠を選択します。メインツールバーのタイムスライダーですべての時間枠を参照し、正しい心相が選択されていることを確認します。
- この時間枠で、 閉じたポリゴン注釈 ツールを選択し、LVの心内膜壁を手動で描写します。
- ベースから頂点までの10〜20スライスについても同じことを行い、すべてのROIが同じ名前になるようにします(LVENDOなど)。
- ROI メニュー で、 ROI ボリューム |不足 しているROIを生成して、手動で描画されたROIの補間によってすべての短軸スライスのROIを生成します。
- ROI メニュー で、 ROI ボリューム |[ボリュームの計算 ] を使用して、同じ ROI 名を持つ ROI グループのボリュームを計算します。
- 時間枠を参照し、収縮末期(より小さなLVボリューム)に対応するフェーズを選択し、上記の手順10.7〜10.10を繰り返します。
- 式(3)と式(4)を使用して、ストロークボリューム(SV)と駆出率を計算します。
SV = EDV - ESV[mL] (3)
EF = 100 × SV/EDV [%] (4)
ここで、EDVは拡張末期容積、ESVは収縮末期容積です。
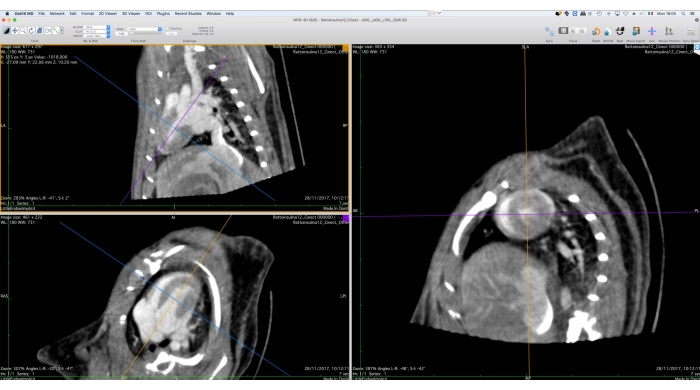
図5:多面変形ツールのグラフィカルインターフェイス。 このツールは、後続の機能分析のためにCine-CTデータの方向を変更するために使用されます。ユーザーは、心臓の短軸ビューが右側に表示されるように、画面の左側にある参照軸を回転および移動する必要があります。この手順の最後に、ユーザーは方向を変えたイメージを DICOM ファイル・セットとしてエクスポートできます。画像はOsirix MDで取得され、健康な成体雄のWistarラット(507 g)に2 mLのイオメプロール、200 mg / mLを0.4 mL / minの速度で5分間注射し、ボクセルサイズ0.24 mm3のフィルターバックプロジェクションで再構築したものです。 この図の拡大版を表示するには、ここをクリックしてください。
結果
このセクションでは、これまでに説明した手順に従って、PET分析とCT分析の両方の典型的な結果を示します。 図6 は、対照(健常)CD-1マウスの[18F]FDG PETスキャンの自動心筋およびLV腔セグメンテーションの結果を示す。再構成された画像では右心室が常に見えるとは限りませんが、DICOMヘッダーに基づく方向軸を使用して、米国心臓協会(AHA)の推奨事項に従って標準...
ディスカッション
この論文で提示されたプロトコルは、高解像度PET / CTイメージングを使用した、心臓損傷の小動物モデルでのトランスレーショナル心血管研究の典型的な実験手順に焦点を当てています。提示された結果は、PETおよびCine-CT画像の高い定量的および定性的価値を示しており、その糖代謝、形状、およびその収縮のダイナミクスに関する心臓全体の機能的および構造的情報の両方を提供します。?...
開示事項
ダニエレ・パネッタは、Inviscan SasからマイクロCT装置の研究開発のための助成金を受け取りました。
謝辞
この研究の一部は、JPI-HDHL-INTIMIC "GUTMOM"プロジェクト:子孫の母親の肥満と認知機能障害:GUT微生物の因果関係の役割と早期食予防(プロジェクト番号。 INTIMIC-085、イタリア教育省、大学および研究政令第946/2019号)。
資料
| Name | Company | Catalog Number | Comments |
| 0.9% sterile saline | Fresenius Kabi | 0.9% sodium chloride for injection | |
| 1025L Physiological Monitoring | Small Animal Instruments | Physiological monitoring system for small animal imaging | |
| 5 mL syringes | Artsana | Syringes with needle for injection of PET tracer | |
| Atomlab 500 | Else Nuclear | PET Dose calibrator | |
| Atrium software | Inviscan | Version 1.5.5 | PET/CT operating software |
| Butterfly catheters | Delta Med | 27.5 G needle | |
| Carimas software | Turku PET Center | Version 2.10 | Image analysis software |
| Fenestra VC | Medilumine | Lipid emulsion iodinated contrast agent for small animals | |
| Heat lamp | Heat lamp with clamp and switch | ||
| Insulin syringes | Artsana | Syringes with needle for injection of CT CA | |
| Iomeron 400 mgI/mL | Bracco | Iomeprol, vascular contrast agent | |
| IRIS PET/CT | Inviscan | PET/CT scanner for small animals | |
| Isoflurane | Zoetis | Inhalation anesthetic, 250 mL | |
| OneTouch Glucometer | Johnson&Johnson Medical | Glucose meter kit | |
| Osirix MD software | Pixmeo | Version 11 | Image analysis software |
| Oxygen | Air liquide | Compressed gas | |
| Rectal probe for 1025L | Small Animal Instruments | Rectal probe with cable for SAII 1025L systems | |
| Respiratory sensor for 1025L | Small Animal Instruments | Respiratory pillow with tubings for SAII 1025L systems | |
| TJ-3A syringe pump | Longer | Motorized syringe pump for CT CA injection |
参考文献
- Zaragoza, C. Animal models of cardiovascular diseases. Journal of Biomedicine and Biotechnology. 2011, 497841 (2011).
- Russell, J. C., Proctor, S. D. Small animal models of cardiovascular disease: Tools for the study of the roles of metabolic syndrome, dyslipidemia, and atherosclerosis. Cardiovascular Pathology. 15 (6), 318-330 (2006).
- Riehle, C., Bauersachs, J. Small animal models of heart failure. Cardiovascular Research. 115 (13), 1838-1849 (2019).
- Menichetti, L., et al. MicroPET/CT imaging of αvß3 integrin via a novel 68Ga-NOTA-RGD peptidomimetic conjugate in rat myocardial infarction. European Journal of Nuclear Medicine and Molecular Imaging. 40 (8), 1265-1274 (2013).
- Zhou, H., et al. Development of a micro-computed tomography-based image-guided conformal radiotherapy system for small animals. International Journal of Radiation Oncology, Biology, Physics. 78 (1), 297-305 (2010).
- Di Lascio, N., Kusmic, C., Stea, F., Faita, F. Ultrasound-based pulse wave velocity evaluation in mice. Journal of Visualized Experiments. (120), e54362 (2017).
- Dann, M. M., et al. Quantification of murine myocardial infarct size using 2-D and 4-D high-frequency ultrasound. American Journal of Physiology-Heart and Circulatory Physiology. 322 (3), 359-372 (2022).
- Espe, E. K. Novel insight into the detailed myocardial motion and deformation of the rodent heart using high-resolution phase contrast cardiovascular magnetic resonance. Journal of Cardiovascular Magnetic Resonance. 15 (1), 82 (2013).
- Vanhove, C., et al. Accurate molecular imaging of small animals taking into account animal models, handling, anaesthesia, quality control and imaging system performance. EJNMMI Physics. 2 (1), 31 (2015).
- Garcia, M. J., et al. State of the art: Imaging for myocardial viability: A scientific statement from the American Heart Association. Circulation: Cardiovascular Imaging. 13 (7), 000053 (2020).
- Panetta, D., et al. Cardiac computed tomography perfusion: Contrast agents, challenges and emerging methodologies from preclinical research to the clinics. Academic Radiology. 28 (1), 1-18 (2020).
- Kusmic, C. Up-regulation of heme oxygenase-1 after infarct initiation reduces mortality, infarct size and left ventricular remodeling: experimental evidence and proof of concept. Journal of Translational Medicine. 12 (1), 89 (2014).
- Muthuramu, I., Lox, M., Jacobs, F., De Geest, B. Permanent ligation of the left anterior descending coronary artery in mice: A model of post-myocardial infarction remodelling and heart failure. Journal of Visualized Experiments. (94), e52206 (2014).
- Fischer, M., et al. Comparison of metabolic and functional parameters using cardiac 18F-FDG-PET in early to mid-adulthood male and female mice. EJNMMI Research. 11 (1), 7 (2021).
- Valenta, I., et al. Feasibility evaluation of myocardial cannabinoid type 1 receptor imaging in obesity: A translational approach. JACC: Cardiovascular Imaging. 11 (2), 320-332 (2018).
- Fueger, B. J., et al. Impact of animal handling on the results of 18F-FDG PET studies in mice. Journal of Nuclear Medicine. 47 (6), 999-1006 (2006).
- . Carimas User Manual Available from: https://turkupetcentre.fl/carimas/files/archive/Html/a1.html (2022)
- Peters, A. M. Graphical analysis of dynamic data: The Patlak-Rutland plot. Nuclear Medicine Communications. 15 (9), 669-672 (1994).
- Choi, Y., et al. Parametric images of myocardial metabolic rate of glucose generated from dynamic cardiac PET and 2-[18F]fluoro-2-deoxy-d-glucose studies. Journal of Nuclear Medicine. 32 (4), 733-738 (1991).
- Laffon, E., Marthan, R. Is Patlak y-intercept a relevant metrics. European Journal of Nuclear Medicine and Molecular Imaging. 48 (5), 1287-1290 (2021).
- Flores, J. E., McFarland, L. M., Vanderbilt, A., Ogasawara, A. K., Williams, S. -. P. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: Sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192-200 (2008).
- Ng, C. K. Sensitivity of myocardial fluorodeoxyglucose lumped constant to glucose and insulin. American Journal of Physiology-Heart and Circulatory Physiology. 260 (2), 593-603 (1991).
- Shoghi, K. I., Welch, M. J. Hybrid image and blood sampling input function for quantification of small animal dynamic PET data. Nuclear Medicine and Biology. 34 (8), 989-994 (2007).
- Heuberger, J., Pixmeo, S., Rosset, A. OsiriX User Manual. Blurb. , (2017).
- Cerqueira, M. D., et al. Standardized myocardial segmentation and nomenclature for tomographic imaging of the heart. A statement for healthcare professionals from the Cardiac Imaging Committee of the Council on Clinical Cardiology of the American Heart Association. Circulation. 105 (4), 539-542 (2002).
- Kolanowski, T. J., et al. Multiparametric evaluation of post-MI small animal models using metabolic ([18F]FDG) and perfusion-based (SYN1) heart viability tracers. International Journal of Molecular Sciences. 22 (22), 12591 (2021).
- Guiducci, L., et al. Contribution of organ blood flow, intrinsic tissue clearance and glycaemia to the regulation of glucose use in obese and type 2 diabetic rats: A PET study. Nutrition Metabolism and Cardiovascular Diseases. 21 (9), 726-732 (2011).
- Tadinada, S. M., et al. Functional resilience of C57BL/6J mouse heart to dietary fat overload. American Journal of Physiology-Heart and Circulatory Physiology. 321 (5), 850-864 (2021).
- Dreyfuss, A. D., et al. A novel mouse model of radiation-induced cardiac injury reveals biological and radiological biomarkers of cardiac dysfunction with potential clinical relevance. Clinical Cancer Research. 27 (8), 2266-2276 (2021).
- Hsu, B. PET tracers and techniques for measuring myocardial blood flow in patients with coronary artery disease. Journal of Biomedical Research. 27 (6), 452-459 (2013).
- Dinkel, J., et al. Intrinsic gating for small-animal computed tomography. Circulation: Cardiovascular Imaging. 1 (3), 235-243 (2008).
- Kuntz, J., et al. Fully automated intrinsic respiratory and cardiac gating for small animal CT. Physics in Medicine and Biology. 55 (7), 2069-2085 (2010).
- Li, Y., Zhang, W., Wu, H., Liu, G. Advanced tracers in PET imaging of cardiovascular disease. BioMed Research International. 2014, 504532 (2014).
- Kim, D. -. Y., Cho, S. -. G., Bom, H. -. S. Emerging tracers for nuclear cardiac PET imaging. Nuclear Medicine and Molecular Imaging. 52 (4), 266-278 (2018).
- Maddahi, J., Packard, R. R. S. Cardiac PET perfusion tracers: Current status and future directions. Seminars in Nuclear Medicine. 44 (5), 333-343 (2014).
- Bentourkia, M. Kinetic modeling of PET data without blood sampling. IEEE Transactions on Nuclear Science. 52 (3), 697-702 (2005).
- Lammertsma, A. A. Forward to the past: The case for quantitative PET imaging. Journal of Nuclear Medicine. 58 (7), 1019-1024 (2017).
- Nahrendorf, M., et al. High-resolution imaging of murine myocardial infarction with delayed-enhancement cine micro-CT. American Journal of Physiology-Heart and Circulatory Physiology. 292 (6), 3172-3178 (2007).
- Badea, C. T., Fubara, B., Hedlund, L. W., Johnson, G. A. 4-D micro-CT of the mouse heart. Molecular Imaging. 4 (2), 110-116 (2005).
- Technical Resources. MediLumine Available from: https://www.medilumine.com/technical-resources (2019)
- Nebuloni, L., Kuhn, G. A., Müller, R. A Comparative analysis of water-soluble and blood-pool contrast agents for in vivo vascular imaging with micro-CT. Academic Radiology. 20 (10), 1247-1255 (2013).
- Panetta, D., et al. Performance evaluation of the CT component of the IRIS PET/CT preclinical tomograph. Nuclear Instruments & Methods in Physics Research Section A: Accelerators Spectrometers Detectors and Associated Equipment. 805, 135-144 (2016).
- Gu, J., et al. At what dose can total body and whole abdominal irradiation cause lethal intestinal injury among C57BL/6J mice. Dose-Response. 18 (3), 1559325820956783 (2020).
- Amirrashedi, M., Zaidi, H., Ay, M. R. Advances in preclinical PET instrumentation. PET Clinics. 15 (4), 403-426 (2020).
- Clark, D. P., Badea, C. T. Advances in micro-CT imaging of small animals. Physica Medica. 88, 175-192 (2021).
- Belcari, N., Del Guerra, A., Panetta, D., Grupen, C., Buvat, I. High-Resolution and Animal Imaging Instrumentation and Techniques. Handbook of Particle Detection and Imaging. , 1497-1535 (2021).
- Wang, G., Rahmim, A., Gunn, R. N. PET Parametric imaging: Past, present, and future. IEEE Transactions on Radiation and Plasma Medical Sciences. 4 (6), 663-675 (2020).
- Befera, N. T., Badea, C. T., Johnson, G. A. Comparison of 4D-microSPECT and microCT for murine cardiac function. Molecular Imaging and Biology. 16 (2), 235-245 (2014).
- van Deel, E., Ridwan, Y., van Vliet, J. N., Belenkov, S., Essers, J. In vivo quantitative assessment of myocardial structure, function, perfusion and viability using cardiac micro-computed tomography. Journal of Visualized Experiments. (108), e53603 (2016).
- Lee, C. -. L., et al. Assessing cardiac injury in mice with dual energy-microCT, 4D-microCT and microSPECT imaging following partial-heart irradiation. International Journal of Radiation Oncology, Biology, Physics. 88 (3), 686-693 (2014).
- Harms, H., et al. Comparison of clinical non-commercial tools for automated quantification of myocardial blood flow using oxygen-15-labelled water PET/CT. European Heart Journal - Cardiovascular Imaging. 15 (4), 431-441 (2013).
- Nesterov, S. V., et al. Myocardial perfusion quantitation with 15O-labelled water PET: High reproducibility of the new cardiac analysis software (CarimasTM). European Journal of Nuclear Medicine and Molecular Imaging. 36 (10), 1594-1602 (2009).
- Nesterov, S. V., et al. Myocardial perfusion quantification with Rb-82 PET: Good interobserver agreement of Carimas software on global, regional, and segmental levels. Annals of Nuclear Medicine. 36, 507-514 (2022).
- Nesterov, S. V., et al. One-tissue compartment model for myocardial perfusion quantification with N-13 ammonia PET provides matching results: A cross-comparison between Carimas, FlowQuant, and PMOD. Journal of Nuclear Cardiology. , (2021).
- Thackeray, J. T., Kuntner-Hannes, C., Haemisch, Y. Preclinical Multimodality Imaging and Image Fusion in Cardiovascular Disease. Image Fusion in Preclinical Applications. , 161-181 (2019).
- Vohra, R., Batra, A., Forbes, S. C., Vandenborne, K., Walter, G. A. Magnetic resonance monitoring of disease progression in mdx mice on different genetic backgrounds. The American Journal of Pathology. 187 (9), 2060-2070 (2017).
- Baehr, A., et al. Agrin promotes coordinated therapeutic processes leading to improved cardiac repair in pigs. Circulation. 142 (9), 868-881 (2020).
- Lalwani, K., et al. Contrast agents for quantitative microCT of lung tumors in mice. Comparative Medicine. 63 (6), 482-490 (2013).
- Bertoldo, A., et al. Evaluation of compartmental and spectral analysis models of [18F]FDG kinetics for heart and brain studies with PET. IEEE Transactions on Bio-medical Engineering. 45 (12), 1429-1448 (1998).
- Li, Y., Kundu, B. K. An improved optimization algorithm of the three-compartment model with spillover and partial volume corrections for dynamic FDG PET images of small animal hearts in vivo. Physics in Medicine and Biology. 63 (5), 055003 (2018).
- Mabrouk, R., Dubeau, F., Bentourkia, M., Bentabet, L. Extraction of time activity curves from gated FDG-PET images for small animals' heart studies. Computerized Medical Imaging and Graphics. 36 (6), 484-491 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved