A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
التحضير والتقييم الهيكلي للطبقات الأحادية للخلايا الظهارية في جهاز زراعة الموائع الدقيقة بحجم فسيولوجي
In This Article
Summary
يصف البروتوكول المقدم تطوير واستخدام تقنية تلطيخ الأكتين الخيطي القائم على الفالويدين مع مجهر المسح بالليزر متحد البؤر (CLSM) لتصور بنية طبقة الخلية الملتصقة في قنوات الثقافة الديناميكية للسوائع الدقيقة وغرف الاستزراع الثابتة التقليدية للبئر الثابت. يساعد هذا النهج في تقييم التقاء طبقة الخلية ، وتكوين الطبقة الأحادية ، وتوحيد سمك الطبقة.
Abstract
تحمل تجارب الموائع الدقيقة في المختبر إمكانات كبيرة للكشف عن العديد من الأفكار حول الظواهر الفسيولوجية الدقيقة التي تحدث في حالات مثل متلازمة الضائقة التنفسية الحادة (ARDS) وإصابة الرئة التي يسببها جهاز التنفس الصناعي (VILI). ومع ذلك ، فإن الدراسات في قنوات الموائع الدقيقة ذات الأبعاد الفسيولوجية ذات الصلة بالقصيبات الطرفية للرئة البشرية تواجه حاليا العديد من التحديات ، خاصة بسبب الصعوبات في إنشاء ظروف زراعة الخلايا المناسبة ، بما في ذلك معدلات تدفق الوسائط ، داخل بيئة مزرعة معينة. يصف البروتوكول المقدم نهجا قائما على الصور لتقييم بنية الخلايا الظهارية الرئوية البشرية NCI-H441 المزروعة في قناة الموائع الدقيقة غير المنفذة للأكسجين بأبعاد ذات صلة فسيولوجية بالقصيبات الطرفية للرئة البشرية. باستخدام تلطيخ الأكتين الخيطي القائم على الفالويدين ، يتم الكشف عن الهياكل الهيكلية الخلوية للخلايا بواسطة الفحص المجهري بالليزر متحد البؤر ، مما يسمح بتصور الخلايا الفردية وكذلك الطبقات. يحدد القياس الكمي اللاحق ما إذا كانت ظروف زراعة الخلايا المستخدمة تنتج طبقات أحادية موحدة مناسبة لمزيد من التجارب. يصف البروتوكول زراعة الخلايا وطرق تقييم الطبقة في قنوات الموائع الدقيقة وبيئات الآبار الثابتة التقليدية. وهذا يشمل بناء القناة ، وزراعة الخلايا والظروف المطلوبة ، والتثبيت ، والنفاذية والتلوين ، والتصوير المجهري متحد البؤر ، ومعالجة الصور ، وتحليل البيانات.
Introduction
متلازمة الضائقة التنفسية الحادة (ARDS) هي حالة حادة تنشأ عن إهانة وانتشار الإصابة في حمة الرئة ، مما يؤدي إلى وذمة رئوية في الحويصلات الهوائية ، وعدم كفاية تبادل الغازات ، ونقص الأكسجة اللاحق1. هذا يبدأ دورة من إطلاق السيتوكين المؤيد للالتهابات ، وتجنيد العدلات ، وإطلاق الوسيط السام ، وتلف الأنسجة ، والذي يؤدي في حد ذاته إلى مزيد من الاستجابة الالتهابية2. بالإضافة إلى ذلك ، قد يتم تعطيل الفاعل بالسطح الرئوي ، الذي يعمل على استقرار الشعب الهوائية ويمنع الضرر الناجم عن التوظيف / إلغاء التوظيف المتكرر (R / D) ، أو جعله مختلا وظيفيا بسبب العمليات الكيميائية التي تحدث أثناء متلازمة الضائقة التنفسية الحادة ، مما يؤدي إلى مزيد من الإجهاد والإصابة في الحمة المحيطة3. في حالة حدوث ضرر كاف ، قد تكون التهوية الميكانيكية ضرورية لضمان الأوكسجين الجهازي الكافي4. ومع ذلك ، تفرض التهوية الميكانيكية تحدياتها وصدماتها الخاصة ، بما في ذلك إمكانية إصابة الرئة التي يسببها جهاز التنفس الصناعي (VILI) ، والتي تتميز بأنها إصابة لحمة الرئة بسبب الضغوط الميكانيكية المفروضة أثناء التضخم المفرط (الصدمة الزائدة) و / أو R / D لواجهة الهواء والسائل في مجرى الهواء المغلق بالسوائل (atelectrauma)5. يمكن أن يؤدي تدرج الضغط الذي تعاني منه الخلايا الظهارية المعرضة لواجهة الهواء والسائل (كما هو الحال في القصيبات الهوائية المسدودة بالسائل) في نموذج atelectrauma إلى استجابة انسداد ناشئة عن النفاذية (POOR) ، مما يؤدي إلى دورة حميدة من الإصابة6،7،8.
يمكن أن توفر التجارب في المختبر رؤى على نطاق صغير لهذه الظواهر ، لكن الدراسات الحالية في بيئات قنوات الموائع الدقيقة ذات الأبعاد ذات الصلة من الناحية الفسيولوجية تواجه العديد من التحديات9. أولا ، يشكل تحسين ظروف زراعة الخلايا حاجزا كبيرا أمام الدخول لأبحاث زراعة الخلايا في بيئات الموائع الدقيقة ، حيث يوجد تقاطع ضيق تسمح فيه معلمات تدفق الوسائط ومدة الثقافة وظروف الثقافة الأخرى بتكوين طبقة الخلية المثلى. وهذا يشمل قيود الانتشار التي تفرضها الطبيعة غير المنفذة للأكسجين لحاوية قناة ثقافة الموائع الدقيقة. وهذا يستلزم دراسة متأنية لمعلمات تدفق الوسائط ، حيث أن معدلات التدفق المنخفضة يمكن أن تحرم الخلايا من الأكسجين ، خاصة تلك الأبعد عن المدخل ؛ من ناحية أخرى ، يمكن أن تدفع معدلات التدفق العالية الخلايا خارج قناة الثقافة أو تؤدي إلى تطور طبقة غير لائق أو غير متساو. ويمكن معالجة قيود الانتشار باستخدام مواد منفذة للأكسجين مثل بوليديميثيل سيلوكسان (PDMS) في جهاز استزراع السطح البيني بين الهواء والسائل (ALI)؛ ومع ذلك ، فإن العديد من قنوات زراعة الموائع الدقيقة التقليدية ، مثل تلك الخاصة بنظام استشعار مقاومة الخلايا الخلوية الكهربائية (ECIS) ، غير منفذة للأكسجين بطبيعتها ، نظرا لطبيعة العلبة المصنعة10. يهدف هذا البروتوكول إلى توفير تقنية لتحليل طبقات الخلايا المزروعة في حاوية غير منفذة للأكسجين.
عند مقارنة صلاحية ظروف الاستزراع، فإن ملاحظات خصائص طبقة محددة، مثل وجود طبقة أحادية، وطوبولوجيا السطح، والتلاقي، وتوحيد سمك الطبقة، ضرورية لتحديد ما إذا كانت طبقة الخلية التي تنتجها مجموعة معينة من ظروف الاستزراع تفي بالمواصفات المطلوبة وذات صلة بالفعل بالتصميم التجريبي. يمكن إجراء تقييم محدود بطرق مثل ECIS ، والتي تستخدم قياسات الجهد الكهربائي (الجهد) الناتج عن مقاومة التيار المتردد عالي التردد (AC) (المعاوقة) التي تفرضها الأغشية العازلة كهربائيا للخلايا المزروعة على أقطاب ذهبية داخل مجموعة التدفق. من خلال تعديل تردد التيار المتردد المطبق على الخلايا ، يمكن استهداف وفحص الخصائص الخلوية المحددة المعتمدة على التردد للخلايا وطبقات الخلايا مثل قوة التصاق السطح ، وتشكيل الوصلة الضيقة ، وتكاثر الخلايا أو التقائها11. ومع ذلك ، يصعب إلى حد ما تفسير هذه الأشكال غير المباشرة من القياسات في بداية التجربة ، وقد لا تحدد جميع الجوانب ذات الصلة بطبقة الخلية. إن مجرد مراقبة طبقة الخلية تحت مجهر تباين الطور قد يكشف عن طبيعة صفات معينة مثل التقارب. ومع ذلك ، فإن العديد من الخصائص ذات الصلة مثل وجود توحيد أحادي الطبقة وسمك الطبقة تتطلب تقييما ثلاثي الأبعاد (3D) غير ممكن مع التصوير المجهري الساطع أو تباين الطور أو التصوير المجهري الفلوري12.
كان الهدف من هذه الدراسة هو تطوير تقنية تلطيخ الأكتين الخيطي للسماح بالتحقق القائم على التصوير لطبقة أحادية وتقييم توحيد طبقة الخلية باستخدام مجهر المسح بالليزر متحد البؤر (CLSM). اعتبر الأكتين الخيطي (F-actin) هدفا مناسبا لاقتران الفلوروفور ، ويرجع ذلك جزئيا إلى الطريقة التي يتبع بها F-actin غشاء الخلية بإحكام ، مما يسمح بتقريب بصري لحجم الخليةبأكمله 13. فائدة أخرى مهمة لاستهداف F-actin هي الطريقة التي يوضح بها تلطيخ F-actin بصريا الاضطرابات أو التغيرات الهيكلية الخلوية التي تفرضها الضغوط والسلالات التي تعاني منها الخلايا. تم استخدام التثبيت المتشابك مع الفورمالديهايد الخالي من الميثانول للحفاظ على مورفولوجيا الخلايا وطبقة الخلية ، حيث تميل مثبتات التجفيف مثل الميثانول إلى تسطيح الخلايا ، مما يؤدي إلى تشويه طبقة الخلية بشكل كبير وتغيير خصائصها14,15.
لتحديد قدرة تقنية تقييم الطبقة على التخفيف من هذه التحديات ، تم استزراع الخلايا في غرف زراعة تقليدية من ثمانية آبار وكذلك في قنوات الموائع الدقيقة لتقييم الاختلافات ، إن وجدت ، في طبقات الخلايا التي تم إنتاجها. بالنسبة لآبار الاستزراع الثابتة ، تم استخدام وحدات زجاجية ذات ثماني غرف جيدة. بالنسبة لثقافة الموائع الدقيقة ، تم تحسين صفائف التدفق (طول القناة 50 مم ، العرض 5 مم ، العمق 0.6 مم) لزراعة الخلايا الظهارية للرئة البشرية (NCI-H441) في بيئة ذات أبعاد ذات صلة فسيولوجية بالقصيبات الطرفية الموجودة في المنطقة التنفسية للرئة البشرية16. في حين تم تطوير هذا البروتوكول مع وضع بيئة الاستزراع لمصفوفات تدفق ECIS في الاعتبار ، فقد ينطبق على أي بيئة ثقافة ديناميكية غير منفذة للأكسجين والتي يكون من الضروري تقييم خصائص طبقة الخلايا المستزرعة أو ظروف الاستزراع.
Protocol
تم استخدام خط خلايا الرئة الظهارية البشرية NCI-H441 في الدراسة الحالية (انظر جدول المواد).
1. زراعة الخلايا في قناة الموائع الدقيقة
- قم بتصنيع قناة الموائع الدقيقة وقم بإجراء المعالجة المسبقة باتباع الخطوات أدناه.
- احصل على صفيف تدفق أحادي القناة (انظر جدول المواد) وافصل الجزء العلوي عن لوحة قاعدة البولي كربونات.
- احصل على غطاء زجاجي مستطيل # 1.5 (سمك 0.17 مم) بأبعاد 60 مم × 22 مم. نظف أسطح الغطاء الزجاجي في حمام بالموجات فوق الصوتية وعالج جانبا واحدا بمحلول 0.1 مجم / مل من Poly-D-Lysine في درجة حرارة الغرفة لمدة 5 دقائق قبل التجفيف عند 60 درجة مئوية لمدة 30 دقيقة.
- قم بتثبيت مادة لاصقة على الوجهين بسمك 0.13 مم (انظر جدول المواد) ، مقطوعة بالليزر لاستيعاب أبعاد سطح صفيف التدفق وقناة التدفق (طول 50 مم ، عرض 5 مم) ، على قمة صفيف التدفق ، مع الحرص على محاذاة فتحات القناة بدقة17.
- قم بتثبيت فاصل مايلر بسمك 0.1 مم (انظر جدول المواد) ، مقطوع بالليزر لاستيعاب أبعاد قمة صفيف التدفق وقناة التدفق ، على الشريط اللاصق ، مع الحرص على محاذاة فتحات القناة بدقة.
- كرر الخطوتين 1.1.3 و 1.1.4 حتى يتم تحقيق ارتفاع القناة المطلوب (على سبيل المثال ، لارتفاع قناة 0.6 مم ، استخدم فواصل وثلاثة شرائط لاصقة).
- قم بتثبيت غطاء زجاجي مستطيل على الشريط اللاصق السفلي مع مواجهة الجانب المعالج ب Poly-D-Lysine للمادة اللاصقة. بعد اكتمال التجميع ، كما هو موضح في الشكل 1 ، قم بتطبيق ضغط ثابت ومتساو على الجزء العلوي والسفلي من البناء مع الاستمرار لمدة دقيقة واحدة.
ملاحظة: اكتمل الآن بناء حاوية القناة ، بما في ذلك غطاء زجاجي ، ومواد لاصقة ، وفواصل ، وأعلى صفيف التدفق. - شطف القناة بالماء غير المتأين باستخدام حقنة ، والتحقق في وقت واحد من وجود تسرب.
- تعقيم حاوية القناة في معقم الأشعة فوق البنفسجية (UV) لمدة 30 دقيقة18.
- باستخدام تقنية معقمة، عالج القناة ب 2.0 ميكروغرام/مل من الفبرونيكتين البشري (انظر جدول المواد) في محلول ملحي مخزن بالفوسفات (PBS) واحتضانه لمدة 30 دقيقة على الأقل عند 37 درجة مئوية19.
- قم بإجراء زراعة الخلايا في قناة الموائع الدقيقة باتباع الخطوات أدناه.
- في غطاء التدفق الصفحي المعقم ، استخدم ماصة دقيقة لنقل تعليق متساو لخلايا NCI-H441 في وسط RPMI 1640 مع مصل بقري جنيني بنسبة 10٪ (FBS) (انظر جدول المواد) لزرع قناتين من الموائع الدقيقة ، لكل منهما خلايا بكثافة سطح 150000 خلية / سم2.
- بالنسبة للقنوات مقاس 50 مم × 5 مم × 0.6 مم ، استخدم 0.25 مل من تعليق 2.5 × 106 خلايا / مل لملء كل قناة ، بالإضافة إلى جزء من المنافذ. تحقق من توزيع الخلايا بالتساوي داخل القنوات باستخدام مجهر برايتفيلد.
- استزرع القناتين لمدة 24 ساعة و 48 ساعة على التوالي عند 37 درجة مئوية مع 5٪ CO2 باستخدام مضخة حقنة قابلة للبرمجة (انظر جدول المواد) ، وسحب الوسائط المستهلكة من القناة والوسائط الجديدة إلى القناة من خزان وسائط معقم متصل بمدخل القناة يتكون من حقنة مفتوحة 20 مل مغطاة بغشاء البارافين.
- بعد فترة انتظار مدتها 10 دقائق بعد بذر الخلايا ، قم بإدخال وضخ وسائط جديدة من الخزان عبر القناة بمعدل تدفق متغير يبدأ من 0.2 ميكرولتر / دقيقة ويصل إلى 10 ميكرولتر / دقيقة لمدة 4 ساعات ، مع الحفاظ على هذا المعدل بعدذلك 20.
ملاحظة: يوفر معدل التدفق المتغير هذا ظروف استزراع تسمح للخلايا ب (1) الاستقرار بالجاذبية على سطح المزرعة ، (2) الالتصاق بسطح الثقافة ، و (3) تشكيل طبقة أحادية متقاربة.
- بعد فترة انتظار مدتها 10 دقائق بعد بذر الخلايا ، قم بإدخال وضخ وسائط جديدة من الخزان عبر القناة بمعدل تدفق متغير يبدأ من 0.2 ميكرولتر / دقيقة ويصل إلى 10 ميكرولتر / دقيقة لمدة 4 ساعات ، مع الحفاظ على هذا المعدل بعدذلك 20.
- في غطاء التدفق الصفحي المعقم ، استخدم ماصة دقيقة لنقل تعليق متساو لخلايا NCI-H441 في وسط RPMI 1640 مع مصل بقري جنيني بنسبة 10٪ (FBS) (انظر جدول المواد) لزرع قناتين من الموائع الدقيقة ، لكل منهما خلايا بكثافة سطح 150000 خلية / سم2.
- إجراء تثبيت الخلية داخل قنوات الموائع الدقيقة باستخدام محلول الفورمالديهايد.
تنبيه: الفورمالديهايد سام ويجب التعامل معه في غطاء دخان كيميائي مناسب21.- في غطاء الدخان الكيميائي ، قم بإعداد محاليل الفورمالديهايد باستخدام 4٪ فورمالديهايد في PBS (خال من الميثانول) (انظر جدول المواد) لإنشاء جزأين سعة 4 مل ، مع تخفيف الأول إلى تركيز 1٪ فورمالديهايد والثاني إلى 2٪ فورمالديهايد باستخدام محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS ؛ مع Ca 2+ و Mg2+) كمخفف. انقل محاليل الفورمالديهايد لفصل المحاقن سعة 5 مل وقم بتسميتها وفقا لذلك. ارسم 20 مل من DPBS في حقنة منفصلة سعة 20 مل.
- قم بإزالة قنوات الموائع الدقيقة من جهاز الاستزراع وضعها في غطاء الدخان الكيميائي.
- تجميع جهاز التثبيت وتلطيخ.
- قم بتوصيل جزء 10 سم من أنبوب النقل بالمنفذ الجانبي لمحبس ثلاثي الاتجاهات عبر قفل Luer ذكر لمحول شوكة الخرطوم (انظر جدول المواد) ، ثم قم بتوصيل محبس بمنفذ مدخل صفيف التدفق.
- بعد ذلك ، قم بتوصيل جزء آخر بطول 10 سم من أنابيب النقل بمنفذ مخرج صفيف التدفق باستخدام نفس النوع من محول شوكة الخرطوم.
- أخيرا ، قم بتأمين الأطراف الحرة لكلا أنبوبي النقل في حاوية نفايات كيميائية وبيولوجية مناسبة ، مثل أنبوب طرد مركزي مخروطي فارغ سعة 50 مل مكتوب عليه.
- أدر المحبس لحظر منفذ مدخل صفيف التدفق واغسل خط النفايات باستخدام DPBS. بعد ذلك ، أدر المحبس لسد خط النفايات واغسل الخلايا ببطء باستخدام 2 مل من DPBS. كرر خطوة التنظيف باستخدام المحلول الجديد في كل مرة. يتم تقديم محلول جديد (أو تركيز المحلول) إلى القناة.
- ادفع ببطء 2 مل من محلول التثبيت 1٪ عبر القناة ثم اتركه لمدة 5 دقائق22.
- ادفع ببطء 2 مل من محلول التثبيت 2٪ عبر القناة ثم اتركه لمدة 15 دقيقة.
- اغسل الخلايا عن طريق إدخال 2 مل من DPBS الطازج ببطء إلى القناة في ثلاث حالات منفصلة (5 دقائق لكل منها).
- أكمل الخطوات 1.3.3-1.3.7 لكلتا قناتي الموائع الدقيقة بالتوازي.
- وصمة عار ، تتخلل ، وإضافة وسائط تصاعد إلى الخلايا في قناة الموائع الدقيقة.
- تحضير محلول سابونين 0.1٪ بإضافة 1 مجم من الصابونين (انظر جدول المواد) لكل مل من DPBS لإنتاج 4 مل من المحلول ودوامة بلطف لخلط23. ارسم 8 مل من DPBS في حقنة سعة 20 مل.
- أضف كاشف phalloidin الملطخ F-actin وكاشف Hoechst الملطخ بالنواة (انظر جدول المواد) إلى محلول الصابونين 0.1٪ ، عند قطرتين (0.1 مل) من كل كاشف لكل مل من محلول الصابونين. حافظ على محلول التلوين / النفاذية الجاهز بعيدا عن الضوء من خلال تغطيته بورق الألمنيوم24.
- اغسل الخط بكمية صغيرة من محلول التلوين / النفاذية (كما هو موضح في الخطوة 1.3.4) ، ثم أدخل 2 مل من المحلول إلى قناة الموائع الدقيقة وقم بتغطية القناة بورق الألمنيوم قبل السماح لها بالجلوس في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل محلول التلوين / النفاذية مرتين باستخدام 2 مل من DPBS لمدة 5 دقائق لكل تدفق.
- للحصول على جودة صورة أفضل ، أضف وسائط تركيب مناسبة (مع مؤشر انكسار يتطابق بشكل وثيق مع الزيت الموضوعي للمجهر وزجاج الغطاء ، انظر جدول المواد) في القناة.
- باستخدام ماصة دقيقة ، أدخل الحد الأدنى من مركب مضاد للتلاشي الناعم في كل منفذ من منافذ قناة الموائع الدقيقة ، مما يضمن تغطية السطح السفلي بالكامل وعدم وجود فقاعات محاصرة داخل منطقة التصوير المطلوبة25. أغلق نهايات القناة وتحقق من سلامة طبقة الخلية من خلال المراقبة تحت مجهر برايتفيلد.
- أكمل الخطوات 1.4.3-1.4.5 لكلتا قناتي الموائع الدقيقة بالتوازي.
ملاحظة: خلايا الصورة في أسرع وقت ممكن بعد تلطيخها للحصول على أقصى جودة للصورة. في حالة حدوث تبييض ضوئي أو رغبة في التخزين طويل الأجل ، يمكن استخدام وسائط تركيب أخرى ذات خصائص مضادة للتلاشي أو الحفاظ على العينة. لاحظ أن وسائط التركيب المعالجة الصلبة سوف تشوه بنية 3D للخلايا ، وبالتالي طبقة الخلية ؛ لهذا السبب ، يفضل استخدام وسائط التركيب الناعمة26.
- خلايا الصورة في قناة الموائع الدقيقة باتباع الخطوات أدناه.
- اضبط إعدادات المجهر متحد البؤر (انظر جدول المواد)، بما في ذلك معلمات طاقة الليزر والكسب والإزاحة والمسح الضوئي مثل سرعة المسح الضوئي ومنطقة المسح الضوئي وتنسيق المسح الضوئي والدقة وقطر الثقب27.
- اختبر موقع التصوير عن طريق إجراء عمليات مسح مرجعية بالإضافة إلى مكدسات Z حتى يتم استيفاء معلمات وشروط الصورة المطلوبة. معلمات الطلب عند أهداف تكبير أعلى بالتتابع حتى يتم الوصول إلى هدف غمر الزيت 40xوتحسينه 28.
- باستخدام لوحة قاعدة صفيف التدفق كمرجع، قم ببناء مداخن Z في خمسة مواقع، في الموقع المحتمل للقطب الأول على جانب المدخل، في منتصف المسافة بين المركز والموقع السابق، المركز، في منتصف المسافة بين المركز وموقع القطب الأخير (على جانب المخرج)، وفي القطب الأخير، كما هو موضح في الشكل 2.
- إجراء معالجة الصور وتحليل البيانات.
- تصدير المقاطع العرضية XZ و YZ باستخدام حزمة برامج المجهر متحد البؤر (انظر جدول المواد).
- باستخدام برنامج معالجة الصور (انظر جدول المواد) مع قدرات اكتشاف الحواف (قيمة العتبة 15.0)، قم بقياس مساحة الصورة الإجمالية بالبكسل باستخدام أداة العصا السحرية خارج الصورة، ثم المساحة باستثناء إجمالي مساحة المقطع العرضي لطبقة الخلية بالبكسل باستخدام أداة العصا السحرية في جزء الصورة الخارجي لطبقة الخلية29.
- باستخدام برنامج معالجة البيانات (انظر جدول المواد) ، اطرح قيمة بكسل المساحة الخارجية من إجمالي قيمة بكسل المساحة لإيجاد قيمة بكسل مساحة المقطع العرضي.
- قم بتحويل قيم بكسل مساحة المقطع العرضي إلى قيم μm2 بضرب قيم البكسل في مربع قيمة μm / pixel ، كما هو موضح في برنامج المجهر للصورة المعينة (0.31 μm / pixel لمكدسات Z الملتقطة بدقة 1024 بكسل بدون تكبير على عدسة غمر الزيت 40x).
- حساب المتوسطات والانحرافات المعيارية للبيانات ونتائج الرسم البياني.
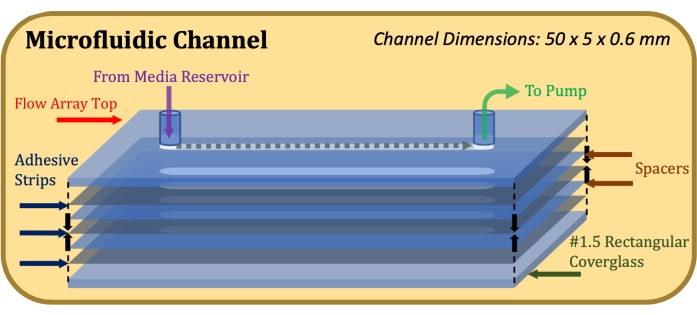
الشكل 1: مخطط عرض منفجر لبناء قناة الموائع الدقيقة. العنصر العلوي هو الجزء العلوي من مجموعة التدفق ، والعناصر الرمادية الرقيقة عبارة عن شرائط لاصقة ، والعناصر الزرقاء الرقيقة عبارة عن فواصل مايلر ، والعنصر السفلي هو غطاء زجاجي مستطيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
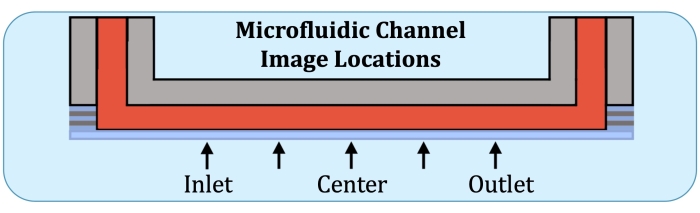
الشكل 2: خمسة مواقع تصوير على طول المنطقة المنتجة للطبقة باستمرار لقناة ثقافة الموائع الدقيقة. مواقع التصوير هي كما يلي: جانب المدخل ، بالقرب من المكان الذي سيكون فيه القطب الأول على صفيف التدفق السليم ؛ في منتصف الطريق بين موقع جانب المدخل ومركز القناة ؛ مركز القناة في منتصف الطريق بين المركز وموقع جانب المخرج ، وجانب المخرج ، بالقرب من المكان الذي سيكون فيه القطب الأخير على صفيف التدفق السليم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. زراعة الخلايا في الغطاء الزجاجي المكون من ثماني غرف
- قم بإجراء المعالجة المسبقة للغطاء الزجاجي المكون من ثمانية غرف جيدة.
- احصل على غطاء زجاجي معقم من ثماني غرف جيدا مصنوع من غطاء زجاجي # 1.5 ومعالجة سطحية تزيد من الالتصاق الخلايا (الشكل 3 ، انظر جدول المواد).
- باستخدام تقنية معقمة ، عالج سطح آبار الاستزراع ب 2.0 ميكروغرام / مل من الفبرونيكتين البشري في برنامج تلفزيوني واحتضانه لمدة 30 دقيقة على الأقل عند 37 درجة مئوية19.
- قم بإجراء زراعة الخلايا في غطاء الغرفة باتباع الخطوات أدناه.
- في غطاء التدفق الصفحي المعقم ، انقل 0.5 مل أجزاء من محاليل خلايا NCI-H441 المعلقة بالتساوي في وسط RPMI 1640 مع 10٪ FBS بكثافة حجمية تبلغ 81000 و 162000 و 324000 خلية / مل لزرع آبار الاستزراع بكثافة سطحية تبلغ 45000 و 90000 و 180000 خلية / سم2 على التوالي. تحقق من أن الخلايا قد تم توزيعها بالتساوي داخل الآبار باستخدام مجهر برايتفيلد.
- خلايا المزرعة لمدة 24 ساعة و 48 ساعة و 96 ساعة عند 37 درجة مئوية مع 5٪ CO2 ، لتحل محل الوسائط يوميا.
- قم بإجراء تثبيت الفورمالديهايد في غطاء زجاجي مكون من ثماني غرف جيدا.
تنبيه: الفورمالديهايد سام ويجب التعامل معه في غطاء دخان كيميائي مناسب21.- في غطاء الدخان الكيميائي ، قم بإعداد محاليل الفورمالديهايد عن طريق صنع جزأين من 4٪ فورمالديهايد في PBS (خال من الميثانول) ، تمييع الأول إلى تركيز 1٪ فورمالديهايد والآخر إلى 2٪ فورمالديهايد باستخدام محلول ملحي مخزن بالفوسفات من Dulbecco (DPBS ؛ مع Ca 2+ و Mg2+) كمخفف.
- قم بإزالة غطاء الغطاء المكون من ثمانية آبار من الحاضنة وضعه في غطاء الدخان الكيميائي.
- اغسل الخلايا برفق باستخدام 0.5 مل من DPBS باستخدام ماصة دقيقة عن طريق إدخال السائل ببطء على طول الجزء العلوي من زاوية كل بئر.
- قم بإزالة السائل الموجود في كل بئر عن طريق استخراجه ببطء من زاوية الآبار باستخدام ماصة دقيقة. باستخدام طريقة إدخال السائل (الخطوة 2.3.3) ، أدخل 0.5 مل من محلول مثبت 1٪ في كل بئر واتركه لمدة 5 دقائق22.
- إزالة السائل الموجود في كل بئر باستخدام طريقة استخراج السائل المذكورة في الخطوة 2.3.4. باستخدام طريقة إدخال السائل المذكورة في الخطوة 2.3.3 ، أدخل 0.5 مل من محلول مثبت 2٪ في كل بئر واتركه لمدة 15 دقيقة.
- باستخدام طرق إدخال واستخراج السوائل (الخطوتان 2.3.3 و 2.3.4) ، اغسل الخلايا عن طريق إدخال وإزالة 0.5 مل من DPBS الطازجة في كل بئر في ثلاث حالات منفصلة لمدة 5 دقائق لكل منها.
- قم بإجراء التلوين والنفاذية وإضافة الوسائط المتصاعدة في زجاج الغطاء المكون من ثماني غرف جيدا.
- تحضير محلول سابونين 0.1٪ بإضافة 1 ملغ من الصابونين لكل مل من DPBS ودوامة بلطف لخلط23.
- إلى محلول الصابونين 0.1٪ ، أضف قطرتين (0.1 مل) لكل من كاشف القضيب الملطخ F-actin وكاشف Hoechst الملطخ بالنواة لكل مل من محلول الصابونين. احتفظ بالمحلول المحضر بعيدا عن الضوء من خلال تغطيته بورق الألمنيوم24.
- أدخل 0.2 مل من محلول التلوين / النفاذية لكل بئر وقم بتغطية الغطاء الزجاجي بورق الألمنيوم قبل السماح له بالجلوس في درجة حرارة الغرفة لمدة 30 دقيقة.
- اغسل محلول التلوين / النفاذية مرتين باستخدام 0.5 مل من DPBS.
- للحصول على جودة صورة أفضل ، أضف وسائط تركيب مناسبة (مع مؤشر انكسار يتطابق بشكل وثيق مع زيت المجهر الموضوعي وزجاج الغطاء) في الآبار.
- باستخدام ماصة دقيقة ، أدخل الحد الأدنى من مركب مضاد للبهتان الناعم في كل بئر ، مما يضمن تغطية السطح السفلي بالكامل وعدم وجود فقاعات محاصرة داخل منطقة التصوير المطلوبة25. تحقق من سلامة طبقة الخلية من خلال المراقبة تحت مجهر برايتفيلد.
ملاحظة: خلايا الصورة في أسرع وقت ممكن بعد تلطيخها للحصول على أقصى جودة للصورة. في حالة حدوث تبييض ضوئي أو رغبة في التخزين طويل الأجل ، يمكن استخدام وسائط تركيب أخرى ذات خصائص مضادة للتلاشي أو الحفاظ على العينة. لاحظ أن وسائط التركيب المعالجة الصلبة ستشوه بنية 3D للخلايا ، وبالتالي طبقة الخلية ، لذا يفضل استخدام وسائط التركيب الناعمة26.
- باستخدام ماصة دقيقة ، أدخل الحد الأدنى من مركب مضاد للبهتان الناعم في كل بئر ، مما يضمن تغطية السطح السفلي بالكامل وعدم وجود فقاعات محاصرة داخل منطقة التصوير المطلوبة25. تحقق من سلامة طبقة الخلية من خلال المراقبة تحت مجهر برايتفيلد.
- قم بإجراء التصوير في الغطاء الزجاجي المكون من ثماني غرف جيدا.
- اضبط إعدادات المجهر متحد البؤر ، بما في ذلك معلمات طاقة الليزر والكسب والإزاحة والمسح الضوئي مثل سرعة المسح الضوئي ومنطقة المسح وتنسيق المسح الضوئي والدقة وقطر الثقب27.
- اختبر موقع التصوير عن طريق إجراء عمليات مسح مرجعية بالإضافة إلى مكدسات Z حتى يتم استيفاء معلمات وشروط الصورة المطلوبة. معلمات الطلب عند أهداف تكبير أعلى بالتتابع حتى يتم الوصول إلى هدف غمر الزيت 40xوتحسينه 28.
- قم ببناء مداخن Z من ثلاثة مواقع عشوائية في كل مطابقة لكثافة البذر / مدة الثقافة.
- إجراء معالجة الصور وتحليل البيانات.
- تصدير المقاطع العرضية XZ و YZ باستخدام حزمة برامج المجهر متحد البؤر.
- باستخدام برنامج معالجة الصور مع قدرات اكتشاف الحواف (قيمة العتبة 15.0) ، قم بقياس إجمالي مساحة الصورة بالبكسل باستخدام أداة Magic Wand خارج الصورة ، ثم المساحة باستثناء إجمالي مساحة المقطع العرضي لطبقة الخلية بالبكسل باستخدام أداة Magic Wand في جزء الصورة الخارجي لطبقة الخلية29.
- باستخدام برنامج معالجة البيانات ، اطرح قيمة بكسل المنطقة الخارجية من إجمالي قيمة بكسل المساحة للعثور على قيمة بكسل مساحة المقطع العرضي.
- قم بتحويل قيم بكسل مساحة المقطع العرضي إلى قيم μm2 بضرب قيم البكسل في مربع قيمة μm / pixel كما هو موضح في برنامج المجهر للصورة المعينة (0.31 ميكرومتر / بكسل لمكدسات Z الملتقطة بدقة 1024 بكسل بدون تكبير على عدسة غمر الزيت 40x).
- حساب المتوسطات والانحرافات المعيارية ونتائج الرسم البياني.
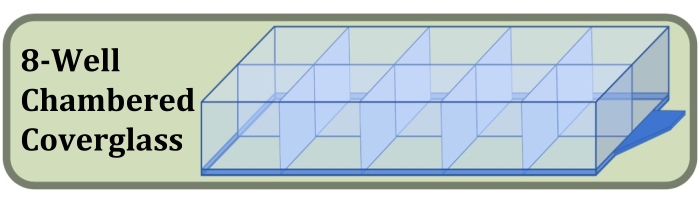
الشكل 3: رسم تخطيطي للغطاء الزجاجي المكون من ثماني غرف والمستخدم في تجربة زراعة الآبار الثابتة والتلوين والتصوير الذي يقارن تأثيرات كثافة بذر الخلايا الأولية ومدة الاستزراع على تكوين طبقات الخلايا. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
النتائج
تسمح الطريقة المقدمة بتصور طبقات الخلايا الظهارية المستزرعة في قنوات استزراع الموائع الدقيقة وتستخدم عرضا توضيحيا في بيئات زراعة الخلايا التقليدية ذات الآبار الثابتة للتحقق من الصحة. ستكون الصور التي تم الحصول عليها موجودة على طيف من الجودة وشدة الإشارة وخصوصية الهدف الخلوي. ستظهر الصو...
Discussion
يصف البروتوكول المقدم الثقافة ، والتثبيت المتشابك ، والتلوين ، والنفاذية ، والتصور المجهري متحد البؤر للخلايا الظهارية الرئوية البشرية NCI-H441 في البيئة الديناميكية لمجموعة تدفق الموائع الدقيقة أحادية القناة ، وكذلك في البيئة الثابتة لغطاء زجاجي تقليدي من ثماني غرف جيدا. مع أي بروتوكول لث...
Disclosures
يعلن أصحاب البلاغ عدم وجود تضارب في المصالح.
Acknowledgements
يعترف المؤلفون بآلان شيباردسون لتصميمه نمط القطع لورقة 3M اللاصقة والمايلر المستخدمة في بناء قناة الموائع الدقيقة ولاختبار معدل تدفق وسائط زراعة الخلايا وبرمجة مضخة الحقنة. تم توفير التمويل من قبل NIH R01 HL0142702 ، و NSF CBET 1706801 ، ومنحة عميد كلية نيوكومب تولين.
Materials
| Name | Company | Catalog Number | Comments |
| A1R HD25 Confocal Microscope System | Nikon | A1R HD25 | https://www.microscope.healthcare.nikon. com/products/confocal-microscopes/a1hd25-a1rhd25/specifications |
| ActinGreen 488 ReadyProbes Reagent (AlexaFluor 488 phalloidin) | Invitrogen | R37110 | https://www.thermofisher.com/order/catalog/product/R37110 |
| Adhesive Transfer Tape Double Linered | 3M | 468MP | https://gizmodorks.com/3m-468mp-adhesive-transfer-tape-sheet-5-pack/ |
| Air-Tite HSW Soft-Ject Disposable Syringes | Air-Tite RL5 | 14-817-53 | https://www.fishersci.com/shop/products/air-tite-hsw-soft-ject-disposable-syringes-6/1481753#?keyword=syringe%20leur%20locking%205ml |
| BAISDY 4 mil (0.1 mm) Thick Mylar Sheet | BAISDY | AS022 | https://www.amazon.ca/Stencil-Perfect-Silhouette-Machines-BAISDY/dp/B07RJJ9BNC |
| Branson Ultrasonics M Series Ultrasonic Cleaning Bath | Branson Ultrasonics | 15-336-100 | https://www.fishersci.com/shop/products/m-series-ultrasonic-cleaning-bath/15336100 |
| Corning Fibronectin, Human | Fisher Scientific | CB-40008 | https://www.fishersci.com/shop/products/corning-fibronectin-human-3/CB40008?keyword=true |
| DPBS, calcium, magnesium | Gibco | 14040133 | https://www.thermofisher.com/order/catalog/product/14040133?SID=srch-srp-14040133 |
| ECIS Cultureware Disposable Electrode Arrays 8 x 10 ECIS Flow Array | Applied BioPhysics | 1F8x10E PC | https://www.biophysics.com/cultureware.php#1F8x10E |
| Enterprise Technology Solutions UV Sterilizer Cabinet, White | Enterprise Technology Solutions | 50-211-1163 | https://www.fishersci.com/shop/products/uv-sterilizer-cabinet-white/502111163 |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | https://www.thermofisher.com/order/catalog/product/26140079 |
| Finnpipette F2 Variable Volume Pipettes | Thermo Scientific | 4642090 | https://www.thermofisher.com/order/catalog/product/4642090 |
| Fisherbrand 50mL Easy Reader Plastic Centrifuge Tubes | Fisher Scientific | 06-443-21 | https://www.fishersci.com/shop/products/fisherbrand-higher-speed-easy-reader-plastic-centrifuge-tubes-8/p-193269 |
| Fisherbrand Cover Glasses: Rectangles (#1.5) | Fisher Scientific | 12-544-GP | https://www.fishersci.com/shop/products/cover-glasses-rectangles-promo-22/12544GP#coverglass |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-458 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955458 |
| Gibco RPMI 1640 Medium | Gibco | 11875093 | https://www.thermofisher.com/order/catalog/product/11875093 |
| Image-iT Fixative Solution (4% formaldehyde, methanol-free) | Invitrogen | FB002 | https://www.thermofisher.com/order/catalog/product/FB002 |
| ImageJ Fiji | ImageJ | ImageJ Fiji | https://imagej.net/downloads |
| Immersion Oil F 30 cc | Nikon | MXA22168 | https://www.microscope.healthcare.nikon. com/products/accessories/immersion-oil/specifications |
| Large-Capacity Reach-In CO2 Incubator, 821 L, Polished Stainless Steel | Thermo Scientific | 3950 | https://www.thermofisher.com/order/catalog/product/3950 |
| Laxco LMC-3000 Series Brightfield Compound Microscope System | Laxco | LMC3BF1 | https://www.fishersci.com/shop/products/lmc-3000-series-brightfield-compound-microscope-system-8/LMC3BF1 |
| Masterflex Fitting, Nylon, Straight, Male Luer Lock to Hose Barb Adapters, 1/16" ID; 25/PK | Masterflex | ZY-45505-31 | https://www.masterflex.com/i/masterflex-fitting-nylon-straight-male-luer-lock-to-hose-barb-adapters-1-16-id-25-pk/4550531?PubID=ZY&persist=true&ip=no& gclid=Cj0KCQiA3rKQBhCNARIsAC UEW_Zb5yXy1em6bGs0a9KFOk5k pdlkHCvAEslHumdqcnlwSN0MdR0 udmwaAuDHEALw_wcB |
| Microsoft Excel | Microsoft | 0016 | https://www.microsoft.com/en-us/download/details.aspx?id=56547 |
| National Target All-Plastic Disposable Syringes | Thermo Scientific | 03-377-24 | https://www.fishersci.com/shop/products/national-target-all-plastic-disposable-syringes/0337724#tab8 |
| NCI-H441 Human Epithelial Lung Cells | American Type Culture Collection (ATCC) | HTB-174 | https://www.atcc.org/products/htb-174 |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | https://www.syringepump.com/NE-16001800.php |
| NIS Elements AR | Nikon | NIS Elements AR | https://www.microscope.healthcare.nikon. com/products/software/nis-elements/nis-elements-advanced-research |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Invitrogen | R37605 | https://www.thermofisher.com/order/catalog/product/R37605?SID=srch-srp-R37605 |
| Nunc Lab-Tek Chambered Coverglass | Thermo Scientific | 155411 | https://www.thermofisher.com/order/catalog/product/155361 |
| Parafilm M Wrapping Film | Fisher Scientific | S37441 | https://www.fishersci.com/shop/products/parafilm-m-wrapping-film-3/S37441 |
| PendoTech 3-Way Stopcock, Polysulfone, Male/Female Luer Inlet x Female Luer Branch | PendoTech | ZY-19406-49 | https://www.masterflex.com/i/pendotech-3-way-stopcock-polysulfone-male-female-luer-inlet-x-female-luer-branch/1940649 |
| Phosphate Buffered Solution (PBS), pH 7.4 | Gibco | 10010023 | https://www.thermofisher.com/order/catalog/product/10010023 |
| Poly-D-Lysine | Gibco | A3890401 | https://www.thermofisher.com/order/catalog/product/A3890401#/A3890401 |
| Reynolds Aluminum Wrap Foil | Reynolds | 458742928317 | https://www.amazon.com/Reynolds-Wrap-Aluminum-Foil-Square/dp/B00UNT0Y2M |
| Saponin | Millipore Sigma (Sigma Aldrich) | 47036 | https://www.sigmaaldrich.com/US/en/product/sigma/47036 |
| SlowFade Glass Soft-set Antifade Mountant | Invitrogen | S36917-5X2ML | https://www.thermofisher.com/order/catalog/product/S36917-5X2ML |
| Thermo Scientific 1300 Series Class II, Type A2 Biological Safety Cabinet Package | Thermo Scientific | 13-100-752PM | https://www.fishersci.com/shop/products/1300-series-class-ii-type-a2-biological-safety-cabinet-package-promo/p-9049003#?keyword=biosafety%20hood |
| Tygon Transfer Tubing, BioPharm Platinum-Cured Silicone, 1/16" ID x 1/8" OD; 50 Ft | Cole-Parmer | EW-95702-01 | https://www.coleparmer.com/i/tygon-transfer-tubing-biopharm-platinum-cured-silicone-1-16-id-x-1-8-od-50-ft/9570201?searchterm=95702-01 |
References
- Matthay, M. A., et al. Acute respiratory distress syndrome. Nature Reviews Disease Primers. 5, 18 (2019).
- Rawal, G., Yadav, S., Kumar, R. Acute respiratory distress syndrome: An update and Review. Journal of Translational Internal Medicine. 6 (2), 74-77 (2018).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface-tension-induced epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 94 (2), 770-783 (2003).
- Modrykamien, A. M., Gupta, P. The acute respiratory distress syndrome. Baylor University Medical Center Proceedings. 28 (2), 163-171 (2017).
- Jacob, A. -. M., Gaver, D. P. Atelectrauma disrupts pulmonary epithelial barrier integrity and alters the distribution of tight junction proteins ZO-1 and Claudin 4. Journal of Applied Physiology. 113 (9), 1377-1387 (2012).
- Kay, S. S., Bilek, A. M., Dee, K. C., Gaver, D. P. Pressure gradient, not exposure duration, determines the extent of epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 97 (1), 269-276 (2004).
- Jacob, A. M., Gaver, D. P. An investigation of the influence of cell topography on epithelial mechanical stresses during pulmonary airway reopening. Physics of Fluids. 17 (3), 031502 (1994).
- Gaver, D. P., et al. The POOR get POORer: A hypothesis for the pathogenesis of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 202 (8), 1081-1087 (2020).
- Jain, P., et al. Reconstruction of ultra-thin alveolar-capillary basement membrane mimics. Advanced Biology. 5 (8), 2000427 (2021).
- Byrne, M. B., Leslie, M. T., Gaskins, H. R., Kenis, P. J. A. Methods to study the tumor microenvironment under controlled oxygen conditions. Trends in Biotechnology. 32 (11), 556-563 (2014).
- Szulcek, R., Bogaard, H. J., van Nieuw Amerongen, G. P. Electric cell-substrate impedance sensing for the quantification of endothelial proliferation, barrier function, and motility. Journal of Visualized Experiments. (85), e51300 (2014).
- Jaccard, N., et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images. Biotechnology and Bioengineering. 111 (3), 504-517 (2013).
- Hagiyama, M., et al. Modest static pressure suppresses columnar epithelial cell growth in association with cell shape and cytoskeletal modifications. Frontiers in Physiology. 8, 00997 (2017).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of Nucleic Acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Zhu, L., Rajendram, M., Huang, K. C. Effects of fixation on bacterial cellular dimensions and integrity. Iscience. 24 (4), 102348 (2021).
- Lust, R. M. . The Pulmonary System. XPharm: The Comprehensive Pharmacology Reference. , 1-6 (2007).
- EpilogueLaser. FusionSeries: Pro & Edge Laser System Manual and Original Instructions. EpilogueLaser. , (2022).
- Chitnis, D. S., Katara, G., Hemvani, N., Chitnis, S., Chitnis, V. Surface disinfection by exposure to germicidal UV light. Indian Journal of Medical Microbiology. 26 (3), 241 (2008).
- Sandell, L., Sakai, D. Mammalian cell culture. Current Protocols Essential Laboratory Techniques. 5 (1), 4 (2011).
- New Era Pump Systems. Multi-Phaser Programmable Syringe Pump: NE-1000 Series User Manual. New Era Pump Systems. , (2014).
- Thermo Fisher Scientific. Safety Data Sheet: Image-iT Fixative Solution (4% formaldehyde, methanol-free). Thermo Fisher Scientific. , (2018).
- Thavarajah, R., Mudimbaimannar, V. K., Rao, U. K., Ranganathan, K., Elizabeth, J. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Jamur, M. C., Oliver, C. Permeabilization of cell membranes. Immunocytochemical Methods and Protocols. 588, 63-66 (2009).
- Thermo Fisher Scientific. ActinGreen 488 ReadyProbes Reagent Protocol. Thermo Fisher Scientific. , (2022).
- Slowfade Glass soft-set Antifade Mountant. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/S36917-5X2ML?SID=srch-hj-S36917-5X2ML (2022)
- Ravikumar, S., Surekha, R., Thavarajah, R. Mounting media: An overview. Journal of Dr. NTR University of Health Sciences. 3 (5), 1-8 (2014).
- Shihan, M. H., Novo, S. G., Le Marchand, S. J., Wang, Y., Duncan, M. K. A simple method for quantitating confocal fluorescent images. Biochemistry and Biophysics Reports. 25, 100916 (2021).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Ferriera, F., Rasband, W. ImageJ User Guide. National Institutes of Health. , (2012).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Smith, H. S., Riggs, J. L., Mosesson, M. W. Production of fibronectin by human epithelial cells in culture. American Association for Cancer Research. 39 (10), 4138-4144 (1979).
- Sieck, G. C., Mantilla, C. B., Prakash, Y. S. Volume measurements in confocal microscopy. Methods in Enzymology. 307, 296-315 (1999).
- Heijink, I. H., et al. Characterisation of cell adhesion in airway epithelial cell types using electric cell-substrate impedance sensing. European Respiratory Journal. 35 (4), 894-903 (2009).
- Zhang, X., Wang, W., Li, F., Voiculescu, I. Stretchable impedance sensor for mammalian cell proliferation measurements. Lab on a Chip. 17 (12), 2054-2066 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved