Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación y evaluación estructural de monocapas de células epiteliales en un dispositivo de cultivo microfluídico de tamaño fisiológico
En este artículo
Resumen
El protocolo presentado describe el desarrollo y uso de una técnica de tinción de actina filamentosa basada en faloidina con microscopía de barrido láser confocal (CLSM) para visualizar la estructura de la capa celular adherente en canales de cultivo dinámico microfluídico y cámaras tradicionales de cultivo estático de pozo fijo. Este enfoque ayuda a evaluar la confluencia de la capa celular, la formación de monocapa y la uniformidad del espesor de la capa.
Resumen
La experimentación microfluídica in vitro tiene un gran potencial para revelar muchos conocimientos sobre los fenómenos microfisiológicos que ocurren en afecciones como el síndrome de dificultad respiratoria aguda (SDRA) y la lesión pulmonar inducida por el ventilador (VILI). Sin embargo, los estudios en canales microfluídicos con dimensiones fisiológicamente relevantes para los bronquiolos terminales del pulmón humano se enfrentan actualmente a varios desafíos, especialmente debido a las dificultades para establecer condiciones apropiadas de cultivo celular, incluidas las tasas de flujo de medios, dentro de un entorno de cultivo dado. El protocolo presentado describe un enfoque basado en imágenes para evaluar la estructura de las células epiteliales pulmonares humanas NCI-H441 cultivadas en un canal microfluídico impermeable al oxígeno con dimensiones fisiológicamente relevantes para los bronquiolos terminales del pulmón humano. Usando tinción de actina filamentosa basada en faloidina, las estructuras citoesqueléticas de las células se revelan mediante microscopía de barrido láser confocal, lo que permite la visualización de células individuales y en capas. La cuantificación posterior determina si las condiciones de cultivo celular empleadas están produciendo monocapas uniformes adecuadas para una mayor experimentación. El protocolo describe el cultivo celular y los métodos de evaluación de capas en canales microfluídicos y entornos tradicionales de pozos fijos. Esto incluye la construcción de canales, el cultivo celular y las condiciones requeridas, la fijación, la permeabilización y la tinción, las imágenes microscópicas confocales, el procesamiento de imágenes y el análisis de datos.
Introducción
El síndrome de dificultad respiratoria aguda (SDRA) es una afección aguda que surge del insulto y la propagación de la lesión en el parénquima pulmonar, que resulta en edema pulmonar de los alvéolos, intercambio gaseoso inadecuado e hipoxemia posterior1. Esto inicia un ciclo de liberación de citoquinas proinflamatorias, reclutamiento de neutrófilos, liberación de mediadores tóxicos y daño tisular, que a su vez incurre en una respuesta inflamatoria adicional2. Además, el surfactante pulmonar, que estabiliza las vías respiratorias y previene el daño causado por el reclutamiento/desreclutamiento repetitivo (R/D), puede ser inactivado o disfuncional por los procesos químicos que ocurren durante el SDRA, lo que resulta en más estrés y lesiones en el parénquima circundante3. Si se sufre un daño suficiente, puede ser necesaria la ventilación mecánica para asegurar una oxigenación sistémica adecuada4. Sin embargo, la ventilación mecánica impone sus propios desafíos y traumas, incluyendo la posibilidad de lesión pulmonar inducida por el ventilador (VILI), caracterizada como lesión del parénquima pulmonar causada por las tensiones mecánicas impuestas durante el sobreinflado (volutrauma) y/o la R/D de la interfaz aire-líquido en la vía aérea ocluida por líquido (atelectrauma)5. El gradiente de presión experimentado por las células epiteliales expuestas a una interfaz aire-líquido (como en un bronquiolo ocluido con líquido) en el modelo de atelectrauma puede resultar en una respuesta obstructiva originada por permeabilidad (POOR), lo que lleva a un ciclo virtuoso de lesión POOR-get-POORer 6,7,8.
La experimentación in vitro puede proporcionar información a microescala sobre estos fenómenos, pero los estudios actuales en entornos de canales microfluídicos con dimensiones fisiológicamente relevantes enfrentan varios desafíos9. Por un lado, la optimización de las condiciones de cultivo celular plantea una barrera significativa para la entrada para la investigación de cultivos celulares en entornos microfluídicos, ya que existe una intersección estrecha dentro de la cual los parámetros de flujo del medio, la duración del cultivo y otras condiciones de cultivo permiten la formación óptima de la capa celular. Esto incluye las limitaciones de difusión impuestas por la naturaleza impermeable al oxígeno del recinto del canal de cultivo microfluídico. Esto requiere una cuidadosa consideración de los parámetros de flujo del medio, ya que los bajos caudales pueden privar a las células de oxígeno, especialmente a las más alejadas de la entrada; Por otro lado, los altos caudales pueden empujar a las células fuera del canal de cultivo o dar lugar a un desarrollo inadecuado o desigual de la capa. Las limitaciones de difusión pueden abordarse mediante el uso de materiales permeables al oxígeno como el polidimetilsiloxano (PDMS) en un aparato de cultivo de interfaz aire-líquido (ALI); sin embargo, muchos canales de cultivo microfluídicos convencionales, como los del sistema de detección de impedancia de sustrato de celda eléctrica (ECIS), son inherentemente impermeables al oxígeno, dada la naturaleza del recinto fabricado10. Este protocolo tiene como objetivo proporcionar una técnica para analizar las capas celulares cultivadas en un recinto impermeable al oxígeno.
Al comparar la viabilidad de las condiciones de cultivo, las observaciones de características específicas de la capa, como la presencia de una monocapa, la topología de la superficie, la confluencia y la uniformidad del espesor de la capa, son necesarias para determinar si la capa celular producida por un conjunto particular de condiciones de cultivo cumple con las especificaciones deseadas y son realmente relevantes para el diseño experimental. Se puede realizar una evaluación limitada mediante métodos como ECIS, que utiliza mediciones del potencial eléctrico (voltaje) creado por la resistencia a la corriente alterna de alta frecuencia (CA) (impedancia) impuesta por membranas eléctricamente aislantes de células cultivadas en electrodos de oro dentro de la matriz de flujo. Al modular la frecuencia de CA aplicada a las células, las propiedades celulares específicas dependientes de la frecuencia de las células y las capas celulares, como la fuerza de adherencia superficial, la formación de la unión estrecha y la proliferación o confluencia celular, pueden ser dirigidas y examinadas11. Sin embargo, estas formas indirectas de mediciones son algo difíciles de interpretar al inicio de un experimento, y pueden no cuantificar todos los aspectos relevantes de la capa celular. La simple observación de la capa celular bajo un microscopio de contraste de fase puede revelar la naturaleza de ciertas cualidades como la confluencia; sin embargo, muchas características relevantes, como la presencia de una monocapa y la uniformidad del espesor de la capa, requieren una evaluación tridimensional (3D) que no es posible con imágenes microscópicas fluorescentes, de campo claro, contraste de fase o fluorescentes12.
El objetivo de este estudio fue desarrollar una técnica de tinción de actina filamentosa para permitir la verificación basada en imágenes de una monocapa y la evaluación de la uniformidad de la capa celular utilizando microscopía de barrido láser confocal (CLSM). La actina filamentosa (F-actina) se consideró un objetivo apropiado para el conjugado fluoróforo, debido en parte a la forma en que la actina F sigue estrechamente la membrana celular, permitiendo una aproximación visual de todo el volumen celular13. Otro beneficio importante de dirigirse a la actina F es la manera en que la tinción de la actina F dilucida visualmente las interrupciones o alteraciones citoesqueléticas impuestas por las tensiones y tensiones experimentadas por las células. La fijación de reticulación con formaldehído libre de metanol fue utilizada para preservar la morfología de las células y la capa celular, ya que los fijadores deshidratantes como el metanol tienden a aplanar las células, distorsionando groseramente la capa celular y alterando sus propiedades14,15.
Para determinar la capacidad de la técnica de evaluación de capas para mitigar estos desafíos, las células se cultivaron en cámaras de cultivo tradicionales de ocho pocillos, así como en canales microfluídicos para evaluar las diferencias, si las hubiera, en las capas celulares que se produjeron. Para los pozos de cultivo fijos, se utilizaron unidades de vidrio de cubierta con cámara de ocho pocillos. Para el cultivo microfluídico, las matrices de flujo (longitud del canal 50 mm, ancho 5 mm, profundidad 0,6 mm) fueron optimizadas para cultivar células epiteliales pulmonares humanas inmortalizadas (NCI-H441) en un ambiente con dimensiones fisiológicamente relevantes para los bronquiolos terminales presentes en la zona respiratoria del pulmón humano16. Si bien este protocolo se desarrolló teniendo en cuenta el entorno de cultivo de las matrices de flujo ECIS, puede aplicarse a cualquier entorno de cultivo dinámico impermeable al oxígeno para el cual es necesaria la evaluación de las características de la capa celular cultivada o las condiciones de cultivo.
Protocolo
Para el presente estudio se utilizó la línea de células pulmonares epiteliales humanas NCI-H441 (ver Tabla de Materiales).
1. Cultivo celular en el canal microfluídico
- Fabrica el canal microfluídico y realiza el pretratamiento siguiendo los pasos a continuación.
- Obtenga una matriz de flujo de un solo canal (consulte la Tabla de materiales) y separe la parte superior de la placa base de policarbonato.
- Obtenga una cubierta de vidrio rectangular #1.5 (espesor 0.17 mm) con dimensiones de 60 mm x 22 mm. Limpie las superficies del vidrio de cobertura en un baño ultrasónico y trate un lado con una solución de 0,1 mg / ml de poli-D-lisina a temperatura ambiente durante 5 minutos antes de secar a 60 °C durante 30 minutos.
- Coloque un adhesivo de doble cara de 0,13 mm de espesor (consulte la Tabla de materiales), cortado con láser para acomodar las dimensiones de la parte superior de la matriz de flujo y el canal de flujo (50 mm de longitud, 5 mm de ancho), en la parte superior de la matriz de flujo, teniendo cuidado de alinear con precisión los recortes del canal17.
- Fije un espaciador mylar de 0,1 mm de espesor (consulte la Tabla de materiales), cortado con láser para acomodar las dimensiones de la parte superior de la matriz de flujo y el canal de flujo, a la tira adhesiva, teniendo cuidado de alinear con precisión los recortes del canal.
- Repita los pasos 1.1.3 y 1.1.4 hasta que se alcance la altura de canal deseada (por ejemplo, para una altura de canal de 0,6 mm, utilice dos espaciadores y tres tiras adhesivas).
- Fije una cubierta de vidrio rectangular a la tira adhesiva más inferior con el lado tratado con poli-D-lisina orientado hacia el adhesivo. Una vez completado el montaje, como se indica en la Figura 1, aplique una presión firme e igual en la parte superior e inferior de la construcción y mantenga durante 1 minuto.
NOTA: La construcción del recinto del canal, que incluye vidrio de cobertura, adhesivos, espaciadores y parte superior de la matriz de flujo, ya está completa. - Enjuague el canal con agua desionizada con una jeringa, verificando simultáneamente si hay fugas.
- Esterilice la carcasa del canal en un esterilizador ultravioleta (UV) durante 30 min18.
- Utilizando la técnica estéril, tratar el canal con 2,0 μg/ml de fibronectina humana (ver Tabla de materiales) en solución salina tamponada con fosfato (PBS) e incubar durante al menos 30 min a 37 °C19.
- Realizar cultivo celular en el canal microfluídico siguiendo los pasos a continuación.
- En una campana de flujo laminar estéril, use una micropipeta para transferir una suspensión uniforme de células NCI-H441 en medio RPMI 1640 con 10% de suero bovino fetal (FBS) (ver Tabla de materiales) para sembrar dos canales microfluídicos, cada uno con células a una densidad superficial de 150,000 células / cm2.
- Para canales de 50 mm x 5 mm x 0,6 mm, use 0,25 ml de una suspensión de 2,5 x 106 celdas/ml para llenar cada canal, así como una parte de los puertos. Verifique que las células se hayan distribuido uniformemente dentro de los canales utilizando un microscopio de campo claro.
- Cultivar los dos canales durante 24 h y 48 h respectivamente a 37 °C con 5% deCO2 utilizando una bomba de jeringa programable (ver Tabla de materiales), extrayendo los medios gastados del canal y los medios frescos en el canal desde un depósito de medios estéril conectado a la entrada del canal compuesto por una jeringa de 20 ml cortada cubierta con película de parafina.
- Después de un período de espera de 10 minutos después de la siembra celular, introducir y bombear medios frescos desde el depósito a través del canal a una velocidad de flujo variable que comienza en 0.2 μL / min y aumenta hasta 10 μL / min durante 4 h, manteniendo a esa velocidad a partir de entonces20.
NOTA: Este caudal variable proporciona condiciones de cultivo que permiten a las células (1) asentarse gravitacionalmente en la superficie de cultivo, (2) adherirse a la superficie de cultivo y (3) formar una monocapa confluente.
- Después de un período de espera de 10 minutos después de la siembra celular, introducir y bombear medios frescos desde el depósito a través del canal a una velocidad de flujo variable que comienza en 0.2 μL / min y aumenta hasta 10 μL / min durante 4 h, manteniendo a esa velocidad a partir de entonces20.
- En una campana de flujo laminar estéril, use una micropipeta para transferir una suspensión uniforme de células NCI-H441 en medio RPMI 1640 con 10% de suero bovino fetal (FBS) (ver Tabla de materiales) para sembrar dos canales microfluídicos, cada uno con células a una densidad superficial de 150,000 células / cm2.
- Realizar la fijación celular dentro de los canales microfluídicos utilizando solución de formaldehído.
PRECAUCIÓN: El formaldehído es tóxico y debe manipularse en una campana extractora química apropiada21.- En una campana extractora química, prepare soluciones de formaldehído usando formaldehído al 4% en PBS (sin metanol) (consulte la Tabla de materiales) para crear dos porciones de 4 ml, diluyendo la primera a una concentración de formaldehído al 1% y la segunda a formaldehído al 2% usando solución salina tamponada con fosfato de Dulbecco (DPBS; con Ca 2+ y Mg2+) como diluyente. Transfiera las soluciones de formaldehído a jeringas separadas de 5 ml y etiquételas en consecuencia. Extraiga 20 ml de DPBS en una jeringa separada de 20 ml.
- Retire los canales microfluídicos del aparato de cultivo y colóquelos en la campana extractora de humos químicos.
- Montar el aparato de fijación y tinción.
- Conecte un segmento de 10 cm de tubo de transferencia al puerto lateral de una llave de paso de tres vías a través de un adaptador de púa de manguera de bloqueo Luer macho (consulte Tabla de materiales), luego conecte la llave de paso al puerto de entrada de la matriz de flujo.
- A continuación, conecte otro segmento de 10 cm de tubo de transferencia al puerto de salida de la matriz de flujo utilizando el mismo tipo de adaptador de púa de manguera.
- Finalmente, asegure los extremos libres de ambos tubos de transferencia en un contenedor de desechos químicos y de riesgo biológico, como un tubo de centrífuga cónica vacío de 50 ml etiquetado.
- Gire la llave de paso para bloquear el puerto de entrada de la matriz de flujo y enjuague la línea de descarga con DPBS. Luego, gire la llave de paso para bloquear la línea de desechos y lave lentamente las celdas con 2 ml de DPBS. Repita el paso de lavado usando la nueva solución cada vez. Se introduce una nueva solución (o concentración de solución) en el canal.
- Empuje lentamente 2 ml de solución fijadora al 1% a través del canal y luego deje reposar durante 5 min22.
- Empuje lentamente 2 ml de solución fijadora al 2% a través del canal y luego deje reposar durante 15 minutos.
- Lave las células introduciendo lentamente 2 ml de DPBS fresco en el canal en tres instancias separadas (5 min cada una).
- Complete los pasos 1.3.3-1.3.7 para ambos canales microfluídicos en paralelo.
- Tiñe, permeabiliza y agrega medios de montaje a las celdas en el canal microfluídico.
- Prepare una solución de saponina al 0,1% agregando 1 mg de saponina (consulte la Tabla de materiales) por ml de DPBS para producir 4 ml de solución y un vórtice suave para mezclar23. Extraiga 8 ml de DPBS en una jeringa de 20 ml.
- Agregue un reactivo de faloidina que tiñe F-actina y un reactivo Hoechst que tiñe el núcleo (consulte la Tabla de materiales) a la solución de saponina al 0,1%, a dos gotas (0,1 ml) de cada reactivo por ml de solución de saponina. Mantenga la solución de tinción/permeabilización preparada lejos de la luz cubriendo con papel de aluminio24.
- Enjuague la línea con una pequeña cantidad de solución de tinción/permeabilización (como se describe en el paso 1.3.4), luego introduzca 2 ml de la solución en el canal microfluídico y cubra el canal con papel de aluminio antes de dejarlo reposar a temperatura ambiente durante 30 minutos.
- Enjuague la solución de tinción/permeabilización dos veces con 2 ml de DPBS durante 5 minutos por descarga.
- Para una mejor calidad de imagen, agregue un medio de montaje adecuado (con un índice de refracción que coincida estrechamente con el aceite del objetivo del microscopio y el vidrio de la cubierta, consulte la Tabla de materiales) en el canal.
- Con una micropipeta, introduzca una cantidad mínima de un montante antidecolorante de fijación suave en cada puerto del canal microfluídico, asegurándose de que la superficie inferior esté completamente cubierta y que no queden burbujas atrapadas dentro del área de imagen deseada25. Selle los extremos del canal y verifique la integridad de la capa celular observando bajo un microscopio de campo claro.
- Complete los pasos 1.4.3-1.4.5 para ambos canales microfluídicos en paralelo.
NOTA: Celdas de imagen tan pronto como sea posible después de la tinción para obtener la máxima calidad de imagen. Si se produce fotoblanqueo o se desea un almacenamiento a largo plazo, se pueden utilizar otros medios de montaje con propiedades antidecoloración o de preservación de muestras. Tenga en cuenta que los medios de montaje de curado duro distorsionarán la estructura 3D de las celdas y, por extensión, la capa celular; Por esta razón, es preferible el soporte de montaje de ajuste suave26.
- Imágenes de células en el canal microfluídico siguiendo los pasos a continuación.
- Ajuste la configuración del microscopio confocal (consulte la Tabla de materiales), incluidos los parámetros de potencia, ganancia, desplazamiento y escaneo del láser, como la velocidad de escaneo, el área de escaneo, el formato de escaneo, la resolución y el diámetro 27 del orificio27.
- Pruebe la ubicación de las imágenes tomando escaneos de referencia, así como pilas Z hasta que se hayan cumplido los parámetros y condiciones de imagen deseados. Parámetros de marcación en objetivos de aumento secuencialmente más altos hasta que se haya alcanzado el objetivo de inmersión en aceite 40x y optimizado28.
- Usando la placa base de la matriz de flujo como referencia, construya pilas Z en cinco ubicaciones, en la ubicación potencial del primer electrodo en el lado de entrada, a medio camino entre el centro y la ubicación anterior, el centro, a medio camino entre el centro y la ubicación del último electrodo (en el lado de salida), y en el último electrodo, como se indica en la Figura 2.
- Realizar procesamiento de imágenes y análisis de datos.
- Exporte secciones transversales XZ e YZ utilizando el paquete de software de microscopio confocal (consulte la Tabla de materiales).
- Utilizando un software de procesamiento de imágenes (consulte Tabla de materiales) con capacidades de detección de bordes (valor de umbral 15.0), mida el área total de la imagen en píxeles utilizando la herramienta Varita mágica fuera de la imagen, luego el área excluyendo el área de sección transversal total de la capa de celda en píxeles utilizando la herramienta Varita mágica en la parte de la imagen exterior a la capa de celda29.
- Utilizando software de procesamiento de datos (consulte la Tabla de materiales), reste el valor del píxel del área exterior del valor del píxel del área total para encontrar el valor del píxel del área de la sección transversal.
- Convierta los valores de píxeles de área de sección transversal a valores de μm2 multiplicando los valores de píxeles por el cuadrado del valor de μm/píxel, como se indica en el software del microscopio para la imagen en particular (0,31 μm/píxel para pilas Z tomadas en resolución 1024p sin zoom en una lente de inmersión en aceite de 40x).
- Calcular medias y desviaciones estándar de los datos y graficar los resultados.
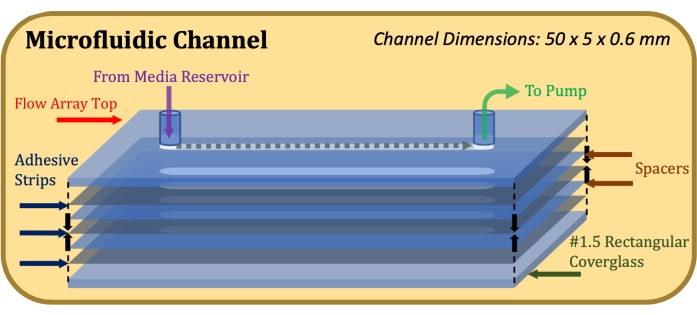
Figura 1: Esquema de vista explotada de la construcción del canal microfluídico. El elemento superior es la parte superior de la matriz de flujo, los elementos grises delgados son tiras adhesivas, los elementos azules delgados son espaciadores mylar y el elemento inferior es el vidrio de cubierta rectangular. Haga clic aquí para ver una versión más grande de esta figura.
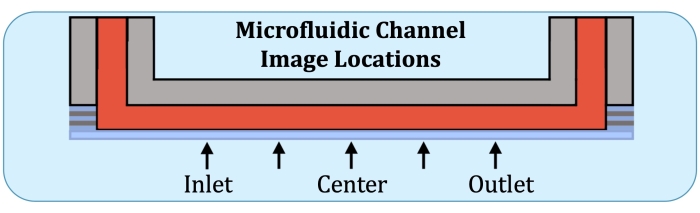
Figura 2: Cinco ubicaciones de imágenes a lo largo de la región productora de capas consistentes del canal de cultivo microfluídico. Las ubicaciones de las imágenes son las siguientes: lado de entrada, cerca de donde estaría el primer electrodo en la matriz de flujo intacta; a medio camino entre la ubicación del lado de entrada y el centro del canal; centro del canal; A medio camino entre el centro y la ubicación del lado de salida, y el lado de salida, cerca de donde estaría el último electrodo en la matriz de flujo intacta. Haga clic aquí para ver una versión más grande de esta figura.
2. Cultivo celular en el vidrio de cubierta con cámara de ocho pocillos
- Realice el tratamiento previo de la cubierta de vidrio de ocho pocillos.
- Obtenga un vidrio de cubierta estéril de ocho pocillos fabricado con un vidrio de cubierta # 1.5 y un tratamiento superficial que aumenta la adherencia celular (Figura 3, consulte la Tabla de materiales).
- Utilizando una técnica estéril, tratar la superficie de los pocillos de cultivo con 2,0 μg/ml de fibronectina humana en PBS e incubar durante al menos 30 min a 37 °C19.
- Realice el cultivo celular en el vidrio de cubierta con cámara siguiendo los pasos a continuación.
- En una campana de flujo laminar estéril, transfiera porciones de 0.5 ml de soluciones de células NCI-H441 suspendidas uniformemente en medio RPMI 1640 con 10% de FBS a densidades volumétricas de 81,000, 162,000 y 324,000 células / ml para sembrar los pocillos de cultivo a densidades superficiales de 45,000, 90,000 y 180,000 células / cm2, respectivamente. Verifique que las células se hayan distribuido uniformemente dentro de los pocillos usando un microscopio de campo claro.
- Cultivar células durante 24 h, 48 h y 96 h a 37 °C con 5% deCO2, sustituyendo diariamente los medios.
- Realice la fijación de formaldehído en el vidrio de cubierta con cámara de ocho pocillos.
PRECAUCIÓN: El formaldehído es tóxico y debe manipularse en una campana extractora química apropiada21.- En una campana extractora química, prepare soluciones de formaldehído haciendo dos porciones de formaldehído al 4% en PBS (sin metanol), diluyendo la primera a una concentración de formaldehído al 1% y la otra a formaldehído al 2% utilizando solución salina tamponada con fosfato de Dulbecco (DPBS; con Ca 2+ y Mg2+) como diluyente.
- Retire el vidrio de cubierta con cámara de cultivo de ocho pocillos de la incubadora y colóquelo en la campana extractora de humos químicos.
- Lave suavemente las células con 0,5 ml de DPBS usando una micropipeta introduciendo lentamente líquido a lo largo de la parte superior de la esquina de cada pocillo.
- Retire el líquido existente en cada pocillo extrayéndolo lentamente de la esquina de los pocillos con una micropipeta. Utilizando el método de introducción líquida (paso 2.3.3), introducir 0,5 ml de solución fijadora al 1% en cada pocillo y dejar reposar durante 5 min22.
- Eliminar el líquido existente en cada pocillo utilizando el método de extracción de líquidos mencionado en el paso 2.3.4. Utilizando el método de introducción de líquidos mencionado en el paso 2.3.3, introducir 0,5 ml de solución fijadora al 2% en cada pocillo y dejar reposar durante 15 minutos.
- Utilizando los métodos de introducción y extracción de líquidos (pasos 2.3.3 y 2.3.4), lave las celdas introduciendo y eliminando 0,5 ml de DPBS fresco en cada pocillo en tres instancias separadas durante 5 minutos cada una.
- Realice la tinción, permeabilización y adición de medios de montaje en el vidrio de cubierta con cámara de ocho pocillos.
- Prepare una solución de saponina al 0,1% agregando 1 mg de saponina por ml de DPBS y mezcle suavemente23.
- A la solución de saponina al 0,1%, agregue dos gotas (0,1 ml) de cada una de un reactivo faloidina con tinción de actina F y un reactivo Hoechst para teñir el núcleo por ml de solución de saponina. Mantenga la solución preparada alejada de la luz cubriendo con papel de aluminio24.
- Introduzca 0,2 ml de solución de tinción/permeabilización en cada pocillo y cubra el vidrio de cubierta con papel de aluminio antes de dejarlo reposar a temperatura ambiente durante 30 minutos.
- Enjuague la solución de tinción/permeabilización dos veces con 0,5 ml de DPBS.
- Para una mejor calidad de imagen, agregue un medio de montaje adecuado (con un índice de refracción que coincida estrechamente con el aceite objetivo del microscopio y el vidrio de la cubierta) en los pozos.
- Usando una micropipeta, introduzca una cantidad mínima de un montante antidecolorante de fijación suave en cada pocillo, asegurándose de que la superficie inferior esté completamente cubierta y que no queden burbujas atrapadas dentro del área de imagen deseada25. Verifique la integridad de la capa celular observando bajo un microscopio de campo claro.
NOTA: Celdas de imagen tan pronto como sea posible después de la tinción para obtener la máxima calidad de imagen. Si se produce fotoblanqueo o se desea un almacenamiento a largo plazo, se pueden utilizar otros medios de montaje con propiedades antidecoloración o de preservación de muestras. Tenga en cuenta que los medios de montaje de curado duro distorsionarán la estructura 3D de las celdas y, por extensión, la capa de celda, por lo que es preferible un medio de montaje de fraguado suave26.
- Usando una micropipeta, introduzca una cantidad mínima de un montante antidecolorante de fijación suave en cada pocillo, asegurándose de que la superficie inferior esté completamente cubierta y que no queden burbujas atrapadas dentro del área de imagen deseada25. Verifique la integridad de la capa celular observando bajo un microscopio de campo claro.
- Realice imágenes en el vidrio de cubierta con cámara de ocho pocillos.
- Ajuste la configuración del microscopio confocal, incluidos los parámetros de potencia, ganancia, desplazamiento y escaneo del láser, como la velocidad de escaneo, el área de escaneo, el formato de escaneo, la resolución y el diámetro27 del orificio del láser.
- Pruebe la ubicación de las imágenes tomando escaneos de referencia, así como pilas Z hasta que se hayan cumplido los parámetros y condiciones de imagen deseados. Parámetros de marcación en objetivos de aumento secuencialmente más altos hasta que se haya alcanzado el objetivo de inmersión en aceite 40x y optimizado28.
- Construye pilas Z de tres ubicaciones aleatorias en cada coincidencia entre densidad de siembra y duración de cultivo.
- Realizar procesamiento de imágenes y análisis de datos.
- Exporte secciones transversales XZ e YZ utilizando el paquete de software de microscopio confocal.
- Utilizando un software de procesamiento de imágenes con capacidades de detección de bordes (valor de umbral 15.0), mida el área total de la imagen en píxeles utilizando la herramienta Varita mágica fuera de la imagen, luego el área excluyendo el área de sección transversal total de la capa de celda en píxeles utilizando la herramienta Varita mágica en la parte de la imagen exterior a la capa de celda29.
- Con un software de procesamiento de datos, reste el valor del píxel del área exterior del valor del píxel del área total para encontrar el valor del píxel del área transversal.
- Convierta los valores de píxeles del área de la sección transversal a valores de μm2 multiplicando los valores de píxeles por el cuadrado del valor de μm/píxel como se indica en el software del microscopio para la imagen en particular (0,31 μm/píxel para pilas Z tomadas en resolución 1024p sin zoom en una lente de inmersión en aceite de 40x).
- Calcular medias y desviaciones estándar y graficar resultados.
Figura 3: Diagrama del vidrio de cubierta de ocho pocillos utilizado para el experimento de cultivo, tinción e imagen de pozo fijo que compara los efectos de la densidad inicial de siembra celular y la duración del cultivo en la formación de capas celulares. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El método presentado permite la visualización de capas celulares epiteliales cultivadas en canales de cultivo microfluídico y utiliza una demostración en entornos tradicionales de cultivo celular de pozo fijo como validación. Las imágenes adquiridas existirán en un espectro de calidad, intensidad de señal y especificidad de objetivo celular. Las imágenes exitosas demostrarán un alto contraste, lo que permitirá el análisis de imágenes y la cuantificación de datos para su posterior evaluación estadística. L...
Discusión
El protocolo presentado describe el cultivo, la fijación de reticulación, la tinción, la permeabilización y la visualización microscópica confocal de células epiteliales pulmonares humanas NCI-H441 en el entorno dinámico de una matriz de flujo microfluídico de un solo canal, así como en el entorno estático de un vidrio de cubierta tradicional de ocho pocillos. Con cualquier protocolo de cultivo celular microfluídico, las condiciones de flujo de los medios de cultivo celular son de suma importancia, ya que el ...
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Los autores reconocen a Alan Shepardson por diseñar el patrón de corte para el adhesivo 3M y la lámina de mylar utilizados en la construcción del canal microfluídico y por probar la velocidad de flujo de medios de cultivo celular y la programación de la bomba de jeringa. Los fondos fueron proporcionados por NIH R01 HL0142702, NSF CBET 1706801 y Newcomb-Tulane College Dean's Grant.
Materiales
| Name | Company | Catalog Number | Comments |
| A1R HD25 Confocal Microscope System | Nikon | A1R HD25 | https://www.microscope.healthcare.nikon. com/products/confocal-microscopes/a1hd25-a1rhd25/specifications |
| ActinGreen 488 ReadyProbes Reagent (AlexaFluor 488 phalloidin) | Invitrogen | R37110 | https://www.thermofisher.com/order/catalog/product/R37110 |
| Adhesive Transfer Tape Double Linered | 3M | 468MP | https://gizmodorks.com/3m-468mp-adhesive-transfer-tape-sheet-5-pack/ |
| Air-Tite HSW Soft-Ject Disposable Syringes | Air-Tite RL5 | 14-817-53 | https://www.fishersci.com/shop/products/air-tite-hsw-soft-ject-disposable-syringes-6/1481753#?keyword=syringe%20leur%20locking%205ml |
| BAISDY 4 mil (0.1 mm) Thick Mylar Sheet | BAISDY | AS022 | https://www.amazon.ca/Stencil-Perfect-Silhouette-Machines-BAISDY/dp/B07RJJ9BNC |
| Branson Ultrasonics M Series Ultrasonic Cleaning Bath | Branson Ultrasonics | 15-336-100 | https://www.fishersci.com/shop/products/m-series-ultrasonic-cleaning-bath/15336100 |
| Corning Fibronectin, Human | Fisher Scientific | CB-40008 | https://www.fishersci.com/shop/products/corning-fibronectin-human-3/CB40008?keyword=true |
| DPBS, calcium, magnesium | Gibco | 14040133 | https://www.thermofisher.com/order/catalog/product/14040133?SID=srch-srp-14040133 |
| ECIS Cultureware Disposable Electrode Arrays 8 x 10 ECIS Flow Array | Applied BioPhysics | 1F8x10E PC | https://www.biophysics.com/cultureware.php#1F8x10E |
| Enterprise Technology Solutions UV Sterilizer Cabinet, White | Enterprise Technology Solutions | 50-211-1163 | https://www.fishersci.com/shop/products/uv-sterilizer-cabinet-white/502111163 |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | https://www.thermofisher.com/order/catalog/product/26140079 |
| Finnpipette F2 Variable Volume Pipettes | Thermo Scientific | 4642090 | https://www.thermofisher.com/order/catalog/product/4642090 |
| Fisherbrand 50mL Easy Reader Plastic Centrifuge Tubes | Fisher Scientific | 06-443-21 | https://www.fishersci.com/shop/products/fisherbrand-higher-speed-easy-reader-plastic-centrifuge-tubes-8/p-193269 |
| Fisherbrand Cover Glasses: Rectangles (#1.5) | Fisher Scientific | 12-544-GP | https://www.fishersci.com/shop/products/cover-glasses-rectangles-promo-22/12544GP#coverglass |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-458 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955458 |
| Gibco RPMI 1640 Medium | Gibco | 11875093 | https://www.thermofisher.com/order/catalog/product/11875093 |
| Image-iT Fixative Solution (4% formaldehyde, methanol-free) | Invitrogen | FB002 | https://www.thermofisher.com/order/catalog/product/FB002 |
| ImageJ Fiji | ImageJ | ImageJ Fiji | https://imagej.net/downloads |
| Immersion Oil F 30 cc | Nikon | MXA22168 | https://www.microscope.healthcare.nikon. com/products/accessories/immersion-oil/specifications |
| Large-Capacity Reach-In CO2 Incubator, 821 L, Polished Stainless Steel | Thermo Scientific | 3950 | https://www.thermofisher.com/order/catalog/product/3950 |
| Laxco LMC-3000 Series Brightfield Compound Microscope System | Laxco | LMC3BF1 | https://www.fishersci.com/shop/products/lmc-3000-series-brightfield-compound-microscope-system-8/LMC3BF1 |
| Masterflex Fitting, Nylon, Straight, Male Luer Lock to Hose Barb Adapters, 1/16" ID; 25/PK | Masterflex | ZY-45505-31 | https://www.masterflex.com/i/masterflex-fitting-nylon-straight-male-luer-lock-to-hose-barb-adapters-1-16-id-25-pk/4550531?PubID=ZY&persist=true&ip=no& gclid=Cj0KCQiA3rKQBhCNARIsAC UEW_Zb5yXy1em6bGs0a9KFOk5k pdlkHCvAEslHumdqcnlwSN0MdR0 udmwaAuDHEALw_wcB |
| Microsoft Excel | Microsoft | 0016 | https://www.microsoft.com/en-us/download/details.aspx?id=56547 |
| National Target All-Plastic Disposable Syringes | Thermo Scientific | 03-377-24 | https://www.fishersci.com/shop/products/national-target-all-plastic-disposable-syringes/0337724#tab8 |
| NCI-H441 Human Epithelial Lung Cells | American Type Culture Collection (ATCC) | HTB-174 | https://www.atcc.org/products/htb-174 |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | https://www.syringepump.com/NE-16001800.php |
| NIS Elements AR | Nikon | NIS Elements AR | https://www.microscope.healthcare.nikon. com/products/software/nis-elements/nis-elements-advanced-research |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Invitrogen | R37605 | https://www.thermofisher.com/order/catalog/product/R37605?SID=srch-srp-R37605 |
| Nunc Lab-Tek Chambered Coverglass | Thermo Scientific | 155411 | https://www.thermofisher.com/order/catalog/product/155361 |
| Parafilm M Wrapping Film | Fisher Scientific | S37441 | https://www.fishersci.com/shop/products/parafilm-m-wrapping-film-3/S37441 |
| PendoTech 3-Way Stopcock, Polysulfone, Male/Female Luer Inlet x Female Luer Branch | PendoTech | ZY-19406-49 | https://www.masterflex.com/i/pendotech-3-way-stopcock-polysulfone-male-female-luer-inlet-x-female-luer-branch/1940649 |
| Phosphate Buffered Solution (PBS), pH 7.4 | Gibco | 10010023 | https://www.thermofisher.com/order/catalog/product/10010023 |
| Poly-D-Lysine | Gibco | A3890401 | https://www.thermofisher.com/order/catalog/product/A3890401#/A3890401 |
| Reynolds Aluminum Wrap Foil | Reynolds | 458742928317 | https://www.amazon.com/Reynolds-Wrap-Aluminum-Foil-Square/dp/B00UNT0Y2M |
| Saponin | Millipore Sigma (Sigma Aldrich) | 47036 | https://www.sigmaaldrich.com/US/en/product/sigma/47036 |
| SlowFade Glass Soft-set Antifade Mountant | Invitrogen | S36917-5X2ML | https://www.thermofisher.com/order/catalog/product/S36917-5X2ML |
| Thermo Scientific 1300 Series Class II, Type A2 Biological Safety Cabinet Package | Thermo Scientific | 13-100-752PM | https://www.fishersci.com/shop/products/1300-series-class-ii-type-a2-biological-safety-cabinet-package-promo/p-9049003#?keyword=biosafety%20hood |
| Tygon Transfer Tubing, BioPharm Platinum-Cured Silicone, 1/16" ID x 1/8" OD; 50 Ft | Cole-Parmer | EW-95702-01 | https://www.coleparmer.com/i/tygon-transfer-tubing-biopharm-platinum-cured-silicone-1-16-id-x-1-8-od-50-ft/9570201?searchterm=95702-01 |
Referencias
- Matthay, M. A., et al. Acute respiratory distress syndrome. Nature Reviews Disease Primers. 5, 18 (2019).
- Rawal, G., Yadav, S., Kumar, R. Acute respiratory distress syndrome: An update and Review. Journal of Translational Internal Medicine. 6 (2), 74-77 (2018).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface-tension-induced epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 94 (2), 770-783 (2003).
- Modrykamien, A. M., Gupta, P. The acute respiratory distress syndrome. Baylor University Medical Center Proceedings. 28 (2), 163-171 (2017).
- Jacob, A. -. M., Gaver, D. P. Atelectrauma disrupts pulmonary epithelial barrier integrity and alters the distribution of tight junction proteins ZO-1 and Claudin 4. Journal of Applied Physiology. 113 (9), 1377-1387 (2012).
- Kay, S. S., Bilek, A. M., Dee, K. C., Gaver, D. P. Pressure gradient, not exposure duration, determines the extent of epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 97 (1), 269-276 (2004).
- Jacob, A. M., Gaver, D. P. An investigation of the influence of cell topography on epithelial mechanical stresses during pulmonary airway reopening. Physics of Fluids. 17 (3), 031502 (1994).
- Gaver, D. P., et al. The POOR get POORer: A hypothesis for the pathogenesis of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 202 (8), 1081-1087 (2020).
- Jain, P., et al. Reconstruction of ultra-thin alveolar-capillary basement membrane mimics. Advanced Biology. 5 (8), 2000427 (2021).
- Byrne, M. B., Leslie, M. T., Gaskins, H. R., Kenis, P. J. A. Methods to study the tumor microenvironment under controlled oxygen conditions. Trends in Biotechnology. 32 (11), 556-563 (2014).
- Szulcek, R., Bogaard, H. J., van Nieuw Amerongen, G. P. Electric cell-substrate impedance sensing for the quantification of endothelial proliferation, barrier function, and motility. Journal of Visualized Experiments. (85), e51300 (2014).
- Jaccard, N., et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images. Biotechnology and Bioengineering. 111 (3), 504-517 (2013).
- Hagiyama, M., et al. Modest static pressure suppresses columnar epithelial cell growth in association with cell shape and cytoskeletal modifications. Frontiers in Physiology. 8, 00997 (2017).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of Nucleic Acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Zhu, L., Rajendram, M., Huang, K. C. Effects of fixation on bacterial cellular dimensions and integrity. Iscience. 24 (4), 102348 (2021).
- Lust, R. M. . The Pulmonary System. XPharm: The Comprehensive Pharmacology Reference. , 1-6 (2007).
- EpilogueLaser. FusionSeries: Pro & Edge Laser System Manual and Original Instructions. EpilogueLaser. , (2022).
- Chitnis, D. S., Katara, G., Hemvani, N., Chitnis, S., Chitnis, V. Surface disinfection by exposure to germicidal UV light. Indian Journal of Medical Microbiology. 26 (3), 241 (2008).
- Sandell, L., Sakai, D. Mammalian cell culture. Current Protocols Essential Laboratory Techniques. 5 (1), 4 (2011).
- New Era Pump Systems. Multi-Phaser Programmable Syringe Pump: NE-1000 Series User Manual. New Era Pump Systems. , (2014).
- Thermo Fisher Scientific. Safety Data Sheet: Image-iT Fixative Solution (4% formaldehyde, methanol-free). Thermo Fisher Scientific. , (2018).
- Thavarajah, R., Mudimbaimannar, V. K., Rao, U. K., Ranganathan, K., Elizabeth, J. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Jamur, M. C., Oliver, C. Permeabilization of cell membranes. Immunocytochemical Methods and Protocols. 588, 63-66 (2009).
- Thermo Fisher Scientific. ActinGreen 488 ReadyProbes Reagent Protocol. Thermo Fisher Scientific. , (2022).
- Slowfade Glass soft-set Antifade Mountant. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/S36917-5X2ML?SID=srch-hj-S36917-5X2ML (2022)
- Ravikumar, S., Surekha, R., Thavarajah, R. Mounting media: An overview. Journal of Dr. NTR University of Health Sciences. 3 (5), 1-8 (2014).
- Shihan, M. H., Novo, S. G., Le Marchand, S. J., Wang, Y., Duncan, M. K. A simple method for quantitating confocal fluorescent images. Biochemistry and Biophysics Reports. 25, 100916 (2021).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Ferriera, F., Rasband, W. ImageJ User Guide. National Institutes of Health. , (2012).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Smith, H. S., Riggs, J. L., Mosesson, M. W. Production of fibronectin by human epithelial cells in culture. American Association for Cancer Research. 39 (10), 4138-4144 (1979).
- Sieck, G. C., Mantilla, C. B., Prakash, Y. S. Volume measurements in confocal microscopy. Methods in Enzymology. 307, 296-315 (1999).
- Heijink, I. H., et al. Characterisation of cell adhesion in airway epithelial cell types using electric cell-substrate impedance sensing. European Respiratory Journal. 35 (4), 894-903 (2009).
- Zhang, X., Wang, W., Li, F., Voiculescu, I. Stretchable impedance sensor for mammalian cell proliferation measurements. Lab on a Chip. 17 (12), 2054-2066 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados