Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Fizyolojik Boyutta Bir Mikroakışkan Kültür Cihazında Epitel Hücre Tek Katmanlarının Hazırlanması ve Yapısal Değerlendirilmesi
Bu Makalede
Özet
Sunulan protokol, mikroakışkan dinamik kültür kanallarında ve geleneksel sabit kuyu statik kültür odalarında yapışkan hücre tabakası yapısını görselleştirmek için konfokal lazer tarama mikroskobu (CLSM) ile falloidin bazlı filamentöz-aktin boyama tekniğinin geliştirilmesini ve kullanımını açıklamaktadır. Bu yaklaşım, hücre katmanı akıcılığını, tek katmanlı oluşumu ve katman kalınlığı homojenliğini değerlendirmeye yardımcı olur.
Özet
İn vitro mikroakışkan deneyler, akut solunum sıkıntısı sendromu (ARDS) ve ventilatöre bağlı akciğer hasarı (VILI) gibi durumlarda meydana gelen mikrofizyolojik fenomenler hakkında birçok içgörü ortaya çıkarmak için büyük bir potansiyele sahiptir. Bununla birlikte, insan akciğerinin terminal bronşiyolleriyle fizyolojik olarak ilgili boyutlara sahip mikroakışkan kanallardaki çalışmalar, özellikle belirli bir kültür ortamında medya akış hızları da dahil olmak üzere uygun hücre kültürü koşullarının oluşturulmasındaki zorluklar nedeniyle şu anda çeşitli zorluklarla karşı karşıyadır. Sunulan protokol, oksijen geçirimsiz bir mikroakışkan kanalda kültürlenmiş NCI-H441 insan akciğer epitel hücrelerinin yapısını, fizyolojik olarak insan akciğerinin terminal bronşiyolleriyle ilgili boyutlarla değerlendirmek için görüntü tabanlı bir yaklaşımı tanımlamaktadır. Phalloidin bazlı filamentli-aktin boyama kullanılarak, hücrelerin sitoiskelet yapıları konfokal lazer tarama mikroskobu ile ortaya çıkarılır ve bireysel ve katmanlı hücrelerin görselleştirilmesine izin verilir. Daha sonraki niceleme, kullanılan hücre kültürü koşullarının daha fazla deney için uygun tek tip tek katmanlar üretip üretmediğini belirler. Protokol, mikroakışkan kanallarda ve geleneksel sabit kuyu ortamlarında hücre kültürü ve katman değerlendirme yöntemlerini açıklamaktadır. Buna kanal yapımı, hücre kültürü ve gerekli koşullar, fiksasyon, geçirgenlik ve boyama, konfokal mikroskobik görüntüleme, görüntü işleme ve veri analizi dahildir.
Giriş
Akut solunum sıkıntısı sendromu (ARDS), akciğer parankiminde yaralanmanın bozulması ve yayılmasından kaynaklanan, alveollerin pulmoner ödemi, yetersiz gaz değişimi ve ardından hipoksemi ile sonuçlanan akut bir durumdur1. Bu, pro-inflamatuar sitokin salınımı, nötrofil alımı, toksik mediatör salınımı ve doku hasarı döngüsünü başlatır ve bu da daha fazla enflamatuar yanıta neden olur2. Ek olarak, hava yollarını stabilize eden ve tekrarlayan işe alım / işe alımın (Ar-Ge) neden olduğu hasarı önleyen pulmoner sürfaktan ARDS sırasında meydana gelen kimyasal işlemler tarafından inaktive edilebilir veya başka bir şekilde işlevsiz hale getirilebilir, bu da çevredeki parankimde daha fazla stres ve yaralanmaya neden olabilir3. Yeterli hasar devam ederse, yeterli sistemik oksijenasyonu sağlamak için mekanik ventilasyon gerekebilir4. Bununla birlikte, mekanik ventilasyon, aşırı şişirme (volutravma) ve/veya sıvı tıkalı hava yolundaki hava-sıvı arayüzünün Ar/Ge'si (atelektravma) sırasında uygulanan mekanik streslerin neden olduğu akciğer parankiminin yaralanması olarak karakterize edilen ventilatöre bağlı akciğer hasarı (VILI) olasılığı da dahil olmak üzere kendi zorluklarını ve travmalarını ortaya koymaktadır5. Atelektravma modelinde hava-sıvı arayüzüne (sıvı tıkalı bronşiyolde olduğu gibi) maruz kalan epitel hücrelerinin yaşadığı basınç gradyanı, geçirgenlik kaynaklı bir obstrüktif yanıta (POOR) neden olabilir ve bu da POOR-get-POORer erdemli yaralanma döngüsüne yol açabilir 6,7,8.
İn vitro deneyler bu fenomenler hakkında mikro ölçekli içgörüler sağlayabilir, ancak fizyolojik olarak ilgili boyutlara sahip mikroakışkan kanal ortamlarındaki mevcut çalışmalar çeşitli zorluklarla karşı karşıyakalmaktadır 9. Birincisi, hücre kültürü koşullarının optimize edilmesi, mikroakışkan ortamlarda hücre kültürü araştırmasına girişte önemli bir engel oluşturur, çünkü ortam akış parametrelerinin, kültür süresinin ve diğer kültür koşullarının optimal hücre katmanı oluşumuna izin verdiği dar bir kesişim vardır. Bu, mikroakışkan kültür kanalı muhafazasının oksijen geçirimsiz doğası tarafından uygulanan difüzyon sınırlamalarını içerir. Bu, ortam akış parametrelerinin dikkatli bir şekilde dikkate alınmasını gerektirir, çünkü düşük akış hızları hücreleri, özellikle girişten en uzak olanları oksijenden mahrum bırakabilir; Öte yandan, yüksek akış hızları hücreleri kültür kanalının dışına itebilir veya yanlış veya düzensiz katman gelişimine neden olabilir. Difüzyon sınırlamaları, bir hava-sıvı arayüzü (ALI) kültür cihazında polidimetilsiloksan (PDMS) gibi oksijen geçirgen malzemeler kullanılarak ele alınabilir; Bununla birlikte, elektrik hücresi-substrat empedans algılama (ECIS) sistemi gibi birçok geleneksel mikroakışkan kültür kanalı, üretilen muhafazanın doğası göz önüne alındığında, doğal olarak oksijen geçirimsizdir10. Bu protokol, oksijen geçirimsiz bir muhafazada kültürlenmiş hücre katmanlarını analiz etmek için bir teknik sağlamayı amaçlamaktadır.
Kültür koşullarının uygulanabilirliğini karşılaştırırken, tek katmanlı bir katmanın varlığı, yüzey topolojisi, akıcılık ve katman kalınlığı homojenliği gibi belirli katman özelliklerinin gözlemleri, belirli bir kültür koşulları kümesi tarafından üretilen hücre katmanının istenen spesifikasyonları karşılayıp karşılamadığını ve gerçekten deneysel tasarımla ilgili olup olmadığını belirlemek için gereklidir. Sınırlı bir değerlendirme, akış dizisi içindeki altın elektrotlar üzerinde kültürlenmiş hücrelerin elektriksel olarak yalıtkan membranları tarafından uygulanan yüksek frekanslı alternatif akıma (AC) (empedans) direnç tarafından oluşturulan elektrik potansiyeli (voltaj) ölçümlerini kullanan ECIS gibi yöntemlerle gerçekleştirilebilir. Hücrelere uygulanan AC frekansını modüle ederek, hücrelerin ve hücre katmanlarının yüzey yapışma kuvveti, sıkı bağlantı noktası oluşumu ve hücre proliferasyonu veya akıcılığı gibi spesifik frekansa bağlı hücresel özellikleri hedeflenebilir ve incelenebilir11. Bununla birlikte, bu dolaylı ölçüm biçimlerinin bir deneyin başlangıcında yorumlanması biraz zordur ve hücre katmanının tüm ilgili yönlerini ölçemeyebilir. Hücre tabakasını bir faz-kontrast mikroskobu altında basitçe gözlemlemek, akıcılık gibi belirli niteliklerin doğasını ortaya çıkarabilir; Bununla birlikte, tek katmanlı ve katman kalınlığı homojenliğinin varlığı gibi birçok ilgili özellik, parlak alan, faz kontrastı veya floresan mikroskobik görüntüleme12 ile mümkün olmayan üç boyutlu (3B) bir değerlendirme gerektirir.
Bu çalışmanın amacı, tek katmanlı bir tabakanın görüntüleme tabanlı doğrulanmasına ve konfokal lazer tarama mikroskobu (CLSM) kullanılarak hücre tabakası homojenliğinin değerlendirilmesine olanak tanıyan bir filamentli-aktin boyama tekniği geliştirmektir. Filamentöz-aktin (F-aktin), kısmen F-aktin'in hücre zarını sıkıca takip etmesi ve tüm hücre hacminingörsel bir şekilde yaklaşmasına izin vermesi nedeniyle florofor konjugatı için uygun bir hedef olarak kabul edildi. F-aktin'i hedeflemenin bir diğer önemli yararı, F-aktin'in boyanmasının, hücrelerin yaşadığı stres ve suşların dayattığı sitoiskelet bozulmalarını veya değişikliklerini görsel olarak aydınlatmasıdır. Metanol içermeyen formaldehit ile çapraz bağlama fiksasyonu, hücrelerin ve hücre tabakasının morfolojisini korumak için kullanılmıştır, çünkü metanol gibi dehidratasyon fiksatifleri hücreleri düzleştirme, hücre tabakasını büyük ölçüde bozma ve özelliklerini değiştirme eğilimindedir14,15.
Katman değerlendirme tekniğinin bu zorlukları hafifletme yeteneğini belirlemek için, hücreler, eğer varsa, üretilen hücre katmanlarındaki farklılıkları değerlendirmek için geleneksel sekiz kuyucuklu kültür odalarında ve mikroakışkan kanallarda kültüre alınmıştır. Sabit kültür kuyuları için sekiz kuyucuklu odacıklı kapak camı üniteleri kullanılmıştır. Mikroakışkan kültür için, akış dizileri (kanal uzunluğu 50 mm, genişlik 5 mm, derinlik 0.6 mm), insan akciğerinin solunum bölgesinde bulunan terminal bronşiyollerle fizyolojik olarak ilgili boyutlara sahip bir ortamda kültürlenmiş insan akciğer epiteli (NCI-H441) hücrelerini kültürlemek için optimize edilmiştir16. Bu protokol, ECIS akış dizilerinin kültür ortamı göz önünde bulundurularak geliştirilmiş olsa da, kültürlenmiş hücre tabakası özelliklerinin veya kültür koşullarının değerlendirilmesinin gerekli olduğu herhangi bir oksijen geçirimsiz dinamik-kültür ortamı için geçerli olabilir.
Protokol
Bu çalışmada NCI-H441 insan epitelyal akciğer hücre hattı kullanılmıştır (bakınız Malzeme Tablosu).
1. Mikroakışkan kanaldaki hücre kültürü
- Mikroakışkan kanalı imal edin ve aşağıdaki adımları izleyerek ön işlemi gerçekleştirin.
- Tek kanallı bir akış dizisi elde edin (bkz. Malzemeler Tablosu) ve üst kısmı polikarbonat taban plakasından ayırın.
- 60 mm x 22 mm boyutlarında #1.5 dikdörtgen bir kapak camı (kalınlık 0.17 mm) elde edin. Ultrasonik bir banyoda kapak camının yüzeylerini temizleyin ve bir tarafa 30 dakika boyunca 60 ° C'de kurumadan önce 5 dakika oda sıcaklığında 0.1 mg / mL Poli-D-Lizin çözeltisi ile muamele edin.
- Akış dizisi üst kısmının ve akış kanalının (50 mm uzunluk, 5 mm genişlik) boyutlarına uyum sağlamak için lazerle kesilmiş 0,13 mm kalınlığında çift taraflı bir yapıştırıcı ( bkz. Malzeme Tablosuna bakınız), kanal kesimlerini hassas bir şekilde hizalamaya özen göstererek akış dizisi üst kısmına yapıştırın17.
- Akış dizisi üst kısmının ve akış kanalının boyutlarına uyum sağlamak için lazerle kesilmiş 0,1 mm kalınlığında bir mylar ara parçasını ( bkz. Malzeme Tablosu) yapışkan şerit üzerine yapıştırın ve kanal kesiklerini hassas bir şekilde hizalamaya özen gösterin.
- İstenen kanal yüksekliğine ulaşılana kadar 1.1.3 ve 1.1.4 adımlarını yineleyin (örneğin, 0,6 mm'lik bir kanal yüksekliği için iki ara parça ve üç yapışkan şerit kullanın).
- Poly-D-Lizin ile muamele edilmiş tarafı yapıştırıcıya bakacak şekilde en alttaki yapışkan şeride dikdörtgen bir kapak camı yapıştırın. Montaj tamamlandıktan sonra, Şekil 1'de gösterildiği gibi, konstrüksiyonun üstüne ve altına sağlam ve eşit basınç uygulayın ve 1 dakika bekleyin.
NOT: Kapak camı, yapıştırıcılar, ara parçalar ve akış dizisi üstü dahil olmak üzere kanal muhafazasının yapımı tamamlanmıştır. - Kanalı bir şırınga kullanarak deiyonize suyla durulayın, aynı anda sızıntıları kontrol edin.
- Kanal muhafazasını ultraviyole (UV) sterilizatörde 30 dakika boyunca sterilize edin18.
- Steril tekniği kullanarak, kanala fosfat tamponlu salin (PBS) içinde 2.0 μg / mL insan fibronektini ( Malzeme Tablosuna bakınız) uygulayın ve 37 ° C'de en az 30 dakika inkübe edin19.
- Aşağıdaki adımları izleyerek mikroakışkan kanalda hücre kültürü gerçekleştirin.
- Steril laminer akış davlumbazında, RPMI 1640 ortamındaki NCI-H441 hücrelerinin eşit bir süspansiyonunu% 10 fetal sığır serumu (FBS) ile aktarmak için bir mikropipet kullanın (bakınız Malzeme Tablosu), her biri 150.000 hücre /cm2 yüzey yoğunluğunda hücrelere sahip iki mikroakışkan kanalı tohumlamak için.
- 50 mm x 5 mm x 0,6 mm kanallar için, her bir kanalı ve bağlantı noktalarının bir kısmını doldurmak üzere 2,5 x 106 hücreli/mL süspansiyonun 0,25 mL'sini kullanın. Parlak alan mikroskobu kullanarak hücrelerin kanallar içinde eşit olarak dağıtıldığını doğrulayın.
- Programlanabilir bir şırınga pompası kullanarak 37 ° C'de sırasıyla 24 saat ve 48 saat boyunca %5 CO2 ile iki kanalı kültürleyin (bkz. Malzeme Tablosu), parafin filmle kaplanmış kesilmiş açık 20 mL'lik bir şırıngadan oluşan kanal girişine bağlı steril bir ortam haznesinden kanala harcanan medyayı ve taze ortamı kanaldan çekin.
- Hücre tohumlamasını takiben 10 dakikalık bir bekleme süresinden sonra, rezervuardan kanala 0,2 μL / dak'dan başlayan ve 4 saat boyunca 10 μL / dak'ya kadar yükselen değişken bir akış hızında taze ortam tanıtın ve pompalayın, bundan sonra20 oranında korunun.
NOT: Bu değişken akış hızı, hücrelerin (1) yerçekimsel olarak kültür yüzeyine yerleşmesine, (2) kültür yüzeyine yapışmasına ve (3) akıcı bir tek katman oluşturmasına izin veren kültür koşulları sağlar.
- Hücre tohumlamasını takiben 10 dakikalık bir bekleme süresinden sonra, rezervuardan kanala 0,2 μL / dak'dan başlayan ve 4 saat boyunca 10 μL / dak'ya kadar yükselen değişken bir akış hızında taze ortam tanıtın ve pompalayın, bundan sonra20 oranında korunun.
- Steril laminer akış davlumbazında, RPMI 1640 ortamındaki NCI-H441 hücrelerinin eşit bir süspansiyonunu% 10 fetal sığır serumu (FBS) ile aktarmak için bir mikropipet kullanın (bakınız Malzeme Tablosu), her biri 150.000 hücre /cm2 yüzey yoğunluğunda hücrelere sahip iki mikroakışkan kanalı tohumlamak için.
- Formaldehit çözeltisi kullanarak mikroakışkan kanalların içinde hücre fiksasyonu gerçekleştirin.
DİKKAT: Formaldehit toksiktir ve uygun bir kimyasal duman başlığı21'de işlenmelidir.- Kimyasal bir duman davlumbazında, iki adet 4 mL'lik porsiyon oluşturmak için PBS'de (metanolsüz) %4 formaldehit kullanarak formaldehit çözeltileri hazırlayın (bkz. Malzeme Tablosuna bakınız), seyreltici olarak Dulbecco'nun fosfat tamponlu salini (DPBS; Ca 2+ ve Mg2+ ile) kullanarak birincisini %1 formaldehit konsantrasyonuna ve ikincisi ila %2 formaldehit konsantrasyonuna seyreltin. Formaldehit çözeltilerini 5 mL şırıngaları ayırmak ve buna göre etiketlemek için aktarın. Ayrı bir 20 mL şırıngaya 20 mL DPBS çekin.
- Mikroakışkan kanalları kültür aparatından çıkarın ve kimyasal duman davlumbazına yerleştirin.
- Sabitleme ve boyama aparatını monte edin.
- 10 cm'lik bir transfer borusu segmentini, hortum dikeni adaptörüne bir erkek Luer kilidi aracılığıyla üç yönlü bir stopcock'un yan portuna takın (bkz.
- Ardından, aynı tip hortum dikeni adaptörünü kullanarak akış dizisinin çıkış portuna 10 cm'lik başka bir transfer borusu segmenti takın.
- Son olarak, her iki transfer tüpünün serbest uçlarını, etiketli boş 50 mL konik santrifüj tüpü gibi kimyasal ve biyolojik tehlikeye uygun bir atık konteynerine sabitleyin.
- Akış dizisi giriş portunu engellemek için stopcock'u çevirin ve atık hattını DPBS ile yıkayın. Ardından, atık hattını engellemek için stopcock'u çevirin ve hücreleri 2 mL DPBS ile yavaşça yıkayın. Her seferinde yeni çözeltiyi kullanarak yıkama adımını tekrarlayın. Kanala yeni bir çözelti (veya çözelti konsantrasyonu) verilir.
- Kanaldan yavaşça 2 mL% 1 fiksatif çözelti itin ve ardından 5 dakika22 bekletin.
- Kanaldan yavaşça 2 mL% 2 fiksatif çözelti itin ve ardından 15 dakika bekletin.
- Üç ayrı durumda (her biri 5 dakika) kanala yavaşça 2 mL taze DPBS ekleyerek hücreleri yıkayın.
- Her iki mikroakışkan kanal için 1.3.3-1.3.7 adımlarını paralel olarak tamamlayın.
- Mikroakışkan kanaldaki hücrelere boyama, geçirgenleştirme ve montaj ortamı ekleme.
- 4 mL çözelti üretmek için mL DPBS başına 1 mg saponin ( Malzeme Tablosuna bakınız) ekleyerek% 0.1 saponin çözeltisi hazırlayın ve23'ü karıştırmak için hafifçe vorteks yapın. 20 mL'lik bir şırıngaya 8 mL DPBS çekin.
- Bir F-aktin boyama faloidin reaktifi ve bir çekirdek boyama Hoechst reaktifi (bakınız Malzeme Tablosu), mL saponin çözeltisi başına her reaktifin iki damlasında (0.1 mL) % 0.1 saponin çözeltisine ekleyin. Alüminyum folyo24 ile kaplayarak hazırlanan boyama/geçirgenleştirici çözeltiyi ışıktan uzak tutun.
- Hattı az miktarda lekeleme / geçirgenleştirici çözelti ile yıkayın (adım 1.3.4'te açıklandığı gibi), daha sonra mikroakışkan kanala 2 mL çözelti ekleyin ve 30 dakika boyunca oda sıcaklığında oturmasına izin vermeden önce kanalı alüminyum folyo ile örtün.
- Boyama/geçirgenleştirici çözeltiyi, yıkama başına 5 dakika boyunca 2 mL DPBS ile iki kez yıkayın.
- Daha iyi görüntü kalitesi için, kanala uygun bir montaj ortamı (mikroskop objektif yağı ve kapak camı ile yakından eşleşen bir kırılma indeksi ile, bkz.
- Bir mikropipet kullanarak, mikroakışkan kanalın her bir portuna minimum miktarda yumuşak ayarlı bir antifade mountant ekleyerek, alt yüzeyin tamamen kaplanmasını ve istenen görüntüleme alanı25 içinde kabarcıkların sıkışmamasını sağlayın. Kanalın uçlarını kapatın ve parlak alan mikroskobu altında gözlemleyerek hücre katmanı bütünlüğünü doğrulayın.
- Her iki mikroakışkan kanal için 1.4.3-1.4.5 adımlarını paralel olarak tamamlayın.
NOT: Maksimum görüntü kalitesi için boyama işleminden sonra mümkün olan en kısa sürede görüntü hücreleri. Fotobeyazlatma meydana gelirse veya uzun süreli depolama istenirse, antifade veya numune koruyucu özelliklere sahip diğer montaj ortamları kullanılabilir. Sert kürlenen montaj ortamının hücrelerin 3B yapısını ve buna bağlı olarak hücre katmanını bozacağını unutmayın; Bu nedenle yumuşak ayarlı montaj malzemesitercih edilir 26.
- Aşağıdaki adımları izleyerek mikroakışkan kanaldaki görüntü hücreleri.
- Lazer gücü, kazanç, ofset ve tarama hızı, tarama alanı, tarama formatı, çözünürlük ve iğne deliği çapı27 gibi tarama parametreleri dahil olmak üzere konfokal mikroskop (bkz. Malzeme Tablosu) ayarlarını yapın.
- İstenilen görüntü parametreleri ve koşulları karşılanana kadar referans taramalarının yanı sıra Z yığınlarını da alarak görüntüleme konumunu test edin. 40x yağ daldırma hedefine ulaşılana ve optimize edilene kadar sıralı olarak daha yüksek büyütme hedeflerinde arama parametreleri28.
- Akış dizisi taban plakasını referans olarak kullanarak, Z-yığınlarını beş yerde, giriş tarafındaki ilk elektrotun muhtemel konumunda, merkez ile önceki konum arasında, merkezde, merkez ile son elektrotun konumu arasında (çıkış tarafında) ve son elektrotta yarıya kadar inşa edin, Şekil 2'de gösterildiği gibi.
- Görüntü işleme ve veri analizi gerçekleştirin.
- Konfokal mikroskop yazılım paketini kullanarak XZ ve YZ kesitlerini dışa aktarın (bkz.
- Kenar algılama özelliklerine (eşik değeri 15.0) sahip bir görüntü işleme yazılımı (bkz. Malzemeler Tablosu) kullanarak, görüntünün dışındaki Sihirli Değnek aracını kullanarak toplam görüntü alanını piksel cinsinden ölçün, ardından görüntünün hücre katmanı29'un dışındaki kısmındaki Sihirli Değnek aracını kullanarak hücre katmanının toplam kesit alanını piksel cinsinden hariç tutan alanı ölçün.
- Veri işleme yazılımını kullanarak (bkz. Malzemeler Tablosu), kesit alanı piksel değerini bulmak için dış alan piksel değerini toplam alan piksel değerinden çıkarın.
- Belirli bir görüntü için mikroskop yazılımında belirtildiği gibi piksel değerlerini μm/piksel değerinin karesiyle çarparak kesit alanı piksel değerleriniμm2 değerlerine dönüştürün (40x yağa daldırma lensinde yakınlaştırma olmadan 1024p çözünürlükte çekilen Z-yığınları için 0,31 μm/piksel).
- Veri ve grafik sonuçlarının ortalamalarını ve standart sapmalarını hesaplayın.
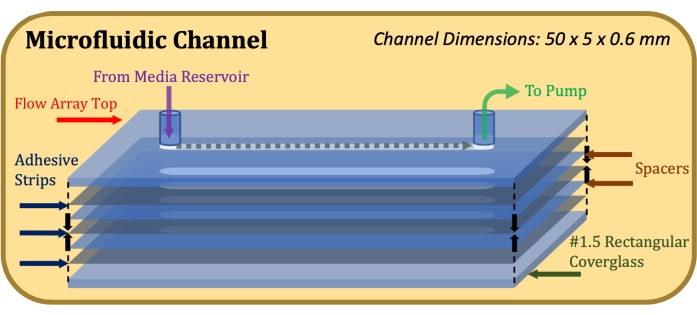
Resim 1: Mikroakışkan kanal konstrüksiyonunun patlamış görünüm şeması. Üst eleman akış dizisinin üst kısmıdır, ince gri elemanlar yapışkan şeritlerdir, ince mavi elemanlar mylar ara parçalardır ve alt eleman dikdörtgen kapak camıdır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
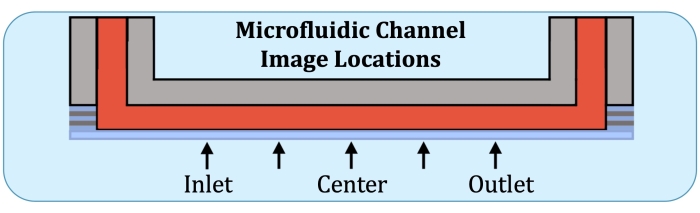
Şekil 2: Mikroakışkan kültür kanalının sürekli katman üreten bölgesi boyunca beş görüntüleme yeri. Görüntüleme konumları aşağıdaki gibidir: giriş tarafı, ilk elektrotun bozulmamış akış dizisinde olacağı yere yakın; giriş tarafı konumu ile kanalın merkezi arasında yarı yolda; kanalın merkezi; merkez ile çıkış tarafı konumu arasında ve çıkış tarafı arasında, son elektrotun bozulmamış akış dizisinde olacağı yere yakın. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
2. Sekiz kuyucuklu kapak camında hücre kültürü
- Sekiz kuyucuklu odacıklı kapak camının ön işlemini gerçekleştirin.
- #1.5 kapak camı ve hücre aderansını artıran yüzey işlemi ile üretilen steril sekiz kuyucuklu bir kapak camı elde edin (Şekil 3, bkz.
- Steril tekniği kullanarak, PBS'de kültür kuyularının yüzeyine 2.0 μg / mL insan fibronektini uygulayın ve 37 ° C'de en az 30 dakika inkübe edin19.
- Aşağıdaki adımları izleyerek odacıklı kapak camında hücre kültürü gerçekleştirin.
- Steril laminer akış davlumbazında, RPMI 1640 ortamında eşit olarak askıya alınmış NCI-H441 hücrelerinin çözeltilerinin 0,5 mL kısımlarını, sırasıyla 45.000, 90.000 ve 180.000 hücre/cm2 yüzey yoğunluklarında kültür kuyularını tohumlamak için 81.000, 162.000 ve 324.000 hücre/mL hacimsel yoğunluklarda %10 FBS ile aktarın. Hücrelerin parlak alan mikroskobu kullanarak kuyucuklar içinde eşit olarak dağıldığını doğrulayın.
- 37 °C'de 24 saat, 48 saat ve 96 saat boyunca %5 CO2 ile kültür hücreleri, günlük olarak medya değiştirir.
- Sekiz kuyucuklu odacıklı kapak camında formaldehit fiksasyonu gerçekleştirin.
DİKKAT: Formaldehit toksiktir ve uygun bir kimyasal duman başlığı21'de işlenmelidir.- Kimyasal bir duman davlumbazında, PBS'de (metanolsüz) iki kısım% 4 formaldehit yaparak formaldehit çözeltileri hazırlayın, ilkini% 1 formaldehit konsantrasyonuna ve diğerini% 2 formaldehite, seyreltici olarak Dulbecco'nun fosfat tamponlu salinini (DPBS; Ca 2 + ve Mg2 + ile) kullanarak seyreltin.
- Sekiz kuyucuklu kültür odacıklı kapak camını inkübatörden çıkarın ve kimyasal duman davlumbazına yerleştirin.
- Her bir kuyucuğun köşesinin üst kısmı boyunca yavaşça sıvı ekleyerek bir mikropipet kullanarak hücreleri 0,5 mL DPBS ile nazikçe yıkayın.
- Her bir kuyucuktaki mevcut sıvıyı, bir mikropipet kullanarak kuyucukların köşesinden yavaşça çıkararak çıkarın. Sıvı giriş yöntemini kullanarak (adım 2.3.3), her bir kuyucuğa 0.5 mL% 1 fiksatif çözelti uygulayın ve 5 dakika22 boyunca oturmasına izin verin.
- Adım 2.3.4'te belirtilen sıvı ekstraksiyon yöntemini kullanarak her bir kuyucuktaki mevcut sıvıyı çıkarın. Adım 2.3.3'te belirtilen sıvı giriş yöntemini kullanarak, her bir kuyucuğa 0,5 mL% 2 fiksatif çözelti uygulayın ve 15 dakika boyunca oturmasına izin verin.
- Sıvı giriş ve ekstraksiyon yöntemlerini (adım 2.3.3 ve 2.3.4) kullanarak, her bir kuyucukta her biri 5 dakika boyunca üç ayrı durumda 0,5 mL taze DPBS ekleyerek ve çıkararak hücreleri yıkayın.
- Sekiz kuyucuklu kapak camında boyama, geçirgenleştirme ve montaj ortamı ilavesi gerçekleştirin.
- DPBS mL başına 1 mg saponin ekleyerek % 0.1 saponin çözeltisi hazırlayın ve23'ü karıştırmak için hafifçe vorteks yapın.
- % 0.1 saponin çözeltisine, her biri bir F-aktin boyama faloidin reaktifinin her biri iki damla (0.1 mL) ve mL saponin çözeltisi başına bir çekirdek boyama Hoechst reaktifi ekleyin. Hazırlanan çözeltiyi alüminyum folyo24 ile kaplayarak ışıktan uzak tutun.
- Her bir kuyucuğa 0,2 mL boyama / geçirgenleştirici çözelti uygulayın ve odacıklı kapak camını 30 dakika oda sıcaklığında oturmasına izin vermeden önce alüminyum folyo ile örtün.
- Boyama/geçirgenleştirici çözeltiyi 0,5 mL DPBS ile iki kez yıkayın.
- Daha iyi görüntü kalitesi için, kuyucuklara uygun bir montaj ortamı (mikroskop objektif yağı ve kapak camıyla yakından eşleşen bir kırılma indeksi ile) ekleyin.
- Bir mikropipet kullanarak, her bir kuyucuğa minimum miktarda yumuşak ayarlı bir antifade mountant ekleyerek, alt yüzeyin tamamen kaplanmasını ve istenen görüntüleme alanı25 içinde kabarcıkların sıkışmamasını sağlayın. Parlak alan mikroskobu altında gözlemleyerek hücre katmanı bütünlüğünü doğrulayın.
NOT: Maksimum görüntü kalitesi için boyama işleminden sonra mümkün olan en kısa sürede görüntü hücreleri. Fotobeyazlatma meydana gelirse veya uzun süreli depolama istenirse, antifade veya numune koruyucu özelliklere sahip diğer montaj ortamları kullanılabilir. Sert kürlenen montaj ortamının hücrelerin 3B yapısını ve buna bağlı olarak hücre katmanını bozacağını, bu nedenle yumuşak ayarlı montaj medyasının tercih edilebilirolduğunu unutmayın 26.
- Bir mikropipet kullanarak, her bir kuyucuğa minimum miktarda yumuşak ayarlı bir antifade mountant ekleyerek, alt yüzeyin tamamen kaplanmasını ve istenen görüntüleme alanı25 içinde kabarcıkların sıkışmamasını sağlayın. Parlak alan mikroskobu altında gözlemleyerek hücre katmanı bütünlüğünü doğrulayın.
- Sekiz kuyucuklu kapak camında görüntüleme yapın.
- Lazer gücü, kazanç, ofset ve tarama hızı, tarama alanı, tarama formatı, çözünürlük ve iğne deliği çapı27 gibi tarama parametreleri dahil olmak üzere konfokal mikroskop ayarlarını yapın.
- İstenilen görüntü parametreleri ve koşulları karşılanana kadar referans taramalarının yanı sıra Z yığınlarını da alarak görüntüleme konumunu test edin. 40x yağ daldırma hedefine ulaşılana ve optimize edilene kadar sıralı olarak daha yüksek büyütme hedeflerinde arama parametreleri28.
- Her tohumlama yoğunluğu/kültür süresi eşleşmesinde üç rastgele konumdan oluşan Z-yığınları oluşturun.
- Görüntü işleme ve veri analizi gerçekleştirin.
- Konfokal mikroskop yazılım paketini kullanarak XZ ve YZ kesitlerini dışa aktarın.
- Kenar algılama özelliklerine sahip bir görüntü işleme yazılımı kullanarak (eşik değeri 15.0), görüntünün dışındaki Sihirli Değnek aracını kullanarak toplam görüntü alanını piksel cinsinden ölçün, ardından görüntünün hücre katmanı29'un dışındaki kısmındaki Sihirli Değnek aracını kullanarak hücre katmanının toplam kesit alanını piksel cinsinden hariç tutan alanı ölçün.
- Bir veri işleme yazılımı kullanarak, kesitsel alan piksel değerini bulmak için dış alan piksel değerini toplam alan piksel değerinden çıkarın.
- Piksel değerlerini, belirli bir görüntü için mikroskop yazılımında belirtildiği gibi μm/piksel değerinin karesiyle çarparak kesit alanı piksel değerleriniμm2 değerlerine dönüştürün (40x yağa daldırma lensinde yakınlaştırma olmadan 1024p çözünürlükte çekilen Z-yığınları için 0,31 μm/piksel).
- Ortalamaları, standart sapmaları ve grafik sonuçlarını hesaplayın.
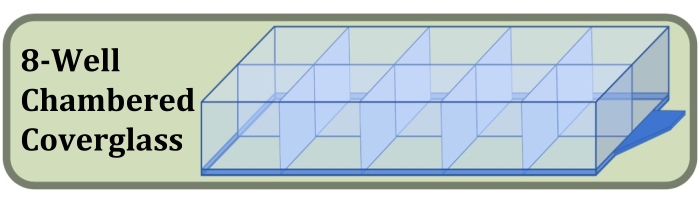
Şekil 3: İlk hücre tohumlama yoğunluğunun ve kültür süresinin hücre katmanlarının oluşumu üzerindeki etkilerini karşılaştıran sabit kuyucuklu kültür, boyama ve görüntüleme deneyi için kullanılan sekiz kuyucuklu odacıklı kapak camının diyagramı. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Sunulan yöntem, mikroakışkan kültür kanallarında kültürlenen epitel hücre katmanlarının görselleştirilmesine izin verir ve doğrulama olarak geleneksel sabit kuyucuklu hücre kültürü ortamlarında bir gösterim kullanır. Elde edilen görüntüler bir kalite, sinyal yoğunluğu ve hücresel hedef özgüllüğü spektrumunda bulunacaktır. Başarılı görüntüler yüksek kontrast gösterecek ve sonraki istatistiksel değerlendirme için görüntü analizine ve verilerin nicelleştirilmesine izin verecekt...
Tartışmalar
Sunulan protokol, NCI-H441 insan akciğer epitel hücrelerinin kültürünü, çapraz bağlama fiksasyonunu, boyanmasını, geçirgenliğini ve konfokal mikroskobik görselleştirmesini, tek kanallı bir mikroakışkan akış dizisinin dinamik ortamında ve ayrıca geleneksel sekiz kuyulu odacıklı bir kapak camının statik ortamında açıklamaktadır. Herhangi bir mikroakışkan hücre kültürü protokolünde, hücre kültürü ortamının akış koşulları çok önemlidir, çünkü yüksek oranlı akış hücreler...
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Yazarlar, Alan Shepardson'a mikroakışkan kanal yapımında kullanılan 3M yapıştırıcı ve mylar levha için kesme desenini tasarladığı ve hücre kültürü ortam akış hızını ve şırınga pompası programlamasını test ettiği için teşekkür eder. Finansman NIH R01 HL0142702, NSF CBET 1706801 ve Newcomb-Tulane College Dean's Grant tarafından sağlandı.
Malzemeler
| Name | Company | Catalog Number | Comments |
| A1R HD25 Confocal Microscope System | Nikon | A1R HD25 | https://www.microscope.healthcare.nikon. com/products/confocal-microscopes/a1hd25-a1rhd25/specifications |
| ActinGreen 488 ReadyProbes Reagent (AlexaFluor 488 phalloidin) | Invitrogen | R37110 | https://www.thermofisher.com/order/catalog/product/R37110 |
| Adhesive Transfer Tape Double Linered | 3M | 468MP | https://gizmodorks.com/3m-468mp-adhesive-transfer-tape-sheet-5-pack/ |
| Air-Tite HSW Soft-Ject Disposable Syringes | Air-Tite RL5 | 14-817-53 | https://www.fishersci.com/shop/products/air-tite-hsw-soft-ject-disposable-syringes-6/1481753#?keyword=syringe%20leur%20locking%205ml |
| BAISDY 4 mil (0.1 mm) Thick Mylar Sheet | BAISDY | AS022 | https://www.amazon.ca/Stencil-Perfect-Silhouette-Machines-BAISDY/dp/B07RJJ9BNC |
| Branson Ultrasonics M Series Ultrasonic Cleaning Bath | Branson Ultrasonics | 15-336-100 | https://www.fishersci.com/shop/products/m-series-ultrasonic-cleaning-bath/15336100 |
| Corning Fibronectin, Human | Fisher Scientific | CB-40008 | https://www.fishersci.com/shop/products/corning-fibronectin-human-3/CB40008?keyword=true |
| DPBS, calcium, magnesium | Gibco | 14040133 | https://www.thermofisher.com/order/catalog/product/14040133?SID=srch-srp-14040133 |
| ECIS Cultureware Disposable Electrode Arrays 8 x 10 ECIS Flow Array | Applied BioPhysics | 1F8x10E PC | https://www.biophysics.com/cultureware.php#1F8x10E |
| Enterprise Technology Solutions UV Sterilizer Cabinet, White | Enterprise Technology Solutions | 50-211-1163 | https://www.fishersci.com/shop/products/uv-sterilizer-cabinet-white/502111163 |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | https://www.thermofisher.com/order/catalog/product/26140079 |
| Finnpipette F2 Variable Volume Pipettes | Thermo Scientific | 4642090 | https://www.thermofisher.com/order/catalog/product/4642090 |
| Fisherbrand 50mL Easy Reader Plastic Centrifuge Tubes | Fisher Scientific | 06-443-21 | https://www.fishersci.com/shop/products/fisherbrand-higher-speed-easy-reader-plastic-centrifuge-tubes-8/p-193269 |
| Fisherbrand Cover Glasses: Rectangles (#1.5) | Fisher Scientific | 12-544-GP | https://www.fishersci.com/shop/products/cover-glasses-rectangles-promo-22/12544GP#coverglass |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-458 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955458 |
| Gibco RPMI 1640 Medium | Gibco | 11875093 | https://www.thermofisher.com/order/catalog/product/11875093 |
| Image-iT Fixative Solution (4% formaldehyde, methanol-free) | Invitrogen | FB002 | https://www.thermofisher.com/order/catalog/product/FB002 |
| ImageJ Fiji | ImageJ | ImageJ Fiji | https://imagej.net/downloads |
| Immersion Oil F 30 cc | Nikon | MXA22168 | https://www.microscope.healthcare.nikon. com/products/accessories/immersion-oil/specifications |
| Large-Capacity Reach-In CO2 Incubator, 821 L, Polished Stainless Steel | Thermo Scientific | 3950 | https://www.thermofisher.com/order/catalog/product/3950 |
| Laxco LMC-3000 Series Brightfield Compound Microscope System | Laxco | LMC3BF1 | https://www.fishersci.com/shop/products/lmc-3000-series-brightfield-compound-microscope-system-8/LMC3BF1 |
| Masterflex Fitting, Nylon, Straight, Male Luer Lock to Hose Barb Adapters, 1/16" ID; 25/PK | Masterflex | ZY-45505-31 | https://www.masterflex.com/i/masterflex-fitting-nylon-straight-male-luer-lock-to-hose-barb-adapters-1-16-id-25-pk/4550531?PubID=ZY&persist=true&ip=no& gclid=Cj0KCQiA3rKQBhCNARIsAC UEW_Zb5yXy1em6bGs0a9KFOk5k pdlkHCvAEslHumdqcnlwSN0MdR0 udmwaAuDHEALw_wcB |
| Microsoft Excel | Microsoft | 0016 | https://www.microsoft.com/en-us/download/details.aspx?id=56547 |
| National Target All-Plastic Disposable Syringes | Thermo Scientific | 03-377-24 | https://www.fishersci.com/shop/products/national-target-all-plastic-disposable-syringes/0337724#tab8 |
| NCI-H441 Human Epithelial Lung Cells | American Type Culture Collection (ATCC) | HTB-174 | https://www.atcc.org/products/htb-174 |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | https://www.syringepump.com/NE-16001800.php |
| NIS Elements AR | Nikon | NIS Elements AR | https://www.microscope.healthcare.nikon. com/products/software/nis-elements/nis-elements-advanced-research |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Invitrogen | R37605 | https://www.thermofisher.com/order/catalog/product/R37605?SID=srch-srp-R37605 |
| Nunc Lab-Tek Chambered Coverglass | Thermo Scientific | 155411 | https://www.thermofisher.com/order/catalog/product/155361 |
| Parafilm M Wrapping Film | Fisher Scientific | S37441 | https://www.fishersci.com/shop/products/parafilm-m-wrapping-film-3/S37441 |
| PendoTech 3-Way Stopcock, Polysulfone, Male/Female Luer Inlet x Female Luer Branch | PendoTech | ZY-19406-49 | https://www.masterflex.com/i/pendotech-3-way-stopcock-polysulfone-male-female-luer-inlet-x-female-luer-branch/1940649 |
| Phosphate Buffered Solution (PBS), pH 7.4 | Gibco | 10010023 | https://www.thermofisher.com/order/catalog/product/10010023 |
| Poly-D-Lysine | Gibco | A3890401 | https://www.thermofisher.com/order/catalog/product/A3890401#/A3890401 |
| Reynolds Aluminum Wrap Foil | Reynolds | 458742928317 | https://www.amazon.com/Reynolds-Wrap-Aluminum-Foil-Square/dp/B00UNT0Y2M |
| Saponin | Millipore Sigma (Sigma Aldrich) | 47036 | https://www.sigmaaldrich.com/US/en/product/sigma/47036 |
| SlowFade Glass Soft-set Antifade Mountant | Invitrogen | S36917-5X2ML | https://www.thermofisher.com/order/catalog/product/S36917-5X2ML |
| Thermo Scientific 1300 Series Class II, Type A2 Biological Safety Cabinet Package | Thermo Scientific | 13-100-752PM | https://www.fishersci.com/shop/products/1300-series-class-ii-type-a2-biological-safety-cabinet-package-promo/p-9049003#?keyword=biosafety%20hood |
| Tygon Transfer Tubing, BioPharm Platinum-Cured Silicone, 1/16" ID x 1/8" OD; 50 Ft | Cole-Parmer | EW-95702-01 | https://www.coleparmer.com/i/tygon-transfer-tubing-biopharm-platinum-cured-silicone-1-16-id-x-1-8-od-50-ft/9570201?searchterm=95702-01 |
Referanslar
- Matthay, M. A., et al. Acute respiratory distress syndrome. Nature Reviews Disease Primers. 5, 18 (2019).
- Rawal, G., Yadav, S., Kumar, R. Acute respiratory distress syndrome: An update and Review. Journal of Translational Internal Medicine. 6 (2), 74-77 (2018).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface-tension-induced epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 94 (2), 770-783 (2003).
- Modrykamien, A. M., Gupta, P. The acute respiratory distress syndrome. Baylor University Medical Center Proceedings. 28 (2), 163-171 (2017).
- Jacob, A. -. M., Gaver, D. P. Atelectrauma disrupts pulmonary epithelial barrier integrity and alters the distribution of tight junction proteins ZO-1 and Claudin 4. Journal of Applied Physiology. 113 (9), 1377-1387 (2012).
- Kay, S. S., Bilek, A. M., Dee, K. C., Gaver, D. P. Pressure gradient, not exposure duration, determines the extent of epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 97 (1), 269-276 (2004).
- Jacob, A. M., Gaver, D. P. An investigation of the influence of cell topography on epithelial mechanical stresses during pulmonary airway reopening. Physics of Fluids. 17 (3), 031502 (1994).
- Gaver, D. P., et al. The POOR get POORer: A hypothesis for the pathogenesis of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 202 (8), 1081-1087 (2020).
- Jain, P., et al. Reconstruction of ultra-thin alveolar-capillary basement membrane mimics. Advanced Biology. 5 (8), 2000427 (2021).
- Byrne, M. B., Leslie, M. T., Gaskins, H. R., Kenis, P. J. A. Methods to study the tumor microenvironment under controlled oxygen conditions. Trends in Biotechnology. 32 (11), 556-563 (2014).
- Szulcek, R., Bogaard, H. J., van Nieuw Amerongen, G. P. Electric cell-substrate impedance sensing for the quantification of endothelial proliferation, barrier function, and motility. Journal of Visualized Experiments. (85), e51300 (2014).
- Jaccard, N., et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images. Biotechnology and Bioengineering. 111 (3), 504-517 (2013).
- Hagiyama, M., et al. Modest static pressure suppresses columnar epithelial cell growth in association with cell shape and cytoskeletal modifications. Frontiers in Physiology. 8, 00997 (2017).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of Nucleic Acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Zhu, L., Rajendram, M., Huang, K. C. Effects of fixation on bacterial cellular dimensions and integrity. Iscience. 24 (4), 102348 (2021).
- Lust, R. M. . The Pulmonary System. XPharm: The Comprehensive Pharmacology Reference. , 1-6 (2007).
- EpilogueLaser. FusionSeries: Pro & Edge Laser System Manual and Original Instructions. EpilogueLaser. , (2022).
- Chitnis, D. S., Katara, G., Hemvani, N., Chitnis, S., Chitnis, V. Surface disinfection by exposure to germicidal UV light. Indian Journal of Medical Microbiology. 26 (3), 241 (2008).
- Sandell, L., Sakai, D. Mammalian cell culture. Current Protocols Essential Laboratory Techniques. 5 (1), 4 (2011).
- New Era Pump Systems. Multi-Phaser Programmable Syringe Pump: NE-1000 Series User Manual. New Era Pump Systems. , (2014).
- Thermo Fisher Scientific. Safety Data Sheet: Image-iT Fixative Solution (4% formaldehyde, methanol-free). Thermo Fisher Scientific. , (2018).
- Thavarajah, R., Mudimbaimannar, V. K., Rao, U. K., Ranganathan, K., Elizabeth, J. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Jamur, M. C., Oliver, C. Permeabilization of cell membranes. Immunocytochemical Methods and Protocols. 588, 63-66 (2009).
- Thermo Fisher Scientific. ActinGreen 488 ReadyProbes Reagent Protocol. Thermo Fisher Scientific. , (2022).
- Slowfade Glass soft-set Antifade Mountant. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/S36917-5X2ML?SID=srch-hj-S36917-5X2ML (2022)
- Ravikumar, S., Surekha, R., Thavarajah, R. Mounting media: An overview. Journal of Dr. NTR University of Health Sciences. 3 (5), 1-8 (2014).
- Shihan, M. H., Novo, S. G., Le Marchand, S. J., Wang, Y., Duncan, M. K. A simple method for quantitating confocal fluorescent images. Biochemistry and Biophysics Reports. 25, 100916 (2021).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Ferriera, F., Rasband, W. ImageJ User Guide. National Institutes of Health. , (2012).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Smith, H. S., Riggs, J. L., Mosesson, M. W. Production of fibronectin by human epithelial cells in culture. American Association for Cancer Research. 39 (10), 4138-4144 (1979).
- Sieck, G. C., Mantilla, C. B., Prakash, Y. S. Volume measurements in confocal microscopy. Methods in Enzymology. 307, 296-315 (1999).
- Heijink, I. H., et al. Characterisation of cell adhesion in airway epithelial cell types using electric cell-substrate impedance sensing. European Respiratory Journal. 35 (4), 894-903 (2009).
- Zhang, X., Wang, W., Li, F., Voiculescu, I. Stretchable impedance sensor for mammalian cell proliferation measurements. Lab on a Chip. 17 (12), 2054-2066 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır