A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הכנה והערכה מבנית של חד-שכבות תאי אפיתל במכשיר תרבית מיקרופלואידית בגודל פיזיולוגי
In This Article
Summary
הפרוטוקול המוצג מתאר את הפיתוח והשימוש בטכניקת צביעת אקטין נימה מבוססת פלואידין עם מיקרוסקופ סריקת לייזר קונפוקלי (CLSM) כדי להמחיש את מבנה שכבת התא הדבק בתעלות תרבית דינמיות מיקרופלואידיות ובתאי תרבית סטטיים קבועים מסורתיים. גישה זו מסייעת בהערכת מפגש שכבות התא, היווצרות חד-שכבתית ואחידות בעובי השכבה.
Abstract
ניסויים מיקרופלואידים במבחנה טומנים בחובם פוטנציאל רב לחשוף תובנות רבות על תופעות מיקרופיזיולוגיות המתרחשות במצבים כגון תסמונת מצוקה נשימתית חריפה (ARDS) ופגיעה ריאתית הנגרמת על ידי הנשמה (VILI). עם זאת, מחקרים בתעלות מיקרופלואידיות בעלות ממדים רלוונטיים פיזיולוגית לסימפונות הסופניים של הריאה האנושית עומדים כיום בפני מספר אתגרים, במיוחד בשל קשיים בקביעת תנאי תרבית תאים מתאימים, כולל קצב זרימת מדיה, בסביבת תרבית נתונה. הפרוטוקול המוצג מתאר גישה מבוססת תמונה להערכת המבנה של תאי אפיתל ריאה אנושיים NCI-H441 בתרבית בתעלה מיקרופלואידית אטומה לחמצן עם ממדים רלוונטיים פיזיולוגית לסימפונות הסופניים של הריאה האנושית. באמצעות צביעת אקטין נימה מבוססת פלואדין, מבני השלד הציטו-שלד של התאים נחשפים על ידי מיקרוסקופ סריקת לייזר קונפוקלי, המאפשר הדמיה של תאים בודדים כמו גם שכבות. כימות לאחר מכן קובע אם תנאי תרבית התאים המופעלים מייצרים מונושכבות אחידות המתאימות לניסויים נוספים. הפרוטוקול מתאר תרביות תאים ושיטות הערכת שכבות בתעלות מיקרופלואידיות ובסביבות מסורתיות של באר קבועה. זה כולל בניית תעלות, תרבית תאים ותנאים נדרשים, קיבוע, חלחול וצביעה, הדמיה מיקרוסקופית קונפוקלית, עיבוד תמונה וניתוח נתונים.
Introduction
תסמונת מצוקה נשימתית חריפה (ARDS) היא מצב חריף הנובע מעלבון והתפשטות של פגיעה בפרנכימת הריאות, וכתוצאה מכך בצקת ריאות של הנאדיות, חילופי גזים לקויים, והיפוקסמיה, לאחר מכן היפוקסמיה1. זה מתחיל מחזור של שחרור ציטוקינים פרו-דלקתיים, גיוס נויטרופילים, שחרור מתווך רעיל ונזק לרקמות, אשר עצמו גורר תגובה דלקתית נוספת2. בנוסף, פעילי שטח ריאתיים, אשר מייצבים את דרכי הנשימה ומונעים נזק הנגרם על ידי גיוס/גיוס חוזר (R/D), עלול להיות מושבת או להפוך לבלתי מתפקד בדרך אחרת על ידי תהליכים כימיים המתרחשים במהלך ARDS, וכתוצאה מכך מתח נוסף ופגיעה בפרנכימה3 שמסביב. אם נגרם נזק מספיק, ייתכן שיהיה צורך באוורור מכני כדי להבטיח חמצון מערכתי נאות4. עם זאת, אוורור מכני מטיל אתגרים וטראומות משלו, כולל האפשרות של פגיעה ריאתית כתוצאה מהנשמה (VILI), המאופיינת כפגיעה בפרנכימת הריאה הנגרמת על ידי לחצים מכניים המופעלים במהלך ניפוח יתר (וולוטראומה) ו / או R/D של ממשק אוויר-נוזל בנתיב האוויר החסום בנוזל (atelectrauma)5. שיפוע הלחץ שחווים תאי אפיתל החשופים לממשק אוויר-נוזל (כמו בסימפונות חבויים בנוזל) במודל האטלקטטראומה יכול לגרום לתגובה חסימתית שמקורה בחדירות (POOR), מה שמוביל למעגל מוסרי של פציעה 6,7,8.
ניסויים במבחנה יכולים לספק תובנות בקנה מידה מיקרוני על תופעות אלה, אך מחקרים עכשוויים בסביבות תעלות מיקרופלואידיות עם ממדים רלוונטיים מבחינה פיזיולוגית עומדים בפני מספר אתגרים9. ראשית, אופטימיזציה של תנאי תרביות תאים מהווה חסם כניסה משמעותי למחקר תרביות תאים בסביבות מיקרופלואידיות, שכן קיים צומת צר שבתוכו פרמטרים של זרימת מדיה, משך תרבית ותנאי תרבית אחרים מאפשרים היווצרות אופטימלית של שכבת התא. זה כולל את מגבלות הדיפוזיה המוטלות על ידי הטבע הבלתי חדיר לחמצן של מארז תעלת התרבית המיקרופלואידית. זה מחייב התחשבות זהירה בפרמטרים של זרימת מדיה, שכן קצבי זרימה נמוכים יכולים למנוע מהתאים חמצן, במיוחד אלה הרחוקים ביותר מהמפרצון; מצד שני, קצבי זרימה גבוהים יכולים לדחוף תאים אל מחוץ לתעלת התרבית או לגרום להתפתחות שכבה לא תקינה או לא אחידה. ניתן לטפל במגבלות הדיפוזיה על ידי שימוש בחומרים חדירים לחמצן כגון פולידימתילסילוקסאן (PDMS) במנגנון תרבית ממשק אוויר-נוזל (ALI); עם זאת, תעלות תרבית מיקרופלואידיות קונבנציונליות רבות, כגון אלה של מערכת חישת עכבת המצע החשמלי של התא (ECIS), הן מטבען אטומות לחמצן, בהתחשב בטבעו של המארז המיוצר10. פרוטוקול זה נועד לספק טכניקה לניתוח שכבות תאים בתרבית במארז אטום לחמצן.
כאשר משווים את הכדאיות של תנאי תרבית, יש צורך בתצפיות של מאפייני שכבה ספציפיים, כגון נוכחות של חד-שכבתיות, טופולוגיית פני שטח, מפגש ואחידות בעובי שכבה, כדי לקבוע אם שכבת התא המיוצרת על ידי קבוצה מסוימת של תנאי תרבית עומדת במפרט הרצוי ואכן רלוונטית לתכנון הניסוי. הערכה מוגבלת יכולה להתבצע בשיטות כגון ECIS, המשתמשת במדידות של פוטנציאל חשמלי (מתח) שנוצר על ידי התנגדות לזרם חילופין בתדר גבוה (AC) (עכבה) המוטלת על ידי ממברנות מבודדות חשמלית של תאים בתרבית על אלקטרודות זהב בתוך מערך הזרימה. על ידי אפנון התדר של AC המופעל על תאים, תכונות תאיות תלויות תדר ספציפיות של התאים ושכבות התא כגון חוזק היצמדות פני השטח, היווצרות צומת הדוק, והתפשטות תאים או מפגש תאים עשויות להיות ממוקדות ונבדקות11. עם זאת, צורות עקיפות אלה של מדידות הן קצת קשה לפרש בתחילת הניסוי, ולא יכול לכמת את כל ההיבטים הרלוונטיים של שכבת התא. התבוננות פשוטה בשכבת התא תחת מיקרוסקופ ניגודיות פאזה עשויה לחשוף את טבען של תכונות מסוימות כגון מפגש; עם זאת, מאפיינים רלוונטיים רבים כגון נוכחות חד-שכבתית ואחידות בעובי השכבה דורשים הערכה תלת-ממדית (תלת-ממדית) שאינה אפשרית עם הדמיה מיקרוסקופית של שדה בהיר, ניגודיות פאזה או פלואורסצנטית12.
מטרת מחקר זה הייתה לפתח טכניקת צביעת אקטין נימה שתאפשר אימות מבוסס הדמיה של שכבה חד-שכבתית והערכת אחידות שכבת התא באמצעות מיקרוסקופ סריקת לייזר קונפוקלי (CLSM). Filamentous-actin (F-actin) נחשב למטרה מתאימה לצמידות פלואורופור, בין השאר בשל האופן שבו F-actin עוקב בחוזקה אחר קרום התא, מה שמאפשר קירוב חזותי של נפח התא כולו13. יתרון חשוב נוסף של מיקוד F-actin הוא האופן שבו צביעה של F-actin מבהירה חזותית הפרעות בשלד או שינויים המוטלים על ידי לחצים וזנים שחווים התאים. קיבוע צולב עם פורמלדהיד נטול מתנול שימש לשימור המורפולוגיה של התאים ושכבת התא, שכן קיבועים מייבשים כגון מתנול נוטים לשטח תאים, לעוות באופן גס את שכבת התא ולשנות את תכונותיה14,15.
כדי לקבוע את יכולתה של טכניקת הערכת השכבות למתן אתגרים אלה, תאים גודלו בתרבית בתאי תרבית מסורתיים של שמונה בארות, כמו גם בתעלות מיקרופלואידיות כדי להעריך את ההבדלים, אם בכלל, בשכבות התא שנוצרו. עבור בארות תרבות קבועות, יחידות כיסוי שמונה בארות שימש יחידות כיסוי קימור. עבור תרבית מיקרופלואידית, מערכי זרימה (אורך תעלה 50 מ"מ, רוחב 5 מ"מ, עומק 0.6 מ"מ) הותאמו לתאי אפיתל ריאה אנושיים מונצחים (NCI-H441) בסביבה עם ממדים רלוונטיים פיזיולוגית לסימפונות הסופניים הנמצאים באזור הנשימה של הריאה האנושית16. בעוד פרוטוקול זה פותח תוך התחשבות בסביבת התרבית של מערכי זרימת ECIS, הוא עשוי לחול על כל סביבה דינמית-תרבית אטומה לחמצן שעבורה נדרשת הערכה של מאפייני שכבת התא בתרבית או תנאי תרבית.
Protocol
קו תאי הריאה האפיתל האנושי NCI-H441 שימש במחקר הנוכחי (ראה טבלת חומרים).
1. תרבית תאים בתעלה המיקרופלואידית
- לייצר את התעלה המיקרופלואידית ולבצע את הטיפול המקדים לפי השלבים הבאים.
- קבל מערך זרימה חד-ערוצי (ראה טבלת חומרים) והפרד את החלק העליון מלוח בסיס הפוליקרבונט.
- השג זכוכית כיסוי מלבנית #1.5 (עובי 0.17 מ"מ) בממדים של 60 מ"מ x 22 מ"מ. נקו את המשטחים של זכוכית הכיסוי באמבטיה על-קולית וטפלו בצד אחד בתמיסת פולי-די-ליזין במינון 0.1 מ"ג/מ"ל בטמפרטורת החדר למשך 5 דקות לפני ייבוש ב-60°C למשך 30 דקות.
- הצמידו דבק דו-צדדי בעובי 0.13 מ"מ (ראו טבלת חומרים), בחיתוך לייזר כדי להתאים למידות ראש מערך הזרימה ותעלת הזרימה (50 מ"מ אורך, 5 מ"מ רוחב), לראש מערך הזרימה, תוך הקפדה על יישור מדויק של מגזרות התעלה17.
- הצמידו ספייסר מיילרי בעובי 0.1 מ"מ (ראו טבלת חומרים), בחיתוך לייזר כדי להתאים למידות ראש מערך הזרימה ותעלת הזרימה, לרצועת ההדבקה, תוך הקפדה על יישור מדויק של חתכי התעלה.
- חזור על שלבים 1.1.3 ו- 1.1.4 עד להשגת גובה הערוץ הרצוי (לדוגמה, עבור גובה ערוץ של 0.6 מ"מ, השתמש בשני ספייסרים ובשלוש רצועות דבק).
- הצמידו זכוכית כיסוי מלבנית לרצועת הדבק התחתונה ביותר, כאשר הצד המטופל בפולי-D-ליזין פונה אל הדבק. לאחר השלמת ההרכבה, כפי שמצוין באיור 1, הפעילו לחץ יציב ושווה על החלק העליון והתחתון של המבנה והחזיקו למשך דקה אחת.
הערה: בניית מארז התעלה, כולל זכוכית כיסוי, דבקים, ספייסרים וראש מערך זרימה, הושלמה כעת. - שטפו את התעלה במים דה-מיוננים באמצעות מזרק, ובדקו במקביל אם יש נזילות.
- יש לעקר את מארז התעלה במעקר אולטרה סגול (UV) למשך 30 דקות18.
- באמצעות טכניקה סטרילית, יש לטפל בתעלה עם פיברונקטין אנושי של 2.0 מיקרוגרם/מ"ל (ראה טבלת חומרים) במי מלח חוצצים פוספט (PBS) ולדגור במשך 30 דקות לפחות בטמפרטורה של 37°C19.
- בצע תרבית תאים בתעלה המיקרופלואידית לפי השלבים הבאים.
- במכסה מנוע סטרילי של זרימה למינרית, השתמש במיקרופיפטה כדי להעביר תרחיף אחיד של תאי NCI-H441 בתווך RPMI 1640 עם סרום בקר עוברי 10% (FBS) (ראה טבלת חומרים) כדי לזרוע שתי תעלות מיקרופלואידיות, כל אחת עם תאים בצפיפות פני השטח של 150,000 תאים לסמ"ק2.
- עבור ערוצים של 50 מ"מ x 5 מ"מ x 0.6 מ"מ, השתמש ב- 0.25 מ"ל של מתלה של 2.5 x 106 תאים/מ"ל כדי למלא כל ערוץ, וכן בחלק מהיציאות. ודא שהתאים התפזרו באופן שווה בתוך הערוצים באמצעות מיקרוסקופ שדה בהיר.
- תרבית את שני הערוצים במשך 24 שעות ו-48 שעות בהתאמה ב-37 מעלות צלזיוס עם 5% CO2 באמצעות משאבת מזרק ניתנת לתכנות (ראה טבלת חומרים), תוך שאיבת מדיה משומשת מהתעלה ומדיה טרייה לתוך התעלה ממאגר מדיה סטרילי המחובר לכניסת התעלה המורכב ממזרק חתוך בנפח 20 מ"ל מכוסה בסרט פרפין.
- לאחר תקופת המתנה של 10 דקות לאחר זריעת תאים, יש להכניס ולשאוב מדיה טרייה מהמאגר דרך התעלה בקצב זרימה משתנה המתחיל ב-0.2 מיקרוליטר/דקה ועד 10 מיקרוליטר/דקה למשך 4 שעות, תוך שמירה על קצב זה לאחרמכן 20.
הערה: קצב זרימה משתנה זה מספק תנאי תרבית המאפשרים לתאים (1) לשקוע בכבידה על פני השטח של התרבית, (2) להיצמד לפני השטח של התרבית, ו-(3) ליצור חד-שכבה מתמזגת.
- לאחר תקופת המתנה של 10 דקות לאחר זריעת תאים, יש להכניס ולשאוב מדיה טרייה מהמאגר דרך התעלה בקצב זרימה משתנה המתחיל ב-0.2 מיקרוליטר/דקה ועד 10 מיקרוליטר/דקה למשך 4 שעות, תוך שמירה על קצב זה לאחרמכן 20.
- במכסה מנוע סטרילי של זרימה למינרית, השתמש במיקרופיפטה כדי להעביר תרחיף אחיד של תאי NCI-H441 בתווך RPMI 1640 עם סרום בקר עוברי 10% (FBS) (ראה טבלת חומרים) כדי לזרוע שתי תעלות מיקרופלואידיות, כל אחת עם תאים בצפיפות פני השטח של 150,000 תאים לסמ"ק2.
- בצע קיבוע תאים בתוך התעלות המיקרופלואידיות באמצעות תמיסת פורמלדהיד.
אזהרה: פורמלדהיד הוא רעיל ויש לטפל בו במנדף כימי מתאים21.- במנדף כימי, הכינו תמיסות פורמלדהיד באמצעות 4% פורמלדהיד ב-PBS (ללא מתנול) (ראו טבלת חומרים) ליצירת שתי מנות של 4 מ"ל, דילול הראשון לריכוז של 1% פורמלדהיד והשני ל-2% פורמלדהיד באמצעות מלח חוצץ פוספט של דולבקו (DPBS; עם Ca 2+ ו-Mg2+) כמדלל. העבירו את תמיסות הפורמלדהיד למזרקים נפרדים בנפח 5 מ"ל ותוויתו בהתאם. צייר 20 מ"ל של DPBS לתוך מזרק נפרד 20 מ"ל.
- הסר תעלות מיקרופלואידיות ממנגנון התרבית והכנס אותן למכסה האדים הכימי.
- להרכיב את מנגנון הקיבוע והצביעה.
- חבר קטע של 10 ס"מ של צינורות העברה ליציאה הצדדית של סטופקוק תלת-כיווני באמצעות מנעול Luer זכר למתאם מוט צינור (ראה טבלת חומרים), ולאחר מכן חבר את הסטופקוק ליציאת הכניסה של מערך הזרימה.
- לאחר מכן, חבר קטע נוסף של 10 ס"מ של צינורות העברה ליציאת היציאה של מערך הזרימה באמצעות אותו סוג של מתאם צינור.
- לבסוף, אבטח את הקצוות החופשיים של שני צינורות ההעברה במיכל פסולת כימי ומתאים לסיכונים ביולוגיים, כגון צינור צנטריפוגה חרוטי ריק של 50 מ"ל.
- סובב את הסטופרקוק כדי לחסום את יציאת הכניסה של מערך הזרימה ושטוף את קו הפסולת עם DPBS. לאחר מכן, סובב את הסטופרקוק כדי לחסום את קו הפסולת ולשטוף לאט תאים עם 2 מ"ל של DPBS. חזור על שלב ההדחה באמצעות הפתרון החדש בכל פעם. פתרון חדש (או ריכוז של תמיסה) מוצג לערוץ.
- לדחוף באיטיות 2 מ"ל של 1% פתרון קיבוע דרך הערוץ ולאחר מכן לאפשר לשבת במשך 5 דקות22.
- לדחוף באיטיות 2 מ"ל של 2% פתרון קיבוע דרך הערוץ ולאחר מכן לאפשר לשבת במשך 15 דקות.
- שטפו תאים על ידי החדרה איטית של 2 מ"ל של DPBS טריים לתעלה בשלושה מופעים נפרדים (5 דקות כל אחד).
- בצע את השלבים 1.3.3-1.3.7 עבור שני התעלות המיקרופלואידיות במקביל.
- צבעו, חדרו והוסיפו אמצעי הרכבה לתאים בתעלה המיקרופלואידית.
- הכינו תמיסת סאפונין 0.1% על ידי הוספת 1 מ"ג סאפונין (ראו טבלת חומרים) לכל מ"ל DPBS כדי לייצר 4 מ"ל תמיסה וערבול עדין לערבוב23. צייר 8 מ"ל של DPBS לתוך מזרק 20 מ"ל.
- הוסף מגיב פאלואדין מכתים F-actin וריאגנט Hoechst מכתים גרעין (ראה טבלת חומרים) לתמיסת 0.1% saponin, בשתי טיפות (0.1 מ"ל) של כל מגיב לכל מ"ל של תמיסת סאפונין. יש להרחיק תמיסת צביעה/חלחול מוכנה מאור על ידי כיסוי ברדיד אלומיניום24.
- שטפו את הקו בכמות קטנה של תמיסת צביעה/חלחול (כמתואר בשלב 1.3.4), לאחר מכן הכניסו 2 מ"ל של התמיסה לתעלה המיקרופלואידית וכסו את התעלה ברדיד אלומיניום לפני שתאפשרו לה לשבת בטמפרטורת החדר למשך 30 דקות.
- יש לשטוף את תמיסת הצביעה/החדירה פעמיים עם 2 מ"ל DPBS למשך 5 דקות לכל סומק.
- לקבלת איכות תמונה טובה יותר, הוסיפו לערוץ אמצעי הרכבה מתאים (עם אינדקס שבירה התואם באופן הדוק את השמן האובייקטיבי של המיקרוסקופ ואת זכוכית הכיסוי, ראו טבלת חומרים).
- באמצעות מיקרופיפטה, הכנס כמות מינימלית של מתקן אנטי-דהייה רך לכל יציאה של התעלה המיקרופלואידית, וודא שהמשטח התחתון מכוסה לחלוטין ולא נלכדות בועות באזור ההדמיה הרצוי25. אטמו את קצות התעלה וודאו את שלמות שכבת התא על ידי התבוננות תחת מיקרוסקופ שדה בהיר.
- בצע את השלבים 1.4.3-1.4.5 עבור שני התעלות המיקרופלואידיות במקביל.
הערה: תאי תמונה בהקדם האפשרי לאחר צביעה לקבלת איכות תמונה מרבית. אם מתרחשת הלבנה או אם יש צורך באחסון לטווח ארוך, ניתן להשתמש באמצעי הרכבה אחרים עם תכונות למניעת עמעום או שימור דגימה. שים לב כי מדיה הרכבה קשה ריפוי יהיה מעוות את המבנה התלת-ממדי של התאים, ובהרחבה, את שכבת התא; מסיבה זו, עדיפה מדיית הרכבה רכה26.
- תאי תמונה בתעלה המיקרופלואידית לפי השלבים הבאים.
- התאם את הגדרות המיקרוסקופ הקונפוקלי (ראה טבלת חומרים), כולל עוצמת לייזר, רווח, הסטה ופרמטרים של סריקה כגון מהירות סריקה, אזור סריקה, תבנית סריקה, רזולוציה וקוטר חור סיכה27.
- בדוק את מיקום ההדמיה על ידי ביצוע סריקות ייחוס וכן ערימות Z עד לעמידה בפרמטרים ובתנאים הרצויים של התמונה. פרמטרי חיוג ביעדי הגדלה גבוהים יותר ברצף עד להשגת יעד טבילת שמן פי 40 ואופטימיזציה28.
- באמצעות לוח הבסיס של מערך הזרימה כנקודת ייחוס, בנו ערימות Z בחמישה מקומות, במיקום העתידי של האלקטרודה הראשונה בצד הכניסה, באמצע הדרך בין המרכז למיקום הקודם, במרכז, באמצע הדרך בין המרכז למיקום של האלקטרודה האחרונה (בצד היציאה), ובאלקטרודה האחרונה, כפי שניתן לראות באיור 2.
- ביצוע עיבוד תמונה וניתוח נתונים.
- יצא חתכי XZ ו-YZ באמצעות חבילת התוכנה למיקרוסקופ קונפוקלי (ראה טבלת חומרים).
- בעזרת תוכנה לעיבוד תמונה (ראו טבלת חומרים) עם יכולות זיהוי קצוות (ערך סף 15.0), מדדו את שטח התמונה הכולל בפיקסלים בעזרת הכלי מטה הקסם מחוץ לתמונה, ולאחר מכן את האזור שאינו כולל שטח חתך הרוחב הכולל של שכבת התא בפיקסלים בעזרת הכלי מטה הקסם בחלק החיצוני של התמונה לשכבת התא29.
- בעזרת תוכנה לעיבוד נתונים (ראה טבלת חומרים), הפחת את ערך הפיקסל של האזור החיצוני מערך הפיקסלים הכולל של השטח כדי למצוא את ערך הפיקסלים של אזור חתך הרוחב.
- המרת ערכי פיקסלים של אזור חתך רוחב לערכי μm2 על-ידי הכפלת ערכי פיקסלים בריבוע ערך μm/pixel, כפי שמצוין בתוכנת המיקרוסקופ של התמונה המסוימת (0.31 μm/pixel עבור ערימות Z שצולמו ברזולוציה של 1024p ללא זום בעדשת טבילת שמן של 40x).
- חישוב אמצעים וסטיות תקן של נתונים ותוצאות גרפים.
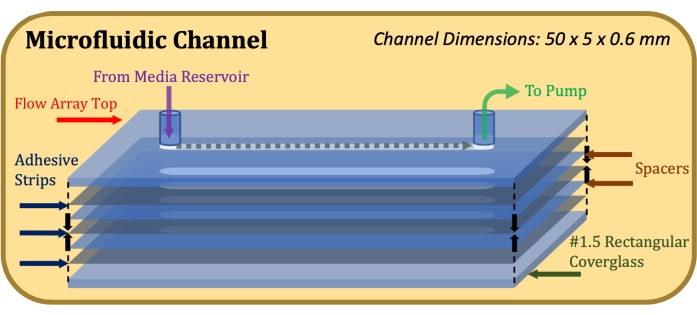
איור 1: סכמת תצוגה מפוצצת של מבנה התעלה המיקרופלואידית. האלמנט העליון הוא החלק העליון של מערך הזרימה, אלמנטים אפורים דקים הם רצועות דבק, אלמנטים כחולים דקים הם ספייסרים מיילריים, והאלמנט התחתון הוא זכוכית הכיסוי המלבנית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
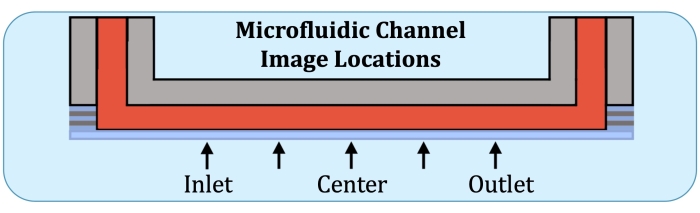
איור 2: חמישה מיקומי הדמיה לאורך האזור המייצר שכבות באופן עקבי של ערוץ התרבית המיקרופלואידית. מיקומי ההדמיה הם כדלקמן: צד כניסה, קרוב למקום שבו תהיה האלקטרודה הראשונה על מערך הזרימה השלם; באמצע הדרך בין מיקום צד הכניסה למרכז הערוץ; מרכז הערוץ; באמצע הדרך בין המרכז למיקום בצד היציאה, ובצד היציאה, קרוב למקום שבו תהיה האלקטרודה האחרונה על מערך הזרימה השלם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
2. תרבית תאים בזכוכית הכיסוי בעלת שמונה התאים
- בצע טיפול מקדים של זכוכית כיסוי שמונה תאים היטב.
- השג זכוכית כיסוי סטרילית בעלת שמונה תאים המיוצרת עם זכוכית כיסוי #1.5 וטיפול פני שטח המגדיל את היצמדות התאים (איור 3, ראה טבלת חומרים).
- באמצעות טכניקה סטרילית, לטפל בפני השטח של בארות תרבית עם 2.0 מיקרוגרם / מ"ל פיברונקטין אנושי PBS לדגור לפחות 30 דקות ב 37 ° C19.
- בצע תרבית תאים בזכוכית הכיסוי התאית לפי השלבים הבאים.
- במכסה מנוע סטרילי של זרימה למינרית, העבר 0.5 מ"ל חלקים של תמיסות של תאי NCI-H441 המרחפים באופן שווה בתווך RPMI 1640 עם 10% FBS בצפיפות נפחית של 81,000, 162,000 ו- 324,000 תאים / מ"ל כדי לזרוע את בארות התרבית בצפיפות פני השטח של 45,000, 90,000 ו- 180,000 תאים לסמ"ק2, בהתאמה. ודא שהתאים התפזרו באופן שווה בתוך הבארות באמצעות מיקרוסקופ שדה בהיר.
- תאי תרבית במשך 24 שעות, 48 שעות ו-96 שעות ב-37°C עם 5% CO2, המחליפים מדיה מדי יום.
- בצע קיבוע פורמלדהיד בזכוכית הכיסוי בעלת שמונה התאים היטב.
אזהרה: פורמלדהיד הוא רעיל ויש לטפל בו במנדף כימי מתאים21.- במנדף כימי, הכינו תמיסות פורמלדהיד על ידי הכנת שתי מנות של 4% פורמלדהיד ב-PBS (ללא מתנול), דילול הראשונה לריכוז של 1% פורמלדהיד והשנייה ל-2% פורמלדהיד באמצעות מלח חוצץ פוספט של דולבקו (DPBS; עם Ca 2+ ו-Mg2+) כמדלל.
- הסר את זכוכית הכיסוי בעלת שמונה הבארות מהאינקובטור והכנס אותה למכסה האדים הכימי.
- בעדינות לשטוף תאים עם 0.5 מ"ל של DPBS באמצעות micropipette על ידי החדרת נוזל לאט לאורך החלק העליון של הפינה של כל באר.
- הסר נוזל קיים בכל באר על ידי חילוץ איטי מפינת הבארות באמצעות מיקרופיפטה. באמצעות שיטת החדרת נוזלים (שלב 2.3.3), להכניס 0.5 מ"ל של 1% פתרון קיבוע לתוך כל באר ולאפשר לו לשבת במשך 5 דקות22.
- הסר נוזלים קיימים בכל באר באמצעות שיטת מיצוי הנוזלים המוזכרת בשלב 2.3.4. באמצעות שיטת החדרת הנוזלים המוזכרת בשלב 2.3.3, הכניסו 0.5 מ"ל של 2% תמיסה מקובעת לכל באר ואפשרו לה לשבת במשך 15 דקות.
- באמצעות שיטות החדרה ומיצוי נוזלים (שלבים 2.3.3 ו- 2.3.4), לשטוף תאים על ידי החדרה והסרה של 0.5 מ"ל של DPBS טרי בכל באר בשלושה מופעים נפרדים במשך 5 דקות כל אחד.
- בצע צביעה, חדירה וחיבור מדיה להרכבה בזכוכית הכיסוי בעלת שמונה התאים היטב.
- הכינו תמיסת סאפונין 0.1% על ידי הוספת 1 מ"ג סאפונין לכל מ"ל DPBS וערבבו בעדינות לערבוב23.
- לתמיסת 0.1% סאפונין יש להוסיף שתי טיפות (0.1 מ"ל) כל אחת של מגיב פאלואדין מכתים F-actin ומגיב Hoechst מכתים גרעין לכל מ"ל של תמיסת סאפונין. יש להרחיק את התמיסה המוכנה מאור על ידי כיסוי ברדיד אלומיניום24.
- הכניסו 0.2 מ"ל של תמיסת צביעה/חדירה לכל באר וכסו את הזכוכית המקורה ברדיד אלומיניום לפני שתאפשרו לה לשבת בטמפרטורת החדר למשך 30 דקות.
- יש לשטוף את תמיסת הצביעה/חלחול פעמיים עם 0.5 מ"ל DPBS.
- לקבלת איכות תמונה טובה יותר, הוסף אמצעי הרכבה מתאים (עם אינדקס שבירה התואם באופן הדוק את שמן המטרה של המיקרוסקופ וזכוכית כיסוי) לתוך הבארות.
- באמצעות מיקרופיפטה, הכנס כמות מינימלית של מתקן אנטי-דהייה רך לכל באר, וודא שהמשטח התחתון מכוסה לחלוטין ולא נלכדות בועות באזור ההדמיה הרצוי25. ודא את שלמות שכבת התא על-ידי התבוננות תחת מיקרוסקופ שדה בהיר.
הערה: תאי תמונה בהקדם האפשרי לאחר צביעה לקבלת איכות תמונה מרבית. אם מתרחשת הלבנה או אם יש צורך באחסון לטווח ארוך, ניתן להשתמש באמצעי הרכבה אחרים עם תכונות למניעת עמעום או שימור דגימה. שים לב שמדיית הרכבה קשיחה תעוות את המבנה התלת-ממדי של התאים, ובהרחבה, את שכבת התא, ולכן עדיפה מדיית הרכבה רכה26.
- באמצעות מיקרופיפטה, הכנס כמות מינימלית של מתקן אנטי-דהייה רך לכל באר, וודא שהמשטח התחתון מכוסה לחלוטין ולא נלכדות בועות באזור ההדמיה הרצוי25. ודא את שלמות שכבת התא על-ידי התבוננות תחת מיקרוסקופ שדה בהיר.
- בצע הדמיה בזכוכית כיסוי בעלת שמונה תאים.
- התאם את הגדרות המיקרוסקופ הקונפוקלי, כולל עוצמת לייזר, רווח, הסטה ופרמטרים של סריקה כגון מהירות סריקה, אזור סריקה, תבנית סריקה, רזולוציה וקוטר חור סיכה27.
- בדוק את מיקום ההדמיה על ידי ביצוע סריקות ייחוס וכן ערימות Z עד לעמידה בפרמטרים ובתנאים הרצויים של התמונה. פרמטרי חיוג ביעדי הגדלה גבוהים יותר ברצף עד להשגת יעד טבילת שמן פי 40 ואופטימיזציה28.
- בנה ערימות Z של שלושה מיקומים אקראיים בכל התאמת צפיפות זריעה/משך תרבית.
- ביצוע עיבוד תמונה וניתוח נתונים.
- ייצא חתכי XZ ו- YZ באמצעות חבילת התוכנה למיקרוסקופ קונפוקלי.
- בעזרת תוכנה לעיבוד תמונה עם יכולות זיהוי קצוות (ערך סף 15.0), מדדו את שטח התמונה הכולל בפיקסלים בעזרת הכלי מטה הקסם מחוץ לתמונה, ולאחר מכן את האזור שאינו כולל שטח חתך הרוחב הכולל של שכבת התא בפיקסלים בעזרת הכלי מטה הקסם בחלק החיצוני של התמונה לשכבת התא29.
- באמצעות תוכנה לעיבוד נתונים, הפחת את ערך הפיקסל של האזור החיצוני מערך הפיקסל הכולל של השטח כדי למצוא את ערך הפיקסלים של אזור חתך הרוחב.
- המר ערכי פיקסלים של שטח חתך רוחב לערכי μm2 על-ידי הכפלת ערכי פיקסלים בריבוע ערך μm/pixel כפי שמצוין בתוכנת המיקרוסקופ של התמונה המסוימת (0.31 μm/pixel עבור ערימות Z שצולמו ברזולוציית 1024p ללא זום בעדשת טבילת שמן של 40x).
- חישוב אמצעים וסטיות תקן ותוצאות גרף.
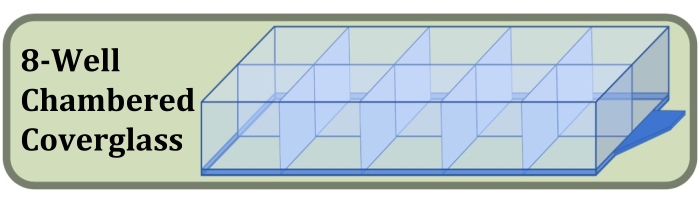
איור 3: דיאגרמה של זכוכית כיסוי בעלת שמונה בארות ששימשה לניסוי התרבית, הצביעה וההדמיה של באר קבועה, המשווה את ההשפעות של צפיפות זריעת התאים הראשונית ומשך התרבית על היווצרות שכבות התא. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
השיטה המוצגת מאפשרת הדמיה של שכבות תאי אפיתל בתרבית בתעלות תרבית מיקרופלואידיות ומשתמשת בהדגמה בסביבות מסורתיות של תרביות תאים קבועות כאימות. תמונות שיתקבלו יתקיימו בספקטרום של איכות, עוצמת אות וספציפיות מטרה סלולרית. תמונות מוצלחות יפגינו ניגודיות גבוהה, מה שיאפשר ניתוח תמונה וכימות נ...
Discussion
הפרוטוקול המוצג מתאר את התרבית, קיבוע הצלבה, צביעה, חלחול והדמיה מיקרוסקופית קונפוקלית של תאי אפיתל ריאה אנושיים NCI-H441 בסביבה הדינמית של מערך זרימה מיקרופלואידית חד-ערוצית, כמו גם בסביבה הסטטית של זכוכית כיסוי מסורתית בעלת שמונה תאים. עם כל פרוטוקול תרבית תאים מיקרופלואידית, תנאי הזרימה ש?...
Disclosures
המחברים מצהירים כי אין ניגודי עניינים.
Acknowledgements
המחברים מודים לאלן שפרדסון על תכנון תבנית החיתוך עבור דבק 3M ויריעת מיילר המשמשת לבניית תעלות מיקרופלואידיות ועל בדיקת קצב זרימת המדיה של תרבית התא ותכנות משאבת המזרק. המימון סופק על ידי NIH R01 HL0142702, NSF CBET 1706801, ומענק הדיקן של מכללת ניוקומב-טוליין.
Materials
| Name | Company | Catalog Number | Comments |
| A1R HD25 Confocal Microscope System | Nikon | A1R HD25 | https://www.microscope.healthcare.nikon. com/products/confocal-microscopes/a1hd25-a1rhd25/specifications |
| ActinGreen 488 ReadyProbes Reagent (AlexaFluor 488 phalloidin) | Invitrogen | R37110 | https://www.thermofisher.com/order/catalog/product/R37110 |
| Adhesive Transfer Tape Double Linered | 3M | 468MP | https://gizmodorks.com/3m-468mp-adhesive-transfer-tape-sheet-5-pack/ |
| Air-Tite HSW Soft-Ject Disposable Syringes | Air-Tite RL5 | 14-817-53 | https://www.fishersci.com/shop/products/air-tite-hsw-soft-ject-disposable-syringes-6/1481753#?keyword=syringe%20leur%20locking%205ml |
| BAISDY 4 mil (0.1 mm) Thick Mylar Sheet | BAISDY | AS022 | https://www.amazon.ca/Stencil-Perfect-Silhouette-Machines-BAISDY/dp/B07RJJ9BNC |
| Branson Ultrasonics M Series Ultrasonic Cleaning Bath | Branson Ultrasonics | 15-336-100 | https://www.fishersci.com/shop/products/m-series-ultrasonic-cleaning-bath/15336100 |
| Corning Fibronectin, Human | Fisher Scientific | CB-40008 | https://www.fishersci.com/shop/products/corning-fibronectin-human-3/CB40008?keyword=true |
| DPBS, calcium, magnesium | Gibco | 14040133 | https://www.thermofisher.com/order/catalog/product/14040133?SID=srch-srp-14040133 |
| ECIS Cultureware Disposable Electrode Arrays 8 x 10 ECIS Flow Array | Applied BioPhysics | 1F8x10E PC | https://www.biophysics.com/cultureware.php#1F8x10E |
| Enterprise Technology Solutions UV Sterilizer Cabinet, White | Enterprise Technology Solutions | 50-211-1163 | https://www.fishersci.com/shop/products/uv-sterilizer-cabinet-white/502111163 |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | https://www.thermofisher.com/order/catalog/product/26140079 |
| Finnpipette F2 Variable Volume Pipettes | Thermo Scientific | 4642090 | https://www.thermofisher.com/order/catalog/product/4642090 |
| Fisherbrand 50mL Easy Reader Plastic Centrifuge Tubes | Fisher Scientific | 06-443-21 | https://www.fishersci.com/shop/products/fisherbrand-higher-speed-easy-reader-plastic-centrifuge-tubes-8/p-193269 |
| Fisherbrand Cover Glasses: Rectangles (#1.5) | Fisher Scientific | 12-544-GP | https://www.fishersci.com/shop/products/cover-glasses-rectangles-promo-22/12544GP#coverglass |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-458 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955458 |
| Gibco RPMI 1640 Medium | Gibco | 11875093 | https://www.thermofisher.com/order/catalog/product/11875093 |
| Image-iT Fixative Solution (4% formaldehyde, methanol-free) | Invitrogen | FB002 | https://www.thermofisher.com/order/catalog/product/FB002 |
| ImageJ Fiji | ImageJ | ImageJ Fiji | https://imagej.net/downloads |
| Immersion Oil F 30 cc | Nikon | MXA22168 | https://www.microscope.healthcare.nikon. com/products/accessories/immersion-oil/specifications |
| Large-Capacity Reach-In CO2 Incubator, 821 L, Polished Stainless Steel | Thermo Scientific | 3950 | https://www.thermofisher.com/order/catalog/product/3950 |
| Laxco LMC-3000 Series Brightfield Compound Microscope System | Laxco | LMC3BF1 | https://www.fishersci.com/shop/products/lmc-3000-series-brightfield-compound-microscope-system-8/LMC3BF1 |
| Masterflex Fitting, Nylon, Straight, Male Luer Lock to Hose Barb Adapters, 1/16" ID; 25/PK | Masterflex | ZY-45505-31 | https://www.masterflex.com/i/masterflex-fitting-nylon-straight-male-luer-lock-to-hose-barb-adapters-1-16-id-25-pk/4550531?PubID=ZY&persist=true&ip=no& gclid=Cj0KCQiA3rKQBhCNARIsAC UEW_Zb5yXy1em6bGs0a9KFOk5k pdlkHCvAEslHumdqcnlwSN0MdR0 udmwaAuDHEALw_wcB |
| Microsoft Excel | Microsoft | 0016 | https://www.microsoft.com/en-us/download/details.aspx?id=56547 |
| National Target All-Plastic Disposable Syringes | Thermo Scientific | 03-377-24 | https://www.fishersci.com/shop/products/national-target-all-plastic-disposable-syringes/0337724#tab8 |
| NCI-H441 Human Epithelial Lung Cells | American Type Culture Collection (ATCC) | HTB-174 | https://www.atcc.org/products/htb-174 |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | https://www.syringepump.com/NE-16001800.php |
| NIS Elements AR | Nikon | NIS Elements AR | https://www.microscope.healthcare.nikon. com/products/software/nis-elements/nis-elements-advanced-research |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Invitrogen | R37605 | https://www.thermofisher.com/order/catalog/product/R37605?SID=srch-srp-R37605 |
| Nunc Lab-Tek Chambered Coverglass | Thermo Scientific | 155411 | https://www.thermofisher.com/order/catalog/product/155361 |
| Parafilm M Wrapping Film | Fisher Scientific | S37441 | https://www.fishersci.com/shop/products/parafilm-m-wrapping-film-3/S37441 |
| PendoTech 3-Way Stopcock, Polysulfone, Male/Female Luer Inlet x Female Luer Branch | PendoTech | ZY-19406-49 | https://www.masterflex.com/i/pendotech-3-way-stopcock-polysulfone-male-female-luer-inlet-x-female-luer-branch/1940649 |
| Phosphate Buffered Solution (PBS), pH 7.4 | Gibco | 10010023 | https://www.thermofisher.com/order/catalog/product/10010023 |
| Poly-D-Lysine | Gibco | A3890401 | https://www.thermofisher.com/order/catalog/product/A3890401#/A3890401 |
| Reynolds Aluminum Wrap Foil | Reynolds | 458742928317 | https://www.amazon.com/Reynolds-Wrap-Aluminum-Foil-Square/dp/B00UNT0Y2M |
| Saponin | Millipore Sigma (Sigma Aldrich) | 47036 | https://www.sigmaaldrich.com/US/en/product/sigma/47036 |
| SlowFade Glass Soft-set Antifade Mountant | Invitrogen | S36917-5X2ML | https://www.thermofisher.com/order/catalog/product/S36917-5X2ML |
| Thermo Scientific 1300 Series Class II, Type A2 Biological Safety Cabinet Package | Thermo Scientific | 13-100-752PM | https://www.fishersci.com/shop/products/1300-series-class-ii-type-a2-biological-safety-cabinet-package-promo/p-9049003#?keyword=biosafety%20hood |
| Tygon Transfer Tubing, BioPharm Platinum-Cured Silicone, 1/16" ID x 1/8" OD; 50 Ft | Cole-Parmer | EW-95702-01 | https://www.coleparmer.com/i/tygon-transfer-tubing-biopharm-platinum-cured-silicone-1-16-id-x-1-8-od-50-ft/9570201?searchterm=95702-01 |
References
- Matthay, M. A., et al. Acute respiratory distress syndrome. Nature Reviews Disease Primers. 5, 18 (2019).
- Rawal, G., Yadav, S., Kumar, R. Acute respiratory distress syndrome: An update and Review. Journal of Translational Internal Medicine. 6 (2), 74-77 (2018).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface-tension-induced epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 94 (2), 770-783 (2003).
- Modrykamien, A. M., Gupta, P. The acute respiratory distress syndrome. Baylor University Medical Center Proceedings. 28 (2), 163-171 (2017).
- Jacob, A. -. M., Gaver, D. P. Atelectrauma disrupts pulmonary epithelial barrier integrity and alters the distribution of tight junction proteins ZO-1 and Claudin 4. Journal of Applied Physiology. 113 (9), 1377-1387 (2012).
- Kay, S. S., Bilek, A. M., Dee, K. C., Gaver, D. P. Pressure gradient, not exposure duration, determines the extent of epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 97 (1), 269-276 (2004).
- Jacob, A. M., Gaver, D. P. An investigation of the influence of cell topography on epithelial mechanical stresses during pulmonary airway reopening. Physics of Fluids. 17 (3), 031502 (1994).
- Gaver, D. P., et al. The POOR get POORer: A hypothesis for the pathogenesis of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 202 (8), 1081-1087 (2020).
- Jain, P., et al. Reconstruction of ultra-thin alveolar-capillary basement membrane mimics. Advanced Biology. 5 (8), 2000427 (2021).
- Byrne, M. B., Leslie, M. T., Gaskins, H. R., Kenis, P. J. A. Methods to study the tumor microenvironment under controlled oxygen conditions. Trends in Biotechnology. 32 (11), 556-563 (2014).
- Szulcek, R., Bogaard, H. J., van Nieuw Amerongen, G. P. Electric cell-substrate impedance sensing for the quantification of endothelial proliferation, barrier function, and motility. Journal of Visualized Experiments. (85), e51300 (2014).
- Jaccard, N., et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images. Biotechnology and Bioengineering. 111 (3), 504-517 (2013).
- Hagiyama, M., et al. Modest static pressure suppresses columnar epithelial cell growth in association with cell shape and cytoskeletal modifications. Frontiers in Physiology. 8, 00997 (2017).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of Nucleic Acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Zhu, L., Rajendram, M., Huang, K. C. Effects of fixation on bacterial cellular dimensions and integrity. Iscience. 24 (4), 102348 (2021).
- Lust, R. M. . The Pulmonary System. XPharm: The Comprehensive Pharmacology Reference. , 1-6 (2007).
- EpilogueLaser. FusionSeries: Pro & Edge Laser System Manual and Original Instructions. EpilogueLaser. , (2022).
- Chitnis, D. S., Katara, G., Hemvani, N., Chitnis, S., Chitnis, V. Surface disinfection by exposure to germicidal UV light. Indian Journal of Medical Microbiology. 26 (3), 241 (2008).
- Sandell, L., Sakai, D. Mammalian cell culture. Current Protocols Essential Laboratory Techniques. 5 (1), 4 (2011).
- New Era Pump Systems. Multi-Phaser Programmable Syringe Pump: NE-1000 Series User Manual. New Era Pump Systems. , (2014).
- Thermo Fisher Scientific. Safety Data Sheet: Image-iT Fixative Solution (4% formaldehyde, methanol-free). Thermo Fisher Scientific. , (2018).
- Thavarajah, R., Mudimbaimannar, V. K., Rao, U. K., Ranganathan, K., Elizabeth, J. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Jamur, M. C., Oliver, C. Permeabilization of cell membranes. Immunocytochemical Methods and Protocols. 588, 63-66 (2009).
- Thermo Fisher Scientific. ActinGreen 488 ReadyProbes Reagent Protocol. Thermo Fisher Scientific. , (2022).
- Slowfade Glass soft-set Antifade Mountant. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/S36917-5X2ML?SID=srch-hj-S36917-5X2ML (2022)
- Ravikumar, S., Surekha, R., Thavarajah, R. Mounting media: An overview. Journal of Dr. NTR University of Health Sciences. 3 (5), 1-8 (2014).
- Shihan, M. H., Novo, S. G., Le Marchand, S. J., Wang, Y., Duncan, M. K. A simple method for quantitating confocal fluorescent images. Biochemistry and Biophysics Reports. 25, 100916 (2021).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Ferriera, F., Rasband, W. ImageJ User Guide. National Institutes of Health. , (2012).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Smith, H. S., Riggs, J. L., Mosesson, M. W. Production of fibronectin by human epithelial cells in culture. American Association for Cancer Research. 39 (10), 4138-4144 (1979).
- Sieck, G. C., Mantilla, C. B., Prakash, Y. S. Volume measurements in confocal microscopy. Methods in Enzymology. 307, 296-315 (1999).
- Heijink, I. H., et al. Characterisation of cell adhesion in airway epithelial cell types using electric cell-substrate impedance sensing. European Respiratory Journal. 35 (4), 894-903 (2009).
- Zhang, X., Wang, W., Li, F., Voiculescu, I. Stretchable impedance sensor for mammalian cell proliferation measurements. Lab on a Chip. 17 (12), 2054-2066 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved