È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Preparazione e valutazione strutturale di monostrati di cellule epiteliali in un dispositivo di coltura microfluidica di dimensioni fisiologiche
In questo articolo
Riepilogo
Il protocollo presentato descrive lo sviluppo e l'uso di una tecnica di colorazione filamentosa-actina a base di falloidina con microscopia a scansione laser confocale (CLSM) per visualizzare la struttura dello strato cellulare aderente nei canali di coltura dinamica microfluidica e nelle tradizionali camere di coltura statica a pozzo fisso. Questo approccio aiuta a valutare la confluenza dello strato cellulare, la formazione del monostrato e l'uniformità dello spessore dello strato.
Abstract
La sperimentazione microfluidica in vitro ha un grande potenziale per rivelare molte informazioni sui fenomeni microfisiologici che si verificano in condizioni come la sindrome da distress respiratorio acuto (ARDS) e il danno polmonare indotto da ventilatore (VILI). Tuttavia, gli studi su canali microfluidici con dimensioni fisiologicamente rilevanti per i bronchioli terminali del polmone umano affrontano attualmente diverse sfide, soprattutto a causa delle difficoltà nello stabilire condizioni di coltura cellulare appropriate, comprese le velocità di flusso dei media, all'interno di un determinato ambiente di coltura. Il protocollo presentato descrive un approccio basato su immagini per valutare la struttura di cellule epiteliali polmonari umane NCI-H441 coltivate in un canale microfluidico impermeabile all'ossigeno con dimensioni fisiologicamente rilevanti per i bronchioli terminali del polmone umano. Utilizzando la colorazione filamentosa-actina a base di falloidina, le strutture citoscheletriche delle cellule vengono rivelate dalla microscopia a scansione laser confocale, consentendo la visualizzazione di cellule individuali e stratificate. La quantificazione successiva determina se le condizioni di coltura cellulare impiegate producono monostrati uniformi adatti per ulteriori sperimentazioni. Il protocollo descrive i metodi di coltura cellulare e di valutazione degli strati nei canali microfluidici e nei tradizionali ambienti a pozzetti fissi. Ciò include la costruzione del canale, la coltura cellulare e le condizioni richieste, la fissazione, la permeabilizzazione e la colorazione, l'imaging microscopico confocale, l'elaborazione delle immagini e l'analisi dei dati.
Introduzione
La sindrome da distress respiratorio acuto (ARDS) è una condizione acuta derivante dalla beffa e dalla propagazione di lesioni nel parenchima polmonare, con conseguente edema polmonare degli alveoli, scambio gassoso inadeguato e successiva ipossiemia1. Questo avvia un ciclo di rilascio di citochine pro-infiammatorie, reclutamento di neutrofili, rilascio di mediatori tossici e danno tissutale, che a sua volta comporta un'ulteriore risposta infiammatoria2. Inoltre, il tensioattivo polmonare, che stabilizza le vie aeree e previene i danni causati dal reclutamento / dereclutamento ripetitivo (R / D), può essere inattivato o altrimenti reso disfunzionale dai processi chimici che si verificano durante l'ARDS, con conseguente ulteriore stress e lesioni al parenchima circostante3. Se si verificano danni sufficienti, può essere necessaria la ventilazione meccanica per garantire un'adeguata ossigenazione sistemica4. Tuttavia, la ventilazione meccanica impone le proprie sfide e traumi, tra cui la possibilità di lesioni polmonari indotte dal ventilatore (VILI), caratterizzate come lesioni al parenchima polmonare causate dalle sollecitazioni meccaniche imposte durante il sovragonfiaggio (volutrauma) e/o la R/D dell'interfaccia aria-liquido nelle vie aeree occluse dal fluido (atelectrauma)5. Il gradiente di pressione sperimentato dalle cellule epiteliali esposte a un'interfaccia aria-liquido (come in un bronchiolo occluso con fluido) nel modello atelectrauma può provocare una risposta ostruttiva originata dalla permeabilità (POOR), portando a un ciclo virtuoso di lesione POOR-get-POORer 6,7,8.
La sperimentazione in vitro può fornire approfondimenti su micro-scala su questi fenomeni, ma gli studi attuali in ambienti di canali microfluidici con dimensioni fisiologicamente rilevanti affrontano diverse sfide9. Per uno, l'ottimizzazione delle condizioni di coltura cellulare rappresenta una barriera significativa all'ingresso per la ricerca sulle colture cellulari in ambienti microfluidici, poiché esiste una stretta intersezione all'interno della quale i parametri del flusso dei media, la durata della coltura e altre condizioni di coltura consentono la formazione ottimale dello strato cellulare. Ciò include le limitazioni di diffusione imposte dalla natura impermeabile all'ossigeno dell'involucro del canale di coltura microfluidico. Ciò richiede un'attenta considerazione dei parametri di flusso dei fluidi, poiché basse portate possono privare le cellule di ossigeno, specialmente quelle più lontane dall'ingresso; D'altra parte, portate elevate possono spingere le cellule fuori dal canale di coltura o provocare uno sviluppo improprio o irregolare dello strato. I limiti di diffusione possono essere risolti utilizzando materiali permeabili all'ossigeno come il polidimetilsilossano (PDMS) in un apparato di coltura aria-liquido (ALI); tuttavia, molti canali di coltura microfluidica convenzionali, come quelli del sistema ECIS (Electric Cell-Substrate Impedance Sensing), sono intrinsecamente impermeabili all'ossigeno, data la natura dell'involucro fabbricato10. Questo protocollo mira a fornire una tecnica per analizzare gli strati cellulari coltivati in un involucro impermeabile all'ossigeno.
Quando si confronta la vitalità delle condizioni di coltura, sono necessarie osservazioni di specifiche caratteristiche dello strato, come la presenza di un monostrato, la topologia superficiale, la confluenza e l'uniformità dello spessore dello strato, per determinare se lo strato cellulare prodotto da un particolare insieme di condizioni di coltura soddisfa le specifiche desiderate e sono effettivamente rilevanti per il disegno sperimentale. Una valutazione limitata può essere eseguita con metodi come ECIS, che utilizza misure del potenziale elettrico (tensione) creato dalla resistenza alla corrente alternata ad alta frequenza (AC) (impedenza) imposta da membrane elettricamente isolanti di celle coltivate su elettrodi d'oro all'interno della matrice di flusso. Modulando la frequenza di AC applicata alle cellule, possono essere mirateed esaminate specifiche proprietà cellulari dipendenti dalla frequenza delle cellule e degli strati cellulari, come la forza di aderenza superficiale, la formazione di giunzioni strette e la proliferazione o confluenza cellulare. Tuttavia, queste forme indirette di misurazioni sono alquanto difficili da interpretare all'inizio di un esperimento e potrebbero non quantificare tutti gli aspetti rilevanti dello strato cellulare. La semplice osservazione dello strato cellulare al microscopio a contrasto di fase può rivelare la natura di alcune qualità come la confluenza; tuttavia, molte caratteristiche rilevanti come la presenza di un monostrato e l'uniformità dello spessore dello strato richiedono una valutazione tridimensionale (3D) che non è possibile con l'imaging microscopico a campo chiaro, a contrasto di fase o fluorescente12.
L'obiettivo di questo studio era sviluppare una tecnica di colorazione filamentosa-actina per consentire la verifica basata sull'imaging di un monostrato e la valutazione dell'uniformità dello strato cellulare utilizzando la microscopia a scansione laser confocale (CLSM). L'actina filamentosa (F-actina) è stata ritenuta un bersaglio appropriato per il coniugato fluoroforo, in parte a causa del modo in cui la F-actina segue strettamente la membrana cellulare, consentendo un'approssimazione visiva dell'intero volume cellulare13. Un altro importante vantaggio del targeting di F-actina è il modo in cui la colorazione di F-actina chiarisce visivamente le interruzioni citoscheletriche o le alterazioni imposte dalle sollecitazioni e dalle tensioni sperimentate dalle cellule. La fissazione reticolante con formaldeide priva di metanolo è stata utilizzata per preservare la morfologia delle cellule e dello strato cellulare, poiché i fissativi disidratanti come il metanolo tendono ad appiattire le cellule, distorcendo grossolanamente lo strato cellulare e alterandone le proprietà14,15.
Per determinare la capacità della tecnica di valutazione dello strato di mitigare queste sfide, le cellule sono state coltivate in camere di coltura tradizionali a otto pozzetti e in canali microfluidici per valutare le differenze, se presenti, negli strati cellulari prodotti. Per i pozzetti di coltura fissi sono state utilizzate unità di vetro di copertura a otto pozzetti. Per la coltura microfluidica, array di flusso (lunghezza del canale 50 mm, larghezza 5 mm, profondità 0,6 mm) sono stati ottimizzati per la coltura di cellule epiteliali polmonari umane immortalizzate (NCI-H441) in un ambiente con dimensioni fisiologicamente rilevanti per i bronchioli terminali presenti nella zona respiratoria del polmone umano16. Sebbene questo protocollo sia stato sviluppato tenendo presente l'ambiente di coltura degli array di flusso ECIS, può essere applicato a qualsiasi ambiente di coltura dinamica impermeabile all'ossigeno per il quale è necessaria la valutazione delle caratteristiche dello strato cellulare in coltura o delle condizioni di coltura.
Protocollo
Per il presente studio è stata utilizzata la linea cellulare polmonare epiteliale umana NCI-H441 (vedere Tabella dei materiali).
1. Coltura cellulare nel canale microfluidico
- Fabbricare il canale microfluidico ed eseguire il pretrattamento seguendo i passaggi seguenti.
- Ottenere un array di flusso a canale singolo (vedere la tabella dei materiali) e separare la parte superiore dalla piastra di base in policarbonato.
- Ottenere un coperchio rettangolare #1.5 (spessore 0,17 mm) con dimensioni di 60 mm x 22 mm. Pulire le superfici del vetro di copertura in un bagno ad ultrasuoni e trattare un lato con una soluzione di 0,1 mg / ml di poli-D-lisina a temperatura ambiente per 5 minuti prima di asciugare a 60 ° C per 30 minuti.
- Applicare un biadesivo di 0,13 mm di spessore (vedi Tabella dei materiali), tagliato al laser per adattarsi alle dimensioni del flow array top e del canale di flusso (lunghezza 50 mm, larghezza 5 mm), alla parte superiore dell'array di flusso, avendo cura di allineare con precisione i ritagli del canale17.
- Applicare un distanziatore in mylar di 0,1 mm di spessore (vedi Tabella dei materiali), tagliato al laser per adattarsi alle dimensioni della parte superiore dell'array di flusso e del canale di flusso, sulla striscia adesiva, avendo cura di allineare con precisione i ritagli del canale.
- Ripetere i passaggi 1.1.3 e 1.1.4 fino a raggiungere l'altezza del canale desiderata (ad esempio, per un'altezza del canale di 0,6 mm, utilizzare due distanziali e tre strisce adesive).
- Applicare un vetro di copertura rettangolare alla striscia adesiva più in basso con il lato trattato con Poly-D-lisina rivolto verso l'adesivo. Al termine dell'assemblaggio, come indicato nella Figura 1, applicare una pressione decisa e uguale sulla parte superiore e inferiore della costruzione e tenere premuto per 1 minuto.
NOTA: La costruzione dell'involucro del canale, compresi i vetri di copertura, gli adesivi, i distanziatori e la parte superiore dell'array di flusso, è ora completa. - Risciacquare il canale con acqua deionizzata usando una siringa, controllando contemporaneamente la presenza di perdite.
- Sterilizzare l'involucro del canale in uno sterilizzatore a raggi ultravioletti (UV) per 30 minuti18.
- Utilizzando una tecnica sterile, trattare il canale con 2,0 μg/mL di fibronectina umana (vedere Tabella dei materiali) in soluzione salina tamponata fosfato (PBS) e incubare per almeno 30 minuti a 37 °C19.
- Eseguire la coltura cellulare nel canale microfluidico seguendo i passaggi seguenti.
- In una cappa a flusso laminare sterile, utilizzare una micropipetta per trasferire una sospensione uniforme di cellule NCI-H441 in terreno RPMI 1640 con siero bovino fetale (FBS) al 10% (vedi Tabella dei materiali) per seminare due canali microfluidici, ciascuno con cellule a una densità superficiale di 150.000 cellule / cm2.
- Per canali da 50 mm x 5 mm x 0,6 mm, utilizzare 0,25 mL di una sospensione 2,5 x 106 celle/mL per riempire ciascun canale, nonché una parte delle porte. Verificare che le cellule siano state distribuite uniformemente all'interno dei canali utilizzando un microscopio a campo chiaro.
- Coltivare i due canali rispettivamente per 24 ore e 48 ore a 37 °C con il 5% di CO2 utilizzando una pompa a siringa programmabile (vedi tabella dei materiali), aspirando i mezzi esausti dal canale e i mezzi freschi nel canale da un serbatoio di supporti sterili attaccato all'ingresso del canale costituito da una siringa da 20 mL tagliata coperta con pellicola di paraffina.
- Dopo un periodo di attesa di 10 minuti dopo la semina cellulare, introdurre e pompare fluidi freschi dal serbatoio attraverso il canale a una portata variabile a partire da 0,2 μL/min e fino a 10 μL/min per 4 ore, mantenendosi successivamente a tale velocità20.
NOTA: Questa portata variabile fornisce condizioni di coltura che consentono alle cellule di (1) stabilirsi gravitazionalmente sulla superficie di coltura, (2) aderire alla superficie di coltura e (3) formare un monostrato confluente.
- Dopo un periodo di attesa di 10 minuti dopo la semina cellulare, introdurre e pompare fluidi freschi dal serbatoio attraverso il canale a una portata variabile a partire da 0,2 μL/min e fino a 10 μL/min per 4 ore, mantenendosi successivamente a tale velocità20.
- In una cappa a flusso laminare sterile, utilizzare una micropipetta per trasferire una sospensione uniforme di cellule NCI-H441 in terreno RPMI 1640 con siero bovino fetale (FBS) al 10% (vedi Tabella dei materiali) per seminare due canali microfluidici, ciascuno con cellule a una densità superficiale di 150.000 cellule / cm2.
- Eseguire la fissazione cellulare all'interno dei canali microfluidici utilizzando una soluzione di formaldeide.
ATTENZIONE: La formaldeide è tossica e deve essere maneggiata in apposita cappa chimica21.- In una cappa chimica, preparare soluzioni di formaldeide utilizzando formaldeide al 4% in PBS (senza metanolo) (vedi Tabella dei materiali) per creare due porzioni da 4 ml, diluendo la prima a una concentrazione dell'1% di formaldeide e la seconda al 2% di formaldeide usando la soluzione salina tamponata fosfato di Dulbecco (DPBS; con Ca 2+ e Mg2+) come diluente. Trasferire le soluzioni di formaldeide in siringhe separate da 5 mL ed etichettare di conseguenza. Aspirare 20 mL di DPBS in una siringa separata da 20 ml.
- Rimuovere i canali microfluidici dall'apparato di coltura e inserirli nella cappa aspirante chimica.
- Assemblare l'apparato di fissazione e colorazione.
- Collegare un segmento di 10 cm di tubo di trasferimento alla porta laterale di un rubinetto di arresto a tre vie tramite un adattatore maschio Luer lock to hose barb (vedere Tabella dei materiali), quindi collegare il rubinetto di arresto alla porta di ingresso dell'array di flusso.
- Quindi, collegare un altro segmento di 10 cm del tubo di trasferimento alla porta di uscita dell'array di flusso utilizzando lo stesso tipo di adattatore per barbetta del tubo.
- Infine, fissare le estremità libere di entrambi i tubi di trasferimento in un contenitore per rifiuti adatto ai rischi chimici e biologici, come una provetta conica da centrifuga vuota da 50 ml etichettata.
- Ruotare il rubinetto di arresto per bloccare la porta di ingresso dell'array di flusso e lavare la linea di scarico con DPBS. Quindi, ruotare il rubinetto di arresto per bloccare la linea di scarico e lavare lentamente le celle con 2 ml di DPBS. Ripetere ogni volta la fase di lavaggio utilizzando la nuova soluzione. Una nuova soluzione (o concentrazione di soluzione) viene introdotta nel canale.
- Spingere lentamente 2 ml di soluzione fissativa all'1% attraverso il canale e quindi lasciare riposare per 5 minutie 22.
- Spingere lentamente 2 ml di soluzione fissativa al 2% attraverso il canale e poi lasciare riposare per 15 minuti.
- Lavare le celle introducendo lentamente 2 ml di DPBS fresco nel canale in tre istanze separate (5 minuti ciascuna).
- Completare i passaggi 1.3.3-1.3.7 per entrambi i canali microfluidici in parallelo.
- Colorare, permeabilizzare e aggiungere supporti di montaggio alle celle nel canale microfluidico.
- Preparare la soluzione di saponina allo 0,1% aggiungendo 1 mg di saponina (vedere Tabella dei materiali) per ml di DPBS per produrre 4 ml di soluzione e vortice delicato per miscelare23. Aspirare 8 mL di DPBS in una siringa da 20 ml.
- Aggiungere un reagente falloidina colorante F-actina e un reagente Hoechst colorante il nucleo (vedere tabella dei materiali) alla soluzione di saponina allo 0,1%, a due gocce (0,1 ml) di ciascun reagente per mL di soluzione di saponina. Tenere la soluzione colorante / permeabilizzante preparata lontano dalla luce coprendo con un foglio di alluminio24.
- Lavare la linea con una piccola quantità di soluzione colorante/permeabilizzante (come descritto al punto 1.3.4), quindi introdurre 2 mL della soluzione nel canale microfluidico e coprire il canale con un foglio di alluminio prima di lasciarlo riposare a temperatura ambiente per 30 minuti.
- Lavare la soluzione colorante/permeabilizzante due volte con 2 ml di DPBS per 5 minuti per lavaggio.
- Per una migliore qualità dell'immagine, aggiungere un supporto di montaggio adatto (con un indice di rifrazione che corrisponda strettamente all'olio dell'obiettivo del microscopio e al vetro di copertura, vedere Tabella dei materiali) nel canale.
- Utilizzando una micropipetta, introdurre una quantità minima di un montante antifade soft-set su ciascuna porta del canale microfluidico, assicurandosi che la superficie inferiore sia completamente coperta e che nessuna bolla sia intrappolata all'interno dell'area di imaging desiderata25. Sigillare le estremità del canale e verificare l'integrità dello strato cellulare osservando al microscopio a campo chiaro.
- Completare i passaggi 1.4.3-1.4.5 per entrambi i canali microfluidici in parallelo.
NOTA: Celle immagine il più presto possibile dopo la colorazione per la massima qualità dell'immagine. Se si verifica il fotosbiancamento o si desidera una conservazione a lungo termine, è possibile utilizzare altri supporti di montaggio con proprietà anti-dissolvenza o di conservazione del campione. Si noti che i supporti di montaggio a polimerizzazione dura distorceranno la struttura 3D delle celle e, per estensione, lo strato cellulare; Per questo motivo, il supporto di montaggio soft setting è preferibile26.
- Cellule di immagine nel canale microfluidico seguendo i passaggi seguenti.
- Regolare le impostazioni del microscopio confocale (vedere Tabella dei materiali), inclusi i parametri di potenza laser, guadagno, offset e scansione come velocità di scansione, area di scansione, formato di scansione, risoluzione e diametro del foro stenopeico27.
- Testare la posizione dell'imaging eseguendo scansioni di riferimento e Z-stack fino a quando i parametri e le condizioni dell'immagine desiderati non sono stati soddisfatti. Parametri di accesso a obiettivi di ingrandimento sequenzialmente più elevati fino al raggiungimento e ottimizzazione dell'obiettivo di immersione in olio 40x28.
- Utilizzando la piastra di base dell'array di flusso come riferimento, costruire stack Z in cinque posizioni, nella posizione prevista del primo elettrodo sul lato di ingresso, a metà strada tra il centro e la posizione precedente, il centro, a metà strada tra il centro e la posizione dell'ultimo elettrodo (sul lato di uscita) e all'ultimo elettrodo, come indicato nella Figura 2.
- Eseguire l'elaborazione delle immagini e l'analisi dei dati.
- Esportare le sezioni trasversali XZ e YZ utilizzando il pacchetto software per microscopi confocali (vedere Tabella dei materiali).
- Utilizzando un software di elaborazione delle immagini (vedere Tabella dei materiali) con funzionalità di rilevamento dei bordi (valore soglia 15.0), misurare l'area totale dell'immagine in pixel utilizzando lo strumento bacchetta magica all'esterno dell'immagine, quindi l'area escludendo l'area della sezione trasversale totale del livello di cella in pixel utilizzando lo strumento bacchetta magica nella porzione dell'immagine esterna al livello di cella29.
- Utilizzando un software di elaborazione dati (vedere Tabella dei materiali), sottrarre il valore dei pixel dell'area esterna dal valore dei pixel dell'area totale per trovare il valore dei pixel dell'area della sezione trasversale.
- Converti i valori dei pixel dell'area della sezione trasversale in valori μm2 moltiplicando i valori dei pixel per il quadrato del valore μm/pixel, come indicato nel software del microscopio per l'immagine specifica (0,31 μm/pixel per Z-stack scattate in risoluzione 1024p senza zoom su un obiettivo ad immersione d'olio 40x).
- Calcola le medie e le deviazioni standard dei dati e dei risultati grafici.
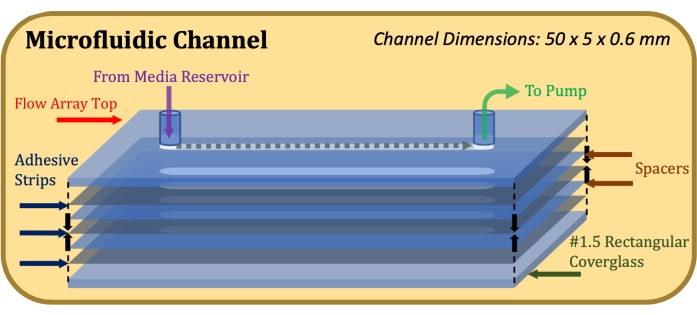
Figura 1: Schema esploso della costruzione del canale microfluidico. L'elemento superiore è la parte superiore della matrice di flusso, gli elementi grigi sottili sono strisce adesive, gli elementi blu sottili sono distanziatori in mylar e l'elemento inferiore è il vetro di copertura rettangolare. Fare clic qui per visualizzare una versione ingrandita di questa figura.
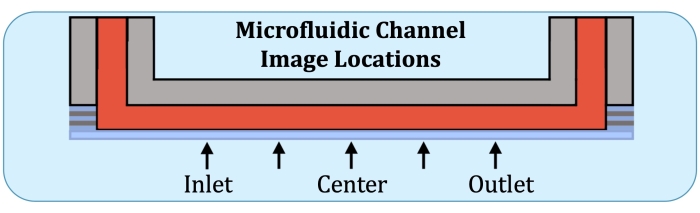
Figura 2: Cinque posizioni di imaging lungo la regione che produce costantemente strati del canale di coltura microfluidica. Le posizioni di imaging sono le seguenti: lato ingresso, vicino a dove si troverebbe il primo elettrodo sull'array di flusso intatto; a metà strada tra la posizione lato ingresso e il centro del canale; centro del canale; A metà strada tra il centro e la posizione lato uscita, e lato uscita, vicino a dove si troverebbe l'ultimo elettrodo sull'array di flusso intatto. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Coltura cellulare nel vetro di copertura a otto pozzetti
- Eseguire il pretrattamento del vetro di copertura a otto pozzetti.
- Ottenere un vetro di copertura sterile a otto pozzetti prodotto con un vetro di copertura #1.5 e un trattamento superficiale che aumenta l'aderenza delle celle (Figura 3, vedere Tabella dei materiali).
- Utilizzando una tecnica sterile, trattare la superficie dei pozzetti di coltura con 2,0 μg/mL di fibronectina umana in PBS e incubare per almeno 30 minuti a 37 °C19.
- Eseguire la coltura cellulare nel vetro di copertura camerato seguendo i passaggi seguenti.
- In una cappa a flusso laminare sterile, trasferire porzioni 0,5 mL di soluzioni di cellule NCI-H441 uniformemente sospese in mezzo RPMI 1640 con FBS al 10% a densità volumetriche di 81.000, 162.000 e 324.000 cellule/ml per seminare i pozzetti di coltura a densità superficiali rispettivamente di 45.000, 90.000 e 180.000 cellule/cm2. Verificare che le cellule siano state distribuite uniformemente all'interno dei pozzetti utilizzando un microscopio a campo chiaro.
- Cellule di coltura per 24 ore, 48 ore e 96 ore a 37 °C con il 5% di CO2, sostituendo quotidianamente i mezzi.
- Eseguire la fissazione della formaldeide nel vetro di copertura a otto pozzetti.
ATTENZIONE: La formaldeide è tossica e deve essere maneggiata in apposita cappa chimica21.- In una cappa chimica, preparare soluzioni di formaldeide facendo due porzioni di formaldeide al 4% in PBS (senza metanolo), diluendo la prima a una concentrazione dell'1% di formaldeide e l'altra al 2% di formaldeide usando la soluzione salina tamponata fosfato di Dulbecco (DPBS; con Ca 2+ e Mg2+) come diluente.
- Rimuovere il vetro di copertura a camera di coltura a otto pozzetti dall'incubatore e inserirlo nella cappa aspirante chimica.
- Lavare delicatamente le celle con 0,5 ml di DPBS utilizzando una micropipetta introducendo lentamente liquido lungo la parte superiore dell'angolo di ciascun pozzetto.
- Rimuovere il liquido esistente in ciascun pozzetto estraendolo lentamente dall'angolo dei pozzetti utilizzando una micropipetta. Utilizzando il metodo di introduzione del liquido (fase 2.3.3), introdurre 0,5 ml di soluzione fissativa all'1% in ciascun pozzetto e lasciarlo riposare per 5 minutie 22.
- Rimuovere il liquido esistente in ciascun pozzetto utilizzando il metodo di estrazione del liquido indicato al punto 2.3.4. Utilizzando il metodo di introduzione del liquido menzionato al punto 2.3.3, introdurre 0,5 ml di soluzione fissativa al 2% in ciascun pozzetto e lasciarlo riposare per 15 minuti.
- Utilizzando i metodi di introduzione ed estrazione del liquido (fasi 2.3.3 e 2.3.4), lavare le celle introducendo e rimuovendo 0,5 ml di DPBS fresco in ciascun pozzetto in tre istanze separate per 5 minuti ciascuna.
- Eseguire la colorazione, la permeabilizzazione e l'aggiunta di supporti di montaggio nel vetro di copertura a otto pozzetti.
- Preparare la soluzione di saponina allo 0,1% aggiungendo 1 mg di saponina per ml di DPBS e vortice delicatamente per miscelare23.
- Alla soluzione di saponina allo 0,1%, aggiungere due gocce (0,1 ml) ciascuna di un reagente falloidina colorante F-actina e un reagente Hoechst colorante il nucleo per ml di soluzione di saponina. Tenere la soluzione preparata al riparo dalla luce coprendo con un foglio di alluminio24.
- Introdurre 0,2 ml di soluzione colorante / permeabilizzante in ciascun pozzetto e coprire il vetro di copertura camerato con un foglio di alluminio prima di lasciarlo riposare a temperatura ambiente per 30 minuti.
- Lavare la soluzione colorante/permeabilizzante due volte con 0,5 mL di DPBS.
- Per una migliore qualità dell'immagine, aggiungere un supporto di montaggio adatto (con un indice di rifrazione che corrisponda strettamente all'olio dell'obiettivo del microscopio e al vetro di copertura) nei pozzetti.
- Utilizzando una micropipetta, introdurre una quantità minima di un montante antifade soft-set su ciascun pozzetto, assicurandosi che la superficie inferiore sia completamente coperta e che nessuna bolla sia intrappolata all'interno dell'area di imaging desiderata25. Verificare l'integrità dello strato cellulare osservando al microscopio a campo chiaro.
NOTA: Celle immagine il più presto possibile dopo la colorazione per la massima qualità dell'immagine. Se si verifica il fotosbiancamento o si desidera una conservazione a lungo termine, è possibile utilizzare altri supporti di montaggio con proprietà anti-dissolvenza o di conservazione del campione. Si noti che il supporto di montaggio a polimerizzazione dura distorce la struttura 3D delle celle e, per estensione, il livello della cella, quindi è preferibile un supporto di montaggio soft-setting26.
- Utilizzando una micropipetta, introdurre una quantità minima di un montante antifade soft-set su ciascun pozzetto, assicurandosi che la superficie inferiore sia completamente coperta e che nessuna bolla sia intrappolata all'interno dell'area di imaging desiderata25. Verificare l'integrità dello strato cellulare osservando al microscopio a campo chiaro.
- Eseguire l'imaging nel vetro di copertura a otto pozzetti.
- Regolare le impostazioni del microscopio confocale, inclusi i parametri di potenza laser, guadagno, offset e scansione come velocità di scansione, area di scansione, formato di scansione, risoluzione e diametro del foro stenopeico27.
- Testare la posizione dell'imaging eseguendo scansioni di riferimento e Z-stack fino a quando i parametri e le condizioni dell'immagine desiderati non sono stati soddisfatti. Parametri di accesso a obiettivi di ingrandimento sequenzialmente più elevati fino al raggiungimento e ottimizzazione dell'obiettivo di immersione in olio 40x28.
- Costruisci stack Z di tre posizioni casuali in ogni corrispondenza densità di semina / durata della coltura.
- Eseguire l'elaborazione delle immagini e l'analisi dei dati.
- Esporta sezioni trasversali XZ e YZ utilizzando il pacchetto software per microscopi confocali.
- Utilizzando un software di elaborazione delle immagini con funzionalità di rilevamento dei bordi (valore soglia 15.0), misurare l'area totale dell'immagine in pixel utilizzando lo strumento bacchetta magica all'esterno dell'immagine, quindi l'area escludendo l'area della sezione trasversale totale del livello di cella in pixel utilizzando lo strumento bacchetta magica nella porzione dell'immagine esterna al livello di cella29.
- Utilizzando un software di elaborazione dati, sottrarre il valore dei pixel dell'area esterna dal valore dei pixel dell'area totale per trovare il valore dei pixel dell'area trasversale.
- Converti i valori dei pixel dell'area della sezione trasversale in valori μm2 moltiplicando i valori dei pixel per il quadrato del valore μm/pixel come indicato nel software del microscopio per l'immagine specifica (0,31 μm/pixel per Z-stack scattate con risoluzione 1024p senza zoom su un obiettivo ad immersione d'olio 40x).
- Calcola le medie e le deviazioni standard e i risultati grafici.
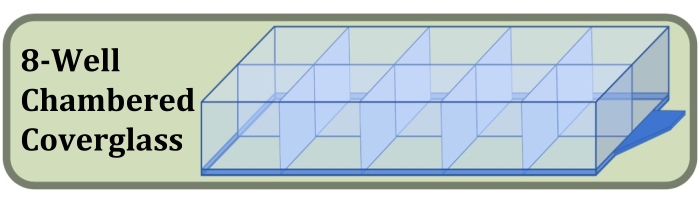
Figura 3: Diagramma del vetro di copertura a otto pozzetti utilizzato per la coltura a pozzetto fisso, la colorazione e l'esperimento di imaging che confronta gli effetti della densità iniziale di semina cellulare e della durata della coltura sulla formazione degli strati cellulari. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Risultati
Il metodo presentato consente la visualizzazione di strati cellulari epiteliali coltivati in canali di coltura microfluidica e utilizza una dimostrazione in ambienti tradizionali di coltura cellulare a pozzetto fisso come convalida. Le immagini acquisite esisteranno su uno spettro di qualità, intensità del segnale e specificità del bersaglio cellulare. Le immagini di successo dimostreranno un elevato contrasto, consentendo l'analisi delle immagini e la quantificazione dei dati per la successiva valutazione statistica....
Discussione
Il protocollo presentato descrive la coltura, la fissazione della reticolazione, la colorazione, la permeabilizzazione e la visualizzazione microscopica confocale delle cellule epiteliali polmonari umane NCI-H441 nell'ambiente dinamico di un array di flusso microfluidico a canale singolo, nonché nell'ambiente statico di un tradizionale vetro di copertura a otto pozzetti. Con qualsiasi protocollo di coltura cellulare microfluidica, le condizioni di flusso dei terreni di coltura cellulare sono di fondamentale importanza, ...
Divulgazioni
Gli autori non dichiarano conflitti di interesse.
Riconoscimenti
Gli autori ringraziano Alan Shepardson per aver progettato il modello di taglio per l'adesivo 3M e il foglio di mylar utilizzati nella costruzione di canali microfluidici e per aver testato la portata dei media di coltura cellulare e la programmazione della pompa a siringa. Il finanziamento è stato fornito da NIH R01 HL0142702, NSF CBET 1706801 e Newcomb-Tulane College Dean's Grant.
Materiali
| Name | Company | Catalog Number | Comments |
| A1R HD25 Confocal Microscope System | Nikon | A1R HD25 | https://www.microscope.healthcare.nikon. com/products/confocal-microscopes/a1hd25-a1rhd25/specifications |
| ActinGreen 488 ReadyProbes Reagent (AlexaFluor 488 phalloidin) | Invitrogen | R37110 | https://www.thermofisher.com/order/catalog/product/R37110 |
| Adhesive Transfer Tape Double Linered | 3M | 468MP | https://gizmodorks.com/3m-468mp-adhesive-transfer-tape-sheet-5-pack/ |
| Air-Tite HSW Soft-Ject Disposable Syringes | Air-Tite RL5 | 14-817-53 | https://www.fishersci.com/shop/products/air-tite-hsw-soft-ject-disposable-syringes-6/1481753#?keyword=syringe%20leur%20locking%205ml |
| BAISDY 4 mil (0.1 mm) Thick Mylar Sheet | BAISDY | AS022 | https://www.amazon.ca/Stencil-Perfect-Silhouette-Machines-BAISDY/dp/B07RJJ9BNC |
| Branson Ultrasonics M Series Ultrasonic Cleaning Bath | Branson Ultrasonics | 15-336-100 | https://www.fishersci.com/shop/products/m-series-ultrasonic-cleaning-bath/15336100 |
| Corning Fibronectin, Human | Fisher Scientific | CB-40008 | https://www.fishersci.com/shop/products/corning-fibronectin-human-3/CB40008?keyword=true |
| DPBS, calcium, magnesium | Gibco | 14040133 | https://www.thermofisher.com/order/catalog/product/14040133?SID=srch-srp-14040133 |
| ECIS Cultureware Disposable Electrode Arrays 8 x 10 ECIS Flow Array | Applied BioPhysics | 1F8x10E PC | https://www.biophysics.com/cultureware.php#1F8x10E |
| Enterprise Technology Solutions UV Sterilizer Cabinet, White | Enterprise Technology Solutions | 50-211-1163 | https://www.fishersci.com/shop/products/uv-sterilizer-cabinet-white/502111163 |
| Fetal Bovine Serum (FBS) | Gibco | 26140079 | https://www.thermofisher.com/order/catalog/product/26140079 |
| Finnpipette F2 Variable Volume Pipettes | Thermo Scientific | 4642090 | https://www.thermofisher.com/order/catalog/product/4642090 |
| Fisherbrand 50mL Easy Reader Plastic Centrifuge Tubes | Fisher Scientific | 06-443-21 | https://www.fishersci.com/shop/products/fisherbrand-higher-speed-easy-reader-plastic-centrifuge-tubes-8/p-193269 |
| Fisherbrand Cover Glasses: Rectangles (#1.5) | Fisher Scientific | 12-544-GP | https://www.fishersci.com/shop/products/cover-glasses-rectangles-promo-22/12544GP#coverglass |
| Fisherbrand Sterile Syringes for Single Use | Fisher Scientific | 14-955-458 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955458 |
| Gibco RPMI 1640 Medium | Gibco | 11875093 | https://www.thermofisher.com/order/catalog/product/11875093 |
| Image-iT Fixative Solution (4% formaldehyde, methanol-free) | Invitrogen | FB002 | https://www.thermofisher.com/order/catalog/product/FB002 |
| ImageJ Fiji | ImageJ | ImageJ Fiji | https://imagej.net/downloads |
| Immersion Oil F 30 cc | Nikon | MXA22168 | https://www.microscope.healthcare.nikon. com/products/accessories/immersion-oil/specifications |
| Large-Capacity Reach-In CO2 Incubator, 821 L, Polished Stainless Steel | Thermo Scientific | 3950 | https://www.thermofisher.com/order/catalog/product/3950 |
| Laxco LMC-3000 Series Brightfield Compound Microscope System | Laxco | LMC3BF1 | https://www.fishersci.com/shop/products/lmc-3000-series-brightfield-compound-microscope-system-8/LMC3BF1 |
| Masterflex Fitting, Nylon, Straight, Male Luer Lock to Hose Barb Adapters, 1/16" ID; 25/PK | Masterflex | ZY-45505-31 | https://www.masterflex.com/i/masterflex-fitting-nylon-straight-male-luer-lock-to-hose-barb-adapters-1-16-id-25-pk/4550531?PubID=ZY&persist=true&ip=no& gclid=Cj0KCQiA3rKQBhCNARIsAC UEW_Zb5yXy1em6bGs0a9KFOk5k pdlkHCvAEslHumdqcnlwSN0MdR0 udmwaAuDHEALw_wcB |
| Microsoft Excel | Microsoft | 0016 | https://www.microsoft.com/en-us/download/details.aspx?id=56547 |
| National Target All-Plastic Disposable Syringes | Thermo Scientific | 03-377-24 | https://www.fishersci.com/shop/products/national-target-all-plastic-disposable-syringes/0337724#tab8 |
| NCI-H441 Human Epithelial Lung Cells | American Type Culture Collection (ATCC) | HTB-174 | https://www.atcc.org/products/htb-174 |
| NE-1600 Six Channel Programmable Syringe Pump | New Era Pump Systems | NE-1600 | https://www.syringepump.com/NE-16001800.php |
| NIS Elements AR | Nikon | NIS Elements AR | https://www.microscope.healthcare.nikon. com/products/software/nis-elements/nis-elements-advanced-research |
| NucBlue Live ReadyProbes Reagent (Hoechst 33342) | Invitrogen | R37605 | https://www.thermofisher.com/order/catalog/product/R37605?SID=srch-srp-R37605 |
| Nunc Lab-Tek Chambered Coverglass | Thermo Scientific | 155411 | https://www.thermofisher.com/order/catalog/product/155361 |
| Parafilm M Wrapping Film | Fisher Scientific | S37441 | https://www.fishersci.com/shop/products/parafilm-m-wrapping-film-3/S37441 |
| PendoTech 3-Way Stopcock, Polysulfone, Male/Female Luer Inlet x Female Luer Branch | PendoTech | ZY-19406-49 | https://www.masterflex.com/i/pendotech-3-way-stopcock-polysulfone-male-female-luer-inlet-x-female-luer-branch/1940649 |
| Phosphate Buffered Solution (PBS), pH 7.4 | Gibco | 10010023 | https://www.thermofisher.com/order/catalog/product/10010023 |
| Poly-D-Lysine | Gibco | A3890401 | https://www.thermofisher.com/order/catalog/product/A3890401#/A3890401 |
| Reynolds Aluminum Wrap Foil | Reynolds | 458742928317 | https://www.amazon.com/Reynolds-Wrap-Aluminum-Foil-Square/dp/B00UNT0Y2M |
| Saponin | Millipore Sigma (Sigma Aldrich) | 47036 | https://www.sigmaaldrich.com/US/en/product/sigma/47036 |
| SlowFade Glass Soft-set Antifade Mountant | Invitrogen | S36917-5X2ML | https://www.thermofisher.com/order/catalog/product/S36917-5X2ML |
| Thermo Scientific 1300 Series Class II, Type A2 Biological Safety Cabinet Package | Thermo Scientific | 13-100-752PM | https://www.fishersci.com/shop/products/1300-series-class-ii-type-a2-biological-safety-cabinet-package-promo/p-9049003#?keyword=biosafety%20hood |
| Tygon Transfer Tubing, BioPharm Platinum-Cured Silicone, 1/16" ID x 1/8" OD; 50 Ft | Cole-Parmer | EW-95702-01 | https://www.coleparmer.com/i/tygon-transfer-tubing-biopharm-platinum-cured-silicone-1-16-id-x-1-8-od-50-ft/9570201?searchterm=95702-01 |
Riferimenti
- Matthay, M. A., et al. Acute respiratory distress syndrome. Nature Reviews Disease Primers. 5, 18 (2019).
- Rawal, G., Yadav, S., Kumar, R. Acute respiratory distress syndrome: An update and Review. Journal of Translational Internal Medicine. 6 (2), 74-77 (2018).
- Bilek, A. M., Dee, K. C., Gaver, D. P. Mechanisms of surface-tension-induced epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 94 (2), 770-783 (2003).
- Modrykamien, A. M., Gupta, P. The acute respiratory distress syndrome. Baylor University Medical Center Proceedings. 28 (2), 163-171 (2017).
- Jacob, A. -. M., Gaver, D. P. Atelectrauma disrupts pulmonary epithelial barrier integrity and alters the distribution of tight junction proteins ZO-1 and Claudin 4. Journal of Applied Physiology. 113 (9), 1377-1387 (2012).
- Kay, S. S., Bilek, A. M., Dee, K. C., Gaver, D. P. Pressure gradient, not exposure duration, determines the extent of epithelial cell damage in a model of pulmonary airway reopening. Journal of Applied Physiology. 97 (1), 269-276 (2004).
- Jacob, A. M., Gaver, D. P. An investigation of the influence of cell topography on epithelial mechanical stresses during pulmonary airway reopening. Physics of Fluids. 17 (3), 031502 (1994).
- Gaver, D. P., et al. The POOR get POORer: A hypothesis for the pathogenesis of ventilator-induced lung injury. American Journal of Respiratory and Critical Care Medicine. 202 (8), 1081-1087 (2020).
- Jain, P., et al. Reconstruction of ultra-thin alveolar-capillary basement membrane mimics. Advanced Biology. 5 (8), 2000427 (2021).
- Byrne, M. B., Leslie, M. T., Gaskins, H. R., Kenis, P. J. A. Methods to study the tumor microenvironment under controlled oxygen conditions. Trends in Biotechnology. 32 (11), 556-563 (2014).
- Szulcek, R., Bogaard, H. J., van Nieuw Amerongen, G. P. Electric cell-substrate impedance sensing for the quantification of endothelial proliferation, barrier function, and motility. Journal of Visualized Experiments. (85), e51300 (2014).
- Jaccard, N., et al. Automated method for the rapid and precise estimation of adherent cell culture characteristics from phase contrast microscopy images. Biotechnology and Bioengineering. 111 (3), 504-517 (2013).
- Hagiyama, M., et al. Modest static pressure suppresses columnar epithelial cell growth in association with cell shape and cytoskeletal modifications. Frontiers in Physiology. 8, 00997 (2017).
- Srinivasan, M., Sedmak, D., Jewell, S. Effect of fixatives and tissue processing on the content and integrity of Nucleic Acids. The American Journal of Pathology. 161 (6), 1961-1971 (2002).
- Zhu, L., Rajendram, M., Huang, K. C. Effects of fixation on bacterial cellular dimensions and integrity. Iscience. 24 (4), 102348 (2021).
- Lust, R. M. . The Pulmonary System. XPharm: The Comprehensive Pharmacology Reference. , 1-6 (2007).
- EpilogueLaser. FusionSeries: Pro & Edge Laser System Manual and Original Instructions. EpilogueLaser. , (2022).
- Chitnis, D. S., Katara, G., Hemvani, N., Chitnis, S., Chitnis, V. Surface disinfection by exposure to germicidal UV light. Indian Journal of Medical Microbiology. 26 (3), 241 (2008).
- Sandell, L., Sakai, D. Mammalian cell culture. Current Protocols Essential Laboratory Techniques. 5 (1), 4 (2011).
- New Era Pump Systems. Multi-Phaser Programmable Syringe Pump: NE-1000 Series User Manual. New Era Pump Systems. , (2014).
- Thermo Fisher Scientific. Safety Data Sheet: Image-iT Fixative Solution (4% formaldehyde, methanol-free). Thermo Fisher Scientific. , (2018).
- Thavarajah, R., Mudimbaimannar, V. K., Rao, U. K., Ranganathan, K., Elizabeth, J. Chemical and physical basics of routine formaldehyde fixation. Journal of Oral and Maxillofacial Pathology. 16 (3), 400-405 (2012).
- Jamur, M. C., Oliver, C. Permeabilization of cell membranes. Immunocytochemical Methods and Protocols. 588, 63-66 (2009).
- Thermo Fisher Scientific. ActinGreen 488 ReadyProbes Reagent Protocol. Thermo Fisher Scientific. , (2022).
- Slowfade Glass soft-set Antifade Mountant. Thermo Fisher Scientific Available from: https://www.thermofisher.com/order/catalog/product/S36917-5X2ML?SID=srch-hj-S36917-5X2ML (2022)
- Ravikumar, S., Surekha, R., Thavarajah, R. Mounting media: An overview. Journal of Dr. NTR University of Health Sciences. 3 (5), 1-8 (2014).
- Shihan, M. H., Novo, S. G., Le Marchand, S. J., Wang, Y., Duncan, M. K. A simple method for quantitating confocal fluorescent images. Biochemistry and Biophysics Reports. 25, 100916 (2021).
- North, A. J. Seeing is believing? A beginners' guide to practical pitfalls in image acquisition. Journal of Cell Biology. 172 (1), 9-18 (2006).
- Ferriera, F., Rasband, W. ImageJ User Guide. National Institutes of Health. , (2012).
- Halldorsson, S., Lucumi, E., Gómez-Sjöberg, R., Fleming, R. M. T. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosensors and Bioelectronics. 63, 218-231 (2015).
- Smith, H. S., Riggs, J. L., Mosesson, M. W. Production of fibronectin by human epithelial cells in culture. American Association for Cancer Research. 39 (10), 4138-4144 (1979).
- Sieck, G. C., Mantilla, C. B., Prakash, Y. S. Volume measurements in confocal microscopy. Methods in Enzymology. 307, 296-315 (1999).
- Heijink, I. H., et al. Characterisation of cell adhesion in airway epithelial cell types using electric cell-substrate impedance sensing. European Respiratory Journal. 35 (4), 894-903 (2009).
- Zhang, X., Wang, W., Li, F., Voiculescu, I. Stretchable impedance sensor for mammalian cell proliferation measurements. Lab on a Chip. 17 (12), 2054-2066 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon