Method Article
إعادة تكوين الحركة القائمة على الأكتين مع البروتينات المتاحة تجاريا
In This Article
Summary
يصف هذا البروتوكول كيفية إنتاج مذنبات الأكتين على أسطح الخرز باستخدام مكونات البروتين المتاحة تجاريا. تحاكي هذه الأنظمة الهياكل البارزة الموجودة في الخلايا ، ويمكن استخدامها لفحص الآليات الفسيولوجية لإنتاج القوة بطريقة مبسطة.
Abstract
العديد من حركات الخلايا وتغيرات الشكل وأنواع معينة من الحركة البكتيرية والعضية داخل الخلايا مدفوعة بأكتين البوليمر الحيوي الذي يشكل شبكة ديناميكية على سطح الخلية أو العضية أو البكتيريا. يمكن دراسة الأساس البيوكيميائي والميكانيكي لإنتاج القوة خلال هذه العملية عن طريق إعادة إنتاج الحركة القائمة على الأكتين بطريقة غير خلوية على الأسطح الخاملة مثل الخرز الذي يتم تشغيله وحضنه بمجموعة من المكونات الخاضعة للرقابة. في ظل الظروف المناسبة ، تتجمع شبكة الأكتين المرنة على سطح الخرزة وتنفتح بسبب الضغط الناتج عن نمو الشبكة ، وتشكل "مذنب الأكتين" الذي يدفع الخرزة إلى الأمام. ومع ذلك ، تتطلب مثل هذه التجارب تنقية مجموعة من البروتينات المختلفة المرتبطة بالأكتين ، وغالبا ما تضعها بعيدا عن متناول غير المتخصصين. توضح هذه المقالة بالتفصيل بروتوكولا للحصول على مذنبات الأكتين وحركة الخرز باستخدام الكواشف المتاحة تجاريا. يمكن تغيير طلاء الخرز وحجم الخرزة وخليط الحركة لمراقبة التأثير على سرعة الخرزة والمسارات والمعلمات الأخرى. يمكن استخدام هذا الفحص لاختبار الأنشطة الكيميائية الحيوية لمختلف البروتينات المرتبطة بالأكتين ، ولإجراء قياسات فيزيائية كمية تلقي الضوء على خصائص المادة النشطة لشبكات الأكتين. ستكون هذه أداة مفيدة للمجتمع ، مما يتيح دراسة الحركة القائمة على الأكتين في المختبر دون معرفة الخبراء في تنقية البروتين المرتبط بالأكتين.
Introduction
يتم التحكم في بلمرة الأكتين في الخلايا مكانيا وزمانيا عن طريق التنظيم المحكم لنواة خيوط الأكتين في اتجاه مجرى إشارات الخلية1. تحدث التنوي عن طريق تكوين أداة تشذيب الأكتين ، ثم يتبلمر كلا طرفي الخيط الوليد تلقائيا ، على الرغم من أن أحد الطرفين أكثر ديناميكية (الطرف الشائك) من الطرف الآخر (الطرف المدبب)2. عندما يتم توجيه التنوي وبلمرة النهاية الشائكة نحو السطح ، فإنها تنتج قوة كافية (في نطاق بيكو إلى نانو نيوتن) لدفع غشاء الخلية للحركة وتحريك الأجسام بحجم ميكرون داخل الخلية مع التحلل المائي ATP كمصدر للطاقة3. تتضمن بعض الأمثلة بكتيريا Listeria monocytogenes التي تستخدم مذنبات الأكتين للانتشار من خلية إلى أخرى ، والميتوكوندريا ، حيث تكون الحركة القائمة على المذنب الأكتين مهمة للوراثة العشوائية أثناء الانقسامالميتوزي 4,5. المذنبات الأكتين على endosomes وغيرها من الحويصلات داخل الخلايا متورطة في الانفصال عن الأغشية المانحة6،7،8.
مع الطريقة المعروضة هنا ، يتم تجاوز جوانب الإشارات لبلمرة الأكتين الخلوية ، ويتم إنتاج بلمرة الأكتين على حبات البوليسترين الميكرومترية عن طريق طلائها بمنشطات نواة الأكتين المتفرعة ، وتحديدا المجال النشط لبروتين WASP البشري ، VCA (وتسمى أيضا WA أو WCA)1. ثم يتم تحضين الخرز المطلي في مزيج يحتوي على المكونات اللازمة لبلمرة الأكتين ، بما في ذلك نواة بلمرة الأكتين الرئيسية في الخلايا ، مركب Arp2 / 3 ، والذي يتم تنشيطه بواسطة VCA على سطح الخرزة لتشكيل خيوط جديدة كفروع من جوانب خيوط الابنة1. يتبلمر الأكتين في البداية بشكل موحد حول الخرزة ، ولكن بعد ذلك يكسر التماثل تلقائيا لإنشاء مذنب أكتين يدفع الخرزة إلى الأمام ، وبالتالي يعيد إنشاء شبكات بارزة ومذنبات تشبه الخلايا بطريقة خاضعة للرقابة. تم استخدام مناهج مماثلة مع الخرز والأسطح المطلية الأخرى في الماضي من قبلنا وآخرين لدراسة الكيمياء الحيوية والفيزياء الحيوية لبلمرة الأكتين9،10،11،12 ، ولكن كانت هناك حاجة إلى خبرة واسعة في البروتينات المرتبطة بالأكتين لهذه التجارب. يصف البروتوكول المقدم هنا كيفية إنشاء مذنبات الأكتين وحركته بقوة باستخدام الكواشف المتاحة تجاريا (أو التي ستتوفر قريبا) ، مما يجعل هذا النهج في متناول أي شخص ، بما في ذلك في بيئة تعليمية لتدريس المفاهيم الفيزيائية الحيوية. تشمل الميزات الرئيسية أهمية السحب اللطيف والموثوق ، واستخدام المونومر المعقد بالبروفيلين كمصدر للأكتين ، وضرورة استخدام منشط معقد نشط للغاية Apr2 / 3 ككاشف لطلاء الخرزة.
Protocol
1. إعداد المخازن المؤقتة
ملاحظة: استخدم H2O فائق النقاء لجميع المخازن المؤقتة. ليس من الضروري أن تكون معقمة. قم بتصفية جميع المحاليل الموضحة في الخطوات 1.1-1.4 باستخدام مرشح حقنة 0.2 ميكرومتر ، والقسمة في أجزاء من 500 ميكرولتر -2 مل لكل أنبوب حسب الاستخدام ، وتخزينها في -20 درجة مئوية.
- قم بإعداد 10٪ BSA بوزن 2 جم من BSA في أنبوب مخروطي سعة 50 مل وملء علامة 20 مل ب H2O. امزج حتى يذوب BSA (حوالي 30 دقيقة) ، ثم اصنع الحجم إلى 20 مل.
ملاحظة: استخدم BSA عالي الجودة (انظر جدول المواد). يستخدم محلول BSA بنسبة 10٪ في كل من تحضير الخرز ومزيج الحركة. - لتحضير الخرزة ، قم بإعداد المخزن المؤقت Xb (10 mM HEPES ، 0.1 M KCl ، 1 mM MgCl 2 ، و 0.1 mM CaCl 2 ، pH 7.5) كمحلول 10x ، وقم بتخفيفه قبل الاستخدام (100 ميكرولتر من محلول مخزون 10x Xb + 900 ميكرولتر من H2 O). تحضير Xb / 1٪ BSA عن طريق خلط 100 ميكرولتر من محلول مخزون 10x Xb + 100 ميكرولتر من 10٪ BSA + 800 ميكرولتر من H2O.
- تحضير G-buffer (2 mM Tris، 0.2 mM CaCl 2، 0.2 mM DTT،2 mM ATP)، وهو المخزن المؤقت المستخدم لتخفيف الأكتين الأحادي (G-actin). اضبط الرقم الهيدروجيني 7 ، وليس الرقم الهيدروجيني 8 كما هو مستخدم تقليديا (انظر المناقشة).
- قم بإعداد المخزن المؤقت للحركة MB13 (10 مللي مول HEPES ، 1.5 مللي متر ATP ، 3 مللي متر DTT ، 1.5 مللي متر MgCl2 ، 1 مللي متر EGTA ، 50 مللي مول KCl ، 1٪ BSA ، درجة الحموضة 7.5). بالنسبة لبعض التطبيقات ، يعد 10x MB13 مفيدا. ومع ذلك ، قم بإعداد 10x MB13 بدون BSA ، لأنه يؤدي إلى مشاكل أثناء تعديل الأس الهيدروجيني. أضف BSA من محلول مخزون 10٪ (معد في الخطوة 1.1) عند إعادة تكوين 1x MB13 من 10x MB13.
2. إعداد حلول البروتين
ملاحظة: استخدم H2 O عالي النقاء لجميع عمليات إعادة التعليق. ليس من الضروري أن تكون معقمة. تعامل مع جميع البروتينات الموجودة على الثلج والقسمة في أنابيب مبردة مسبقا. تعامل بلطف حتى لا تنتج فقاعات ، ولا تتحلل أبدا من محاليل البروتين. لتخزين المخزونات عند -80 درجة مئوية ، فإن التجميد السريع في النيتروجين السائل ليس ضروريا. قم بتكييف حجم القسمة لتجنب أكثر من حوالي خمس دورات تجميد وذوبان ، حيث لا يبدو أن هذا يؤثر على نشاط أي من البروتينات. يمكن تخزين حصص العمل عند -20 درجة مئوية لبضعة أسابيع.
- تحضير محلول G-actin (عضلة الهيكل العظمي للأرانب) كما هو موضح أدناه.
- نبض مسحوق الأكتين الطرد المركزي (انظر جدول المواد) عند 4 °C لجمع المادة الصلبة في الجزء السفلي من الأنبوب.
- أضف H 2 O وفقا لتعليمات الشركات المصنعة (1 ملغ بروتين في 100 ميكرولتر من H 2 O البارد للأكتين غيرالمسمى ، 100 ميكروغرام بروتين في 100 ميكرولتر من H2O البارد للأكتين المسمى ATTO).
- اتركه على الثلج لمدة 15 دقيقة على الأقل. امزج برفق عن طريق السحب لأعلى ولأسفل ، واتركه على الثلج لمدة 15 دقيقة أخرى على الأقل ، واخلطه مرة أخرى. نبض الطرد المركزي عند 4 °C لجمع الحل في الجزء السفلي من الأنبوب ، وإعادة مزج.
- قم بإعداد 10-50 ميكرولتر من الأليتين غير المسمى اعتمادا على الاستخدام ، و 20 ميكرولتر من الأكتين المسمى ATTO. قم بتخزين القسمة في -80 درجة مئوية.
- لإزالة بلمرة أوليغومرات الأكتين التي تتشكل أثناء التجفيد والتجميد ، قم بتخفيف حصة من الأكتين المعاد تعليقه ~ 8 أضعاف في G-buffer مع ATP و DTT إضافيين (على سبيل المثال ، إلى 20 ميكرولتر من محلول الأكتين المعاد تعليقه من الخطوة 2.1.4 ، أضف 134 ميكرولتر من G-buffer ، 0.32 ميكرولتر من 0.2 mM ATP و 0.16 ميكرولتر من 1 M DTT). لوضع العلامات الفلورية ، أضف ما يقرب من 10٪ من الأكتين المسمى ؛ على سبيل المثال ، أضف 5 ميكرولتر من الأكتين المسمى ATTO إلى 40 ميكرولتر من الأكتين المخفف غير المصنف. دعه يتحلل من البلمرة على الجليد مع الخلط العرضي (السحب) على الأقل بضعة أيام إلى أسبوع قبل قياس تركيز البروتين بواسطة مقايسة برادفورد كما هو موضح في الخطوة 3.
ملاحظة: احتفظ بالأكتين المخفف غير الملصق والفلورسنت على الثلج في غرفة باردة أو ثلاجة. لا تجمد أبدا أو تسمح للتدفئة. سيستمر المستحضر في إزالة البلمرة بمرور الوقت ، وعندما يتم التعامل معه بشكل صحيح يمكن استخدامه لمدة 6 أشهر على الأقل.
- أعد تعليق مركب Arp2 / 3 (دماغ الخنازير) (انظر جدول المواد) باتباع تعليمات الشركة المصنعة (20 ميكروغرام بروتين في 20 ميكرولتر بارد H 2 O) ، مع تسلسل الطرد المركزي النبضي ، والخلط ، وما إلى ذلك على الجليد كما هو موضح للأكتين في الخطوة2.1. اجمع محاليل البروتين من إعادة تعليق أنبوبين من المسحوق للحصول على مخزون أكبر للتجارب القابلة للتكرار. تحضير 2 ميكرولتر من القسمة وتخزينها في -80 درجة مئوية.
- أعد تعليق البروفيلين (المؤتلف البشري) (انظر جدول المواد) بتركيز أعلى 4 مرات مما هو منصوص عليه في تعليمات الشركة الصانعة (100 ميكروغرام بروتين في 25 ميكرولتر بارد H 2 O) ، مع تسلسل الطرد المركزي النبضي ، والخلط ، وما إلى ذلك على الجليد كما هو الحال بالنسبة للأكتين في الخطوة2.1. اجمع محاليل البروتين من إعادة تعليق أنبوبين من المسحوق قبل تحديد تركيز البروتين للحصول على مخزون أكبر للتجارب القابلة للتكرار.
ملاحظة: يحفظ على الثلج في غرفة باردة أو ثلاجة. لا تجمد أبدا أو تسمح للتدفئة. عند التعامل معها بشكل صحيح ، يكون البروفيلين المعاد تعليقه جيدا لمدة 6 أشهر إلى 1 سنة على الأقل. - أعد تعليق بروتين السد (α1β2 ، المؤتلف البشري) (انظر جدول المواد) باتباع تعليمات الشركة المصنعة (50 ميكروغرام بروتين في 50 ميكرولتر بارد H 2 O) ، مع تسلسل الطرد المركزي النبضي والخلط وما إلى ذلك على الجليد كما هو موضح للأكتين في الخطوة2.1. قم بتبريد 50 ميكرولتر من الجلسرين على الجليد وأضف 50 ميكرولتر من بروتين السد المعاد تعليقه إليه ؛ تخلط بلطف. يحفظ في درجة حرارة -20 درجة مئوية.
ملاحظة: لا يتجمد المحلول ويكون النشاط قويا ، لذلك يمكن الاحتفاظ بالمحلول كحصة واحدة لعدة أشهر ، أو حتى سنوات ، إذا تم التعامل معه بعناية. بروتين تغطية الفأر المؤتلف ، وهو الأكثر استخداما في الماضي في التجارب المختبرية 13 ، سيكون متاحا تجاريا قريبا. - أعد تعليق الجلسولين (المؤتلف البشري ، الموسوم به) (انظر جدول المواد) باتباع تعليمات الشركة المصنعة (20 ميكروغرام بروتين في 20 ميكرولتر بارد H 2 O) ، مع تسلسل الطرد المركزي النبضي ، والخلط ، وما إلى ذلك على الجليد كما هو موضح للأكتين في الخطوة2.1. يتم استخدام حوالي 2 ميكرولتر من الجلسولين يوميا من التجارب ؛ لذلك ، قم بإعداد حصص كبيرة (5-10 ميكرولتر) وتخزينها في -80 درجة مئوية.
ملاحظة: يتم توفير البروتوكول مع gelsolin كبديل. يوصى باستخدام بروتين السد بدلا من الجلسولين ، إما تم شراؤه أو تنقيته كما في13. - أعد تعليق VCA (WASP-VCA البشري ، علامة GST) (انظر جدول المواد) بتركيز أعلى بمقدار ضعفين مما هو منصوص عليه في تعليمات الشركة المصنعة (500 ميكروغرام بروتين في 250 ميكرولتر بارد H 2 O) ، مع تسلسل الطرد المركزي النبضي ، والخلط ، وما إلى ذلك على الجليد كما هو الحال بالنسبة للأكتين في الخطوة2.1. اصنع 10 ميكرولتر من القسمة واحفظها في -80 درجة مئوية.
ملاحظة: بمجرد تسويق SpVCA (pVCA البشري ، الستربتافيدين و His-tagged) أو إذا كان تنقية البروتين14 ممكنا ، يوصى باستخدام SpVCA بدلا من VCA. VCA لا يعطي المذنبات بشكل متكرر في ظل الظروف الموضحة هنا.
3. قياس تركيزات البروتين
- بناء منحنى برادفورد القياسي المصنوع من اثنين من التخفيفات التسلسلية المتداخلة من BSA.
ملاحظة: يحتاج المنحنى القياسي فقط إلى البناء كل شهرين (أو حتى أقل تكرارا) طالما أن مقياس الطيف الضوئي لا يتغير.- في الصف 1 من رف microtube ، ضع أنابيب لسلسلة تخفيف BSA # 1: أربعة أنابيب سعة 2 مل متبوعة بأربعة أنابيب سعة 1.5 مل. في الصف 3 من الرف ، ضع أنابيب لسلسلة تخفيف BSA # 2 كما هو الحال بالنسبة للسلسلة # 1. في الصف 5 من الحامل ، ضع أنبوبا واحدا سعة 2 مل لكل عينة يتم قياسها مع أنبوبين سعة 1.5 مل. أضف أنبوبا واحدا سعة 1.5 مل في الصف 5 للفراغ.
- قم بقياس كاشف برادفورد (انظر جدول المواد) في أنابيب 1.5 مل.
- املأ أنبوبا مخروطيا سعة 15 مل في الأعلى بكاشف برادفورد لتسهيل السحب (سيتم إرجاع الفائض إلى زجاجة المخزون في الثلاجة) على الثلج. تناول كاشف برادفورد سعة 200 ميكرولتر وأخرجه مرة أخرى إلى الأنبوب المخروطي لتبليل طرف الماصة. نظرا لأن المحلول لزج ، ماصة ببطء للسماح للمحلول بالدخول وترك الطرف تماما دون تكوين فقاعات.
- باستخدام الطرف "قبل الرطب" ، قم ببطء بماصة 200 ميكرولتر من كاشف برادفورد في كل أنبوب من أنابيب 1.5 مل في الحامل (أربعة لكل تخفيف BSA ، وواحد للفراغ واثنان لكل عينة يتم قياسها). قم بذلك أولا للسماح لكاشف برادفورد بالتسخين تماما إلى درجة حرارة الغرفة قبل الخلط مع محاليل البروتين. أعد المحتويات المتبقية من الأنبوب المخروطي سعة 15 مل إلى الزجاجة.
- قم بقياس H 2 O في أنابيب2مل. في الصف 1 من الحامل ، أضف 1990 ميكرولتر H2O إلى الأنبوب الأول ، و 900 ميكرولتر إلى الأنابيب الثلاثة الأخرى. بالنسبة للصف 3 ، أضف 1,992.5 ميكرولتر إلى الأنبوب الأول و 900 ميكرولتر إلى الأنابيب الثلاثة الأخرى. أضف 2000 ميكرولتر H2O إلى كل أنبوب من أنابيب العينة في الصف 5.
ملاحظة: بالنسبة لجميع وحدات التخزين الأكبر من 1000 ميكرولتر ، استخدم ماصة 1000 ميكرولتر ، ولكن قم بإدارة الكمية الكاملة عن طريق السحب مرتين. من المهم تجهيز كل شيء قبل البدء في الخطوات اللاحقة ، لتجنب ترك البروتينات المخففة للغاية في H2O لفترات طويلة من الزمن. - لتحضير سلسلة تخفيف BSA # 1 ، امزج 10 ميكرولتر من 2 مجم / مل BSA المعاير (انظر جدول المواد) في الأنبوب مع 1,990 μL H2O لعمل محلول 10 ميكروغرام / مل. من هذا ، قم بعمل ثلاثة تخفيفات تسلسلية (5 ميكروغرام / مل ، 2.5 ميكروغرام / مل ، و 1.25 ميكروغرام / مل BSA) عن طريق نقل 900 ميكرولتر من كل محلول إلى الأنبوب التالي (يحتوي على 900 ميكرولتر H2O).
- لتحضير سلسلة تخفيف BSA # 2 ، امزج 7.5 ميكرولتر من 2 مجم / مل BSA معاير في الأنبوب مع 1,992.5 μL H2O لعمل محلول 7.5 ميكروغرام / مل. من هذا ، قم بعمل ثلاثة تخفيفات تسلسلية (3.75 ميكروغرام / مل ، 1.875 ميكروغرام / مل و 0.9375 ميكروغرام / مل BSA) عن طريق نقل 900 ميكرولتر من كل محلول إلى الأنبوب التالي (يحتوي على 900 ميكرولتر H2O).
- امزج واقرأ الامتصاص لتوليد المنحنى القياسي. أضف 800 μL H2O إلى أنبوب كاشف برادفورد للفراغ ، وابدأ تشغيل المؤقت. بأكبر قدر ممكن من الكفاءة دون صنع فقاعات ، امزج 800 ميكرولتر من كل معيار BSA مع كاشف برادفورد 200 ميكرولتر في الأنابيب المعدة. بمجرد خلط جميع المعايير مع كاشف برادفورد (< 5 دقائق) ، صب كل معيار في كفيت يمكن التخلص منه وقراءة الامتصاص عند 600 نانومتر في مقياس الطيف الضوئي بعد إفراغ الماكينة.
ملاحظة: يمكن استخدام نفس الكوفيت لقراءة السلسلة بأكملها إذا تمت قراءة المعيار الأقل تركيزا أولا وتم إفراغ الكوفيت جيدا بين القراءات. أعد المنحنى القياسي حتى يكون للملاءمة الخطية قيمة R لا تقل عن 0.99. فقط بعد إتقان السحب والخلط اللطيف ، انتقل إلى قراءة العينات.
- قياس تركيزات الأكتين والبروتينات المرتبطة بالأكتين
- في الأنابيب سعة 2 مل التي تحتوي على 2000 ميكرولتر من H 2 O (المحضرة في الخطوة 3.1.3) ، امزج بلطف ما يلي:2ميكرولتر لكل من مركب Arp2 / 3 و profilin ، 4 ميكرولتر من G-actin المسمى ، 5 ميكرولتر لكل من الجلسولين و VCA و 8 ميكرولتر من بروتين السد (المؤتلف البشري). خذ على الفور 800 ميكرولتر من المحلول واخلطه مع كاشف برادفورد المعد بالفعل ، ثم كرر الحصول على قراءتين في حدود 5٪ -10٪ من بعضهما البعض لكل عينة. يشير الاختلاف الأكبر إلى وجود مشكلة في إعادة التعليق أو المناولة. اقرأ في غضون بضع دقائق من الخلط مع كاشف برادفورد.
ملاحظة: في حالة استخدام منحنى قياسي من يوم آخر ، يجب تحضير الفراغ من الخطوة 3.1.6 فقط ، بالإضافة إلى العينات.
- في الأنابيب سعة 2 مل التي تحتوي على 2000 ميكرولتر من H 2 O (المحضرة في الخطوة 3.1.3) ، امزج بلطف ما يلي:2ميكرولتر لكل من مركب Arp2 / 3 و profilin ، 4 ميكرولتر من G-actin المسمى ، 5 ميكرولتر لكل من الجلسولين و VCA و 8 ميكرولتر من بروتين السد (المؤتلف البشري). خذ على الفور 800 ميكرولتر من المحلول واخلطه مع كاشف برادفورد المعد بالفعل ، ثم كرر الحصول على قراءتين في حدود 5٪ -10٪ من بعضهما البعض لكل عينة. يشير الاختلاف الأكبر إلى وجود مشكلة في إعادة التعليق أو المناولة. اقرأ في غضون بضع دقائق من الخلط مع كاشف برادفورد.
- احسب تركيزات الأكتين والبروتينات المرتبطة بالأكتين باستخدام المنحنى القياسي وعامل التخفيف. أعد القياس لكل تعليق جديد. الأوزان الجزيئية لتحويل قراءات mg / mL التي تم الحصول عليها عبر مقايسة برادفورد إلى μM هي: الأكتين 43 كيلو د ، Arp2 / 3 المركب 224 كيلو د ، البروفيلين 15 كيلو د ، الجلسولين 95 كيلو د ، بروتين السد 68 كيلو د (المؤتلف البشري) أو 63.5 كيلو د (المؤتلف الفأر) ، VCA 43 كيلو د ، و SpVCA 54 كيلو د (الوزن الجزيئي المونومر).
4. طلاء الخرز
- قم بتبريد جهاز الطرد المركزي مسبقا إلى 4 درجات مئوية واضبط الكتلة الجافة المهيجة (انظر جدول المواد) على 18 درجة مئوية.
- اغسل الخرز: ماصة 50 ميكرولتر من المخزن المؤقت Xb في أنبوب طرد مركزي دقيق سعة 1.5 مل ، أضف 9 ميكرولتر من تعليق حبة بقطر 4.5 ميكرومتر أو 2 ميكرولتر من تعليق حبة بقطر 1 ميكرومتر (تعليق 2.5٪ وزن / فولت) (انظر جدول المواد). امزج العينات جيدا وجهاز طرد مركزي على حرارة 20000 × جم لمدة 10 دقائق عند 4 درجات مئوية.
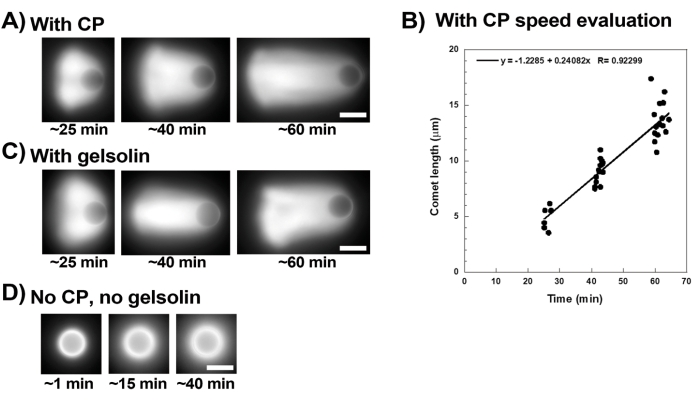
ملاحظة: إجمالي مساحة سطح الخرزة لكلا حجمي الخرزة هو 3 سم2: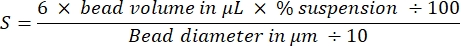
مشتقة عن طريق حساب عدد الخرز ثم سطحها الكلي باستخدام المعادلات الكلاسيكية لحجم ومساحة سطح الكرات. يمكن استخدام أحجام أخرى من الخرز إذا تم ضبط الكميات للحفاظ على مساحة السطح الكلية ثابتة عند 3 سم2. - معطف الخرز: قم بإزالة المادة الطافية بعناية دون إزعاج الخرز ، وأعد تعليق حبيبات الخرزة في 40 ميكرولتر من 2 ميكرومتر SpVCA (أو 7 ميكرومتر VCA) في مخزن Xb المؤقت عن طريق السحب اللطيف. حرك عند 18 درجة مئوية ، 1000 دورة في الدقيقة لمدة 20 دقيقة.
- اغسل الخرز المطلي: قم بالطرد المركزي للمزيج (20000 × جم لمدة 10 دقائق عند 4 درجات مئوية) وقم بإزالة المادة الطافية بعناية. أعد تعليق الخرز في 50 ميكرولتر من Xb / 1٪ BSA البارد ، وأجهزة الطرد المركزي عند 20000 × جم لمدة 10 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية وكرر خطوة الغسيل 1x.
- أعد تعليق حبيبات الخرزة المطلية من الخطوة 4.4 في 120 ميكرولتر بارد Xb / 1٪ BSA لكلا حجمي الخرز بحيث تكون كمية مساحة سطح الخرزة / ميكرولتر من محلول الخرزة هي نفسها. تخزينها على الجليد في الثلاجة أو غرفة باردة. ستستمر الخرز المطلي في العمل بشكل طبيعي لعدة أسابيع على الأقل.
5. إعداد مزيج الحركة والشرائح للمراقبة
ملاحظة: الحجم الإجمالي لمزيج الحركة هو 8.4 ميكرولتر للسماح بخلوص حوالي 25 ميكرومتر بين الشريحة وغطاء الغطاء 18 مم × 18 مم حتى لا يتم ضغط الخرز من جميع الأحجام (حتى قطر 10 ميكرومتر). مزيج الحركة الأساسي هو حوالي 5 ميكرومتر G-actin (10٪ أكتين فلوري مسمى) مع 5 ميكرومتر بروفيلين ، 50 نانومتر Arp2 / 3 مركب ، و 25 نانومتر بروتين تغطية (أو 240 نانومتر جيلسولين).
- تحضير خليط تفاعل الحركة. تعتمد الكميات الدقيقة من الأكتين (وبالتالي البروفيلين) على التركيز المحسوب في الخطوة 3.3 ، ولكن التفاعل التمثيلي يكون كما يلي. تخلط على الجليد ، بهذا الترتيب: 3.2 ميكرولتر من MB13 ، 1.5 ميكرولتر من البروفيلين عند 30 ميكرومتر مخفف في MB13 ، 1 ميكرولتر من بروتين السد عند 0.21 ميكرومتر مخفف في MB13 أو جيلسولين مخفف إلى 2 ميكرومتر في MB13 ، 1 ميكرولتر من مركب Arp2 / 3 عند 0.47 ميكرومتر مخفف في MB13 ، 0.2 ميكرولتر من تعليق حبة (دوامة قبل الاستخدام مباشرة) ، و 1.5 ميكرولتر من الأكتين عند 30 ميكرومتر في G-buffer. تخلط جيدا ولكن بسرعة وبدء المؤقت.
- اكتشف خليط تفاعل الحركة بالكامل على شريحة. قم بتغطيتها بغطاء 18 مم × 18 مم وأغلق غطاء الغطاء باستخدام VALAP المذاب باستخدام فرشاة طلاء صغيرة. VALAP هو مزيج من اللانولين والبارافين والفازلين (انظر جدول المواد) 1: 1: 1 بالوزن ، يذوب ويقلب معا.
6. المراقبة المجهرية
- راقب تفاعلات الحركة على الفور باستخدام هدف 100x إما على مجهر قائم أو مقلوب (انظر جدول المواد) ، مزود بتباين الطور و / أو الفحص المجهري فوق الفلوري (مكعب GFP ، انظر جدول المواد). تتم الملاحظات في درجة حرارة الغرفة (23-25 درجة مئوية).
- للحصول على متوسط سرعات الإزاحة لمجموعة كاملة من الخرز، قم بتسجيل تباين الطور أو الصور الثابتة الفلورية بمرور الوقت عن طريق مسح الشريحة بأكملها. قياس طول المذنب باليد والمؤامرة مقابل الوقت. ميل الملاءمة الخطية هو متوسط سرعة النمو.
- لتقييم سرعة الخرز الفردي ، اجمع أفلام الفاصل الزمني في الفحص المجهري لتباين الطور. اعتمادا على سرعة الخرزة والدقة المطلوبة ، خذ إطارات كل 1-10 ثوان. استخدم أداة التتبع لأي برنامج لمعالجة الصور للحصول على سرعات ومسارات الخرز.
النتائج
أحد الجوانب الرئيسية لإنشاء مذنبات الأكتين بشكل متكرر على الخرز هو السحب اللطيف والدقيق للبروتينات الحساسة المرتبطة بالأكتين. يعد إنشاء منحنى برادفورد القياسي طريقة جيدة لتقييم مهارات سحب العينات. يوضح الشكل 1A ، B أنابيب المنحنى القياسي ومثالا على الشكل الذي يبدو عليه التخفيفان التسلسليان ل BSA بمجرد مزجهما مع كاشف برادفورد. لاحظ تدرج اللون الأزرق المتدرج (تركيز البروتين العالي يعطي محلولا أكثر زرقة). عند قراءتها في مقياس الطيف الضوئي ورسمها ، تعطي هذه الحلول منحنى قياسيا كما هو موضح في الشكل 1C. لممارسة السحب بعناية ، يجب تكرار الفحص حتى يصبح عامل الارتباط الخطي 0.999 ، كما هو موضح.
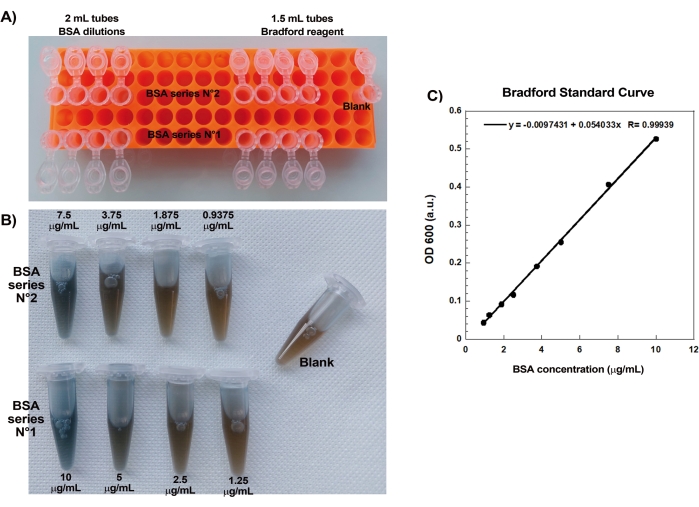
بمجرد تقييم تركيزات البروتينات التجارية المعاد تعليقها بعناية عبر مقايسة برادفورد ، يتم تحضير الخرز المطلي ومزيج الحركة وخلطهما معا. يوضح الشكل 2A صورا تمثيلية للمراحل المختلفة لتكوين المذنبات: تتشكل سحب الأكتين في غضون دقائق من خلط الخرز المغلف ب SpVCA ووسط الحركة. يحدث استقطاب السحب في ~ 5 دقائق وإنتاج المذنبات في 15-20 دقيقة. تستمر مذنبات الأكتين ، المرئية مع كل من المجهر epifluorescence و phase contrast (الشكل 2A) ، في الاستطالة لعدة ساعات ، ولكن لا يتم الحفاظ على سرعة ثابتة لذلك يتم تقييم حركة الخرزة عادة في غضون 1 ساعة. من ناحية أخرى ، يستغرق الأمر 30 دقيقة مع حبات مغلفة ب VCA للحصول على سحب الأكتين الساطعة (الشكل 2B) ، ولا تتشكل المذنبات ، على الرغم من أن التماثل يبدأ في الانكسار عند 1-2 ساعة (السهم في الشكل 2B) وتظهر السحب الاستقطاب بعد الحضانة بين عشية وضحاها.
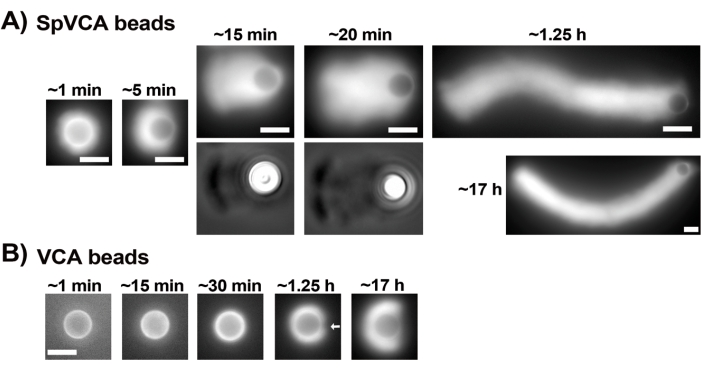
يوضح الشكل 3 مثالا على تقييم سرعة حبة الحبيبات في وجود بروتين السد. نظرا لأن جميع الخرزات تكسر التماثل في نفس الوقت تقريبا ، يتم إجراء تسجيلات "الفاصل الزمني الزائف" حيث يتم مسح الشريحة ضوئيا ويتم التقاط صور لجميع المذنبات بمرور الوقت (الشكل 3 أ). المذنبات لا تتبلمر. لذلك ، يمكن استخدام الزيادة في أطوال المذنبات المقاسة بمرور الوقت لحساب سرعة الإزاحة (الشكل 3 ب). يمكن استخدام Gelsolin بدلا من بروتين السد لتكوين المذنب إذا تمت إضافة 10x أكثر من الجلسولين للتعويض عن انخفاض نشاط السد. المذنبات التي تشكلت في وجود الجلسولين هي نفسها نوعيا وتتحرك بنفس سرعات الخرز مع بروتين السد (الشكل 3C). يعد نشاط السد أمرا أساسيا لتركيز البلمرة على سطح الخرزة ، وعندما لا يتم تضمين بروتين السد أو الجلسولين في مزيج الحركة ، لا تستقطب سحب الأكتين أبدا لتشكيل المذنبات ، على الرغم من أن سحب الأكتين الساطعة تتشكل حول الخرز (الشكل 3 د). يمكن استخدام المذنبات على الخرز لقياس إنتاج القوة القائمة على الأكتين في سياقات كيميائية حيوية مختلفة عن طريق تغيير مزيج الحركة ومراقبة النتيجة على الحركة باستخدام تقنيات معالجة دقيقة مختلفة ، على سبيل المثال15.
الشكل 1: منحنى برادفورد القياسي. (أ) صورة لكيفية إعداد الأنابيب لصنع منحنى برادفورد القياسي. لا يتم عرض أنابيب العينة. (ب) صورة للتخفيفات التسلسلية المتداخلة BSA التي كانت تختلط مرة واحدة مع كاشف برادفورد. (ج) تقاس الامتصاصات عند 600 nm من المحاليل الموضحة في (ب) في مقياس الطيف الضوئي ويتم رسمها كدالة لتركيزات البروتين في محاليل BSA. يتم استخدام الملاءمة الخطية لحساب تركيز العينة. عامل الارتباط ، R ، للملاءمة الخطية هو 0.999. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 2: تكوين المذنب على الخرز المطلي ب SpVCA بدلا من الخرز المطلي ب VCA. (أ) حبات تمثيلية مغلفة ب SpVCA (حبة مختلفة في كل صورة) تظهر بمرور الوقت. يشار إلى الوقت من لحظة الخلط. تتشكل سحب الأكتين على الفور ، ويعطي استقطاب السحب المذنبات ، التي تستمر في الاستطالة لساعات. (ب) خرز تمثيلي مطلي ب VCA (حبة مختلفة في كل صورة) تظهر بمرور الوقت. أكثر من 1 ساعة ضرورية لرؤية بدايات استقطاب سحابة الأكتين (السهم) وحتى الحضانة الطويلة لا تنتج المذنبات. جميع الصور عبارة عن خرز قطره 4.5 ميكرومتر ، وتصوير فوق التألق للأكتين الفلوري مقترنا بتصور تباين الطور للنقاط الزمنية 15 و 20 دقيقة في (A) ، وأشرطة المقياس = 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
الشكل 3: تحليل سرعة المذنبات والخرزات . (أ) و(ج) في وجود بروتين السد (CP) أو الجلسولين، تستقطب سحب الأكتين لتكوين مذنبات في أول 20 دقيقة من التفاعل، وتستطيل المذنبات بمرور الوقت. الوقت من الخلط المشار إليه لكل صورة ؛ كل صورة هي حبة مختلفة. هناك بعض التباين بين الخرز والتحضير ، ولكن في المتوسط تتحرك الخرز بسرعة ميكرون / أقل ميكرون في الدقيقة (0.2-1 ميكرومتر / دقيقة) في ظل الظروف القياسية الموضحة هنا. (ب) تمثيل بياني يوضح تقييم طول المذنب (كل عدد الخرزات) بمرور الوقت. يتوافق ميل الارتباط الخطي مع متوسط سرعة الإزاحة ، في هذه الحالة 0.24 ميكرومتر / دقيقة. (د) في حالة عدم وجود نشاط تغطية (بدون بروتين تغطية أو جيلسولين) ، تتشكل سحب الأكتين حول الخرز ، لكن المذنبات لا تتشكل. جميع الصور من خرز قطره 4.5 ميكرومتر ، تصوير فوق التألق للأكتين الفلوري ، قضبان المقياس = 5 ميكرومتر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يصف البروتوكول المفصل هنا كيفية الحصول على نمو شبكة الأكتين على أسطح الخرز ، وتشكيل المذنبات ، وحركة الخرزة باستخدام البروتينات المتاحة تجاريا. ومع ذلك ، في بعض الأحيان لا يتم ملاحظة المذنبات بشكل متكرر أو تكون غير متجانسة بين الشريحة و coverslip. تؤكد المناقشة التالية على بعض النقاط الرئيسية في البروتوكول وتقترح بعض المعلمات التي يمكن تعديلها. أحد العوامل التي يجب وضعها في الاعتبار هو أن تكوين المذنب وسرعة الخرزة يتأثران بدرجة الحرارة ، حيث تؤثر درجات الحرارة التي تزيد كثيرا عن 25 درجة مئوية أو أقل بكثير من 23 درجة مئوية سلبا على تكوين المذنب وتعطي بيانات غير قابلة للتكرار. يوصى بشدة باستخدام مجهر يتم التحكم في درجة حرارته أو مجهر في غرفة يتم التحكم في مناخها. على الرغم من أن الأكتين المسمى بالفلورسنت غالبا ما يتم تضمينه في مزيج الحركة لمراقبة المذنبات بواسطة الفحص المجهري الفلوري ، بمجرد أن يزيد طول المذنبات عن قطر حبة ، فإنها تكون مرئية أيضا بواسطة الفحص المجهري لتباين الطور كمسحة داكنة بجوار الخرزة. يعد تصور تباين الطور أكثر ملاءمة للتصوير بفاصل زمني حيث ترتبط بعض السمية الضوئية بالتصوير الفلوري حتى عبر القرص الدوار. نظرا لأن الخرز يستقر بمرور الوقت ، فإن المجهر المقلوب ينتج انحرافا أفقيا أقل للخرزة من المجهر المستقيم وهو أكثر ملاءمة للأفلام. يعد استخدام VALAP المنصهر لإغلاق الشرائح أمرا مهما لأن مواد مثل طلاء الأظافر تتداخل مع تكوين المذنب. يمكن صنع كميات كبيرة من VALAP في دورق ، ثم يتم جرفها لإعادة ملء أكواب أصغر أكثر قابلية للذوبان السريع. VALAP جيد لسنوات في درجة حرارة الغرفة.
جانب تقني رئيسي آخر هو التحضير الدقيق للمخزن المؤقت ومزيج الحركة. يجب توخي الحذر عند إعداد MB13 ، خاصة في خطوة ضبط الأس الهيدروجيني. يجب ضبط الرقم الهيدروجيني ل MB13 بسرعة إلى محايد مع NaOH لتجنب التحلل المائي ATP ، ولكن ليس بسرعة كبيرة حيث يذوب EGTA مع اقتراب الرقم الهيدروجيني من المستوى المحايد. EGTA هو مكون رئيسي لأنه يعقد الكالسيوم المرتبط بالأكتين ، مما يعطي في مزيج الحركة شكل المغنيسيوم الأكثر نشاطا16. MB13 المحضر بسرعة كبيرة أو ببطء شديد يعطي تكوين مذنب دون المستوى الأمثل أو حتى لا شيء على الإطلاق. نقطة رئيسية إضافية هي تتبع تركيز KCl بعناية في مزيج الحركة عند اللعب مع الظروف. على سبيل المثال ، عند استخدام 1x MB13 في مزيج التفاعل وتخفيف البروفيلين ، وبروتين السد ، ومركب Arp2 / 3 في MB13 ، يكون تركيز KCl النهائي في تفاعل الحركة حوالي 40-50 mM بسبب التخفيف بواسطة G-buffer. يعطي هذا التركيز أفضل النتائج في فحص المذنب ، وأي أكثر من 60 mM KCl يقلل من نشاط النواة المعقدة Arp2 / 3.
على الجانب البروتيني للأشياء ، يتمثل أحد الجوانب التقنية الحاسمة للحصول على مذنبات الأكتين في التعامل السليم مع البروتينات التجارية المرتبطة بالأكتين ، ولا سيما السحب الدقيق لكميات الميكرولتر. تعد خطية منحنى برادفورد القياسي اختبارا جيدا للسحب ويمكن بعد ذلك استخدام المنحنى للقياسات الروتينية لتركيزات البروتين. في الواقع ، عند استخدام البروتينات التجارية المعاد تعليقها لإجراء المذنب ، من المهم دائما التحقق من تركيزات البروتين ، حيث يمكن أن يؤدي تقلب الدفعات وخطأ المستخدم أثناء إعادة التعليق إلى اختلافات بين التركيزات الحقيقية والمتوقعة. في بعض الأحيان يمكن أن تؤدي الاختلافات الصغيرة في تركيزات البروتين إلى الغياب التام للمذنبات.
جانب آخر مهم من الطريقة المعروضة هنا هو استخدام G-actin المعقد كوقود للبلمرة. تاريخيا ، استخدمت الأنظمة المختبرية الأكتين الخيطي المبلمر مسبقا (F-actin) كمصدر للأكتين: إزالة البلمرة في البلمرة السائبة على السطح10,17. كان لهذا ميزة التحكم في مستويات G-actin ، لكنه أضاف طبقة من التعقيد تتطلب مكونات إضافية لتحفيز إزالة البلمرة. نظرا لأن دوران شبكة الأكتين ليس ضروريا لإنتاج القوة والحركة ، والتي تغذيها النواة والبلمرة على سطح الخرزة ، في حين أن عوامل إزالة بلمرة الأكتين مثل ADF / cofilin تعمل على الشبكات القديمة البعيدة عن السطح18 ، فإن معظم إعادة تكوين الحركة القائمة على الأكتين في المختبر تتم الآن دون دوران من أجل البساطة. ومع ذلك ، هناك بعض العيوب لاستخدام G-actin. أولا ، عند استخدام الأكتين التجاري ، الذي تم تجفيفه بالتجميد ، توجد oligomers. خطوات إزالة البلمرة الموضحة هنا مهمة جدا في الحصول على نتائج قابلة للتكرار. على وجه الخصوص ، على الرغم من أن G-buffer يتم ضبطه تقليديا على الرقم الهيدروجيني 8 ، يبدو أن الرقم الهيدروجيني المنخفض (الرقم الهيدروجيني 7 ، على سبيل المثال) يعمل بشكل أفضل في المقايسات الموضحة في هذه المقالة ، ربما لأن انخفاض درجة الحموضة يعزز إزالة البلمرة19. عيب آخر لاستخدام G-actin هو أنه بمجرد وضعه في ظروف الملح المسموح بها للبلمرة ، يحدث التنوي التلقائي ويتشكل F-actin بكميات كبيرة وكذلك على سطح الخرزة. يعمل تعقيد G-actin مع profilin على قمع التنوي التلقائي في بلمرة النهاية السائبة والمدببة ، وبالتالي تركيز كل من التنوي وبلمرة النهاية الشائكة على السطح20. Profilin-G-actin ذو صلة من الناحية الفسيولوجية ، حيث أن الكثير من الأكتين في الخلية موجود في هذا الشكل21. هنا ، يتم استخدام نسبة 1: 1 من profilin: actin ؛ ومع ذلك ، فإن النسب الأعلى (على سبيل المثال 3: 1) تمنع البلمرة بشكل أكثر شمولا في الجزء الأكبر ، على الرغم من أن النسب الأعلى تمنع أيضا مركب Arp2 / 3 واستطالة النهاية الشائكة إلى حد ما22,23.
يعد نشاط السد أيضا مفتاحا لتكوين المذنبات لأنه يضمن إدخال أكتين جديد على السطح عبر دورات التنوي بواسطة مركب Arp2 / 3 المنشط على السطح24,25. بدون تغطية ، لا تكسر سحب الأكتين التماثل لتشكيل المذنبات لأن البلمرة على السطح لا تبني توترا كافيا لكسر السحابة26. في الماضي ، استخدمنا بروتين تغطية الفأرالمؤتلف المنقى منزليا 13 ، لكن الاختبارات التي أجريت لهذه المقالة تشير إلى أن بروتين السد البشري المؤتلف المتاح تجاريا فعال بنفس القدر ، كما هو متاح تجاريا جيلسولين ، على الرغم من أنه يجب استخدام 10x أكثر من الجلسولين ، وبالنسبة لبعض التطبيقات ، قد لا يكون مناسبا لأنه يحتوي على نشاط قطع الأكتين بالإضافة إلى الحدالأقصى 27.
أخيرا ، تكمن متانة هذه الطريقة في استخدام منشط معقد Arp2 / 3 نشط للغاية ، streptavidin-pVCA (SpVCA)28. يتضمن SpVCA مجال ربط profilin-G-actin ل WASP (المجال p) بالإضافة إلى مجال الربط المعقد Arp2 / 3 حيث وجد أن هذا هو الأكثر كفاءة في ظروف profilin-G-actin29. والأهم من ذلك ، أن استخدام علامة الستربتافيدين ، التي تم تقديمها في الأصل للسماح بوظائف السطح عبر رابط البيوتين-ستربتافيدين ، له تأثير إضافي يتمثل في زيادة التنشيط المعقد Arp2 / 3 ، ويرجع ذلك على الأرجح إلى حقيقة أن الستربتافيدين عبارة عن رباعي وبالتالي يقوم بتجميع المنشط ، المعروف بزيادة نشاط Arp2 / 3 المعقد30 . SpVCA المنتجة تجاريا قيد التطوير حاليا وستكون متاحة قريبا للشراء. وتجدر الإشارة أيضا إلى أنه على الرغم من استخدام 40 ميكرولتر من 2 ميكرومتر SpVCA بشكل روتيني لطلاء 3 سم2 من سطح الخرزة ، فإن تركيزات الطلاء الأخرى (أعلى وأقل) تعمل أيضا ، واللعب مع هذه الظروف يعطي سرعات وأشكال مختلفة لنمو المذنبات. في الواقع ، عندما لا تتشكل المذنبات أو لا يكون حجم المذنب متجانسا على الشريحة ، يجب اختبار ظروف الطلاء المختلفة ، بالإضافة إلى تركيزات مختلفة من KCl و profilin في مزيج الحركة. يمكن أيضا تغيير تركيزات الأكتين ومركب Arp2 / 3 وبروتين السد في مزيج الحركة لتحسين تكوين المذنبات ، ولكن في أيدينا ، غالبا ما يؤدي تغيير هذه النسب إلى نتائج مربكة.
في الختام ، تنتج الطرق الموضحة هنا تجميع الأكتين على أسطح الخرز وحركته ، ولكن يمكن استخدام أي سطح يمكن تشغيله باستخدام SpVCA. في الحالات التي لا يعمل فيها الامتزاز كما هو موضح هنا ، يمكن استخدام مجموعة الستربتافيدين لربط SpVCA بسطح الاهتمام بعد البيوتينيل. يمكن استخدام هياكل الأكتين المتكونة على هذا النحو ، المذنبات أو غير ذلك ، لاختبار الجوانب البيوكيميائية والفيزيائية الحيوية المختلفة لشبكات الأكتين ، وهي مناسبة بشكل خاص للتلاعب الفيزيائي باستخدام الماصات الدقيقة والملاقط الضوئية وعمليات الاجتثاث بالليزر15،26،31،32. بالإضافة إلى استخداماته لمجتمع البحث ، فإن النهج الموصوف هنا مناسب كأداة تعليمية لطلاب الفيزياء الحيوية الجامعيين لدراسة مفاهيم المادة النشطة مثل كسر التماثل والتنظيم الذاتي.
Disclosures
يعلن المؤلفون أنه ليس لديهم تضارب في المصالح مع محتويات هذه المقالة.
Acknowledgements
نعرب عن تقديرنا الصادق لأعضاء منزلنا الجديد في LPENS على ترحيبهم الحار ، وعلى وجه الخصوص ، فريق ABCDJ على كل مساعدتهم ودعمهم. يقر JP بالدعم المالي من مؤسسة ARC (Grant PJA 20191209604) ، ويقر CS بالدعم المالي من منظمة برنامج علوم الحدود البشرية (Grant RGP0026/2020).
Materials
| Name | Company | Catalog Number | Comments |
| Actin, rabbit muscle, Alexa Fluor 488 conjugate | Invitrogen (ThermoFisher Scientific) | A12373 (recently discontinued) | This product can be replaced with ATTO-488 actin from Hypermol. |
| Actin, rabbit muscle, ATTO-488 | Hypermol | 8153 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Arp2/3 complex | Cytoskeleton | RP01P | |
| ATP | Sigma | A7699 | |
| BioSpectrometer, basic | Eppendorf | 035739 | |
| Bradford Reagent | Bio-Rad | 500-0006 | |
| BSA, high quality | Sigma | A3059 | |
| BSA standard 2 mg/mL (Pierce) | Thermo Scientific | 23209 | |
| Capping protein (a1b2, mouse recombinant) | Home-purified (Reference 13) | This product will soon be commercially available from Cytoskeleton. | |
| Capping protein (a1b2, human recombinant) | Hypermol | 8322 | |
| Cube, GFP: U-MNIBA3 or U-MWB2 | Olympus | discontinued | Any GFP cube, adapted to the microscope being used, can be used. |
| Dry block, agitating: ThermoMixer C (refrigerated) | Eppendorf | 035963 | |
| ** with SmartBlock, 24 microtubes 2 mL | Eppendorf | 035969 | |
| Gelsolin (human recombinant, His-tagged) | Cytoskeleton | HPG6 | |
| Lanolin | Sigma | 49909 | |
| Microcentrifuge 5427R + rotor | Eppendorf | 934126 | |
| Microscope, upright: BX51 | Olympus | discontinued | Any epifluorescence upright microscope equipped with phase contrast optics can be used. |
| Microscope, inverted: IX70 | Olympus | discontinued | Any epifluorescence inverted microscope equipped with phase contrast optics can be used. |
| Paraffin | Sigma | 76244 | |
| Petroleum jelly: Vaseline | Sigma | 16415 | |
| Pipettes Research Plus | Eppendorf | Gilson pipettes don't work as well for delivery of very small volumes (0.5 µL for example). | |
| **10 µL | 933954 | ||
| **2.5 µL | 933953 | These two sizes are essential, but the use of high-quality pipettes (a full Research Plus set for example) is recommended. | |
| Polystyrene carboxylate beads | Polysciences | ||
| **approx. 1 µm diameter | 08226 | ||
| **approx. 4.5 µm diameter | 17140-5 | ||
| Profilin 1 (human recombinant, untagged) | Cytoskeleton | PR02 | |
| SpVCA (human WASP pVCA domain, N-ter His-tag, C-ter Streptavidin tag) | Home-purified (Reference 14) | This product will soon be commercially available from Cytoskeleton. | |
| VCA (human WASP VCA domain, GST-tagged) | Cytoskeleton | VCG03 |
References
- Campellone, K. G., Welch, M. D. A nucleator arms race: cellular control of actin assembly. Nature Reviews Molecular Cell Biology. 11 (4), 237-251 (2010).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. Journal of Cell Biology. 103, 2747-2754 (1986).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Tilney, L. G., Tilney, M. S. The wily ways of a parasite: induction of actin assembly by Listeria. Trends in Microbiology. 1 (1), 25-31 (1993).
- Moore, A. S., et al. Actin cables and comet tails organize mitochondrial networks in mitosis. Nature. 591 (7851), 659-664 (2021).
- Taunton, J., et al. Actin-dependent propulsion of endosomes and lysosomes by recruitment of N-WASP. Journal of Cell Biology. 148 (3), 519-530 (2000).
- Velarde, N., Gunsalus, K. C., Piano, F. Diverse roles of actin in C. elegans early embryogenesis. BMC Developmental Biology. 7, 142(2007).
- Merrifield, C. J., et al. Endocytic vesicles move at the tips of actin tails in cultured mast cells. Nature Cell Biology. 1 (1), 72-74 (1999).
- Samarin, S., et al. How VASP enhances actin-based motility. Journal of Cell Biology. 163 (1), 131-142 (2003).
- Bernheim-Groswasser, A., Wiesner, S., Golsteyn, R. M., Carlier, M. -F., Sykes, C. The dynamics of actin-based motility depend on surface parameters. Nature. 417 (6886), 308-311 (2002).
- Boujemaa-Paterski, R., et al. Network heterogeneity regulates steering in actin-based motility. Nature Communications. 8 (1), 655(2017).
- Akin, O., Mullins, R. D. Capping protein increases the rate of actin-based motility by promoting filament nucleation by the Arp2/3 complex. Cell. 133 (5), 841-851 (2008).
- Palmgren, S., Ojala, P. J., Wear, M. A., Cooper, J. A., Lappalainen, P. Interactions with PIP2, ADP-actin monomers, and capping protein regulate the activity and localization of yeast twinfilin. Journal of Cell Biology. 155 (2), 251-260 (2001).
- Carvalho, K., et al. Actin polymerization or myosin contraction: two ways to build up cortical tension for symmetry breaking. Philosophical Transactions of the Royal Society B. 368 (1629), 20130005(2013).
- Marcy, Y., Prost, J., Carlier, M. -F., Sykes, C. Forces generated during actin-based propulsion: a direct measurement by micromanipulation. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 5992-5997 (2004).
- Carlier, M. -F. Actin: protein structure and filament dynamics. Journal of Biological Chemistry. 266 (1), 1-4 (1991).
- Loisel, T. P., Boujemaa, R., Pantaloni, D., Carlier, M. F. Reconstitution of actin-based motility of Listeria and Shigella using pure proteins. Nature. 401 (6753), 613-616 (1999).
- Reymann, A. -C., et al. Turnover of branched actin filament networks by stochastic fragmentation with ADF/cofilin. Molecular Biology of the Cell. 22 (14), 2541-2550 (2011).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Quantitative variations with pH of Actin Depolymerizing Factor/Cofilin's multiple actions on actin filaments. Biochemistry. 58 (1), 40-47 (2019).
- Plastino, J., Blanchoin, L. Dynamic stability of the actin ecosystem. Journal of Cell Science. 132 (4), 219832(2019).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Suarez, C., et al. Profilin regulates F-actin network homeostasis by favoring formin over Arp2/3 complex. Developmental Cell. 32 (1), 43-53 (2015).
- Courtemanche, N., Pollard, T. D. Interaction of profilin with the barbed end of actin filaments. Biochemistry. 52 (37), 6456-6466 (2013).
- Achard, V., et al. A "primer"-based mechanism underlies branched actin filament network formation and motility. Current Biology. 20 (5), 423-428 (2010).
- Sykes, C., Plastino, J. Actin filaments up against a wall. Nature. 464 (7287), 365-366 (2010).
- vander Gucht, J., Paluch, E., Plastino, J., Sykes, C. Stress release drives symmetry breaking for actin-based movement. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7847-7852 (2005).
- McGough, A. M., Staiger, C. J., Min, J. -K., Simonetti, K. D. The gelsolin family of actin regulatory proteins: modular structures, versatile functions. FEBS Letters. 552 (2-3), 75-81 (2003).
- Abou-Ghali, M., et al. Capping protein is not necessary for polarized actin network growth and actin based motility. Journal of Biological Chemistry. 295, 15366-15375 (2020).
- Yarar, D., D'Alessio, J. A., Jeng, R. L., Welch, M. D. Motility determinants in WASP family proteins. Molecular Biology of the Cell. 13 (11), 4045-4059 (2002).
- Padrick, S. B., et al. Hierarchical regulation of WASP/WAVE proteins. Molecular Cell. 32 (3), 426-438 (2008).
- Bussonier, M., et al. Mechanical detection of a long-range actin network emanating from a biomimetic cortex. Biophysical Journal. 107 (4), 854-862 (2014).
- Paluch, E., vander Gucht, J., Joanny, J. -F., Sykes, C. Deformations in actin comets from rocketing beads. Biophysical Journal. 91 (8), 3113-3122 (2006).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved