Method Article
Reconstitution de la motilité à base d’actine avec des protéines disponibles dans le commerce
Dans cet article
Résumé
Ce protocole décrit comment produire des comètes d’actine à la surface des billes en utilisant des ingrédients protéiques disponibles dans le commerce. De tels systèmes imitent les structures protrusives trouvées dans les cellules et peuvent être utilisés pour examiner les mécanismes physiologiques de production de force de manière simplifiée.
Résumé
De nombreux mouvements cellulaires et changements de forme et certains types de motilité bactérienne et organite intracellulaire sont entraînés par l’actine biopolymère qui forme un réseau dynamique à la surface de la cellule, de l’organite ou de la bactérie. La base biochimique et mécanique de la production de force au cours de ce processus peut être étudiée en reproduisant le mouvement à base d’actine de manière acellulaire sur des surfaces inertes telles que des billes fonctionnalisées et incubées avec un ensemble contrôlé de composants. Dans les conditions appropriées, un réseau élastique d’actine s’assemble à la surface du cordon et s’ouvre en raison de la contrainte générée par la croissance du réseau, formant une « comète d’actine » qui propulse la perle vers l’avant. Cependant, de telles expériences nécessitent la purification d’une foule de différentes protéines de liaison à l’actine, les mettant souvent hors de portée des non-spécialistes. Cet article détaille un protocole pour obtenir de manière reproductible des comètes d’actine et la motilité des billes en utilisant des réactifs disponibles dans le commerce. Le revêtement des perles, la taille des billes et le mélange de motilité peuvent être modifiés pour observer l’effet sur la vitesse du cordon, les trajectoires et d’autres paramètres. Ce test peut être utilisé pour tester les activités biochimiques de différentes protéines de liaison à l’actine et pour effectuer des mesures physiques quantitatives qui mettent en lumière les propriétés de la matière active des réseaux d’actine. Ce sera un outil utile pour la communauté, permettant l’étude de la motilité in vitro à base d’actine sans connaissances spécialisées dans la purification des protéines liant l’actine.
Introduction
La polymérisation de l’actine dans les cellules est contrôlée spatialement et temporellement par une régulation étroite de la nucléation du filament d’actine en aval de la signalisation cellulaire1. La nucléation se produit par la formation d’un trimère d’actine, puis les deux extrémités du filament naissant polymérisent spontanément, bien qu’une extrémité soit plus dynamique (l’extrémité barbelée) que l’autre (l’extrémité pointue)2. Lorsque la nucléation et la polymérisation de l’extrémité barbelée sont dirigées vers une surface, elles produisent suffisamment de force (dans la gamme pico-to-nano Newton) pour pousser la membrane cellulaire pour le mouvement et déplacer des objets de la taille d’un micron à l’intérieur de la cellule avec l’hydrolyse de l’ATP comme source d’énergie3. Quelques exemples incluent les bactéries Listeria monocytogenes qui utilisent les comètes d’actine pour se propager de cellule à cellule, et les mitochondries, où le mouvement basé sur les comètes d’actine est important pour l’hérédité aléatoire pendant la mitose 4,5. Les comètes d’actine sur les endosomes et autres vésicules intracellulaires sont impliquées dans le détachement des membranes donneuses 6,7,8.
Avec la méthode présentée ici, les aspects de signalisation de la polymérisation cellulaire de l’actine sont contournés, et la polymérisation de l’actine est produite sur des billes micrométriques de polystyrène en les recouvrant d’activateurs de nucléation d’actine ramifiée, en particulier le domaine actif de la protéine WASP humaine, VCA (également appelée WA ou WCA)1. Les billes enrobées sont ensuite incubées dans un mélange contenant les ingrédients nécessaires à la polymérisation de l’actine, y compris le principal nucléateur de polymérisation de l’actine dans les cellules, le complexe Arp2/3, qui est activé par VCA à la surface du cordon pour former de nouveaux filaments sous forme de branches sur les côtés des filaments filles1. L’actine polymérise initialement uniformément autour de la perle, mais brise ensuite spontanément la symétrie pour créer une comète d’actine qui pousse la perle vers l’avant, recréant ainsi des réseaux protubérants et des comètes de type cellulaire de manière contrôlée. Des approches similaires avec des billes et d’autres surfaces revêtues ont été utilisées dans le passé par nous et d’autres pour étudier la biochimie et la biophysique de la polymérisation de l’actine 9,10,11,12, mais une vaste expertise dans les protéines de liaison à l’actine était nécessaire pour ces expériences. Le protocole présenté ici décrit comment créer de manière robuste des comètes d’actine et de motilité entièrement avec des réactifs disponibles dans le commerce (ou bientôt disponibles), rendant cette approche accessible à tous, y compris dans un cadre éducatif pour l’enseignement des concepts biophysiques. Les principales caractéristiques comprennent l’importance d’un pipetage doux et fiable, l’utilisation de monomère complexé par la profiline comme source d’actine et l’essentialité de l’utilisation d’un activateur du complexe Apr2/3 hautement actif comme réactif de revêtement de billes.
Protocole
1. Préparation des tampons
REMARQUE: Utilisez Ultrapure H2O pour tous les tampons. Il n’a pas besoin d’être stérile. Filtrer toutes les solutions décrites aux étapes 1.1 à 1.4 à l’aide d’un filtre à seringue de 0,2 μm, aliquote par portions de 500 μL-2 mL par tube selon l’utilisation, et conserver à -20 °C.
- Préparer 10 % de BSA en pesant 2 g de BSA dans un tube conique de 50 mL et en remplissant jusqu’à la marque de 20 mL avec H2O. Mélanger jusqu’à dissolution du BSA (environ 30 min), puis porter le volume à 20 mL.
NOTE: Utilisez BSA de haute qualité (voir le tableau des matériaux). La solution de BSA à 10% est utilisée à la fois dans la préparation des billes et dans le mélange de motilité. - Pour la préparation des billes, préparer le tampon Xb (HEPES 10 mM, 0,1 M KCl, 1 mM MgCl2 et 0,1 mM CaCl2, pH7,5) sous forme de solution 10x et diluer avant utilisation (100 μL de solution mère 10x Xb + 900 μL deH2O). Préparer Xb/1% BSA en mélangeant 100 μL de solution mère 10x Xb + 100 μL de BSA à 10% + 800 μL deH2O.
- Préparer le tampon G (2 mM Tris, 0,2 mM CaCl2, 0,2 mM DTT, 2 mM ATP), qui est le tampon utilisé pour diluer l’actine monomère (G-actine). Ajustez à pH 7, et non à pH 8 comme traditionnellement utilisé (voir discussion).
- Préparer le tampon de motilité MB13 (10 mM HEPES, 1,5 mM ATP, 3 mM TNT, 1,5 mM MgCl2, 1 mM EGTA, 50 mM KCl, 1% BSA, pH7,5). Pour certaines applications, 10x MB13 est utile. Cependant, préparez 10x MB13 sans BSA, car cela entraîne des problèmes lors de l’ajustement du pH. Ajouter BSA à partir d’une solution mère à 10% (préparée à l’étape 1.1) lors de la reconstitution de 1x MB13 à partir de 10x MB13.
2. Préparation de solutions protéiques
REMARQUE: Utilisez ultrapure H2O pour toutes les suspensions. Il n’a pas besoin d’être stérile. Manipulez toutes les protéines sur la glace et aliquote dans des tubes pré-réfrigérés. Manipuler doucement pour ne pas produire de bulles, et ne jamais vorter les solutions protéiques. Pour que les stocks soient stockés à -80 °C, la congélation instantanée dans de l’azote liquide n’est pas nécessaire. Adapter la taille de l’aliquote pour éviter plus de cinq cycles de gel-dégel, car cela ne semble pas affecter l’activité de l’une des protéines. Les aliquotes de travail peuvent être conservées à -20 °C pendant quelques semaines.
- Préparer la solution de G-actine (muscle squelettique de lapin) comme décrit ci-dessous.
- Poudre d’actine de centrifugeuse pulsée (voir tableau des matériaux) à 4 °C pour recueillir le solide au fond du tube.
- Ajouter H2 O selon les instructions du fabricant (1 mg de protéines dans 100 μL de H 2 O froid pour l’actine non marquée, 100 μg de protéines dans 100 μL de H2O froid pour l’actinemarquée ATTO).
- Laissez-le reposer sur la glace pendant au moins 15 minutes. Mélanger doucement en pipérant de haut en bas, laisser reposer sur la glace au moins 15 minutes et mélanger à nouveau. Centrifuger à impulsions à 4 °C pour recueillir la solution au fond du tube, et remixer.
- Préparez 10 à 50 μL d’aliquotes d’actine non marquée selon l’utilisation et 20 μL d’aliquotes d’actine marquée ATTO. Conserver les aliquotes à -80 °C.
- Pour dépolymériser les oligomères d’actine qui se forment lors de la lyophilisation et de la congélation, diluer une partie aliquote d’actine remise en suspension ~8 fois dans un tampon G enrichi d’ATP et de DTT supplémentaires (par exemple, à 20 μL de solution d’actine remise en suspension à partir de l’étape 2.1.4, ajouter 134 μL de tampon G, 0,32 μL de 0,2 mM d’ATP et 0,16 μL de 1 M de DTT). Pour le marquage fluorescent, ajouter environ 10% d’actine marquée; par exemple, ajoutez 5 μL d’actine marquée ATTO à 40 μL d’actine diluée non marquée. Laisser dépolymériser sur la glace avec un mélange occasionnel (pipetage) au moins quelques jours à une semaine avant de mesurer la concentration en protéines par le test de Bradford, comme décrit à l’étape 3.
REMARQUE : Conservez l’actine diluée non étiquetée et fluorescente sur de la glace dans une chambre froide ou un réfrigérateur; Ne jamais geler ou laisser réchauffer. La préparation continuera à se dépolymériser au fil du temps et, lorsqu’elle est manipulée correctement, peut être utilisée pendant au moins 6 mois.
- Resuspendre le complexe Arp2/3 (cerveau porcin) (voir le tableau des matériaux) en suivant les instructions du fabricant (20 μg de protéines dans 20 μL de H 2 O froid), avec la séquence de centrifugation par impulsions, de mélange, etc. sur de la glace comme décrit pour l’actine à l’étape2.1. Combinez les solutions protéiques de la remise en suspension de deux tubes de poudre pour avoir un stock plus important pour les expériences reproductibles. Préparer 2 μL d’aliquotes et conserver à -80 °C.
- Resuspendre la profiline (recombinante humaine) (voir le tableau des matériaux) à une concentration 4 fois plus élevée que celle stipulée dans les instructions du fabricant (100 μg de protéines dans 25 μL de H 2 O froid), avec la séquence de centrifugation par impulsions, de mélange, etc. sur de la glace comme pour l’actine à l’étape2.1. Combinez les solutions protéiques de la remise en suspension de deux tubes de poudre avant de déterminer la concentration en protéines pour avoir un stock plus important pour les expériences reproductibles.
REMARQUE : Conserver sur la glace dans une chambre froide ou au réfrigérateur; Ne jamais geler ou laisser réchauffer. Lorsqu’elle est manipulée correctement, la profiline remise en suspension est bonne pendant au moins 6 mois à 1 an. - Remettre en suspension la protéine de recouvrement (α1β2, recombinant humain) (voir le tableau des matériaux) en suivant les instructions du fabricant (50 μg de protéines dans 50 μL de H 2 O froid), avec la séquence de centrifugation par impulsions, de mélange, etc. sur glace comme décrit pour l’actine à l’étape2.1. Refroidir 50 μL de glycérol sur de la glace et y ajouter les 50 μL de protéine de coiffage en resuspension; Mélangez doucement. Conserver à -20 °C.
REMARQUE: La solution ne gèle pas et l’activité est robuste, de sorte que la solution peut être conservée comme une seule aliquote pendant des mois, voire des années, si elle est manipulée avec soin. La protéine de coiffage recombinante de souris, la plus couramment utilisée dans le passé dans les expériences in vitro 13, sera bientôt disponible dans le commerce. - Resuspendre la gelsoline (recombinante humaine, marquée His) (voir le tableau des matières) en suivant les instructions du fabricant (20 μg de protéines dans 20 μL de H 2 O froid), avec la séquence de centrifugation par impulsions, de mélange, etc. sur de la glace comme décrit pour l’actine à l’étape2.1. Environ 2 μL de gelsoline sont utilisés par jour d’expériences; par conséquent, préparer de grosses aliquotes (5-10 μL) et conserver à -80 °C.
REMARQUE: Le protocole avec la gelsoline est fourni comme alternative. L’utilisation de protéines de coiffage à la place de la gelsoline est recommandée, achetée ou purifiée comme dans13. - Resuspendre le VCA (WASP-VCA humain, marqué TPS) (voir le tableau des matériaux) à une concentration 2x plus élevée que celle stipulée dans les instructions du fabricant (500 μg de protéines dans 250 μL deH2Ofroid), avec la séquence de centrifugation par impulsions, de mélange, etc. sur glace comme pour l’actine à l’étape 2.1. Préparer des aliquotes de 10 μL et conserver à -80 °C.
REMARQUE: Une fois que SpVCA (pVCA humain, streptavidine et His-tagged) est commercialisé ou si la purification des protéines14 est possible, l’utilisation de SpVCA au lieu de VCA est recommandée. VCA ne donne pas de comètes reproductibles dans les conditions décrites ici.
3. Mesure des concentrations en protéines
- Construire une courbe standard de Bradford constituée de deux dilutions sérielles de BSA qui se chevauchent.
REMARQUE: La courbe standard ne doit être construite que tous les deux mois (ou même moins fréquemment) tant que le spectrophotomètre ne change pas.- Dans la rangée 1 d’un rack à microtubes, placer les tubes pour la série de dilution BSA #1 : quatre tubes de 2 mL suivis de quatre tubes de 1,5 mL. Dans la rangée 3 du rack, placer les tubes pour la série de dilution BSA #2 comme pour la série #1. Dans la rangée 5 du rack, placer un tube de 2 mL pour chaque échantillon à mesurer avec deux tubes de 1,5 mL. Ajouter un seul tube de 1,5 mL à la rangée 5 pour l’ébauche.
- Mesurer le réactif de Bradford (voir le tableau des matériaux) dans les tubes de 1,5 mL.
- Remplissez un tube conique de 15 ml sur le dessus avec le réactif Bradford pour faciliter le pipetage (l’excédent sera retourné dans la bouteille de stock dans le réfrigérateur) sur de la glace. Prenez 200 μL de réactif Bradford et éjectez-le dans le tube conique pour mouiller l’embout de la pipette. Comme la solution est visqueuse, pipeter lentement pour permettre à la solution d’entrer et de sortir complètement de l’embout sans faire de bulles.
- Avec l’embout « pré-mouillé », pipeter lentement 200 μL de réactif Bradford dans chacun des tubes de 1,5 mL du rack (quatre pour chaque dilution BSA, un pour l’essai à blanc et deux pour chaque échantillon à mesurer). Faites-le d’abord pour permettre au réactif Bradford de bien chauffer à température ambiante avant de le mélanger avec des solutions protéiques. Remettre le reste du contenu du tube conique de 15 ml dans le flacon.
- Mesurer H 2 O dans les tubes de2mL. Dans la rangée 1 du rack, ajouter 1 990 μLH2Oau premier tube et 900 μL aux trois autres tubes. Pour la rangée 3, ajouter 1 992,5 μL dans le premier tube et 900 μL dans les trois autres tubes. Ajouter 2 000 μLH2Oà chacun des tubes à échantillon de la rangée 5.
REMARQUE : Pour tous les volumes supérieurs à 1 000 μL, utilisez une pipette de 1 000 μL, mais administrez la quantité complète en pipetant deux fois. Il est important de tout préparer avant de commencer les étapes suivantes, afin d’éviter de laisser des protéines fortement diluées dansH2Opendant de longues périodes. - Pour préparer la série de dilution de BSA #1, mélanger 10 μL de BSA étalonné à 2 mg/mL (voir le tableau des matières) dans le tube avec 1 990 μLH2O pour obtenir une solution de 10 μg/mL. À partir de là, faire trois dilutions en série (5 μg/mL, 2,5 μg/mL et 1,25 μg/mL de BSA) en transférant 900 μL de chaque solution dans le tube suivant (contenant 900 μLH2O).
- Pour préparer la série de dilution BSA #2, mélanger 7,5 μL de BSA étalonné 2 mg/mL dans le tube avec 1 992,5 μL H2O pour obtenir une solution de 7,5 μg/mL. À partir de là, effectuer trois dilutions en série (3,75 μg/mL, 1,875 μg/mL et 0,9375 μg/mL de BSA) en transférant 900 μL de chaque solution dans le tube suivant (contenant 900 μLH2O).
- Mélanger et lire l’absorbance pour générer la courbe standard. Ajouter 800 μL H2O dans le tube de réactif Bradford pour l’ébauche et démarrer la minuterie. Aussi efficacement que possible sans faire de bulles, mélanger 800 μL de chaque étalon BSA avec 200 μL de réactif Bradford dans les tubes préparés. Une fois que tous les étalons ont été mélangés avec le réactif Bradford (< 5 min), versez chaque étalon dans une cuvette jetable et lisez l’absorbance à 600 nm dans le spectrophotomètre après avoir occulté la machine.
NOTE: La même cuvette peut être utilisée pour lire toute la série si l’étalon le moins concentré est lu en premier et que la cuvette est bien vidée entre les lectures. Rétablissez la courbe standard jusqu’à ce que l’ajustement linéaire ait une valeur R d’au moins 0,99. Ce n’est qu’après le pipetage et le mélange doux que vous passez à la lecture des échantillons.
- Mesurer les concentrations d’actine et de protéines liant l’actine
- Dans les tubes de 2 mL contenant 2 000 μL de H2O (préparés à l’étape 3.1.3), mélanger délicatement les éléments suivants : 2 μL de complexeArp2/3 et de profiline, 4 μL de G-actine marquée, 5 μL de gelsoline et de VCA et 8 μL de protéine de coiffage (recombinant humain). Prélever immédiatement 800 μL de la solution et mélanger avec le réactif Bradford déjà préparé, puis répéter pour avoir deux lectures à 5% et 10% l’une de l’autre pour chaque échantillon. Une différence plus importante indique un problème de remise en suspension ou de manipulation. Lire quelques minutes après le mélange avec le réactif Bradford.
NOTA: Si vous utilisez une courbe standard d’un autre jour, seul le blanc de l’étape 3.1.6 doit être préparé, en plus des échantillons.
- Dans les tubes de 2 mL contenant 2 000 μL de H2O (préparés à l’étape 3.1.3), mélanger délicatement les éléments suivants : 2 μL de complexeArp2/3 et de profiline, 4 μL de G-actine marquée, 5 μL de gelsoline et de VCA et 8 μL de protéine de coiffage (recombinant humain). Prélever immédiatement 800 μL de la solution et mélanger avec le réactif Bradford déjà préparé, puis répéter pour avoir deux lectures à 5% et 10% l’une de l’autre pour chaque échantillon. Une différence plus importante indique un problème de remise en suspension ou de manipulation. Lire quelques minutes après le mélange avec le réactif Bradford.
- Calculer les concentrations d’actine et de protéines liant l’actine à l’aide de la courbe standard et du facteur de dilution. Refaites la mesure pour chaque nouvelle suspension. Les poids moléculaires pour convertir les lectures mg/mL obtenues par le test de Bradford en μM sont les suivants : actine 43 kD, complexe Arp2/3 224 kD, profiline 15 kD, gésoline 95 kD, protéine de coiffage 68 kD (recombinant humain) ou 63,5 kD (recombinant de souris), VCA 43 kD et SpVCA 54 kD (poids moléculaire monomère).
4. Revêtement des billes
- Prérefroidir la centrifugeuse à 4 °C et régler le bloc sec agitant (voir tableau des matières) à 18 °C.
- Laver les billes : pipeter 50 μL de tampon Xb dans un tube microcentrifuge de 1,5 mL, ajouter 9 μL de suspension de billes de 4,5 μm de diamètre ou 2 μL de suspension de billes de 1 μm de diamètre (suspension de 2,5 % p/v) (voir le tableau des matières). Bien mélanger et centrifuger les échantillons à 20 000 x g pendant 10 min à 4 °C.
NOTE: La surface totale du cordon des deux tailles de perles est de 3 cm2: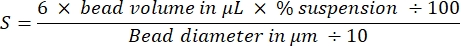
dérivée en calculant le nombre de billes puis leur surface totale à l’aide d’équations classiques pour le volume et la surface des sphères. D’autres tailles de billes peuvent être utilisées si les quantités sont ajustées pour maintenir la surface totale constante à 3 cm2. - Enduire les billes : retirer délicatement le surnageant sans déranger les billes et remettre en suspension la pastille de bille dans 40 μL de SpVCA 2 μM (ou 7 μM VCA) dans un tampon Xb par pipetage doux. Agiter à 18 °C, 1 000 tr/min pendant 20 min.
- Lavez les billes enduites : centrifuger le mélange (20 000 x g pendant 10 min à 4 °C) et retirer délicatement le surnageant. Resuspendre les billes dans 50 μL de Xb/1 % de BSA froid et centrifuger à 20 000 x g pendant 10 min à 4 °C. Retirez le surnageant et répétez l’étape de lavage 1x.
- Remettez en suspension la pastille de bille enduite de l’étape 4.4 dans 120 μL de Xb/BSA froid à 1 % pour les deux tailles de billes afin que la surface du billet/μL de solution de billes soit la même. Conserver sur de la glace dans un réfrigérateur ou une chambre froide. Les perles enduites continueront de fonctionner normalement pendant au moins plusieurs semaines.
5. Préparation du mélange de motilité et des lames pour l’observation
REMARQUE : Le volume total du mélange de motilité est de 8,4 μL pour permettre un dégagement d’environ 25 μm entre la lame et la lamelle de couverture de 18 mm x 18 mm afin que les billes de toutes tailles (jusqu’à 10 μm de diamètre) ne soient pas pressées. Le mélange de motilité de base est d’environ 5 μM de G-actine (actine fluorescente marquée à 10%) avec 5 μM de profiline, 50 nM de complexe Arp2/3 et 25 nM de protéine de coiffage (ou 240 nM de gelsoline).
- Préparer le mélange de réaction de motilité. Les quantités exactes d’actine (et donc de profiline) dépendent de la concentration calculée à l’étape 3.3, mais une réaction représentative est la suivante. Mélanger sur glace, dans cet ordre : 3,2 μL de MB13, 1,5 μL de profiline à 30 μM dilué dans MB13, 1 μL de protéine de coiffage à 0,21 μM dilué dans MB13 ou gelsoline diluée à 2 μM dans MB13, 1 μL de complexe Arp2/3 à 0,47 μM dilué dans MB13, 0,2 μL de suspension de billes (vortex juste avant utilisation), et 1,5 μL d’actine à 30 μM dans le tampon G. Mélangez bien mais rapidement et démarrez la minuterie.
- Repérez tout le mélange de réaction de motilité sur une lame. Couvrir avec un capot de 18 mm x 18 mm et sceller le bordereau avec du VALAP fondu à l’aide d’un petit pinceau. VALAP est un mélange de lanoline, de paraffine et de vaseline (voir le tableau des matériaux) 1:1:1 en poids, fondu et agité ensemble.
6. Observation microscopique
- Observez immédiatement les réactions de motilité à l’aide d’un objectif 100x sur un microscope droit ou inversé (voir le tableau des matériaux), équipé d’une microscopie à contraste de phase et/ou d’épifluorescence (cube GFP, voir Tableau des matériaux). Les observations sont effectuées à température ambiante (23-25 °C).
- Pour obtenir des vitesses de déplacement moyennes pour toute une population de perles, enregistrez le contraste de phase ou les images fixes fluorescentes au fil du temps en balayant la diapositive entière. Mesurez la longueur de la comète à la main et tracez en fonction du temps. La pente de l’ajustement linéaire est la vitesse de croissance moyenne.
- Pour évaluer la vitesse des billes individuelles, collectez des films time-lapse en microscopie à contraste de phase. Selon la vitesse du cordon et la résolution requise, prenez des images toutes les 1 à 10 s. Utilisez l’outil de suivi de n’importe quel programme de traitement d’image pour obtenir des vitesses et des trajectoires de perles.
Résultats
L’un des aspects clés de la création reproductible de comètes d’actine sur des billes est le pipetage doux et précis de délicates protéines liant l’actine. Générer une courbe standard de Bradford est un bon moyen d’évaluer les compétences de pipetage. La figure 1A,B montre les tubes pour la courbe étalon et un exemple de ce à quoi ressemblent les deux dilutions en série de BSA une fois mélangées avec du réactif de Bradford. Notez la teinte bleue graduée (une concentration plus élevée en protéines donne une solution plus bleue). Lorsqu’elles sont lues dans le spectrophotomètre et tracées, ces solutions donnent une courbe standard comme le montre la figure 1C. Pour pratiquer un pipetage soigneux, le test doit être répété jusqu’à ce que le facteur de corrélation linéaire soit de 0,999, comme indiqué.
Une fois que les concentrations de protéines commerciales en suspension ont été soigneusement évaluées par le test de Bradford, les billes enrobées et le mélange de motilité sont préparés et mélangés ensemble. La figure 2A montre des images représentatives des différents stades de formation des comètes : les nuages d’actine se forment quelques minutes après le mélange de billes recouvertes de SpVCA et du milieu de motilité ; La polarisation des nuages se produit à ~5 min et la production de comètes à 15-20 min. Les comètes d’actine, visibles à la fois avec l’épifluorescence et la microscopie à contraste de phase (Figure 2A), continuent à s’allonger pendant de nombreuses heures, mais une vitesse constante n’est pas maintenue, de sorte que la motilité des billes est normalement évaluée en 1 heure. D’autre part, il faut 30 minutes avec des billes recouvertes de VCA pour obtenir des nuages d’actine brillants (Figure 2B), et aucune comète ne se forme, bien que la symétrie commence à se rompre à 1-2 h (flèche sur la Figure 2B) et que les nuages montrent une polarisation après une incubation nocturne.
La figure 3 montre un exemple d’évaluation de la vitesse des billes en présence de protéine de coiffage. Étant donné que toutes les perles brisent la symétrie à peu près au même moment, des enregistrements « pseudo-time-lapse » sont effectués où la lame est balayée et des images de l’ensemble de la population de comètes sont prises au fil du temps (Figure 3A). Les comètes ne se dépolymérisent pas; par conséquent, l’augmentation de la longueur des comètes mesurée au fil du temps peut être utilisée pour calculer la vitesse de déplacement (Figure 3B). La gelsoline peut être utilisée à la place de la protéine de coiffage pour la formation de comètes si 10 fois plus de gelsoline est ajoutée pour compenser son activité de coiffage réduite. Les comètes formées en présence de gelsoline sont qualitativement les mêmes et se déplacent à peu près à la même vitesse que les billes avec la protéine de coiffage (Figure 3C). L’activité de coiffage est essentielle pour concentrer la polymérisation à la surface de la bille, et lorsque ni la protéine de coiffage ni la gelsoline ne sont incluses dans le mélange de motilité, les nuages d’actine ne se polarisent jamais pour former des comètes, bien que des nuages d’actine brillants se forment autour des billes (Figure 3D). Les comètes sur billes peuvent être utilisées pour mesurer la production de force à base d’actine dans différents contextes biochimiques en modifiant le mélange de motilité et en observant le résultat sur la motilité en utilisant différentes techniques de micromanipulation, par exemple15.
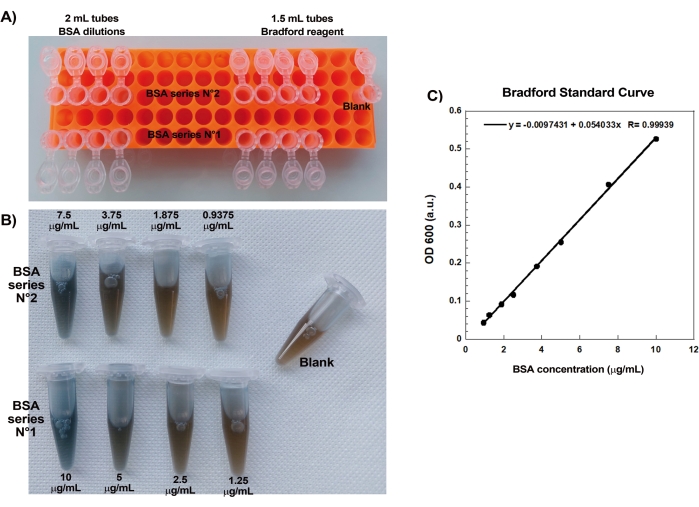
Figure 1 : Courbe standard de Bradford. (A) Image de la façon de mettre en place les tubes pour faire la courbe standard de Bradford. Les tubes d’échantillon ne sont pas indiqués. (B) Image des deux dilutions en série BSA qui se chevauchent une fois mélangées avec le réactif Bradford. (C) Les absorbances à 600 nm des solutions indiquées en (B) sont mesurées dans le spectrophotomètre et sont tracées en fonction des concentrations protéiques des solutions de BSA. L’ajustement linéaire est utilisé pour calculer la concentration de l’échantillon. Le facteur de corrélation, R, de l’ajustement linéaire est de 0,999. Veuillez cliquer ici pour voir une version agrandie de cette figure.
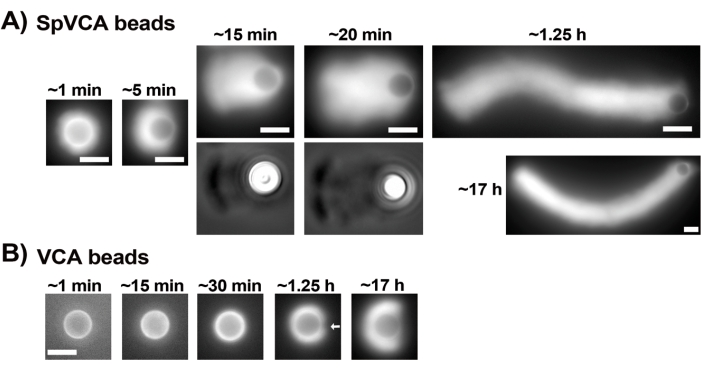
Figure 2 : Formation de comètes sur des billes enduites de SpVCA par opposition aux billes enduites de VCA. (A) Perles représentatives enduites de SpVCA (perles différentes dans chaque image) montrées au fil du temps. Le temps à partir du moment du mélange est indiqué. Les nuages d’actine se forment immédiatement et la polarisation des nuages donne des comètes qui continuent à s’allonger pendant des heures. (B) Perles recouvertes de VCA représentatives (perles différentes dans chaque image) montrées au fil du temps. Plus de 1 h est nécessaire pour voir les débuts de la polarisation des nuages d’actine (flèche) et même de longues incubations ne produisent pas de comètes. Toutes les images sont des billes de 4,5 μm de diamètre, imagerie par épifluorescence de l’actine fluorescente associée à une visualisation de contraste de phase pour les points de temps de 15 et 20 minutes en (A), barres d’échelle = 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
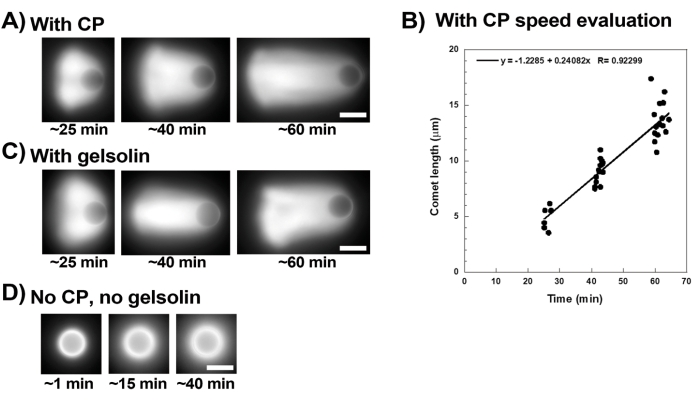
Figure 3 : Analyse de la vitesse des comètes et des billes. (A) et (C) En présence de protéine de coiffage (CP) ou de gelsoline, les nuages d’actine se polarisent pour former des comètes dans les 20 premières minutes de réaction, et les comètes s’allongent avec le temps. Temps de mixage indiqué pour chaque image; Chaque image est une perle différente. Il existe une certaine variabilité entre les billes et la préparation, mais en moyenne, les billes se déplacent à des vitesses micron/submicrons par minute (0,2-1 μm/min) dans les conditions standard décrites ici. (B) Graphique représentatif montrant l’évaluation de la longueur des comètes (population entière de billes) au fil du temps. La pente de la corrélation linéaire correspond à la vitesse moyenne de déplacement, dans ce cas 0,24 μm/min. (D) En l’absence d’activité de coiffage (pas de protéine de coiffage ni de gelsoline), des nuages d’actine se forment autour des billes, mais les comètes ne se forment pas. Toutes les images sont des billes de 4,5 μm de diamètre, imagerie par épifluorescence de l’actine fluorescente, barres d’échelle = 5 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le protocole détaillé ici décrit comment obtenir la croissance du réseau d’actine sur les surfaces des billes, la formation de comètes et la motilité des billes en utilisant des protéines disponibles dans le commerce. Cependant, il arrive parfois que les comètes ne soient pas observées de manière reproductible ou ne soient pas homogènes entre la glissière et la lamelle de couverture. La discussion qui suit met l’accent sur certains points clés du protocole et suggère certains paramètres qui peuvent être ajustés. Un facteur à garder à l’esprit est que la formation des comètes et la vitesse des billes sont affectées par la température, avec des températures bien supérieures à 25 ° C ou bien inférieures à 23 ° C ayant un impact négatif sur la formation des comètes et donnant des données non reproductibles. L’utilisation d’un microscope à température contrôlée ou d’un microscope dans une pièce climatisée est fortement recommandée. Bien que l’actine marquée par fluorescence soit souvent incluse dans le mélange de motilité pour observer les comètes par microscopie à fluorescence, une fois que les comètes ont plus d’un diamètre de bille, elles sont également visibles par microscopie à contraste de phase comme un frottis sombre à côté de la perle. La visualisation du contraste de phase est plus appropriée pour l’imagerie accélérée car une certaine phototoxicité est associée à l’imagerie par fluorescence, même via un disque rotatif. Parce que les perles se déposent avec le temps, un microscope inversé produit moins de dérive horizontale de perles qu’un microscope vertical et est plus approprié pour les films. L’utilisation de VALAP fondu pour sceller les lames est importante car des substances telles que le vernis à ongles interfèrent avec la formation des comètes. De grandes quantités de VALAP peuvent être fabriquées dans un bécher, puis extraites pour remplir des béchers plus petits plus susceptibles d’une fonte rapide. VALAP est bon pendant des années à température ambiante.
Un autre aspect technique clé est la préparation méticuleuse du tampon et du mélange de motilité. Des précautions doivent être prises lors de la préparation du MB13, en particulier à l’étape d’ajustement du pH. Le pH de MB13 doit être ajusté rapidement à neutre avec NaOH pour éviter l’hydrolyse de l’ATP, mais pas trop rapidement car l’EGTA se solubilise lorsque le pH se rapproche de la neutralité. L’EGTA est un ingrédient clé car il complexifie le calcium lié à l’actine, donnant dans le mélange de motilité la forme de magnésium plus active16. MB13 préparé trop rapidement ou trop lentement donne une formation de comètes sous-optimale ou même pas du tout. Un autre point clé est de garder une trace attentive de la concentration de KCl dans le mélange de motilité lorsque vous jouez avec des conditions. Par exemple, lors de l’utilisation de 1x MB13 dans le mélange réactionnel et de la dilution de la profiline, de la protéine de coiffage et du complexe Arp2/3 dans MB13, la concentration finale de KCl dans la réaction de motilité est d’environ 40-50 mM en raison de la dilution par le tampon G. Cette concentration donne les meilleurs résultats dans le test de la comète, et plus de 60 mM KCl diminue l’activité de nucléation du complexe Arp2/3.
Du côté des protéines, un aspect technique essentiel de l’obtention de comètes d’actine est la manipulation appropriée des protéines commerciales liant l’actine, en particulier le pipetage précis de quantités de microlitres. La linéarité de la courbe standard de Bradford est un bon test de pipetage et la courbe peut ensuite être utilisée pour des mesures de routine des concentrations de protéines. En effet, lors de l’utilisation de protéines commerciales en suspension pour la procédure comète, il est important de toujours vérifier les concentrations de protéines, car la variabilité des lots et l’erreur de l’utilisateur lors de la remise en suspension peuvent entraîner des différences entre les concentrations réelles et attendues. Parfois, de petites différences dans les concentrations de protéines peuvent conduire à l’absence complète de comètes.
Un autre aspect important de la méthode présentée ici est l’utilisation de la G-actine complexée par la profiline comme carburant pour la polymérisation. Historiquement, les systèmes in vitro utilisaient l’actine filamenteuse pré-polymérisée (F-actine) comme source d’actine : dépolymérisation dans la polymérisation en vrac en surface10,17. Cela avait l’avantage de contrôler les niveaux de G-actine, mais ajoutait une couche de complexité nécessitant des composants supplémentaires pour catalyser la dépolymérisation. Étant donné que le renouvellement du réseau d’actine n’est pas nécessaire pour la production de force et la motilité, qui sont alimentées par nucléation et polymérisation à la surface de la bille, alors que les facteurs de dépolymérisation de l’actine tels que l’ADF/cofiline agissent sur les réseaux vieillis loin de la surface18, la plupart des reconstitutions in vitro de la motilité à base d’actine se font maintenant sans renouvellement pour plus de simplicité. Cependant, il y a quelques inconvénients à utiliser la G-actine. Tout d’abord, lors de l’utilisation d’actine commerciale, qui a été lyophilisée, des oligomères sont présents. Les étapes de dépolymérisation décrites ici sont très importantes pour obtenir des résultats reproductibles. En particulier, bien que le tampon G soit traditionnellement ajusté à pH 8, un pH plus bas (pH 7, par exemple) semble mieux fonctionner dans les tests décrits dans cet article, peut-être parce qu’un pH bas améliore la dépolymérisation19. Un autre inconvénient de l’utilisation de la G-actine est qu’une fois placée dans des conditions salines propices à la polymérisation, une nucléation spontanée se produit et la F-actine se forme dans la masse ainsi que sur la surface du cordon. La complexation de la G-actine avec de la profiline supprime la nucléation spontanée dans la polymérisation en vrac et à extrémité pointue, concentrant ainsi à la fois la nucléation et la polymérisation de l’extrémité barbelée à la surface20. La profiline-G-actine est physiologiquement pertinente, car une grande partie de l’actine dans la cellule est présente sous cette forme21. Ici, un rapport de 1:1 de profiline:actine est utilisé; cependant, des rapports plus élevés (par exemple 3:1) inhibent plus complètement la polymérisation dans la masse, bien que des rapports plus élevés inhibent également le complexe Arp2/3 et l’allongement de l’extrémité barbelée dans une certaine mesure22,23.
L’activité de coiffage est également essentielle pour la formation des comètes puisqu’elle assure l’insertion d’une nouvelle actine à la surface via des cycles de nucléation par le complexe Arp2/3 activé en surface24,25. Sans capsulage, les nuages d’actine ne brisent pas la symétrie pour former des comètes car la polymérisation à la surface n’accumule pas suffisamment de tension pour ouvrir le nuage26. Dans le passé, nous avons utilisé la protéine de coiffage de souris recombinante purifiée à la maison 13, mais les tests effectués pour cet article indiquent que la protéine de coiffage humain recombinante disponible dans le commerce est tout aussi efficace, tout comme la gelsoline disponible dans le commerce, bien que10 fois plus de gelsoline doive être utilisée, et pour certaines applications, elle peut ne pas être appropriée car elle a une activité de séparation de l’actine ainsi que le bouchage27.
Enfin, la robustesse de cette méthode réside dans l’utilisation d’un activateur du complexe Arp2/3 très actif, la streptavidine-pVCA (SpVCA)28. SpVCA inclut le domaine de liaison profiline-G-actine de WASP (le domaine p) en plus du domaine de liaison complexe Arp2/3 car il s’avère être le plus efficace dans les conditions de profiline-G-actine29. Plus important encore, l’utilisation de l’étiquette de streptavidine, introduite à l’origine pour permettre la fonctionnalisation de surface via la liaison biotine-streptavidine, a pour effet supplémentaire d’augmenter l’activation du complexe Arp2/3, probablement en raison du fait que la streptavidine est un tétramère et regroupe donc l’activateur, connu pour augmenter l’activité du complexe Arp2/330 . SpVCA produit commercialement est actuellement en développement et sera bientôt disponible à l’achat. Il convient également de noter que, bien que 40 μL de SpVCA 2 μM soient couramment utilisés pour recouvrir 3 cm2 de surface de billes, d’autres concentrations de revêtement (plus élevées et plus faibles) fonctionnent également, et jouer avec ces conditions donne des vitesses de croissance et des morphologies différentes des comètes. En effet, lorsque les comètes ne se forment pas ou que la taille des comètes n’est pas homogène sur la lame, différentes conditions de revêtement doivent être testées, ainsi que différentes concentrations de KCl et de profiline dans le mélange de motilité. Les concentrations d’actine, du complexe Arp2/3 et de la protéine de coiffage dans le mélange de motilité peuvent également être modifiées pour optimiser la formation des comètes, mais entre nos mains, changer ces proportions donne souvent des résultats confus.
Pour conclure, les méthodes décrites ici produisent un assemblage d’actine sur les surfaces et la motilité des billes, mais toute surface pouvant être fonctionnalisée avec SpVCA peut être utilisée. Dans les cas où l’adsorption telle que décrite ici ne fonctionne pas, la fraction streptavidine peut être utilisée pour attacher SpVCA à la surface d’intérêt après biotinylation. Les structures d’actine ainsi formées, comètes ou non, peuvent être utilisées pour tester différents aspects biochimiques et biophysiques des réseaux d’actine, et sont particulièrement appropriées pour les manipulations physiques avec des micropipettes, des pinces optiques et des ablations au laser 15,26,31,32. En plus de ses utilisations pour le milieu de la recherche, l’approche décrite ici est appropriée comme outil d’enseignement pour les étudiants de premier cycle en biophysique afin d’étudier des concepts de matière active tels que la brisure de symétrie et l’auto-organisation.
Déclarations de divulgation
Les auteurs déclarent n’avoir aucun conflit d’intérêts avec le contenu de cet article.
Remerciements
Nous remercions sincèrement les membres de notre nouvelle maison au LPENS pour leur accueil chaleureux, et en particulier, l’équipe ABCDJ pour toute leur aide et leur soutien. J.P. reconnaît le soutien financier de la Fondation ARC (Grant PJA 20191209604), et C.S. reconnaît le soutien financier de l’Organisation du programme scientifique Human Frontiers (subvention RGP0026/2020).
matériels
| Name | Company | Catalog Number | Comments |
| Actin, rabbit muscle, Alexa Fluor 488 conjugate | Invitrogen (ThermoFisher Scientific) | A12373 (recently discontinued) | This product can be replaced with ATTO-488 actin from Hypermol. |
| Actin, rabbit muscle, ATTO-488 | Hypermol | 8153 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Arp2/3 complex | Cytoskeleton | RP01P | |
| ATP | Sigma | A7699 | |
| BioSpectrometer, basic | Eppendorf | 035739 | |
| Bradford Reagent | Bio-Rad | 500-0006 | |
| BSA, high quality | Sigma | A3059 | |
| BSA standard 2 mg/mL (Pierce) | Thermo Scientific | 23209 | |
| Capping protein (a1b2, mouse recombinant) | Home-purified (Reference 13) | This product will soon be commercially available from Cytoskeleton. | |
| Capping protein (a1b2, human recombinant) | Hypermol | 8322 | |
| Cube, GFP: U-MNIBA3 or U-MWB2 | Olympus | discontinued | Any GFP cube, adapted to the microscope being used, can be used. |
| Dry block, agitating: ThermoMixer C (refrigerated) | Eppendorf | 035963 | |
| ** with SmartBlock, 24 microtubes 2 mL | Eppendorf | 035969 | |
| Gelsolin (human recombinant, His-tagged) | Cytoskeleton | HPG6 | |
| Lanolin | Sigma | 49909 | |
| Microcentrifuge 5427R + rotor | Eppendorf | 934126 | |
| Microscope, upright: BX51 | Olympus | discontinued | Any epifluorescence upright microscope equipped with phase contrast optics can be used. |
| Microscope, inverted: IX70 | Olympus | discontinued | Any epifluorescence inverted microscope equipped with phase contrast optics can be used. |
| Paraffin | Sigma | 76244 | |
| Petroleum jelly: Vaseline | Sigma | 16415 | |
| Pipettes Research Plus | Eppendorf | Gilson pipettes don't work as well for delivery of very small volumes (0.5 µL for example). | |
| **10 µL | 933954 | ||
| **2.5 µL | 933953 | These two sizes are essential, but the use of high-quality pipettes (a full Research Plus set for example) is recommended. | |
| Polystyrene carboxylate beads | Polysciences | ||
| **approx. 1 µm diameter | 08226 | ||
| **approx. 4.5 µm diameter | 17140-5 | ||
| Profilin 1 (human recombinant, untagged) | Cytoskeleton | PR02 | |
| SpVCA (human WASP pVCA domain, N-ter His-tag, C-ter Streptavidin tag) | Home-purified (Reference 14) | This product will soon be commercially available from Cytoskeleton. | |
| VCA (human WASP VCA domain, GST-tagged) | Cytoskeleton | VCG03 |
Références
- Campellone, K. G., Welch, M. D. A nucleator arms race: cellular control of actin assembly. Nature Reviews Molecular Cell Biology. 11 (4), 237-251 (2010).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. Journal of Cell Biology. 103, 2747-2754 (1986).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Tilney, L. G., Tilney, M. S. The wily ways of a parasite: induction of actin assembly by Listeria. Trends in Microbiology. 1 (1), 25-31 (1993).
- Moore, A. S., et al. Actin cables and comet tails organize mitochondrial networks in mitosis. Nature. 591 (7851), 659-664 (2021).
- Taunton, J., et al. Actin-dependent propulsion of endosomes and lysosomes by recruitment of N-WASP. Journal of Cell Biology. 148 (3), 519-530 (2000).
- Velarde, N., Gunsalus, K. C., Piano, F. Diverse roles of actin in C. elegans early embryogenesis. BMC Developmental Biology. 7, 142(2007).
- Merrifield, C. J., et al. Endocytic vesicles move at the tips of actin tails in cultured mast cells. Nature Cell Biology. 1 (1), 72-74 (1999).
- Samarin, S., et al. How VASP enhances actin-based motility. Journal of Cell Biology. 163 (1), 131-142 (2003).
- Bernheim-Groswasser, A., Wiesner, S., Golsteyn, R. M., Carlier, M. -F., Sykes, C. The dynamics of actin-based motility depend on surface parameters. Nature. 417 (6886), 308-311 (2002).
- Boujemaa-Paterski, R., et al. Network heterogeneity regulates steering in actin-based motility. Nature Communications. 8 (1), 655(2017).
- Akin, O., Mullins, R. D. Capping protein increases the rate of actin-based motility by promoting filament nucleation by the Arp2/3 complex. Cell. 133 (5), 841-851 (2008).
- Palmgren, S., Ojala, P. J., Wear, M. A., Cooper, J. A., Lappalainen, P. Interactions with PIP2, ADP-actin monomers, and capping protein regulate the activity and localization of yeast twinfilin. Journal of Cell Biology. 155 (2), 251-260 (2001).
- Carvalho, K., et al. Actin polymerization or myosin contraction: two ways to build up cortical tension for symmetry breaking. Philosophical Transactions of the Royal Society B. 368 (1629), 20130005(2013).
- Marcy, Y., Prost, J., Carlier, M. -F., Sykes, C. Forces generated during actin-based propulsion: a direct measurement by micromanipulation. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 5992-5997 (2004).
- Carlier, M. -F. Actin: protein structure and filament dynamics. Journal of Biological Chemistry. 266 (1), 1-4 (1991).
- Loisel, T. P., Boujemaa, R., Pantaloni, D., Carlier, M. F. Reconstitution of actin-based motility of Listeria and Shigella using pure proteins. Nature. 401 (6753), 613-616 (1999).
- Reymann, A. -C., et al. Turnover of branched actin filament networks by stochastic fragmentation with ADF/cofilin. Molecular Biology of the Cell. 22 (14), 2541-2550 (2011).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Quantitative variations with pH of Actin Depolymerizing Factor/Cofilin's multiple actions on actin filaments. Biochemistry. 58 (1), 40-47 (2019).
- Plastino, J., Blanchoin, L. Dynamic stability of the actin ecosystem. Journal of Cell Science. 132 (4), 219832(2019).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Suarez, C., et al. Profilin regulates F-actin network homeostasis by favoring formin over Arp2/3 complex. Developmental Cell. 32 (1), 43-53 (2015).
- Courtemanche, N., Pollard, T. D. Interaction of profilin with the barbed end of actin filaments. Biochemistry. 52 (37), 6456-6466 (2013).
- Achard, V., et al. A "primer"-based mechanism underlies branched actin filament network formation and motility. Current Biology. 20 (5), 423-428 (2010).
- Sykes, C., Plastino, J. Actin filaments up against a wall. Nature. 464 (7287), 365-366 (2010).
- vander Gucht, J., Paluch, E., Plastino, J., Sykes, C. Stress release drives symmetry breaking for actin-based movement. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7847-7852 (2005).
- McGough, A. M., Staiger, C. J., Min, J. -K., Simonetti, K. D. The gelsolin family of actin regulatory proteins: modular structures, versatile functions. FEBS Letters. 552 (2-3), 75-81 (2003).
- Abou-Ghali, M., et al. Capping protein is not necessary for polarized actin network growth and actin based motility. Journal of Biological Chemistry. 295, 15366-15375 (2020).
- Yarar, D., D'Alessio, J. A., Jeng, R. L., Welch, M. D. Motility determinants in WASP family proteins. Molecular Biology of the Cell. 13 (11), 4045-4059 (2002).
- Padrick, S. B., et al. Hierarchical regulation of WASP/WAVE proteins. Molecular Cell. 32 (3), 426-438 (2008).
- Bussonier, M., et al. Mechanical detection of a long-range actin network emanating from a biomimetic cortex. Biophysical Journal. 107 (4), 854-862 (2014).
- Paluch, E., vander Gucht, J., Joanny, J. -F., Sykes, C. Deformations in actin comets from rocketing beads. Biophysical Journal. 91 (8), 3113-3122 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon