Method Article
Aktin bazlı hareketliliğin ticari olarak temin edilebilen proteinlerle yeniden yapılandırılması
Bu Makalede
Özet
Bu protokol, ticari olarak temin edilebilen protein bileşenlerini kullanarak boncukların yüzeylerinde aktin kuyruklu yıldızlarının nasıl üretileceğini açıklamaktadır. Bu tür sistemler, hücrelerde bulunan çıkıntılı yapıları taklit eder ve kuvvet üretiminin fizyolojik mekanizmalarını basitleştirilmiş bir şekilde incelemek için kullanılabilir.
Özet
Birçok hücre hareketi ve şekil değişikliği ve belirli hücre içi bakteri ve organel hareketliliği türleri, hücrenin, organelin veya bakterinin yüzeyinde dinamik bir ağ oluşturan biyopolimer aktin tarafından yönlendirilir. Bu işlem sırasında kuvvet üretiminin biyokimyasal ve mekanik temeli, aktin bazlı hareketin, kontrollü bir bileşen seti ile işlevselleştirilmiş ve inkübe edilmiş boncuklar gibi inert yüzeylerde asellüler bir şekilde çoğaltılmasıyla incelenebilir. Uygun koşullar altında, elastik bir aktin ağı boncuk yüzeyinde toplanır ve ağ büyümesinin yarattığı stres nedeniyle açılır ve boncuğu ileriye doğru iten bir "aktin kuyruklu yıldızı" oluşturur. Bununla birlikte, bu tür deneyler, bir dizi farklı aktin bağlayıcı proteinin saflaştırılmasını gerektirir ve bu da onları uzman olmayanların erişemeyeceği bir yere koyar. Bu makalede, ticari olarak temin edilebilen reaktifler kullanılarak aktin kuyruklu yıldızları ve boncukların hareketliliğinin yeniden üretilebilir bir şekilde elde edilmesi için bir protokol detaylandırılmaktadır. Boncuk kaplama, boncuk boyutu ve hareketlilik karışımı, boncuk hızı, yörüngeleri ve diğer parametreler üzerindeki etkisini gözlemlemek için değiştirilebilir. Bu test, farklı aktin bağlayıcı proteinlerin biyokimyasal aktivitelerini test etmek ve aktin ağlarının aktif madde özelliklerine ışık tutan nicel fiziksel ölçümler yapmak için kullanılabilir. Bu, toplum için yararlı bir araç olacak ve aktin bağlayıcı protein saflaştırmasında uzman bilgisi olmadan in vitro aktin bazlı hareketliliğin incelenmesini sağlayacaktır.
Giriş
Hücrelerde aktin polimerizasyonu, hücre sinyalizasyonunun aşağı yönündeki aktin filament nükleasyonunun sıkı bir şekilde düzenlenmesiyle mekansal ve geçici olarak kontrol edilir1. Çekirdeklenme bir aktin trimerinin oluşumu yoluyla gerçekleşir ve daha sonra ortaya çıkan filamentin her iki ucu kendiliğinden polimerize olur, ancak bir ucu diğerinden (sivri uç) daha dinamiktir (dikenli uç)2. Çekirdeklenme ve dikenli uç polimerizasyonu bir yüzeye doğru yönlendirildiğinde, hücre zarını hareket için dışarı itmek ve enerji kaynağı olarak ATP hidrolizi ile hücre içindeki mikron boyutlu nesneleri hareket ettirmek için yeterli kuvvet (pico-nano Newton aralığında) üretirler3. Bazı örnekler arasında hücreden hücreye yayılmak için aktin kuyruklu yıldızları kullanan Listeria monocytogenes bakterileri ve aktin kuyruklu yıldız bazlı hareketin mitoz 4,5 sırasında randomize kalıtım için önemli olduğu mitokondri sayılabilir. Endozomlar ve diğer hücre içi veziküller üzerindeki aktin kuyruklu yıldızları, donör membranlardan ayrılmada rol oynar 6,7,8.
Burada sunulan yöntemle, hücresel aktin polimerizasyonunun sinyal yönleri atlanır ve aktin polimerizasyonu, mikrometrik polistiren boncuklar üzerinde, dallanmış aktin nükleasyonunun aktivatörleriyle, özellikle de insan WASP proteininin aktif alanıyla, VCA (WA veya WCA olarak da adlandırılır)1 ile kaplanarak üretilir. Kaplanmış boncuklar daha sonra, hücrelerdeki ana aktin polimerizasyon nükleatörü, VCA tarafından boncuk yüzeyinde aktive edilen Arp2/3 kompleksi de dahil olmak üzere, aktin polimerizasyonu için gerekli bileşenleri içeren bir karışımdainkübe edilir. Aktin başlangıçta boncuk etrafında düzgün bir şekilde polimerize olur, ancak daha sonra boncuğu ileriye doğru iten bir aktin kuyruklu yıldızı oluşturmak için kendiliğinden simetriyi kırar, böylece hücre benzeri çıkıntılı ağları ve kuyruklu yıldızları kontrollü bir şekilde yeniden oluşturur. Boncuklar ve diğer kaplamalı yüzeylerle benzer yaklaşımlar geçmişte biz ve diğerleri tarafından aktinpolimerizasyonunun biyokimyasını ve biyofiziğini incelemek için 9,10,11,12 kullanılmıştır, ancak bu deneyler için aktin bağlayıcı proteinlerde kapsamlı uzmanlık gerekiyordu. Burada sunulan protokol, aktin kuyruklu yıldızlarının ve hareketliliğin tamamen ticari olarak temin edilebilen (veya yakında kullanıma sunulacak) reaktiflerle nasıl sağlam bir şekilde oluşturulacağını açıklamakta ve bu yaklaşımı biyofiziksel kavramları öğretmek için bir eğitim ortamı da dahil olmak üzere herkes için erişilebilir kılmaktadır. Temel özellikler arasında nazik ve güvenilir pipetlemenin önemi, aktin kaynağı olarak profilin kompleksli monomerin kullanılması ve boncuk kaplama reaktifi olarak oldukça aktif bir Apr2/3 kompleks aktivatörü kullanmanın gerekliliği yer almaktadır.
Protokol
1. Tamponların hazırlanması
NOT: Tüm tamponlar için ultra saf H2O kullanın. Steril olması gerekmez. 1.1-1.4 adımlarında açıklanan tüm çözeltileri 0,2 μm şırınga filtresi, kullanıma bağlı olarak tüp başına 500 μL-2 mL'lik kısımlarda aliquot ile filtreleyin ve -20 °C'de saklayın.
- 50 mL'lik konik bir tüpe 2 g BSA tartarak ve 20 mL işaretineH2O ile doldurarak% 10 BSA hazırlayın BSA çözülene kadar karıştırın (yaklaşık 30 dakika) ve ardından hacmi 20 mL'ye kadar yapın.
NOT: Yüksek kaliteli BSA kullanın (bkz. %10 BSA çözeltisi hem boncuk hazırlamada hem de hareketlilik karışımında kullanılır. - Boncuk hazırlama için, Xb tamponunu (10 mM HEPES, 0.1 M KCl, 1 mM MgCl 2 ve 0.1 mM CaCl 2, pH 7.5) 10x çözelti olarak hazırlayın ve kullanmadan önce seyreltin (100 μL 10x Xb stok çözeltisi + 900 μL H2 O). 100 μL 10x Xb stok çözeltisi + 100 μL %10 BSA + 800 μL H2O karıştırarak Xb/%1 BSA hazırlayın.
- Monomerik aktinin (G-aktin) seyreltilmesinde kullanılan tampon olan G-tamponunu (2 mM Tris, 0,2 mM CaCl 2, 0,2 mM DTT,2 mM ATP) hazırlayın. Geleneksel olarak kullanıldığı gibi pH 8'e değil, pH 7'ye ayarlayın (tartışmaya bakınız).
- Hareketlilik tamponu MB13'ü hazırlayın (10 mM HEPES, 1,5 mM ATP, 3 mM DTT, 1,5 mM MgCl2, 1 mM EGTA, 50 mM KCl,% 1 BSA, pH 7,5). Bazı uygulamalar için 10x MB13 kullanışlıdır. Bununla birlikte, pH ayarı sırasında sorunlara yol açtığından, BSA olmadan 10x MB13 hazırlayın. 10x MB13'ü 10x MB13'ten yeniden yapılandırırken %10 stok çözeltisinden (adım 1.1'de hazırlanan) BSA'yı ekleyin.
2. Protein çözeltilerinin hazırlanması
NOT: Tüm süspansiyonlar için ultra saf H2O kullanın. Steril olması gerekmez. Buz ve aliquot üzerindeki tüm proteinleri önceden soğutulmuş tüplere yerleştirin. Kabarcıklar üretmemek için nazikçe manipüle edin ve asla vorteks protein çözeltileri kullanmayın. Stokların -80°C'de depolanması için sıvı azotta flaş dondurma gerekli değildir. Yaklaşık beşten fazla donma-çözülme döngüsünden kaçınmak için aliquot boyutunu uyarlayın, çünkü bu, proteinlerin hiçbirinin aktivitesini etkilemiyor. Çalışma alikotları birkaç hafta boyunca -20 ° C'de saklanabilir.
- Aşağıda açıklandığı gibi G-aktin (tavşan iskelet kası) çözeltisi hazırlayın.
- Tüpün altındaki katıyı toplamak için 4 ° C'de darbeli santrifüj aktin tozu (Malzeme Tablosuna bakınız).
- Üreticilerin talimatlarına göre H2 O ekleyin (etiketsiz aktin için 100 μL soğuk H2 O'da 1 mg protein, ATTO etiketli aktin için 100 μL soğukH2O'da 100 μgprotein).
- En az 15 dakika buz üzerinde bekletin. Yukarı ve aşağı pipetleyerek, en az 15 dakika daha buz üzerinde bekleterek yavaşça karıştırın ve tekrar karıştırın. Tüpün altındaki çözeltiyi toplamak için 4 ° C'de darbe santrifüjü ve remiks.
- Kullanıma bağlı olarak 10-50 μL etiketsiz aktin alikotu ve ATTO etiketli aktinin 20 μL alikotu hazırlayın. Alikotları -80 °C'de saklayın.
- Liyofilizasyon ve donma sırasında oluşan aktin oligomerlerini depolimerize etmek için, ek ATP ve DTT ile çivilenmiş G tamponunda ~8 kat yeniden askıya alınmış aktin ~8 kat aliquot seyreltin (örneğin, adım 2.1.4'ten 20μL resuspended aktin çözeltisine, 134 μL G-tamponu, 0.32 μL 0.2 mM ATP ve 0.16 μL 1 M DTT ekleyin). Floresan etiketleme için, yaklaşık% 10 etiketli aktin ekleyin; örneğin, 40 μL seyreltilmiş etiketsiz aktin'e 5 μL ATTO etiketli aktin ekleyin. Adım 3'te açıklandığı gibi Bradford testi ile protein konsantrasyonunu ölçmeden önce en az birkaç gün ila bir hafta arasında ara sıra karıştırma (pipetleme) ile buz üzerinde depolimerize olmasına izin verin.
NOT: Seyreltilmiş etiketsiz ve floresan aktinini soğuk bir odada veya buzdolabında buz üzerinde saklayın; asla donmayın veya ısınmaya izin vermeyin. Preparat zamanla depolimerize olmaya devam edecek ve uygun şekilde kullanıldığında en az 6 ay boyunca kullanılabilir.
- Arp2/3 kompleksini (domuz beyni) (bkz. Malzeme Tablosu) üreticinin talimatlarını (20 μL soğuk H 2 O'da 20 μg protein) izleyerek, adım 2.1'deaktin için açıklandığı gibi buz üzerinde nabız santrifüjleme, karıştırma vb. dizilimiyle yeniden askıya alın. Tekrarlanabilir deneyler için daha büyük bir stoğa sahip olmak için iki tüp tozun yeniden sulandırılmasından protein çözeltilerini birleştirin. 2 μL alikot hazırlayın ve -80 ° C'de saklayın.
- Profilini (insan rekombinantı) (bakınız Malzeme Tablosu) üreticinin talimatlarında öngörülenden 4 kat daha yüksek bir konsantrasyonda (25 μL soğuk H 2 O'da 100 μg protein), adım 2.1'deki aktin için olduğu gibi buz üzerinde darbe santrifüjleme, karıştırma vb. dizilimiyle yeniden askıya alın. Tekrarlanabilir deneyler için daha büyük bir stoğa sahip olmak için protein konsantrasyonunu belirlemeden önce protein çözeltilerini iki tüp tozun yeniden canlandırılmasından birleştirin.
NOT: Soğuk bir odada veya buzdolabında buz üzerinde tutun; asla donmayın veya ısınmaya izin vermeyin. Doğru kullanıldığında, askıya alınmış profilin en az 6 ay ila 1 yıl boyunca iyidir. - Üreticinin talimatlarını (50 μL soğuk H 2 O'da 50 μg protein) takiben, adım 2.1'de aktin için açıklandığı gibi buz üzerinde darbe santrifüjleme, karıştırma vb. sekansı ile kapaklama proteinini (α1β2, insan rekombinant) (Malzeme Tablosuna bakınız) yeniden askıya alın. Buz üzerinde 50 μL gliserol soğutun ve 50 μL resuspended capping proteinini ekleyin; yavaşça karıştırın. -20 °C'de saklayın.
NOT: Çözelti donmaz ve aktivite sağlamdır, bu nedenle çözelti dikkatli bir şekilde ele alındığında aylarca, hatta yıllarca tek bir aliquot olarak tutulabilir. Geçmişte in vitro deneylerde en yaygın olarak kullanılan fare rekombinant kapak proteini13, yakında ticari olarak satışa sunulacak. - Üreticinin talimatlarını (20 μL soğuk H2 O'da 20 μg protein) izleyerek jelsolini (insan rekombinant, Onun etiketli) (Malzeme Tablosuna bakınız), adım 2.1'de aktin için açıklandığı gibi buz üzerinde nabız santrifüjleme, karıştırma vb. sekansı ile yeniden askıya alın. Deneylerde günde yaklaşık 2 μL jelsolin kullanılır; Bu nedenle, büyük alikotlar (5-10 μL) hazırlayın ve -80 ° C'de saklayın.
NOT: Gelsolin ile protokol alternatif olarak sağlanmıştır. Gelsolin yerine kapak proteininin kullanılması,13'te olduğu gibi satın alınması veya saflaştırılması önerilir. - VCA (insan WASP-VCA, GST-etiketli) (Malzeme Tablosuna bakınız) üreticinin talimatlarında belirtilenden 2 kat daha yüksek konsantrasyonda (250 μL soğuk H 2 O'da 500 μg protein), adım 2.1'deki aktiniçin olduğu gibi buz üzerinde darbe santrifüjleme, karıştırma vb. dizilimiyle yeniden askıya alın. 10 μL alikot yapın ve -80 ° C'de saklayın.
NOT: SpVCA (insan pVCA, streptavidin ve His-tagged) ticarileştirildikten sonra veya protein saflaştırma14 mümkünse, VCA yerine SpVCA kullanılması önerilir. VCA, burada açıklanan koşullar altında kuyruklu yıldızlara tekrarlanabilir bir şekilde vermez.
3. Protein konsantrasyonlarının ölçümü
- BSA'nın üst üste binen iki seri seyreltmesinden yapılmış bir Bradford standart eğrisi oluşturun.
NOT: Standart eğrinin, spektrofotometre değişmediği sürece yalnızca birkaç ayda bir (veya daha az sıklıkta) oluşturulması gerekir.- Bir mikrotüp rafının 1. sırasında, BSA seyreltme serisi #1 için tüpler yerleştirin: dört adet 2 mL tüp ve ardından dört adet 1,5 mL tüp. Rafın 3. sırasında, BSA seyreltme serisi #2 için tüpleri seri #1'e olduğu gibi yerleştirin. Rafın 5. sırasında, iki adet 1,5 mL tüp ile birlikte ölçülecek her numune için bir adet 2 mL tüp yerleştirin. Boşluk için satır 5'e tek bir 1,5 mL tüp ekleyin.
- Bradford Reaktifini (bakınız Malzeme Tablosu) 1,5 mL tüplere ölçün.
- Buz üzerinde daha kolay pipetleme (fazlalık buzdolabındaki stok şişesine iade edilecektir) için Bradford Reaktifi ile üste 15 mL'lik konik bir tüp doldurun. 200 μL Bradford Reaktifini alın ve pipet ucunu ıslatmak için konik tüpe geri atın. Çözelti viskoz olduğundan, çözeltinin kabarcık yapmadan uca tamamen girip çıkmasına izin vermek için yavaşça pipetleyin.
- "Önceden ıslatılmış" uçla, raftaki 1,5 mL'lik tüplerin her birine yavaşça 200 μL Bradford Reaktifi pipetleyin (her BSA seyreltmesi için dört, boş için bir ve ölçülecek her numune için iki). Bradford Reaktifinin protein çözeltileriyle karıştırmadan önce oda sıcaklığına iyice ısınmasını sağlamak için önce bunu yapın. 15 mL konik tüpün kalan içeriğini şişeye iade edin.
- H2O'yu 2 mL tüplere ölçün. Rafın 1. sırasında, ilk tüpe 1.990 μL H2O ve diğer üç tüpe 900 μL ekleyin. 3. sıra için, ilk tüpe 1.992,5 μL ve diğer üç tüpe 900 μL ekleyin. 5. sıradaki numune tüplerinin her birine 2.000 μL H2O ekleyin.
NOT: 1.000 μL'den büyük tüm hacimler için 1.000 μL'lik pipet kullanın, ancak tam miktarı iki kez pipetleyerek uygulayın. H2 O'da uzun süre seyreltilmiş proteinlerin bırakılmasını önlemek için, sonraki adımlara başlamadan önce her şeyi hazırlamak önemlidir. - BSA seyreltme serisi #1'i hazırlamak için, 10 μL kalibre edilmiş 2 mg/mL BSA'yı (bakınız Malzeme Tablosu) 10 μg/mL'lik bir çözelti oluşturmak üzere 1.990 μLH2O ile tüpe karıştırın. Bundan, her çözeltinin 900 μL'sini bir sonraki tüpe (900 μL H 2 O içeren) aktararak üç seri seyreltme (5 μg / mL, 2.5 μg / mL ve1.25μg / mL BSA) yapın.
- BSA seyreltme serisi #2'yi hazırlamak için, 7.5 μL kalibre edilmiş 2 mg / mL BSA'yı 1.992.5 μL H2O ile tüpe karıştırarak 7.5 μg / mL'lik bir çözelti oluşturun. Bundan, her bir çözeltinin 900 μL'sini bir sonraki tüpe (900 μL H2O içeren) aktararak üç seri seyreltme (3.75 μg / mL, 1.875 μg / mL ve 0.9375 μg / mL BSA) yapın.
- Standart eğriyi oluşturmak için absorbansı karıştırın ve okuyun. Boşluk için Bradford reaktif tüpüne 800 μL H2O ekleyin ve zamanlayıcıyı başlatın. Kabarcıklar yapmadan mümkün olduğunca verimli bir şekilde, hazırlanan tüplerde her BSA standardının 800 μL'sini 200 μL Bradford reaktifi ile karıştırın. Tüm standartlar Bradford reaktifi ile karıştırıldıktan sonra (< 5 dakika), her standardı tek kullanımlık bir küvete dökün ve makineyi boşalttıktan sonra spektrofotometrede 600 nm'deki absorbansı okuyun.
NOT: Aynı küvet, önce en az konsantre standart okunursa ve küvet okumalar arasında iyi boşaltılırsa, tüm seriyi okumak için kullanılabilir. Doğrusal uyum en az 0,99 R değerine sahip olana kadar standart eğriyi yeniden yapın. Sadece pipetleme ve nazik karıştırma işlemlerinde ustalaştıktan sonra, numuneleri okumaya devam edin.
- Aktin ve aktin bağlayıcı proteinlerin konsantrasyonlarını ölçün
- 2.000 μL H2 O içeren2mL tüplerde (adım 3.1.3'te hazırlanan), aşağıdakileri nazikçe karıştırın: Arp2/3 kompleksi ve profilinin her biri 2 μL, etiketli G-aktin, 5 μL her biri jelsolin ve VCA ve 8 μL kapak proteini (insan rekombinant). Hemen çözeltinin 800 μL'sini alın ve önceden hazırlanmış Bradford reaktifi ile karıştırın ve ardından her numune için birbirinin% 5-% 10'u içinde iki okuma yapmak için tekrarlayın. Daha büyük bir fark, süspansiyon veya yol tutuşu ile ilgili bir sorun olduğunu gösterir. Bradford reaktifi ile karıştırdıktan sonra birkaç dakika içinde okuyun.
NOT: Başka bir güne ait standart bir eğri kullanılıyorsa, numunelere ek olarak yalnızca adım 3.1.6'daki boşluk hazırlanmalıdır.
- 2.000 μL H2 O içeren2mL tüplerde (adım 3.1.3'te hazırlanan), aşağıdakileri nazikçe karıştırın: Arp2/3 kompleksi ve profilinin her biri 2 μL, etiketli G-aktin, 5 μL her biri jelsolin ve VCA ve 8 μL kapak proteini (insan rekombinant). Hemen çözeltinin 800 μL'sini alın ve önceden hazırlanmış Bradford reaktifi ile karıştırın ve ardından her numune için birbirinin% 5-% 10'u içinde iki okuma yapmak için tekrarlayın. Daha büyük bir fark, süspansiyon veya yol tutuşu ile ilgili bir sorun olduğunu gösterir. Bradford reaktifi ile karıştırdıktan sonra birkaç dakika içinde okuyun.
- Standart eğriyi ve seyreltme faktörünü kullanarak aktin ve aktin bağlayıcı proteinlerin konsantrasyonlarını hesaplayın. Her yeni süspansiyon için ölçümü yeniden yapın. Bradford testi ile elde edilen mg/mL okumalarını μM'ye dönüştürmek için moleküler ağırlıklar şunlardır: aktin 43 kD, Arp2/3 kompleksi 224 kD, profilin 15 kD, jelsolin 95 kD, kapak proteini 68 kD (insan rekombinant) veya 63,5 kD (fare rekombinant), VCA 43 kD ve SpVCA 54 kD (monomer moleküler ağırlık).
4. Boncukların kaplanması
- Santrifüjü 4 °C'ye önceden soğutun ve çalkalayıcı kuru bloğu (bkz. Malzeme Tablosu) 18 ° C'ye ayarlayın.
- Boncukları yıkayın: pipet 50 μL Xb tamponunu 1,5 mL mikrosantrifüj tüpe yerleştirin, 9 μL 4,5 μm çapında boncuk süspansiyonu veya 2 μL 1 μm çapında boncuk süspansiyonu (% 2,5 w / v süspansiyon) ekleyin (bkz. İyice karıştırın ve numuneleri 4 °C'de 10 dakika boyunca 20.000 x g'de santrifüj edin.
NOT: Her iki boncuk boyutunun toplam boncuk yüzey alanı 3cm2'dir: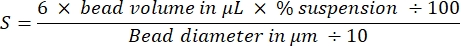
boncuk sayısını ve daha sonra kürelerin hacmi ve yüzey alanı için klasik denklemleri kullanarak toplam yüzeylerini hesaplayarak türetilmiştir. Toplam yüzey alanını 3cm2'de sabit tutmak için miktarlar ayarlanırsa diğer boncuk boyutları kullanılabilir. - Boncukları kaplayın: boncukları rahatsız etmeden süpernatantı dikkatlice çıkarın ve boncuk peletini Xb tamponunda 40 μL 2 μM SpVCA (veya 7 μM VCA) içinde nazik pipetleme ile yeniden askıya alın. 18 °C'de, 20 dakika boyunca 1.000 rpm'de çalkalayın.
- Kaplamalı boncukları yıkayın: karışımı santrifüj edin (4 ° C'de 10 dakika boyunca 20.000 x g) ve süpernatanı dikkatlice çıkarın. Boncukları 50 μL soğuk Xb / % 1 BSA'da yeniden askıya alın ve 4 ° C'de 10 dakika boyunca 20.000 x g'de santrifüj yapın. Süpernatantı çıkarın ve yıkama adımı 1x'i tekrarlayın.
- Kaplanmış boncuk peletini her iki boncuk boyutu için 120 μL soğuk Xb/%1 BSA'da adım 4.4'ten yeniden askıya alın, böylece boncuk yüzey alanı / boncuk çözeltisinin μL miktarı aynı olur. Bir buzdolabında veya soğuk odada buz üzerinde saklayın. Kaplamalı boncuklar en az birkaç hafta boyunca normal şekilde çalışmaya devam edecektir.
5. Motilitenin karışımının ve slaytların gözlem için hazırlanması
NOT: Hareketlilik karışımının toplam hacmi, kızak ile 18 mm x 18 mm kapak kayması arasında yaklaşık 25 μm boşluk bırakması için 8,4 μL'dir, böylece her boyuttaki boncuklar (10 μm çapa kadar) sıkılmaz. Temel hareketlilik karışımı, 5 μM profilin, 50 nM Arp2/3 kompleksi ve 25 nM kapak proteini (veya 240 nM jelsolin) ile yaklaşık 5 μM G-aktindir (% 10 etiketli floresan aktin).
- Motiliteli reaksiyon karışımını hazırlayın. Aktinin (ve dolayısıyla profilinin) kesin miktarları, adım 3.3'te hesaplanan konsantrasyona bağlıdır, ancak temsili bir reaksiyon aşağıdaki gibidir. Buz üzerinde şu sırayla karıştırın: 3,2 μL MB13, MB13'te seyreltilmiş 30 μM'de 1,5 μL profilin, MB13'te seyreltilmiş 0,21 μM'de 1 μL kapak proteini veya MB13'te 2 μM'ye seyreltilmiş jelsolin, MB13'te seyreltilmiş 0,47 μM'de 1 μL Arp2/3 kompleksi, 0,2 μL boncuk süspansiyonu (kullanımdan hemen önce vorteks), ve G tamponunda 30 μM'de 1.5 μL aktin. İyice ama hızlı bir şekilde karıştırın ve zamanlayıcıyı başlatın.
- Tüm hareketlilik reaksiyonu karışımını bir slayt üzerinde tespit edin. 18 mm x 18 mm kapak kayması ile örtün ve küçük bir boya fırçası kullanarak kapak kapağını eritilmiş VALAP ile kapatın. VALAP, lanolin, parafin ve petrol jölesinin bir karışımıdır (bakınız Malzeme Tablosu) 1: 1: 1, ağırlıkça, eritilir ve birlikte karıştırılır.
6. Mikroskopi gözlemi
- Faz kontrastı ve/veya epifloresan mikroskopi (GFP küpü, bakınız Malzeme Tablosu) ile donatılmış dik veya ters çevrilmiş bir mikroskopta (bakınız Malzeme Tablosu) 100x objektif kullanarak hareketlilik reaksiyonlarını hemen gözlemleyin. Gözlemler oda sıcaklığında (23-25 °C) yapılır.
- Tüm boncuk popülasyonu için ortalama yer değiştirme hızları elde etmek için, tüm slaytı tarayarak faz kontrastı veya floresan hareketsiz görüntüleri zaman içinde kaydedin. Kuyruklu yıldız uzunluğunu elle ölçün ve zamana karşı çizin. Doğrusal uyumun eğimi ortalama büyüme hızıdır.
- Tek tek boncukların hızını değerlendirmek için, faz kontrast mikroskobunda hızlandırılmış filmler toplayın. Boncuk hızına ve gereken çözünürlüğe bağlı olarak, her 1-10 saniyede bir kare çekin. Boncuk hızlarını ve yörüngelerini elde etmek için herhangi bir görüntü işleme programının izleme aracını kullanın.
Sonuçlar
Boncuklar üzerinde tekrar üretilebilir aktin kuyruklu yıldızları oluşturmanın kilit yönlerinden biri, hassas aktin bağlayıcı proteinlerin nazik ve hassas pipetlenmesidir. Bradford standart eğrisi oluşturmak, pipetleme becerilerini değerlendirmenin iyi bir yoludur. Şekil 1A, B, standart eğri için tüpleri ve BSA'nın iki seri seyreltmesinin Bradford reaktifi ile karıştırıldığında nasıl göründüğüne dair bir örnek göstermektedir. Derecelendirilmiş mavi renk tonuna dikkat edin (daha yüksek protein konsantrasyonu daha mavi bir çözelti verir). Spektrofotometrede okunduğunda ve çizildiğinde, bu çözümler Şekil 1C'de gösterildiği gibi standart bir eğri verir. Dikkatli pipetleme uygulamak için, gösterildiği gibi doğrusal korelasyon faktörü 0.999 olana kadar tahlil tekrarlanmalıdır.
Ticari olarak askıya alınmış proteinlerin konsantrasyonları Bradford testi ile dikkatlice değerlendirildikten sonra, kaplanmış boncuklar ve motiliteli karışım hazırlanır ve karıştırılır. Şekil 2A, kuyruklu yıldız oluşumunun farklı aşamalarının temsili görüntülerini göstermektedir: aktin bulutları, SpVCA kaplı boncukların ve hareketlilik ortamının karıştırılmasından birkaç dakika sonra oluşur; bulut polarizasyonu ~ 5 dakikada ve kuyruklu yıldız üretimi 15-20 dakikada gerçekleşir. Hem epifloresan hem de faz kontrast mikroskobu ile görülebilen aktin kuyruklu yıldızları (Şekil 2A) saatlerce uzamaya devam eder, ancak tutarlı bir hız korunmaz, bu nedenle boncuk hareketliliği normalde 1 saat içinde değerlendirilir. Öte yandan, parlak aktin bulutları elde etmek VCA kaplı boncuklarla 30 dakika sürer (Şekil 2B) ve kuyruklu yıldız oluşmaz, ancak simetri 1-2 saatte kırılmaya başlar (Şekil 2B'deki ok) ve bulutlar gece boyunca inkübasyondan sonra polarizasyon gösterir.
Şekil 3 , kapak proteini varlığında boncuk hızı değerlendirmesinin bir örneğini göstermektedir. Tüm boncuklar simetriyi yaklaşık olarak aynı anda kırdığından, slaytın tarandığı ve tüm kuyruklu yıldız popülasyonunun resimlerinin zaman içinde alındığı "sözde hızlandırılmış" kayıtlar yapılır (Şekil 3A). Kuyruklu yıldızlar depolimerize olmaz; bu nedenle, zaman içinde ölçülen kuyruklu yıldız uzunluklarındaki artış, yer değiştirme hızını hesaplamak için kullanılabilir (Şekil 3B). Gelsolin, azaltılmış kapak aktivitesini telafi etmek için 10x daha fazla jelsolin eklenirse, kuyruklu yıldız oluşumu için kapak proteini yerine kullanılabilir. Gelsolin varlığında oluşan kuyruklu yıldızlar kalitatif olarak aynıdır ve kapak proteinli boncuklarla yaklaşık olarak aynı hızlarda hareket eder (Şekil 3C). Kapaklama aktivitesi, boncuk yüzeyinde polimerizasyonu yoğunlaştırmak için anahtardır ve ne kapak proteini ne de jelsolin hareketlilik karışımına dahil edilmediğinde, aktin bulutları asla kuyruklu yıldızlar oluşturmak için polarize olmaz, ancak parlak aktin bulutları boncukların etrafında oluşur (Şekil 3D). Boncuklar üzerindeki kuyruklu yıldızlar, motilite karışımını değiştirerek ve farklı mikromanipülasyon teknikleri kullanarak motilite üzerindeki sonucu gözlemleyerek farklı biyokimyasal bağlamlarda aktin bazlı kuvvet üretimini ölçmek için kullanılabilir, örneğin15.
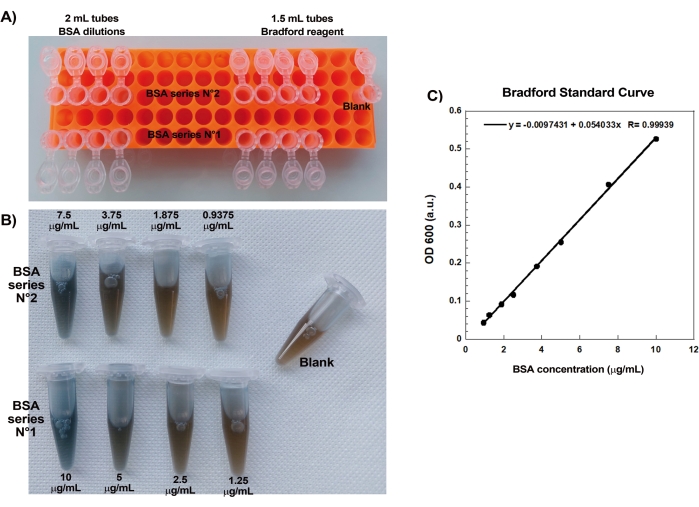
Resim 1: Bradford standart eğrisi. (A) Bradford standart eğrisini yapmak için tüplerin nasıl kurulacağının resmi. Örnek tüpler gösterilmez. (B) Bir zamanlar Bradford reaktifi ile karıştırılmış üst üste binen iki BSA seri seyreltmesinin resmi. (C) (B)'de gösterilen çözeltilerin 600 nm'sindeki absorbanslar spektrofotometrede ölçülür ve BSA çözeltilerinin protein konsantrasyonlarının bir fonksiyonu olarak çizilir. Doğrusal uyum, numune konsantrasyonunu hesaplamak için kullanılır. Doğrusal uyumun korelasyon faktörü R, 0.999'dur. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
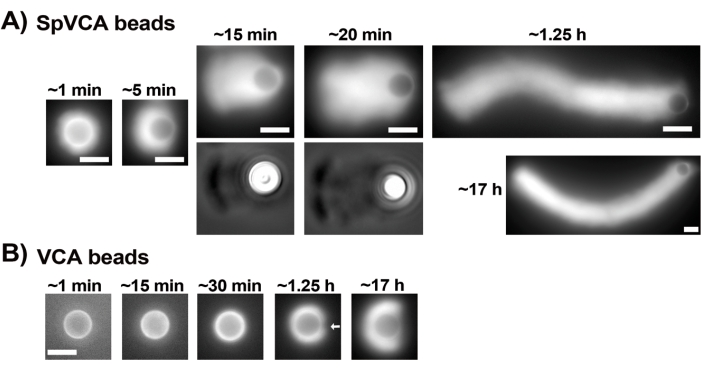
Resim 2: VCA kaplı boncukların aksine SpVCA kaplı boncuklar üzerinde kuyruklu yıldız oluşumu. (A) Zaman içinde gösterilen temsili SpVCA kaplı boncuklar (her resimde farklı boncuk). Karıştırma anından itibaren geçen süre belirtilir. Aktin bulutları hemen oluşur ve bulut polarizasyonu saatlerce uzamaya devam eden kuyruklu yıldızlara verir. (B) Zaman içinde gösterilen temsili VCA kaplı boncuklar (her resimde farklı boncuk). Aktin bulutu polarizasyonunun (ok) başlangıcını görmek için 1 saatten fazla gereklidir ve uzun inkübasyonlar bile kuyruklu yıldızlar üretmez. Tüm görüntüler 4,5 μm çapında boncuklardan, floresan aktinin epifloresan görüntülemesi, (A) içindeki 15 ve 20 dakikalık zaman noktaları için faz kontrastı görselleştirme ile eşleştirilmiştir, ölçek çubukları = 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
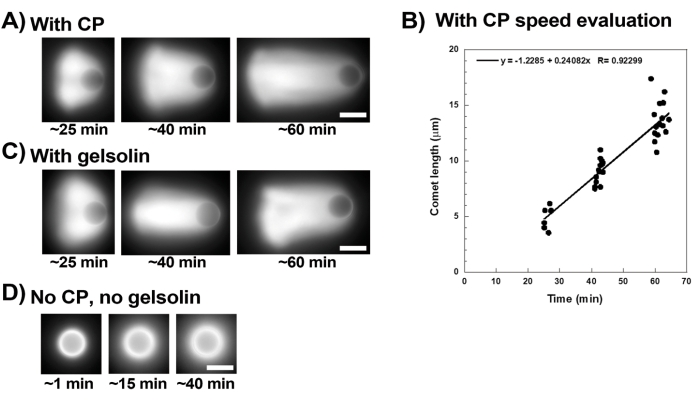
Şekil 3: Kuyruklu yıldızlar ve boncuk hızı analizi . (A) ve (C) Kapak proteini (CP) veya jelsolin varlığında, aktin bulutları reaksiyonun ilk 20 dakikasında kuyruklu yıldızlar oluşturmak için polarize olur ve kuyruklu yıldızlar zamanla uzar. Her görüntü için belirtilen karıştırma süresi; her görüntü farklı bir boncuktur. Boncuklar ve hazırlama arasında bazı değişkenlikler vardır, ancak ortalama olarak boncuklar, burada açıklanan standart koşullar altında dakika başına mikron / mikron altı hızlarda (0.2-1 μm / dak) hareket eder. (B) Kuyruklu yıldız uzunluğunun (boncukların tüm popülasyonunun) zaman içindeki değerlendirmesini gösteren temsili grafik. Doğrusal korelasyonun eğimi, ortalama yer değiştirme hızına karşılık gelir, bu durumda 0.24 μm / dak. (D) Kapaklama aktivitesinin yokluğunda (kapak proteini veya jelsolin yok), aktin bulutları boncukların etrafında oluşur, ancak kuyruklu yıldızlar oluşmaz. Tüm görüntüler 4,5 μm çapında boncuklar, floresan aktinin epifloresan görüntüleme, ölçek çubukları = 5 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Burada ayrıntılı olarak açıklanan protokol, ticari olarak temin edilebilen proteinleri kullanarak boncuk yüzeylerinde aktin ağı büyümesinin, kuyruklu yıldız oluşumunun ve boncuk hareketliliğinin nasıl elde edileceğini açıklamaktadır. Bununla birlikte, bazen kuyruklu yıldızlar tekrarlanabilir şekilde gözlenmez veya kayma ve kapak kayması arasında homojen değildir. Aşağıdaki tartışma, protokoldeki bazı önemli noktaları vurgulamakta ve ayarlanabilecek bazı parametreler önermektedir. Akılda tutulması gereken bir faktör, kuyruklu yıldız oluşumunun ve boncuk hızının sıcaklıktan etkilenmesi, 25 ° C'nin çok üzerinde veya 23 ° C'nin çok altındaki sıcaklıkların kuyruklu yıldız oluşumunu olumsuz yönde etkilemesi ve tekrarlanamaz veriler vermesidir. İklim kontrollü bir odada sıcaklık kontrollü bir mikroskop veya mikroskop kullanılması şiddetle tavsiye edilir. Her ne kadar floresan olarak etiketlenmiş aktin, floresan mikroskobu ile kuyruklu yıldızları gözlemlemek için genellikle hareketlilik karışımına dahil edilse de, kuyruklu yıldızlar bir boncuk çapından daha uzun olduğunda, faz kontrast mikroskobu ile boncuğun yanında koyu bir yayma olarak da görülebilirler. Faz kontrastı görselleştirmesi, hızlandırılmış görüntüleme için daha uygundur, çünkü bazı fototoksisiteler dönen disk aracılığıyla bile floresan görüntüleme ile ilişkilidir. Boncuklar zamanla yerleştiğinden, ters çevrilmiş bir mikroskop, dik olandan daha az yatay boncuk sürüklenmesi üretir ve filmler için daha uygundur. Kızakları kapatmak için erimiş VALAP kullanımı önemlidir, çünkü oje gibi maddeler kuyruklu yıldız oluşumuna müdahale eder. Bir beherde büyük miktarlarda VALAP yapılabilir ve daha sonra hızlı erimeye daha uygun olan daha küçük beherleri doldurmak için kepçeyle çıkarılabilir. VALAP oda sıcaklığında yıllarca iyidir.
Bir diğer önemli teknik husus da titiz tampon ve motiliteli karışım hazırlığıdır. MB13 hazırlanırken, özellikle pH ayarlama adımında dikkatli olunmalıdır. MB13'ün pH'ı, ATP hidrolizini önlemek için NaOH ile hızlı bir şekilde nötre ayarlanmalıdır, ancak pH nötre yaklaştıkça EGTA çözünürken çok hızlı olmamalıdır. EGTA önemli bir bileşendir, çünkü aktine bağlı kalsiyumu kompleksleştirir ve hareketlilik karışımına daha aktif magnezyum formu16'yı verir. Çok hızlı veya çok yavaş hazırlanan MB13, optimal olmayan kuyruklu yıldız oluşumu sağlar, hatta hiç vermez. Ek bir kilit nokta, koşullarla oynarken hareketlilik karışımındaki KCl konsantrasyonunu dikkatli bir şekilde takip etmektir. Örneğin, reaksiyon karışımında 1x MB13 kullanıldığında ve profilin, kapak proteini ve MB13'te Arp2/3 kompleksi seyreltildiğinde, hareketlilik reaksiyonundaki son KCl konsantrasyonu, G-tamponu ile seyreltme nedeniyle yaklaşık 40-50 mM'dir. Bu konsantrasyon kuyruklu yıldız testinde en iyi sonuçları verir ve 60 mM'den fazla KCl, Arp2/3 kompleks çekirdeklenme aktivitesini azaltır.
İşin protein tarafında, aktin kuyruklu yıldızları elde etmenin kritik bir teknik yönü, ticari aktin bağlayıcı proteinlerin, özellikle de mikrolitre miktarlarının hassas pipetlenmesinin doğru bir şekilde kullanılmasıdır. Bradford standart eğrisinin doğrusallığı, pipetleme için iyi bir testtir ve eğri daha sonra protein konsantrasyonlarının rutin ölçümleri için kullanılabilir. Gerçekten de, kuyruklu yıldız prosedürü için yeniden askıya alınmış ticari proteinler kullanıldığında, protein konsantrasyonlarını her zaman doğrulamak önemlidir, çünkü yeniden süspansiyon sırasında parti değişkenliği ve kullanıcı hatası, gerçek ve beklenen konsantrasyonlar arasında farklılıklara yol açabilir. Bazen protein konsantrasyonlarındaki küçük farklılıklar kuyruklu yıldızların tamamen yokluğuna yol açabilir.
Burada sunulan yöntemin bir diğer önemli yönü, polimerizasyon için yakıt olarak profilin kompleksli G-aktin'in kullanılmasıdır. Tarihsel olarak, in vitro sistemler aktin kaynağı olarak prepolimerize filamentli aktin (F-aktin) kullanmıştır: yüzeydeki toplu beslenen polimerizasyonda depolimerizasyon10,17. Bu, G-aktin seviyelerini kontrol etme avantajına sahipti, ancak depolimerizasyonu katalize etmek için ek bileşenler gerektiren bir karmaşıklık katmanı ekledi. Aktin ağının cirosu, boncuk yüzeyinde çekirdeklenme ve polimerizasyon ile beslenen kuvvet üretimi ve hareketliliği için gerekli olmadığından, ADF / kofilin gibi aktin depolimerizasyon faktörleri, yüzey18'den uzaktaki yaşlı ağlara etki ederken, aktin bazlı hareketliliğin in vitro yeniden yapılandırılması artık basitlik için ciro olmadan yapılmaktadır. Bununla birlikte, G-aktin kullanmanın bazı dezavantajları vardır. İlk olarak, liyofilize edilmiş ticari aktin kullanıldığında, oligomerler mevcuttur. Burada açıklanan depolimerizasyon adımları, tekrarlanabilir sonuçların elde edilmesinde çok önemlidir. Özellikle, G-tamponu geleneksel olarak pH 8'e ayarlanmasına rağmen, düşük pH (örneğin pH 7), bu makalede açıklanan tahlillerde daha iyi çalışıyor gibi görünmektedir, çünkü muhtemelen düşük pH depolimerizasyonu arttırır19. G-aktin kullanmanın bir diğer dezavantajı, polimerizasyona izin veren tuz koşullarına yerleştirildikten sonra, kendiliğinden çekirdeklenmenin meydana gelmesi ve F-aktin'in yığında ve boncuk yüzeyinde oluşmasıdır. G-aktin'in profilin ile komplekslenmesi, kütle ve sivri uçlu polimerizasyonda spontan çekirdeklenmeyi baskılar, böylece yüzey20'de hem çekirdeklenmeye hem de dikenli uç polimerizasyonuna odaklanır. Profilin-G-aktin fizyolojik olarak önemlidir, çünkü hücredeki aktinin çoğu bu formda bulunur21. Burada, profilin:aktinin 1: 1 oranı kullanılır; Bununla birlikte, daha yüksek oranlar (örneğin 3: 1), kütledeki polimerizasyonu daha iyi inhibe eder, ancak daha yüksek oranlar Arp2/3 kompleksini ve dikenli uç uzamasını bir dereceye kadar 22,23'e kadar inhibe eder.
Kapaklama aktivitesi aynı zamanda kuyruklu yıldız oluşumu için de anahtardır, çünkü yüzeyle aktive edilen Arp2/3 kompleksi24,25 tarafından çekirdeklenme döngüleri yoluyla yüzeye yeni aktin yerleştirilmesini sağlar. Kapak olmadan, aktin bulutları kuyruklu yıldızlar oluşturmak için simetriyi kırmaz, çünkü yüzeydeki polimerizasyon bulutu açmak için yeterli gerilim oluşturmaz26. Geçmişte, ev saflaştırılmış rekombinant fare kapak proteini13'ü kullandık, ancak bu makale için yapılan testler, ticari olarak temin edilebilen rekombinant insan kapak proteininin, ticari olarak temin edilebilen jelsolin gibi eşit derecede etkili olduğunu göstermektedir, ancak 10x daha fazla jelsolin kullanılması gerekir ve bazı uygulamalar için,27'yi kapatmanın yanı sıra aktin kesme aktivitesine sahip olduğu için uygun olmayabilir.
Son olarak, bu yöntemin sağlamlığı, çok aktif bir Arp2/3 kompleks aktivatörü olan streptavidin-pVCA (SpVCA)28'in kullanılmasında yatmaktadır. SpVCA, Arp2/3 karmaşık bağlama etki alanına ek olarak WASP'nin profilin-G-aktin bağlama alanını (p etki alanı) içerir, çünkü profilin-G-aktin koşullarında29 en verimli olduğu bulunmuştur. Daha da önemlisi, başlangıçta biyotin-streptavidin bağlantısı yoluyla yüzey işlevselliğine izin vermek için tanıtılan streptavidin etiketinin kullanımı, muhtemelen streptavidinin bir tetramer olması ve böylece Arp2/3 kompleks aktivitesini arttırdığı bilinen aktivatörü kümelemesi nedeniyle Arp2/3 kompleks aktivasyonunu arttırmanın ek etkisine sahiptir30 . Ticari olarak üretilen SpVCA şu anda geliştirilme aşamasındadır ve yakında satın alınabilecektir. Ayrıca,3 cm2 boncuk yüzeyini kaplamak için rutin olarak 2 μM SpVCA'nın 40 μL'sinin kullanılmasına rağmen, diğer kaplama konsantrasyonlarının (daha yüksek ve daha düşük) de çalıştığı ve bu koşullarla oynamanın farklı kuyruklu yıldız büyüme hızları ve morfolojileri verdiği belirtilmelidir. Gerçekten de, kuyruklu yıldızlar oluşmadığında veya kuyruklu yıldız boyutu slaytta homojen olmadığında, farklı kaplama koşullarının yanı sıra hareketlilik karışımındaki farklı KCl ve profilin konsantrasyonları test edilmelidir. Motilitenin karışımındaki aktin, Arp2/3 kompleksi ve kapak proteini konsantrasyonları da kuyruklu yıldız oluşumunu optimize etmek için değiştirilebilir, ancak elimizde bu oranların değiştirilmesi genellikle kafa karıştırıcı sonuçlar verir.
Sonuç olarak, burada açıklanan yöntemler boncuk yüzeyleri ve hareketlilik üzerinde aktin montajı üretir, ancak SpVCA ile işlevselleştirilebilen herhangi bir yüzey kullanılabilir. Burada tarif edildiği gibi adsorpsiyonun işe yaramadığı durumlarda, streptavidin moiety, SpVCA'yı biyotinilasyondan sonra ilgilenilen yüzeye bağlamak için kullanılabilir. Bu şekilde oluşan aktin yapıları, kuyruklu yıldızlar veya başka türlü, aktin ağlarının farklı biyokimyasal ve biyofiziksel yönlerini test etmek için kullanılabilir ve özellikle mikropipetler, optik cımbızlar ve lazer ablasyonları ile fiziksel manipülasyonlar için uygundur 15,26,31,32. Araştırma topluluğuna kullanımlarına ek olarak, burada açıklanan yaklaşım, lisans biyofizik öğrencilerinin simetri kırma ve kendi kendine örgütlenme gibi aktif madde kavramlarını incelemeleri için bir öğretim aracı olarak uygundur.
Açıklamalar
Yazarlar bu makalenin içeriği ile çıkar çatışması olmadığını beyan ederler.
Teşekkürler
LPENS'teki yeni evimizin üyelerine sıcak karşılamaları için ve özellikle ABCDJ ekibine tüm yardım ve destekleri için içtenlikle teşekkür ederiz. J.P., Foundation ARC'den (Grant PJA 20191209604) finansal desteği kabul eder ve C.S., Human Frontiers Science Program Organizasyonu'ndan (Grant RGP0026/2020) finansal desteği kabul eder.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Actin, rabbit muscle, Alexa Fluor 488 conjugate | Invitrogen (ThermoFisher Scientific) | A12373 (recently discontinued) | This product can be replaced with ATTO-488 actin from Hypermol. |
| Actin, rabbit muscle, ATTO-488 | Hypermol | 8153 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Arp2/3 complex | Cytoskeleton | RP01P | |
| ATP | Sigma | A7699 | |
| BioSpectrometer, basic | Eppendorf | 035739 | |
| Bradford Reagent | Bio-Rad | 500-0006 | |
| BSA, high quality | Sigma | A3059 | |
| BSA standard 2 mg/mL (Pierce) | Thermo Scientific | 23209 | |
| Capping protein (a1b2, mouse recombinant) | Home-purified (Reference 13) | This product will soon be commercially available from Cytoskeleton. | |
| Capping protein (a1b2, human recombinant) | Hypermol | 8322 | |
| Cube, GFP: U-MNIBA3 or U-MWB2 | Olympus | discontinued | Any GFP cube, adapted to the microscope being used, can be used. |
| Dry block, agitating: ThermoMixer C (refrigerated) | Eppendorf | 035963 | |
| ** with SmartBlock, 24 microtubes 2 mL | Eppendorf | 035969 | |
| Gelsolin (human recombinant, His-tagged) | Cytoskeleton | HPG6 | |
| Lanolin | Sigma | 49909 | |
| Microcentrifuge 5427R + rotor | Eppendorf | 934126 | |
| Microscope, upright: BX51 | Olympus | discontinued | Any epifluorescence upright microscope equipped with phase contrast optics can be used. |
| Microscope, inverted: IX70 | Olympus | discontinued | Any epifluorescence inverted microscope equipped with phase contrast optics can be used. |
| Paraffin | Sigma | 76244 | |
| Petroleum jelly: Vaseline | Sigma | 16415 | |
| Pipettes Research Plus | Eppendorf | Gilson pipettes don't work as well for delivery of very small volumes (0.5 µL for example). | |
| **10 µL | 933954 | ||
| **2.5 µL | 933953 | These two sizes are essential, but the use of high-quality pipettes (a full Research Plus set for example) is recommended. | |
| Polystyrene carboxylate beads | Polysciences | ||
| **approx. 1 µm diameter | 08226 | ||
| **approx. 4.5 µm diameter | 17140-5 | ||
| Profilin 1 (human recombinant, untagged) | Cytoskeleton | PR02 | |
| SpVCA (human WASP pVCA domain, N-ter His-tag, C-ter Streptavidin tag) | Home-purified (Reference 14) | This product will soon be commercially available from Cytoskeleton. | |
| VCA (human WASP VCA domain, GST-tagged) | Cytoskeleton | VCG03 |
Referanslar
- Campellone, K. G., Welch, M. D. A nucleator arms race: cellular control of actin assembly. Nature Reviews Molecular Cell Biology. 11 (4), 237-251 (2010).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. Journal of Cell Biology. 103, 2747-2754 (1986).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Tilney, L. G., Tilney, M. S. The wily ways of a parasite: induction of actin assembly by Listeria. Trends in Microbiology. 1 (1), 25-31 (1993).
- Moore, A. S., et al. Actin cables and comet tails organize mitochondrial networks in mitosis. Nature. 591 (7851), 659-664 (2021).
- Taunton, J., et al. Actin-dependent propulsion of endosomes and lysosomes by recruitment of N-WASP. Journal of Cell Biology. 148 (3), 519-530 (2000).
- Velarde, N., Gunsalus, K. C., Piano, F. Diverse roles of actin in C. elegans early embryogenesis. BMC Developmental Biology. 7, 142(2007).
- Merrifield, C. J., et al. Endocytic vesicles move at the tips of actin tails in cultured mast cells. Nature Cell Biology. 1 (1), 72-74 (1999).
- Samarin, S., et al. How VASP enhances actin-based motility. Journal of Cell Biology. 163 (1), 131-142 (2003).
- Bernheim-Groswasser, A., Wiesner, S., Golsteyn, R. M., Carlier, M. -F., Sykes, C. The dynamics of actin-based motility depend on surface parameters. Nature. 417 (6886), 308-311 (2002).
- Boujemaa-Paterski, R., et al. Network heterogeneity regulates steering in actin-based motility. Nature Communications. 8 (1), 655(2017).
- Akin, O., Mullins, R. D. Capping protein increases the rate of actin-based motility by promoting filament nucleation by the Arp2/3 complex. Cell. 133 (5), 841-851 (2008).
- Palmgren, S., Ojala, P. J., Wear, M. A., Cooper, J. A., Lappalainen, P. Interactions with PIP2, ADP-actin monomers, and capping protein regulate the activity and localization of yeast twinfilin. Journal of Cell Biology. 155 (2), 251-260 (2001).
- Carvalho, K., et al. Actin polymerization or myosin contraction: two ways to build up cortical tension for symmetry breaking. Philosophical Transactions of the Royal Society B. 368 (1629), 20130005(2013).
- Marcy, Y., Prost, J., Carlier, M. -F., Sykes, C. Forces generated during actin-based propulsion: a direct measurement by micromanipulation. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 5992-5997 (2004).
- Carlier, M. -F. Actin: protein structure and filament dynamics. Journal of Biological Chemistry. 266 (1), 1-4 (1991).
- Loisel, T. P., Boujemaa, R., Pantaloni, D., Carlier, M. F. Reconstitution of actin-based motility of Listeria and Shigella using pure proteins. Nature. 401 (6753), 613-616 (1999).
- Reymann, A. -C., et al. Turnover of branched actin filament networks by stochastic fragmentation with ADF/cofilin. Molecular Biology of the Cell. 22 (14), 2541-2550 (2011).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Quantitative variations with pH of Actin Depolymerizing Factor/Cofilin's multiple actions on actin filaments. Biochemistry. 58 (1), 40-47 (2019).
- Plastino, J., Blanchoin, L. Dynamic stability of the actin ecosystem. Journal of Cell Science. 132 (4), 219832(2019).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Suarez, C., et al. Profilin regulates F-actin network homeostasis by favoring formin over Arp2/3 complex. Developmental Cell. 32 (1), 43-53 (2015).
- Courtemanche, N., Pollard, T. D. Interaction of profilin with the barbed end of actin filaments. Biochemistry. 52 (37), 6456-6466 (2013).
- Achard, V., et al. A "primer"-based mechanism underlies branched actin filament network formation and motility. Current Biology. 20 (5), 423-428 (2010).
- Sykes, C., Plastino, J. Actin filaments up against a wall. Nature. 464 (7287), 365-366 (2010).
- vander Gucht, J., Paluch, E., Plastino, J., Sykes, C. Stress release drives symmetry breaking for actin-based movement. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7847-7852 (2005).
- McGough, A. M., Staiger, C. J., Min, J. -K., Simonetti, K. D. The gelsolin family of actin regulatory proteins: modular structures, versatile functions. FEBS Letters. 552 (2-3), 75-81 (2003).
- Abou-Ghali, M., et al. Capping protein is not necessary for polarized actin network growth and actin based motility. Journal of Biological Chemistry. 295, 15366-15375 (2020).
- Yarar, D., D'Alessio, J. A., Jeng, R. L., Welch, M. D. Motility determinants in WASP family proteins. Molecular Biology of the Cell. 13 (11), 4045-4059 (2002).
- Padrick, S. B., et al. Hierarchical regulation of WASP/WAVE proteins. Molecular Cell. 32 (3), 426-438 (2008).
- Bussonier, M., et al. Mechanical detection of a long-range actin network emanating from a biomimetic cortex. Biophysical Journal. 107 (4), 854-862 (2014).
- Paluch, E., vander Gucht, J., Joanny, J. -F., Sykes, C. Deformations in actin comets from rocketing beads. Biophysical Journal. 91 (8), 3113-3122 (2006).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır