Method Article
상업적으로 이용 가능한 단백질을 사용한 액틴 기반 운동성의 재구성
요약
이 프로토콜은 상업적으로 이용 가능한 단백질 성분을 사용하여 구슬 표면에 액틴 혜성을 생성하는 방법을 설명합니다. 이러한 시스템은 세포에서 발견되는 돌출 구조를 모방하고 단순화 된 방식으로 힘 생산의 생리적 메커니즘을 검사하는 데 사용할 수 있습니다.
초록
많은 세포 이동 및 모양 변화와 특정 유형의 세포 내 박테리아 및 세포 기관 운동성은 세포, 세포 기관 또는 박테리아의 표면에서 동적 네트워크를 형성하는 생체 고분자 액틴에 의해 구동됩니다. 이 과정에서 힘 생산의 생화학 적 및 기계적 기초는 제어 된 구성 요소 세트로 기능화되고 배양 된 비드와 같은 불활성 표면에서 액틴 기반 운동을 무세포 방식으로 재현함으로써 연구 할 수 있습니다. 적절한 조건에서 탄성 액틴 네트워크가 비드 표면에 조립되고 네트워크 성장에 의해 생성 된 스트레스로 인해 열리 며 비드를 앞으로 추진하는 "액틴 혜성"을 형성합니다. 그러나 이러한 실험은 다양한 액틴 결합 단백질의 정제를 필요로하며, 종종 비 전문가의 손이 닿지 않는 곳에 있습니다. 이 기사는 상업적으로 이용 가능한 시약을 사용하여 액틴 혜성과 비드의 운동성을 재현 가능하게 얻기 위한 프로토콜에 대해 자세히 설명합니다. 비드 코팅, 비드 크기 및 운동성 혼합물을 변경하여 비드 속도, 궤적 및 기타 파라미터에 대한 영향을 관찰할 수 있습니다. 이 분석은 다양한 액틴 결합 단백질의 생화학적 활성을 테스트하고 액틴 네트워크의 활성 물질 특성을 밝히는 정량적 물리적 측정을 수행하는 데 사용할 수 있습니다. 이것은 액틴 결합 단백질 정제에 대한 전문 지식 없이도 시험관 내 액틴 기반 운동성을 연구할 수 있는 커뮤니티에 유용한 도구가 될 것입니다.
서문
세포에서의 액틴 중합은 세포 신호 전달1의 하류의 액틴 필라멘트 핵 생성의 엄격한 조절에 의해 공간적 및 시간적으로 제어됩니다. 핵 생성은 액틴 삼량 체의 형성을 통해 발생하며, 초기 필라멘트의 양쪽 끝은 자발적으로 중합되지만 한쪽 끝은 다른 쪽 끝 (뾰족한 끝)보다 더 역동적입니다 (가시가있는 끝)2. 핵 생성 및 가시 말단 중합이 표면을 향할 때, 그들은 이동을 위해 세포막을 밀어 내고 ATP 가수 분해를 에너지 원으로 사용하여 세포 내부의 미크론 크기의 물체를 이동시키기에 충분한 힘 (피코 대 나노 뉴턴 범위에서)을 생성합니다3. 몇 가지 예로는 액틴 혜성을 사용하여 세포에서 세포로 퍼지는 리스테리아 모노사이토제네스 박테리아와 유사분열 4,5 동안 무작위 유전에 액틴 혜성 기반 움직임이 중요한 미토콘드리아가 있습니다. 엔도 솜 및 다른 세포 내 소포의 액틴 혜성은 기증자 막 6,7,8로부터의 분리와 관련이 있습니다.
여기에 제시된 방법을 사용하면 세포 액틴 중합의 신호 전달 측면이 우회되고 액틴 중합은 분지형 액틴 핵 생성의 활성화제, 특히 인간 WASP 단백질의 활성 도메인인 VCA(WA 또는 WCA라고도 함)1로 코팅하여 마이크로메트릭 폴리스티렌 비드에서 생성됩니다. 코팅된 비드는 이어서, 세포 내의 주요 액틴 중합 핵제인 Arp2/3 복합체를 포함하여, 액틴 중합에 필요한 성분을 함유하는 혼합물에서 인큐베이션되고, 이는 비드 표면에서 VCA에 의해 활성화되어 딸 필라멘트1의 측면으로부터 가지로서 새로운 필라멘트를 형성한다. 액틴은 처음에는 비드 주위에서 균일하게 중합되지만 자발적으로 대칭을 깨뜨려 비드를 앞으로 밀어내는 액틴 혜성을 생성하여 세포와 같은 돌출 네트워크와 혜성을 제어 된 방식으로 재현합니다. 비드 및 기타 코팅 된 표면에 대한 유사한 접근법이 과거에 액틴 중합 9,10,11,12의 생화학 및 생물 물리학을 연구하기 위해 우리와 다른 사람들에 의해 사용되었지만 이러한 실험에는 액틴 결합 단백질에 대한 광범위한 전문 지식이 필요했습니다. 여기에 제시된 프로토콜은 상업적으로 이용 가능한(또는 곧 이용 가능한) 시약으로 액틴 혜성과 운동성을 강력하게 생성하는 방법을 설명하여 생물물리학적 개념을 가르치기 위한 교육 환경을 포함하여 누구나 이 접근 방식에 액세스할 수 있도록 합니다. 주요 특징으로는 부드럽고 신뢰할 수 있는 피펫팅의 중요성, 액틴 공급원으로 프로필린 복합체 단량체 사용, 비드 코팅 시약으로 고활성 Apr2/3 복합 활성제 사용의 필요성 등이 있습니다.
프로토콜
1. 완충액의 제조
참고: 모든 완충액에는 초순수 H2O를 사용하십시오. 멸균 할 필요는 없습니다. 1.1-1.4단계에 설명된 모든 용액을 0.2μm 주사기 필터로 여과하고 사용량에 따라 튜브당 500μL-2mL씩 분취한 후 -20°C에서 보관합니다.
- 50mL 원뿔형 튜브에 BSA 2g을 칭량하고H2O로 20mL 표시까지 채워 10% BSA를 준비합니다. BSA가 용해될 때까지(약 30분) 혼합한 다음 부피를 20mL로 구성합니다.
알림: 고품질 BSA를 사용하십시오( 재료 표 참조). 10% BSA 용액은 비드 준비와 운동성 혼합 모두에 사용됩니다. - 비드 제조를 위해, Xb 완충액 (10 mM Hepes, 0.1 M KCl, 1 mM MgCl2, 및 0.1 mMCaCl2, pH 7.5)을 10x 용액으로서 준비하고, 사용하기 전에 희석한다 (100 μL의 10x Xb 원액 + 900 μL의H2O). 10x Xb 원액 100μL + 10% BSA 100μL +H2O800μL를 혼합하여 Xb/1% BSA를 준비합니다.
- 단량체 액틴(G-액틴)을 희석하는 데 사용되는 완충액인 G 완충액(2mM 트리스, 0.2mMCaCl2, 0.2mM DTT, 2mM ATP)을 준비합니다. 전통적으로 사용되는 pH 8이 아닌 pH 7로 조정하십시오 (토론 참조).
- 운동성 완충제 MB13 (10 mM 헤페스, 1.5 mM ATP, 3 mM DTT, 1.5 mMMgCl2, 1 mM EGTA, 50 mM KCl, 1% BSA, pH 7.5)을 준비한다. 일부 응용 프로그램의 경우 10x MB13이 유용합니다. 그러나 BSA 없이 10x MB13을 준비하면 pH 조정 중에 문제가 발생할 수 있습니다. 10x MB13에서 1x MB13을 재구성할 때 10% 스톡 용액(1.1단계에서 준비)에서 BSA를 추가합니다.
2. 단백질 용액의 제조
알림: 모든 재현탁액에는 초순수 H2O를 사용하십시오. 멸균 할 필요는 없습니다. 얼음 위의 모든 단백질을 처리하고 사전 냉각 된 튜브에 분취합니다. 거품이 생기지 않도록 부드럽게 조작하고 단백질 용액을 소용돌이하지 마십시오. 주식을 -80°C에서 보관하려면 액체 질소에서 급속 냉동할 필요가 없습니다. 약 5회 이상의 동결-해동 주기를 피하기 위해 분취량 크기를 조정하는데, 이는 단백질의 활성에 영향을 미치지 않는 것으로 보이기 때문이다. 작업 분취량은 -20 ° C에서 몇 주 동안 보관할 수 있습니다.
- 아래 설명 된대로 G- 액틴 (토끼 골격근) 용액을 준비하십시오.
- 펄스 원심 분리기 액틴 분말 ( 재료 표 참조)을 4 ° C에서 튜브 바닥에 고체를 수집합니다.
- 제조업체의 지침에 따라 H 2 O를 추가하십시오 (표지되지 않은 액틴의 경우 차가운 H 2 O 100μL에단백질 1mg, ATTO 표지 된 액틴의 경우 차가운 H2O 100μL에 단백질 100μg).
- 적어도 15 분 동안 얼음 위에 두십시오. 위아래로 피펫팅하여 부드럽게 혼합하고 얼음 위에 최소 15분 더 그대로 두었다가 다시 섞습니다. 4°C에서 펄스 원심분리하여 튜브의 바닥에서 용액을 수집하고 재혼합합니다.
- 사용에 따라 표지되지 않은 액틴 분취량 10-50 μL 분취량과 ATTO 표지 액틴 분취량 20 μL 분취량을 준비합니다. 분취량을 -80°C에서 보관하십시오.
- 동결건조 및 동결 중에 형성되는 액틴 올리고머를 해중합하려면 추가 ATP 및 DTT로 스파이크된 G-완충액에서 재현탁된 액틴의 분취량을 ~8배 희석합니다(예: 2.1.4단계의 재현탁액틴 용액 20μL에 G-완충액 134μL, 0.2mM ATP 0.32μL 및 1M DTT 0.16μL를 추가). 형광 표지의 경우 약 10% 표지된 액틴을 추가합니다. 예를 들어, 희석된 표지되지 않은 액틴 40μL에 ATTO 표지된 액틴 5μL를 추가합니다. 단계 3에 설명된 대로 Bradford 분석으로 단백질 농도를 측정하기 전에 최소 며칠에서 일주일 동안 가끔 혼합(피펫팅)하여 얼음에서 해중합시키십시오.
알림: 표지되지 않은 형광 액틴을 희석하여 차가운 방이나 냉장고의 얼음 위에 보관하십시오. 절대 얼거나 따뜻하게 하지 마십시오. 제제는 시간이 지남에 따라 해중합을 계속하며 적절하게 취급하면 최소 6개월 동안 사용할 수 있습니다.
- 제조업체의 지침(20μL 차가운H2O에 20μg 단백질)에 따라 Arp2/3 복합체(돼지 뇌)(재료 표 참조)를 단계 2.1에서 액틴에 대해 설명된 대로 얼음 위에서 펄스 원심분리, 혼합 등의 순서로 재현탁합니다. 재현 가능한 실험을 위해 두 개의 분말 튜브를 재현탁하여 단백질 용액을 결합하여 더 큰 스톡을 확보하십시오. 2 μL 분취량을 준비하고 -80°C에서 보관한다.
- 2.1 단계에서 액틴과 같이 얼음 위에서 펄스 원심 분리, 혼합 등의 순서로 제조업체의 지침 (25 μL 차가운 H2O 중 100 μg 단백질)에 규정 된 것보다 4 배 높은 농도로 프로파일 린 (인간 재조합) (재료 표 참조)을 재현탁합니다. 재현 가능한 실험을 위해 더 큰 스톡을 갖도록 단백질 농도를 결정하기 전에 두 개의 분말 튜브를 재현탁한 단백질 용액을 결합합니다.
알림: 차가운 방이나 냉장고에 얼음 위에 보관하십시오. 절대 얼거나 따뜻하게 하지 마십시오. 적절하게 취급하면 재현탁 된 프로파일 린은 최소 6 개월에서 1 년 동안 좋습니다. - 제조업체의 지침(50μL 차가운H2O중 50μg 단백질)에 따라 캡핑 단백질(α1β2, 인간 재조합)(재료 표 참조)을 단계 2.1에서 액틴에 대해 설명된 대로 얼음 위에서 펄스 원심분리, 혼합 등의 순서로 재현탁합니다. 얼음에 글리세롤 50μL를 식히고 재현탁 캡핑 단백질 50μL를 첨가합니다. 부드럽게 섞는다. -20 °C에서 보관하십시오.
참고: 용액이 얼지 않고 활성이 강력하므로 조심스럽게 취급하면 용액을 몇 달 또는 몇 년 동안 단일 부분 표본으로 보관할 수 있습니다. 마우스 재조합 캡핑 단백질, 시험 관내 실험(13)에서 과거에 가장 통상적으로 사용되었던 단백질이 곧 상업적으로 입수가능할 것이다. - 단계 2.1에서 액틴에 대해 설명된 대로 얼음 위에서 펄스 원심분리, 혼합 등의 순서를 사용하여 제조업체의 지침(20μL 차가운H2O중 20μg 단백질)에 따라 겔솔린(인간 재조합, His-tagged)(재료 표 참조)을 재현탁합니다. 실험 하루에 약 2 μL의 겔 솔린이 사용됩니다. 따라서 큰 분취량 (5-10 μL)을 준비하고 -80 ° C에서 보관하십시오.
참고: 젤솔린을 사용한 프로토콜이 대안으로 제공됩니다. 젤솔린 대신에 캡핑 단백질을 사용하는 것이 좋으며,13에서와 같이 구입하거나 정제하는 것이 좋습니다. - VCA (인간 WASP-VCA, GST- tagged) ( 재료 표 참조)를 제조업체의 지침 (250 μL 차가운 H 2 O 중 500 μg 단백질)에 규정 된 것보다 2 배 높은 농도로 재현 탁시키고,2.1단계에서 액틴과 마찬가지로 얼음에서 펄스 원심 분리, 혼합 등의 순서를 사용합니다. 10 μL 분취량을 만들고 -80 °C에서 보관하십시오.
참고: SpVCA(인간 pVCA, 스트렙타비딘 및 His-tagged)가 상용화되거나 단백질 정제14 가 가능한 경우 VCA 대신 SpVCA를 사용하는 것이 좋습니다. VCA는 여기에 설명 된 조건에서 혜성을 재현 가능하게 제공하지 않습니다.
3. 단백질 농도 측정
- BSA의 두 개의 겹치는 연속 희석으로 구성된 Bradford 표준 곡선을 구성합니다.
참고 : 표준 곡선은 분광 광도계가 변경되지 않는 한 2 개월마다 (또는 덜 자주) 구성하면됩니다.- 마이크로튜브 랙의 1행에 BSA 희석 시리즈 #1용 튜브를 배치합니다: 4개의 2mL 튜브와 4개의 1.5mL 튜브. 랙의 3행에 BSA 희석 시리즈 #2용 튜브를 시리즈 #1과 같이 배치합니다. 랙의 5행에 측정할 각 샘플에 대해 2mL 튜브 1개와 1.5mL 튜브 1개를 놓습니다. 블랭크의 5열에 단일 1.5mL 튜브를 추가합니다.
- Bradford 시약( 재료 표 참조)을 1.5mL 튜브에 넣습니다.
- 얼음 위에 15mL 원뿔형 튜브를 Bradford 시약으로 채워 더 쉽게 피펫팅할 수 있습니다(초과분은 냉장고의 스톡 병으로 반환됩니다). 200 μL Bradford 시약을 꺼내 원뿔형 튜브로 다시 꺼내 피펫 팁을 적십니다. 용액의 점성이 있으므로 용액이 거품을 만들지 않고 팁에 완전히 들어가고 떠날 수 있도록 천천히 피펫을 돌립니다.
- "사전 습식" 팁을 사용하여 200μL의 Bradford 시약을 랙의 각 1.5mL 튜브에 천천히 피펫팅합니다(각 BSA 희석에 대해 4개, 블랭크에 대해 1개, 측정할 각 샘플에 대해 2개). 단백질 용액과 혼합하기 전에 Bradford 시약이 실온으로 완전히 따뜻해질 수 있도록 하려면 먼저 이 작업을 수행하십시오. 15mL 원추형 튜브의 나머지 내용물을 병에 다시 넣습니다.
- 2mL 튜브에 들어간H2O를 측정합니다. 랙의 행 1에서 첫 번째 튜브에 1,990 μL H2O를 추가하고 다른 세 튜브에 900 μL를 추가합니다. 행 3의 경우 첫 번째 튜브에 1,992.5μL를 추가하고 다른 세 튜브에 900μL를 추가합니다. 2,000 μLH2O를 행 5의 각 샘플 튜브에 추가합니다.
참고: 1,000μL보다 큰 모든 부피의 경우 1,000μL 피펫을 사용하되 피펫팅을 두 번 하여 전량을 투여합니다. 단백질을 H2O로 희석 된 단백질을 장기간 방치하지 않도록 후속 단계를 시작하기 전에 모든 것을 준비하는 것이 중요합니다. - BSA 희석 시리즈 #1을 준비하려면 10μL의 보정된 2mg/mL BSA( 재료 표 참조)를 1,990μL H2O와 함께 튜브에 혼합하여 10μg/mL 용액을 만듭니다. 이로부터 각 용액 900μL를 다음 튜브(900μLH2O함유)로 옮겨 3회 연속 희석(5μg/mL, 2.5μg/mL 및 1.25μg/mL BSA)을 만듭니다.
- BSA 희석 시리즈 #2를 준비하려면 7.5μL의 보정된 2mg/mL BSA를 튜브에 1,992.5μL H2O와 혼합하여 7.5μg/mL 용액을 만듭니다. 이로부터 각 용액 900μL를 다음 튜브(900μLH2O함유)로 옮겨 3회 연속 희석(3.75μg/mL, 1.875μg/mL 및 0.9375μg/mL BSA)을 만듭니다.
- 흡광도를 혼합하고 판독하여 표준 곡선을 생성합니다. 블랭크용 Bradford 시약 튜브에 800μLH2O를 추가하고 타이머를 시작합니다. 기포를 만들지 않고 가능한 한 효율적으로 준비된 튜브에 각 BSA 표준물질 800μL와 Bradford 시약 200μL를 혼합합니다. 모든 표준물질이 Bradford 시약과 혼합되면(< 5분) 각 표준물질을 일회용 큐벳에 붓고 기계를 블랭킹한 후 분광 광도계에서 600nm에서 흡광도를 읽습니다.
알림: 가장 덜 집중된 표준을 먼저 읽고 읽기 사이에 큐벳을 잘 비운 경우 동일한 큐벳을 사용하여 전체 시리즈를 읽을 수 있습니다. 선형 피팅의 R 값이 0.99 이상이 될 때까지 표준 곡선을 다시 실행합니다. 피펫팅과 부드러운 혼합이 마스터된 후에만 샘플 판독을 진행합니다.
- 액틴 및 액틴 결합 단백질의 농도 측정
- 2,000 μL의 H 2 O (3.1.3 단계에서 제조)를 함유하는 2 mL 튜브에서, Arp2 / 3 복합체 및 프로파일 린 각각2μL, 표지 된 G- 액틴 4 μL, 겔 솔린 및 VCA 각각 5 μL 및 캡핑 단백질 (인간 재조합) 8 μL를 부드럽게 혼합한다. 즉시 용액 800μL를 취하여 이미 준비된 Bradford 시약과 혼합한 다음 각 샘플에 대해 서로 5%-10% 내에서 두 번의 판독값을 갖도록 반복합니다. 차이가 클수록 재가동 또는 취급에 문제가 있음을 나타냅니다. Bradford 시약과 혼합한 후 몇 분 이내에 읽으십시오.
참고: 다른 날의 표준 곡선을 사용하는 경우 샘플 외에 3.1.6단계의 블랭크만 준비하면 됩니다.
- 2,000 μL의 H 2 O (3.1.3 단계에서 제조)를 함유하는 2 mL 튜브에서, Arp2 / 3 복합체 및 프로파일 린 각각2μL, 표지 된 G- 액틴 4 μL, 겔 솔린 및 VCA 각각 5 μL 및 캡핑 단백질 (인간 재조합) 8 μL를 부드럽게 혼합한다. 즉시 용액 800μL를 취하여 이미 준비된 Bradford 시약과 혼합한 다음 각 샘플에 대해 서로 5%-10% 내에서 두 번의 판독값을 갖도록 반복합니다. 차이가 클수록 재가동 또는 취급에 문제가 있음을 나타냅니다. Bradford 시약과 혼합한 후 몇 분 이내에 읽으십시오.
- 액틴 및 액틴 결합 단백질의 농도를 표준 곡선과 희석 계수를 사용하여 계산합니다. 각각의 새 재서스펜션에 대해 측정을 다시 실행합니다. 브래드포드 분석을 통해 얻은 mg/mL 판독값을 μM으로 변환하는 분자량은 액틴 43kD, Arp2/3 복합체 224kD, 프로필린 15kD, 젤솔린 95kD, 캡핑 단백질 68kD(인간 재조합) 또는 63.5kD(마우스 재조합), VCA 43kD 및 SpVCA 54kD(단량체 분자량)입니다.
4. 구슬 코팅
- 원심분리기를 4°C로 사전 냉각하고 교반 건조 블록( 재료 표 참조)을 18°C로 설정합니다.
- 비드 세척: Xb 버퍼 50μL를 1.5mL 미세 원심분리 튜브에 피펫팅하고 직경 4.5μm 비드 현탁액 9μL 또는 직경 1μm 비드 현탁액 2μL(2.5% w/v 현탁액)를 추가합니다( 재료 표 참조). 완전히 혼합하고 샘플을 20,000 x g 에서 4°C에서 10분 동안 원심분리합니다.
참고: 두 비드 크기의 총 비드 표면적은3cm2입니다.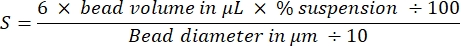
구슬의 수를 계산한 다음 구의 부피와 표면적에 대한 고전적인 방정식을 사용하여 전체 표면을 계산하여 파생됩니다. 총 표면적을3cm2로 일정하게 유지하기 위해 양을 조정하면 다른 크기의 비드를 사용할 수 있습니다. - 비드 코팅: 비드를 방해하지 않고 상청액을 조심스럽게 제거하고 부드러운 피펫팅으로 Xb 버퍼에 2μM SpVCA(또는 7μM VCA)의 40μL에 비드 펠릿을 재현탁합니다. 18 °C, 1,000 rpm에서 20 분 동안 교반합니다.
- 세척된 비드: 혼합물을 원심분리(4°C에서 10분 동안 20,000 x g )하고 상청액을 조심스럽게 제거한다. 비드를 50μL의 차가운 Xb/1% BSA에 재현탁하고 20,000 x g 에서 4°C에서 10분 동안 원심분리합니다. 상청액을 제거하고 세척 단계 1x를 반복합니다.
- 비드 표면적/비드 용액의 μL의 양이 동일하도록 두 크기의 비드에 대해 120μL 콜드 Xb/1% BSA에 4.4단계의 코팅된 비드 펠릿을 재현탁합니다. 냉장고 또는 차가운 방에서 얼음 위에 보관하십시오. 코팅된 비드는 적어도 몇 주 동안 정상적으로 계속 작동합니다.
5. 관찰을위한 운동성 믹스 및 슬라이드 준비
알림: 운동성 믹스의 총 부피는 8.4μL로 슬라이드와 25mm x 18mm 커버슬립 사이에 약 18μm의 간격을 허용하므로 모든 크기(최대 직경 10μm)의 비드가 압착되지 않습니다. 기본 운동성 혼합물은 5μM 프로필린, 50nM Arp2/3 복합체 및 25nM 캡핑 단백질(또는 240nM 겔솔린)과 약 5μM G-액틴(10% 표지된 형광 액틴)입니다.
- 운동성 반응 혼합물을 준비한다. 액틴(따라서 프로필린)의 정확한 양은 단계 3.3에서 계산된 농도에 따라 다르지만, 대표적인 반응은 다음과 같다. MB13에 희석 된 3.2 μL의 MB13, MB13에 희석 된 30 μM의 프로파일 린 1.5 μL, MB13에 희석 된 0.21 μM의 캡핑 단백질 1 μL 또는 MB13에서 2 μM으로 희석 된 겔 솔린, MB13에 희석 된 0.47 μM의 Arp2 / 3 복합체 1 μL, 비드 현탁액 0.2 μL (사용 직전 와류) 순으로 얼음에 혼합하십시오. 및 G- 완충액에서 30 μM에서 1.5 μL의 액틴. 잘 섞지 만 빨리 섞고 타이머를 시작하십시오.
- 슬라이드에서 전체 운동성 반응 혼합물을 발견합니다. 18mm x 18mm 커버슬립으로 덮고 작은 붓을 사용하여 녹인 VALA로 커버슬립을 밀봉합니다. VALAB은 라놀린, 파라핀 및 바셀린( 재료 표 참조)을 1:1:1 중량비로 혼합하여 함께 녹이고 교반합니다.
6. 현미경 관찰
- 위상차 및/또는 에피형광 현미경(GFP 큐브, 재료 표 참조)이 장착된 직립 또는 도립 현미경(재료 표 참조)에서 100x 대물렌즈를 사용하여 운동성 반응을 즉시 관찰합니다. 관찰은 실온 (23-25 ° C)에서 수행됩니다.
- 전체 비드 모집단에 대한 평균 변위 속도를 얻으려면 전체 슬라이드를 스캔하여 시간 경과에 따른 위상차 또는 형광 정지 이미지를 기록합니다. 혜성 길이를 손으로 측정하고 플롯 대 시간을 측정합니다. 선형 피팅의 기울기는 평균 성장 속도입니다.
- 개별 비드의 속도를 평가하려면 위상차 현미경으로 타임랩스 동영상을 수집하십시오. 비드 속도와 필요한 해상도에 따라 1-10초마다 프레임을 가져옵니다. 이미지 처리 프로그램의 추적 도구를 사용하여 비드 속도와 궤적을 얻으십시오.
결과
비드에서 액틴 혜성을 재현 가능하게 생성하는 핵심 측면 중 하나는 섬세한 액틴 결합 단백질의 부드럽고 정밀한 피펫팅입니다. Bradford 표준 곡선을 생성하는 것은 피펫팅 기술을 평가하는 좋은 방법입니다. 그림 1A, B 는 표준 곡선의 튜브와 BSA의 두 연속 희석이 Bradford 시약과 혼합되었을 때 어떻게 보이는지에 대한 예를 보여줍니다. 등급이 매겨진 파란색 색조에 유의하십시오(단백질 농도가 높을수록 더 파란색 용액이 제공됨). 분광 광도계에서 읽고 플로팅하면 이러한 솔루션은 그림 1C와 같이 표준 곡선을 제공합니다. 신중한 피펫팅을 수행하려면 그림과 같이 선형 상관 계수가 0.999가 될 때까지 분석을 반복해야 합니다.
상업용 재현탁 단백질의 농도가 Bradford 분석을 통해 신중하게 평가되면 코팅된 비드와 운동성 혼합물을 준비하고 함께 혼합합니다. 도 2A는 혜성 형성의 상이한 단계의 대표적인 이미지를 나타낸다: SpVCA-코팅된 비드 및 운동성 매질을 혼합한 지 분 내에 액틴 구름 형성; 구름 편광은 ~ 5 분에 발생하고 혜성 생성은 15-20 분에 발생합니다. 에피형광과 위상차 현미경(그림 2A)으로 볼 수 있는 액틴 혜성은 몇 시간 동안 계속 늘어나지만 일정한 속도가 유지되지 않아 비드 운동성은 일반적으로 1시간 이내에 평가됩니다. 반면에 VCA 코팅 비드로 밝은 액틴 구름을 얻는 데 30분이 걸리며(그림 2B), 혜성은 형성되지 않지만 대칭은 1-2시간에 깨지기 시작하고(그림 2B의 화살표) 구름은 밤새 배양 후 편광을 보입니다.
도 3 은 캡핑 단백질의 존재 하에서의 비드 속도 평가의 예를 나타낸다. 모든 구슬이 거의 동시에 대칭을 깨기 때문에 슬라이드를 스캔하고 시간이 지남에 따라 전체 혜성 집단의 사진을 찍는 "의사 타임 랩스"기록이 수행됩니다 (그림 3A). 혜성은 해중합되지 않습니다. 따라서 시간이 지남에 따라 측정된 혜성 길이의 증가를 사용하여 변위 속도를 계산할 수 있습니다(그림 3B). 겔솔린은 감소된 캡핑 활성을 보상하기 위해 10배 더 많은 겔솔린이 첨가되면 혜성 형성을 위한 캡핑 단백질 대신 사용할 수 있습니다. 겔솔린의 존재하에 형성된 혜성은 질적으로 동일하며 캡핑 단백질이있는 비드와 거의 같은 속도로 움직입니다 (그림 3C). 캡핑 활성은 비드 표면에서 중합을 집중시키는 데 중요하며, 캡핑 단백질이나 겔솔린이 운동성 혼합물에 포함되지 않은 경우 액틴 구름은 비드 주위에 밝은 액틴 구름이 형성되지만 액틴 구름은 편광되어 혜성을 형성하지 않습니다(그림 3D). 비드 상의 혜성은 운동성 혼합을 변경하고 다양한 미세 조작 기술(예:15)을 사용하여 운동성에 대한 결과를 관찰함으로써 다양한 생화학적 맥락에서 액틴 기반 힘 생산을 측정하는 데 사용할 수 있습니다.
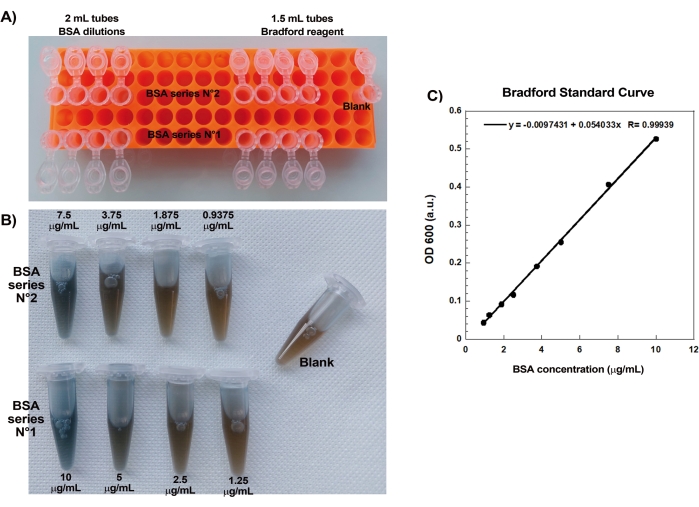
그림 1: 브래드포드 표준 곡선. (A) 브래드포드 표준 곡선을 만들기 위해 튜브를 설정하는 방법의 그림. 샘플 튜브는 표시되지 않습니다. (B) 브래드포드 시약과 혼합된 후 두 개의 겹치는 BSA 직렬 희석액 사진. (C) (B)에 표시된 용액의 600nm에서의 흡광도는 분광 광도계에서 측정되며 BSA 용액의 단백질 농도의 함수로 표시됩니다. 선형 피팅은 샘플 농도를 계산하는 데 사용됩니다. 선형 피팅의 상관 계수 R은 0.999입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
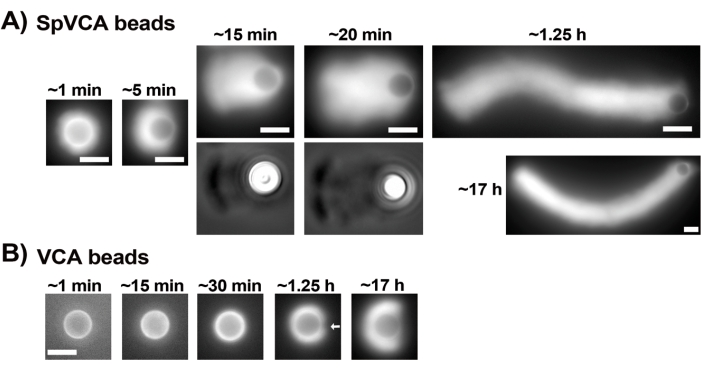
그림 2: VCA 코팅 비드와 달리 SpVCA 코팅 비드에서의 혜성 형성. (A) 시간 경과에 따라 나타낸 대표적인 SpVCA-코팅 비드 (각 이미지에서 상이한 비드). 혼합 순간부터 시간이 표시됩니다. 액틴 구름은 즉시 형성되고 구름 편광은 혜성을 제공하며 몇 시간 동안 계속 늘어납니다. (b) 시간 경과에 따라 나타낸 대표적인 VCA-코팅 비드 (각 이미지에서 상이한 비드). 액틴 구름 편광 (화살표)의 시작을보기 위해서는 1 시간 이상이 필요하며 긴 잠복기조차도 혜성을 생성하지 않습니다. 모든 이미지는 직경 4.5μm의 비드, 형광 액틴의 에피형광 이미징과 (A)의 15분 및 20분 시점, 스케일 바 = 5μm에 대한 위상차 시각화와 쌍을 이룹니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 3: 혜성 및 비드 속도 분석 . (A) 및 (C) 캡핑 단백질 (CP) 또는 겔 솔린이있는 경우 액틴 구름은 반응의 처음 20 분 동안 편광되어 혜성을 형성하고 혜성은 시간이 지남에 따라 길어집니다. 각 이미지에 대해 표시된 믹싱까지의 시간; 각 이미지는 다른 비드입니다. 비드와 준비 사이에는 약간의 변동성이 있지만 평균적으로 비드는 여기에 설명된 표준 조건에서 분당 미크론/서브미크론(0.2-1μm/분)으로 이동합니다. (B) 시간 경과에 따른 혜성 길이(구슬의 전체 개체군)의 평가를 보여주는 대표적인 그래프. 선형 상관의 기울기는 평균 변위 속도(이 경우 0.24μm/min)에 해당합니다. (D) 캡핑 활성이 없는 경우(캡핑 단백질 또는 겔솔린 없음) 액틴 구름이 비드 주위에 형성되지만 혜성은 형성되지 않습니다. 모든 이미지는 직경 4.5μm의 비드, 형광 액틴의 에피형광 이미징, 스케일 바 = 5μm입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 자세히 설명된 프로토콜은 상업적으로 이용 가능한 단백질을 사용하여 비드 표면에서 액틴 네트워크 성장, 혜성 형성 및 비드 운동성을 얻는 방법을 설명합니다. 그러나 때때로 혜성은 재현 가능하게 관찰되지 않거나 슬라이드와 커버 슬립 사이에서 불균일합니다. 다음 논의에서는 프로토콜의 몇 가지 핵심 사항을 강조하고 조정할 수 있는 몇 가지 매개 변수를 제안합니다. 명심해야 할 한 가지 요소는 혜성 형성과 비드 속도가 온도의 영향을 받으며 25°C보다 훨씬 높거나 23°C 미만의 온도는 혜성 형성에 부정적인 영향을 미치고 재현할 수 없는 데이터를 제공한다는 것입니다. 온도 조절이 가능한 실내에서 온도 제어 현미경 또는 현미경을 사용하는 것이 좋습니다. 형광 현미경으로 혜성을 관찰하기 위해 형광 표지 된 액틴이 운동성 혼합물에 포함되는 경우가 많지만, 혜성의 길이가 비드 직경을 초과하면 비드 옆의 어두운 얼룩으로 위상차 현미경으로도 볼 수 있습니다. 위상차 시각화는 일부 광독성이 회전 디스크를 통해서 도 형광 이미징과 관련이 있기 때문에 타임 랩스 이미징에 더 적합합니다. 구슬은 시간이 지남에 따라 가라앉기 때문에 도립 현미경은 수직 현미경보다 수평 구슬 드리프트가 적고 동영상에 더 적합합니다. 용융 VALAP을 사용하여 슬라이드를 밀봉하는 것은 매니큐어와 같은 물질이 혜성 형성을 방해하기 때문에 중요합니다. 많은 양의 VALAP을 비커로 만든 다음 퍼서 빠르게 녹기 쉬운 작은 비커를 다시 채울 수 있습니다. VALAP은 실온에서 수년간 유효합니다.
또 다른 주요 기술적 측면은 세심한 완충액 및 운동성 혼합 준비입니다. MB13을 준비 할 때, 특히 pH 조정 단계에서주의를 기울여야합니다. MB13의 pH는 ATP 가수 분해를 피하기 위해 NaOH로 중성으로 빠르게 조정되어야하지만 pH가 중성에 가까워짐에 따라 EGTA가 용해되므로 너무 빠르지 않아야합니다. EGTA는 액틴에 결합된 칼슘을 복합체화하기 때문에, 운동성을 부여하여 마그네슘 형태16을 보다 활성으로 혼합해 주기 때문에 핵심 성분이다. MB13은 너무 빨리 또는 너무 느리게 준비되어 차선의 혜성 형성을 제공하거나 전혀 생성하지 않습니다. 추가 요점은 조건을 가지고 놀 때 운동성 믹스에서 KCl 농도를 주의 깊게 추적하는 것입니다. 예를 들어, 반응 믹스에 1x MB13을 사용하고 MB13에서 프로필린, 캡핑 단백질 및 Arp2/3 복합체를 희석하는 경우, 운동성 반응의 최종 KCl 농도는 G-완충액에 의한 희석으로 인해 약 40-50mM입니다. 이 농도는 혜성 분석에서 최상의 결과를 제공하며, 60mM KCl 이상이면 Arp2/3 복합 핵형성 활성이 감소합니다.
단백질 측면에서 액틴 혜성을 얻는 데 중요한 기술적 측면은 상업용 액틴 결합 단백질의 적절한 취급, 특히 마이크로리터 양의 정밀한 피펫팅입니다. Bradford 표준 곡선의 선형성은 피펫팅에 대한 좋은 테스트이며 곡선은 단백질 농도의 일상적인 측정에 사용할 수 있습니다. 실제로, 혜성 절차에 재현탁 상용 단백질을 사용할 때는 재현탁 중 배치 변동성과 사용자 오류로 인해 실제 농도와 예상 농도 간에 차이가 발생할 수 있으므로 항상 단백질 농도를 확인하는 것이 중요합니다. 때로는 단백질 농도의 작은 차이로 인해 혜성이 완전히 없어 질 수 있습니다.
여기에 제시된 방법의 또 다른 중요한 측면은 중합을위한 연료로서 프로파일 린 복합체 G- 액틴의 사용이다. 역사적으로, 시험관 내 시스템은 액틴 공급원으로서 사전 중합 된 필라멘트 액틴 (F- 액틴)을 사용했다 : 표면10,17에 벌크 공급 중합에서의 해중합. 이것은 G- 액틴 수준을 제어하는 이점이 있었지만 해중합을 촉매하기 위해 추가 구성 요소가 필요한 복잡성 층을 추가했습니다. 액틴 네트워크의 회전율은 비드 표면에서 핵 생성 및 중합에 의해 연료가 공급되는 힘 생성 및 운동성에 필요하지 않은 반면, ADF/코필린과 같은 액틴 해중합 인자는 표면(18)에서 멀리 떨어진 노화된 네트워크에 작용하기 때문에 액틴 기반 운동성의 대부분의 시험관 내 재구성은 이제 단순성을 위해 회전율 없이 수행됩니다. 그러나 G- 액틴을 사용하는 데는 몇 가지 단점이 있습니다. 첫째, 동결 건조 된 상업용 액틴을 사용할 때, 올리고머가 존재한다. 여기에 설명된 해중합 단계는 재현 가능한 결과를 얻는 데 매우 중요합니다. 특히, G- 완충액은 전통적으로 pH 8로 조정되지만, 낮은 pH (예 : pH 7)는이 기사에 설명 된 분석에서 더 잘 작동하는 것으로 보이며, 이는 아마도 낮은 pH가 해중합을 향상시키기 때문입니다19. G- 액틴을 사용하는 또 다른 단점은 일단 중합에 허용되는 염 조건에 놓이면 자발적인 핵 생성이 일어나고 F- 액틴이 비드 표면뿐만 아니라 벌크에서 형성된다는 것입니다. G- 액틴과 프로파일 린을 복합체화하면 벌크 및 뾰족한 말단 중합에서 자발적인 핵 형성이 억제되어 표면(20)에서 핵 생성 및 가시 말단 중합이 모두 집중됩니다. Profilin-G- 액틴은 세포에있는 많은 액틴이이 형태21에 존재하기 때문에 생리 학적으로 관련이 있습니다. 여기서는 프로필린:액틴의 1:1 비율이 사용됩니다. 그러나 더 높은 비율 (예 : 3 : 1)은 벌크에서의 중합을보다 철저하게 억제하지만, 더 높은 비율은 Arp2 / 3 복합체 및 가시 끝 신장을 어느 정도 억제합니다22,23.
캡핑 활동은 또한 표면 활성화 Arp2/3 복합체24,25에 의한 핵 생성 주기를 통해 표면에 새로운 액틴의 삽입을 보장하기 때문에 혜성 형성의 핵심입니다. 캡핑하지 않으면, 액틴 구름은 혜성을 형성하기 위해 대칭을 깨뜨리지 않는데, 이는 표면에서의 중합이 구름을 깨뜨릴 만큼 충분한 장력을 형성하지 않기 때문이다(26). 과거에는 가정용 정제 재조합 마우스 캡핑 단백질 13을 사용했지만,이 기사를 위해 수행 된 테스트는 상업적으로 이용 가능한 재조합 인간 캡핑 단백질이 상업적으로 이용 가능한 겔 솔린과 마찬가지로 똑같이 효과적이라는 것을 나타내지 만10 배 더 많은 겔솔린을 사용해야하며 특정 용도의 경우 액틴 절단 활성과 캡핑27이 있기 때문에 적절하지 않을 수 있습니다.
마지막으로이 방법의 견고성은 매우 활성 인 Arp2 / 3 복합 활성화 제 인 스트렙 타비 딘 -pVCA (SpVCA) 28의 사용에 있습니다. SpVCA는 Arp2/3 복합체 결합 도메인 이외에 WASP의 프로필린-G-액틴 결합 도메인(p 도메인)을 포함하며, 이는 프로프로필린-G-액틴 조건29에서 가장 효율적인 것으로 밝혀졌다. 더욱 중요한 것은, 원래 비오틴-스트렙타비딘 링크를 통한 표면 기능화를 허용하기 위해 도입된 스트렙타비딘 태그의 사용은 아마도 스트렙타비딘이 사량체이고 따라서 Arp2/3 복합체 활성을 증가시키는 것으로 알려진 활성화제를 클러스터링한다는 사실 때문에 Arp2/3 복합체 활성화를 증가시키는 추가적인 효과를 갖는다.30 . 상업적으로 생산된 SpVCA는 현재 개발 중이며 곧 구매할 수 있습니다. 40μL의 2μM SpVCA가3cm2 의 비드 표면을 코팅하는 데 일상적으로 사용되지만 다른 코팅 농도(더 높거나 낮음)도 작동하며 이러한 조건에서 재생하면 혜성 성장 속도와 형태가 다릅니다. 실제로, 혜성이 형성되지 않거나 혜성 크기가 슬라이드에서 균질하지 않은 경우, 운동성 혼합물에서 다른 KCl 및 프로파일 린 농도뿐만 아니라 다른 코팅 조건을 테스트해야합니다. 운동성 혼합물에서 액틴, Arp2/3 복합체 및 캡핑 단백질의 농도도 혜성 형성을 최적화하기 위해 변경될 수 있지만 우리 손에서는 이러한 비율을 변경하면 종종 혼란스러운 결과를 얻을 수 있습니다.
결론적으로, 여기에 설명된 방법은 비드 표면 및 운동성 상에서 액틴 조립체를 생성하지만, SpVCA로 기능화될 수 있는 임의의 표면이 사용될 수 있다. 본원에 기재된 바와 같은 흡착이 작동하지 않는 경우에, 스트렙타비딘 잔기는 비오티닐화 후에 SpVCA를 관심 표면에 부착시키는데 사용될 수 있다. 이렇게 형성된 액틴 구조, 혜성 또는 기타는 액틴 네트워크의 상이한 생화학적 및 생물물리학적 측면을 시험하는데 사용될 수 있고, 마이크로피펫, 광학 핀셋 및 레이저 제거(15,26,31,32)를 사용한 물리적 조작에 특히 적합하다. 연구 커뮤니티에 대한 용도 외에도 여기에 설명 된 접근 방식은 학부 생물 물리학 학생들이 대칭 파괴 및 자기 조직화와 같은 활성 물질 개념을 연구하기위한 교육 도구로 적합합니다.
공개
저자는이 기사의 내용과 이해 상충이 없음을 선언합니다.
감사의 말
우리는 LPENS의 새 집 구성원들의 따뜻한 환영, 특히 ABCDJ 팀의 모든 도움과 지원에 진심으로 감사드립니다. JP는 재단 ARC(보조금 PJA 20191209604)의 재정 지원을 인정하고 C.S.는 휴먼 프론티어 과학 프로그램 기구(보조금 RGP0026/2020)의 재정 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| Actin, rabbit muscle, Alexa Fluor 488 conjugate | Invitrogen (ThermoFisher Scientific) | A12373 (recently discontinued) | This product can be replaced with ATTO-488 actin from Hypermol. |
| Actin, rabbit muscle, ATTO-488 | Hypermol | 8153 | |
| Actin, rabbit skeletal muscle | Cytoskeleton | AKL99 | |
| Arp2/3 complex | Cytoskeleton | RP01P | |
| ATP | Sigma | A7699 | |
| BioSpectrometer, basic | Eppendorf | 035739 | |
| Bradford Reagent | Bio-Rad | 500-0006 | |
| BSA, high quality | Sigma | A3059 | |
| BSA standard 2 mg/mL (Pierce) | Thermo Scientific | 23209 | |
| Capping protein (a1b2, mouse recombinant) | Home-purified (Reference 13) | This product will soon be commercially available from Cytoskeleton. | |
| Capping protein (a1b2, human recombinant) | Hypermol | 8322 | |
| Cube, GFP: U-MNIBA3 or U-MWB2 | Olympus | discontinued | Any GFP cube, adapted to the microscope being used, can be used. |
| Dry block, agitating: ThermoMixer C (refrigerated) | Eppendorf | 035963 | |
| ** with SmartBlock, 24 microtubes 2 mL | Eppendorf | 035969 | |
| Gelsolin (human recombinant, His-tagged) | Cytoskeleton | HPG6 | |
| Lanolin | Sigma | 49909 | |
| Microcentrifuge 5427R + rotor | Eppendorf | 934126 | |
| Microscope, upright: BX51 | Olympus | discontinued | Any epifluorescence upright microscope equipped with phase contrast optics can be used. |
| Microscope, inverted: IX70 | Olympus | discontinued | Any epifluorescence inverted microscope equipped with phase contrast optics can be used. |
| Paraffin | Sigma | 76244 | |
| Petroleum jelly: Vaseline | Sigma | 16415 | |
| Pipettes Research Plus | Eppendorf | Gilson pipettes don't work as well for delivery of very small volumes (0.5 µL for example). | |
| **10 µL | 933954 | ||
| **2.5 µL | 933953 | These two sizes are essential, but the use of high-quality pipettes (a full Research Plus set for example) is recommended. | |
| Polystyrene carboxylate beads | Polysciences | ||
| **approx. 1 µm diameter | 08226 | ||
| **approx. 4.5 µm diameter | 17140-5 | ||
| Profilin 1 (human recombinant, untagged) | Cytoskeleton | PR02 | |
| SpVCA (human WASP pVCA domain, N-ter His-tag, C-ter Streptavidin tag) | Home-purified (Reference 14) | This product will soon be commercially available from Cytoskeleton. | |
| VCA (human WASP VCA domain, GST-tagged) | Cytoskeleton | VCG03 |
참고문헌
- Campellone, K. G., Welch, M. D. A nucleator arms race: cellular control of actin assembly. Nature Reviews Molecular Cell Biology. 11 (4), 237-251 (2010).
- Pollard, T. D. Rate constants for the reactions of ATP- and ADP-actin with the ends of actin filaments. Journal of Cell Biology. 103, 2747-2754 (1986).
- Blanchoin, L., Boujemaa-Paterski, R., Sykes, C., Plastino, J. Actin dynamics, architecture and mechanics in cell motility. Physiological Reviews. 94 (1), 235-263 (2014).
- Tilney, L. G., Tilney, M. S. The wily ways of a parasite: induction of actin assembly by Listeria. Trends in Microbiology. 1 (1), 25-31 (1993).
- Moore, A. S., et al. Actin cables and comet tails organize mitochondrial networks in mitosis. Nature. 591 (7851), 659-664 (2021).
- Taunton, J., et al. Actin-dependent propulsion of endosomes and lysosomes by recruitment of N-WASP. Journal of Cell Biology. 148 (3), 519-530 (2000).
- Velarde, N., Gunsalus, K. C., Piano, F. Diverse roles of actin in C. elegans early embryogenesis. BMC Developmental Biology. 7, 142 (2007).
- Merrifield, C. J., et al. Endocytic vesicles move at the tips of actin tails in cultured mast cells. Nature Cell Biology. 1 (1), 72-74 (1999).
- Samarin, S., et al. How VASP enhances actin-based motility. Journal of Cell Biology. 163 (1), 131-142 (2003).
- Bernheim-Groswasser, A., Wiesner, S., Golsteyn, R. M., Carlier, M. -. F., Sykes, C. The dynamics of actin-based motility depend on surface parameters. Nature. 417 (6886), 308-311 (2002).
- Boujemaa-Paterski, R., et al. Network heterogeneity regulates steering in actin-based motility. Nature Communications. 8 (1), 655 (2017).
- Akin, O., Mullins, R. D. Capping protein increases the rate of actin-based motility by promoting filament nucleation by the Arp2/3 complex. Cell. 133 (5), 841-851 (2008).
- Palmgren, S., Ojala, P. J., Wear, M. A., Cooper, J. A., Lappalainen, P. Interactions with PIP2, ADP-actin monomers, and capping protein regulate the activity and localization of yeast twinfilin. Journal of Cell Biology. 155 (2), 251-260 (2001).
- Carvalho, K., et al. Actin polymerization or myosin contraction: two ways to build up cortical tension for symmetry breaking. Philosophical Transactions of the Royal Society B. 368 (1629), 20130005 (2013).
- Marcy, Y., Prost, J., Carlier, M. -. F., Sykes, C. Forces generated during actin-based propulsion: a direct measurement by micromanipulation. Proceedings of the National Academy of Sciences of the United States of America. 101 (16), 5992-5997 (2004).
- Carlier, M. -. F. Actin: protein structure and filament dynamics. Journal of Biological Chemistry. 266 (1), 1-4 (1991).
- Loisel, T. P., Boujemaa, R., Pantaloni, D., Carlier, M. F. Reconstitution of actin-based motility of Listeria and Shigella using pure proteins. Nature. 401 (6753), 613-616 (1999).
- Reymann, A. -. C., et al. Turnover of branched actin filament networks by stochastic fragmentation with ADF/cofilin. Molecular Biology of the Cell. 22 (14), 2541-2550 (2011).
- Wioland, H., Jegou, A., Romet-Lemonne, G. Quantitative variations with pH of Actin Depolymerizing Factor/Cofilin's multiple actions on actin filaments. Biochemistry. 58 (1), 40-47 (2019).
- Plastino, J., Blanchoin, L. Dynamic stability of the actin ecosystem. Journal of Cell Science. 132 (4), 219832 (2019).
- Pollard, T. D., Blanchoin, L., Mullins, R. D. Molecular mechanisms controlling actin filament dynamics in nonmuscle cells. Annual Review of Biophysics and Biomolecular Structure. 29, 545-576 (2000).
- Suarez, C., et al. Profilin regulates F-actin network homeostasis by favoring formin over Arp2/3 complex. Developmental Cell. 32 (1), 43-53 (2015).
- Courtemanche, N., Pollard, T. D. Interaction of profilin with the barbed end of actin filaments. Biochemistry. 52 (37), 6456-6466 (2013).
- Achard, V., et al. A "primer"-based mechanism underlies branched actin filament network formation and motility. Current Biology. 20 (5), 423-428 (2010).
- Sykes, C., Plastino, J. Actin filaments up against a wall. Nature. 464 (7287), 365-366 (2010).
- vander Gucht, J., Paluch, E., Plastino, J., Sykes, C. Stress release drives symmetry breaking for actin-based movement. Proceedings of the National Academy of Sciences of the United States of America. 102 (22), 7847-7852 (2005).
- McGough, A. M., Staiger, C. J., Min, J. -. K., Simonetti, K. D. The gelsolin family of actin regulatory proteins: modular structures, versatile functions. FEBS Letters. 552 (2-3), 75-81 (2003).
- Abou-Ghali, M., et al. Capping protein is not necessary for polarized actin network growth and actin based motility. Journal of Biological Chemistry. 295, 15366-15375 (2020).
- Yarar, D., D'Alessio, J. A., Jeng, R. L., Welch, M. D. Motility determinants in WASP family proteins. Molecular Biology of the Cell. 13 (11), 4045-4059 (2002).
- Padrick, S. B., et al. Hierarchical regulation of WASP/WAVE proteins. Molecular Cell. 32 (3), 426-438 (2008).
- Bussonier, M., et al. Mechanical detection of a long-range actin network emanating from a biomimetic cortex. Biophysical Journal. 107 (4), 854-862 (2014).
- Paluch, E., vander Gucht, J., Joanny, J. -. F., Sykes, C. Deformations in actin comets from rocketing beads. Biophysical Journal. 91 (8), 3113-3122 (2006).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유