A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
تقييم التئام كسور العظام باستخدام التصوير المقطعي المحوسب الدقيق
* These authors contributed equally
In This Article
Summary
التصوير المقطعي المحوسب الدقيق (μCT) هو أداة تصوير غير مدمرة مفيدة في تقييم بنية العظام في الدراسات قبل السريرية ، ولكن هناك نقص في الإجماع على إجراءات μCT لتحليل الكالس الشافي للعظام. توفر هذه الدراسة بروتوكول μCT خطوة بخطوة يسمح بمراقبة التئام الكسور.
Abstract
التصوير المقطعي المحوسب الدقيق (μCT) هو طريقة التصوير الأكثر شيوعا لتوصيف مورفولوجيا ثلاثية الأبعاد (3D) للعظام والعظام المشكلة حديثا أثناء التئام الكسور في التحقيقات العلمية الانتقالية. عادة ما تتضمن دراسات التئام كسور العظام الطويلة في القوارض الشفاء الثانوي وتشكيل الكالس المعدني. قد يختلف شكل الكالس المتشكل وكثافة العظم المتشكل حديثا اختلافا كبيرا بين النقاط الزمنية والعلاجات. في حين أن المنهجيات القياسية لتحديد معلمات العظم القشري والتربيقي السليم تستخدم على نطاق واسع ومضمنة في البرامج المتاحة تجاريا ، هناك نقص في الإجماع على إجراءات تحليل الكالس الشافي. الغرض من هذا العمل هو وصف بروتوكول موحد يحدد كمية جزء حجم العظام وكثافة الكالس المعدنية في الكالس الشافي. يصف البروتوكول المعلمات المختلفة التي يجب مراعاتها أثناء التصوير والتحليل ، بما في ذلك محاذاة العينة أثناء التصوير ، وحجم حجم الاهتمام ، وعدد الشرائح التي يتم تحديدها لتحديد الكالس.
Introduction
تم استخدام التصوير المقطعي المحوسب الدقيق (μCT) على نطاق واسع في أبحاث العظام قبل السريرية ، مما يوفر صورا غير جراحية عالية الدقة لتقييم البنية المجهرية للعظام1،2،3،4،5. يتضمن μCT عددا كبيرا من صور الأشعة السينية ، التي تم الحصول عليها من عينة دوارة أو باستخدام مصدر وكاشف دوار للأشعة السينية. تستخدم الخوارزميات لإعادة بناء البيانات الحجمية 3D في شكل كومة من شرائح الصور. التصوير المقطعي المحوسب السريري هو المعيار الذهبي للتصوير ثلاثي الأبعاد للعظام البشرية ، و μCT هي تقنية شائعة الاستخدام لتقييم كفاءة شفاء العظام في التجارب1،2،3،4،6،7. العظام المعدنية لديها تباين ممتاز مع الأشعة السينية ، في حين أن الأنسجة الرخوة لديها تباين ضعيف نسبيا ما لم يتم استخدام عامل تباين. في تقييم التئام الكسور ، يولد μCT صورا توفر معلومات مفصلة حول بنية 3D وكثافة الكالس المعدني. يمكن أيضا استخدام المسح الضوئي μCT في الجسم الحي للتقييم الطولي والزمني لالتئام الكسور.
إن القياس الكمي للعظام القشرية والتربيقية السليمة باستخدام μCT راسخ وموحدبشكل عام 8. على الرغم من أن الدراسات قبل السريرية تستخدم مجموعة متنوعة من منهجيات القياس الكمي لتحليل التئام الكسور9،10،11 ، إلا أنه لم يتم نشر بروتوكول مفصل لتحليل صور μCT لقياس الكالس بعد. لذلك ، فإن الهدف من هذه الدراسة هو توفير بروتوكول مفصل خطوة بخطوة لتصوير μCT وتحليل الكالس شفاء العظام.
Protocol
تم تطوير البروتوكول التالي لتوصيف الكالس الشافي للعظام الطويلة الذي يتم حصاده من الفئران الرحيم. ومع ذلك ، يمكن تطبيق معظم الخطوات على الفئران وتستخدم أيضا للمسح في الجسم الحي للعظام المكسورة. يصف البروتوكول نظام μCT معين وبرنامج محدد لمعالجة الصور وتحليلها وتصورها (انظر جدول المواد) ، ومع ذلك فإن المنهجية قابلة للتطبيق بشكل عام على الماسحات الضوئية والبرامج الأخرى. تمت الموافقة على البروتوكول من قبل لجنة رعاية واستخدام الحيوان المؤسسية في كلية الطب بجامعة ولاية بنسلفانيا. كانت الفئران المستخدمة في هذه الدراسة تبلغ من العمر 16 أسبوعا ، ذكور الفئران C57BL / 6J (متوسط الوزن 31.45 ± 3.2 جم).
1. حصاد الأنسجة وحفظها
ملاحظة: استخدم نموذج كسر الفئران المناسب. في هذه الدراسة ، تم استخدام نموذج كسر الظنبوب المفتوح في منتصف الحجاب وفقا للبروتوكول القياسي الموصوف في12،13.
- في نهاية تجربة نموذج الكسر ، القتل الرحيم للفأر عن طريق إعطاء حقنة داخل الصفاق من الكيتامين أو الزيلازين (500 مجم / كجم أو 50 مجم / كجم ، على التوالي).
- باستخدام المقص ، احصد العظم المكسور من منتصف عظم الفخذ إلى المفصل الظنبوبي دون إزعاج موقع الكسر. قم بإزالة العضلات المحيطة بالعظم مع ترك الأنسجة الرخوة التي هي على اتصال مباشر مع العظام فقط لدعم موقع الكسر أثناء خطوات المعالجة اللاحقة. إزالة دبوس داخل النخاع باستخدام ملقط مرقئ البعوض الصغير.
- حفظ العينات في الفورمالين عند 4 درجات مئوية أو في محلول ملحي عند -20 درجة مئوية. يعتمد اختيار مركبة الحفظ على التطبيقات المقصودة في اتجاه مجرى النهر إلى μCT. في هذه الدراسة ، تم حفظ العينات في محلول ملحي عند -20 درجة مئوية.
2. المسح الضوئي μCT
- إعداد العينة
- للمسح المتزامن لعينات متعددة ، ضع ما يصل إلى ست عينات في تركيبات مسح ضوئي مطورة خصيصا ومطبوعة 3D (الشكل 1 أ ، ب) أو ما شابه ذلك. يقلل المسح الضوئي المتزامن من وقت المسح الضوئي وتكلفته. تحتوي التركيبات المخصصة المستخدمة في هذه الدراسة على ست فتحات للاحتفاظ بعينات العظام الطويلة وفتحة مركزية لشبح هيدروكسيباتيت (HA) (الشكل 1 أ ، ب ؛ جدول المواد).
ملاحظة: سيعمل HA phantom كمعيار في الخطوة 4.2 (انظر أدناه) لتحويل وحدات μCT (عادة Hounsfield) إلى كثافة HA (mgHA / ccm). - ضع التركيبات المعدة في حقنة أو أنبوب مخروطي مشابه لقطر مجال الرؤية (FOV ؛ الشكل 1 ج). في هذه الدراسة ، تم استخدام حقنة 20 مم لتتناسب مع مجال الرؤية 21.5 مم.
- لمنع العينات من الجفاف أثناء عملية المسح ، املأ المحقنة أو الأنبوب المتعارف عليه بالمادة الحافظة المستخدمة في الخطوة 1.3 (تم استخدام محلول ملحي في هذه الدراسة).
- للمسح المتزامن لعينات متعددة ، ضع ما يصل إلى ست عينات في تركيبات مسح ضوئي مطورة خصيصا ومطبوعة 3D (الشكل 1 أ ، ب) أو ما شابه ذلك. يقلل المسح الضوئي المتزامن من وقت المسح الضوئي وتكلفته. تحتوي التركيبات المخصصة المستخدمة في هذه الدراسة على ست فتحات للاحتفاظ بعينات العظام الطويلة وفتحة مركزية لشبح هيدروكسيباتيت (HA) (الشكل 1 أ ، ب ؛ جدول المواد).
- المسح الضوئي
- قبل المسح ، تأكد من معايرة آلة μCT على النحو التالي: ضع شبح HA في خط الوسط ل μCT FOV ، وامسح الشبح ، وقم بقياس كثافة HA. تأكد من أن الكثافة المقاسة متوافقة مع الكثافة التي توفرها الشركة المصنعة.
- قم بمحاذاة خط الوسط لتركيبات العينة مع خط الوسط التقريبي ل μCT FOV. هذا يضمن أن العينات داخل مجال الرؤية ، وأن محاورها الطويلة لها اتجاه يتزامن تقريبا مع الاتجاه المحوري للصور الناتجة.
ملاحظة: يمكن أن يساعد هذا التوجه الموحد لاحقا في جعل إجراء التحليل أقل عرضة للتغيرات مثل كمية الأنسجة التي تعتبر ضمن حجم الاهتمام. - اضبط معلمات المسح لنظام μCT (جدول المواد). المعلمات المستخدمة في هذه الدراسة هي 10.5 ميكرومتر (حجم فوكسل الخواص) ، 55 كيلو فولت (الطاقة / الشدة) ، 145 ميكروأمبير (التيار) ، و 300 مللي ثانية (وقت التكامل). حدد حجم الفوكسل بناء على السماكة التقريبية لترابيق الفأر (20-60 ميكرومتر)8. افحص الفحص بصريا في طرق عرض مختلفة للتأكد من أنه يغطي الحجم الكامل لجميع عينات الكالس.

الشكل 1: هيكل تركيبات المسح المخصصة. (أ) صور لتركيبات المسح (أعلى) ، توضح فتحات العينات الست ، وشبح HA (أسفل). (B) صور توضح عينة العظم الطويل (أعلى) وشبح HA (أسفل) موضوعة في الفتحات المخصصة. (ج) صور توضح أداة المسح الموضوعة في حقنة عيار 20 مم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
3. تجزئة الصورة
ملاحظة: يتم إعادة إنشاء الصور الأولية تلقائيا إلى بيانات تسلسل الصور.
- تحويل الصور: تحويل بيانات تسلسل الصور المعاد بناؤها إلى تسلسلات صور DICOM باستخدام برنامج معالجة الصور (انظر جدول المواد). استيراد تسلسلات صور DICOM إلى البرنامج (انظر جدول المواد) لمعالجة الصور وتحليلها وتصورها (الشكل 2 أ).
- اقتصاص الصورة: عينة واحدة في كل مرة ، قم بقص كل مكدس صور وتأكد من تضمين العينة بأكملها في الحجم الذي تم اقتصاصه (الشكل 2B). احفظ الصورة التي تم اقتصاصها كما يلي: انقر فوق علامة التبويب ملف في الجانب العلوي الأيسر من الشاشة، وحدد حفظ المشروع، ثم حدد تصغير حجم المشروع من الخيارات التي تظهر على الشاشة. سيتم حفظ الملف بتنسيق البرنامج التجاري.
- تقليل تشويش الصورة: استخدم طريقة تصفية لتقليل مستوى الضوضاء وتجنب التمويه على النحو التالي.
- انقر فوق علامة التبويب ملف واختر الصورة المراد معالجتها باستخدام Open Data. ستظهر الصورة المفتوحة في نافذة عرض المشروع في الزاوية العلوية اليسرى من الشاشة.
- انقر بزر الماوس الأيمن لتحديد معالجة الصور ثم تصفية وضع الحماية. انقر على إنشاء.
- قم بما يلي في نافذة الخصائص (في الزاوية السفلية اليسرى من الشاشة): اختر البيانات كنوع المعاينة ؛ حدد نوع المرشح من القائمة المنسدلة بجوار تصفية ؛ اختيار 3D للتفسير ؛ تحديد قابل للفصل من القائمة المنسدلة بجوار نوع kernel ؛ املأ القيم التي سيتم استخدامها للانحراف المعياري وعامل حجم النواة في المربع الفارغ المتاح بجوار كل منهما ؛ حدد نفس الإدخال من القائمة المنسدلة بجوار الإخراج ؛ انقر على تطبيق.
ملاحظة: يعتمد اختيار نوع المرشح (الخيارات المتاحة هي ثنائية ، ومربعة ، وغاوسية ، ومتوسطة ، وأسية متكررة ، ومحددة ، وانتشار متباين الخواص ، ووسائل غير محلية ، وإخفاء غير حاد ، ومرشح FFT) والمعلمات على مستوى الضوضاء وحجم فوكسل للصور الممسوحة ضوئيا. بالنسبة لمرشح Gaussian ، 3 × 3 × 3 و 5 × 5 × 5 هي قيم شائعة الاستخدام لعامل حجم النواة ، ويستخدم 0.5-2.0 بشكل شائع للانحراف المعياري8. في هذه الدراسة ، تم تطبيق مرشح Gaussian ، وتم استخدام 5 × 5 × 5 و 0.8 لعامل حجم النواة والانحراف المعياري ، على التوالي.
- إعادة محاذاة الصورة
ملاحظة: هذه خطوة اختيارية. عند حدوث اختلال في محاذاة عينات العظام الطويلة بالنسبة إلى محاور إحداثيات نظام التصوير أثناء عملية المسح ، يمكن تطبيق طريقة محاذاة رقمية لتصحيح عدم المحاذاة (الشكل 2C).- قم بإنشاء صورة 3D معروضة للعينة على النحو التالي. في نافذة عرض المشروع، حدد الصورة التي تمت تصفيتها والتي تم اقتصاصها (تم إنشاؤها في الخطوة 3.3). انقر بزر الماوس الأيمن لتحديد العرض ثم عرض وحدة التخزين من القائمة المنسدلة ، ثم انقر فوق إنشاء. تحقق بصريا من الصورة المقدمة 3D في الطائرات السهمية والأمامية.
- قم بتدوير مستوى الصوت المعروض يدويا للحصول على محاذاة جيدة في المحور الطولي. قم بتطبيق التحويل على الصور التي تم تدويرها على النحو التالي: في نافذة الخصائص ، انقر فوق محرر التحويل ، ثم انتقل إلى محول المحرر وحدد محول من القائمة المنسدلة. الآن يمكن تدوير العينة وإعادة محاذاتها. بمجرد الانتهاء من عملية إعادة المحاذاة ، انقر فوق محرر التحويل مرة أخرى لقفل الصورة.
- أعد تشكيل الصورة التي تمت تصفيتها (التي تم إنشاؤها في الخطوة 3.3) لإنشاء شرائح صورة مستوية عرضية (محورية) جديدة كما يلي: في نافذة عرض المشروع، حدد الصورة من الخطوة 3.4.2. انقر بزر الماوس الأيمن لتحديد تحويل هندسي ثم إعادة تشكيل الصورة المحولة من القائمة المنسدلة وانقر فوق إنشاء. في نافذة الخصائص ، انتقل إلى البيانات وقم بما يلي: للاستيفاء ، حدد قياسي من القائمة المنسدلة ؛ للوضع ، اختر ممتد ؛ للحفظ ، اختر حجم Voxel ؛ لقيمة الحشو، أدخل صفر في المربع الفارغ المتاح. ثم انقر فوق تطبيق.
- تحديد حجم الفائدة (VOI)
- انتقل من خلال شرائح الصورة المستعرضة وحدد المستوى المركزي للكسر الكالس المكسور. حدد VOI بناء على النهايات القريبة والبعيدة للكالس. في الحالات التي يصعب فيها تحديد نهايات الكالس ، حدد VOI بناء على مسافة موحدة بعيدا عن مستوى مركز الكالس (الشكل 2D).
ملاحظة: خلال مراحل الشفاء التي تسبق إعادة تشكيل العظام ، يكون تحديد حواف الكالس المعدني أمرا سهلا لأن البنية التربيقية للعظم المنسوج المتشكل حديثا تختلف عن البنية القشرية للعظم الأصلي. ومع ذلك ، عندما تترتب على ذلك مرحلة إعادة البناء ، يكتسب العظم المشكل حديثا البنية القشرية تدريجيا. وبالتالي ، يصبح تحديد حواف الكالس أمرا صعبا بشكل متزايد.
- انتقل من خلال شرائح الصورة المستعرضة وحدد المستوى المركزي للكسر الكالس المكسور. حدد VOI بناء على النهايات القريبة والبعيدة للكالس. في الحالات التي يصعب فيها تحديد نهايات الكالس ، حدد VOI بناء على مسافة موحدة بعيدا عن مستوى مركز الكالس (الشكل 2D).

الشكل 2: تجزئة الصورة. أ: صورة توضح ست عينات في مسح واحد. (ب) اقتصاص الصور لعزل العينات الفردية. (C) محاذاة رقمية لتصحيح محور طولي غير محاذ (خط منقط أصفر). د: تعريف مستوى مركز صوت الخلوة ومستوى مركز الكالس. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. تحليل الصور
- تجزئة الكالس والعظم القشري
- حدد الحدود الخارجية للكالس بشكل شبه تلقائي باستخدام أداة التجزئة lasso مع خيارات التتبع التلقائي وحواف التتبع (الشكل 3A) على النحو التالي:
- بعد إعادة تجميع الصور المحولة (الخطوة 3.4.3) ، انقر فوق علامة التبويب تجزئة في صف علامة التبويب الثاني من أعلى الشاشة. في نافذة محرر التجزئة ، حدد صورة محولة (تم إنشاؤها في الخطوة 3.4.3) من القائمة المنسدلة بجوار الصورة.
- في نافذة المواد ، انقر نقرا مزدوجا فوق إضافة ؛ من خلال القيام بذلك ، ستظهر علامتا تبويب باسم material3 و material4. انقر بزر الماوس الأيمن لإعادة تسمية material3 إلى الكالس والمواد 4 إلى العظم القشري.
- في نافذة التحديد ، انقر فوق رمز lasso ؛ من الخيارات التي تظهر، حدد Freehand لوضع 2D، و Inside لوضع 3D، وكل من حواف التتبع التلقائي و Trace للخيارات. استخدم اللاسو لتحديد مناطق الاهتمام.
- كرر خطوة الكنتوري هذه مع أخذ عينات من شرائح عبر VOI (الشكل 3B). يمكن تباعد الشرائح المحددة (على سبيل المثال ، مفصولة ب 20 شريحة).
ملاحظة: في المناطق ذات هياكل الكالس المعقدة ، يمكن للمستخدم التفكير في تقليل التباعد بين الشرائح المحددة لالتقاط المزيد من الأجزاء (الشكل 3 أ ، ب). - قم بالاستيفاء عبر مخططات الكالس المحددة لإنشاء تسمية الكالس كاملة (الشكل 3C ، D) على النحو التالي: في نافذة المواد ، اختر ملف Callus (تم إنشاؤه في الخطوة 4.1.1.2.) ، وانقر فوق علامة التبويب التحديد في الجزء العلوي من الشاشة ، وحدد استيفاء من القائمة المنسدلة. في نافذة التحديد ، انقر فوق علامة الجمع.
- افتح ملف العظم القشري الذي تم إنشاؤه في الخطوة 4.1.1.2. قسم العظم القشري ، بما في ذلك التجويف النخاعي ، كما هو موضح للكالس في الخطوتين 4.1.1 و 4.1.2. (الشكل 4 أ ، ب). قم باستيفاء قشرة السمحاق المحيطية لإنشاء ملصق عظمي قشري كما هو موضح للكالس في الخطوة 4.1.3 (الشكل 4C ، D).
- احسب الحجم المحيطي ومتوسط القيمة الرمادية للكالس على النحو التالي: انقر فوق علامة التبويب تجزئة في الصف العلوي من الشاشة وحدد إحصائيات المواد من القائمة المنسدلة. سيؤدي هذا إلى إنشاء جدول يحتوي على جميع القيم المحسوبة. يتم توفير قيم العظم القشري والكالس (بعد طرح العظم القشري) بشكل منفصل. بمجرد إنشاء الجدول، انقر على تصدير إلى مساحة العمل لحفظ البيانات.
- حدد الحدود الخارجية للكالس بشكل شبه تلقائي باستخدام أداة التجزئة lasso مع خيارات التتبع التلقائي وحواف التتبع (الشكل 3A) على النحو التالي:
- تحويل وحدات التدرج الرمادي إلى كثافة المعادن في العظام
- قم بقص الصورة ثلاثية الأبعاد لشبح HA مقاس 4.5 مم (الشكل 2ب) من الصورة بأكملها وانقر فوق تجزئة. يحتوي راتنج HA phantom على خمس أسطوانات HA صغيرة (الشكل 1 أ). بالنسبة لأسطوانة HA ذات الكثافة الأعلى ، حدد الشرائح الأولى والأخيرة عن طريق الفحص البصري.
- ارسم دائرتين في الشريحتين الأولى والأخيرة (تجنب الحواف) باستخدام أداة الفرشاة (الشكل 5 أ) على النحو التالي: في نافذة المواد ، انقر فوق إضافة أربع مرات. انقر بزر الماوس الأيمن لإعادة تسمية material3 و material4 و material5 و material6 إلى phantom1 و phantom2 و phantom3 و phantom4 على التوالي. حدد Phantom1 ، وانقر فوق أيقونة الفرشاة في نافذة SELECTION واستخدم شريط التمرير لضبط حجم الفرشاة (التتبع الدائري) بناء على حجم الوهمية (يجب أن يكون حجم الدائرة أصغر من حجم الشبح).
- قم بتطبيق الاستيفاء بين الدائرتين لإنشاء وحدة تخزين لكل أسطوانة HA (الشكل 5B) على النحو التالي: في نافذة المواد ، حدد Phantom1 ، وانقر فوق علامة التبويب التحديد في الصف العلوي من الشاشة ، وحدد استيفاء من القائمة المنسدلة. في نافذة التحديد ، انقر فوق علامة الجمع.
- كرر عملية التجزئة بثلاث من أسطوانات HA المتبقية ، بدءا من ثاني أعلى كثافة HA وتنتهي بثاني أدنى كثافة HA (الشكل 5B). يمكن استبعاد الأسطوانة ذات الكثافة الأقل HA لأنه غالبا ما يكون من الصعب تقسيمها.
- استخدم ملصقات 3D التي تم إنشاؤها لحساب متوسط القيم الرمادية لأسطوانات HA الأربعة التي تم تحليلها. باستخدام جدول بيانات (انظر جدول المواد) أو ما شابه ذلك ، ارسم متوسط القيم الرمادية وقيم كثافة المعادن في العظام المقابلة (BMD) التي توفرها الشركة المصنعة الوهمية. قم بإنشاء معادلة ارتباط بين BMD والقيم الرمادية باستخدام الانحدار الخطي.
- تجزئة الكالس المعدني وحساب BMD
- استنادا إلى معادلة الارتباط التي تم إنشاؤها في الخطوة 4.2.5 والعتبة المختارة التي تميز الكالس المعدني وغير المعدني ، حدد عتبة القيمة الرمادية المقابلة. وفقا لذلك ، قم بتسمية منطقة الكالس بقيم رمادية أكبر من العتبة على أنها الكالس المعدني وقم بتسمية الباقي على أنه غير معدني (الشكل 6 أ ، ب). في هذه الدراسة ، تم استخدام 250 mgHA / ccm كعتبة للكالس المعدني14,15.
- احسب إجمالي أحجام الكالس والكالس المعدني. بناء على هذه القيم ، احسب جزء حجم العظام (حجم الكالس المعدني الطبيعي إلى إجمالي حجم الكالس = BV / TV). استخدم متوسط القيمة الرمادية المقاسة لإجمالي الكالس لحساب كثافة المعادن المعدنية للكالس باستخدام معادلة الارتباط الناتجة في 4.2.5.
ملاحظة: بناء على هدف الدراسة والبرنامج المستخدم للتحليل ، يمكن حساب معلمات أخرى مثل SMI (مؤشر نموذج الهيكل) وسمك التربيق ودرجة تباين الخواص.

الشكل 3: تجزئة الحد الخارجي للكالس. (أ) محيط الحدود الخارجية للكالس (الخط الأحمر). (ب) الخطوط العريضة عند الشرائح التي تم أخذ عينات منها عبر VOI (شرائح حمراء). (C) تسمية الكالس 3D التي تم إنشاؤها عن طريق الاستيفاء (الحجم الأحمر). د: مقطع عرضي لعلامة الكالس الموضحة بالحرف (ج) (بما في ذلك العظم القشري). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تجزئة العظم القشري. أ: محيط سطح السمحاق للقشرة (الخط الأخضر). (ب) الخطوط عند الشرائح التي تم أخذ عينات منها عبر VOI (شرائح خضراء). (ج) ملصق 3D للعظم القشري (يحتوي على التجويف النخاعي ؛ أخضر) والكالس (أحمر) تم إنشاؤه من ملصقات محفورة من قشرة السمحاق والكالس. د: مقطع عرضي للالكالس (أحمر) والعظم القشري (يحتوي على التجويف داخل النخاع؛ أخضر). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: تحويل الوحدات ذات التدرج الرمادي إلى BMD. (أ) ملامح أسطوانة HA عند الشريحتين الأولى والأخيرة (الدوائر الحمراء). (B) أسطوانات HA المقحمة 3D (يسار) والمقاطع العرضية (يمين). البني: أعلى كثافة HA ؛ الأزرق: ثاني أعلى كثافة HA ؛ البنفسجي: ثالث أعلى كثافة HA ؛ الأخضر: رابع أعلى كثافة HA. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
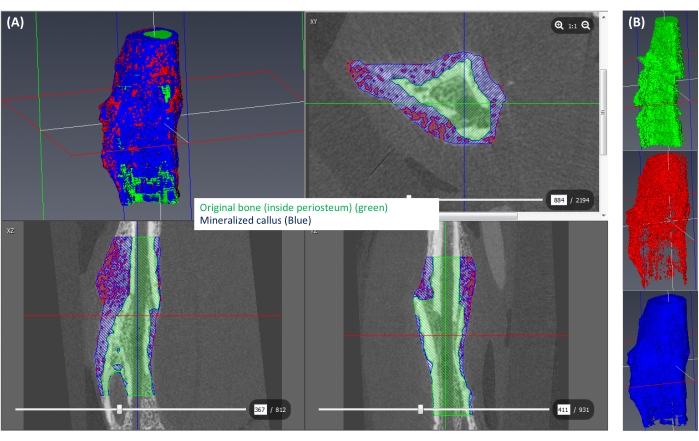
الشكل 6: تجزئة الكالس المعدني . (أ) يظهر الكالس المعدني (≥250 mgHA/ccm) باللون الأزرق، وبقية الكالس (<250 mgHA/ccm) باللون الأحمر، والمساحة المقابلة للعظم الأصلي موضحة باللون الأخضر. (ب) عرض 3D لكل تسمية معزولة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
النتائج
لمراقبة تكوين العظام أثناء التئام الكسور ، تم إحداث كسر في الظنبوب المفتوح في منتصف الحجاب الحاجز في الفئران البالغة C75BL / 6J. تم تثبيت الكسر باستخدام مسمار داخل النخاع ، وهو نموذج راسخ للشفاء الثانوي13. تم حصاد أنسجة الكالس في الأيام 14 و 21 و 28 بعد الكسر12. تمثل هذه الن...
Discussion
الغرض من هذه الدراسة هو وصف بروتوكول مفصل لتحليل μCT بهدف التحديد الكمي الدقيق لهيكل الكالس المعدني 3D ، والذي غالبا ما يكون أساسيا في دراسات التئام العظام والكسور. يستخدم البروتوكول منصة برمجية لتحليل الصور 3D للأغراض العامة تسهل تصور الصور والتجزئة / وضع العلامات والقياسات التي تتراوح من ?...
Disclosures
ليس لدى المؤلفين أي تضارب في المصالح للكشف عنه.
Acknowledgements
تم دعم هذا العمل من قبل المعاهد الوطنية للصحة (NIH) R01 DK121327 إلى R.A.E و R01 AR071968 إلى F.K.
Materials
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher chemical | SF100-20 | Used for bone tissue fixation |
| Avizo | Thermo Scientific | Image processing and analysis software | |
| Hydroxyapatite phantom | Micro-CT HA D4.5, QRM | QRM-70128 | |
| Image Processing Language | Scanco | Used to convert raw images to DICOM images | |
| Micro-Mosquito Straight Hemostatic Forceps | Medline | Used to remove the intramedullary pin | |
| Microsoft Excel | Microsoft | Spreadsheet software | |
| Scanco mCT system (vivaCT 40) | Scanco | Used for µCT imaging |
References
- Rüegsegger, P., Koller, B., Müller, R. A microtomographic system for the nondestructive evaluation of bone architecture. Calcified Tissue International. 58 (1), 24-29 (1996).
- Müller, R., et al. Morphometric analysis of human bone biopsies: a quantitative structural comparison of histological sections and micro-computed tomography. Bone. 23 (1), 59-66 (1998).
- Waarsing, J. H., et al. Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data. Bone. 34 (1), 163-169 (2004).
- Boyd, S. K., Davison, P., Müller, R., Gasser, J. A. Monitoring individual morphological changes over time in ovariectomized rats by in vivo micro-computed tomography. Bone. 39 (4), 854-862 (2006).
- Christiansen, B. A. Effect of micro-computed tomography voxel size and segmentation method on trabecular bone microstructure measures in mice. Bone Reports. 5, 136-140 (2016).
- Holdsworth, D. W., Thornton, M. M. Micro-CT in small animal and specimen imaging. Trends in Biotechnology. 20 (8), 34-39 (2002).
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Morgan, E. F., et al. Micro-computed tomography assessment of fracture healing: Relationships among callus structure, composition, and mechanical function. Bone. 44 (2), 335-344 (2009).
- O'Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50 (6), 1357-1367 (2012).
- Bissinger, O., et al. Fully automated segmentation of callus by micro-CT compared to biomechanics. Journal of Orthopaedic Surgery and Research. 12 (1), 108 (2017).
- Brown, M. L., et al. Delayed fracture healing and increased callus adiposity in a C57BL/6J murine model of obesity-associated type 2 diabetes mellitus. PLOS One. 9 (6), 99656 (2014).
- Khajuria, D. K., et al. Aberrant structure of fibrillar collagen and elevated levels of advanced glycation end products typify delayed fracture healing in the diet-induced obesity mouse model. Bone. 137, 115436 (2020).
- Sigurdsen, U., Reikeras, O., Hoiseth, A., Utvag, S. E. Correlations between strength and quantitative computed tomography measurement of callus mineralization in experimental tibial fractures. Clinical Biomechanics. 26 (1), 95-100 (2011).
- Duvall, C. L., Taylor, W. R., Weiss, D., Wojtowicz, A. M., Guldberg, R. E. Impaired angiogenesis, early callus formation, and late stage remodeling in fracture healing of osteopontin-deficient mice. Journal of Bone and Mineral Research. 22 (2), 286-297 (2007).
- Gerstenfeld, L. C., et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. Journal of Bone and Mineral Research. 24 (2), 196-208 (2009).
- Alentado, V. J., et al. Validation of the modified radiographic union score for tibia fractures (mRUST) in murine femoral fractures. Frontiers in Endocrinology. 13, 911058 (2022).
- Yu, K. E., et al. Enhancement of impaired MRSA-infected fracture healing by combinatorial antibiotics and modulation of sustained inflammation. Journal of Bone and Mineral Research. 37 (1), 1352-1365 (2022).
- Nyman, J. S., et al. Quantitative measures of femoral fracture repair in rats derived by micro-computed tomography. Journal of Biomechanics. 42 (7), 891-897 (2009).
- Fiset, S., et al. Experimental validation of the radiographic union score for tibial fractures (RUST) using micro-computed tomography scanning and biomechanical testing in an in-vivo rat model. The Journal of Bone and Joint Surgery. 100 (21), 1871-1878 (2018).
- Shefelbine, S. J., et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis. Bone. 36 (3), 480-488 (2005).
- Liu, Y., et al. Glucocorticoid-induced delayed fracture healing and impaired bone biomechanical properties in mice. Clinical Interventions in Aging. 13, 1465-1474 (2018).
- Watson, P. J., Fitton, L. C., Meloro, C., Fagan, M. J., Gröning, F. Mechanical adaptation of trabecular bone morphology in the mammalian mandible. Scientific Reports. 8 (1), 7277 (2018).
- Nie, C., Wang, Z., Liu, X. The effect of depression on fracture healing and osteoblast differentiation in rats. Neuropsychiatric Disease and Treatment. 14, 1705-1713 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved