Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Évaluation de la cicatrisation des fractures osseuses à l’aide de la microtomodensitométrie
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La micro-tomodensitométrie (μCT) est un outil d’imagerie non destructif qui joue un rôle déterminant dans l’évaluation de la structure osseuse dans les études précliniques, mais il n’y a pas de consensus sur les procédures de μCT pour analyser le cal de cicatrisation osseuse. Cette étude fournit un protocole de μCT étape par étape qui permet de surveiller la cicatrisation des fractures.
Résumé
La micro-tomodensitométrie (μCT) est la modalité d’imagerie la plus courante pour caractériser la morphologie tridimensionnelle (3D) de l’os et de l’os nouvellement formé au cours de la cicatrisation des fractures dans les recherches en sciences translationnelles. Les études sur la cicatrisation des fractures des os longs chez les rongeurs impliquent généralement une cicatrisation secondaire et la formation d’un cal minéralisé. La forme du cal formé et la densité de l’os nouvellement formé peuvent varier considérablement d’un moment à l’autre et d’un traitement à l’autre. Alors que les méthodologies standard pour quantifier les paramètres de l’os cortical et trabéculaire intact sont largement utilisées et intégrées dans les logiciels disponibles dans le commerce, il n’y a pas de consensus sur les procédures d’analyse du cal en voie de guérison. Le but de ce travail est de décrire un protocole standardisé qui quantifie la fraction volumique osseuse et la densité minérale des callosités dans le cal en voie de guérison. Le protocole décrit différents paramètres qui doivent être pris en compte lors de l’imagerie et de l’analyse, y compris l’alignement de l’échantillon pendant l’imagerie, la taille du volume d’intérêt et le nombre de coupes qui sont profilées pour définir le durillon.
Introduction
L’imagerie par microtomodensitométrie (μCT) a été largement utilisée dans la recherche préclinique sur les os, fournissant des images non invasives à haute résolution pour évaluer la microstructure des os 1,2,3,4,5. La μCT implique un grand nombre d’images de rayons X, obtenues à partir d’un échantillon rotatif ou à l’aide d’une source de rayons X et d’un détecteur rotatifs. Des algorithmes sont utilisés pour reconstruire des données volumétriques 3D sous la forme d’une pile de tranches d’image. La tomodensitométrie clinique est l’étalon-or pour l’imagerie 3D des os humains, et la μTDM est une technique couramment utilisée pour évaluer l’efficacité de la cicatrisation osseuse chez les animaux de laboratoire 1,2,3,4,6,7. L’os minéralisé a un excellent contraste avec les rayons X, tandis que les tissus mous ont un contraste relativement faible à moins qu’un agent de contraste ne soit utilisé. Dans l’évaluation de la cicatrisation des fractures, la μCT génère des images qui fournissent des informations détaillées sur la structure 3D et la densité du cal minéralisé. La tomodensitométrie μCT in vivo peut également être utilisée pour l’évaluation longitudinale et temporelle de la cicatrisation des fractures.
La quantification de l’os cortical et trabéculaire intact à l’aide de la μCT est généralement bien établie et normalisée8. Bien que les études précliniques utilisent une variété de méthodologies de quantification pour analyser la cicatrisation des fractures 9,10,11, un protocole détaillé d’analyse d’images μCT pour la quantification des callosités n’a pas encore été publié. Par conséquent, l’objectif de cette étude est de fournir un protocole détaillé étape par étape pour l’imagerie μCT et l’analyse des callosités de cicatrisation osseuse.
Protocole
Le protocole suivant a été élaboré pour caractériser les callosités de cicatrisation des os longs prélevés sur des souris euthanasiées. Cependant, la plupart des étapes peuvent être appliquées à des rats et également utilisées pour l’imagerie in vivo d’os fracturés. Le protocole décrit un système μCT particulier et un logiciel spécifique de traitement, d’analyse et de visualisation d’images (voir le tableau des matériaux), mais la méthodologie est généralement applicable à d’autres scanners et logiciels. Le protocole a été approuvé par le Comité institutionnel de soins et d’utilisation des animaux de la faculté de médecine de l’Université d’État de Pennsylvanie. Les souris utilisées dans cette étude étaient des souris mâles C57BL/6J âgées de 16 semaines (poids moyen de 31,45 ± 3,2 g).
1. Prélèvement et conservation des tissus
REMARQUE : Utilisez un modèle de fracture murine approprié. Pour cette étude, le modèle de fracture tibiale ouverte diaphysaire moyenne a été utilisé selon le protocole standard décrit en12,13.
- À la fin de l’expérience du modèle de fracture, euthanasier la souris en lui administrant une injection intrapéritonéale de kétamine ou de xylazine (500 mg/kg ou 50 mg/kg, respectivement).
- À l’aide de ciseaux, prélevez l’os fracturé du fémur moyen à l’articulation tibio-talienne sans perturber le site de la fracture. Retirez les muscles entourant l’os, ne laissant que les tissus mous qui sont en contact direct avec l’os pour soutenir le site de fracture pendant les étapes de traitement suivantes. Retirez la broche intramédullaire à l’aide d’une pince hémostatique droite micro-moustique.
- Conserver les échantillons dans du formol à 4 °C ou dans du sérum physiologique à -20 °C. Le choix du véhicule de conservation dépend des applications prévues en aval de μCT. Dans cette étude, les échantillons ont été conservés dans une solution saline à -20 °C.
2. Balayage μCT
- Préparation de l’échantillon
- Pour la numérisation simultanée de plusieurs échantillons, placez jusqu’à six échantillons dans un dispositif de numérisation imprimé en 3D développé sur mesure (Figure 1 A,B) ou similaire. La numérisation simultanée réduit le temps et les coûts de numérisation. Le dispositif personnalisé utilisé dans cette étude contient six fentes pour contenir les échantillons d’os longs et un trou central pour un fantôme d’hydroxyapatite (HA) (Figure 1A,B ; Table des matériaux).
REMARQUE : Le fantôme HA servira de norme à l’étape 4.2 (voir ci-dessous) pour convertir les unités μCT (généralement Hounsfield) en densité HA (mgHA/ccm). - Placez le dispositif préparé dans une seringue ou un tube conique dont le diamètre est similaire à celui du champ de vision (champ de vision ; Graphique 1C). Dans cette étude, une seringue de 20 mm a été utilisée pour correspondre au champ de vision de 21,5 mm.
- Pour éviter que les échantillons ne se dessèchent pendant le processus de numérisation, remplissez la seringue ou le tube canonique avec l’agent de conservation utilisé à l’étape 1.3 (une solution saline a été utilisée dans cette étude).
- Pour la numérisation simultanée de plusieurs échantillons, placez jusqu’à six échantillons dans un dispositif de numérisation imprimé en 3D développé sur mesure (Figure 1 A,B) ou similaire. La numérisation simultanée réduit le temps et les coûts de numérisation. Le dispositif personnalisé utilisé dans cette étude contient six fentes pour contenir les échantillons d’os longs et un trou central pour un fantôme d’hydroxyapatite (HA) (Figure 1A,B ; Table des matériaux).
- Balayage
- Avant le balayage, vérifiez que l’appareil μCT est calibré comme suit : placez un fantôme HA sur l’axe du champ de vision μCT, scannez le fantôme et mesurez la densité de HA. Assurez-vous que la densité mesurée est cohérente avec la densité fournie par le fabricant.
- Alignez l’axe de l’appareil d’échantillonnage avec l’axe médian approximatif du champ de vision μCT. Cela permet de s’assurer que les échantillons se trouvent à l’intérieur du champ de vision et que leurs grands axes ont une orientation coïncidant approximativement avec la direction axiale des images résultantes.
REMARQUE : Cette orientation normalisée peut par la suite contribuer à rendre la procédure d’analyse moins sujette aux variabilités, par exemple en ce qui concerne la quantité de tissu considérée dans le volume d’intérêt. - Définissez les paramètres de balayage du système μCT (Table des matériaux). Les paramètres utilisés dans cette étude sont 10,5 μm (taille de voxel isotrope), 55 kVp (énergie/intensité), 145 μA (courant) et 300 ms (temps d’intégration). Déterminer la taille du voxel en fonction de l’épaisseur approximative des trabécules de souris (20-60 μm)8. Inspectez visuellement l’analyse dans différentes vues pour vous assurer qu’elle couvre tout le volume de tous les échantillons de callosités.

Figure 1 : Structure de l’appareil de balayage personnalisé. (A) Images de l’appareil de balayage (en haut), montrant les six fentes d’échantillonnage, et le fantôme HA (en bas). (B) Images montrant l’échantillon d’os long (en haut) et le fantôme HA (en bas) placés dans les emplacements dédiés. (C) Images montrant l’appareil de balayage placé dans une seringue de 20 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Segmentation des images
REMARQUE : Les images brutes sont automatiquement reconstruites en données de séquence d’images.
- Conversion d’images : convertissez les données de séquence d’images reconstruites en séquences d’images DICOM à l’aide d’un logiciel de traitement d’images (voir Table des matériaux). Importez des séquences d’images DICOM dans le logiciel (voir la table des matériaux) pour le traitement, l’analyse et la visualisation d’images (Figure 2A).
- Recadrage de l’image : un échantillon à la fois, recadrez chaque pile d’images et assurez-vous que l’ensemble de l’échantillon est inclus dans le volume recadré (Figure 2B). Enregistrez l’image recadrée comme suit : cliquez sur l’onglet Fichier en haut à gauche de l’écran, sélectionnez Enregistrer le projet, puis sélectionnez Réduire la taille du projet parmi les options qui s’affichent à l’écran. Le fichier sera enregistré au format logiciel commercial.
- Débruitage de l’image : utilisez une méthode de filtrage pour réduire le niveau de bruit et éviter les flous comme suit.
- Cliquez sur l’onglet Fichier et choisissez l’image à traiter à l’aide d’Open Data. L’image ouverte apparaîtra dans la fenêtre de vue du projet dans le coin supérieur gauche de l’écran.
- Cliquez avec le bouton droit de la souris pour sélectionner Traitement d’image , puis Filtre bac à sable. Cliquez sur Créer.
- Effectuez les opérations suivantes dans la fenêtre Propriétés (dans le coin inférieur gauche de l’écran) : choisissez Données comme type d’aperçu ; sélectionnez le type de filtre dans le menu déroulant à côté de Filtre ; choisir la 3D pour l’interprétation ; sélectionnez Séparable dans le menu déroulant à côté de Type de noyau ; renseignez les valeurs à utiliser pour l’écart-type et le facteur de taille du noyau dans la case vide disponible à côté de chacun d’eux ; sélectionnez Identique à l’entrée dans le menu déroulant à côté de Sortie ; cliquez sur Appliquer.
REMARQUE : Le choix du type de filtre (les options disponibles sont bilatérales, boîte, gaussiennes, médianes, exponentielle récursive, délimitées, diffusion anisotrope, moyennes non locales, masquage flou et filtre FFT) et des paramètres dépend du niveau de bruit et de la taille des voxels des images numérisées. Pour le filtre gaussien, 3 x 3 x 3 et 5 x 5 x 5 sont des valeurs couramment utilisées pour le facteur de taille du noyau, et 0,5-2,0 est couramment utilisé pour l’écart-type8. Dans cette étude, un filtre gaussien a été appliqué, et 5 x 5 x 5 et 0,8 ont été utilisés pour le facteur de taille du noyau et l’écart-type, respectivement.
- Réalignement de l’image
REMARQUE : Il s’agit d’une étape facultative. Lorsqu’un désalignement des échantillons d’os longs par rapport aux axes de coordonnées du système d’imagerie se produit pendant le processus de numérisation, une méthode d’alignement numérique peut être appliquée pour corriger le désalignement (Figure 2C).- Créez une image rendue en 3D de l’échantillon comme suit. Dans la fenêtre d’affichage du projet, sélectionnez l’image filtrée et recadrée (créée à l’étape 3.3). Cliquez avec le bouton droit de la souris pour sélectionner Affichage , puis Rendu volumique dans le menu déroulant, puis cliquez sur Créer. Vérifiez visuellement l’image rendue en 3D dans les plans sagittal et frontal.
- Faites pivoter manuellement le volume rendu pour obtenir un bon alignement dans l’axe longitudinal. Appliquez la transformation aux images pivotées comme suit : dans la fenêtre des propriétés, cliquez sur l’éditeur de transformation, puis accédez à l’éditeur-manipulateur de transformation et sélectionnez Transformer dans le menu déroulant. Il est maintenant possible de faire pivoter et de réaligner l’échantillon. Une fois le processus de réalignement terminé, cliquez à nouveau sur l’éditeur de transformation pour verrouiller l’image.
- Rééchantillonnez l’image filtrée (créée à l’étape 3.3) pour créer de nouvelles tranches d’image du plan transversal (axial) comme suit : Dans la fenêtre Vue du projet, sélectionnez l’image de l’étape 3.4.2. Cliquez avec le bouton droit de la souris pour sélectionner Transformation de géométrie , puis Rééchantillonnez l’image transformée dans le menu déroulant, puis cliquez sur Créer. Dans la fenêtre des propriétés, accédez à Données et procédez comme suit : pour l’interpolation, sélectionnez Standard dans le menu déroulant ; pour mode, choisissez Extended (Étendu) ; pour preserve (conserver), sélectionnez Voxel Size (Taille du voxel) ; Pour Padding Value (Valeur de remplissage), entrez zéro dans la zone vide disponible. Cliquez ensuite sur Appliquer.
- Définition du volume d’intérêt (VOI)
- Parcourez les coupes transversales de l’image et identifiez le plan central du cal de fracture. Définissez la VOI en fonction des extrémités proximales et distales du cal. Dans les cas où les extrémités des callosités sont difficiles à définir, définissez la VOI en fonction d’une distance normalisée par rapport au plan central de la callosité (Figure 2D).
REMARQUE : Pendant les phases de cicatrisation qui précèdent le remodelage osseux, il est facile de définir les bords du cal minéralisé car la structure trabéculaire de l’os tissé nouvellement formé est distincte de la structure corticale de l’os d’origine. Cependant, lorsque la phase de remodelage s’ensuit, l’os nouvellement formé acquiert progressivement la structure corticale ; Ainsi, définir les bords du cal devient de plus en plus difficile.
- Parcourez les coupes transversales de l’image et identifiez le plan central du cal de fracture. Définissez la VOI en fonction des extrémités proximales et distales du cal. Dans les cas où les extrémités des callosités sont difficiles à définir, définissez la VOI en fonction d’une distance normalisée par rapport au plan central de la callosité (Figure 2D).

Figure 2 : Segmentation de l’image. (A) Image montrant six échantillons au sein d’une numérisation. (B) Recadrage de l’image pour isoler des échantillons individuels. (C) Alignement numérique pour corriger un axe longitudinal mal aligné (ligne pointillée jaune). (D) Définition du plan central de la VOI et du cal calleux. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Analyse d’images
- Segmentation du cal et de l’os cortical
- Tracez le contour de la limite extérieure du cal de manière semi-automatique à l’aide de l’outil lasso de segmentation avec les options de traçage automatique et de traçage des bords (Figure 3A) comme suit :
- Après le réassemblage des images transformées (étape 3.4.3), cliquez sur l’onglet Segmentation dans la deuxième ligne d’onglets en haut de l’écran. Dans la fenêtre de l’éditeur de segmentation, sélectionnez une image transformée (créée à l’étape 3.4.3) dans le menu déroulant en regard de l’image.
- Dans la fenêtre MATÉRIAUX, double-cliquez sur Ajouter ; Ce faisant, deux onglets nommés Matériau3 et Matériau4 apparaîtront. Cliquez avec le bouton droit de la souris pour renommer material3 en callosité et material4 en cortical.
- Dans la fenêtre SÉLECTION, cliquez sur l’icône au lasso ; dans les options qui s’affichent, sélectionnez Main levée pour le mode 2D, Intérieur pour le mode 3D, et Traçage automatique et Tracer les arêtes pour les options. Utilisez le lasso pour marquer les régions d’intérêt.
- Répétez cette étape de contournage avec des tranches échantillonnées sur l’ensemble de la VOI (Figure 3B). Les tranches profilées peuvent être espacées (par exemple, séparées de 20 tranches).
REMARQUE : Dans les régions où les structures de callosités sont complexes, l’utilisateur peut envisager de réduire l’espacement entre les tranches profilées pour capturer plus de fragments (Figure 3A,B). - Interpolez sur les contours des callosités profilées pour créer une étiquette de callosité complète (Figure 3C,D) comme suit : dans la fenêtre MATÉRIAUX, choisissez le fichier Callus (créé à l’étape 4.1.1.2.), cliquez sur l’onglet Sélection en haut de l’écran, puis sélectionnez Interpoler dans le menu déroulant. Dans la fenêtre SÉLECTION, cliquez sur le signe plus.
- Ouvrez le fichier d’os cortical créé à l’étape 4.1.1.2. Segmentez l’os cortical, y compris la cavité médullaire, comme indiqué pour le cal aux étapes 4.1.1 et 4.1.2. (Figures 4A et B). Interpolez le cortex périosté profilé pour créer une étiquette osseuse corticale comme indiqué pour le cal à l’étape 4.1.3 (Figure 4C,D).
- Calculez le volume profilé et la valeur moyenne de gris de la callosité comme suit : cliquez sur l’onglet Segmentation dans la rangée supérieure de l’écran et sélectionnez Statistiques du matériau dans le menu déroulant. Cela générera une table contenant toutes les valeurs calculées. Les valeurs de l’os cortical et du cal (après soustraction de l’os cortical) sont fournies séparément. Une fois la table générée, cliquez sur Exporter dans l’espace de travail pour enregistrer les données.
- Tracez le contour de la limite extérieure du cal de manière semi-automatique à l’aide de l’outil lasso de segmentation avec les options de traçage automatique et de traçage des bords (Figure 3A) comme suit :
- Conversion des unités de l’échelle de gris en densité minérale osseuse
- Recadrez l’image 3D du fantôme HA de 4,5 mm (Figure 2B) à partir de l’image entière et cliquez sur Segmentation. La résine du fantôme HA contient cinq petits cylindres HA (Figure 1A). Pour le cylindre HA qui a la densité la plus élevée, définissez la première et la dernière tranche par inspection visuelle.
- Tracez deux cercles à la première et à la dernière tranche (en évitant les bords) à l’aide de l’outil pinceau (Figure 5A) comme suit : dans la fenêtre MATÉRIAUX, cliquez quatre fois sur Ajouter . Cliquez avec le bouton droit de la souris pour renommer material3, material4, material5 et material6 en phantom1, phantom2, phantom3 et phantom4, respectivement. Sélectionnez Fantôme1, cliquez sur l’icône en forme de pinceau dans la fenêtre SÉLECTION et utilisez le curseur pour ajuster la taille du pinceau (tracé circulaire) en fonction de la taille du fantôme (la taille du cercle doit être inférieure à celle du fantôme).
- Appliquez une interpolation entre les deux cercles pour créer un volume pour chaque cylindre HA (Figure 5B) comme suit : dans la fenêtre MATÉRIAUX, sélectionnez Phantom1, cliquez sur l’onglet Sélection sur la ligne supérieure de l’écran, puis sélectionnez Interpoler dans le menu déroulant. Dans la fenêtre SÉLECTION, cliquez sur le signe Plus.
- Répétez le processus de segmentation avec trois des cylindres d’AH restants, en commençant par la deuxième densité d’AH la plus élevée et en terminant par la deuxième densité d’AH la plus faible (Figure 5B). Le cylindre ayant la densité HA la plus faible peut être exclu car il est souvent difficile à segmenter.
- Utilisez les étiquettes 3D générées pour calculer les valeurs de gris moyennes des quatre cylindres HA analysés. À l’aide d’une feuille de calcul (voir le tableau des matériaux) ou d’un document similaire, tracez les valeurs moyennes de gris et les valeurs correspondantes de densité minérale osseuse (DMO) fournies par le fabricant fantôme. Générez une équation de corrélation entre la DMO et les valeurs de gris à l’aide de la régression linéaire.
- Segmentation des callosités minéralisées et calcul de la DMO
- Sur la base de l’équation de corrélation générée à l’étape 4.2.5 et du seuil choisi qui différencie les callosités minéralisées et non minéralisées, déterminez le seuil de valeur grise correspondant. Par conséquent, étiqueter la zone de callosité dont les valeurs de gris sont supérieures au seuil comme étant des callosités minéralisées et étiqueter le reste comme non minéralisé (figure 6A,B). Dans cette étude, 250 mgHA/ccm a été utilisé comme seuil pour les callosités minéralisées14,15.
- Calculer les volumes totaux de callosités et de callosités minéralisées. Sur la base de ces valeurs, calculez la fraction volumique osseuse (volume de callosités minéralisé normalisé au volume total de callosités = BV/TV). Utilisez la valeur moyenne de gris mesurée pour le cal total pour calculer la DMO du cal à l’aide de l’équation de corrélation générée au point 4.2.5.
REMARQUE : En fonction de l’objectif de l’étude et du logiciel utilisé pour l’analyse, d’autres paramètres tels que le SMI (indice du modèle de structure), l’épaisseur trabéculaire et le degré d’anisotropie peuvent être calculés.

Figure 3 : Segmentation de la limite externe du cal (A) Un contour de la limite extérieure du cal (ligne rouge). (B) Contours des tranches échantillonnées dans l’ensemble de la VOI (tranches rouges). (C) Une étiquette de callosité 3D créée par interpolation (volume rouge). (D) Une coupe transversale de l’étiquette de callosité indiquée en C (y compris l’os cortical). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Segmentation de l’os cortical. (A) Un contour de la surface périostée du cortex (ligne verte). (B) Contours au niveau des tranches échantillonnées dans l’ensemble de la VOI (tranches vertes). (C) Une étiquette 3D de l’os cortical (contenant la cavité médullaire ; vert) et du cal (rouge) créée à partir d’étiquettes interpolées du cortex périosté et du cal calleux. (D) Coupe transversale du cal (rouge) et de l’os cortical (contenant la cavité intramédullaire ; vert). Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Conversion des unités en niveaux de gris en BMD. (A) Contours du cylindre HA à la première et à la dernière tranche (cercles rouges). (B) Cylindres HA interpolés en 3D (à gauche) et sections transversales (à droite). Brun : densité HA la plus élevée ; bleu : deuxième densité HA la plus élevée ; violet : troisième densité d’AH la plus élevée ; vert : quatrième densité d’AH la plus élevée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
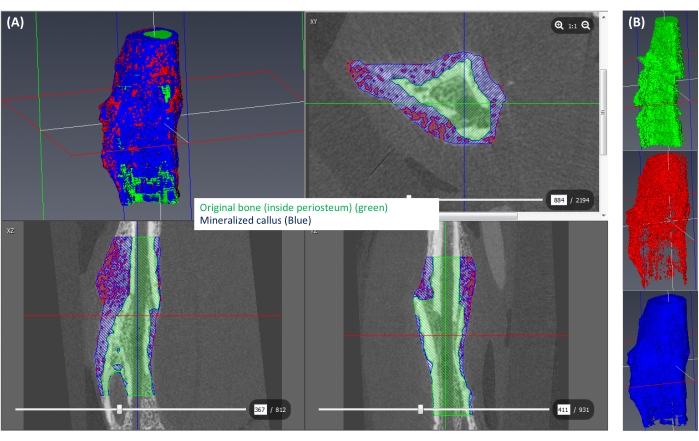
Figure 6 : Segmentation du cal minéralisé. (A) Le cal minéralisé (≥250 mgHA/ccm) est représenté en bleu, le reste du cal (<250 mgHA/ccm) est représenté en rouge et l’espace correspondant à l’os d’origine est indiqué en vert. (B) Une vue 3D de chaque étiquette isolée. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Pour surveiller la formation osseuse pendant la cicatrisation de la fracture, une fracture ouverte du tibia diaphysaire moyen a été induite chez des souris mâles adultes C75BL/6J. La fracture a été stabilisée à l’aide d’un clou intramédullaire, un modèle établi de cicatrisation secondaire13. Les tissus calleux ont été prélevés aux jours 14, 21 et 28 après la fracture12. Ces moments représentent différentes phases de la guérison. La formation osseuse en...
Discussion
Le but de cette étude est de décrire un protocole détaillé pour l’analyse μCT dans le but de quantifier avec précision la structure minéralisée des callosités en 3D, qui est souvent fondamentale dans les études de cicatrisation osseuse et fracturée. Le protocole utilise une plate-forme logicielle d’analyse d’images 3D à usage général à la pointe de la technologie qui facilite la visualisation, la segmentation/étiquetage des images et les mesures allant du plus simple au plus complexe.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Ce travail a été soutenu par les National Institutes of Health (NIH) R01 DK121327 à R.A.E et R01 AR071968 à F.K.
matériels
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher chemical | SF100-20 | Used for bone tissue fixation |
| Avizo | Thermo Scientific | Image processing and analysis software | |
| Hydroxyapatite phantom | Micro-CT HA D4.5, QRM | QRM-70128 | |
| Image Processing Language | Scanco | Used to convert raw images to DICOM images | |
| Micro-Mosquito Straight Hemostatic Forceps | Medline | Used to remove the intramedullary pin | |
| Microsoft Excel | Microsoft | Spreadsheet software | |
| Scanco mCT system (vivaCT 40) | Scanco | Used for µCT imaging |
Références
- Rüegsegger, P., Koller, B., Müller, R. A microtomographic system for the nondestructive evaluation of bone architecture. Calcified Tissue International. 58 (1), 24-29 (1996).
- Müller, R., et al. Morphometric analysis of human bone biopsies: a quantitative structural comparison of histological sections and micro-computed tomography. Bone. 23 (1), 59-66 (1998).
- Waarsing, J. H., et al. Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data. Bone. 34 (1), 163-169 (2004).
- Boyd, S. K., Davison, P., Müller, R., Gasser, J. A. Monitoring individual morphological changes over time in ovariectomized rats by in vivo micro-computed tomography. Bone. 39 (4), 854-862 (2006).
- Christiansen, B. A. Effect of micro-computed tomography voxel size and segmentation method on trabecular bone microstructure measures in mice. Bone Reports. 5, 136-140 (2016).
- Holdsworth, D. W., Thornton, M. M. Micro-CT in small animal and specimen imaging. Trends in Biotechnology. 20 (8), 34-39 (2002).
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Morgan, E. F., et al. Micro-computed tomography assessment of fracture healing: Relationships among callus structure, composition, and mechanical function. Bone. 44 (2), 335-344 (2009).
- O'Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50 (6), 1357-1367 (2012).
- Bissinger, O., et al. Fully automated segmentation of callus by micro-CT compared to biomechanics. Journal of Orthopaedic Surgery and Research. 12 (1), 108 (2017).
- Brown, M. L., et al. Delayed fracture healing and increased callus adiposity in a C57BL/6J murine model of obesity-associated type 2 diabetes mellitus. PLOS One. 9 (6), 99656 (2014).
- Khajuria, D. K., et al. Aberrant structure of fibrillar collagen and elevated levels of advanced glycation end products typify delayed fracture healing in the diet-induced obesity mouse model. Bone. 137, 115436 (2020).
- Sigurdsen, U., Reikeras, O., Hoiseth, A., Utvag, S. E. Correlations between strength and quantitative computed tomography measurement of callus mineralization in experimental tibial fractures. Clinical Biomechanics. 26 (1), 95-100 (2011).
- Duvall, C. L., Taylor, W. R., Weiss, D., Wojtowicz, A. M., Guldberg, R. E. Impaired angiogenesis, early callus formation, and late stage remodeling in fracture healing of osteopontin-deficient mice. Journal of Bone and Mineral Research. 22 (2), 286-297 (2007).
- Gerstenfeld, L. C., et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. Journal of Bone and Mineral Research. 24 (2), 196-208 (2009).
- Alentado, V. J., et al. Validation of the modified radiographic union score for tibia fractures (mRUST) in murine femoral fractures. Frontiers in Endocrinology. 13, 911058 (2022).
- Yu, K. E., et al. Enhancement of impaired MRSA-infected fracture healing by combinatorial antibiotics and modulation of sustained inflammation. Journal of Bone and Mineral Research. 37 (1), 1352-1365 (2022).
- Nyman, J. S., et al. Quantitative measures of femoral fracture repair in rats derived by micro-computed tomography. Journal of Biomechanics. 42 (7), 891-897 (2009).
- Fiset, S., et al. Experimental validation of the radiographic union score for tibial fractures (RUST) using micro-computed tomography scanning and biomechanical testing in an in-vivo rat model. The Journal of Bone and Joint Surgery. 100 (21), 1871-1878 (2018).
- Shefelbine, S. J., et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis. Bone. 36 (3), 480-488 (2005).
- Liu, Y., et al. Glucocorticoid-induced delayed fracture healing and impaired bone biomechanical properties in mice. Clinical Interventions in Aging. 13, 1465-1474 (2018).
- Watson, P. J., Fitton, L. C., Meloro, C., Fagan, M. J., Gröning, F. Mechanical adaptation of trabecular bone morphology in the mammalian mandible. Scientific Reports. 8 (1), 7277 (2018).
- Nie, C., Wang, Z., Liu, X. The effect of depression on fracture healing and osteoblast differentiation in rats. Neuropsychiatric Disease and Treatment. 14, 1705-1713 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon