Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Оценка заживления переломов костей с помощью микрокомпьютерной томографии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Микрокомпьютерная томография (мкКТ) — это неразрушающий метод визуализации, который играет важную роль в оценке структуры костной ткани в доклинических исследованиях, однако до сих пор нет единого мнения о процедурах μКТ для анализа костной мозоли. В этом исследовании представлен пошаговый протокол μКТ, который позволяет контролировать заживление перелома.
Аннотация
Микрокомпьютерная томография (мкКТ) является наиболее распространенным методом визуализации для характеристики трехмерной (3D) морфологии кости и новообразованной кости во время заживления переломов в трансляционных научных исследованиях. Исследования заживления переломов длинных костей у грызунов обычно включают вторичное заживление и образование минерализованной мозоли. Форма образовавшейся мозоли и плотность новообразованной кости могут существенно различаться в зависимости от времени и лечения. В то время как стандартные методики количественной оценки параметров интактной кортикальной и трабекулярной кости широко используются и встроены в коммерчески доступное программное обеспечение, существует отсутствие консенсуса по процедурам анализа заживающей мозоли. Целью данной работы является описание стандартизированного протокола, который количественно оценивает объемную долю костной ткани и минеральную плотность каллуса в заживающей мозоли. Протокол описывает различные параметры, которые следует учитывать во время визуализации и анализа, включая выравнивание образца во время визуализации, размер интересующего объема и количество срезов, которые оконтуриваются для определения каллуса.
Введение
Микрокомпьютерная томография (мкКТ) широко используется в доклинических исследованиях костей, обеспечивая неинвазивные изображения с высоким разрешением для оценки микроструктуры костей 1,2,3,4,5. МикроКТ включает в себя большое количество рентгеновских изображений, полученных с вращающегося образца или с помощью вращающегося источника рентгеновского излучения и детектора. Алгоритмы используются для реконструкции объемных 3D-данных в виде стопки срезов изображения. Клиническая КТ является золотым стандартом для 3D-визуализации костей человека, а μКТ является широко используемым методом оценки эффективности заживления костей у экспериментальных животных 1,2,3,4,6,7. Минерализованная кость имеет отличный контраст для рентгена, в то время как мягкие ткани имеют относительно слабый контраст, если не используется контрастное вещество. При оценке заживления перелома микроКТ генерирует изображения, которые предоставляют подробную информацию о 3D-структуре и плотности минерализованной каллуса. Компьютерная томография in vivo также может быть использована для продольной оценки заживления перелома во времени.
Количественная оценка интактной кортикальной и трабекулярной кости с помощью микроКТ в целом хорошо известна и стандартизирована8. Несмотря на то, что в доклинических исследованиях используются различные методики количественной оценки для анализа заживления переломов 9,10,11, подробный протокол анализа изображений мкКТ для количественного определения каллуса еще не опубликован. Поэтому целью данного исследования является предоставление подробного пошагового протокола для микроКТ-визуализации и анализа костной мозоли.
протокол
Следующий протокол был разработан для характеристики длиннокостной мозоли, полученной от усыпленных мышей. Тем не менее, большинство этапов могут быть применены к крысам, а также использованы для сканирования сломанных костей in vivo . Протокол описывает конкретную систему микроКТ и конкретное программное обеспечение для обработки, анализа и визуализации изображений (см. Таблицу материалов), однако методология в целом применима и к другим сканерам и программному обеспечению. Протокол был одобрен Комитетом по уходу за животными и их использованию Медицинского колледжа Университета штата Пенсильвания. Мышами, использованными в этом исследовании, были 16-недельные самцы мышей C57BL/6J (средний вес 31,45 ± 3,2 г).
1. Заготовка и консервация тканей
ПРИМЕЧАНИЕ: Используйте подходящую модель мышиного перелома. Для данного исследования использовалась модель среднедиафизарного открытого перелома большеберцовой кости в соответствии со стандартным протоколом, описанным в12,13.
- В конце эксперимента с моделью перелома усыпьте мышь, введя внутрибрюшинную инъекцию кетамина или ксилазина (500 мг/кг или 50 мг/кг соответственно).
- С помощью ножниц извлекают сломанную кость от середины бедренной кости до большеберцового сустава, не нарушая место перелома. Удалите мышцы, окружающие кость, оставив только мягкие ткани, которые находятся в непосредственном контакте с костью, чтобы поддерживать место перелома во время последующих этапов обработки. Извлеките интрамедуллярный штифт с помощью прямых гемостатических щипцов для микрокомаров.
- Образцы хранят в формалине при 4 °C или в физиологическом растворе при -20 °C. Выбор носителя для консервации зависит от предполагаемых применений после микроКТ. В этом исследовании образцы хранились в физиологическом растворе при -20 °C.
2. Сканирование микрокомпьютерной томографии
- Подготовка образцов
- Для одновременного сканирования нескольких образцов поместите до шести образцов в специально разработанное приспособление для сканирования, напечатанное на 3D-принтере (рис. 1 A, B) или аналогичное. Одновременное сканирование сокращает время и стоимость сканирования. Приспособление, используемое в этом исследовании, содержит шесть прорезей для длинных образцов костей и центральное отверстие для фантома гидроксиапатита (ГК) (рис. 1A, B; Содержание материалов).
ПРИМЕЧАНИЕ: На шаге 4.2 (см. ниже) фантом ГК будет использоваться в качестве стандарта для преобразования единиц микроКТ (обычно Хаунсфилда) в плотность ГК (мгГА/куб.см). - Поместите подготовленное приспособление в шприц или коническую трубку, аналогичную диаметру поля зрения (FOV; Рисунок 1С). В этом исследовании использовался шприц диаметром 20 мм, чтобы соответствовать полю зрения 21,5 мм.
- Чтобы предотвратить высыхание образцов в процессе сканирования, наполните шприц или каноническую пробирку консервантом, использованным на этапе 1.3 (в данном исследовании использовался физиологический раствор).
- Для одновременного сканирования нескольких образцов поместите до шести образцов в специально разработанное приспособление для сканирования, напечатанное на 3D-принтере (рис. 1 A, B) или аналогичное. Одновременное сканирование сокращает время и стоимость сканирования. Приспособление, используемое в этом исследовании, содержит шесть прорезей для длинных образцов костей и центральное отверстие для фантома гидроксиапатита (ГК) (рис. 1A, B; Содержание материалов).
- Сканирование
- Перед сканированием убедитесь, что аппарат μCT откалиброван следующим образом: поместите фантом HA на осевую линию поля зрения μCT, отсканируйте фантом и измерьте плотность HA. Убедитесь, что измеренная плотность соответствует плотности, предоставленной производителем.
- Совместите осевую линию прибора образца с приблизительной осевой линией поля зрения μCT. Это гарантирует, что образцы находятся в пределах поля зрения, а их длинные оси имеют ориентацию, приблизительно совпадающую с осевым направлением результирующих изображений.
ПРИМЕЧАНИЕ: Такая стандартизированная ориентация может в дальнейшем помочь сделать процедуру анализа менее подверженной изменениям, например, в количестве рассматриваемой ткани в интересующем объеме. - Задайте параметры сканирования системы μCT (Таблица материалов). Параметры, используемые в этом исследовании: 10,5 мкм (изотропный размер вокселя), 55 кВпик (энергия/интенсивность), 145 мкА (ток) и 300 мс (время интегрирования). Определите размер воксела, исходя из приблизительной толщины трабекул мышей (20-60 мкм)8. Визуально осмотрите скан в разных ракурсах, чтобы убедиться, что он покрывает весь объем всех образцов каллуса.

Рисунок 1: Структура настраиваемого сканирующего приспособления. (A) Изображения сканирующего приспособления (вверху), показывающие шесть слотов для образцов и фантом HA (внизу). (B) Изображения, показывающие образец длинной кости (вверху) и фантом HA (внизу), помещенные в специальные слоты. (C) Изображения, показывающие сканирующее приспособление, помещенное в шприц диаметром 20 мм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
3. Сегментация изображений
ПРИМЕЧАНИЕ: Изображения в формате RAW автоматически восстанавливаются в соответствии с данными последовательности изображений.
- Преобразование изображений: преобразование восстановленных данных последовательности изображений в последовательности изображений DICOM с помощью программного обеспечения для обработки изображений (см. Таблицу материалов). Импортируйте последовательности изображений DICOM в программное обеспечение (см. таблицу материалов) для обработки, анализа и визуализации изображений (рис. 2A).
- Обрезка изображений: по одному образцу за раз, обрезайте каждую стопку изображений и убедитесь, что весь образец включен в обрезанный том (рис. 2B). Сохраните обрезанное изображение следующим образом: перейдите на вкладку « Файл » в левой верхней части экрана, выберите «Сохранить проект», а затем выберите «Свернуть размер проекта » из параметров, появившихся на экране. Файл будет сохранен в формате коммерческого программного обеспечения.
- Шумоподавление изображения: используйте метод фильтрации для снижения уровня шума и предотвращения размытия следующим образом.
- Перейдите на вкладку «Файл » и выберите изображение, которое будет обработано с помощью «Открытых данных». Открытое изображение появится в окне просмотра проекта в левом верхнем углу экрана.
- Щелкните правой кнопкой мыши, чтобы выбрать «Обработка изображений », а затем «Песочница фильтров». Нажмите кнопку Создать.
- В окне «Свойства» (в левом нижнем углу экрана) выполните следующие действия: выберите «Данные » в качестве типа предварительного просмотра; выберите тип фильтра из выпадающего меню рядом с пунктом Фильтр; выбрать 3D для интерпретации; выберите Separable из выпадающего меню рядом с типом ядра; Заполните значения, которые будут использоваться для стандартного отклонения и коэффициента размера ядра, в доступном пустом поле рядом с каждым из них; выберите То же, что и входные данные в раскрывающемся меню рядом с выходом; нажмите кнопку Применить.
ПРИМЕЧАНИЕ: Выбор типа фильтра (доступные варианты: двусторонний, прямоугольный, гауссовский, медианный, рекурсивный экспоненциальный, разграничительный, анизотропная диффузия, нелокальное среднее, нерезкая маскировка и фильтр БПФ) и параметров зависит от уровня шума и размера воксела сканируемых изображений. Для фильтра Гаусса 3 x 3 x 3 и 5 x 5 x 5 являются обычно используемыми значениями для коэффициента размера ядра, а 0,5-2,0 обычно используется для стандартного отклонения8. В этом исследовании был применен фильтр Гаусса, а 5 x 5 x 5 и 0,8 использовались для коэффициента размера ядра и стандартного отклонения соответственно.
- Выравнивание изображения
ПРИМЕЧАНИЕ: Это необязательный шаг. Если в процессе сканирования происходит смещение длинных образцов кости относительно координатных осей системы визуализации, для коррекции смещения может быть применен метод цифрового выравнивания (рис. 2C).- Создайте 3D-изображение образца следующим образом. В окне вида проекта выберите отфильтрованное, обрезанное изображение (созданное на шаге 3.3). Щелкните правой кнопкой мыши, чтобы выбрать « Дисплей », а затем « Объемный рендеринг » в раскрывающемся меню, затем нажмите «Создать». Визуально проверьте 3D визуализированное изображение в сагиттальной и фронтальной плоскостях.
- Вручную поверните визуализированный объем, чтобы получить хорошее выравнивание по продольной оси. Примените трансформацию к повернутым изображениям следующим образом: в окне свойств нажмите кнопку Редактор преобразований, затем перейдите в редактор-манипулятор преобразований и выберите из выпадающего меню пункт Трансформер . Теперь образец можно поворачивать и выравнивать. После завершения процесса выравнивания снова нажмите редактор трансформирования , чтобы заблокировать изображение.
- Измените разрешение отфильтрованного изображения (созданного на шаге 3.3) для создания новых срезов изображения в поперечной (осевой) плоскости следующим образом: В окне "Вид проекта" выберите изображение из шага 3.4.2. Щелкните правой кнопкой мыши, чтобы выбрать Geometry Transform , а затем Resample Transformed Image в ниспадающем меню и нажмите Create. В окне свойств перейдите в раздел Данные и выполните следующие действия: для интерполяции выберите Стандартный из выпадающего меню; для режима выберите Расширенный; для сохранения выберите Voxel Size; В поле Значение заполнения введите ноль в доступное пустое поле. Затем нажмите кнопку Применить.
- Определение интересующего объема (VOI)
- Пройдитесь по поперечным срезам изображения и определите центральную плоскость мозоли перелома. Определите VOI на основе проксимального и дистального концов мозоли. В тех случаях, когда концы мозолей трудно определить, определите VOI на основе стандартизированного расстояния от центральной плоскости мозоли (рис. 2D).
ПРИМЕЧАНИЕ: Во время фаз заживления, которые предшествуют ремоделированию кости, определить края минерализованной мозоли легко, потому что трабекулярная структура вновь сформированной тканой кости отличается от кортикальной структуры исходной кости. Однако, когда наступает фаза ремоделирования, новообразованная кость постепенно приобретает кортикальную структуру; Таким образом, определение краев мозоли становится все более сложной задачей.
- Пройдитесь по поперечным срезам изображения и определите центральную плоскость мозоли перелома. Определите VOI на основе проксимального и дистального концов мозоли. В тех случаях, когда концы мозолей трудно определить, определите VOI на основе стандартизированного расстояния от центральной плоскости мозоли (рис. 2D).

Рисунок 2: Сегментация изображения. (A) Изображение, показывающее шесть образцов в рамках одного сканирования. (B) Обрезка изображения для изоляции отдельных образцов. (C) Цифровое выравнивание для исправления смещения продольной оси (желтая пунктирная линия). (D) Определение ВОИ и плоскости центра мозоли. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Анализ изображений
- Сегментация костной мозоли и кортикальной кости
- Очертите внешнюю границу каллуса полуавтоматически с помощью инструмента «Сегментация лассо» с параметрами автоматической трассировки и трассировки краев (рис. 3A) следующим образом:
- После повторной сборки преобразованных изображений (шаг 3.4.3) перейдите на вкладку Сегментация во второй строке вкладки в верхней части экрана. В окне редактора сегментации выберите преобразованное изображение (созданное на шаге 3.4.3) из выпадающего меню рядом с изображением.
- В окне МАТЕРИАЛЫ дважды нажмите кнопку Добавить; При этом появятся две вкладки с именами Material3 и Material4. Щелкните правой кнопкой мыши, чтобы переименовать material3 в callus, а material4 в кортикальную кость.
- В окне ВЫДЕЛЕНИЕ нажмите на иконку лассо; В появившемся окне выберите « Произвольная схема » для 2D-режима, « Внутри » для 3D-режима, а также «Автотрассировка» и «Трассировка ребер» для параметров . Используйте лассо, чтобы отметить интересующие области.
- Повторите этот этап контурирования со срезами, взятыми поперек VOI (рис. 3B). Контурные срезы могут быть разнесены друг от друга (например, разделены 20 срезами).
ПРИМЕЧАНИЕ: В областях со сложной каллусной структурой пользователь может рассмотреть возможность уменьшения расстояния между контурными срезами, чтобы захватить больше фрагментов (рис. 3A, B). - Интерполируйте контуры каллуса, чтобы создать полную метку каллуса (рис. 3C,D) следующим образом: в окне МАТЕРИАЛЫ выберите файл Callus (созданный на шаге 4.1.1.2.), перейдите на вкладку Selection в верхней части экрана и выберите Interpolate из ниспадающего меню. В окне SELECTION нажмите на плюсик.
- Откройте файл Cortical Bone (Кортикальная кость), созданный на шаге 4.1.1.2. Сегментируйте кортикальную кость, включая костномозговую полость, как описано для костной мозоли на шагах 4.1.1 и 4.1.2. (Рисунок 4А,Б). Интерполируйте контурную надкостничную кору, чтобы создать метку кортикальной кости, как показано на шаге 4.1.3 (рис. 4C, D).
- Рассчитайте контурный объем и среднее значение серого мозоли следующим образом: перейдите на вкладку « Сегментация » в верхней строке экрана и выберите «Статистика материала » из выпадающего меню. При этом будет создана таблица, содержащая все вычисленные значения. Значения кортикальной кости и мозоли (после вычитания кортикальной кости) предоставляются отдельно. После создания таблицы нажмите кнопку Экспорт в рабочую область , чтобы сохранить данные.
- Очертите внешнюю границу каллуса полуавтоматически с помощью инструмента «Сегментация лассо» с параметрами автоматической трассировки и трассировки краев (рис. 3A) следующим образом:
- Преобразование единиц шкалы серого в минеральную плотность костной ткани
- Обрежьте 3D-изображение фантома HA 4,5 мм (рис. 2B) от всего изображения и нажмите кнопку Сегментация. Смола фантома ГК содержит пять небольших цилиндров ГК (рис. 1А). Для цилиндра HA с наибольшей плотностью определите первый и последний срезы путем визуального осмотра.
- Нарисуйте два круга на первом и последнем срезах (избегая краев) с помощью инструмента «Кисть» (рис. 5A) следующим образом: в окне «Материалы» нажмите кнопку «Добавить » четыре раза. Щелкните правой кнопкой мыши, чтобы переименовать material3, material4, material5 и material6 в phantom1, phantom2, phantom3 и phantom4 соответственно. Выберите Phantom1, нажмите на иконку кисти в окне SELECTION и с помощью ползунка отрегулируйте размер кисти (круговая трассировка) в зависимости от размера фантома (размер круга должен быть меньше, чем у фантома).
- Примените интерполяцию между двумя окружностями для создания объема для каждого цилиндра HA (рис. 5B) следующим образом: в окне MATERIALS выберите Phantom1, перейдите на вкладку Selection в верхней строке экрана и выберите Interpolate из выпадающего меню. В окне ВЫБОР нажмите на знак плюса.
- Повторите процесс сегментации с тремя оставшимися цилиндрами HA, начиная со второго по величине плотности HA и заканчивая вторым по величине плотностью HA (рисунок 5B). Цилиндр с наименьшей плотностью HA можно исключить, потому что его часто трудно сегментировать.
- Используйте сгенерированные 3D-метки для вычисления средних значений серого для четырех анализируемых цилиндров HA. Используя электронную таблицу (см. Таблицу материалов) или аналогичную таблицу, постройте график средних значений серого и соответствующих значений минеральной плотности костной ткани (МПК), предоставленных производителем фантома. Постройте уравнение корреляции между МПК и значениями серого с помощью линейной регрессии.
- Сегментация минерализованной каллуса и расчет МПК
- На основе корреляционного уравнения, полученного на шаге 4.2.5, и выбранного порога, который дифференцирует минерализованную и неминерализованную каллус, определите соответствующий порог значения серого. Соответственно, область каллуса серыми значениями, превышающими пороговое значение, пометьте как минерализованную каллус, а остальную часть — как неминерализованную (рис. 6A, B). В данном исследовании 250 мгГА/МКМ использовали в качестве порогового значения минерализованной каллусной14,15.
- Рассчитайте общий объем каллуса и минерализованной каллуса. Исходя из этих значений, рассчитайте объемную долю костной ткани (минерализованный объем каллуса, нормированный к общему объему каллуса = BV/TV). Используйте измеренное среднее значение серого для общей каллусной мозоли для расчета МПК каллуса с использованием корреляционного уравнения, полученного в 4.2.5.
ПРИМЕЧАНИЕ: Исходя из цели исследования и программного обеспечения, используемого для анализа, могут быть рассчитаны другие параметры, такие как SMI (индекс модели структуры), трабекулярная толщина и степень анизотропии.

Рисунок 3: Сегментация наружной границы каллуса. (А) Контур внешней границы каллуса (красная линия). (B) Контуры на срезах, взятых поперек VOI (красные срезы). (C) 3D-метка каллуса, созданная путем интерполяции (красный объем). (D) Поперечный срез каллусной метки, показанной на рисунке C (включая кортикальную кость). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Сегментация кортикальной кости. (А) Контур надкостничной поверхности коры (зеленая линия). (B) Контуры на срезах, взятых поперек VOI (зеленые срезы). (C) 3D-метка кортикальной кости (содержащая костномозговую полость; зеленая) и мозоль (красная), созданная из интерполированных меток надкостничной коры и мозоли. (D) Поперечный срез мозоли (красный) и кортикальной кости (содержащей интрамедуллярную полость; зеленый). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 5: Преобразование единиц измерения шкалы серого в BMD. (A) Контуры цилиндра HA на первом и последнем срезах (красные кружки). (B) 3D-интерполированные цилиндры HA (слева) и поперечные сечения (справа). Коричневый: самая высокая плотность ГК; синий: вторая по величине плотность ГК; фиолетовый: третья по величине плотность ГК; зеленый: четвертая по величине плотность HA. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
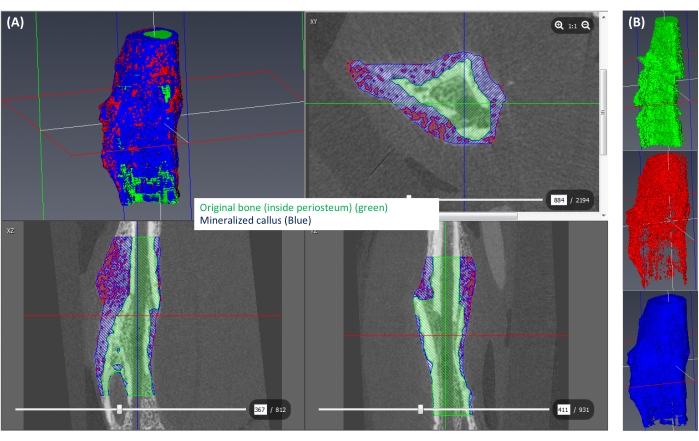
Рисунок 6: Сегментация минерализованной каллусной поверхности . (A) Минерализованная мозоль (≥250 мгГА/куб. см) показана синим цветом, остальная часть мозоли (<250 мгГА/куб. см) показана красным цветом, а пространство, соответствующее исходной кости, показано зеленым цветом. (B) 3D-вид каждой изолированной этикетки. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Для мониторинга костеобразования во время заживления переломов у взрослых самцов мышей C75BL/6J индуцировали открытый перелом большеберцовой кости средней диафизарной формы. Перелом был стабилизирован с помощью интрамедуллярного гвоздя, установленной модели вторичного заживления
Обсуждение
Целью данного исследования является описание подробного протокола микроКТ-анализа с целью точного количественного определения 3D-минерализованной каллусной структуры, которая часто является основополагающей в исследованиях заживления костей и переломов. Протокол использует соврем...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана Национальными институтами здравоохранения (NIH) R01 DK121327 для R.A.E и R01 AR071968 для F.K.
Материалы
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher chemical | SF100-20 | Used for bone tissue fixation |
| Avizo | Thermo Scientific | Image processing and analysis software | |
| Hydroxyapatite phantom | Micro-CT HA D4.5, QRM | QRM-70128 | |
| Image Processing Language | Scanco | Used to convert raw images to DICOM images | |
| Micro-Mosquito Straight Hemostatic Forceps | Medline | Used to remove the intramedullary pin | |
| Microsoft Excel | Microsoft | Spreadsheet software | |
| Scanco mCT system (vivaCT 40) | Scanco | Used for µCT imaging |
Ссылки
- Rüegsegger, P., Koller, B., Müller, R. A microtomographic system for the nondestructive evaluation of bone architecture. Calcified Tissue International. 58 (1), 24-29 (1996).
- Müller, R., et al. Morphometric analysis of human bone biopsies: a quantitative structural comparison of histological sections and micro-computed tomography. Bone. 23 (1), 59-66 (1998).
- Waarsing, J. H., et al. Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data. Bone. 34 (1), 163-169 (2004).
- Boyd, S. K., Davison, P., Müller, R., Gasser, J. A. Monitoring individual morphological changes over time in ovariectomized rats by in vivo micro-computed tomography. Bone. 39 (4), 854-862 (2006).
- Christiansen, B. A. Effect of micro-computed tomography voxel size and segmentation method on trabecular bone microstructure measures in mice. Bone Reports. 5, 136-140 (2016).
- Holdsworth, D. W., Thornton, M. M. Micro-CT in small animal and specimen imaging. Trends in Biotechnology. 20 (8), 34-39 (2002).
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Morgan, E. F., et al. Micro-computed tomography assessment of fracture healing: Relationships among callus structure, composition, and mechanical function. Bone. 44 (2), 335-344 (2009).
- O'Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50 (6), 1357-1367 (2012).
- Bissinger, O., et al. Fully automated segmentation of callus by micro-CT compared to biomechanics. Journal of Orthopaedic Surgery and Research. 12 (1), 108 (2017).
- Brown, M. L., et al. Delayed fracture healing and increased callus adiposity in a C57BL/6J murine model of obesity-associated type 2 diabetes mellitus. PLOS One. 9 (6), 99656 (2014).
- Khajuria, D. K., et al. Aberrant structure of fibrillar collagen and elevated levels of advanced glycation end products typify delayed fracture healing in the diet-induced obesity mouse model. Bone. 137, 115436 (2020).
- Sigurdsen, U., Reikeras, O., Hoiseth, A., Utvag, S. E. Correlations between strength and quantitative computed tomography measurement of callus mineralization in experimental tibial fractures. Clinical Biomechanics. 26 (1), 95-100 (2011).
- Duvall, C. L., Taylor, W. R., Weiss, D., Wojtowicz, A. M., Guldberg, R. E. Impaired angiogenesis, early callus formation, and late stage remodeling in fracture healing of osteopontin-deficient mice. Journal of Bone and Mineral Research. 22 (2), 286-297 (2007).
- Gerstenfeld, L. C., et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. Journal of Bone and Mineral Research. 24 (2), 196-208 (2009).
- Alentado, V. J., et al. Validation of the modified radiographic union score for tibia fractures (mRUST) in murine femoral fractures. Frontiers in Endocrinology. 13, 911058 (2022).
- Yu, K. E., et al. Enhancement of impaired MRSA-infected fracture healing by combinatorial antibiotics and modulation of sustained inflammation. Journal of Bone and Mineral Research. 37 (1), 1352-1365 (2022).
- Nyman, J. S., et al. Quantitative measures of femoral fracture repair in rats derived by micro-computed tomography. Journal of Biomechanics. 42 (7), 891-897 (2009).
- Fiset, S., et al. Experimental validation of the radiographic union score for tibial fractures (RUST) using micro-computed tomography scanning and biomechanical testing in an in-vivo rat model. The Journal of Bone and Joint Surgery. 100 (21), 1871-1878 (2018).
- Shefelbine, S. J., et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis. Bone. 36 (3), 480-488 (2005).
- Liu, Y., et al. Glucocorticoid-induced delayed fracture healing and impaired bone biomechanical properties in mice. Clinical Interventions in Aging. 13, 1465-1474 (2018).
- Watson, P. J., Fitton, L. C., Meloro, C., Fagan, M. J., Gröning, F. Mechanical adaptation of trabecular bone morphology in the mammalian mandible. Scientific Reports. 8 (1), 7277 (2018).
- Nie, C., Wang, Z., Liu, X. The effect of depression on fracture healing and osteoblast differentiation in rats. Neuropsychiatric Disease and Treatment. 14, 1705-1713 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены