JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미세 컴퓨터 단층 촬영을 이용한 골절 치유 평가
* 이 저자들은 동등하게 기여했습니다
요약
미세 컴퓨터 단층 촬영(μCT)은 전임상 연구에서 뼈 구조를 평가하는 데 중요한 비파괴 이미징 도구이지만 뼈 치유 캘러스를 분석하기 위한 μCT 절차에 대한 합의가 부족합니다. 이 연구는 골절 치유를 모니터링할 수 있는 단계별 μCT 프로토콜을 제공합니다.
초록
마이크로 컴퓨터 단층 촬영(μCT)은 중개 과학 조사에서 골절 치유 중 뼈와 새로 형성된 뼈의 3차원(3D) 형태를 특성화하는 가장 일반적인 이미징 방식입니다. 설치류의 장골 골절 치유에 대한 연구는 일반적으로 2차 치유와 광물화된 캘러스 형성을 포함합니다. 형성된 굳은살의 모양과 새로 형성된 뼈의 밀도는 시점과 치료에 따라 크게 다를 수 있습니다. 온전한 피질골 및 섬유주골의 매개변수를 정량화하기 위한 표준 방법론이 널리 사용되고 상업적으로 이용 가능한 소프트웨어에 내장되어 있는 반면, 치유 캘러스를 분석하는 절차에 대한 합의가 부족합니다. 이 작업의 목적은 치유 캘러스에서 골 부피 분율과 캘러스 미네랄 밀도를 정량화하는 표준화된 프로토콜을 설명하는 것입니다. 이 프로토콜은 이미징 중 샘플 정렬, 관심 부피의 크기, 캘러스를 정의하기 위해 윤곽이 그려진 슬라이스 수를 포함하여 이미징 및 분석 중에 고려해야 하는 다양한 매개변수를 설명합니다.
서문
미세 컴퓨터 단층 촬영(μCT) 이미징은 전임상 뼈 연구에 널리 사용되어 뼈 1,2,3,4,5의 미세 구조를 평가하기 위해 비침습적 고해상도 이미지를 제공합니다. μCT는 회전하는 샘플에서 또는 회전하는 X선 소스 및 검출기를 사용하여 얻은 많은 수의 X선 이미지를 포함합니다. 알고리즘은 이미지 슬라이스 스택 형태로 3D 체적 데이터를 재구성하는 데 사용됩니다. 임상 CT는 인간 뼈의 3D 이미징을 위한 황금 표준이며, μCT는 실험 동물 1,2,3,4,6,7에서 뼈 치유 효율을 평가하기 위해 일반적으로 사용되는 기술입니다. 광물화된 뼈는 X선에 대한 대비가 우수한 반면, 연조직은 조영제를 사용하지 않는 한 상대적으로 대비가 낮습니다. 골절 치유 평가에서 μCT는 광물화된 캘러스의 3D 구조 및 밀도에 대한 자세한 정보를 제공하는 이미지를 생성합니다. 생체 내 μCT 스캐닝은 골절 치유의 종단적, 시간 경과 평가에도 사용할 수 있습니다.
μCT를 이용한 온전한 피질골 및 섬유주골의 정량화는 일반적으로 잘 확립되어 있고 표준화되어 있다8. 전임상 연구에서는 골절 치유를 분석하기 위해 다양한 정량화 방법론을 사용하지만(9,10,11), 캘러스 정량화를 위한 μCT 이미지 분석의 자세한 프로토콜은 아직 발표되지 않았습니다. 따라서 본 연구의 목적은 μCT 영상 및 뼈 치유 캘러스 분석을 위한 상세한 단계별 프로토콜을 제공하는 것이다.
프로토콜
다음 프로토콜은 안락사된 마우스에서 채취한 장골 치유 캘러스를 특성화하기 위해 개발되었습니다. 그러나 대부분의 단계는 쥐에게 적용 할 수 있으며 골절 된 뼈의 생체 내 스캐닝에도 사용할 수 있습니다. 이 프로토콜은 특정 μCT 시스템과 특정 이미지 처리, 분석 및 시각화 소프트웨어( 재료 표 참조)를 설명하지만 방법론은 일반적으로 다른 스캐너 및 소프트웨어에 적용할 수 있습니다. 이 프로토콜은 펜실베니아 주립 대학 의과 대학의 기관 동물 관리 및 사용위원회의 승인을 받았습니다. 본 연구에 사용된 마우스는 16주령의 수컷 C57BL/6J 마우스(평균 체중 31.45 ± 3.2 g)였다.
1. 조직 채취 및 보존
알림: 적절한 쥐 골절 모델을 사용하십시오. 본 연구를 위해,12,13에 기술된 표준 프로토콜에 따라 중간 골격 개방 경골 골절 모델을 사용하였다.
- 골절 모델 실험이 끝나면 케타민 또는 자일라진(각각 500mg/kg 또는 50mg/kg)을 복강내 주사하여 마우스를 안락사시킵니다.
- 가위를 사용하여 골절 부위를 방해하지 않고 대퇴골 중앙에서 경골 관절까지 골절된 뼈를 채취합니다. 뼈를 둘러싼 근육을 제거하고 후속 처리 단계에서 골절 부위를 지지하기 위해 뼈와 직접 접촉하는 연조직만 남깁니다. 마이크로 모기 직선 지혈 집게를 사용하여 골수 내 핀을 제거하십시오.
- 샘플을 4°C의 포르말린 또는 -20°C의 식염수에 보존합니다. 보존 차량의 선택은 μCT로 다운스트림하는 의도된 응용 분야에 따라 다릅니다. 본 연구에서, 샘플을 -20°C에서 식염수 중에 보존하였다.
2. μCT 스캐닝
- 시료 전처리
- 여러 샘플을 동시에 스캔하려면 최대 6개의 샘플을 맞춤형으로 개발된 3D 프린팅 스캐닝 고정 장치(그림 1 A, B) 또는 이와 유사한 곳에 배치합니다. 동시 스캔은 스캔 시간과 비용을 줄여줍니다. 이 연구에 사용된 맞춤형 고정 장치에는 장골 샘플을 보관할 수 있는 6개의 슬롯과 하이드록시아파타이트(HA) 팬텀을 위한 중앙 구멍이 포함되어 있습니다(그림 1A, B; 재료 표).
알림: HA 팬텀은 4.2단계(아래 참조)에서 μCT 단위(일반적으로 Hounsfield)를 HA 밀도(mgHA/ccm)로 변환하는 표준 역할을 합니다. - 준비된 고정구를 시야의 직경과 유사한 주사기 또는 원뿔형 튜브에 배치합니다(FOV; 그림 1C). 이 연구에서는 21.5mm 시야를 일치시키기 위해 20mm 주사기를 사용했습니다.
- 스캐닝 과정에서 샘플이 건조되는 것을 방지하기 위해 주사기 또는 표준 튜브에 1.3단계에서 사용된 방부제를 채웁니다(이 연구에서는 식염수를 사용함).
- 여러 샘플을 동시에 스캔하려면 최대 6개의 샘플을 맞춤형으로 개발된 3D 프린팅 스캐닝 고정 장치(그림 1 A, B) 또는 이와 유사한 곳에 배치합니다. 동시 스캔은 스캔 시간과 비용을 줄여줍니다. 이 연구에 사용된 맞춤형 고정 장치에는 장골 샘플을 보관할 수 있는 6개의 슬롯과 하이드록시아파타이트(HA) 팬텀을 위한 중앙 구멍이 포함되어 있습니다(그림 1A, B; 재료 표).
- 스캔
- 스캔하기 전에 μCT 기계가 다음과 같이 보정되었는지 확인하십시오: μCT FOV의 중심선에 HA 팬텀을 놓고 팬텀을 스캔하고 HA의 밀도를 측정합니다. 측정된 밀도가 제조업체에서 제공한 밀도와 일치하는지 확인하십시오.
- 샘플 고정장치 중심선을 μCT FOV의 대략적인 중심선에 맞춥니다. 이렇게 하면 샘플이 FOV 내에 있고 긴 축의 방향이 결과 이미지의 축 방향과 거의 일치합니다.
참고: 이 표준화된 방향은 나중에 분석 절차가 관심 부피 내에서 고려되는 조직의 양과 같은 변동에 덜 취약하도록 하는 데 도움이 될 수 있습니다. - μCT 시스템의 스캐닝 파라미터를 설정합니다(재료 표). 이 연구에 사용된 매개변수는 10.5μm(등방성 복셀 크기), 55kVp(에너지/강도), 145μA(전류) 및 300ms(통합 시간)입니다. 마우스 섬유주의 대략적인 두께(20-60μm)를 기준으로 복셀 크기를 결정합니다.8. 다른 보기에서 스캔을 육안으로 검사하여 모든 캘러스 샘플의 전체 부피를 덮고 있는지 확인합니다.

그림 1: 맞춤형 스캐닝 고정 장치의 구조. (A) 스캐닝 픽스처의 이미지(위), 6개의 샘플 슬롯 및 HA 팬텀(아래). (B) 전용 슬롯에 배치된 장골 샘플(위)과 HA 팬텀(아래)을 보여주는 이미지. (C) 20mm 주사기에 넣은 스캐닝 고정 장치를 보여주는 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 이미지 분할
참고: Raw 이미지는 이미지 시퀀스 데이터에 맞게 자동으로 재구성됩니다.
- 이미지 변환: 이미지 처리 소프트웨어를 사용하여 재구성된 이미지 시퀀스 데이터를 DICOM 이미지 시퀀스로 변환합니다(재료 표 참조). 이미지 처리, 분석 및 시각화를 위해 DICOM 이미지 시퀀스를 소프트웨어로 가져옵니다(재료 표 참조).
- 이미지 자르기: 한 번에 하나의 샘플에서 각 이미지 스택을 자르고 전체 샘플이 잘린 볼륨에 포함되도록 합니다(그림 2B). 잘라낸 이미지를 다음과 같이 저장합니다. 화면 왼쪽 위에 있는 파일 탭을 클릭하고 프로젝트 저장을 선택한 다음 화면에 나타나는 옵션에서 프로젝트 크기 최소화 를 선택합니다. 파일은 상용 소프트웨어 형식으로 저장됩니다.
- 이미지 노이즈 제거: 필터링 방법을 사용하여 다음과 같이 노이즈 수준을 줄이고 흐림을 방지합니다.
- 파일 탭을 클릭하고 Open Data를 사용하여 처리할 이미지를 선택합니다. 열린 이미지는 화면 왼쪽 상단의 프로젝트 보기 창에 나타납니다.
- 마우스 오른쪽 버튼을 클릭하여 Image Processing 을 선택한 다음 Filter Sandbox를 선택합니다. 만들기를 클릭합니다.
- 속성 창(화면 왼쪽 하단 모서리에 있음)에서 다음을 수행합니다. Filter(필터) 옆에 있는 드롭다운 메뉴에서 필터 유형을 선택합니다. 해석을 위해 3D 를 선택하십시오. 커널 유형 옆의 드롭다운 메뉴에서 Separable 을 선택합니다. 표준 편차 및 커널 크기 계수에 사용할 값을 각각 옆에 있는 사용 가능한 빈 상자에 입력합니다. 출력 옆에 있는 드롭다운 메뉴에서 입력과 동일(Same as input )을 선택합니다. 적용을 클릭합니다.
참고: 필터 유형(사용 가능한 옵션은 양측, 상자, 가우스, 중앙값, 재귀 지수, 묘사, 이방성 확산, 비국소 평균, 언샵 마스킹 및 FFT 필터) 및 매개변수의 선택은 노이즈 수준과 스캔한 이미지의 복셀 크기에 따라 다릅니다. 가우스 필터의 경우 커널 크기 계수에 일반적으로 사용되는 값인 3 x 3 x 3 및 5 x 5 x 5가 일반적이며 표준 편차8에는 일반적으로 0.5-2.0이 사용됩니다. 본 연구에서는 가우시안 필터를 적용하였으며, 커널 크기 계수와 표준편차는 각각 5 x 5 x 5와 0.8을 사용하였다.
- 이미지 재정렬
참고: 이 단계는 선택 사항입니다. 스캐닝 프로세스 중에 이미징 시스템의 좌표축에 대한 장골 샘플의 정렬 불량이 발생하면 디지털 정렬 방법을 적용하여 정렬 불량을 수정할 수 있습니다(그림 2C).- 다음과 같이 샘플의 3D 렌더링 이미지를 만듭니다. 프로젝트 보기 창에서 필터링되고 잘린 이미지(3.3단계에서 생성됨)를 선택합니다. 드롭다운 메뉴에서 Display( 디스플레이 )를 선택하고 Volume Rendering(볼륨 렌더링 )을 마우스 오른쪽 버튼으로 클릭한 다음 Create(생성)를 클릭합니다. 시상면과 정면의 3D 렌더링 이미지를 육안으로 확인합니다.
- 렌더링된 볼륨을 수동으로 회전하여 세로 축에서 올바른 정렬을 얻습니다. 다음과 같이 회전된 이미지에 변형을 적용합니다: 속성 창에서 변형 편집기를 클릭한 다음 변형 편집기-조작기로 이동하여 드롭다운 메뉴에서 변환기를 선택합니다. 이제 샘플을 회전하고 재정렬할 수 있습니다. 재정렬 프로세스가 완료되면 변형 편집기를 다시 클릭하여 이미지를 잠급니다.
- 3.3단계에서 만든 필터링된 이미지를 다시 샘플링하여 다음과 같이 새 횡방향(축방향) 평면 이미지 슬라이스를 만듭니다. 프로젝트 뷰 창에서 3.4.2단계의 이미지를 선택합니다. 마우스 오른쪽 버튼을 클릭하여 지오메트리 변환(Geometry Transform )을 선택한 다음 드롭다운 메뉴에서 변환된 이미지 리샘플링(Resample Transformed Image )을 선택하고 생성(Create)을 클릭합니다. 속성 창에서 데이터로 이동하여 다음을 수행합니다.보간을 위해 드롭다운 메뉴에서 표준을 선택합니다. 모드에서 Extended(확장)를 선택합니다. 보존을 위해 Voxel Size를 선택하십시오. [Padding value]의 경우 사용 가능한 빈 상자에 0을 입력합니다. 그런 다음 적용을 클릭합니다.
- 관심 볼륨(VOI) 정의
- 가로 이미지 슬라이스를 살펴보고 골절 캘러스의 중심면을 식별합니다. 캘러스의 근위부와 말단부를 기준으로 VOI를 정의합니다. 캘러스 끝을 정의하기 어려운 경우 캘러스 중심 평면에서 떨어진 표준화된 거리를 기준으로 VOI를 정의합니다(그림 2D).
참고: 뼈 리모델링 이전의 치유 단계에서 새로 형성된 직조 뼈의 섬유주 구조가 원래 뼈의 피질 구조와 구별되기 때문에 광물화된 캘러스의 가장자리를 정의하는 것은 쉽습니다. 그러나 리모델링 단계가 계속되면 새로 형성된 뼈는 점진적으로 피질 구조를 획득합니다. 따라서 굳은살의 가장자리를 정의하는 것이 점점 더 어려워집니다.
- 가로 이미지 슬라이스를 살펴보고 골절 캘러스의 중심면을 식별합니다. 캘러스의 근위부와 말단부를 기준으로 VOI를 정의합니다. 캘러스 끝을 정의하기 어려운 경우 캘러스 중심 평면에서 떨어진 표준화된 거리를 기준으로 VOI를 정의합니다(그림 2D).

그림 2: 이미지 분할 . (A) 한 번의 스캔으로 6개의 샘플을 보여주는 이미지. (B) 개별 샘플을 분리하기 위한 이미지 자르기. (C) 잘못 정렬된 세로축을 수정하기 위한 디지털 정렬(노란색 점선). (D) VOI 및 캘러스 중심 평면의 정의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 이미지 분석
- 굳은 살과 피질 뼈의 분할
- 다음과 같이 자동 추적 및 가장자리 추적 옵션이 있는 세그멘테이션 올가미 도구를 사용하여 캘러스의 바깥쪽 경계를 반자동으로 윤곽을 그립니다(그림 3A).
- 변환된 이미지를 다시 조립한 후(3.4.3단계) 화면 상단의 두 번째 탭 행에 있는 세그멘테이션 탭을 클릭합니다. 세그멘테이션 편집기 창의 image 옆에 있는 드롭다운 메뉴에서 변환된 이미지(3.4.3단계에서 생성됨)를 선택합니다.
- MATERIALS 창에서 추가를 두 번 클릭합니다. 이렇게 하면 Material3 및 Material4라는 두 개의 탭이 나타납니다. 마우스 오른쪽 버튼을 클릭하여 material3의 이름을 callus로, material4의 이름을 cortical bone으로 바꿉니다.
- SELECTION 창에서 올가미 아이콘을 클릭합니다. 표시되는 옵션에서 2D 모드의 경우 자유형(Freehand )을 선택하고, 3D 모드의 경우 내부(Inside )를 선택하고, 옵션의 경우 자동 추적( Auto trace ) 및 가장자리 추적(Trace Edges )을 선택합니다. 올가미를 사용하여 관심 영역을 표시합니다.
- VOI에서 샘플링된 슬라이스를 사용하여 이 컨투어링 단계를 반복합니다(그림 3B). 윤곽이 있는 슬라이스는 이격될 수 있다(예를 들어, 20개의 슬라이스로 분리됨).
참고: 복잡한 캘러스 구조가 있는 영역에서는 윤곽이 있는 슬라이스 사이의 간격을 줄여 더 많은 조각을 캡처할 수 있습니다(그림 3A, B). - 다음과 같이 윤곽선이 있는 캘러스 아웃라인을 가로질러 보간하여 완전한 캘러스 레이블을 만듭니다(그림 3C,D). 재료 창에서 캘러스 파일(4.1.1.2단계에서 생성됨)을 선택하고 화면 상단의 선택 탭을 클릭한 다음 드롭다운 메뉴에서 보간을 선택합니다. 선택 창에서 더하기 기호를 클릭합니다.
- 4.1.1.2단계에서 만든 Cortical Bone 파일을 엽니다. 4.1.1 및 4.1.2 단계에서 굳은살에 대해 설명된 대로 수질강을 포함한 피질 뼈를 분할합니다. (그림 4A, B). 윤곽이 있는 골막 피질을 보간하여 4.1.3단계에서 굳은살에 대해 설명된 대로 피질 뼈 레이블을 만듭니다(그림 4C,D).
- 다음과 같이 캘러스의 윤곽 체적과 평균 회색 값을 계산합니다. 화면 맨 위 행의 세그멘테이션(Segmentation ) 탭을 클릭하고 드롭다운 메뉴에서 재료 통계(Material Statistics )를 선택합니다. 이렇게 하면 계산된 모든 값이 포함된 테이블이 생성됩니다. 피질골과 굳은살(피질골을 뺀 후)의 값은 별도로 제공됩니다. 테이블이 생성되면 Export into Workspace를 클릭하여 데이터를 저장합니다.
- 다음과 같이 자동 추적 및 가장자리 추적 옵션이 있는 세그멘테이션 올가미 도구를 사용하여 캘러스의 바깥쪽 경계를 반자동으로 윤곽을 그립니다(그림 3A).
- 그레이 스케일 단위를 골밀도로 변환
- 전체 이미지에서 4.5mm HA 팬텀의 3D 이미지(그림 2B)를 자르고 Segmentation(세그멘테이션)을 클릭합니다. HA 팬텀의 수지에는 5개의 작은 HA 실린더가 포함되어 있습니다(그림 1A). 밀도가 가장 높은 HA 실린더의 경우 육안 검사로 첫 번째 슬라이스와 마지막 슬라이스를 정의합니다.
- 다음과 같이 브러시 도구(그림 5A)를 사용하여 첫 번째 조각과 마지막 조각(가장자리 피하기)에 두 개의 원을 그립니다. 재료 창에서 추가를 네 번 클릭합니다. 마우스 오른쪽 버튼을 클릭하여 material3, material4, material5 및 material6의 이름을 각각 phantom1, phantom2, phantom3 및 phantom4로 바꿉니다. Phantom1을 선택하고 선택 창에서 브러시 아이콘을 클릭한 다음 슬라이더를 사용하여 팬텀의 크기에 따라 브러시 크기(원형 추적)를 조정합니다(원의 크기는 팬텀의 크기보다 작아야 함).
- 다음과 같이 두 원 사이에 보간을 적용하여 각 HA 실린더에 대한 볼륨을 생성합니다(그림 5B). 재료 창에서 Phantom1을 선택하고 화면 맨 위 행의 선택 탭을 클릭한 다음 드롭다운 메뉴에서 보간을 선택합니다. 선택 창에서 더하기 기호를 클릭합니다.
- 두 번째로 높은 HA 밀도에서 시작하여 두 번째로 낮은 HA 밀도로 끝나는 나머지 HA 실린더 3개로 분할 프로세스를 반복합니다(그림 5B). HA 밀도가 가장 낮은 실린더는 분할하기 어려운 경우가 많기 때문에 제외할 수 있습니다.
- 생성된 3D 레이블을 사용하여 분석된 HA 실린더 4개의 평균 회색 값을 계산합니다. 스프레드시트( 재료 표 참조) 또는 이와 유사한 것을 사용하여 팬텀 제조업체에서 제공한 평균 회색 값과 해당 골밀도(BMD) 값을 표시합니다. 선형 회귀를 사용하여 BMD와 회색 값 사이의 상관 방정식을 생성합니다.
- 광물화된 캘러스의 세분화 및 BMD 계산
- 4.2.5단계에서 생성된 상관 방정식과 광물화된 캘러스와 광물화되지 않은 캘러스를 구별하기 위해 선택한 임계값에 따라 해당 회색 값 임계값을 결정합니다. 따라서 임계값보다 큰 회색 값을 가진 캘러스 영역을 광물화된 캘러스로 표시하고 나머지는 광물화되지 않은 캘러스로 표시합니다(그림 6A, B). 이 연구에서는 250mgHA/ccm을 광물화된 캘러스14,15의 역치로 사용했습니다.
- 총 캘러스와 광물화된 캘러스 부피를 계산합니다. 이 값을 기반으로 뼈 부피 분율(총 캘러스 부피로 정규화된 광물화된 캘러스 부피 = BV/TV)을 계산합니다. 총 캘러스에 대해 측정된 평균 회색 값을 사용하여 4.2.5에서 생성된 상관 방정식을 사용하여 캘러스의 BMD를 계산합니다.
참고: 연구 목표와 분석에 사용된 소프트웨어에 따라 SMI(구조 모델 지수), 섬유주 두께 및 이방성 정도와 같은 기타 매개변수를 계산할 수 있습니다.

그림 3: 캘러스 바깥쪽 경계의 분할. (A) 캘러스 바깥쪽 경계의 윤곽선(빨간색 선). (B) VOI에서 샘플링된 슬라이스의 윤곽선(빨간색 슬라이스). (C) 보간(빨간색 볼륨)으로 생성된 3D 캘러스 레이블입니다. (D) C에 표시된 캘러스 라벨의 단면(피질골 포함). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4 : 피질 뼈의 분할. (A) 피질의 골막 표면의 윤곽 (녹색 선). (B) VOI에서 샘플링된 슬라이스의 윤곽선(녹색 슬라이스). (C) 골막 피질과 굳은살의 보간된 레이블로 생성된 피질골(수질 구멍 포함, 녹색)과 캘러스(빨간색)의 3D 레이블. (D) 굳은살(빨간색)과 피질골(골수내강 포함, 녹색)의 단면. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: 그레이스케일 단위를 BMD로 변환 . (A) 첫 번째 슬라이스와 마지막 슬라이스(빨간색 원)에서 HA 실린더의 윤곽선. (B) 3D 보간된 HA 실린더(왼쪽)와 단면(오른쪽). 갈색: 가장 높은 HA 밀도; 파란색: 두 번째로 높은 HA 밀도; 보라색: 세 번째로 높은 HA 밀도; 녹색: 네 번째로 높은 HA 밀도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
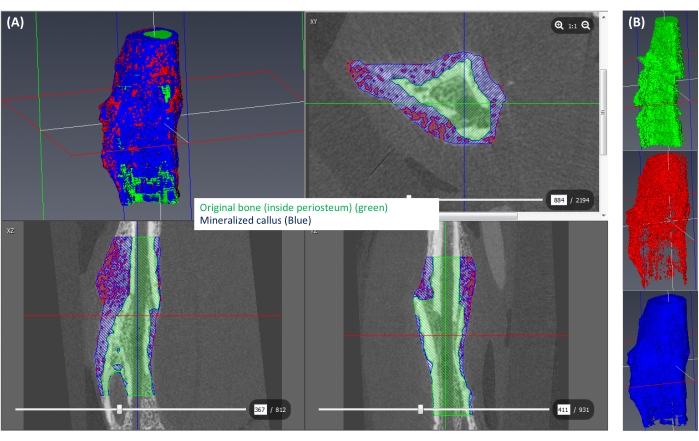
그림 6: 광물화된 캘러스의 분할. (A) 광물화된 캘러스(≥250 mgHA/ccm)는 파란색으로, 나머지 캘러스(<250 mgHA/ccm)는 빨간색으로, 원래 뼈에 해당하는 공간은 녹색으로 표시됩니다. (B) 분리된 각 레이블의 3D 보기. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
골절 치유 동안 뼈 형성을 모니터링하기 위해 성인 수컷 C75BL/6J 마우스에서 중간 골격 개방 경골 골절을 유도했습니다. 골절은 골수내 손발톱을 사용하여 안정화시켰는데, 이는 2차 치유의 확립된 모델이다13. 캘러스 조직은 골절 후 14일, 21일 및 28일에 수확되었습니다12. 이 시점은 치유의 여러 단계를 나타냅니다. 2차 뼈 치유 동안 연골내골 형성은 섬유연골(연?...
토론
이 연구의 목적은 종종 뼈 및 골절 치유 연구의 기본이 되는 3D 광물화된 캘러스 구조의 정확한 정량화를 목표로 μCT 분석을 위한 자세한 프로토콜을 설명하는 것입니다. 이 프로토콜은 이미지 시각화, 분할/라벨링 및 간단한 것부터 복잡한 것까지 다양한 측정을 용이하게 하는 범용 최첨단 3D 이미지 분석 소프트웨어 플랫폼을 활용합니다.
프로토콜에서 가장 시간이 많이 걸리...
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
이 작업은 미국 국립보건원(NIH) R01 DK121327에서 R.A.E로, R01 AR071968에서 F.K.로 지원되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher chemical | SF100-20 | Used for bone tissue fixation |
| Avizo | Thermo Scientific | Image processing and analysis software | |
| Hydroxyapatite phantom | Micro-CT HA D4.5, QRM | QRM-70128 | |
| Image Processing Language | Scanco | Used to convert raw images to DICOM images | |
| Micro-Mosquito Straight Hemostatic Forceps | Medline | Used to remove the intramedullary pin | |
| Microsoft Excel | Microsoft | Spreadsheet software | |
| Scanco mCT system (vivaCT 40) | Scanco | Used for µCT imaging |
참고문헌
- Rüegsegger, P., Koller, B., Müller, R. A microtomographic system for the nondestructive evaluation of bone architecture. Calcified Tissue International. 58 (1), 24-29 (1996).
- Müller, R., et al. Morphometric analysis of human bone biopsies: a quantitative structural comparison of histological sections and micro-computed tomography. Bone. 23 (1), 59-66 (1998).
- Waarsing, J. H., et al. Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data. Bone. 34 (1), 163-169 (2004).
- Boyd, S. K., Davison, P., Müller, R., Gasser, J. A. Monitoring individual morphological changes over time in ovariectomized rats by in vivo micro-computed tomography. Bone. 39 (4), 854-862 (2006).
- Christiansen, B. A. Effect of micro-computed tomography voxel size and segmentation method on trabecular bone microstructure measures in mice. Bone Reports. 5, 136-140 (2016).
- Holdsworth, D. W., Thornton, M. M. Micro-CT in small animal and specimen imaging. Trends in Biotechnology. 20 (8), 34-39 (2002).
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Morgan, E. F., et al. Micro-computed tomography assessment of fracture healing: Relationships among callus structure, composition, and mechanical function. Bone. 44 (2), 335-344 (2009).
- O'Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50 (6), 1357-1367 (2012).
- Bissinger, O., et al. Fully automated segmentation of callus by micro-CT compared to biomechanics. Journal of Orthopaedic Surgery and Research. 12 (1), 108 (2017).
- Brown, M. L., et al. Delayed fracture healing and increased callus adiposity in a C57BL/6J murine model of obesity-associated type 2 diabetes mellitus. PLOS One. 9 (6), 99656 (2014).
- Khajuria, D. K., et al. Aberrant structure of fibrillar collagen and elevated levels of advanced glycation end products typify delayed fracture healing in the diet-induced obesity mouse model. Bone. 137, 115436 (2020).
- Sigurdsen, U., Reikeras, O., Hoiseth, A., Utvag, S. E. Correlations between strength and quantitative computed tomography measurement of callus mineralization in experimental tibial fractures. Clinical Biomechanics. 26 (1), 95-100 (2011).
- Duvall, C. L., Taylor, W. R., Weiss, D., Wojtowicz, A. M., Guldberg, R. E. Impaired angiogenesis, early callus formation, and late stage remodeling in fracture healing of osteopontin-deficient mice. Journal of Bone and Mineral Research. 22 (2), 286-297 (2007).
- Gerstenfeld, L. C., et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. Journal of Bone and Mineral Research. 24 (2), 196-208 (2009).
- Alentado, V. J., et al. Validation of the modified radiographic union score for tibia fractures (mRUST) in murine femoral fractures. Frontiers in Endocrinology. 13, 911058 (2022).
- Yu, K. E., et al. Enhancement of impaired MRSA-infected fracture healing by combinatorial antibiotics and modulation of sustained inflammation. Journal of Bone and Mineral Research. 37 (1), 1352-1365 (2022).
- Nyman, J. S., et al. Quantitative measures of femoral fracture repair in rats derived by micro-computed tomography. Journal of Biomechanics. 42 (7), 891-897 (2009).
- Fiset, S., et al. Experimental validation of the radiographic union score for tibial fractures (RUST) using micro-computed tomography scanning and biomechanical testing in an in-vivo rat model. The Journal of Bone and Joint Surgery. 100 (21), 1871-1878 (2018).
- Shefelbine, S. J., et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis. Bone. 36 (3), 480-488 (2005).
- Liu, Y., et al. Glucocorticoid-induced delayed fracture healing and impaired bone biomechanical properties in mice. Clinical Interventions in Aging. 13, 1465-1474 (2018).
- Watson, P. J., Fitton, L. C., Meloro, C., Fagan, M. J., Gröning, F. Mechanical adaptation of trabecular bone morphology in the mammalian mandible. Scientific Reports. 8 (1), 7277 (2018).
- Nie, C., Wang, Z., Liu, X. The effect of depression on fracture healing and osteoblast differentiation in rats. Neuropsychiatric Disease and Treatment. 14, 1705-1713 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유