A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הערכת ריפוי שברים בעצם באמצעות טומוגרפיה מיקרו-ממוחשבת
* These authors contributed equally
In This Article
Summary
טומוגרפיה מיקרו-ממוחשבת (μCT) היא כלי הדמיה לא הרסני המסייע בהערכת מבנה העצם במחקרים פרה-קליניים, אולם קיים חוסר הסכמה על הליכי μCT לניתוח יבלת ריפוי העצם. מחקר זה מספק פרוטוקול μCT שלב אחר שלב המאפשר מעקב אחר ריפוי שברים.
Abstract
טומוגרפיה מיקרו-ממוחשבת (μCT) היא שיטת ההדמיה הנפוצה ביותר המאפיינת את המורפולוגיה התלת-ממדית (3D) של עצם ועצם חדשה שנוצרה במהלך ריפוי שברים בחקירות מדעיות תרגומיות. מחקרים על ריפוי שברים ארוכים במכרסמים כוללים בדרך כלל ריפוי משני והיווצרות של יבלת מינרלית. צורת היבלת שנוצרה וצפיפות העצם החדשה שנוצרה עשויות להשתנות באופן משמעותי בין נקודות זמן וטיפולים. בעוד שמתודולוגיות סטנדרטיות לכימות פרמטרים של עצם קליפת המוח והטרבקולר שלמות נמצאות בשימוש נרחב ומוטמעות בתוכנות זמינות מסחרית, קיים חוסר הסכמה על נהלים לניתוח יבלת הריפוי. מטרת עבודה זו היא לתאר פרוטוקול סטנדרטי המכמת את נפח העצם, את צפיפות המינרלים ואת צפיפות המינרלים של יבלת הריפוי. הפרוטוקול מתאר פרמטרים שונים שיש לקחת בחשבון במהלך ההדמיה והניתוח, כולל יישור הדגימה במהלך ההדמיה, גודל נפח העניין ומספר הפרוסות המעוצבות כדי להגדיר את היבלת.
Introduction
הדמיית טומוגרפיה מיקרו-ממוחשבת (μCT) נמצאת בשימוש נרחב במחקר עצמות פרה-קליני, ומספקת תמונות לא פולשניות ברזולוציה גבוהה להערכת המיקרו-מבנה של עצמות 1,2,3,4,5. μCT כולל מספר רב של תמונות רנטגן, המתקבלות ממדגם מסתובב או באמצעות מקור וגלאי רנטגן מסתובב. אלגוריתמים משמשים לשחזור נתונים נפחיים תלת-ממדיים בצורת ערימה של פרוסות תמונה. CT קליני הוא תקן הזהב להדמיית תלת-ממד של עצמות אדם, ו-μCT היא טכניקה נפוצה להערכת יעילות ריפוי העצם בחיות ניסוי 1,2,3,4,6,7. לעצם מינרלית יש ניגודיות מצוינת לצילום רנטגן, בעוד שלרקמות רכות יש ניגודיות גרועה יחסית, אלא אם כן נעשה שימוש בחומר ניגוד. בהערכה של ריפוי שברים, μCT מייצר תמונות המספקות מידע מפורט על המבנה התלת-ממדי והצפיפות של היבלת המינרלית. סריקת μCT In vivo יכולה לשמש גם להערכת אורך, מהלך זמן של ריפוי שברים.
הכימות של עצם קליפת המוח והטרבקולר השלמות באמצעות μCT הוא בדרך כלל מבוסס היטב וסטנדרטי8. למרות שמחקרים פרה-קליניים משתמשים במגוון מתודולוגיות כימות כדי לנתח ריפוי שברים 9,10,11, פרוטוקול מפורט של ניתוח תמונת μCT לכימות יבלות טרם פורסם. לכן, מטרת מחקר זה היא לספק פרוטוקול מפורט שלב אחר שלב להדמיית μCT וניתוח של יבלות ריפוי עצם.
Protocol
הפרוטוקול הבא פותח כדי לאפיין יבלות ריפוי עצם ארוכות שנקצרו מעכברים שעברו המתת חסד. עם זאת, רוב השלבים יכולים להיות מיושמים על חולדות ומשמשים גם לסריקת in vivo של עצמות שבורות. הפרוטוקול מתאר מערכת μCT מסוימת ותוכנות ספציפיות לעיבוד, ניתוח והדמיה של תמונות (ראה טבלת חומרים), אך המתודולוגיה ישימה בדרך כלל לסורקים ותוכנות אחרות. הפרוטוקול אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של המכללה לרפואה של אוניברסיטת פנסילבניה. עכברים ששימשו במחקר זה היו עכברי C57BL/6J זכרים בני 16 שבועות (משקל ממוצע 31.45 ± 3.2 גרם).
1. קצירת רקמות ושימורן
הערה: השתמש במודל שבר מורין מתאים. במחקר זה נעשה שימוש במודל השבר הטיביאלי הפתוח האמצעי-דיאפיזי על פי הפרוטוקול הסטנדרטי המתוארב-12,13.
- בסוף ניסוי מודל השבר, הרדימו את העכבר על ידי מתן זריקה תוך צפקית של קטמין או קסילזין (500 מ"ג/ק"ג או 50 מ"ג/ק"ג, בהתאמה).
- בעזרת מספריים, קוצרים את עצם השבר מאמצע עצם הירך למפרק הטיביוטלרי מבלי להפריע לאתר השבר. הסר את השרירים המקיפים את העצם והשאיר רק את הרקמה הרכה שנמצאת במגע ישיר עם העצם כדי לתמוך באתר השבר במהלך שלבי העיבוד הבאים. הסר את הסיכה התוך מדולרית באמצעות מלקחיים המוסטטיים ישרים מיקרו-יתוש.
- שמור את הדגימות פורמלין ב 4 ° C או מלוחים ב -20 ° C. בחירת רכב השימור תלויה ביישומים המיועדים במורד הזרם ל- μCT. במחקר זה, הדגימות נשמרו במי מלח ב -20 מעלות צלזיוס.
2. סריקת μCT
- הכנת דוגמאות
- לסריקה סימולטנית של דגימות מרובות, מקמו עד שש דגימות במתקן סריקה מותאם אישית שפותח בתלת-ממד (איור 1 A,B) או דומה. סריקה סימולטנית מפחיתה את זמן הסריקה ואת העלות. גוף התאורה המותאם אישית ששימש במחקר זה מכיל שישה חריצים להחזקת דגימות העצם הארוכות וחור מרכזי עבור פנטום הידרוקסיאפטיט (HA) (איור 1A,B; טבלת חומרים).
הערה: פאנטום HA ישמש כתקן בשלב 4.2 (ראה להלן) להמרת יחידות μCT (בדרך כלל Hounsfield) לצפיפות HA (mgHA/ccm). - מניחים את המתקן המוכן במזרק או בצינור חרוטי הדומה לקוטר שדה הראייה (FOV; איור 1C). במחקר זה נעשה שימוש במזרק בקוטר 20 מ"מ כדי להתאים לשדה הראייה של 21.5 מ"מ.
- כדי למנוע מהדגימות להתייבש במהלך תהליך הסריקה, מלא את המזרק או את הצינור הקנוני בחומר המשמר המשמש בשלב 1.3 (במחקר זה נעשה שימוש במי מלח).
- לסריקה סימולטנית של דגימות מרובות, מקמו עד שש דגימות במתקן סריקה מותאם אישית שפותח בתלת-ממד (איור 1 A,B) או דומה. סריקה סימולטנית מפחיתה את זמן הסריקה ואת העלות. גוף התאורה המותאם אישית ששימש במחקר זה מכיל שישה חריצים להחזקת דגימות העצם הארוכות וחור מרכזי עבור פנטום הידרוקסיאפטיט (HA) (איור 1A,B; טבלת חומרים).
- סריקה
- לפני הסריקה, ודא שמכשיר ה-μCT מכויל באופן הבא: מקם פנטום HA בקו האמצע של ה-μCT FOV, סרוק את הפנטום ומדוד את צפיפות ה-HA. ודא שהצפיפות הנמדדת תואמת את הצפיפות שסופקה על-ידי היצרן.
- יישרו את קו המרכז של גוף התאורה לדוגמה עם קו האמצע המשוער של μCT FOV. הדבר מבטיח שהדגימות נמצאות בתוך ה-FOV, והצירים הארוכים שלהן הם בעלי כיוון חופף בקירוב לכיוון הצירי של התמונות המתקבלות.
הערה: אוריינטציה סטנדרטית זו יכולה לסייע מאוחר יותר להפוך את הליך הניתוח לפחות נוטה לשינויים כגון בכמות הרקמה הנחשבת בתוך היקף העניין. - הגדר את פרמטרי הסריקה של מערכת μCT (רשימת חומרים). הפרמטרים ששימשו במחקר זה הם 10.5 מיקרומטר (גודל ווקסל איזוטרופי), 55 kVp (אנרגיה/עוצמה), 145 μA (זרם) ו-300 מילישניות (זמן אינטגרציה). קבע את גודל הווקסל בהתבסס על העובי המשוער של טרבקולה העכבר (20-60 מיקרומטר)8. בדוק חזותית את הסריקה בתצוגות שונות כדי לוודא שהיא מכסה את כל עוצמת הקול של כל דגימות היבלות.

איור 1: מבנה מתקן הסריקה המותאם אישית. (A) תמונות של מתקן הסריקה (למעלה), המציגות את ששת חריצי הדגימה, ואת פנטום HA (למטה). (B) תמונות המציגות את דגימת העצם הארוכה (למעלה) ואת פנטום ה-HA (למטה) שהונחו בחריצים הימורים. (C) תמונות המציגות את מתקן הסריקה מונח במזרק בקוטר 20 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
3. פילוח תמונות
הערה: תמונות גולמיות משוחזרות אוטומטית לנתוני רצף תמונות.
- המרת תמונה: המירו את נתוני רצף התמונות המשוחזרים לרצפי תמונות DICOM באמצעות תוכנה לעיבוד תמונה (ראו טבלת חומרים). ייבאו רצפי תמונות DICOM לתוכנה (ראו טבלת חומרים) לצורך עיבוד, ניתוח והדמיה של תמונות (איור 2A).
- חיתוך תמונות: דגימה אחת בכל פעם, חתכו כל אוסף תמונות וודאו שכל הדגימה כלולה באמצעי האחסון החתוך (איור 2B). שמור את התמונה החתוכה באופן הבא: לחץ על הכרטיסיה קובץ בפינה הימנית העליונה של המסך, בחר שמור פרוייקט ולאחר מכן בחר מזער גודל פרוייקט מהאפשרויות המופיעות על המסך. הקובץ יישמר בפורמט התוכנה המסחרית.
- הכחשת תמונה: השתמש בשיטת סינון כדי להפחית את רמת הרעש ולמנוע טשטושים באופן הבא.
- לחץ על הכרטיסיה קובץ ובחר את התמונה לעיבוד באמצעות נתונים פתוחים. התמונה שנפתחה תופיע בחלון תצוגת הפרויקט בפינה השמאלית העליונה של המסך.
- לחץ לחיצה ימנית כדי לבחור עיבוד תמונה ולאחר מכן סנן ארגז חול. לחץ על צור.
- בצע את הפעולות הבאות בחלון מאפיינים (בפינה השמאלית התחתונה של המסך): בחר נתונים כסוג התצוגה המקדימה; בחר את סוג המסנן מהתפריט הנפתח לצד מסנן; בחר 3D לפרשנות; בחר ניתן להפרדה מהתפריט הנפתח לצד סוג הליבה; מלא את הערכים שישמשו עבור סטיית תקן ומקדם גודל ליבה בתיבה הריקה הזמינה ליד כל אחד מהם; בחר זהה לקלט מהתפריט הנפתח לצד פלט; לחץ על החל.
הערה: בחירת סוג המסנן (האפשרויות הזמינות הן דו-צדדית, תיבה, גאוסיאנית, חציון, מעריכי רקורסיבי, תיחום, דיפוזיה אנאיזוטרופית, אמצעים לא מקומיים, מיסוך לא חד ומסנן FFT) והפרמטרים תלויים ברמת הרעש ובגודל הווקסל של תמונות סרוקות. עבור מסנן גאוס, 3 x 3 x 3 ו- 5 x 5 x 5 הם ערכים נפוצים עבור גורם גודל הליבה, ו- 0.5-2.0 משמש בדרך כלל עבור סטיית תקן8. במחקר זה הוחל מסנן גאוס, ו- 5 x 5 x 5 ו- 0.8 שימשו לגורם גודל ליבה וסטיית תקן, בהתאמה.
- יישור מחדש של התמונה
הערה: זהו שלב אופציונלי. כאשר מתרחשת אי-התאמה של דגימות עצם ארוכות ביחס לצירי הקואורדינטות של מערכת ההדמיה במהלך תהליך הסריקה, ניתן ליישם שיטת יישור דיגיטלית כדי לתקן את אי-ההתאמה (איור 2C).- צור תמונה מעובדת בתלת-ממד של הדגימה באופן הבא. בחלון תצוגת הפרוייקט, בחר את התמונה המסוננת והחתוכה (שנוצרה בשלב 3.3). לחץ באמצעות לחצן העכבר הימני כדי לבחור תצוגה ולאחר מכן עיבוד עוצמת קול מהתפריט הנפתח ולאחר מכן לחץ על צור. בדוק חזותית את התמונה המעובדת בתלת-ממד במישור הקשת ובמישור הקדמי.
- סובב ידנית את אמצעי האחסון המעובד לקבלת יישור טוב בציר האורך. החל את ההמרה על התמונות המסובבות באופן הבא: בחלון המאפיינים, לחץ על עורך שינוי הצורה, ולאחר מכן עבור אל שינוי צורה עורך-מניפולטור ובחר שנאי מהתפריט הנפתח. כעת ניתן לסובב את המדגם וליישר אותו מחדש. לאחר השלמת תהליך היישור מחדש, לחץ שוב על עורך שינוי הצורה כדי לנעול את התמונה.
- דגימה מחדש של התמונה המסוננת (שנוצרה בשלב 3.3) כדי ליצור פרוסות תמונה רוחביות (ציריות) חדשות באופן הבא: בחלון תצוגת Project, בחר את התמונה משלב 3.4.2. לחץ לחיצה ימנית כדי לבחור שינוי צורה בגיאומטריה ולאחר מכן דגימה מחדש של תמונה שהשתנתה מהתפריט הנפתח ולחץ על צור. בחלון המאפיינים, עבור אל נתונים ובצע את הפעולות הבאות: עבור אינטרפולציה, בחר רגיל מהתפריט הנפתח; עבור מצב, בחר מורחב; לשימור, בחר גודל ווקסל; בתיבה ערך ריווח, הזן אפס בתיבה הריקה הזמינה. לאחר מכן לחץ על החל.
- הגדרת היקף הריבית (VOI)
- עברו על פרוסות התמונה הרוחבית וזהו את המישור המרכזי של יבלת השבר. הגדר את ה- VOI בהתבסס על הקצוות הפרוקסימליים והדיסטליים של היבלת. במקרים שבהם קצות היבלות קשים להגדרה, הגדירו את ה-VOI בהתבסס על מרחק סטנדרטי מהמישור המרכזי של היבלות (איור 2D).
הערה: במהלך שלבי ריפוי שקודמים לעיצוב מחדש של העצם, קל להגדיר את הקצוות של היבלת המינרלית מכיוון שהמבנה הטרבקולרי של העצם הארוגה, שזה עתה נוצר, שונה מהמבנה הקורטיקלי של העצם המקורית. עם זאת, כאשר שלב remodeling מתרחש, העצם החדשה שנוצרה רוכשת את המבנה קליפת המוח בהדרגה; לכן, הגדרת הקצוות של יבלת הופך מאתגר יותר ויותר.
- עברו על פרוסות התמונה הרוחבית וזהו את המישור המרכזי של יבלת השבר. הגדר את ה- VOI בהתבסס על הקצוות הפרוקסימליים והדיסטליים של היבלת. במקרים שבהם קצות היבלות קשים להגדרה, הגדירו את ה-VOI בהתבסס על מרחק סטנדרטי מהמישור המרכזי של היבלות (איור 2D).

איור 2: פילוח תמונות . (A) תמונה המציגה שש דגימות בסריקה אחת. (B) חיתוך תמונה לבידוד דגימות בודדות. (C) יישור דיגיטלי לתיקון ציר אורך שגוי (קו מקווקו צהוב). (ד) הגדרת המישור המרכזי VOI ו-callus. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
4. ניתוח תמונות
- פילוח של היבלות ועצם קליפת המוח
- צור את הגבול החיצוני של היבלת באופן אוטומטי למחצה באמצעות הכלי לאסו סגמנטציה עם אפשרויות מעקב ועקיבה אוטומטיות (איור 3A) באופן הבא:
- לאחר הרכבה מחדש של תמונות שעברו טרנספורמציה (שלב 3.4.3), לחץ על הכרטיסיה סגמנטציה בשורת הכרטיסייה השניה מראש המסך. בחלון עורך הסגמנטציה, בחר תמונה שעברה טרנספורמציה (נוצרה בשלב 3.4.3) מהתפריט הנפתח לצד תמונה.
- בחלון חומרים, לחץ פעמיים על הוסף; על ידי כך, יופיעו שתי כרטיסיות בשם Material3 ו- Material4. לחץ לחיצה ימנית כדי לשנות את שם material3 ל-callus ואת material4 לעצם קליפת המוח.
- בחלון SELECTION, לחץ על סמל הלאסו; מתוך האפשרויות שמופיעות, בחרו Freehand עבור מצב דו-ממד, Inside עבור מצב תלת-ממד, וקצוות Auto trace ו-Trace עבור אפשרויות. השתמש בלאסו כדי לסמן את אזורי העניין.
- חזרו על שלב קווי המתאר הזה עם פרוסות שנדגמו לאורך ה-VOI (איור 3B). ניתן לרווח את הפרוסות עם קווי המתאר זו מזו (למשל, להפריד ביניהן ב-20 פרוסות).
הערה: באזורים עם מבני יבלות מורכבים, המשתמש יכול לשקול להקטין את הריווח בין פרוסות עם קווי מתאר כדי ללכוד יותר מקטעים (איור 3A,B). - בצע אינטרפולציה לאורך קווי המתאר של היבלות המתארות כדי ליצור תווית יבלות מלאה (איור 3C,D) באופן הבא: בחלון חומרים, בחר את קובץ Callus (שנוצר בשלב 4.1.1.2.), לחץ על הכרטיסיה בחירה בחלק העליון של המסך ובחר אינטרפולציה מהתפריט הנפתח. בחלון SELECTION, לחץ על סימן הפלוס.
- פתח את קובץ העצם הקורטיקלי שנוצר בשלב 4.1.1.2. פלח את עצם קליפת המוח, כולל החלל המדולרי, כפי שמתואר עבור היבלת בשלבים 4.1.1 ו- 4.1.2. (איור 4A,B). בצעו אינטרפולציה של קליפת המוח הפריאוסטאלית המעוגלת כדי ליצור תווית עצם קליפת המוח כפי שמתואר עבור היבלות בשלב 4.1.3 (איור 4C,D).
- חשב את עוצמת הקול המתוארת ואת הערך האפור הממוצע של היבלת באופן הבא: לחץ על הכרטיסייה סגמנטציה בשורה העליונה של המסך ובחר סטטיסטיקת חומרים מהתפריט הנפתח. פעולה זו תיצור טבלה המכילה את כל הערכים המחושבים. הערכים של עצם קליפת המוח ואת callus (לאחר הפחתת עצם קליפת המוח) מסופקים בנפרד. לאחר יצירת הטבלה, לחץ על יצא לסביבת עבודה כדי לשמור את הנתונים.
- צור את הגבול החיצוני של היבלת באופן אוטומטי למחצה באמצעות הכלי לאסו סגמנטציה עם אפשרויות מעקב ועקיבה אוטומטיות (איור 3A) באופן הבא:
- המרה של יחידות בקנה מידה אפור לצפיפות מינרלים עצם
- חתוך את התמונה התלת-ממדית של פנטום HA בגודל 4.5 מ"מ (איור 2B) מהתמונה כולה ולחץ על סגמנטציה. השרף של פנטום HA מכיל חמישה גלילי HA קטנים (איור 1A). עבור גליל HA בעל הצפיפות הגבוהה ביותר, הגדר את הפרוסה הראשונה והאחרונה על ידי בדיקה חזותית.
- ציירו שני עיגולים בפרוסה הראשונה והאחרונה (הימנעו מקצוות) בעזרת הכלי מברשת (איור 5A) באופן הבא: בחלון MATERIALS, לחצו על ' הוסף' ארבע פעמים. לחץ באמצעות לחצן העכבר הימני כדי לשנות את שמם של material3, material4, material5 ו- material6 ל- phantom1, phantom2, phantom3 ו- phantom4, בהתאמה. בחרו ' פאנטום1', לחצו על סמל המברשת בחלון 'בחירה' והשתמשו במחוון להתאמת גודל המברשת (עקיבה מעגלית) בהתאם לגודל הפנטום (גודל העיגול צריך להיות קטן מזה של הפאנטום).
- החל אינטרפולציה בין שני העיגולים כדי ליצור אמצעי אחסון לכל גליל HA (איור 5B) באופן הבא: בחלון חומרים, בחר Phantom1, לחץ על הכרטיסיה בחירה בשורה העליונה של המסך ובחר אינטרפולציה מהתפריט הנפתח. בחלון SELECTION, לחץ על סימן החיבור.
- חזור על תהליך הסגמנטציה עם שלושה מגלילי ה-HA הנותרים, החל מצפיפות ה-HA השנייה בגובהה וכלה בצפיפות ה-HA השנייה הנמוכה ביותר (איור 5B). ניתן להוציא את הצילינדר עם צפיפות HA הנמוכה ביותר מכיוון שלעתים קרובות קשה לפלח.
- השתמש בתוויות התלת-ממדיות שנוצרו כדי לחשב את הערכים האפורים הממוצעים של ארבעת גלילי ה-HA שנותחו. באמצעות גיליון אלקטרוני (ראה טבלת חומרים) או דומה, התווה את ערכי האפור הממוצע ואת ערכי צפיפות המינרלים התואמים של העצם (BMD) שסופקו על-ידי יצרן הפנטום. צור משוואת מתאם בין BMD לבין הערכים האפורים באמצעות רגרסיה ליניארית.
- פילוח של יבלת מינרליזציה וחישוב של BMD
- בהתבסס על משוואת המתאם שנוצרה בשלב 4.2.5 והסף שנבחר המבדיל בין יבלות מינרליות ולא מינרליות, קבע את סף הערך האפור המתאים. בהתאם לכך, תייגו את אזור היבלות עם ערכים אפורים גדולים מהסף כקאלוס שעבר מינרליזציה ותייגו את השאר כלא מינרליים (איור 6A,B). במחקר זה, 250 mgHA/ccm שימש כסף עבור יבלת מינרלית14,15.
- חשב את סך כרכי היבלת והמינרלים. בהתבסס על ערכים אלה, חשב את מקטע נפח העצם (נפח יבלות מינרלי מנורמל לנפח היבלות הכולל = BV / TV). השתמש בערך האפור הממוצע הנמדד עבור היבלת הכוללת כדי לחשב את BMD של יבלות באמצעות משוואת המתאם הנוצרת ב- 4.2.5.
הערה: בהתבסס על מטרת המחקר והתוכנה המשמשת לניתוח, ניתן לחשב פרמטרים אחרים כגון SMI (מדד מודל מבנה), עובי טרבקולרי ומידת אנאיזוטרופיה.

איור 3: פילוח הגבול החיצוני של היבלת. (A) קו מתאר של הגבול החיצוני של היבלת (קו אדום). (B) קווי מתאר בפרוסות שנדגמו לרוחב ה-VOI (פרוסות אדומות). (C) תווית יבלות תלת-ממדית שנוצרה על-ידי אינטרפולציה (נפח אדום). (D) חתך רוחב של תווית היבלות המוצגת ב-C (כולל עצם קליפת המוח). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 4: פילוח של עצם קליפת המוח. (A) קווי מתאר של פני השטח הפריאוסטיאליים של קליפת המוח (קו ירוק). (B) קווי מתאר בפרוסות שנדגמו לרוחב ה-VOI (פרוסות ירוקות). (C) תווית תלת-ממדית של עצם קליפת המוח (המכילה את החלל המדולרי; ירוק) ושל היבלת (באדום) שנוצרה מתוויות אינטרפולציה של קליפת המוח הפריאוסטאלית ושל היבלת. (D) חתך רוחב של היבלת (אדום) ועצם קליפת המוח (המכילה את החלל התוך-מדולרי; ירוק). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 5: המרה של יחידות בקנה מידה אפור ל-BMD. (A) קווי המתאר של גליל HA בפרוסה הראשונה והאחרונה (עיגולים אדומים). (B) מיכלי HA באינטרפולציה תלת-ממדית (משמאל) וחתך רוחב (מימין). חום: צפיפות HA הגבוהה ביותר; כחול: צפיפות HA השנייה בגובהה; סגול: צפיפות HA השלישית בגובהה; ירוק: צפיפות ההיאלורונית הרביעית בגובהה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
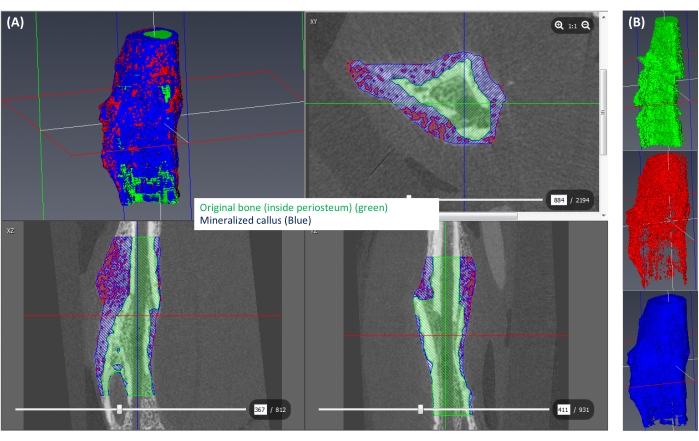
איור 6: פילוח של היבלת המינרלית. (A) היבלת המינרלית (≥250 mgHA/ccm) מוצגת בכחול, שאר היבלת (<250 mgHA/ccm) מוצגת באדום, והחלל המתאים לעצם המקורית מוצג בירוק. (B) תצוגה תלת-ממדית של כל תווית מבודדת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
תוצאות
כדי לעקוב אחר היווצרות העצם במהלך ריפוי השבר, נגרם שבר טיביאלי פתוח באמצע דיאפיזה בעכברים בוגרים, זכרים C75BL/6J. השבר יוצב באמצעות ציפורן תוך מדולרית, מודל מבוסס של ריפוי משני13. רקמות יבלות נקצרו בימים 14, 21 ו-28 לאחר השבר12. נקודות זמן אלה מייצגות שלבים שונים של ריפוי. ה?...
Discussion
מטרת מחקר זה היא לתאר פרוטוקול מפורט לניתוח μCT במטרה לכמת במדויק את מבנה היבלות המינרלי התלת-ממדי, שהוא לעתים קרובות בסיסי במחקרי ריפוי עצמות ושברים. הפרוטוקול משתמש בפלטפורמת תוכנה מתקדמת לניתוח תמונות תלת-ממד לשימוש כללי המאפשרת הדמיית תמונות, סגמנטציה/תיוג ומדידות הנעות בין פשוט למור?...
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי המכונים הלאומיים לבריאות (NIH) R01 DK121327 ל- R.A.E ו- R01 AR071968 ל- F.K.
Materials
| Name | Company | Catalog Number | Comments |
| 10% neutral buffered formalin | Fisher chemical | SF100-20 | Used for bone tissue fixation |
| Avizo | Thermo Scientific | Image processing and analysis software | |
| Hydroxyapatite phantom | Micro-CT HA D4.5, QRM | QRM-70128 | |
| Image Processing Language | Scanco | Used to convert raw images to DICOM images | |
| Micro-Mosquito Straight Hemostatic Forceps | Medline | Used to remove the intramedullary pin | |
| Microsoft Excel | Microsoft | Spreadsheet software | |
| Scanco mCT system (vivaCT 40) | Scanco | Used for µCT imaging |
References
- Rüegsegger, P., Koller, B., Müller, R. A microtomographic system for the nondestructive evaluation of bone architecture. Calcified Tissue International. 58 (1), 24-29 (1996).
- Müller, R., et al. Morphometric analysis of human bone biopsies: a quantitative structural comparison of histological sections and micro-computed tomography. Bone. 23 (1), 59-66 (1998).
- Waarsing, J. H., et al. Detecting and tracking local changes in the tibiae of individual rats: a novel method to analyse longitudinal in vivo micro-CT data. Bone. 34 (1), 163-169 (2004).
- Boyd, S. K., Davison, P., Müller, R., Gasser, J. A. Monitoring individual morphological changes over time in ovariectomized rats by in vivo micro-computed tomography. Bone. 39 (4), 854-862 (2006).
- Christiansen, B. A. Effect of micro-computed tomography voxel size and segmentation method on trabecular bone microstructure measures in mice. Bone Reports. 5, 136-140 (2016).
- Holdsworth, D. W., Thornton, M. M. Micro-CT in small animal and specimen imaging. Trends in Biotechnology. 20 (8), 34-39 (2002).
- Schambach, S. J., Bag, S., Schilling, L., Groden, C., Brockmann, M. A. Application of micro-CT in small animal imaging. Methods. 50 (1), 2-13 (2010).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Morgan, E. F., et al. Micro-computed tomography assessment of fracture healing: Relationships among callus structure, composition, and mechanical function. Bone. 44 (2), 335-344 (2009).
- O'Neill, K. R., et al. Micro-computed tomography assessment of the progression of fracture healing in mice. Bone. 50 (6), 1357-1367 (2012).
- Bissinger, O., et al. Fully automated segmentation of callus by micro-CT compared to biomechanics. Journal of Orthopaedic Surgery and Research. 12 (1), 108 (2017).
- Brown, M. L., et al. Delayed fracture healing and increased callus adiposity in a C57BL/6J murine model of obesity-associated type 2 diabetes mellitus. PLOS One. 9 (6), 99656 (2014).
- Khajuria, D. K., et al. Aberrant structure of fibrillar collagen and elevated levels of advanced glycation end products typify delayed fracture healing in the diet-induced obesity mouse model. Bone. 137, 115436 (2020).
- Sigurdsen, U., Reikeras, O., Hoiseth, A., Utvag, S. E. Correlations between strength and quantitative computed tomography measurement of callus mineralization in experimental tibial fractures. Clinical Biomechanics. 26 (1), 95-100 (2011).
- Duvall, C. L., Taylor, W. R., Weiss, D., Wojtowicz, A. M., Guldberg, R. E. Impaired angiogenesis, early callus formation, and late stage remodeling in fracture healing of osteopontin-deficient mice. Journal of Bone and Mineral Research. 22 (2), 286-297 (2007).
- Gerstenfeld, L. C., et al. Comparison of effects of the bisphosphonate alendronate versus the RANKL inhibitor denosumab on murine fracture healing. Journal of Bone and Mineral Research. 24 (2), 196-208 (2009).
- Alentado, V. J., et al. Validation of the modified radiographic union score for tibia fractures (mRUST) in murine femoral fractures. Frontiers in Endocrinology. 13, 911058 (2022).
- Yu, K. E., et al. Enhancement of impaired MRSA-infected fracture healing by combinatorial antibiotics and modulation of sustained inflammation. Journal of Bone and Mineral Research. 37 (1), 1352-1365 (2022).
- Nyman, J. S., et al. Quantitative measures of femoral fracture repair in rats derived by micro-computed tomography. Journal of Biomechanics. 42 (7), 891-897 (2009).
- Fiset, S., et al. Experimental validation of the radiographic union score for tibial fractures (RUST) using micro-computed tomography scanning and biomechanical testing in an in-vivo rat model. The Journal of Bone and Joint Surgery. 100 (21), 1871-1878 (2018).
- Shefelbine, S. J., et al. Prediction of fracture callus mechanical properties using micro-CT images and voxel-based finite element analysis. Bone. 36 (3), 480-488 (2005).
- Liu, Y., et al. Glucocorticoid-induced delayed fracture healing and impaired bone biomechanical properties in mice. Clinical Interventions in Aging. 13, 1465-1474 (2018).
- Watson, P. J., Fitton, L. C., Meloro, C., Fagan, M. J., Gröning, F. Mechanical adaptation of trabecular bone morphology in the mammalian mandible. Scientific Reports. 8 (1), 7277 (2018).
- Nie, C., Wang, Z., Liu, X. The effect of depression on fracture healing and osteoblast differentiation in rats. Neuropsychiatric Disease and Treatment. 14, 1705-1713 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved