Method Article
الفحص المجهري فائق الدقة للمجمع المشبكي داخل الخط الجرثومي Caenorhabditis elegans
In This Article
Summary
يمكن أن يوفر الفحص المجهري فائق الدقة نظرة تفصيلية على تنظيم المكونات داخل مجمع المشابك في الانقسام الاختزالي. هنا ، نوضح بروتوكولا لحل البروتينات الفردية لمجمع Caenorhabditis elegans synaptonemal.
Abstract
أثناء الانقسام الميوزي، يجب أن تتعرف الكروموسومات المتماثلة على بعضها البعض وتلتصق بعضها ببعض للسماح بفصلها الصحيح. أحد الأحداث الرئيسية التي تؤمن تفاعل الكروموسومات المتماثلة هو تجميع المركب المشبكي (SC) في الطور الأول الاختزالي. على الرغم من وجود القليل من التماثل التسلسلي بين مكونات البروتين داخل SC بين الأنواع المختلفة ، فقد تم الحفاظ على الهيكل العام ل SC بشكل كبير أثناء التطور. في الصور المجهرية الإلكترونية ، يظهر SC كهيكل ثلاثي يشبه السلم يتكون من عناصر أو محاور جانبية ، وخيوط عرضية ، وعنصر مركزي.
ومع ذلك ، فإن التحديد الدقيق لتوطين المكونات الفردية داخل المجمع بواسطة المجهر الإلكتروني لتحديد التركيب الجزيئي ل SC لا يزال يمثل تحديا. على النقيض من ذلك ، يسمح الفحص المجهري الفلوري بتحديد مكونات البروتين الفردية داخل المجمع. ومع ذلك ، نظرا لأن SC يبلغ عرضه ~ 100 نانومتر فقط ، فلا يمكن حل بنيته التحتية عن طريق الفحص المجهري الفلوري التقليدي المحدود الحيود. وبالتالي ، فإن تحديد البنية الجزيئية ل SC يتطلب تقنيات مجهرية ضوئية فائقة الدقة مثل مجهر الإضاءة المهيكل (SIM) ، أو الفحص المجهري لاستنفاد الانبعاثات المحفزة (STED) ، أو الفحص المجهري لتوطين الجزيء الواحد (SMLM).
للحفاظ على بنية وتفاعلات المكونات الفردية داخل SC ، من المهم مراقبة المجمع في بيئة قريبة من بيئته الأصلية في الخلايا الجرثومية. لذلك ، نظهر بروتوكولا للكيمياء والتصوير المناعي يتيح دراسة البنية التحتية ل SC في أنسجة الخط الجرثومي Caenorhabditis elegans السليمة والمبثوقة باستخدام الفحص المجهري SMLM و STED. يقلل تثبيت الأنسجة مباشرة على الغطاء من حركة العينات أثناء التصوير ويقلل من الانحرافات في العينة لتحقيق الدقة العالية اللازمة لتصور البنية التحتية ل SC في سياقها البيولوجي.
Introduction
يعد تقليل عدد الكروموسومات بمقدار النصف أثناء الانقسام الميوزي أمرا أساسيا لتوليد ذرية صحية في الكائنات الحية التي تتكاثر جنسيا. لتحقيق هذا الانخفاض في عدد الكروموسومات، يجب أن تتزاول الكروموسومات المتماثلة وتنفصل أثناء الانقسام الميوزي الأول. لضمان الفصل الدقيق للكروموسومات المتماثلة ، تخضع الخلايا الجرثومية للطور التمهيدي الأول الممتد ، حيث تتزاوج الكروموسومات المتماثلة ، وتشبك ، وتعيد الاتحاد لتوليد روابط مادية بين المتماثلات1. برزت SC كهيكل مركزي أساسي في تنظيم التقدم الصحيح من خلال الطور الاختزالي2.
SC عبارة عن مركب يتم الحفاظ على هيكله العام تطوريا ، على الرغم من وجود القليل من التماثل بين مكوناته البروتينية. تم تحديد SC لأول مرة في الصور المجهرية الإلكترونية على أنها بنية ثلاثية تشبه السلم تتكون من عنصرين أو محورين جانبيين ، ومنطقة مركزية تتكون من خيوط عرضية ، وعنصر مركزي 3,4. يعد تحديد تنظيم المكونات الفردية داخل المجمع أمرا أساسيا لتعزيز فهمنا لدور اللجنة العليا خلال الطور الاختزالي.
يعتبر الكائن الحي النموذجي C. elegans مناسبا بشكل مثالي لدراسة بنية ووظيفة SC نظرا لأن خطوطه الجرثومية تحتوي على عدد كبير من النوى الاختزالية مع SCs المجمعة بالكامل5. كشفت الدراسات الجينية والكيميائية الحيوية أن محاور الكروموسوم تتكون من ثلاثة مجمعات متماسكة متميزة6،7 وأربعة بروتينات مجال HORMA تسمى HTP-1/2/3 و HIM-3 7،8،9،10،11 في C. elegans. في المنطقة الوسطى من SC ، تم تحديد ستة بروتينات تحتوي على مجالات لفائف ملفوفة حتى الآن12،13،14،15،16،17. لسد المسافة بين المحورين ، يتم تضخيم SYP-1 و -5 و -6 بطريقة وجها لوجه (الشكل 1) ، بينما تعمل ثلاثة بروتينات إضافية على استقرار تفاعلها في العنصر المركزي16،17،18،19.
يعد الحصول على رؤية تفصيلية لتنظيم هذه البروتينات أمرا ضروريا لفهم وظائف SC العديدة أثناء الانقسام الاختزالي. نظرا لأن عرض المنطقة المركزية من SC هو ~ 100 نانومتر فقط ، فلا يمكن حل بنيتها التحتية عن طريق الفحص المجهري الفلوري المحدود الحيود. ومع ذلك ، فإن تصور المكونات داخل هيكل بهذا الحجم يمكن تحقيقه بسهولة عن طريق الفحص المجهري فائق الدقة. في الواقع ، ظهر مجهر الإضاءة الهيكلي (SIM) ، والمجهر التوسعي 20 ، والمجهر المستنفد للانبعاثات المحفزة (STED) 21 ، والمجهر التعريبي أحادي الجزيء (SMLM)22،23 كأدوات أساسية لدراسة البنية الجزيئية ل SC عبر الأنواع16،24،25،26،27،28،29 ، 30.
للتغلب على حد الدقة ، يعتمد الفحص المجهري STED على تراكب البقعة المحدودة للحيود لضوء الانبعاث بحزمة على شكل دونات من ليزر STED ، والذي يضيق نظريا وظيفة انتشار النقطة وصولا إلى الأبعاد الجزيئية31,32. ومع ذلك ، فإن الدقة التي يمكن تحقيقها عمليا بواسطة STED ضمن العينات البيولوجية تظل في نطاق بضع عشرات من النانومتر في xy33.
يمكن الحصول على دقة أعلى في العينات البيولوجية باستخدام تقنيات SMLM. يسخر SMLM الخصائص الوامضة لفلوروفورات معينة لحل الأشياء على مستوى الحيود الفرعي عن طريق فصل الفلوروفورات المتداخلة مكانيا في الوقت المناسب. ثم يتم تصوير العينة بشكل متكرر لالتقاط مجموعات فرعية مختلفة من الفلوروفور. ثم يتم تحديد موضع الفلوروفورات داخل العينة عن طريق تركيب وظيفة انتشار النقطة (PSF) للإشارات التي تم الحصول عليها عبر جميع الصور ، والتي يمكنها حل الهياكل حتى 15 نانومتر23,34.
مجتمعة ، تشفر الصور المترجمة مواضع جميع الفلوروفورات. يتم تحديد دقة SMLM من خلال كثافة وضع العلامات وخصائص وميض الفلوروفور. وفقا لمعيار Nyquist-Shannon ، من المستحيل حل الكائنات التي تقل عن ضعف متوسط المسافة من الملصق إلى الملصق بشكل موثوق. وبالتالي ، هناك حاجة إلى كثافة عالية لوضع العلامات للتصوير عالي الدقة. بالنسبة إلى SC في C. elegans ، يمكن تحقيق كثافة عالية لوضع العلامات باستخدام علامات epitope المرفقة بمواقع محددة من البروتينات الداخلية باستخدام تحرير الجينوم. يمكن بعد ذلك تلطيخ علامات epitope بكثافة عالية باستخدام أجسام مضادة وحيدة النسيلة محددة ذات صلات عالية19,30. في الوقت نفسه ، يجب أن تكون دورة الفلوروفورات الفردية قصيرة بما يكفي لضمان عدم التقاط الفلوروفورات المتداخلة مكانيا في نفس الوقت35.
بسبب هذين الشرطين ، يتطلب حل بنية المجمعات الجزيئية الكبيرة مثل SC تصوير عدد كبير بما فيه الكفاية من الصور ، وبالتالي يمكن أن يستغرق عدة ساعات. مأزق أوقات التصوير الطويلة هو أن العينات تميل إلى الانجراف بسبب حركة المرحلة أو التيارات الصغيرة داخل المخزن المؤقت للعينة. حتى الحركات الصغيرة في حدود 10 نانومتر ضارة بدقة نانومتر ويجب تصحيحها. ومع ذلك ، فإن طرق تصحيح الانجراف المستخدمة بشكل شائع ليست قوية بما يكفي لتراكب الصور بدقة لقناتين تم تصويرهما بالتتابع36. هذا يمثل مشكلة لأن الأسئلة البيولوجية غالبا ما تتطلب الكشف الدقيق وتحديد موقع أهداف متعددة داخل نفس العينة. للتحايل على هذه القضايا ، تم تطوير طرق مثل التصوير النسبي. يسمح التصوير النسبي بالتصوير المتزامن للعديد من الفلوروفورات ذات أطياف الإثارة والانبعاث المتداخلة ، مع تخصيص لاحق لكل إشارة مكتشفة إلى الفلوروفور الخاص بها بناء على نسبة الشدة في القنوات المتميزة طيفيا37,38.
بالإضافة إلى ذلك ، فإن دراسة تنظيم المجمعات الجزيئية مثل SC تتطلب معلومات ثلاثية الأبعاد (3D). لتحقيق دقة فائقة في ثلاثة أبعاد (3D-SMLM) ، يتم دمج عدسة أسطوانية في المسار البصري للضوء المنبعث الذي يشوه شكل PSF للفلوروفور اعتمادا على بعده عن المستوى البؤري. ومن ثم ، يمكن استقراء الموضع الدقيق للفلوروفور في المستوى z من خلال تحليل شكل إشارة الانبعاث35,39. الجمع بين هذه التطورات في SMLM يسمح لتصوير تنظيم 3D من المجمعات الجزيئية ، بما في ذلك SC.
Protocol
1. إعداد الحلول وأغطية
ملاحظة: انظر جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والكواشف والجدول 1 لتكوين المحاليل المستخدمة في هذا البروتوكول.
- أغطية مطلية ب Poly-L-lysine
- تحضير 0.01٪ (وزن / حجم) بولي-L-ليسين (انظر الجدول 1).
- اغسل غطاء دقيق (قطر 24 مم ؛ 0.17 ± 0.005 مم ، رقم 1.5) في الإيثانول لمدة 10-30 دقيقة. اشطف الغطاء باستخدام ddH2O لإزالة الإيثانول ، واترك الغطاء حتى يجف في درجة حرارة الغرفة.
- نظف البلازما الغطاء باستخدام منظف البلازما.
ملاحظة: يزيد تنظيف البلازما من مقاومة الغطاء للماء ويسهل الخطوات التالية. في حالة عدم توفر منظف البلازما ، يمكن تخطي هذه الخطوة ، على الرغم من أن هذا قد يتطلب ضبط حجم و / أو تركيز محلول poly-L-lysine. لم يتم اختبار هذا التعديل. - ضع قطرة واحدة (120 ميكرولتر) من 0.01٪ (وزن / حجم) بولي-L-ليسين على غطاء الغطاء. احتضان لمدة 10 دقائق في درجة حرارة الغرفة.
- بعد الحضانة ، اشطف الغطاء في ddH2O وجففه في درجة حرارة الغرفة. يحفظ في درجة حرارة 4 درجة مئوية حتى 1 شهر.
- شظايا F (ab') 2 مترافقة مع الأصباغ العضوية الفلورية
- أضف الترتيب التالي إلى أنبوب تفاعل البوليميراز المتسلسل: 10 ميكرولتر من 0.6-0.7 مجم / مل F (ab') 2 جزء في PBS ، 1 ميكرولتر من 0.1 M NaHCO 3 (درجة الحموضة8.3 ) و 1 ميكرولتر من 1 mM succinimidyl (NHS) إستر الفلوروفور التفاعلي في DMSO (النسبة المولية ل F (ab') 2: الصبغة هي ~ 1:17). تخلط جيدا عن طريق سحب لأعلى ولأسفل.
- احتضان لمدة 1 ساعة في درجة حرارة الغرفة.
- افصل الجزء F (ab') 2 عن الصبغة التفاعلية الحرة المتبقية باستخدام عمود تحلية (7K MWCO) وفقا لمواصفات الشركة المصنعة. استخدم 1x PBS لموازنة العمود وشطف الجزء المسمى F (ab') 2.
- قم بتخزين الجزء المسمى F (ab') 2 عند 4 درجات مئوية لمدة تصل إلى 3 أشهر.
ملاحظة: لم يتم اختبار أوقات التخزين التي تزيد عن 3 أشهر.
2. تشريح وتثبيت
ملاحظة: تم تعديل إجراءات التشريح والتثبيت من الإجراءات الموصى بها سابقا16،40 للحصول على عينات مثالية للفحص المجهري فائق الدقة.
- تشريح
- اختر ديدان C. elegans المطابقة للعمر (نمت عند 20 درجة مئوية لهذه الدراسة) في قطرة 30 ميكرولتر من EBTT (1x Egg buffer41 مع 0.2٪ منظف غير أيوني ، الجدول 1) على غطاء (22 مم × 22 مم ، رقم 1). ضع الغطاء على شريحة زجاجية لتسهيل التلاعب بها. اغسل ب 30 ميكرولتر من EBTT عن طريق السحب لأعلى ولأسفل عدة مرات. قم بإزالة 30 ميكرولتر من المحلول لترك قطرة 30 ميكرولتر على غطاء الغطاء.
ملاحظة: يجب إضافة كميات صغيرة من المنظفات غير الأيونية إلى جميع المحاليل التي يتم فيها سحب الديدان لمنع الديدان من الالتصاق بالأطراف البلاستيكية. - استخدم شفرة مشرط لقطع رؤوس و / أو ذيول الديدان لبثق الغدد التناسلية (الشكل 2 أ).
- اختر ديدان C. elegans المطابقة للعمر (نمت عند 20 درجة مئوية لهذه الدراسة) في قطرة 30 ميكرولتر من EBTT (1x Egg buffer41 مع 0.2٪ منظف غير أيوني ، الجدول 1) على غطاء (22 مم × 22 مم ، رقم 1). ضع الغطاء على شريحة زجاجية لتسهيل التلاعب بها. اغسل ب 30 ميكرولتر من EBTT عن طريق السحب لأعلى ولأسفل عدة مرات. قم بإزالة 30 ميكرولتر من المحلول لترك قطرة 30 ميكرولتر على غطاء الغطاء.
- تثبيت
- ماصة 30 ميكرولتر من المحلول المثبت (الجدول 1) في قطرة الديدان المشرحة والماصة لأعلى ولأسفل للخلط.
ملاحظة: قد يساعد تحريك الأنابيب لأعلى ولأسفل عدة مرات على إطلاق المزيد من الغدد التناسلية. - إصلاح لمدة 1 دقيقة بالضبط بعد إضافة الحل المثبت.
- أوقف التثبيت عن طريق نقل الديدان إلى أنبوب تفاعل البوليميراز المتسلسل المملوء ب TBST (الجدول 1). نقل الديدان في أقل حجم ممكن (~ 15 ميكرولتر).
- قم بتدوير أنبوب تفاعل البوليميراز المتسلسل على جهاز طرد مركزي صغير على الطاولة (2000 × جم ، 10 ثوان). قم بإزالة المادة الطافية واغسلها 2x مع 200 ميكرولتر من TBST لكل منهما.
- يغسل مع 200 ميكرولتر من PBST (الجدول 1) لمدة 5-10 دقائق. كرر الخطوات من 2.1.1 إلى 2.2.5 لما يصل إلى أربع عينات مع الاحتفاظ بالعينات المشرحة على الجليد.
ملاحظة: في حالة معالجة أكثر من أربع عينات، تابع الخطوات من 2.2.6 إلى 2.2.7 بعد كل أربع عينات لضمان بقاء تثبيت العينة متسقا عبر جميع العينات. - قم بتدوير العينات المشرحة على جهاز طرد مركزي صغير على الطاولة (2000 × جم ، 10 ثوان) ، وقم بإزالة PBST ، وأضف 50-100 ميكرولتر من الميثانول البارد (-20 درجة مئوية).
تنبيه: الميثانول سام. ارتداء معدات واقية وتجنب الاستنشاق. - تخلط عن طريق سحب لأعلى ولأسفل وترك العينات في الميثانول لمدة 30-60 ثانية. اغسل العينات 2x في 200 ميكرولتر من PBST.
ملاحظة: في حالة معالجة أكثر من أربع عينات، تابع تشريح العينات المتبقية (الخطوات من 2-1-1 إلى 2-2-7). - اغسل العينات مرة ثالثة باستخدام 200 ميكرولتر من PBST.
- ماصة 30 ميكرولتر من المحلول المثبت (الجدول 1) في قطرة الديدان المشرحة والماصة لأعلى ولأسفل للخلط.
3. حضانة الأجسام المضادة
- حظر
- قم بحظر العينات في محلول حجب واحد (الجدول 1) لمدة 45-60 دقيقة في درجة حرارة الغرفة.
ملاحظة: يمكن أن يتراوح وقت الحضانة من 30 دقيقة في درجة حرارة الغرفة إلى عدة أيام عند 4 درجات مئوية (تم إجراء الاختبار حتى 3 أيام).
- قم بحظر العينات في محلول حجب واحد (الجدول 1) لمدة 45-60 دقيقة في درجة حرارة الغرفة.
- محلول الأجسام المضادة الأساسي
- تمييع الأجسام المضادة المضادة ل HTP-3 (الدجاج42) والأجسام المضادة ل HA (الماوس) (أو الأجسام المضادة المختارة) إلى حلول العمل (1: 250 ل SMLM و 1: 1,000 لعينات الفحص المجهري STED) في 1x حل حجب.
ملاحظة: الأجسام المضادة المستخدمة لتسمية عينات SMLM أكثر تركيزا من عينات STED حيث يوصى بكثافة وضع العلامات الأعلى للفحص المجهري SMLM. - قم بتدوير العينات على جهاز طرد مركزي صغير على الطاولة (2000 × جم ، 10 ثوان) ، وقم بإزالة المخزن المؤقت للحجب ، وأضف 30-50 ميكرولتر من محلول الأجسام المضادة الأساسي. احتضان بين عشية وضحاها عند 4 درجات مئوية (مفضل) أو لمدة 1-2 ساعة في درجة حرارة الغرفة.
- بعد الحضانة ، اغسل 3 × 5-15 دقيقة باستخدام PBST.
- تمييع الأجسام المضادة المضادة ل HTP-3 (الدجاج42) والأجسام المضادة ل HA (الماوس) (أو الأجسام المضادة المختارة) إلى حلول العمل (1: 250 ل SMLM و 1: 1,000 لعينات الفحص المجهري STED) في 1x حل حجب.
- حل العمل لشظايا F (ab') 2 مترافقة مع صبغة الفلورسنت
- قم بتخفيف الأجزاء F (ab') 2 المسماة (الخطوة 1.2.4) إلى حلول العمل (1: 100 ل SMLM و 1: 1,000 لعينات الفحص المجهري STED) في حل حجب واحد.
ملاحظة: بالنسبة لكلتا التقنيتين الفائقتين الاستبانة ، تم استخدام أزواج الفلوروفور المبلغ عنها سابقا ، وهي AlexaFluor647 / CF680 ل SMLM و AlexaFluor594 / Abberior STAR635P ل STED. تم استخدام AlexaFluor647 و STAR645P لتسمية الأجزاء المضادة للفأر (Fab') 2 لاستهداف النهاية C ل SYP-5 ، وشظايا CF680 / AlexaFluor594 المضادة للدجاج (Fab') 2 لاستهداف HTP-3. - قم بتدوير العينات على جهاز طرد مركزي صغير على الطاولة (2000 × جم ، 10 ثوان) ، وقم بإزالة PBST ، وأضف 30-50 ميكرولتر من محلول الأجسام المضادة الثانوي. احتضان لمدة 30 دقيقة إلى 2 ساعة في درجة حرارة الغرفة (يفضل) أو طوال الليل عند 4 درجات مئوية. اغسل 3 × 5-15 دقيقة باستخدام PBST.
- قم بتخفيف الأجزاء F (ab') 2 المسماة (الخطوة 1.2.4) إلى حلول العمل (1: 100 ل SMLM و 1: 1,000 لعينات الفحص المجهري STED) في حل حجب واحد.
4. تركيب العينات على غطاء
- التثبيت اللاحق
ملاحظة: معالجة العينات بشكل فردي من خلال الخطوات 4.1.1-4.2.1.- قم بتدوير العينات الملطخة وإزالة المادة الطافية. أضف 50 ميكرولتر من PBST0.2 وانقل الديدان الملطخة إلى غطاء رقم 22 مم × 22 مم.
ملاحظة: استخدم PBST 0.2 الطازج مع منظف غير أيوني بنسبة0.2 ٪ (الجدول 1) لهذه الخطوة لمنع الديدان من الالتصاق بغطاء الغطاء. - ماصة 5.7-6.3 ميكرولتر من محلول ما بعد التثبيت على غطاء بولي-L-ليسين.
ملاحظة: يجب إحضار أغطية Poly-L-lysine المخزنة عند 4 درجات مئوية إلى درجة حرارة الغرفة أولا. - ماصة قبالة الديدان تشريح في نفس الحجم (5.7-6.3 ميكرولتر) ونقلها إلى قطرة من المثبت على غطاء poly-L-lysine (الشكل 2B).
ملاحظة: في هذه الخطوة والخطوة التالية ، من المهم جدا الاحتفاظ بالأنسجة المشرحة في وسط غطاء الغطاء المطلي ب poly-L-lysine. هذا مهم بشكل خاص في حالة تركيب العينات في حامل مخصص لتناسب مجهر SMLM المصمم خصيصا المستخدم هنا (انظر الخطوة 5.1 ، الشكل 2B). - قم بتغطية العينة بغطاء صغير (قطر 12 مم ، الشكل 2 ب). قم بإزالة السائل الزائد باستخدام قطعة صغيرة من ورق الترشيح (الشكل 2 ب). إصلاح لمدة 3-5 دقائق في غرفة مظلمة.
- قم بتدوير العينات الملطخة وإزالة المادة الطافية. أضف 50 ميكرولتر من PBST0.2 وانقل الديدان الملطخة إلى غطاء رقم 22 مم × 22 مم.
- "تجميد تكسير"
- قم بتجميد العينات عن طريق وضعها على كتلة من الألومنيوم في الثلج الجاف (الشكل 2 ب).
ملاحظة: يجب تبريد كتلة الألومنيوم جيدا في الثلج الجاف قبل وضع العينات عليها. تابع التثبيت اللاحق للعينات المتبقية (الخطوات 4.1.1 إلى 4.2.1). يجب أن تكون العينة على ثلج جاف لمدة 20 دقيقة على الأقل أو حتى 1 ساعة قبل الخطوة التالية (4.2.2). - قم بإزالة الغطاء الأصغر باستخدام ماكينة حلاقة (الشكل 2 ب).
ملاحظة: بالنسبة للأمراض المنقولة جنسيا، انتقل إلى الخطوة 5.2.1. بالنسبة ل SMLM، تابع مع الخطوة 4.2.3. - اغمس الغطاء في أنبوب مخروطي سعة 50 مل يحتوي على PBS بارد (مفضل) أو -20 درجة مئوية ميثانول لمدة 10 ثوان تقريبا.
ملاحظة: درجة الحرارة هي عامل مهم جدا لهذه الخطوة. لذلك ، استخدم برنامج تلفزيوني تم إذابته حديثا أو حفظه في حمام ثلج / إيثانول. - ضع الغطاء في بئر من لوحة من ستة آبار مملوءة بمخزن مؤقت PBST. قم بإزالة PBST من الآبار وأضف PBS جديدا. اترك العينات في PBS لمدة 5 دقائق.
ملاحظة: ضع PBS على جانب البئر لتجنب إتلاف العينات وفصلها. - اغسل باستخدام PBS الطازج واترك العينات عند 4 درجات مئوية حتى التصوير.
ملاحظة: العينات مستقرة لمدة تصل إلى 2 أسابيع ، ولكن يتم تحقيق أفضل النتائج إذا تم تصوير العينات في غضون يومين. - قبل التصوير ، قم بتقييم جودة تركيب العينة تحت مجهر ستيريو.
ملاحظة: يتم تثبيت الخطوط الجرثومية التي تم تركيبها بنجاح بثبات دون أي حركة ملحوظة بالنسبة إلى غطاء الغطاء. سوف ترفرف الخطوط الجرثومية المرفقة بشكل سيئ في محلول العازلة.
- قم بتجميد العينات عن طريق وضعها على كتلة من الألومنيوم في الثلج الجاف (الشكل 2 ب).
5. التصوير
- الفحص المجهري لتوطين جزيء واحد
ملاحظة: تم الحصول على الصور في مركز التصوير EMBL باستخدام مجهر توطين أحادي الجزيء مصمم خصيصا تم بناؤه حول جسم مخصص ، كما ورد سابقا38,43، مع الميزات الفريدة المحددة في جدول المواد; الرجوع إلى https://www.embl.org/about/info/imaging-centre- الحصول على معايرة حبة 3D
- قم بإعداد غطاء دقيق (قطر 24 مم ؛ 0.17 ± 0.005 مم ، رقم 1.5) مع حبات فلورسنت ملتصقة 100 نانومتر كما هو موضح سابقا38,44.
- ضع عينة المعايرة من الخطوة 5.1.1.1 على حامل العينة.
- أضف قطرة من زيت الغمر على هدف الزيت النظيف 100x / 1.5 وقم بتركيب عينة المعايرة على المجهر.
- ضمن MicroManager 2 45,46 ، حدد15-20 موضعا في عينة المعايرة.
- ضمن نافذة المكون الإضافيEMU 47 ، قم بإعداد الحصول على صورة z-stack لكل من المواضع من الخطوة 5.1.1.5.
ملاحظة: هنا ، توفر عدسة أسطوانية مركبة الاستجماتيزم المطلوب للتصوير ثلاثي الأبعاد ، وتم الحصول على 201 شريحة z لكل موضع يمتد من النطاق بين -1 ميكرومتر إلى 1 ميكرومتر ، مع زيادة قدرها 10 نانومتر. تم استخدام إضاءة ليزر 2 كيلوواط / سم2 640 نانومتر لمدة 25 مللي ثانية لكل شريحة z. - احصل على صور z-stack لخرز الفلورسنت 100 نانومتر من خلال مسار بصري مماثل سيتم استخدامه للحصول على عينات من الصور في الخطوة 5.1.11.
- باستخدام منصة التحليل المجهري فائقة الدقة (SMAP48) ، قم بإنشاء نموذج cspline لوظيفة انتشار النقطة التجريبية (PSF) التي سيتم استخدامها لتناسب بيانات 3D-SMLM في الخطوة 5.1.13.
- تحضير حامل العينة. بالنسبة للحامل المصمم خصيصا المستخدم هنا والذي يستخدم حلقة مغناطيسية لإنشاء غرفة التصوير (الشكل 2 ب) ، لف الحلقة المغناطيسية بالبارافيلم.
ملاحظة: بدلا من ذلك ، يمكن استخدام شريحة مجهرية ذات تجويف اكتئاب مقعر لتركيب عينات للمجاهر مع حاملات شرائح. - قم بإعداد 1 مل من المخزن المؤقتللتصوير 44 (الجدول 1).
- خذ قسيمة غطاء واحدة من الخطوة 4.2.6 وضعها في الحامل المصنوع خصيصا. ثبت غطاء الغطاء في الحامل بحلقة مغناطيسية ملفوفة بالبارافيلم (الخطوة 5.1.2).
- قم برش المخزن المؤقت للتصوير برفق (الخطوة 5.1.3) في الغرفة التي أنشأتها الحلقة المغناطيسية أعلى العينة (الشكل 2 ب). ختم الغرفة بقطعة من البارافيلم.
- لتركيب العينة ، أضف قطرة واحدة من زيت الغمر على هدف الزيت النظيف 100x / 1.5. دون إدخال أي هواء في زيت الغمر ، ضع حامل العينة برفق مع العينة المركبة (الخطوة 5.1.5) على مرحلة المجهر.
ملاحظة: قبل وضع العينة على المجهر ، قم بتنظيف الجزء السفلي من الغطاء بالأنسجة و 70٪ من الإيثانول. - باستخدام نافذة المكون الإضافيEMU 47 داخل MicroManager 245,46 ، حرك مرحلة بيزو حتى يتم اكتشاف الإشارة من ليزر قفل التركيز عند الصمام الثنائي الضوئي الرباعي (QPD).
ملاحظة: للحفاظ على تركيز ثابت عبر وقت التصوير ، يتم تحقيق قفل التركيز البؤري عن طريق الانعكاس الداخلي الكلي لليزر القريب من الأشعة تحت الحمراء المقترنة بالألياف من غطاء الغطاء والكشف اللاحق عن حساسية الارتفاع على الصمام الثنائي الضوئي الرباعي (QPD). قدمت إشارة QPD تحكما مغلق الحلقة في حامل بيزو للعدسة الموضوعية. - احصل على صورة المستوى البؤري الخلفي باستخدام ليزر إثارة 640 نانومتر عند طاقة منخفضة (أي 1-5٪) لتأكيد عدم وجود فقاعات هواء في زيت الغمر.
ملاحظة: أخرج العينة من المسرح إذا تم اكتشاف فقاعة هواء. نظف الجزء السفلي من غطاء الغطاء والهدف وكرر الخطوات 5.1.6-5.1.8. خلاف ذلك ، تابع قفل التركيز داخل برنامج EMU47. - توطين أنسجة الغدد التناسلية باستخدام إضاءة برايتفيلد. باستخدام إضاءة منخفضة الكثافة 640 نانومتر ، ركز على قسم الأنسجة الذي يحتوي على العديد من امتدادات SC.
ملاحظة: لا تركز على الهياكل التي تزيد عن 2 ميكرومتر من غطاء الغطاء. لا تستخدم طاقة ليزر أعلى لتحديد موقع العينة ، لأن هذا قد يحول بعض الفلوروفورات إلى حالة وميض قبل الأوان. هنا ، تم استخدام 1 كيلو واط / سم2 في وضع الصعود مع ضبط النبضة على 1,000. - تابع تعريض العينة بإضاءة 640 نانومتر عند إشعاع عال (27 كيلو واط / سم2) لمدة ~ 30 ثانية حتى يتم تحقيق معدل وميض مناسب (الفيديو التكميلي 1).
- احصل على 200000 إطار مع وقت تعريض ضوئي يبلغ 20 مللي ثانية باستخدام أداة الاكتساب متعددة الأبعاد في MicroManager 245,46.
- وفي الوقت نفسه ، قم بإعداد تنشيط الأشعة فوق البنفسجية باستخدام خيار التنشيط للمكون الإضافيEMU 38,47 للحفاظ على معدل الوميض المطلوب.
ملاحظة: استخدم ليزر الأشعة فوق البنفسجية بإشعاع 3 كيلو واط / سم2 في وضع الارتفاع مع ضبط أقصى طول للنبضة على 10000. - إجراء إعادة بناء صورة SMLM والمعالجة اللاحقة.
ملاحظة: لإعادة بناء الصور من بيانات SMLM الأولية، راجع الأساليب المنشورة. تمت معالجة البيانات المقدمة هنا باستخدام برنامج SMAP48,49. تم إجراء إعادة بناء الصورة فائقة الحل ، وتعيين القناة ، وتصحيح الانجراف ، وتصفية التعريب بدقة توطين ضعيفة ومرشح احتمالية قصوى في برنامج SMAP48.
- الحصول على معايرة حبة 3D
- الفحص المجهري لاستنفاد الانبعاثات المحفزة
ملاحظة: تم الحصول على الصور على النظام المجهري STED المتكامل المجهز بليزر الضوء الأبيض ، وليزر STED النبضي 775 نانومتر ، ووحدة الشيخوخة FALCON Fluorescence Lifetime IM(جدول المواد) في مركز التصوير EMBL (https://www.embl.org/about/info/imaging-centre).- ضع قطرة 20 ميكرولتر من وسط التركيب (جدول المواد) على شريحة مجهر. خذ قسيمة غطاء واحدة من الخطوة 4.2.2 وضع العينة برفق على الشريحة المواجهة لوسط التثبيت (الشكل 2 ب).
ملاحظة: تجنب إدخال جيوب هوائية داخل وسط التركيب. - دع وسط التركيب يعالج بين عشية وضحاها.
ملاحظة: قم بتصوير العينات في اليوم التالي أو احتفظ بها عند 4 درجات مئوية حتى التصوير. - لتركيب العينة ، أضف قطرة واحدة من زيت الغمر على غطاء العينة من الخطوة 5.2.2. ضع العينة برفق على مرحلة المجهر باستخدام هدف زيت 100x / 1.40.
- ركز على العينة وحدد موقع نسيج الخط الجرثومي باستخدام إضاءة المجال الساطع.
- باستخدام برنامج المجهر ، حدد منطقة الاهتمام التي سيتم الحصول على صورة TauSTED من أجلها.
- حدد ليزر الإثارة وقوته المناسبة المستخدمة لإثارة الفلوروفورات المستخدمة في العينة.
ملاحظة: هنا ، تم استخدام ليزر 580 نانومتر بطاقة 4٪ لتصوير شظايا الأجسام المضادة الثانوية AlexaFluor 594-conjugated F (ab') 2 ، و 635 نانومتر عند طاقة 3٪ لتصوير شظايا STAR 635P المترافقة F (ab') 2. - باستخدام برنامج المجهر ، حدد طاقة ليزر استنفاد STED المناسبة وقم بإعداد اكتشاف الصورة.
ملاحظة: هنا ، تم ضبط طاقة ليزر استنفاد STED 775 نانومتر على 40٪. تم استخدام الكاشف في وضع العد بقيمة كسب 10 للكشف عن الفوتون ، بمعدل مسح 100 هرتز ، وبحجم بكسل 17 نانومتر. تم استخدام تراكم أربعة أسطر لاقتناء TauSTED.
- ضع قطرة 20 ميكرولتر من وسط التركيب (جدول المواد) على شريحة مجهر. خذ قسيمة غطاء واحدة من الخطوة 4.2.2 وضع العينة برفق على الشريحة المواجهة لوسط التثبيت (الشكل 2 ب).
النتائج
لتصوير SC داخل نسيج الخط الجرثومي C. elegans بواسطة SMLM ، استخدمنا 3D-SMLM بنسبة 2 لون لتوطين HTP-3 ، وهو أحد مكونات محاور الكروموسوم ، والنهاية C للخيوط المستعرضة SYP-5 الموسومة داخليا بعلامة هيماجلوتينين (HA). تم تحديد موقع كلا البروتينين داخل SC من C. elegans سابقا من خلال دراسات أخرى16,30.
لتقليل تشتت الضوء والانحرافات البصرية المتأصلة في العينات البيولوجية السميكة ، قمنا بتصوير الجزء z السفلي من النوى الاختزالية التي تحتوي على SCs (الشكل 3 ، الخطوط الصفراء). لكل صورة تم الحصول عليها ، تم تمييز موضع مرحلة بيزو لمستوى التصوير بالنسبة إلى موضع مرحلة بيزو عندما كان الهدف مركزا على الغطاء. هذا سمح بحساب مسافة بيزو من الغطاء. يتم تثبيت العينات المثبتة بنجاح بثبات بالقرب من الغطاء وتحتفظ بشكل الغدد التناسلية (أي ، لا يتم سحق الأنسجة بين الغطاءين أثناء خطوة ما بعد التثبيت). يمكن تقييم جودة تركيب العينة بسهولة تحت مجهر ستيريو لأن الغدد التناسلية المرفقة جيدا لا تظهر أي حركة في المحلول (الخطوة 4.2.6). ومع ذلك ، نظرا لعشوائية عملية التركيب ، لن يتم بالضرورة وضع أنسجة الغدد التناسلية بشكل مسطح تماما على الغطاء. لذلك ، يمكن العثور على المستوى السفلي للنوى التي تحتوي على SCs على مسافات متفاوتة بالنسبة إلى غطاء الغلاف داخل نفس الغدد التناسلية.
لتوضيح كيفية تغير الدقة اعتمادا على ارتباط الأنسجة بغطاء الغطاء ، حصلنا على صور على مسافات بيزو مختلفة إلى غطاء الغطاء. لتقييم جودة صورة فردية ، تم حساب منحنيات ارتباط حلقة فورييه (FRC)50,51 وتم تحديد الدقة باستخدام المكون الإضافي FRCResolution داخل برنامج SMAP48. يتم عرض نواتين تمثيليتين مستخرجتين من صورتين منفصلتين 3D-SMLM تم التقاطهما على مسافات مختلفة إلى غطاء الغطاء في الشكل 4. في SCs الواقعة بالقرب من الغطاء ، يتم حل محاور الكروموسوم والنهاية C ل SYP-5::HA بشكل جيد في جميع الأبعاد الثلاثة (الشكل 4A ، 0.8 ميكرومتر من غطاء الغطاء). لحل هيكلين مفصولين بمسافة معينة ، يجب أن تكون دقة FRC المحققة بشكل عام أصغر من نصف هذه المسافة في الدقة المحورية.
لفصل نفس الهياكل بشكل جانبي ، يجب تحقيق قيم دقة FRC أصغر. في الواقع ، في العينات التي تقع على مقربة من غطاء الغطاء ، تبلغ دقة FRC 38 نانومتر لقناة AlexaFluor 647 و 34 نانومتر لقناة CF680 ، وبالتالي أقل بكثير من المسافة المتوقعة البالغة 84 نانومتر بين C-termini ل SYP-516. وبالتالي فإن هذا القرار يحل بسهولة تنظيم مجلس الأمن ليس فقط في المناظر الأمامية ولكن أيضا في المناظر الجانبية (الشكل 4B i ، ii). على النقيض من ذلك ، تتدهور الدقة في SCs الواقعة على مسافة 5 ميكرومتر من غطاء الغطاء بسبب تشتت الضوء والانحرافات الكروية (الشكل 4 ب). تنخفض دقة FRC عند هذه المسافة إلى 47 نانومتر (AlexaFluor 647) و 41 نانومتر (CF680) ، والتي لا يمكنها حل C-termini ل SYP-5 بالكامل. نظرا لأن الانحرافات البصرية تضعف الدقة الجانبية بشكل أكثر حدة من الدقة المحورية ، لم يعد يتم حل نطاقات HTP-3 و SYP-5 بوضوح في المقطع العرضي للعرض الجانبي في العينات الموجودة على مسافة 5 ميكرومتر من الغطاء (الشكل 4B ii). كشفت مقارنة دقة FRC للصور التي تم الحصول عليها على مسافات بيزو مختلفة من الغطاء أن الأنسجة المصورة يجب ألا تزيد عن 2 ميكرومتر من الغطاء (الشكل 5). تسلط هذه النتيجة الضوء على أهمية التنفيذ الصحيح لخطوة ما بعد التثبيت ، والتي يجب خلالها ربط الأنسجة بنجاح بطلاء poly-L-lysine لغطاء الغطاء.
لإثبات الدقة التي يمكن تحقيقها باستخدام تقنية أخرى فائقة الدقة ، قمنا أيضا بتصوير SCs في أنسجة جرثومية ثابتة سليمة باستخدام الفحص المجهري TauSTED. يوضح الشكل 6A صور TauSTED بأعلى وأدنى دقة تم تحقيقها في هذه الدراسة كما تم تقديرها من ملفات تعريف خط SC في المنظر الأمامي (الشكل 6B). في كلتا النواتين ، يمكننا حل نطاقي التوطين ل HTP-3 في محاور الكروموسوم و C-termini ل SYP-5 في المنطقة الوسطى ، مما يدل على أن الدقة التي يمكن تحقيقها في TauSTED باستخدام هذا البروتوكول الأمثل أقل من 84 نانومتر. في ظل الظروف المثلى (الشكل 6A ، أعلى) ، يمكننا حل C-termini في مناظر مائلة قليلا ل SC مفصولة ب 50 نانومتر فقط (الشكل 6A ، مستطيل أصفر و 6C).

الشكل 1: رسم تخطيطي لتنظيم المجمع المتشابك في Caenorhabditis elegans. يظهر الرسم الكاريكاتوري بنية مبسطة ل SC في C. elegans تسد بين كروموسومين متماثلين (رمادي). يظهر الهيكل في طرق العرض الأمامية والجانبية والمقطعية. تعرض محاور الكروموسومات في صورة أشرطة حمراء، بينما تظهر الخيوط المستعرضة باللون السماوي. يتم توجيه بروتينات الخيوط المستعرضة (SYP-1 ، 5 ، 6 في C. elegans) بطريقة وجها لوجه (رسومات عصا الكرة السماوية) في المنطقة الوسطى لسد المسافة بين المحورين. يشار إلى المسافات المتوقعة بين المحاور و C-termini للخيوط المستعرضة. اختصار: SC = مجمع متشابك. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
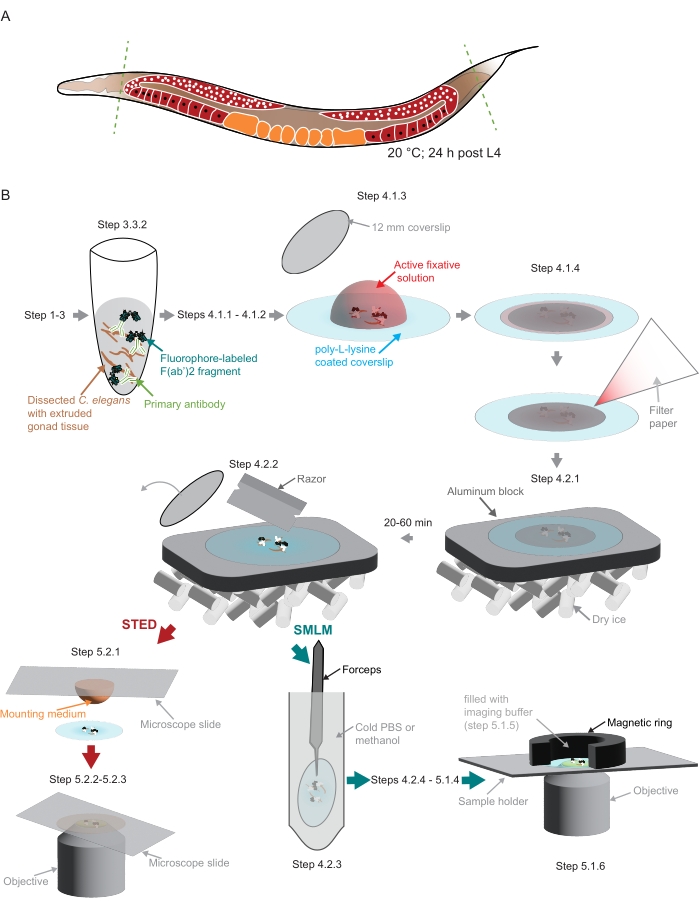
الشكل 2: رسم توضيحي لتحضير العينة المستخدمة في الدراسة . (أ) يتم تشريح صغار C. elegans البالغين عند رؤوسهم أو ذيلهم (خطوط خضراء متقطعة) ومعالجتها كما هو موضح في البروتوكول. (ب) يشار إلى الخطوات الفردية للطريقة برسومات متصلة بأسهم رمادية. الاختصارات: STED = استنفاد الانبعاثات المحفزة ؛ SMLM = مجهر توطين جزيء واحد ؛ PBS = محلول ملحي مخزن بالفوسفات. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
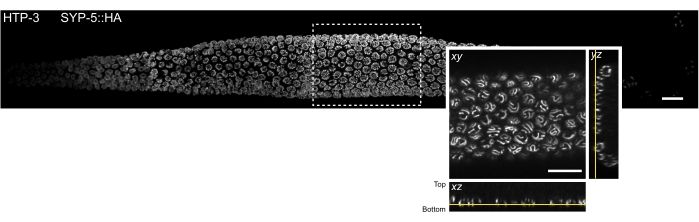
الشكل 3: موقع مقطع الأنسجة الذي يمكن ملاحظته بواسطة مجهر توطين جزيء واحد. MIP لصورة متحدة البؤر لقرص دوار لجبل كامل C. elegans الغدد التناسلية. تم تلطيخ الأنسجة ل HTP-3 والنهاية C ل SYP-5 (SYP-5::HA) ، وتظهر الإشارة المدمجة باللون الرمادي. تم خياطة الصور البؤرية الفردية باستخدام المكون الإضافي Grid / Collection stitch Fiji52 لإنشاء صورة للغدد التناسلية بأكملها. يظهر الجزء الداخلي طريقة عرض xy للمستوى z السفلي الذي يحتوي على SCs. يظهر توطين هذه الطائرة في مناظر متعامدة لقسم الأنسجة المشار إليه بواسطة مستطيل في صورة MIP للغدد التناسلية (خطوط صفراء). قضبان المقياس = 10 ميكرومتر. الاختصارات: MIP = أقصى إسقاط للكثافة ؛ SCs = مجمعات متشابكة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
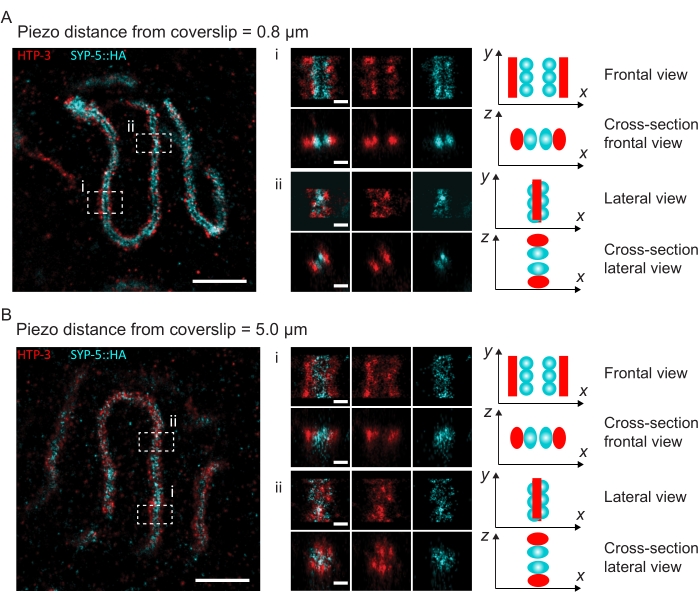
الشكل 4: مجهر توطين جزيء واحد ل HTP-3 و C-termini ل SYP-5. (أ ، ب) إلى اليسار: صور SMLM تظهر نوى باكيتين ملطخة ب HTP-3 (أحمر) والمحطة C ل SYP-5 (SYP-5::HA، سماوي) (شريط المقياس = 1 ميكرومتر). مركز: صور مكبرة للمناطق ذات الأهمية المشار إليها في A و B مع طرق عرض مقطعية مقابلة معروضة أسفل كل صورة (i ، ii ؛ شريط المقياس = 100 نانومتر). يتم تدوير امتدادات SC داخل الصور المكبرة لتوجيه محاور الكروموسوم الموازية للمحور y. يمين: تمثيل رسومي لتوطين البروتينات ذات الأهمية داخل SC يصور اتجاه SC في المناطق المكبرة المعروضة في وسط الشكل. الاختصارات: SMLM = مجهر توطين جزيء واحد ؛ SC = مجمع متشابك. تتوفر البيانات الأولية لإعادة بناء صور SMLM من خلال قاعدة بيانات BioStudies60 (معرف الانضمام: S-BIAD504). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
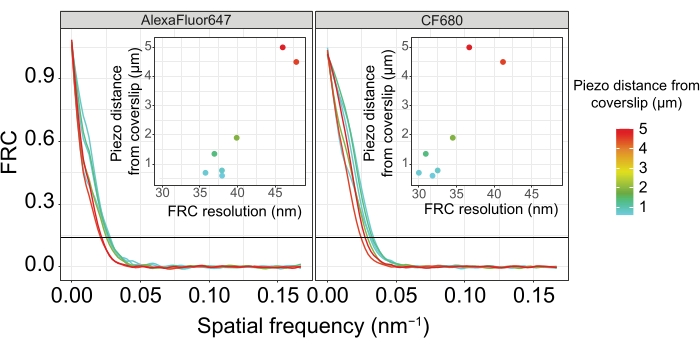
الشكل 5: تعتمد دقة ارتباط حلقة فورييه لصور الفحص المجهري لتوطين الجزيء الواحد على مسافة المستوى z المصور من مستوى قسيمة الغطاء. تظهر الخطوط الملونة منحنيات FRC للصور التي تم الحصول عليها على مسافات مختلفة (كما هو موضح بواسطة شريط الألوان) من قسيمة الغلاف. يشار إلى عتبة 1/7 المستخدمة لتحديد دقة FRC بخط أفقي أسود. تظهر الأجزاء الداخلية اعتماد دقة FRC على مسافة بيزو من غطاء الغطاء. تم تنفيذ التخطيط بواسطة برنامج نصي R مكتوب خصيصا (الإصدار 4.1.2 ، الملف التكميلي 1) حيث تم تنعيم المنحنيات الأصلية بوظائف من حزمة "ggplot2". الاختصارات: FRC = ارتباط حلقة فورييه ؛ SMLM = مجهر توطين جزيء واحد ؛ SC = مجمع متشابك. تتوفر بيانات منحنيات FRC وبيانات SMLM من خلال قاعدة بيانات BioStudies60 (معرف الانضمام: S-BIAD504). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: يعمل الفحص المجهري لاستنفاد الانبعاثات المحفز المعزز بالمعلومات القائمة على العمر الفلوري (TauSTED) على حل نطاقي توطين لكل من HTP-3 والنهاية C ل SYP-5. (أ) تظهر صورتان تمثيليتان TauSTED نوى باكيتين ملطخة ب HTP-3 (أحمر) والنهاية C ل SYP-5 (SYP-5::HA ، سماوي) مع تعريف هيكلي أعلى (أعلى) وأقل (أسفل) (شريط مقياس = 1 ميكرومتر). تحدد المستطيلات المناطق باستخدام C-termini الذي تم حله ل SYP-5 في الأمام (الأبيض) ومنظر مائل قليلا (أصفر) ل SC. (B ، C) توزيع HTP-3 (أحمر) والنهاية C لإشارة SYP-5 (سماوي) تم حلها بواسطة TauSTED. يتم عرض ملفات تعريف الخطوط للمناطق ذات الأهمية التي تحتوي على SC في طرق العرض الأمامية (B) أو المائلة قليلا (C) كخطوط كاملة مع تسوية الكثافة إلى الحد الأقصى للقيمة. تم إنشاء ملفات تعريف الخطوط باستخدام Fiji ImageJ. توضح الخطوط المتقطعة في B متوسط البيانات لكل بروتين. يتوافق الخط السماوي السميك في C مع ملف تعريف الخط مع أقصر مسافة تم حلها بين C-termini ل SYP-5. لتحديد المسافات بين الأجسام المضادة التي تستهدف بروتينات معينة ، تم تزويد ملفات تعريف الخط (n = 9 (B) ، n = 7 (C)) بغاوسيان مزدوج باستخدام برنامج نصي R مكتوب خصيصا (الإصدار 4.1.2 ، الملف التكميلي 1). يشار إلى متوسط المسافة ± الانحراف المعياري (B) والنطاق مع الحد الأدنى للقيمة المظللة بالخط العريض (C) أعلى كل رسم بياني ، على التوالي. الاختصارات: STED = الفحص المجهري لاستنفاد الانبعاثات المحفزة ؛ SC = مجمع متشابك. تتوفر الصور ونقاط البيانات المعروضة لملفات تعريف الخطوط المرسومة من خلال قاعدة بيانات BioStudies60 (معرف الانضمام: S-BIAD504). الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: تكوين المخازن المؤقتة والحلول المستخدمة في هذا البروتوكول. الرجاء الضغط هنا لتحميل هذا الجدول.
الفيديو التكميلي 1: اكتساب المجهر لتوطين جزيء واحد. فيديو يظهر وميض الفلوروفورات بمعدل مناسب (يتم عرض 50 إطارا ، شريط المقياس = 5 ميكرومتر ، 20 مللي ثانية / إطار). الرجاء الضغط هنا لتحميل هذا الفيديو.
الملف التكميلي 1: البرنامج النصي لتحليل البيانات. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
لوحظ التنظيم الشبيه بالسلم ل SC ، وهو أمر ضروري لإعادة التركيب الصحيح وفصل الكروموسومات المتماثلة ، لأول مرة منذ ما يقرب من 70 عاما في المجهر الإلكتروني 3,4. في حين أن التنظيم العام ل SC يتم حله بسهولة في المجهر الإلكتروني ، فإن توطين المكونات الفردية داخل هذا المجمع يتطلب نهجا أكثر استهدافا. مع عرضه ~ 100 نانومتر فقط ، لا يمكن حل البنية التحتية ل SC بواسطة الفحص المجهري الفلوري التقليدي. ومع ذلك ، أصبح الفحص المجهري فائق الدقة محركا رئيسيا للاكتشافات الجديدة حول بنية ووظيفة المجمع المشبكي 16،19،24،25،26،27،28،29،30. لتسهيل هذا البحث ، قمنا بإظهار إجراء تركيب يسمح بدراسة بنية SC داخل أنسجة الغدد التناسلية C. elegans باستخدام الفحص المجهري SMLM و STED.
تتمثل الخطوة الحاسمة لتحسين الدقة في تصوير SMLM في ربط أنسجة الخط الجرثومي مباشرة بغطاء مطلي ب poly-L-lysine (الخطوة 4). يعد الارتباط التساهمي للأنسجة بغطاء الغطاء ضروريا لتقليل الحركات داخل العينة التي من شأنها أن تؤدي إلى انجرافات كبيرة وتجعل التصوير على مدى فترات طويلة من الزمن ل SMLM مستحيلا. بالإضافة إلى ذلك ، حتى المرفق دون المستوى الأمثل الذي يترك النوى التي تحتوي على SCs على مسافة من غطاء الغطاء يؤدي إلى انخفاض كبير في الدقة التي يمكن تحقيقها الناتجة عن الانحرافات الكروية (الشكل 4). بدلا من الملحق التساهمي المستخدم هنا ، يمكن أيضا تثبيت أنسجة الخط الجرثومي الملطخة بين غطاءين مختومين في قطرة صغيرة من مخزن التصويرالمؤقت 19,30. ومع ذلك ، فإن طريقة التثبيت هذه تقلل بشدة من حجم المخزن المؤقت للتصوير في العينة من 1 مل المستخدم في البروتوكول الأمثل هنا إلى بضعة ميكرولتر فقط ، مما سيؤدي إلى تحمض المخزن المؤقت للتصوير وتقليل الوقت الذي يمكن فيه تصوير العينةبشدة 38،53،54.
تحد أوقات الاستحواذ الطويلة لكل من الفحص المجهري SMLM و STED من استخدام هذه الطرق لتصوير العينات الثابتة كيميائيا. هنا ، يضمن تثبيت بارافورمالدهيد الحفاظ على هيكل SC أثناء تحضير العينات والتصوير. ومع ذلك ، على الرغم من الاحتياطات المتخذة هنا لتصوير SC داخل الأنسجة السليمة ، فإن البنية الناتجة من SC بعد التثبيت ليست بالضرورة مطابقة للبنية في حالتها الأصلية داخل كائن حي. علاوة على ذلك ، نظرا لأن صورة واحدة من SC الثابت تمثل "لقطة" واحدة للبنية البيولوجية ، فإن هذا النهج يظل أعمى عن ديناميكيات البنية الأصلية في الجسم الحي.
ومع ذلك ، يمكن أيضا الحصول على معلومات حول ديناميات وتنوع الهياكل الجزيئية الكبيرة من خلال الحصول ليس فقط على "لقطة" واحدة ولكن العديد من "اللقطات". في حين أن هذا النهج يمكن أن يحل التغييرات في بنية SC خلال pachytene19 ، هناك العديد من العوامل التي تحد من عدد الصور التي يمكن الحصول عليها من عينة واحدة معدة باستخدام هذا البروتوكول. أولا ، تؤدي قوى الليزر العالية المستخدمة أثناء الحصول على الصور إلى تبييض دائم للفلوروفورات وتمنع تصوير المناطق المجاورة ذات الأهمية أو مستويات z المتعددة ، مما يقلل بشكل كبير من عدد الصور التي يمكن الحصول عليها من عينة واحدة. ثانيا ، كثافة العينة / الأنسجة على غطاء الغطاء المعد بهذه الطريقة منخفضة ، مما يحد بشكل كبير من عدد الصور التي يمكن الحصول عليها من غطاء واحد. تحظر كثافة العينة المنخفضة أيضا استخدام خطوط أنابيب الحصول على الصور الآلية التي ساعدت في إلقاء الضوء على الأسئلة البيولوجية الأخرى34،55،56،57،58،59. ومع ذلك ، يمكن زيادة كثافة العينة قليلا بواسطة مستخدم متمرس.
تم تحسين البروتوكول المقدم هنا للحصول على كثافة عالية لوضع العلامات اللازمة لتحقيق الدقة المثلى في SMLM35. في حين أن البروتوكولات السابقة تربط الأنسجة تساهميا بالغطاء قبل التلطيخ المناعي16 ، فإن هذا البروتوكول الجديد يربط الأنسجة بالغطاء فقط بعد تلطيخ العينات في المحلول. يسمح هذا التعديل للأجسام المضادة المستخدمة في وضع العلامات المناعية بالوصول بحرية إلى الأنسجة من جميع الجوانب ، في حين أن الارتباط التساهمي للأنسجة بالغطاء قد يقيد الأجسام المضادة من الوصول إلى النوى الأقرب إلى الغطاء ، وبالتالي تقليل درجة وضع العلامات. تعمل التعديلات الموضحة هنا معا على تحسين الدقة من 40-50 نانومتر (دقة FRC)16 إلى 30-40 نانومتر (هذا البروتوكول).
الأهم من ذلك ، في حين أن كثافة وضع العلامات العالية والتركيز العالي للأجسام المضادة أمر ضروري ل SMLM ، وجدنا أنه يتم الحصول على صور مجهرية أفضل STED باستخدام تركيزات أقل من الأجسام المضادة (الخطوة 3). بدقة عشرات النانومتر ، يصبح حجم الجزيئات المستخدمة لتسمية البروتين محل الاهتمام ذا أهمية متزايدة. لذلك استخدمنا شظايا F (ab') 2 التي تبلغ نصف حجم الأجسام المضادة كاملة الطول. سمح التحسن في التباين المحلي بسبب مصدر إشارة أصغر ، وبالتالي الدقة المكتسبة من هذا التعديل مقارنة باستخدام الأجسام المضادة الثانوية كاملة الطول ، بحل اثنين من C-termini من SYP-5 داخل المنطقة الوسطى بواسطة TauSTED ، والتي لم يتم حلها بواسطة STED التقليدي باستخدام الأجسام المضادة كاملة الطول (16 والبيانات غير معروضة). نتوقع أن هذا البروتوكول الأمثل لتصوير SCs في الخطوط الجرثومية C. eleganالسليمة سيسهل التحقيق في العلاقة بين البنية والوظيفة ل SC أثناء الانقسام الاختزالي.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
نود أن نشكر جوناس ريس ومختبر ريس على مشاركة مخازن التصوير لتصوير SMLM. نشكر أيضا Yumi Kim على سلالة C. elegans المستخدمة في هذا البروتوكول و Abby F. Dernburg على الجسم المضاد للدجاج المضاد ل HTP-3. نشكر ماركو لامب وستيفان تيريونغ من مرفق الفحص المجهري الضوئي المتقدم في EMBL هايدلبرغ على دعمهما في استخدام مجهر أوليمبوس iXplore SPIN SR متحد البؤر. تم دعم هذا العمل من قبل المختبر الأوروبي للبيولوجيا الجزيئية و Deutsche Forschungsgemeinschaft (DFG ، مؤسسة الأبحاث الألمانية - 452616889 ، SK). نحن نقدر الوصول والخدمات التي يقدمها مركز التصوير في المختبر الأوروبي للبيولوجيا الجزيئية (EMBL IC)، بدعم سخي من مؤسسة بوهرنجر إنجلهايم.
Materials
| Name | Company | Catalog Number | Comments |
| 100x/1.5 oil objective | Olympus | UPLAPO100XOHR | UPLAPO100XOHR |
| 2-mercaptoethylamine (MEA) | Sigma-Aldrich | 30070-10G | Dissolved in MilliQ water to 5 M solution, pH 8.7 adjusted with HCl. Aliquoted to a single-use volume, frozen, and kept at -80 °C. |
| Additional 640 nm booster laser | Toptica | IBEAM-SMART-640-S-HP | |
| AlexaFluor 594, NHS ester | ThermoFischer Scientific | A37572 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| AlexaFluor 647, NHS ester | ThermoFischer Scientific | A37573 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| anti-HA | Thermo Fisher Scientific | 2-2.2.14 | Mouse monoclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| anti-HTP-3 | a gift from Abby F. Dernburg | MacQueen et al., 2005 | Chicken polyclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| Caenorhabditis elegans strain YKM349 | a gift from Yumi Kim | Hurlock et al., 2020 | syp-5(kim9[syp-5::HA]) I; meIs8[pie-1p::GFP::cosa-1, unc-119(+)] II |
| CF6680, NHS ester | Biotium | 92139 | Dissolved in DMSO to 1mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Circular cover glass 12 mm No. 1 | Menzel-Gläser; VWR | 631-0713 | |
| Circular cover glass 24 mm No. 1.5 | Carl Roth | PK26.1 | |
| Cylindrical lenses | Thorlabs | LJ1516RM-A, LK1002RM-A | |
| Egg Buffer (10x) | Edgar 1995 | 250 mM HEPES, 1.18 M NaCl, 480 mM KCl, 20 mM EDTA, 5 mM EGTA, pH 7.4 | |
| Ethanol (absolute for analysis) | Merck | 64-17-5 | |
| F(ab’)2 fragment anti-chicken IgY | Jackson Immunoresearch | AB_2340347 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| F(ab’)2 fragment anti-mouse IgG | Jackson Immunoresearch | AB_2340761 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| Fisherbrand Microscope slides T/F Ground 0.8-1.0 mm thick | Fisher scientific | 7107 | |
| Gauge Worm Pick 30 diameter 0.254 mm - Iridium 10% | Kisker | 789265 | |
| Glucose oxidase/Catalase enzyme mix (GlOX/Cat ) | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 20x, 1916 U/mL glucose oxidase (Sigma G7141), 42350 U/mL catalase (Sigma C3155), 50 mM Tris-HCl pH 8.0, 51% glycerol, MilliQ water. Stored at -20 °C. |
| Imaging buffer base | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 50 mM Tris-HCl, pH 8.0, 10 mM NaCl, 10% D-Glucose. Aliquoted to a single-use volume (950 μL), frozen, and kept at -80 °C. |
| Invitrogen ProLong Glass Antifade Mountant | ThermoFischer Scientific | P36982 | |
| Leica Stellaris 8 STED FALCON | Leica | N/A | The microscope is equiped with the latest generation white light laser, a 775nm pulsed STED laser, the FALCON Fluorescence Lifetime IMaging module, HC PL APO CS2 100x/1.40 oil objective, and Leica HyD X detector. The system is capable of FLIM module enhanced Tau-STED which measures the specific fluorescence lifetime of a dye and is therefore capable of removing background signal based on differences in fluorescence lifetimes of the dyes, and dye conditions in the sample. Additionally, the resolution is increased by accounting for the variation of fluorescence lifetimes in different areas of the depletion donut. |
| Longwave channel emission filter | AHF Analysentechnik | F47-702 | 700/100 nm bandpass |
| Methanol (absolute for analysis) | Merck | 67-56-1 | |
| NaHCO3 | Sigma-Aldrich/Merck | S5761-500G | 100 mM NaHCO3, pH 8.3 |
| Near-infrared fiber-coupled laser | Toptica | IBEAM-SMART-PT-CD | Custom Design, 808 nm - 75mW |
| Objective lens piezo mount (PIFOC ) | Physik Instrumente | P-726.1.CD | 100 µm travel range |
| Orca Fusion BT sCMOS camera | Hamamatsu | C15440-20UP | |
| PCR tubes | Greiner Bio-One | 673283 | 0.2 mL |
| Phosphate Saline Buffer (PBS 10x) | N/A | 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4 | |
| Pierce 16% formaldehyde (w/v), methanol free | ThermoFischer Scientific | 28906 | 16% formaldehyde is transferred from the original glass ampule into 1.5 mL tube and kept at room temperature. |
| PlasmaPrep2 plasma cleaner | GaLa Instrumente GmbH | N/A | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich/Merck | P2636-25MG | 0.1% w/v solution was prepared in Milli-Q water, and stored in aliquots at -20 °C. |
| Primary dichroic (illumination reflecting) | AHF Analysentechnik | F73-866S | quad bandpass @ 405, 488, 561, 640 |
| Quadnotch filter | AHF Analysentechnik | F40-072 | 405/488/561/640 nm |
| Quadrant photodiode (QPD) | Laser Components | SD197-23-21-041, LC301DQD-PV | |
| Razor blades | Apollo Herkenrath Solinger | N/A | |
| Refractive beam shaper | AdlOptica | PiShaper 6_6_VIS | |
| Roche Blocking Reagent | Roche | 11096176001 | 10x solution was prepared according to recommendation. Frozen aliquots were stored at -20 °C. |
| Scalpel blade (Feather brand #11, No. 3) | Heinz Herenz Medizinalbedarf GmbH | 1110911 | |
| Scalpel removal box | Fisher scientific | 10002-50 | |
| Secondary dichroic (emission reflecting) | AHF Analysentechnik | F38-785S | 750 nm longpass |
| Shortpass filter | Semrock | BSP01-785R-25 | 750 nm |
| Shortwave channel emission filter | AHF Analysentechnik | F37-677 | 676/37 nm bandpass |
| Single molecule localization microscope | EMBL Imaging Centre | Diekmann et al., 2020 with modifications | The microscope provides widefield epi-illumination via a single-mode fiber-coupled laser engine, additional booster laser, and refractive beam shaper to provide a uniform illumination field (Stehr et al, 2019). Widefield images are captured on a sCMOS camera and appropriate relay optics for a system magnification of 61x and a pixel size of 106 nm. For ratiometric imaging of spectrally overlapping far-red dyes, an image splitter produces two spectrally distinct images on the camera (splitting dichroic: 665 nm long pass, shortwave channel emission filter: 676/37 nm bandpass, longwave emission filter: 700/100 nm bandpass. An additional 405/488/561/640 nm quadnotch filter and 750 nm shortpass filter are common to the two paths and provide additional laser blocking). A compound cylindrical lens provides the astigmatism required for 3D imaging. To maintain a fixed focus across acquisitions exceeding 2 hours in time (comprising 200 000 - 250 000 images), focus locking is achieved by total internal reflection of a near-infrared fiber-coupled laser from the coverslip and subsequent height sensitive detection on a quadrant photodiode (QPD). The QPD signal provided closed-loop control of the objective lens piezo mount. For access to this microscope, refer to https://www.embl.org/about/info/imaging-centre or contact ic-contact@embl.de |
| Single-mode fiber-coupled multi-laser engine | Toptica | iCHROME MLE-LFA-HP | Provides widefield epi-illumination of 100 mW at 405, 488, 561, 640 nm |
| Splitting dichroic | AHF Analysentechnik | F48-665SG | 665 nm long pass |
| Square cover glass 22 x 22 mm No.1 | Menzel-Gläser; VWR | 630-2882 | |
| STAR 635P, NHS ester | Abberior | ST635P-0002-1MG | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Stereo microscope Stemi 305 Stand K LAB | Zeiss | N/A | |
| Tetramisole hydrochloride | Sigma-Aldrich/Merck | T1512-2G | 1% (w/v) solution was prepared in Milli-Q water. Frozen aliquots were stored at -20 °C. Thawed aliquot was kept at 4 °C and used for several months. |
| TetraSpeck Microspheres | ThermoFischer Scientific | T7279 | 0.1 µm, fluorescent blue/green/orange/dark red |
| Tris Saline Buffer (TBS 10x) | N/A | 200 mM Tris-HCl, 1.5 M NaCl, pH 7.5 | |
| TWEEN 20 | Sigma-Aldrich/Merck | P9416-50ML | Kept at room temperature in original packaging. |
| WormStuff worm pick | Kisker | 789277 | |
| XY microscope stage | Smaract | N/A | Custom Design |
| Zeba Micro Spin Desalting Column | ThermoFischer Scientific | 89877 | 7K MWCO, 75 µL |
References
- Zickler, D., Kleckner, N. Meiotic chromosomes: integrating structure and function. Annual Review of Genetics. 33, 603(1999).
- Ur, S. N., Corbett, K. D. Architecture and dynamics of meiotic chromosomes. Annual Review of Genetics. 55, 497-526 (2021).
- Fawcett, D. W. The fine structure ot chromosomes in the meiotic prophase of vertebrate spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (4), 403-406 (1956).
- Moses, M. J. Chromosomal structures in crayfish spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (2), 215-218 (1956).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. WormBook. , 433-434 (2017).
- Pasierbek, P., et al. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes & Development. 15 (11), 1349-1360 (2001).
- Severson, A. F., Ling, L., Van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes & Development. 23 (15), 1763-1778 (2009).
- Zetka, M. C., Kawasaki, I., Strome, S., Müller, F. Synapsis and chiasma formation in Caenorhabditis elegans require HIM-3, a meiotic chromosome core component that functions in chromosome segregation. Genes & Development. 13 (17), 2258-2270 (1999).
- Martinez-Perez, E. HTP-1-dependent constraints coordinate homolog pairing and synapsis and promote chiasma formation during C. elegans meiosis. Genes & Development. 19 (22), 2727-2743 (2005).
- Couteau, F., Zetka, M. HTP-1 coordinates synaptonemal complex assembly with homolog alignment during meiosis in C. elegans. Genes & Development. 19 (22), 2744-2756 (2005).
- Goodyer, W., et al. HTP-3 Links DSB Formation with Homolog Pairing and Crossing Over during C. elegans Meiosis. Developmental Cell. 14 (2), 263-274 (2008).
- Colaiácovo, M. P., et al. Synaptonemal complex assembly in C. elegans is dispensable for loading strand-exchange proteins but critical for proper completion of recombination. Developmental Cell. 5 (3), 463-474 (2003).
- MacQueen, A. J., Colaiácovo, M. P., McDonald, K., Villeneuve, A. M. Synapsis-dependent and -independent mechanisms stabilize homolog pairing during meiotic prophase in C. elegans. Genes & Development. 16 (18), 2428-2442 (2002).
- Smolikov, S., et al. Synapsis-defective mutants reveal a correlation between chromosome conformation and the mode of double-strand break repair during Caenorhabditis elegans meiosis. Genetics. 176 (4), 2027-2033 (2007).
- Smolikov, S., Schild-Prüfert, K., Colaiácovo, M. P. A yeast two-hybrid screen for SYP-3 interactors identifies SYP-4, a component required for synaptonemal complex assembly and chiasma formation in Caenorhabditis elegans meiosis. PLoS Genetics. 5 (10), 1000669(2009).
- Hurlock, M. E., et al. Identification of novel synaptonemal complex components in C. Elegants. The Journal of Cell Biology. 219 (5), (2020).
- Zhang, Z., et al. Multivalent weak interactions between assembly units drive synaptonemal complex formation. The Journal of Cell Biology. 219 (5), (2020).
- Schild-Prüfert, K., et al. Organization of the synaptonemal complex during meiosis in Caenorhabditis elegans. Genetics. 189 (2), 411-421 (2011).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. The interaction of crossover formation and the dynamic architecture of the synaptonemal complex during meiosis. bioRxiv. , (2020).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6621), 543-548 (2015).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Schücker, K., Holm, T., Franke, C., Sauer, M., Benavente, R. Elucidation of synaptonemal complex organization by super-resolution imaging with isotropic resolution. Proceedings of the National Academy of Sciences. 112 (7), 2029-2033 (2015).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences. 114 (33), 6857-6866 (2017).
- Zwettler, F. U., et al. Tracking down the molecular architecture of the synaptonemal complex by expansion microscopy. Nature Communications. 11 (1), 1-11 (2020).
- Yoon, S., Choi, E. H., Kim, J. W., Kim, K. P. Structured illumination microscopy imaging reveals localization of replication protein A between chromosome lateral elements during mammalian meiosis. Experimental & Molecular Medicine. 50 (8), 1-12 (2018).
- Prakash, K., et al. Superresolution imaging reveals structurally distinct periodic patterns of chromatin along pachytene chromosomes. Proceedings of the National Academy of Sciences. 112 (47), 14635-14640 (2015).
- Xu, H., et al. Molecular organization of mammalian meiotic chromosome axis revealed by expansion STORM microscopy. Proceedings of the National Academy of Sciences. 116 (37), 18423-18428 (2019).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. Superresolution microscopy reveals the three-dimensional organization of meiotic chromosome axes in intact Caenorhabditis elegans tissue. Proceedings of the National Academy of Sciences. 114 (24), 4734-4743 (2017).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Hein, B., Willig, K. I., Hell, S. W. Stimulated emission depletion (STED) nanoscopy of a fluorescent protein-labeled organelle inside a living cell. Proceedings of the National Academy of Sciences. 105 (38), 14271-14276 (2008).
- Jahr, W., Velicky, P., Danzl, J. G. Strategies to maximize performance in STimulated Emission Depletion (STED) nanoscopy of biological specimens. Methods. 174, 27-41 (2019).
- Thevathasan, J. V., et al. Nuclear pores as versatile reference standards for quantitative superresolution microscopy. Nature Methods. 16 (10), 1045-1053 (2019).
- Xu, K., Shim, S. -H., Zhuang, X. Super-resolution imaging through stochastic switching and localization of single molecules: an overview. Far-Field Optical Nanoscopy. , 27-64 (2013).
- Wang, Y., et al. Localization events-based sample drift correction for localization microscopy with redundant cross-correlation algorithm. Optics Express. 22 (13), 15982(2014).
- Winterflood, C. M., Platonova, E., Albrecht, D., Ewers, H. Dual-color 3D superresolution microscopy by combined spectral-demixing and biplane imaging. Biophysical Journal. 109 (1), 3-6 (2015).
- Diekmann, R., et al. Optimizing imaging speed and excitation intensity for single molecule localization microscopy. Nature Methods. 17 (9), 909(2020).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319 (5864), 810-813 (2008).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Methods in Molecular Biology. 558, 171-195 (2009).
- Edgar, L. G. Blastomere culture and analysis. Methods in Cell Biology. 48, 303-321 (1995).
- MacQueen, A. J., et al. Chromosome sites play dual roles to establish homologous synapsis during meiosis in C. elegans. Cell. 123 (6), 1037-1050 (2005).
- Stehr, F., Stein, J., Schueder, F., Schwille, P., Jungmann, R. Flat-top TIRF illumination boosts DNA-PAINT imaging and quantification. Nature Communications. 10 (1), 1-8 (2019).
- Hoess, P., Mund, M., Reitberger, M., Ries, J. Dual-color and 3D super-resolution microscopy of multi-protein assemblies. Methods in Molecular Biology. 1764, 237-251 (2018).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer Control of microscopes using µManager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. Journal of Biological Methods. 1 (2), 10(2014).
- Deschamps, J., Ries, J. EMU: reconfigurable graphical user interfaces for Micro-Manager. BMC Bioinformatics. 21 (1), 1-13 (2020).
- Ries, J. SMAP: a modular super-resolution microscopy analysis platform for SMLM data. Nature Methods. 17 (9), 870-872 (2020).
- Li, Y., et al. Global fitting for high-accuracy multi-channel single-molecule localization. Nature Communications. 13 (1), 1-11 (2022).
- Nieuwenhuizen, R. P. J., et al. Measuring image resolution in optical nanoscopy. Nature Methods. 10 (6), 557-562 (2013).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. Journal of Structural Biology. 183 (3), 363-367 (2013).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Shi, X., Lim, J., Ha, T. Acidification of the oxygen scavenging system in single-molecule fluorescence studies: in situ sensing with a ratiometric dual-emission probe. Analytical Chemistry. 82 (14), 6132-6138 (2010).
- Olivier, N., Keller, D., Rajan, V. S., Gönczy, P., Manley, S. Simple buffers for 3D STORM microscopy. Biomedical Optics Express. 4 (6), 885-899 (2013).
- Mund, M., et al. Superresolution microscopy reveals partial preassembly and subsequent bending of the clathrin coat during endocytosis. bioRxiv. , (2022).
- Mund, M., et al. Systematic nanoscale analysis of endocytosis links efficient vesicle formation to patterned actin nucleation. Cell. 174 (4), 884-896 (2018).
- Sabinina, V. J., et al. Three-dimensional superresolution fluorescence microscopy maps the variable molecular architecture of the nuclear pore complex. Molecular Biology of the Cell. 32 (17), 1523-1533 (2021).
- Cieslinski, K., et al. Nanoscale structural organization and stoichiometry of the budding yeast kinetochore. bioRxiv. , (2021).
- Sieben, C., Banterle, N., Douglass, K. M., Gönczy, P., Manley, S. Multicolor single-particle reconstruction of protein complexes. Nature Methods. 15 (10), 777-780 (2018).
- Sarkans, U., et al. The BioStudies database—one stop shop for all data supporting a life sciences study. Nucleic Acids Research. 46, (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved