Method Article
カエノラブディティス・エレガンス生殖系列内のシナプトン複合体の超解像顕微鏡
要約
超解像顕微鏡は、減数分裂におけるシナプトン複合体内の成分の構成に関する詳細な洞察を提供することができます。ここでは、 カエノラブディティス・エレガンス ・シナプトン複合体の個々のタンパク質を分解するためのプロトコルを示します。
要約
減数分裂の間、相同染色体はそれらの正しい分離を可能にするために互いに認識して付着しなければならない。相同染色体の相互作用を確保する重要な事象の1つは、減数分裂前期Iにおけるシナプトン複合体(SC)の集合である。異なる種間のSC内のタンパク質成分間の配列相同性はほとんどありませんが、SCの一般的な構造は進化の過程で高度に保存されています。電子顕微鏡写真では、SCは、横方向の要素または軸、横方向のフィラメント、および中央の要素で構成される三部構成のはしごのような構造として表示されます。
しかし、SCの分子構造を決定するために電子顕微鏡法によって複合体内の個々の成分の局在を正確に同定することは依然として困難である。対照的に、蛍光顕微鏡法は、複合体内の個々のタンパク質成分の同定を可能にする。しかし、SCの幅は~100 nmしかないため、その下部構造は回折制限のある従来の蛍光顕微鏡では解決できません。したがって、SCの分子構造を決定するには、構造化照明顕微鏡(SIM)、誘導放出枯渇(STED)顕微鏡、または単一分子局在顕微鏡(SMLM)などの超解像光学顕微鏡技術が必要です。
SC内の個々の成分の構造と相互作用を維持するためには、生殖細胞内の本来の環境に近い環境で複合体を観察することが重要です。したがって、SMLMおよびSTED顕微鏡を使用して、無傷の押し出し カエノラブディティスエレガンス 生殖細胞系列組織におけるSCの下部構造の研究を可能にする免疫組織化学およびイメージングプロトコルを実証します。組織をカバーガラスに直接固定することで、イメージング中のサンプルの動きを減らし、サンプルの収差を最小限に抑えて、SCの下部構造を生物学的コンテキストで視覚化するために必要な高解像度を実現します。
概要
減数分裂中に染色体の数を半分に減らすことは、有性生殖生物に健康な子孫を生み出すための鍵です。この染色体数の減少を達成するためには、相同染色体は減数分裂Iの間に対になって分離しなければならない。相同染色体の正確な分離を確実にするために、生殖細胞は拡張前期Iを受け、その間に相同染色体がペアになり、シナプス、および再結合して、ホモログ間の物理的リンクを生成します1。SCは、減数分裂前期2の正しい進行を調節する上で重要な中心的な構造として浮上しています。
SCは、そのタンパク質成分間にほとんど相同性がないにもかかわらず、その一般的な構造が進化的に保存されている複合体です。SCは、電子顕微鏡写真で、2つの横方向の要素または軸、横方向のフィラメントによって形成された中央領域、および中央の要素3,4からなる三者のはしご状の構造として最初に特定されました。複合体内の個々のコンポーネントの構成を決定することは、減数分裂前期におけるSCの役割の理解を深めるための鍵です。
モデル生物C.エレガンスは、その生殖系列が完全に組み立てられたSCを持つ多数の減数分裂核を含むため、SCの構造と機能を研究するのに理想的です5。遺伝学的および生化学的研究により、染色体軸は、C.エレガンスのHTP-1/2/3およびHIM-3 7,8,9,10,11と呼ばれる3つの異なるコヒーシン複合体6,7および4つのHORMAドメインタンパク質によって形成されることが明らかになりました。SCの中央領域では、コイルドコイルドメインを含む6つのタンパク質がこれまでに同定されています12、13、14、15、16、17。2つの軸間の距離を埋めるために、SYP-1、-5、および-6は直接対決的に二量体化し(図1)、3つの追加のタンパク質が中央要素16、17、18、19での相互作用を安定化させます。
これらのタンパク質の構成に関する詳細な洞察を得ることは、減数分裂中のSCの多くの機能を理解するために不可欠です。SCの中央領域の幅は~100 nmしかないため、その下部構造は回折限界蛍光顕微鏡では解像できません。ただし、このサイズの構造内のコンポーネントの視覚化は、超解像顕微鏡によって容易に達成できます。実際、構造化照明顕微鏡(SIM)、膨張顕微鏡20、誘導放出枯渇(STED)顕微鏡21、および単一分子局在顕微鏡(SMLM)22,23は、種全体のSCの分子構造を研究するための不可欠なツールとして浮上しています16,24,25,26,27,28,29、30。
分解能の限界を克服するために、STED顕微鏡は、発光光の回折制限スポットをSTEDレーザーからのドーナツ状のビームでオーバーレイすることに依存しており、理論的には点像分布関数を分子寸法31,32に制限します。しかし、生体試料内でSTEDによって実際に達成可能な分解能は、xy33では数十ナノメートルの範囲にとどまっています。
SMLM技術を使用すると、生物学的サンプルのさらに高い分解能を得ることができます。SMLMは、特定の蛍光色素の点滅特性を利用して、空間的に重なり合う蛍光色素を時間的に分離することにより、サブ回折レベルでオブジェクトを分離します。次に、サンプルを繰り返しイメージングして、蛍光色素のさまざまなサブセットを捕捉します。次に、サンプル内の蛍光色素の位置は、すべての画像で得られたシグナルに点像分布関数(PSF)を当てはめることによって決定され、15 nmまでの構造を分解できます23,34。
まとめると、局所化された画像はすべての蛍光色素の位置をエンコードします。SMLMの分解能は、標識密度と蛍光色素のブリンキング特性によって決まります。ナイキスト-シャノン基準によれば、ラベル間平均距離の2倍未満のオブジェクトを確実に解決することは不可能です。したがって、高解像度のイメージングには高い標識密度が必要です。 C. elegansのSCでは、ゲノム編集を用いて内因性タンパク質の特定の部位に結合したエピトープタグを用いることで、高い標識密度を達成することができます。次いで、エピトープタグは、高い親和性を有する特異的モノクローナル抗体を用いて高密度で染色することができる19、30。同時に、個々の蛍光色素のオンサイクルは、空間的に重なり合う蛍光色素が同時に捕捉されないように十分に短くなければなりません35。
この2つの要件により、SCのような大きな高分子複合体の構造を解像するには、十分な数の画像をイメージングする必要があり、数時間かかることがあります。イメージング時間が長いことの落とし穴は、ステージの動きやサンプルバッファー内の小さな電流によってサンプルがドリフトする傾向があることです。10 nmオーダーの小さな動きでも、nmの分解能では有害であり、補正する必要があります。しかしながら、一般的に使用されるドリフト補正方法は、順次画像化された2つのチャネルの画像を正確にオーバーレイするのに十分なほど堅牢ではない36。生物学的な質問では、同じサンプル内の複数のターゲットの正確な検出と局在化が求められることが多いため、これは問題があります。これらの問題を回避するために、レシオメトリックイメージングなどの方法が開発されてきた。レシオメトリックイメージングでは、励起スペクトルと発光スペクトルが重なり合う複数の蛍光色素を同時にイメージングし、その後、スペクトル的に異なるチャネルの強度比に基づいて、検出された各シグナルをそれぞれの蛍光色素に割り当てることができます37,38。
さらに、SCのような高分子複合体の構成を研究するには、3次元(3D)情報が必要です。3次元超解像(3D-SMLM)を実現するために、放射光の光路にシリンドリカルレンズが組み込まれており、焦点面からの距離に応じて蛍光色素のPSFの形状が歪んでいます。したがって、z平面内の蛍光色素の正確な位置は、その発光信号の形状を分析することによって外挿することができます35,39。SMLMにおけるこれらの進歩を組み合わせることで、SCを含む高分子複合体の3D組織のイメージングが可能になります。
プロトコル
1.溶液とカバーガラスの準備
注:すべての材料と試薬に関連する詳細については、 材料の 表を、このプロトコルで使用される溶液の組成については 表1 を参照してください。
- ポリ-L-リジンコーティングカバーガラス
- 0.01%(w / v)のポリ-L-リジンを準備します( 表1を参照)。
- 精密カバーガラス(直径24 mm、0.17 ± 0.005 mm、No.1.5)をエタノールで10〜30分間洗浄します。カバーガラスをddH2Oですすいでエタノールを除去し、カバーガラスを室温で乾燥させます。
- プラズマクリーナーを使用してカバーガラスをプラズマ洗浄します。
注意: プラズマクリーニングはカバーガラスの親水性を高め、次の手順を容易にします。プラズマクリーナーが利用できない場合は、この手順をスキップできますが、ポリ-L-リジン溶液の容量や濃度を調整する必要がある場合があります。この変更はテストされていません。 - カバーガラスに0.01%(w/v)のポリL-リジンを1滴(120 μL)置きます。室温で10分間インキュベートします。
- インキュベーション後、カバーガラスをddH2Oですすぎ、室温で乾燥させます。4°Cで1ヶ月まで保存してください。
- 蛍光有機色素と結合したF(ab')2フラグメント
- PBS中の0.6-0.7 mg/mL F(ab')2フラグメント10 μL、0.1 M NaHCO3(pH 8.3)1 μL、DMSO中の1 μLの1 mMスクシンイミジル(NHS)エステル反応性蛍光色素の順にPCRチューブに加えます(F(ab')2:色素のモル比は~1:17)。上下にピペッティングしてよく混ぜます。
- 室温で1時間インキュベートします。
- メーカーの仕様に従って、脱塩カラム(7K MWCO)を使用して、F(ab')2フラグメントを残りの遊離反応性色素から分離します。カラムの平衡化と標識されたF(ab')2フラグメントの溶出には、1x PBSを使用します。
- 標識したF(ab')2フラグメントを4°Cで最大3ヶ月間保存します。
注意: 3か月を超える保管時間はテストされていません。
2.解剖と固定
注:解剖および固定手順は、超解像顕微鏡に最適なサンプルを得るために、以前に推奨された手順16,40から変更されています。
- 解剖
- 年齢が一致した C.エレガンス ワーム(この研究では20°Cで成長)をカバーガラス(22 mm x 22 mm、No.1)上の30 μLのEBTT(0.2%非イオン界面活性剤を含む1x卵バッファー41 、 表1)にピックします。操作しやすいように、カバースリップをスライドガラスの上に置きます。30 μLのEBTTで数回上下にピペッティングして洗浄します。30 μLの溶液を取り出し、カバーガラスに30 μLの滴を残します。
注意: ワームがプラスチックの先端に付着するのを防ぐために、ワームがピペットで送られるすべての溶液に少量の非イオン性洗剤を追加する必要があります。 - メスの刃を使用して、生殖腺を押し出すためにワームの頭や尾を切り落とします(図2A)。
- 年齢が一致した C.エレガンス ワーム(この研究では20°Cで成長)をカバーガラス(22 mm x 22 mm、No.1)上の30 μLのEBTT(0.2%非イオン界面活性剤を含む1x卵バッファー41 、 表1)にピックします。操作しやすいように、カバースリップをスライドガラスの上に置きます。30 μLのEBTTで数回上下にピペッティングして洗浄します。30 μLの溶液を取り出し、カバーガラスに30 μLの滴を残します。
- 固定
- ピペット30μLの固定液(表1)を解剖したワームの滴に入れ、ピペットを上下にピペットして混合します。
注:数回上下にピペッティングすると、より多くの生殖腺を放出するのに役立つ場合があります。 - 固定液を追加した後、正確に1分間固定します。
- TBSTで満たされたPCRチューブにワームを移して固定を停止します(表1)。ワームをできるだけ少ない量(~15 μL)で移します。
- ミニベンチトップ遠心分離機(2,000 × g、10秒)でPCRチューブをスピンダウンします。上清を取り除き、それぞれ200μLのTBSTで2回洗浄します。
- 200 μLのPBST(表1)で5〜10分間洗浄します。解剖したサンプルを氷上に保ちながら、最大4つのサンプルに対して手順2.1.1から2.2.5を繰り返します。
注意: 4つ以上のサンプルを処理する場合は、4つのサンプルごとに手順2.2.6から2.2.7に進み、サンプル固定がすべてのサンプルで一貫していることを確認します。 - 解剖したサンプルをミニベンチトップ遠心分離機(2,000 × g、10秒)で回転させ、PBSTを除去し、50〜100 μLの冷メタノール(-20°C)を加えます。
注意: メタノールは有毒です。保護具を着用し、吸入を避けてください。 - 上下にピペッティングして混合し、サンプルをメタノールに30〜60秒間放置します。サンプルを200 μLのPBSTで2回洗浄します。
注意: 4つ以上のサンプルを処理する場合は、残りのサンプルの解剖に進みます(手順2.1.1から2.2.7)。 - サンプルを200 μLのPBSTで3回目に洗浄します。
- ピペット30μLの固定液(表1)を解剖したワームの滴に入れ、ピペットを上下にピペットして混合します。
3. 抗体インキュベーション
- ブロッキング
- サンプルを1xブロッキング溶液(表1)で室温で45〜60分間ブロックします。
注:インキュベーション時間は、室温で30分から4°Cで数日の範囲です(テストは最大3日間行われました)。
- サンプルを1xブロッキング溶液(表1)で室温で45〜60分間ブロックします。
- 一次抗体溶液
- 抗HTP-3(チキン42)および抗HA(マウス)抗体(または選択した抗体)を1xブロッキング溶液(SMLMの場合は1:250、STED顕微鏡サンプルの場合は1:1,000)に希釈します。
注:SMLM顕微鏡ではより高い標識密度が推奨されるため、SMLMサンプルの標識に使用される抗体はSTEDサンプルよりも濃縮されています。 - ミニベンチトップ遠心分離機(2,000 × g、10秒)でサンプルをスピンし、ブロッキングバッファーを除去し、30〜50 μLの一次抗体溶液を追加します。4°Cで一晩(推奨)、または室温で1〜2時間インキュベートします。
- インキュベーション後、PBSTで3 x 5〜15分洗浄します。
- 抗HTP-3(チキン42)および抗HA(マウス)抗体(または選択した抗体)を1xブロッキング溶液(SMLMの場合は1:250、STED顕微鏡サンプルの場合は1:1,000)に希釈します。
- 蛍光色素に結合したF(ab')2フラグメントの作業溶液
- 標識されたF(ab')2フラグメント(ステップ1.2.4)を1xブロッキング溶液で作業溶液(SMLMの場合は1:100、STED顕微鏡サンプルの場合は1:1,000)に希釈します。
注:両方の超解像技術について、以前に報告された蛍光色素ペア、すなわちSMLM用のAlexaFluor647/CF680とSTED用のAlexaFluor594/Abberior STAR635Pを使用しました。AlexaFluor647およびSTAR645Pを用いて、SYP-5のC末端を標的とする抗マウス(Fab')2フラグメントを標識し、HTP-3を標的とするCF680/AlexaFluor594標識抗ニワトリ(Fab')2フラグメントを標識した。 - ミニベンチトップ遠心分離機(2,000 × g、10秒)でサンプルをスピンさせ、PBSTを除去し、30〜50 μLの二次抗体溶液を加えます。室温で30分から2時間インキュベートするか(推奨)、4°Cで一晩インキュベートします。 PBSTで3 x 5〜15分洗ってください。
- 標識されたF(ab')2フラグメント(ステップ1.2.4)を1xブロッキング溶液で作業溶液(SMLMの場合は1:100、STED顕微鏡サンプルの場合は1:1,000)に希釈します。
4.カバーガラスへのサンプルの取り付け
- 後置
注意: 手順4.1.1〜4.2.1でサンプルを個別に処理します。- 染色したサンプルをスピンダウンし、上清を除去します。PBST0.2 を50 μL加え、染色したワームを22 mm x 22 mmのNo.1カバーガラスに移します。
注意: ワームがカバーガラスに付着するのを防ぐために、この手順には0.2%の非イオン性洗剤(表1)を含む新しいPBST0.2を使用してください。 - ピペット5.7-6.3μLの固定後溶液をポリ-L-リジンカバーガラスに。
注意: 4°Cで保管されたポリ-L-リジンカバーガラスは、最初に室温にする必要があります。 - 解剖したワームを同じ容量(5.7〜6.3 μL)でピペット除去し、ポリ-L-リジンカバーガラス上の固定液の滴に移します(図2B)。
注:このステップと次のステップでは、解剖した組織をポリL-リジンコーティングカバーガラスの中央に保持することが非常に重要です。これは、ここで使用するカスタムメイドのSMLM顕微鏡に合わせてサンプルをカスタムホルダーに取り付ける場合に特に重要です(ステップ5.1、 図2Bを参照)。 - サンプルを小さなカバーガラス(直径12 mm、 図2B)で覆います。ろ紙の小片を使用して余分な液体を取り除きます(図2B)。暗いチャンバーで3〜5分間固定します。
- 染色したサンプルをスピンダウンし、上清を除去します。PBST0.2 を50 μL加え、染色したワームを22 mm x 22 mmのNo.1カバーガラスに移します。
- 「フリーズクラッキング」
- サンプルをドライアイスのアルミブロックの上に置いて凍結します(図2B)。
注意: アルミニウムブロックは、サンプルを置く前にドライアイスで十分に冷却する必要があります。残りのサンプルのポストフィックスに進みます(ステップ4.1.1から4.2.1)。サンプルは、次のステップ(4.2.2)の前に少なくとも20分間または最大1時間ドライアイス上にある必要があります。 - かみそりを使用して小さい方のカバーガラスを取り外します(図2B)。
メモ: STED の場合は、手順 5.2.1 に進みます。SMLM の場合は、ステップ 4.2.3 に進みます。 - カバーガラスを、氷冷PBS(推奨)または-20°Cのメタノールを含む50 mLのコニカルチューブに約10秒間浸します。
注意: 温度はこのステップにとって非常に重要な要素です。したがって、解凍したてのPBSを使用するか、氷/エタノール浴に保管してください。 - カバーガラスをPBSTバッファーで満たされた6ウェルプレートのウェルに入れます。ウェルからPBSTを取り出し、新しいPBSを追加します。サンプルをPBSに5分間放置します。
注意: サンプルの損傷や剥離を避けるために、PBSをウェルの側面にピペットで固定します。 - 新鮮なPBSで洗浄し、イメージングするまでサンプルを4°Cで放置します。
注:サンプルは最大2週間安定していますが、サンプルを2日以内に画像化すると最良の結果が得られます。 - イメージングの前に、実体顕微鏡でサンプルマウントの品質を評価します。
注意: 正常に取り付けられた生殖細胞系列は、カバーガラスに対して識別可能な動きがなく、安定して取り付けられています。付着が不十分な生殖細胞系列は、緩衝液中で羽ばたきます。
- サンプルをドライアイスのアルミブロックの上に置いて凍結します(図2B)。
5. イメージング
- 1分子局在顕微鏡
注:画像は、以前に報告されたように、カスタムボディの周りに構築されたカスタムビルドの単一分子局在顕微鏡を使用して、EMBLイメージングセンターで取得されました。38,43で指定されている固有の機能を備えています。 材料表;https://www.embl.org/about/info/imaging-centre を参照してください- 3Dビーズキャリブレーションの取得
- 前述のように、接着性100 nm蛍光ビーズを用いて精密カバーガラス(直径24 mm;0.17 ± 0.005 mm、No.1.5)を準備します38,44。
- 手順5.1.1.1のキャリブレーションサンプルをサンプルホルダーに入れます。
- クリーンな100倍/1.5オイル対物レンズに液浸オイルを一滴加え、校正サンプルを顕微鏡に取り付けます。
- MicroManager 2 45,46内で、キャリブレーションサンプルに15〜20の位置を指定します。
- EMUプラグインウィンドウ47内で、ステップ5.1.1.5から位置毎に zスタック画像の取得を設定する。
注:ここでは、複合シリンドリカルレンズが3Dイメージングに必要な乱視を提供し、-1μmから1μmの範囲にまたがる各位置について、10nmの増分で201個の zスライスが取得されました。2 kW/cm2 640 nmレーザー照明を、各 zスライスについて25 ms使用しました。 - ステップ5.1.11でサンプル画像を取得するために使用されるのと同じ光路を介して、100nm蛍光ビーズの zスタック画像を取得します。
- 超解像顕微鏡分析プラットフォーム(SMAP48)を使用して、ステップ5.1.13で3D-SMLMデータを適合させるために使用される実験点像分布関数(PSF)の cspline モデルを生成します。
- サンプルホルダーを準備します。ここで使用する特注ホルダーで、磁気リングを使用してイメージングチャンバーを作成する場合(図2B)、磁気リングをパラフィルムで包みます。
注:または、凹状のくぼみキャビティを備えた顕微鏡スライドを使用して、スライドホルダーを備えた顕微鏡用のサンプルを取り付けることもできます。 - 1mLのイメージングバッファー44 を調製する(表1)。
- ステップ4.2.6からカバーガラスを1枚取り出し、カスタムメイドのホルダーに入れます。パラフィルムで包まれた磁気リングでホルダーのカバーガラスを固定します(ステップ5.1.2)。
- サンプル上部の磁気リングによって作成されたチャンバー内のイメージングバッファー(ステップ5.1.3)を静かにピペッティングします(図2B)。チャンバーをパラフィルムで密封します。
- サンプルを取り付けるには、クリーンな100x/1.5オイル対物レンズに液浸オイルを1滴加えます。液浸オイルに空気を入れずに、取り付けたサンプルを入れたサンプルホルダーを顕微鏡ステージにそっと置きます(ステップ5.1.5)。
注:サンプルを顕微鏡に置く前に、カバーガラスの底をティッシュと70%エタノールで拭いてください。 - MicroManager 2 45,46内のEMUプラグインウィンドウ47を使用して、フォーカスロックレーザからの信号が象限フォトダイオード(QPD)で検出されるまでピエゾステージを移動する。
注:撮影時間にわたって一定の焦点を維持するために、カバーガラスからの近赤外線ファイバー結合レーザーの全内部反射とそれに続く象限フォトダイオード(QPD)での高さ感度検出によってフォーカスロックが実現されます。QPD信号は、対物レンズピエゾマウントの閉ループ制御を提供しました。 - 低出力(つまり、1〜5%)で640 nm励起レーザーを使用して後方焦点面画像を取得し、液浸油に気泡がないことを確認します。
注意: 気泡が検出された場合は、サンプルをステージから取り出します。カバーガラスの底部と対物レンズを清掃し、手順5.1.6〜5.1.8を繰り返します。それ以外の場合は、EMUソフトウェア47内でフォーカスをロックすることに進む。 - 明視野照明を使用して生殖腺組織を局在化します。低強度の640 nm照明を使用して、多くのSCストレッチを含む組織の切片に焦点を合わせます。
注意: カバーガラスから2μmを超える構造に焦点を合わせないでください。サンプルの位置を特定するために高いレーザー出力を使用すると、一部の蛍光色素が早期に点滅状態になる可能性があるため、使用しないでください。ここでは、1 kW / cm2 をパルスを1,000に設定した上昇モードで使用しました。 - 適切な点滅速度が達成されるまで、高放射照度(27 kW /cm 2)で640 nmの照明でサンプルを~30秒間露光します(補足ビデオ1)。
- MicroManager 245,46の多次元取得ツールを使用して、20ミリ秒の露光時間で200,000フレームを集録します。
- 一方、EMUプラグイン38,47のアクティベーションオプションを使用してUVアクティベーションを設定し、目的の点滅速度を維持します。
注意: 最大パルス長を3に設定して、上昇モードで2 kW/ cm 10,000の放射照度でUVレーザーを使用します。 - SMLMイメージの再構成と後処理を実行します。
注: 生の SMLM データからイメージを再構築するには、公開されているメソッドを参照してください。ここに示すデータは、SMAP48,49ソフトウェアを使用して処理されました。超解像画像再構成、チャネル割り当て、ドリフト補正、および局在化精度の低い局在化のフィルタリングと最尤フィルタをSMAP48ソフトウェアで実行しました。
- 3Dビーズキャリブレーションの取得
- 誘導放出枯渇顕微鏡
注:画像は、白色光レーザー、775 nmパルスSTEDレーザー、およびEMBLイメージングセンター(https://www.embl.org/about/info/imaging-centre)のFALCON FルオレセンスLifetime IMエージングモジュール(材料表)を備えた統合STED顕微鏡システムで取得されました。- 20 μL滴の封入剤(材料表)を顕微鏡スライドに置きます。手順4.2.2のカバーガラスを1枚取り出し、サンプルを封入剤に面したスライドにそっと置きます(図2B)。
メモ: 取り付け媒体内にエアポケットを入れないでください。 - 封入剤を一晩硬化させます。
注:サンプルは翌日に画像化するか、画像化されるまで4°Cに保ちます。 - サンプルを取り付けるには、ステップ5.2.2のサンプルのカバーガラスに液浸オイルを1滴加えます。100倍/1.40のオイル対物レンズを使用して、サンプルを顕微鏡ステージにそっと置きます。
- サンプルに焦点を合わせ、明視野照明を使用して生殖細胞組織を見つけます。
- 顕微鏡ソフトウェアを使用して、TauSTED画像を取得する関心領域を指定します。
- 励起レーザーと、サンプルに使用する蛍光色素の励起に使用する適切なパワーを選択します。
注:ここでは、AlexaFluor 594結合F(ab')2二次抗体フラグメントのイメージングには4%パワーの580 nmレーザーを使用し、STAR 635P結合F(ab')2フラグメントのイメージングには3%パワーの635 nmレーザーを使用しました。 - 顕微鏡ソフトウェアを使用して、適切なSTED空乏レーザー出力を選択し、画像検出を設定します。
注:ここでは、775 nm STED空乏レーザー出力を40%に設定しました。検出器は、光子検出用のゲイン値10、スキャンレート100Hz、ピクセルサイズ17nmの計数モードで使用されました。TauSTEDの取得には4系統の蓄積が使用されました。
- 20 μL滴の封入剤(材料表)を顕微鏡スライドに置きます。手順4.2.2のカバーガラスを1枚取り出し、サンプルを封入剤に面したスライドにそっと置きます(図2B)。
結果
SMLMによるC.エレガンス生殖系列組織内のSCを画像化するために、染色体軸の構成要素であるHTP-3と、赤血球凝集素(HA)タグで内因的にタグ付けされた横フィラメントSYP-5のC末端を局在化するために、2色レシオメトリック3D-SMLMを採用しています。C.エレガンスのSC内の両方のタンパク質の位置は、他の研究によって以前に決定されました16,30。
厚い生体試料に固有の光散乱と光学収差を最小限に抑えるために、SCを含む減数分裂核の最下部の zセクションを画像化しました(図3、黄色の線)。取得した各画像について、対物レンズがカバーガラスに焦点を合わせたときのピエゾステージ位置に対して、撮像面のピエゾステージ位置がマークされた。これにより、カバーガラスからのピエゾ距離を計算することができました。正常に取り付けられたサンプルは、カバーガラスの近くに安定して取り付けられ、生殖腺の形状を保持します(つまり、固定後ステップ中に組織が2つのカバーガラスの間で押しつぶされることはありません)。サンプルマウントの品質は、よく付着した生殖腺が溶液中で動きを示さないため、実体顕微鏡で容易に評価できます(ステップ4.2.6)。それにもかかわらず、取り付けプロセスの確率性のために、生殖腺組織は必ずしもカバーガラス上に完全に平らに配置されるとは限りません。したがって、SCを含む核の底面は、同じ生殖腺内のカバーガラスに対してさまざまな距離で見つけることができます。
カバーガラスへの組織の付着によって解像度がどのように変化するかを説明するために、カバーガラスまでの異なるピエゾ距離で画像を取得しました。個々の画像の品質を評価するために、フーリエリング相関(FRC)曲線50,51を計算し、解像度をSMAPソフトウェア48内のFRCResolutionプラグインを使用して決定した。カバーガラスまでの距離が異なる2つの別々の3D-SMLM画像から抽出された2つの代表的な核を図4に示します。カバーガラスの近くに位置するSCでは、染色体軸とSYP-5::HAのC末端は3次元すべてでよく分解されています(図4A、カバーガラスから0.8 μm)。所定の距離だけ離れた2つの構造を解像するには、達成されるFRC分解能は、通常、軸方向分解能でこの距離の半分未満である必要があります。
同じ構造を横方向に分離するには、さらに小さいFRC分解能値を達成する必要があります。実際、カバーガラスに近接したサンプルでは、FRC分解能はAlexaFluor 647チャンネルで38nm、CF680チャンネルで34nmであり、したがって、SYP-516のC末端間の予想される距離84nmをはるかに下回っています。したがって、この決議は、正面図だけでなく側面図でもSCの組織を容易に解決します(図4B i、ii)。対照的に、カバーガラスから5μmの距離にあるSCでは、光散乱や球面収差により分解能が低下します(図4B)。この距離でのFRC分解能は47 nm(AlexaFluor 647)および41 nm(CF680)に低下し、SYP-5のC末端を完全に分解することはできません。光学収差は軸方向分解能よりも横方向の分解能を著しく損なうため、HTP-3およびSYP-5バンドは、カバーガラスから5μmの距離にあるサンプルの側面図の断面で明確に分解されなくなりました(図4B ii)。カバーガラスから異なるピエゾ距離で取得した画像のFRC解像度を比較すると、画像化された組織はカバーガラスから2μm以内にある必要があることが明らかになりました(図5)。この結果は、組織がカバーガラスのポリ-L-リジンコーティングに正常に架橋されなければならない後固定ステップの正しい実行の重要性を強調しています。
別の超解像技術で達成可能な分解能を実証するために、TauSTED顕微鏡で固定された無傷の生殖細胞系列組織中のSCも画像化しました。図6Aは、正面図のSCのラインプロファイルから推定された、この研究で達成された最高解像度と最低解像度のTauSTED画像を示しています(図6B)。両方の核で、染色体軸のHTP-3と中央領域のSYP-5のC末端の2つの局在バンドを分解することができ、この最適化されたプロトコルを使用してTauSTEDで達成可能な分解能が84nm未満であることを示しています。最適な条件下では(図6A、上)、わずか50 nmしか離れていないSCのわずかに傾いたビューでC末端を解像することができました(図6A、黄色の長方形と6C)。

図1:カエノラブディティスエレガンスにおけるシナプトン複合体の構成の概略図。漫画は、2つの相同染色体(灰色)を橋渡しするC.エレガンスのSCの単純化された構造を示しています。構造は、正面図、側面図、および断面図で示されています。染色体軸は赤いバーで表示され、横フィラメントはシアンで表示されます。横フィラメントタンパク質(C.エレガンスのSYP-1、5、6)は、2つの軸間の距離を埋めるために、中央領域に直接対向(シアンのボールスティックグラフィックス)で配向されています。軸と横フィラメントのC末端との間の予想される距離が示されます。略語:SC =シナプトン複合体。この図の拡大版を表示するには、ここをクリックしてください。
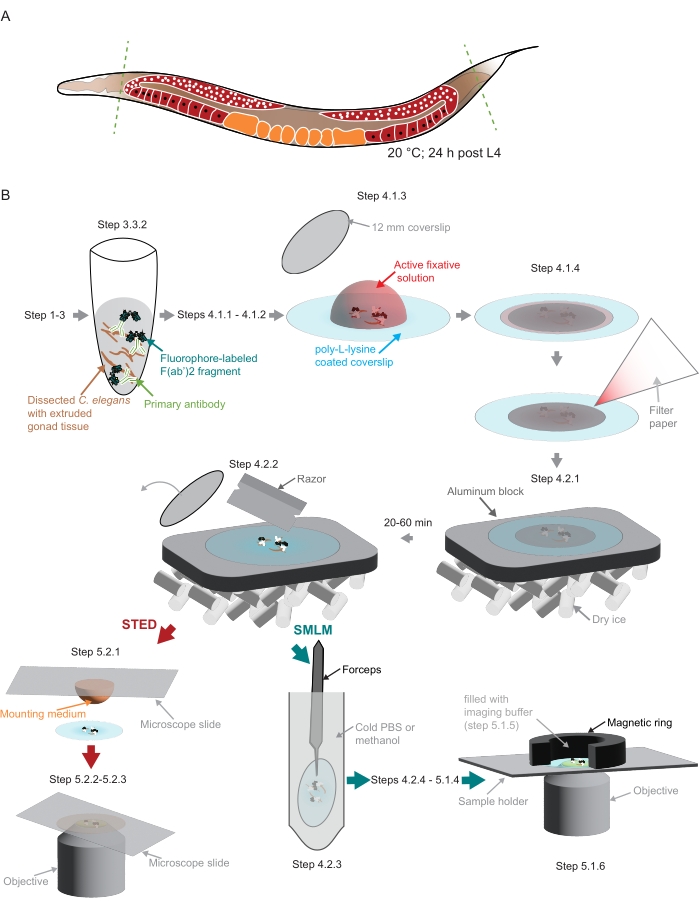
図2:研究で使用されたサンプル調製の図。 (A)若いC.エレガンスの成虫は、頭または尾(緑色の破線)で解剖され、プロトコルに記載されているように処理されます。(B)方法の個々のステップは、灰色の矢印で接続されたグラフィックで示されます。略語:STED =誘導放出枯渇;SMLM = 単一分子局在顕微鏡;PBS =リン酸緩衝生理食塩水。この図の拡大版を表示するには、ここをクリックしてください。
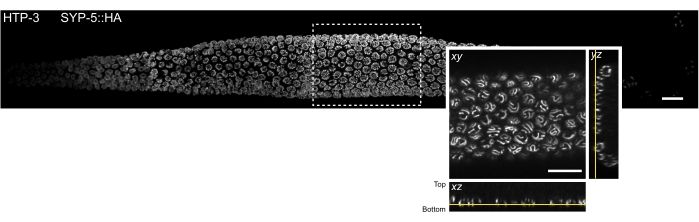
図3:単一分子局在顕微鏡で観察できる組織切片の位置。C.エレガンス生殖腺全体の回転円盤共焦点画像のMIP。組織はHTP-3およびSYP-5のC末端(SYP-5::HA)について染色され、結合されたシグナルは灰色で示されている。個々の共焦点画像は、Grid/Collectionステッチフィジープラグイン52を使用してステッチされ、生殖腺全体の画像を作成しました。挿入図には、SC を含む最下端の Z 平面の XY ビューが表示されます。この平面の局在化は、生殖腺のMIP画像の長方形(黄色の線)によって示される組織断面の直交図に示されている。スケールバー= 10 μm。略語:MIP =最大強度投影。SCs=シナプトン複合体。この図の拡大版を表示するには、ここをクリックしてください。
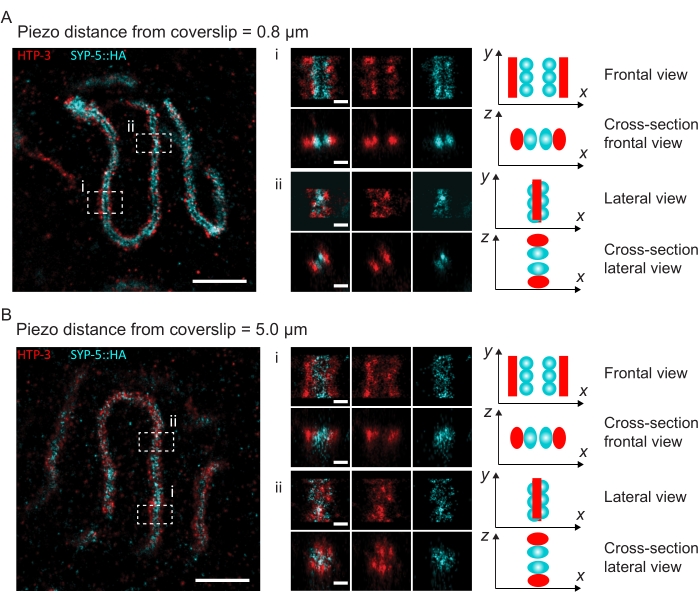
図4:HTP-3とSYP-5のC末端の単一分子局在顕微鏡。 (A,B) 左:HTP-3(赤色)およびSYP-5のC末端(SYP-5::HA、シアン)について染色されたパキテン核を示すSMLM画像(スケールバー= 1μm)。センター:A および B に示されている関心領域のズームイン画像と、各画像の下に表示される対応する断面図(i、ii、スケールバー= 100 nm)。ズームイン画像内のSCのストレッチは、染色体軸がy軸に平行になるように回転されます。右:図の中央に表示されるズームイン領域におけるSCの向きを描写するSC内の目的のタンパク質の局在のグラフィック表現。略語:SMLM =単一分子局在顕微鏡;SC =シナプトン複合体。SMLM画像を再構成するための生データは、バイオスタディデータベース60(アクセッションID:S-BIAD504)を通じて入手可能である。この図の拡大版を表示するには、ここをクリックしてください。
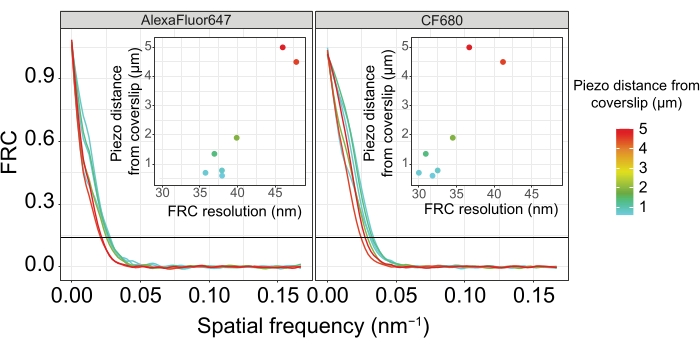
図5:単一分子局在顕微鏡画像のフーリエリング相関分解能は、カバーガラスの平面から画像化された z面の距離に依存します。 色付きの線は、カバーガラスからさまざまな距離(カラーバーで示されているように)で取得された画像のFRC曲線を示しています。FRC解像度の決定に使用される1/7しきい値は、黒い水平線で示されます。挿入図は、カバーガラスからのピエゾ距離に対するFRC分解能の依存性を示します。プロットは、カスタム記述されたRスクリプト(バージョン4.1.2、 補足ファイル1)によって実行され、元の曲線は「ggplot2」パッケージの関数で平滑化されました。略語: FRC = フーリエ環相関;SMLM = 単一分子局在顕微鏡;SC =シナプトン複合体。FRC曲線およびSMLMデータのデータは、バイオスタディデータベース60 (アクセッションID:S−BIAD504)を通じて入手可能である。この図の拡大版を表示するには、ここをクリックしてください。

図6:蛍光寿命ベースの情報(TauSTED)によって強化された誘導放出枯渇顕微鏡は、HTP-3とSYP-5のC末端の両方について2つの局在バンドを分解します。 (A)2つの代表的なTauSTED画像は、HTP-3(赤)とSYP-5のC末端(SYP-5::HA、シアン)について染色されたパキテン核を、より高い(上)およびより低い(下)構造定義(スケールバー= 1μm)で示しています。長方形は、SYP-5の解像されたC末端が正面(白)で、SCのわずかに傾いたビュー(黄色)の領域をマークします。 (B,C)TauSTEDによって解決されたHTP-3(赤)およびSYP-5(シアン)信号のC末端の分布。正面(B)またはわずかに傾いた(C)ビューでSCを含む関心領域のラインプロファイルは、強度が最大値に正規化されたフルラインとして表示されます。ラインプロファイルは、フィジーImageJを使用して生成されました。 B の一点鎖線は、各タンパク質の平均データを示す。 C の太いシアンの線は、SYP-5のC末端間の解像距離が最も短い線プロファイルに対応します。特定のタンパク質を標的とする抗体間の距離を決定するために、ラインプロファイル(n = 9(B)、n = 7(C))に、カスタム記述のRスクリプト(バージョン4.1.2、 補足ファイル1)を使用してダブルガウスをフィッティングしました。平均距離±標準偏差(B)と最小値を太字で強調表示した範囲(C)をそれぞれ各グラフの上部に示します。略語:STED =誘導放出枯渇顕微鏡;SC =シナプトン複合体。プロットされたラインプロファイルの表示画像およびデータポイントは、バイオスタディデータベース60 (アクセッションID:S−BIAD504)を通じて入手可能である。この図の拡大版を表示するには、ここをクリックしてください。
表1:このプロトコルで使用されるバッファーと溶液の組成。この表をダウンロードするには、ここをクリックしてください。
補足ビデオ1:単一分子局在顕微鏡法の取得。 蛍光色素が適切な速度で点滅している様子を示すビデオ(50フレーム表示、スケールバー= 5 μm、20 ms/フレーム)。 このビデオをダウンロードするには、ここをクリックしてください。
補足ファイル1:データ分析スクリプト。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
相同染色体の正しい組換えと分離に不可欠なSCのはしごのような組織は、ほぼ70年前に電子顕微鏡で最初に観察されました3,4。SCの全体的な構成は電子顕微鏡で容易に解決されますが、この複合体内の個々のコンポーネントの局在化には、より的を絞ったアプローチが必要です。幅が~100 nmしかないSCの下部構造は、従来の蛍光顕微鏡では解決できません。しかし、超解像顕微鏡は、シナプトン複合体の構造と機能に関する新しい発見の主要な推進力となっています16、19、24、25、26、27、28、29、30。この研究を容易にするために、SMLMおよびSTED顕微鏡を使用してC.エレガンス生殖腺組織内のSCの構造を研究できる取り付け手順を示しました。
SMLMイメージングの解像度を最適化するための重要なステップは、生殖細胞系列組織をポリ-L-リジンコーティングカバーガラスに直接架橋することです(ステップ4)。カバーガラスへの組織の共有結合は、大きなドリフトをもたらし、SMLMの長期間にわたるイメージングを不可能にするサンプル内の動きを減らすために不可欠です。さらに、カバーガラスから離れたSCを含む核を残す次善のアタッチメントでさえ、球面収差に起因する達成可能な分解能の大幅な低下につながります(図4)。ここで使用される共有結合付着物に代えて、染色された生殖細胞系列組織は、画像化緩衝液19、30の小滴中の2つの密封カバーガラスの間に固定化することもできる。しかしながら、この固定化法は、サンプル中のイメージングバッファーの体積を、ここで最適化されたプロトコルで使用される1mLからわずか数μLに大幅に減少させ、イメージングバッファーの酸性化をもたらし、サンプルをイメージングできる時間を大幅に短縮します38,53,54。
SMLM顕微鏡とSTED顕微鏡の両方で取得時間が長いため、これらの方法の使用は化学的に固定されたサンプルのイメージングに制限されます。ここで、パラホルムアルデヒド固定により、サンプル調製およびイメージング中にSCの構造が確実に保存されます。しかしながら、無傷の組織内のSCを画像化するためにここで取られた予防措置にもかかわらず、固定後に生じるSCの構造は、生体内のその天然状態の構造と必ずしも同一ではない。さらに、固定SCの単一の画像は生物学的構造の単一の「スナップショット」を表すので、このアプローチはin vivoのネイティブ構造のダイナミクスに盲目のままです。
しかし、高分子構造のダイナミクスや変動性に関する情報は、1枚だけでなく多くの「スナップショット」を取得することでも得られます。このアプローチは、pachytene19中のSCの構造の変化を解決することができるが、このプロトコルを使用して調製された単一のサンプルから取得できる画像の数を制限するいくつかの要因がある。まず、画像取得時に使用される高いレーザー出力は、蛍光色素の永久的な漂白をもたらし、隣接する関心領域または複数のz平面のイメージングを妨げるため、単一のサンプルから取得できる画像の数が大幅に減少します。第2に、この方法で調製されたカバーガラス上のサンプル/組織密度が低く、単一のカバーガラスから取得できる画像の数が大幅に制限されます。サンプル密度が低いため、他の生物学的問題に光を当てるのに役立つ自動画像取得パイプラインの使用も禁止されています34,55,56,57,58,59。ただし、経験豊富なユーザーはサンプル密度をわずかに増やすことができます。
ここで紹介するプロトコルは、SMLM35で最適な分解能を達成するために必要な高い標識密度を得るために最適化されています。以前のプロトコルは、免疫染色の前に組織をカバーガラスに共有結合していましたが16、この新しいプロトコルは、サンプルが溶液で染色された後にのみ、組織をカバーガラスに架橋します。この修飾により、免疫標識に使用される抗体は、あらゆる側面から組織に自由にアクセスすることができるが、カバーガラスへの組織の共有結合は、抗体がカバーガラスに最も近い核に到達するのを制限し、それによって標識の程度を低下させる可能性がある。ここで説明する変更により、分解能が40-50 nm(FRC分解能)16 から30-40 nm(このプロトコル)に向上します。
重要なことに、SMLMには高い標識密度と高濃度の抗体が不可欠ですが、より低い抗体濃度を使用すると、より良いSTED顕微鏡画像が得られることがわかりました(ステップ3)。数十ナノメートルの分解能では、目的のタンパク質を標識するために使用される分子のサイズがますます重要になります。そこで、完全長抗体の半分の大きさのF(ab')2フラグメントを採用しました。より小さなシグナル源による局所コントラストの改善、したがって完全長二次抗体を使用した場合と比較してこの修飾によって得られた分解能により、TauSTEDによる中央領域内のSYP-5の2つのC末端の分解能が可能になりましたが、これは完全長抗体を使用した従来のSTEDでは解決されません(16 およびデータは示されていません)。我々は、無傷の C.エレガンの生殖細胞系列におけるSCをイメージングするためのこの最適化されたプロトコルが、減数分裂中のSCの構造機能関係の調査を容易にすることを期待しています。
開示事項
著者は利益相反を宣言しません。
謝辞
SMLMイメージング用のイメージングバッファーを共有してくれたJonas RiesとRiesラボに感謝します。また、このプロトコルで使用されている C.エレガンス 株のキムユミとニワトリ抗HTP-3抗体のアビーF.ダーンバーグにも感謝します。EMBLハイデルベルクの先端光学顕微鏡施設のマルコ・ランペ氏とステファン・テルユング氏が、オリンパスiXplore SPIN共焦点顕微鏡の使用をサポートしてくれたことに感謝します。この研究は、欧州分子生物学研究所とドイツ研究財団(DFG、ドイツ研究財団-452616889、SK)の支援を受けました。私たちは、ベーリンガーインゲルハイム財団によって寛大に支援された、欧州分子生物学研究所(EMBL IC)のイメージングセンターによって提供されるアクセスとサービスを認めます。
資料
| Name | Company | Catalog Number | Comments |
| 100x/1.5 oil objective | Olympus | UPLAPO100XOHR | UPLAPO100XOHR |
| 2-mercaptoethylamine (MEA) | Sigma-Aldrich | 30070-10G | Dissolved in MilliQ water to 5 M solution, pH 8.7 adjusted with HCl. Aliquoted to a single-use volume, frozen, and kept at -80 °C. |
| Additional 640 nm booster laser | Toptica | IBEAM-SMART-640-S-HP | |
| AlexaFluor 594, NHS ester | ThermoFischer Scientific | A37572 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| AlexaFluor 647, NHS ester | ThermoFischer Scientific | A37573 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| anti-HA | Thermo Fisher Scientific | 2-2.2.14 | Mouse monoclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| anti-HTP-3 | a gift from Abby F. Dernburg | MacQueen et al., 2005 | Chicken polyclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| Caenorhabditis elegans strain YKM349 | a gift from Yumi Kim | Hurlock et al., 2020 | syp-5(kim9[syp-5::HA]) I; meIs8[pie-1p::GFP::cosa-1, unc-119(+)] II |
| CF6680, NHS ester | Biotium | 92139 | Dissolved in DMSO to 1mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Circular cover glass 12 mm No. 1 | Menzel-Gläser; VWR | 631-0713 | |
| Circular cover glass 24 mm No. 1.5 | Carl Roth | PK26.1 | |
| Cylindrical lenses | Thorlabs | LJ1516RM-A, LK1002RM-A | |
| Egg Buffer (10x) | Edgar 1995 | 250 mM HEPES, 1.18 M NaCl, 480 mM KCl, 20 mM EDTA, 5 mM EGTA, pH 7.4 | |
| Ethanol (absolute for analysis) | Merck | 64-17-5 | |
| F(ab’)2 fragment anti-chicken IgY | Jackson Immunoresearch | AB_2340347 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| F(ab’)2 fragment anti-mouse IgG | Jackson Immunoresearch | AB_2340761 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| Fisherbrand Microscope slides T/F Ground 0.8-1.0 mm thick | Fisher scientific | 7107 | |
| Gauge Worm Pick 30 diameter 0.254 mm - Iridium 10% | Kisker | 789265 | |
| Glucose oxidase/Catalase enzyme mix (GlOX/Cat ) | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 20x, 1916 U/mL glucose oxidase (Sigma G7141), 42350 U/mL catalase (Sigma C3155), 50 mM Tris-HCl pH 8.0, 51% glycerol, MilliQ water. Stored at -20 °C. |
| Imaging buffer base | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 50 mM Tris-HCl, pH 8.0, 10 mM NaCl, 10% D-Glucose. Aliquoted to a single-use volume (950 μL), frozen, and kept at -80 °C. |
| Invitrogen ProLong Glass Antifade Mountant | ThermoFischer Scientific | P36982 | |
| Leica Stellaris 8 STED FALCON | Leica | N/A | The microscope is equiped with the latest generation white light laser, a 775nm pulsed STED laser, the FALCON Fluorescence Lifetime IMaging module, HC PL APO CS2 100x/1.40 oil objective, and Leica HyD X detector. The system is capable of FLIM module enhanced Tau-STED which measures the specific fluorescence lifetime of a dye and is therefore capable of removing background signal based on differences in fluorescence lifetimes of the dyes, and dye conditions in the sample. Additionally, the resolution is increased by accounting for the variation of fluorescence lifetimes in different areas of the depletion donut. |
| Longwave channel emission filter | AHF Analysentechnik | F47-702 | 700/100 nm bandpass |
| Methanol (absolute for analysis) | Merck | 67-56-1 | |
| NaHCO3 | Sigma-Aldrich/Merck | S5761-500G | 100 mM NaHCO3, pH 8.3 |
| Near-infrared fiber-coupled laser | Toptica | IBEAM-SMART-PT-CD | Custom Design, 808 nm - 75mW |
| Objective lens piezo mount (PIFOC ) | Physik Instrumente | P-726.1.CD | 100 µm travel range |
| Orca Fusion BT sCMOS camera | Hamamatsu | C15440-20UP | |
| PCR tubes | Greiner Bio-One | 673283 | 0.2 mL |
| Phosphate Saline Buffer (PBS 10x) | N/A | 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4 | |
| Pierce 16% formaldehyde (w/v), methanol free | ThermoFischer Scientific | 28906 | 16% formaldehyde is transferred from the original glass ampule into 1.5 mL tube and kept at room temperature. |
| PlasmaPrep2 plasma cleaner | GaLa Instrumente GmbH | N/A | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich/Merck | P2636-25MG | 0.1% w/v solution was prepared in Milli-Q water, and stored in aliquots at -20 °C. |
| Primary dichroic (illumination reflecting) | AHF Analysentechnik | F73-866S | quad bandpass @ 405, 488, 561, 640 |
| Quadnotch filter | AHF Analysentechnik | F40-072 | 405/488/561/640 nm |
| Quadrant photodiode (QPD) | Laser Components | SD197-23-21-041, LC301DQD-PV | |
| Razor blades | Apollo Herkenrath Solinger | N/A | |
| Refractive beam shaper | AdlOptica | PiShaper 6_6_VIS | |
| Roche Blocking Reagent | Roche | 11096176001 | 10x solution was prepared according to recommendation. Frozen aliquots were stored at -20 °C. |
| Scalpel blade (Feather brand #11, No. 3) | Heinz Herenz Medizinalbedarf GmbH | 1110911 | |
| Scalpel removal box | Fisher scientific | 10002-50 | |
| Secondary dichroic (emission reflecting) | AHF Analysentechnik | F38-785S | 750 nm longpass |
| Shortpass filter | Semrock | BSP01-785R-25 | 750 nm |
| Shortwave channel emission filter | AHF Analysentechnik | F37-677 | 676/37 nm bandpass |
| Single molecule localization microscope | EMBL Imaging Centre | Diekmann et al., 2020 with modifications | The microscope provides widefield epi-illumination via a single-mode fiber-coupled laser engine, additional booster laser, and refractive beam shaper to provide a uniform illumination field (Stehr et al, 2019). Widefield images are captured on a sCMOS camera and appropriate relay optics for a system magnification of 61x and a pixel size of 106 nm. For ratiometric imaging of spectrally overlapping far-red dyes, an image splitter produces two spectrally distinct images on the camera (splitting dichroic: 665 nm long pass, shortwave channel emission filter: 676/37 nm bandpass, longwave emission filter: 700/100 nm bandpass. An additional 405/488/561/640 nm quadnotch filter and 750 nm shortpass filter are common to the two paths and provide additional laser blocking). A compound cylindrical lens provides the astigmatism required for 3D imaging. To maintain a fixed focus across acquisitions exceeding 2 hours in time (comprising 200 000 - 250 000 images), focus locking is achieved by total internal reflection of a near-infrared fiber-coupled laser from the coverslip and subsequent height sensitive detection on a quadrant photodiode (QPD). The QPD signal provided closed-loop control of the objective lens piezo mount. For access to this microscope, refer to https://www.embl.org/about/info/imaging-centre or contact ic-contact@embl.de |
| Single-mode fiber-coupled multi-laser engine | Toptica | iCHROME MLE-LFA-HP | Provides widefield epi-illumination of 100 mW at 405, 488, 561, 640 nm |
| Splitting dichroic | AHF Analysentechnik | F48-665SG | 665 nm long pass |
| Square cover glass 22 x 22 mm No.1 | Menzel-Gläser; VWR | 630-2882 | |
| STAR 635P, NHS ester | Abberior | ST635P-0002-1MG | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Stereo microscope Stemi 305 Stand K LAB | Zeiss | N/A | |
| Tetramisole hydrochloride | Sigma-Aldrich/Merck | T1512-2G | 1% (w/v) solution was prepared in Milli-Q water. Frozen aliquots were stored at -20 °C. Thawed aliquot was kept at 4 °C and used for several months. |
| TetraSpeck Microspheres | ThermoFischer Scientific | T7279 | 0.1 µm, fluorescent blue/green/orange/dark red |
| Tris Saline Buffer (TBS 10x) | N/A | 200 mM Tris-HCl, 1.5 M NaCl, pH 7.5 | |
| TWEEN 20 | Sigma-Aldrich/Merck | P9416-50ML | Kept at room temperature in original packaging. |
| WormStuff worm pick | Kisker | 789277 | |
| XY microscope stage | Smaract | N/A | Custom Design |
| Zeba Micro Spin Desalting Column | ThermoFischer Scientific | 89877 | 7K MWCO, 75 µL |
参考文献
- Zickler, D., Kleckner, N. Meiotic chromosomes: integrating structure and function. Annual Review of Genetics. 33, 603(1999).
- Ur, S. N., Corbett, K. D. Architecture and dynamics of meiotic chromosomes. Annual Review of Genetics. 55, 497-526 (2021).
- Fawcett, D. W. The fine structure ot chromosomes in the meiotic prophase of vertebrate spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (4), 403-406 (1956).
- Moses, M. J. Chromosomal structures in crayfish spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (2), 215-218 (1956).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. WormBook. , 433-434 (2017).
- Pasierbek, P., et al. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes & Development. 15 (11), 1349-1360 (2001).
- Severson, A. F., Ling, L., Van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes & Development. 23 (15), 1763-1778 (2009).
- Zetka, M. C., Kawasaki, I., Strome, S., Müller, F. Synapsis and chiasma formation in Caenorhabditis elegans require HIM-3, a meiotic chromosome core component that functions in chromosome segregation. Genes & Development. 13 (17), 2258-2270 (1999).
- Martinez-Perez, E. HTP-1-dependent constraints coordinate homolog pairing and synapsis and promote chiasma formation during C. elegans meiosis. Genes & Development. 19 (22), 2727-2743 (2005).
- Couteau, F., Zetka, M. HTP-1 coordinates synaptonemal complex assembly with homolog alignment during meiosis in C. elegans. Genes & Development. 19 (22), 2744-2756 (2005).
- Goodyer, W., et al. HTP-3 Links DSB Formation with Homolog Pairing and Crossing Over during C. elegans Meiosis. Developmental Cell. 14 (2), 263-274 (2008).
- Colaiácovo, M. P., et al. Synaptonemal complex assembly in C. elegans is dispensable for loading strand-exchange proteins but critical for proper completion of recombination. Developmental Cell. 5 (3), 463-474 (2003).
- MacQueen, A. J., Colaiácovo, M. P., McDonald, K., Villeneuve, A. M. Synapsis-dependent and -independent mechanisms stabilize homolog pairing during meiotic prophase in C. elegans. Genes & Development. 16 (18), 2428-2442 (2002).
- Smolikov, S., et al. Synapsis-defective mutants reveal a correlation between chromosome conformation and the mode of double-strand break repair during Caenorhabditis elegans meiosis. Genetics. 176 (4), 2027-2033 (2007).
- Smolikov, S., Schild-Prüfert, K., Colaiácovo, M. P. A yeast two-hybrid screen for SYP-3 interactors identifies SYP-4, a component required for synaptonemal complex assembly and chiasma formation in Caenorhabditis elegans meiosis. PLoS Genetics. 5 (10), 1000669(2009).
- Hurlock, M. E., et al. Identification of novel synaptonemal complex components in C. Elegants. The Journal of Cell Biology. 219 (5), (2020).
- Zhang, Z., et al. Multivalent weak interactions between assembly units drive synaptonemal complex formation. The Journal of Cell Biology. 219 (5), (2020).
- Schild-Prüfert, K., et al. Organization of the synaptonemal complex during meiosis in Caenorhabditis elegans. Genetics. 189 (2), 411-421 (2011).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. The interaction of crossover formation and the dynamic architecture of the synaptonemal complex during meiosis. bioRxiv. , (2020).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6621), 543-548 (2015).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Schücker, K., Holm, T., Franke, C., Sauer, M., Benavente, R. Elucidation of synaptonemal complex organization by super-resolution imaging with isotropic resolution. Proceedings of the National Academy of Sciences. 112 (7), 2029-2033 (2015).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences. 114 (33), 6857-6866 (2017).
- Zwettler, F. U., et al. Tracking down the molecular architecture of the synaptonemal complex by expansion microscopy. Nature Communications. 11 (1), 1-11 (2020).
- Yoon, S., Choi, E. H., Kim, J. W., Kim, K. P. Structured illumination microscopy imaging reveals localization of replication protein A between chromosome lateral elements during mammalian meiosis. Experimental & Molecular Medicine. 50 (8), 1-12 (2018).
- Prakash, K., et al. Superresolution imaging reveals structurally distinct periodic patterns of chromatin along pachytene chromosomes. Proceedings of the National Academy of Sciences. 112 (47), 14635-14640 (2015).
- Xu, H., et al. Molecular organization of mammalian meiotic chromosome axis revealed by expansion STORM microscopy. Proceedings of the National Academy of Sciences. 116 (37), 18423-18428 (2019).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. Superresolution microscopy reveals the three-dimensional organization of meiotic chromosome axes in intact Caenorhabditis elegans tissue. Proceedings of the National Academy of Sciences. 114 (24), 4734-4743 (2017).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Hein, B., Willig, K. I., Hell, S. W. Stimulated emission depletion (STED) nanoscopy of a fluorescent protein-labeled organelle inside a living cell. Proceedings of the National Academy of Sciences. 105 (38), 14271-14276 (2008).
- Jahr, W., Velicky, P., Danzl, J. G. Strategies to maximize performance in STimulated Emission Depletion (STED) nanoscopy of biological specimens. Methods. 174, 27-41 (2019).
- Thevathasan, J. V., et al. Nuclear pores as versatile reference standards for quantitative superresolution microscopy. Nature Methods. 16 (10), 1045-1053 (2019).
- Xu, K., Shim, S. -H., Zhuang, X. Super-resolution imaging through stochastic switching and localization of single molecules: an overview. Far-Field Optical Nanoscopy. , 27-64 (2013).
- Wang, Y., et al. Localization events-based sample drift correction for localization microscopy with redundant cross-correlation algorithm. Optics Express. 22 (13), 15982(2014).
- Winterflood, C. M., Platonova, E., Albrecht, D., Ewers, H. Dual-color 3D superresolution microscopy by combined spectral-demixing and biplane imaging. Biophysical Journal. 109 (1), 3-6 (2015).
- Diekmann, R., et al. Optimizing imaging speed and excitation intensity for single molecule localization microscopy. Nature Methods. 17 (9), 909(2020).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319 (5864), 810-813 (2008).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Methods in Molecular Biology. 558, 171-195 (2009).
- Edgar, L. G. Blastomere culture and analysis. Methods in Cell Biology. 48, 303-321 (1995).
- MacQueen, A. J., et al. Chromosome sites play dual roles to establish homologous synapsis during meiosis in C. elegans. Cell. 123 (6), 1037-1050 (2005).
- Stehr, F., Stein, J., Schueder, F., Schwille, P., Jungmann, R. Flat-top TIRF illumination boosts DNA-PAINT imaging and quantification. Nature Communications. 10 (1), 1-8 (2019).
- Hoess, P., Mund, M., Reitberger, M., Ries, J. Dual-color and 3D super-resolution microscopy of multi-protein assemblies. Methods in Molecular Biology. 1764, 237-251 (2018).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer Control of microscopes using µManager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. Journal of Biological Methods. 1 (2), 10(2014).
- Deschamps, J., Ries, J. EMU: reconfigurable graphical user interfaces for Micro-Manager. BMC Bioinformatics. 21 (1), 1-13 (2020).
- Ries, J. SMAP: a modular super-resolution microscopy analysis platform for SMLM data. Nature Methods. 17 (9), 870-872 (2020).
- Li, Y., et al. Global fitting for high-accuracy multi-channel single-molecule localization. Nature Communications. 13 (1), 1-11 (2022).
- Nieuwenhuizen, R. P. J., et al. Measuring image resolution in optical nanoscopy. Nature Methods. 10 (6), 557-562 (2013).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. Journal of Structural Biology. 183 (3), 363-367 (2013).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Shi, X., Lim, J., Ha, T. Acidification of the oxygen scavenging system in single-molecule fluorescence studies: in situ sensing with a ratiometric dual-emission probe. Analytical Chemistry. 82 (14), 6132-6138 (2010).
- Olivier, N., Keller, D., Rajan, V. S., Gönczy, P., Manley, S. Simple buffers for 3D STORM microscopy. Biomedical Optics Express. 4 (6), 885-899 (2013).
- Mund, M., et al. Superresolution microscopy reveals partial preassembly and subsequent bending of the clathrin coat during endocytosis. bioRxiv. , (2022).
- Mund, M., et al. Systematic nanoscale analysis of endocytosis links efficient vesicle formation to patterned actin nucleation. Cell. 174 (4), 884-896 (2018).
- Sabinina, V. J., et al. Three-dimensional superresolution fluorescence microscopy maps the variable molecular architecture of the nuclear pore complex. Molecular Biology of the Cell. 32 (17), 1523-1533 (2021).
- Cieslinski, K., et al. Nanoscale structural organization and stoichiometry of the budding yeast kinetochore. bioRxiv. , (2021).
- Sieben, C., Banterle, N., Douglass, K. M., Gönczy, P., Manley, S. Multicolor single-particle reconstruction of protein complexes. Nature Methods. 15 (10), 777-780 (2018).
- Sarkans, U., et al. The BioStudies database—one stop shop for all data supporting a life sciences study. Nucleic Acids Research. 46, (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved