Method Article
Микроскопия со сверхвысоким разрешением синаптонемального комплекса в зародышевой линии Caenorhabditis elegans
В этой статье
Резюме
Микроскопия сверхвысокого разрешения может дать подробное представление об организации компонентов в синаптонемальном комплексе при мейозе. Здесь мы демонстрируем протокол для разрешения отдельных белков синаптонемального комплекса Caenorhabditis elegans .
Аннотация
Во время мейоза гомологичные хромосомы должны распознавать и прилипать друг к другу, чтобы обеспечить их правильную сегрегацию. Одним из ключевых событий, обеспечивающих взаимодействие гомологичных хромосом, является сборка синаптонемного комплекса (СК) в мейотической профазе I. Несмотря на то, что существует небольшая гомология последовательности между белковыми компонентами в пределах SC среди различных видов, общая структура SC была сильно сохранена в ходе эволюции. На электронных микроснимках SC выглядит как трехсторонняя, лестничная структура, состоящая из боковых элементов или осей, поперечных нитей и центрального элемента.
Однако точная идентификация локализации отдельных компонентов в комплексе с помощью электронной микроскопии для определения молекулярной структуры КА остается сложной задачей. Напротив, флуоресцентная микроскопия позволяет идентифицировать отдельные белковые компоненты в комплексе. Однако, поскольку ширина SC составляет всего ~ 100 нм, его подструктура не может быть разрешена с помощью дифракционно-ограниченной обычной флуоресцентной микроскопии. Таким образом, определение молекулярной архитектуры SC требует методов световой микроскопии со сверхвысоким разрешением, таких как структурированная микроскопия освещения (SIM), микроскопия с истощением стимулированного излучения (STED) или одномолекулярная локализационная микроскопия (SMLM).
Для поддержания структуры и взаимодействия отдельных компонентов внутри СК важно наблюдать комплекс в среде, близкой к его родной среде в половых клетках. Таким образом, мы демонстрируем протокол иммуногистохимии и визуализации, который позволяет изучать субструктуру SC в интактной, экструдированной ткани зародышевой линии Caenorhabditis elegans с помощью микроскопии SMLM и STED. Непосредственное закрепление ткани на покровном листе уменьшает движение образцов во время визуализации и сводит к минимуму аберрации в образце для достижения высокого разрешения, необходимого для визуализации подструктуры SC в его биологическом контексте.
Введение
Сокращение числа хромосом вдвое во время мейоза является ключом к созданию здорового потомства у организмов, размножающихся половым путем. Чтобы добиться этого уменьшения числа хромосом, гомологичные хромосомы должны спариваться и разделяться во время мейоза I. Чтобы обеспечить точное разделение гомологичных хромосом, половые клетки подвергаются расширенной профазе I, во время которой гомологичные хромосомы соединяются, синапс и рекомбинируют для создания физических связей между гомологами1. СК стал центральной структурой, которая является ключевой в регулировании правильной прогрессии через мейотическую профазу2.
SC представляет собой комплекс, общая структура которого эволюционно сохранена, хотя между его белковыми компонентами мало гомологии. СК был впервые идентифицирован на электронных микроснимках как трехсторонняя, лестничная структура, состоящая из двух боковых элементов или осей, центральной области, образованной поперечными нитями, и центрального элемента 3,4. Определение организации отдельных компонентов в комплексе является ключом к углублению нашего понимания роли СК во время мейотической профазы.
Модельный организм C. elegans идеально подходит для изучения структуры и функции СК, поскольку его зародышевые линии содержат большое количество мейотических ядер с полностью собранными СК5. Генетические и биохимические исследования показали, что оси хромосом образованы тремя различными когезин-комплексами 6,7 и четырьмя белками домена HORMA, называемыми HTP-1/2/3 и HIM-3 7,8,9,10,11 у C. elegans. В центральной области СК на сегодняшний день идентифицировано шесть белков, содержащих спиральные домены 12,13,14,15,16,17. Чтобы преодолеть расстояние между двумя осями, SYP-1, -5 и -6 димеризируются лицом к лицу (рисунок 1), в то время как три дополнительных белка стабилизируют свое взаимодействие в центральном элементе 16,17,18,19.
Получение подробного представления об организации этих белков имеет важное значение для понимания многих функций SC во время мейоза. Поскольку ширина центральной области КА составляет всего ~100 нм, ее подструктура не может быть разрешена дифракционно-ограниченной флуоресцентной микроскопией. Тем не менее, визуализация компонентов в структуре такого размера легко достижима с помощью микроскопии со сверхвысоким разрешением. Действительно, структурированная микроскопия освещения (SIM), расширительная микроскопия20, микроскопия с инстимулированным истощением (STED)21 и микроскопия локализации одной молекулы (SMLM)22,23 стали важными инструментами для изучения молекулярной архитектуры SC у видов 16,24,25,26,27,28,29, 30 см.
Чтобы преодолеть предел разрешения, микроскопия STED полагается на наложение дифракционного ограниченного пятна излучающего света пучком в форме пончика от лазера STED, который теоретически сужает функцию распространенияточек до молекулярных размеров 31,32. Однако разрешение, которое практически достижимо с помощью STED в биологических образцах, остается в диапазоне нескольких десятков нанометров в xy33.
Еще более высокое разрешение в биологических образцах может быть получено с помощью методов SMLM. SMLM использует мигающие свойства специфических флуорофоров для разрешения объектов на субдифракционном уровне путем разделения пространственно перекрывающихся флуорофоров во времени. Затем образец многократно визуализируется для захвата различных подмножеств флуорофоров. Положение флуорофоров внутри образца затем определяют путем подгонки функции точечного распространения (PSF) к полученным сигналам на всех изображениях, которая может разрешать структуры до 15 нм23,34.
Взятые вместе, локализованные изображения кодируют положения всех флуорофоров. Разрешение SMLM определяется плотностью маркировки и характеристиками моргания флуорофора. Согласно критерию Найквиста-Шеннона, невозможно надежно разрешить объекты, которые менее чем в два раза превышают среднее расстояние от метки до метки. Таким образом, высокая плотность маркировки необходима для визуализации с высоким разрешением. Для SC у C. elegans высокая плотность маркировки может быть достигнута с помощью эпитопных меток, прикрепленных к конкретным участкам эндогенных белков с помощью редактирования генома. Эпитопные метки затем могут быть окрашены с высокой плотностью с использованием специфических моноклональных антител с высоким сродством19,30. В то же время цикл отдельных флуорофоров должен быть достаточно коротким, чтобы гарантировать, что пространственно перекрывающиеся флуорофоры не захватываются одновременно35.
Из-за этих двух требований разрешение структуры больших макромолекулярных комплексов, таких как SC, требует визуализации достаточно большого количества изображений и, таким образом, может занять несколько часов. Подводный камень длительного времени визуализации заключается в том, что образцы имеют тенденцию дрейфовать из-за движения ступени или небольших токов в буфере образца; даже небольшие движения порядка 10 нм вредны при нм разрешении и должны быть исправлены. Однако обычно используемые методы коррекции дрейфа недостаточно надежны, чтобы точно накладывать изображения двух каналов, изображенных последовательно36. Это проблематично, потому что биологические вопросы часто требуют точного обнаружения и локализации нескольких целей в одном образце. Чтобы обойти эти проблемы, были разработаны такие методы, как ратиометрическая визуализация. Ратиометрическая визуализация позволяет одновременно визуализировать несколько флуорофоров с перекрывающимися спектрами возбуждения и излучения с последующим присвоением каждого обнаруженного сигнала соответствующему флуорофору на основе соотношения интенсивностей в спектрально отчетливых каналах37,38.
Кроме того, изучение организации высокомолекулярных комплексов, таких как SC, требует трехмерной (3D) информации. Для достижения сверхразрешения в трех измерениях (3D-SMLM) цилиндрическая линза включена в оптический путь излучаемого света, который искажает форму PSF флуорофора в зависимости от его расстояния от фокальной плоскости. Следовательно, точное положение флуорофора в z-плоскости может быть экстраполировано путем анализа формы его эмиссионного сигнала35,39. Объединение этих достижений в SMLM позволяет получать изображения 3D-организации макромолекулярных комплексов, включая SC.
протокол
1. Приготовление растворов и обтекателей
ПРИМЕЧАНИЕ: См. Таблицу материалов для получения подробной информации , относящейся ко всем материалам и реагентам, и Таблицу 1 для состава растворов, используемых в этом протоколе.
- Крышки с поли-L-лизином
- Готовят 0,01% (мас./об.) поли-L-лизина (см. таблицу 1).
- Промывайте прецизионную крышку (диаметром 24 мм; диаметром 0,17 ± 0,005 мм, No 1,5) в этаноле в течение 10-30 мин. Промойте крышку ddH2O, чтобы удалить этанол, и оставьте крышку сушиться при комнатной температуре.
- Плазменная очистка крышки с помощью плазменного очистителя.
ПРИМЕЧАНИЕ: Плазменная очистка увеличивает гидрофильность покрова и облегчает следующие этапы. Если плазменный очиститель недоступен, этот этап можно пропустить, хотя для этого может потребоваться регулировка объема и/или концентрации раствора поли-L-лизина. Эта модификация не тестировалась. - Поместите одну каплю (120 мкл) 0,01% (мас./об.) поли-L-лизина на крышку. Инкубировать в течение 10 мин при комнатной температуре.
- После инкубации промойте крышку в ddH2Oи высушите при комнатной температуре. Хранить при температуре 4 °C до 1 месяца.
- Фрагменты F(ab')2, сопряженные с флуоресцентными органическими красителями
- Добавьте в ПЦР-трубку в следующем порядке: 10 мкл 0,6-0,7 мг/мл F(ab')2 фрагмента в PBS, 1 мкл 0,1 М NaHCO3 (рН 8,3) и 1 мкл 1 мМ сукцинимидилового (NHS) эфирного реактивного флуорофора в ДМСО (молярное отношение F(ab')2:краситель составляет ~1:17). Хорошо перемешайте, пипеткой вверх и вниз.
- Инкубировать в течение 1 ч при комнатной температуре.
- Отделите фрагмент F(ab')2 от оставшегося свободного реакционноспособного красителя с помощью обессоливающей колонны (7K MWCO) в соответствии со спецификациями завода-изготовителя. Используйте 1x PBS для уравновешивания столбца и элюирования помеченного фрагмента F(ab')2.
- Храните меченый фрагмент F(ab')2 при 4 °C в течение 3 месяцев.
ПРИМЕЧАНИЕ: Сроки хранения более 3 месяцев не тестировались.
2. Рассечение и фиксация
ПРИМЕЧАНИЕ: Процедуры рассечения и фиксации модифицированы по сравнению с ранее рекомендованными процедурами16,40 для получения оптимальных образцов для микроскопии сверхвысокого разрешения.
- Вскрытие
- Соберите соответствующих возрасту червей C. elegans (выращенных при 20 °C для этого исследования) в каплю EBTT объемом 30 мкл (1x Яичный буфер41 с 0,2% неионным моющим средством, таблица 1) на крышке (22 мм x 22 мм, No 1). Поместите крышку на стеклянную горку для облегчения манипуляций. Промывайте 30 мкл EBTT путем пипетки вверх и вниз несколько раз. Удалите 30 мкл раствора, чтобы оставить каплю 30 мкл на крышке.
ПРИМЕЧАНИЕ: Небольшое количество неионного моющего средства должно быть добавлено ко всем растворам, в которых черви пипетируются, чтобы черви не прилипали к пластиковым наконечникам. - Используйте лезвие скальпеля, чтобы отрезать головы и/или хвосты червей для выдавливания гонады (рисунок 2A).
- Соберите соответствующих возрасту червей C. elegans (выращенных при 20 °C для этого исследования) в каплю EBTT объемом 30 мкл (1x Яичный буфер41 с 0,2% неионным моющим средством, таблица 1) на крышке (22 мм x 22 мм, No 1). Поместите крышку на стеклянную горку для облегчения манипуляций. Промывайте 30 мкл EBTT путем пипетки вверх и вниз несколько раз. Удалите 30 мкл раствора, чтобы оставить каплю 30 мкл на крышке.
- Фиксация
- Пипетировать 30 мкл фиксирующего раствора (таблица 1) в каплю рассеченных червей и пипетировать вверх и вниз для смешивания.
ПРИМЕЧАНИЕ: Пипетка вверх и вниз несколько раз может помочь освободить больше гонад. - Фиксировать ровно через 1 мин после добавления фиксирующего раствора.
- Остановите фиксацию путем переноса червей в ПЦР-трубку, заполненную TBST (таблица 1). Перенесите червей в как можно меньший объем (~15 мкл).
- Открутите трубку ПЦР на мини-настольной центрифуге (2000 × г, 10 с). Удалите надотворное вещество и промыть 2 раза по 200 мкл TBST каждый.
- Промыть 200 мкл ПБСТ (табл. 1) в течение 5-10 мин. Повторите этапы 2.1.1-2.2.5 для четырех проб, сохраняя рассеченные образцы на льду.
ПРИМЕЧАНИЕ: При обработке более четырех образцов перейдите к этапам 2.2.6-2.2.7 после каждых четырех образцов, чтобы обеспечить согласованность фиксации образцов во всех образцах. - Раскрутите рассеченные образцы на мини-настольной центрифуге (2000 × г, 10 с), удалите ПБСТ и добавьте 50-100 мкл холодного метанола (-20 °C).
ВНИМАНИЕ: Метанол токсичен. Носите защитные средства и избегайте вдохов. - Перемешайте путем пипетки вверх и вниз и оставьте образцы в метаноле на 30-60 с. Промывайте образцы в 2 раза в 200 мкл PBST.
ПРИМЕЧАНИЕ: При обработке более четырех образцов следует приступить к вскрытию остальных образцов (этапы 2.1.1-2.2.7). - Промыть образцы в третий раз 200 мкл ПБСТ.
- Пипетировать 30 мкл фиксирующего раствора (таблица 1) в каплю рассеченных червей и пипетировать вверх и вниз для смешивания.
3. Инкубация антител
- Блокировка
- Блокируют образцы в 1x Блокирующий раствор (табл. 1) в течение 45-60 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Время инкубации может варьироваться от 30 мин при комнатной температуре до нескольких дней при 4 °C (тестирование проводилось до 3 дней).
- Блокируют образцы в 1x Блокирующий раствор (табл. 1) в течение 45-60 мин при комнатной температуре.
- Первичный раствор антител
- Разбавить анти-HTP-3 (курица42) и анти-ГК (мышь) антитела (или антитела по выбору) к рабочим растворам (1:250 для SMLM и 1:1000 для образцов микроскопии STED) в 1x Блокирующий раствор.
ПРИМЕЧАНИЕ: Антитела, используемые для маркировки образцов SMLM, являются более концентрированными, чем для образцов STED, поскольку для микроскопии SMLM рекомендуется более высокая плотность маркировки. - Раскрутите образцы на мини-настольной центрифуге (2000 × г, 10 с), удалите блокирующий буфер и добавьте 30-50 мкл раствора первичного антитела. Инкубировать на ночь при 4 °C (предпочтительно) или в течение 1-2 ч при комнатной температуре.
- После инкубации промыть 3 х 5-15 мин ПБСТ.
- Разбавить анти-HTP-3 (курица42) и анти-ГК (мышь) антитела (или антитела по выбору) к рабочим растворам (1:250 для SMLM и 1:1000 для образцов микроскопии STED) в 1x Блокирующий раствор.
- Рабочий раствор фрагментов F(ab')2, сопряженных с флуоресцентным красителем
- Разбавляют меченые фрагменты F(ab')2 (этап 1.2.4) до рабочих растворов (1:100 для SMLM и 1:1000 для образцов микроскопии STED) в 1x Блокирующий раствор.
ПРИМЕЧАНИЕ: Для обоих методов сверхвысокого разрешения использовались ранее сообщенные пары флуорофоров, а именно AlexaFluor647/CF680 для SMLM и AlexaFluor594/Abberior STAR635P для STED. AlexaFluor647 и STAR645P использовались для маркировки антимышечных (Fab')2 фрагментов для нацеливания на C-конец SYP-5 и CF680/AlexaFluor594-меченых анти-куриных (Fab')2 фрагментов для нацеливания на HTP-3. - Раскрутите образцы на мини-настольной центрифуге (2000 × г, 10 с), удалите ПБСТ и добавьте 30-50 мкл раствора вторичных антител. Инкубировать в течение 30 мин до 2 ч при комнатной температуре (предпочтительно) или на ночь при 4 °C. Стирать 3 x 5-15 мин с PBST.
- Разбавляют меченые фрагменты F(ab')2 (этап 1.2.4) до рабочих растворов (1:100 для SMLM и 1:1000 для образцов микроскопии STED) в 1x Блокирующий раствор.
4. Монтаж образцов на крышку
- Постфиксация
ПРИМЕЧАНИЕ: Обрабатывайте образцы по отдельности на этапах 4.1.1-4.2.1.- Раскрутите окрашенные образцы и удалите супернатант. Добавьте 50 мкл PBST0,2 и переложите окрашенные черви на крышку Размером 22 мм x 22 мм No 1.
ПРИМЕЧАНИЕ: Используйте свежий PBST0,2 с 0,2% неионным моющим средством (таблица 1) для этого этапа, чтобы предотвратить прилипание червей к крышке. - Пипет 5,7-6,3 мкл постфиксативного раствора на поли-L-лизиновую крышку.
ПРИМЕЧАНИЕ: Поли-L-лизиновые крышки, хранящиеся при температуре 4 °C, сначала следует довести до комнатной температуры. - Пипетку от рассеченных червей в том же объеме (5,7-6,3 мкл) и перекладывают в каплю фиксатора на поли-L-лизиновом покровном листе (рисунок 2В).
ПРИМЕЧАНИЕ: На этом и следующем этапе очень важно сохранить рассеченную ткань в центре покрытого поли-L-лизином покрова. Это особенно важно, если монтировать образцы в пользовательский держатель, чтобы соответствовать специально изготовленному микроскопу SMLM, используемому здесь (см. шаг 5.1, рисунок 2B). - Накройте образец небольшим чехлом (диаметр 12 мм, рисунок 2B). Удалите лишнюю жидкость с помощью небольшого кусочка фильтровальной бумаги (рисунок 2B). Зафиксировать на 3-5 мин в темной камере.
- Раскрутите окрашенные образцы и удалите супернатант. Добавьте 50 мкл PBST0,2 и переложите окрашенные черви на крышку Размером 22 мм x 22 мм No 1.
- "Замораживание-растрескивание"
- Заморозьте образцы, поместив их на алюминиевый блок в сухом льду (рисунок 2B).
ПРИМЕЧАНИЕ: Алюминиевый блок должен быть хорошо охлажден в сухом льду перед размещением на нем образцов. Приступить к постфиксации остальных образцов (этапы 4.1.1-4.2.1). Образец должен находиться на сухом льду не менее 20 мин или до 1 ч до следующего этапа (4.2.2). - Снимите меньшую крышку с помощью бритвы (рисунок 2B).
ПРИМЕЧАНИЕ: Для ЗППП перейдите к этапу 5.2.1. Для SMLM перейдите к шагу 4.2.3. - Окуните крышку в коническую трубку объемом 50 мл, содержащую холодный PBS (предпочтительно) или метанол -20 °C, примерно на 10 с.
ПРИМЕЧАНИЕ: Температура является очень важным фактором для этого этапа. Поэтому используйте PBS, который только что разморожен или хранится в ванне со льдом / этанолом. - Поместите крышку в колодец из шестилуночной пластины, заполненной буфером PBST. Извлеките ПБСТ из колодцев и добавьте свежий ПБС. Оставьте образцы в PBS на 5 минут.
ПРИМЕЧАНИЕ: Пипетка PBS на боковую часть скважины, чтобы избежать повреждения и отсоединения образцов. - Вымойте свежим PBS и оставьте образцы при температуре 4 °C до получения изображения.
ПРИМЕЧАНИЕ: Образцы стабильны в течение 2 недель, но наилучшие результаты достигаются, если образцы получены в течение 2 дней. - Перед визуализацией оцените качество крепления образца под стереомикроскопом.
ПРИМЕЧАНИЕ: Успешно установленные зародышевые линии стабильно прикреплены без заметного движения относительно крышки. Плохо прикрепленные зародышевые линии будут отслаиваться в буферном растворе.
- Заморозьте образцы, поместив их на алюминиевый блок в сухом льду (рисунок 2B).
5. Визуализация
- Одномолекулярная микроскопия локализации
ПРИМЕЧАНИЕ: Изображения были получены в Центре визуализации EMBL с использованием специально построенного одномолекулярного локализующего микроскопа, который был построен вокруг пользовательского тела, как сообщалось ранее.38,43, с уникальными характеристиками, указанными в Таблица материалов; обратитесь к https://www.embl.org/about/info/imaging-centre- Получение 3D-калибровки шариков
- Подготовьте прецизионную крышку (диаметр 24 мм; диаметром 0,17 ± 0,005 мм, No 1,5) со сцепленными 100 нм флуоресцентными шариками, как описано ранее38,44.
- Поместите калибровочный образец, взятый на этапе 5.1.1.1, на держатель для образцов.
- Добавьте каплю погружного масла на чистый масляный объектив 100x/1.5 и установите калибровочный образец на микроскоп.
- В MicroManager 245,46 укажите 15-20 позиций в калибровочном образце.
- В окне47 плагина EMU настройте получение изображения z-стека для каждой из позиций из шага 5.1.1.5.
ПРИМЕЧАНИЕ: Здесь составная цилиндрическая линза обеспечивает астигматизм, необходимый для 3D-визуализации, и для каждого положения, охватывающего диапазон от -1 мкм до 1 мкм, с шагом 10 нм, был получен 201 z-срез. Лазерная подсветка 2 кВт/см2 640 нм использовалась в течение 25 мс для каждого z-среза. - Получите z-стековые изображения 100-нм флуоресцентных шариков по идентичному оптическому пути, который будет использоваться для получения образцов изображений на этапе 5.1.11.
- Используя платформу анализа микроскопии со сверхвысоким разрешением (SMAP48), сгенерируйте модель cspline экспериментальной функции разброса точек (PSF), которая будет использоваться для соответствия данным 3D-SMLM на шаге 5.1.13.
- Подготовьте держатель образца. Для специально изготовленного держателя, используемого здесь, который использует магнитное кольцо для создания камеры визуализации (рисунок 2B), оберните магнитное кольцо парапленкой.
ПРИМЕЧАНИЕ: Альтернативно, слайд микроскопа с вогнутой полостью депрессии может быть использован для крепления образцов для микроскопов с держателями слайдов. - Подготовьте 1 мл буфера визуализации44 (табл. 1).
- Возьмите один обшивочный лист из шага 4.2.6 и поместите его в изготовленный на заказ держатель. Закрепите крышку в держателе с помощью магнитного кольца, обернутого парапленкой (шаг 5.1.2).
- Осторожно пипетируйте буфер изображения (этап 5.1.3) в камере, созданной магнитным кольцом поверх образца (рисунок 2B). Запечатайте камеру куском парапленки.
- Чтобы смонтировать образец, добавьте одну каплю погружного масла на чистый масляный объектив 100x/1.5. Не вводя воздуха в иммерсионное масло, аккуратно поместите держатель образца с установленным образцом (шаг 5.1.5) на ступень микроскопа.
ПРИМЕЧАНИЕ: Прежде чем поместить образец на микроскоп, очистите нижнюю часть крышки тканью и 70% этанолом. - Используя окно плагина EMU47 в MicroManager 245,46, перемещайте пьезо-стадию до тех пор, пока сигнал от лазера блокировки фокусировки не будет обнаружен на квадрантном фотодиоде (QPD).
ПРИМЕЧАНИЕ: Для поддержания фиксированного фокуса в течение всего времени визуализации блокировка фокусировки достигается путем полного внутреннего отражения лазера с волоконной связью в ближнем инфракрасном диапазоне от покровного листа и последующего чувствительного к высоте обнаружения на квадрантном фотодиоде (QPD). Сигнал QPD обеспечивал замкнутый контур управления пьезоаперированием объектива. - Получение изображения задней фокальной плоскости с помощью лазера возбуждения 640 нм при малой мощности (т.е. 1-5%) для подтверждения отсутствия пузырьков воздуха в иммерсионном масле.
ПРИМЕЧАНИЕ: Извлеките образец со сцены при обнаружении пузырька воздуха. Очистите нижнюю часть крышки и объектив и повторите шаги 5.1.6-5.1.8. В противном случае перейдите к блокировке фокуса в программном обеспечении EMU47. - Локализуйте ткань гонады с помощью яркого освещения. Используя освещение низкой интенсивности 640 нм, сосредоточьтесь на участке ткани, который содержит много растяжек SC.
ПРИМЕЧАНИЕ: Не сосредотачивайтесь на структурах, которые находятся более чем на 2 мкм от крышки. Не используйте более высокую мощность лазера для определения местоположения образца, так как это может преждевременно перевести некоторые флуорофоры в мигающее состояние. Здесь 1 кВт/см2 использовался в восходящем режиме с импульсом, установленным на 1000. - Приступайте к экспонированию образца с освещенностью 640 нм при высоком излучении (27 кВт/см2) в течение ~30 с до тех пор, пока не будет достигнута соответствующая скорость моргания (Дополнительное видео 1).
- Получите 200 000 кадров со временем экспозиции 20 мс с помощью многомерного инструмента сбора в MicroManager 245,46.
- Между тем, настройте УФ-активацию с помощью опции активации плагина EMU38,47 для поддержания желаемой скорости мигания.
ПРИМЕЧАНИЕ: Используйте УФ-лазер при излучении 3 кВт/см2 в восходящем режиме с максимальной длиной импульса, установленной на 10 000. - Выполните реконструкцию и постобработку изображений SMLM.
ПРИМЕЧАНИЕ: Чтобы восстановить изображения из необработанных данных SMLM, обратитесь к опубликованным методам. Данные, представленные здесь, были обработаны с использованием программного обеспечения SMAP48,49. В программном обеспечении SMAP48 выполнялись реконструкция изображения со сверхразрешением, назначение каналов, коррекция дрейфа и фильтрация локализаций с низкой точностью локализации и фильтром максимальной вероятности.
- Получение 3D-калибровки шариков
- Микроскопия замедленного истощения выбросов
ПРИМЕЧАНИЕ: Изображения были получены на интегрированной микроскопической системе STED, оснащенной лазером белого света, импульсным лазером STED 775 нм и модулем старения FALCON Fluorescence Lifetime IM(таблица материалов) в Центре визуализации EMBL (https://www.embl.org/about/info/imaging-centre).- Поместите каплю монтажной среды (таблица материалов) объемом 20 мкл на предметное стекло микроскопа. Возьмите один обтекатель из шага 4.2.2 и аккуратно поместите образец на слайд, обращенный к монтажному материалу (рисунок 2B).
ПРИМЕЧАНИЕ: Избегайте введения воздушных карманов в монтажную среду. - Дайте монтажной среде затвердеть в течение ночи.
ПРИМЕЧАНИЕ: Изобразите образцы на следующий день или держите их при температуре 4 °C до получения изображения. - Чтобы смонтировать образец, добавьте одну каплю погружного масла на крышку образца из шага 5.2.2. Аккуратно поместите образец на ступень микроскопа, используя масляный объектив 100x/1.40.
- Сосредоточьтесь на образце и найдите ткань зародышевой линии, используя яркое освещение поля.
- С помощью программного обеспечения микроскопа укажите интересующую область, для которой будет получено изображение TauSTED.
- Выберите лазеры возбуждения и их соответствующую мощность, используемую для возбуждения флуорофоров, используемых в образце.
ПРИМЕЧАНИЕ: Здесь лазер 580 нм мощностью 4% использовался для изображения AlexaFluor 594-конъюгированных фрагментов F(ab')2 вторичных антител и 635 нм при мощности 3% для изображения фрагментов STAR 635P-конъюгированных F(ab')2. - Используя программное обеспечение микроскопа, выберите соответствующую мощность лазера для истощения STED и настройте обнаружение изображения.
ПРИМЕЧАНИЕ: Здесь мощность лазера с истощением STED 775 нм была установлена на 40%. Детектор использовался в режиме подсчета со значением усиления 10 для обнаружения фотонов, со скоростью сканирования 100 Гц и при размере пикселя 17 нм. Для приобретения TauSTED было использовано четырехлинейное накопление.
- Поместите каплю монтажной среды (таблица материалов) объемом 20 мкл на предметное стекло микроскопа. Возьмите один обтекатель из шага 4.2.2 и аккуратно поместите образец на слайд, обращенный к монтажному материалу (рисунок 2B).
Результаты
Чтобы изобразить SC в ткани зародышевой линии C. elegans с помощью SMLM, мы использовали 2-цветной ратиометрический 3D-SMLM для локализации HTP-3, компонента осей хромосомы, и C-конца поперечной нити SYP-5 эндогенно помеченной меткой гемагглютинина (HA). Расположение обоих белков в пределах SC C. elegans ранее определялось другими исследованиями16,30.
Чтобы свести к минимуму рассеяние света и оптические аберрации, присущие толстым биологическим образцам, мы изобразили самое нижнее z-сечение мейотических ядер, которые содержат SCs (рисунок 3, желтые линии). Для каждого полученного изображения положение пьезо-стадии плоскости изображения было отмечено относительно положения пьезо-стадии, когда цель была сфокусирована на крышке. Это позволило рассчитать пьезодальность от покровного листа. Успешно смонтированные образцы стабильно прикрепляются близко к крышке и сохраняют форму гонады (т.е. ткань не измельчается между двумя обшивками на этапе постфиксации). Качество крепления образца может быть легко оценено под стереомикроскопом, поскольку хорошо прикрепленные гонады не показывают никакого движения в растворе (этап 4.2.6). Тем не менее, из-за стохастичности процесса монтажа ткань гонады не обязательно будет выкладываться полностью плоско на крышке. Таким образом, нижняя плоскость ядер, содержащих SCs, может быть найдена на различных расстояниях относительно покровного листа в пределах одной и той же гонады.
Чтобы проиллюстрировать, как меняется разрешение в зависимости от прикрепления ткани к покровному листу, мы получили изображения на разных пьезодальностях до покровного листа. Для оценки качества отдельного изображения были рассчитаны кривые кольцевой корреляции Фурье (FRC)50,51 и разрешение определено с помощью плагина FRCResolution в программном обеспечении SMAP48. Два репрезентативных ядра, извлеченные из двух отдельных изображений 3D-SMLM, сделанных на разных расстояниях до покровного листа, показаны на рисунке 4. В СК, расположенных близко к покровному листу, оси хромосом и С-конец SYP-5::HA хорошо разрешены во всех трех измерениях (рисунок 4A, 0,8 мкм от крышки). Чтобы разрешить две структуры, разделенные заданным расстоянием, достигнутое разрешение FRC обычно должно быть меньше половины этого расстояния в осевом разрешении.
Чтобы разделить одни и те же структуры сбоку, необходимо достичь еще меньших значений разрешения FRC. Действительно, в образцах, которые расположены в непосредственной близости от крышки, разрешение FRC составляет 38 нм для канала AlexaFluor 647 и 34 нм для канала CF680, и, таким образом, значительно ниже ожидаемого расстояния 84 нм между C-терминами SYP-516. Таким образом, эта резолюция легко разрешает организацию ПК не только спереди, но и сбоку (рисунок 4B i,ii). Напротив, разрешение ухудшается в СК, расположенных на расстоянии 5 мкм от покровного листа, из-за рассеяния света и сферических аберраций (рисунок 4B). Разрешения FRC на этом расстоянии падают до 47 нм (AlexaFluor 647) и 41 нм (CF680), что не может полностью разрешить C-термины SYP-5. Поскольку оптические аберрации ухудшают боковое разрешение более серьезно, чем осевое разрешение, полосы HTP-3 и SYP-5 больше не четко разрешаются в поперечном сечении бокового вида в образцах, расположенных на расстоянии 5 мкм от покровного листа (рисунок 4B ii). Сравнение разрешения FRC изображений, полученных на разных пьезодальностях от покровного листа, показало, что изображенная ткань должна находиться не дальше 2 мкм от покровного листа (рисунок 5). Этот результат подчеркивает важность правильного выполнения стадии постфиксации, во время которой ткань должна быть успешно сшита с поли-L-лизиновой оболочкой крышки.
Чтобы продемонстрировать достижимое разрешение с помощью другого метода сверхвысокого разрешения, мы также изобразили SC в фиксированной неповрежденной ткани зародышевой линии с помощью микроскопии TauSTED. На рисунке 6A показаны изображения TauSTED с самым высоким и самым низким разрешением, достигнутым в рамках этого исследования, оцененным по линейным профилям SC в лобовом представлении (рисунок 6B). В обоих ядрах мы могли бы разрешить две полосы локализации HTP-3 в осях хромосом и C-термины SYP-5 в центральной области, демонстрируя, что разрешение, достижимое в TauSTED с использованием этого оптимизированного протокола, ниже 84 нм. В оптимальных условиях (рисунок 6A, вверху) мы могли бы разрешить C-конец в слегка наклоненных видах SC, которые были разделены только 50 нм (рисунок 6A, желтый прямоугольник и 6C).

Рисунок 1: Схема организации синаптонемного комплекса у Caenorhabditis elegans. На мультфильме показана упрощенная структура СК у C. elegans , соединяющая две гомологичные хромосомы (серые). Структура показана в фронтальном, боковом и поперечном видах. Оси хромосом отображаются в виде красных полос, в то время как поперечные нити показаны в голубом цвете. Белки поперечной нити (SYP-1, 5, 6 в C. elegans) ориентированы лицом к лицу (голубая шариковая графика) в центральной области, чтобы преодолеть расстояние между двумя осями. Указаны ожидаемые расстояния между осями и С-концами поперечных нитей. Аббревиатура: SC = синаптонемальный комплекс. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
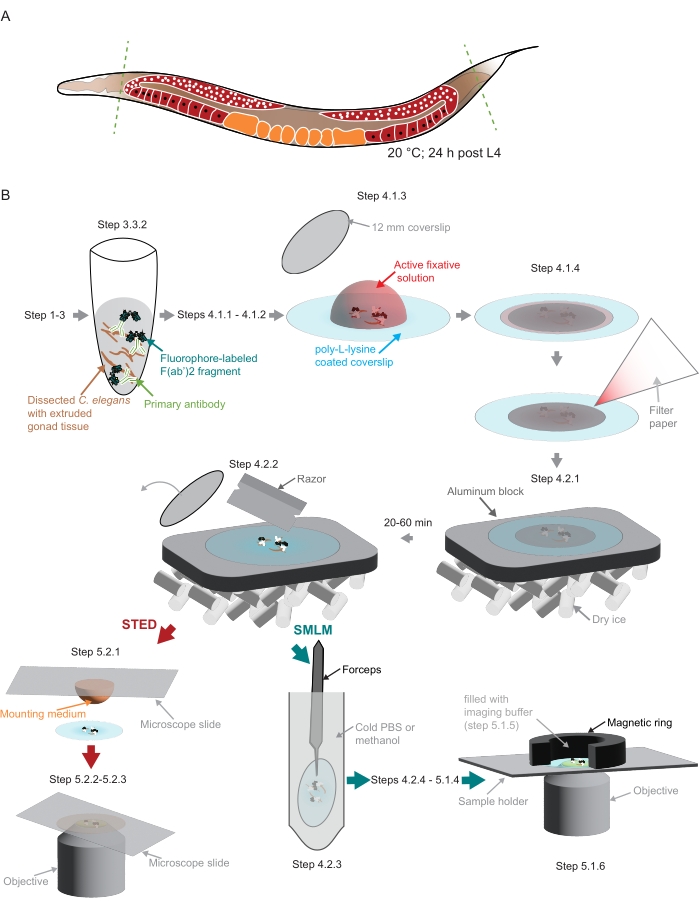
Рисунок 2: Иллюстрация пробоподготовки, использованной в исследовании. (A) Взрослые особи молодых C. elegans рассекаются у головы или хвоста (зеленые, пунктирные линии) и обрабатываются, как описано в протоколе. (B) Отдельные этапы метода обозначены графиками, которые связаны серыми стрелками. Сокращения: STED = истощение стимулированных выбросов; SMLM = одномолекулярная локализационная микроскопия; PBS = фосфатно-буферный физиологический раствор. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
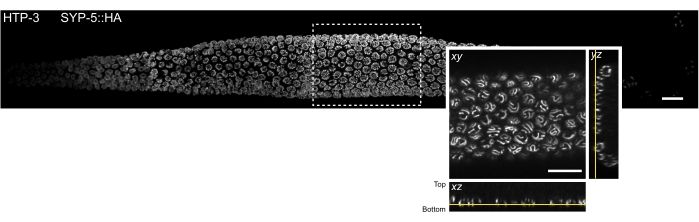
Рисунок 3: Расположение участка ткани, которое можно наблюдать с помощью микроскопии локализации одной молекулы. MIP вращающегося диска конфокального изображения целого mount C. elegans gonad. Ткань окрашивали для HTP-3 и C-конца SYP-5 (SYP-5::HA), а комбинированный сигнал показан серым цветом. Отдельные конфокальные изображения были сшиты с помощью плагина Grid/Collection stitching Fiji52 для создания изображения всей гонады. Вставка показывает xy-образный вид самой нижней z-плоскости, содержащей SCs. Локализация этой плоскости показана в ортогональных видах участка ткани, обозначенного прямоугольником на MIP-изображении гонады (желтые линии). Шкала стержней = 10 мкм. Сокращения: MIP = проекция максимальной интенсивности; SCs = синаптонемальные комплексы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
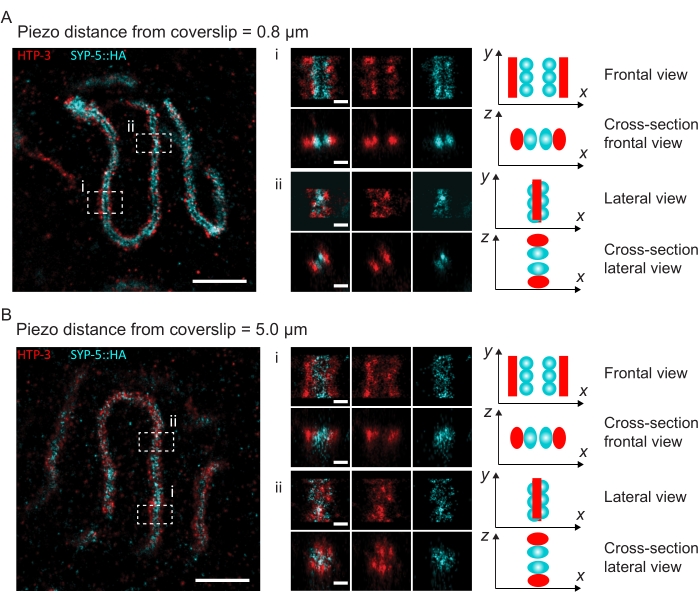
Рисунок 4: Одномолекулярная локализационная микроскопия HTP-3 и C-конца SYP-5. (A,B) Слева: ИЗОБРАЖЕНИЯ SMLM, показывающие ядра пахитена, окрашенные для HTP-3 (красный) и C-конец SYP-5 (SYP-5::HA, голубой) (шкала = 1 мкм). Центр: Увеличенные изображения областей интереса, которые обозначены в форматах A и B с соответствующими видами поперечного сечения, отображаемыми под каждым изображением (i, ii; шкала = 100 нм). Участки SC в увеличенных изображениях поворачиваются, чтобы ориентировать оси хромосом параллельно оси Y. Правильно: Графическое представление локализации интересующих белков в пределах СК, изображающее ориентацию СК в увеличенных областях, отображаемых в центре рисунка. Сокращения: SMLM = одномолекулярная локализационная микроскопия; SC = синаптонемальный комплекс. Необработанные данные для реконструкции изображений SMLM доступны через базу данных BioStudies60 (идентификатор присоединения: S-BIAD504). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
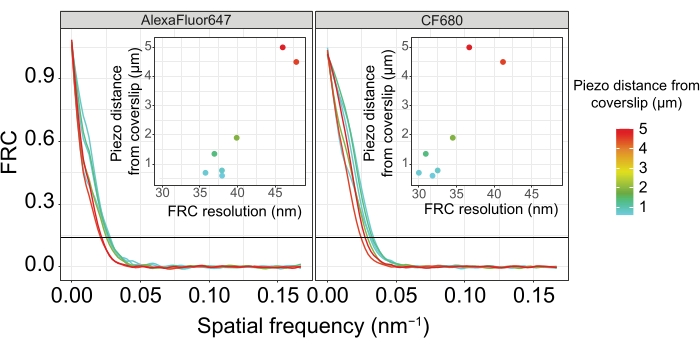
Рисунок 5: Корреляционное разрешение кольца Фурье одномолекулярных микроскопических изображений зависит от расстояния изображаемой z-плоскости от плоскости покровного листа. Цветные линии показывают кривые FRC изображений, полученных на разных расстояниях (как показано цветовой полосой) от обложки. Пороговое значение 1/7, используемое для определения разрешения FRC, обозначается черной горизонтальной линией. Вставки показывают зависимость разрешения FRC от пьезодальности от покровного листа. Построение графиков выполнялось специально написанным скриптом R (версия 4.1.2, Дополнительный файл 1), в котором исходные кривые сглаживались функциями из пакета "ggplot2". Сокращения: FRC = корреляция кольца Фурье; SMLM = одномолекулярная локализационная микроскопия; SC = синаптонемальный комплекс. Данные для кривых FRC и smLM доступны через базу данных BioStudies60 (идентификатор присоединения: S-BIAD504). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Микроскопия замедленного истощения выбросов, усиленная флуоресцентной информацией о времени жизни (TauSTED), разрешает две полосы локализации как для HTP-3, так и для C-конца SYP-5. (A) Два репрезентативных изображения TauSTED показывают ядра пахитена, окрашенные для HTP-3 (красный) и C-конец SYP-5 (SYP-5::HA, голубой) с более высоким (верхним) и нижним (нижним) структурным определением (шкала = 1 мкм). Прямоугольники обозначают области с разрешенным C-концом SYP-5 во фронтальном (белый) и слегка наклоненным видом (желтый) SC. (B,C) Распределение HTP-3 (красный) и C-конец сигнала SYP-5 (голубой), разрешенный TauSTED. Линейные профили областей, представляющих интерес, которые содержат SC во фронтальном (B) или слегка наклоненном (C) видах, отображаются в виде полных линий с интенсивностью, нормированной до максимального значения. Профили линий были сгенерированы с использованием Fiji ImageJ. Пунктирные линии в B показывают усредненные данные для каждого белка. Толстая голубая линия в C соответствует профилю линии с кратчайшим разрешенным расстоянием между C-концами SYP-5. Для определения расстояний между антителами, нацеленными на специфические белки, линейные профили (n = 9 (B), n = 7 (C)) были снабжены двойными гауссианами с использованием специально написанного R-скрипта (версия 4.1.2, Дополнительный файл 1). Среднее расстояние ± стандартным отклонением (B) и диапазон с минимальным значением, выделенным жирным шрифтом (C), указаны в верхней части каждого графика соответственно. Сокращения: STED = микроскопия стимулированного истощения выбросов; SC = синаптонемальный комплекс. Отображаемые изображения и точки данных построенных профилей линий доступны через базу данных BioStudies60 (идентификатор присоединения: S-BIAD504). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Состав буферов и растворов, используемых в данном протоколе. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Дополнительное видео 1: Получение одномолекулярной локализационной микроскопии. Видео, показывающее флуорофоры, мигающие с соответствующей скоростью (показано 50 кадров, шкала = 5 мкм, 20 мс/кадр). Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительный файл 1: Скрипт анализа данных. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Лестничная организация СК, необходимая для правильной рекомбинации и сегрегации гомологичных хромосом, впервые наблюдалась почти 70 лет назад в электронной микроскопии 3,4. В то время как общая организация КА легко решается в электронной микроскопии, локализация отдельных компонентов в этом комплексе требует более целенаправленного подхода. При ширине всего ~100 нм подструктура СК не может быть разрешена с помощью обычной флуоресцентной микроскопии. Тем не менее, микроскопия сверхвысокого разрешения стала основным драйвером для новых открытий о структуре и функции синаптонемального комплекса 16,19,24,25,26,27,28,29,30. Для облегчения этого исследования мы продемонстрировали процедуру монтажа, которая позволяет изучить архитектуру SC в ткани гонады C. elegans с помощью микроскопии SMLM и STED.
Критическим шагом для оптимизации разрешения в SMLM-визуализации является непосредственное сшивание ткани зародышевой линии с покрытой поли-L-лизином покровом (шаг 4). Ковалентное прикрепление ткани к покровному листу имеет важное значение для уменьшения движений внутри образца, что приведет к большим дрейфам и сделает невозможным визуализацию в течение длительных периодов времени для SMLM. Кроме того, даже неоптимальное прикрепление, которое оставляет ядра, содержащие SCs, на расстоянии от покровного листа, приводит к значительному падению достижимого разрешения в результате сферических аберраций (рисунок 4). В качестве альтернативы ковалентному прикреплению, используемому здесь, окрашенная ткань зародышевой линии также может быть иммобилизована между двумя герметичными покровами в небольшой капле буфера визуализации19,30. Однако этот метод иммобилизации значительно уменьшает объем буфера визуализации в образце с 1 мл, используемого в оптимизированном протоколе здесь, до всего нескольких мкл, что приведет к подкислению буфера визуализации и значительно сократит время, в течение которого образец может быть изображен 38,53,54.
Длительные сроки сбора как для SMLM, так и для STED-микроскопии ограничивают использование этих методов для визуализации химически фиксированных образцов. Здесь фиксация параформальдегида гарантирует, что структура SC сохраняется во время подготовки образцов и визуализации. Однако, несмотря на меры предосторожности, принятые здесь для изображения СК в неповрежденной ткани, результирующая структура СК после фиксации не обязательно идентична структуре в ее родном состоянии в живом организме. Более того, поскольку одно изображение фиксированного СК представляет собой единый «снимок» биологической структуры, такой подход остается слепым к динамике нативной структуры in vivo.
Однако информацию о динамике и изменчивости макромолекулярных структур можно получить и путем получения не одного, а множества «снимков». Хотя этот подход может разрешить изменения в структуре SC во время пахитена19, существует несколько факторов, которые ограничивают количество изображений, которые могут быть получены из одного образца, подготовленного с использованием этого протокола. Во-первых, высокие мощности лазера, используемые при получении изображения, приводят к постоянному отбеливанию флуорофоров и исключают визуализацию соседних областей, представляющих интерес, или нескольких z-плоскостей, тем самым значительно уменьшая количество изображений, которые могут быть получены из одного образца. Во-вторых, плотность образца/ткани на покровном листе, подготовленном этим методом, низкая, что значительно ограничивает количество изображений, которые могут быть получены из одного обтекателя. Низкая плотность выборки также запрещает использование автоматизированных конвейеров сбора изображений, которые помогли пролить свет на другие биологические вопросы 34,55,56,57,58,59. Однако плотность выборки может быть немного увеличена опытным пользователем.
Протокол, представленный здесь, оптимизирован для получения высокой плотности маркировки, необходимой для достижения оптимального разрешения в SMLM35. В то время как предыдущие протоколы ковалентно прикрепляли ткань к покровному листу перед иммуноокрашиванием16, этот новый протокол сшивает ткань с покровным листом только после того, как образцы были окрашены в раствор. Эта модификация позволяет антителам, используемым для иммуномаркировки, свободно получать доступ к ткани со всех сторон, в то время как ковалентное прикрепление ткани к покровному листу может ограничивать антитела от достижения ядер, ближайших к покровному листу, тем самым уменьшая степень маркировки. Вместе описанные здесь модификации улучшают разрешение с 40-50 нм (разрешение FRC)16 до 30-40 нм (этот протокол).
Важно отметить, что, хотя высокая плотность маркировки и высокая концентрация антител необходимы для SMLM, мы обнаружили, что лучшие микроскопические изображения STED получаются с использованием более низких концентраций антител (этап 3). При разрешении в десятки нанометров размер молекул, используемых для маркировки интересующего белка, становится все более важным. Поэтому мы использовали фрагменты F(ab')2, которые вдвое меньше полноразмерных антител. Улучшение локальной контрастности за счет меньшего источника сигнала и, следовательно, разрешения, полученного этой модификацией по сравнению с использованием полноразмерных вторичных антител, позволило разрешить два C-конца SYP-5 в центральной области TauSTED, которые не разрешаются обычным ЗППП с использованием полноразмерных антител (16 и данные не показаны). Мы ожидаем, что этот оптимизированный протокол для визуализации СК в интактных зародышевых линиях C. eleganоблегчит исследование структурно-функциональной взаимосвязи SC во время мейоза.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Мы хотели бы поблагодарить Джонаса Риса и лабораторию Риса за совместное использование буферов изображений для обработки изображений SMLM. Мы также благодарим Юми Ким за штамм C. elegans, используемый в этом протоколе, и Эбби Ф. Дернбург за антитело против курицы против HTP-3. Мы благодарим Марко Лампе и Стефана Терюнга из Advanced Light Microscopy Facility в EMBL Heidelberg за их поддержку в использовании конфокального микроскопа Olympus iXplore SPIN SR. Эта работа была поддержана Европейской лабораторией молекулярной биологии и Deutsche Forschungsgemeinschaft (DFG, Немецкий исследовательский фонд - 452616889, Словакия). Мы признаем доступ и услуги, предоставляемые Центром визуализации в Европейской лаборатории молекулярной биологии (EMBL IC), щедро поддерживаемые Фондом Берингера Ингельхайма.
Материалы
| Name | Company | Catalog Number | Comments |
| 100x/1.5 oil objective | Olympus | UPLAPO100XOHR | UPLAPO100XOHR |
| 2-mercaptoethylamine (MEA) | Sigma-Aldrich | 30070-10G | Dissolved in MilliQ water to 5 M solution, pH 8.7 adjusted with HCl. Aliquoted to a single-use volume, frozen, and kept at -80 °C. |
| Additional 640 nm booster laser | Toptica | IBEAM-SMART-640-S-HP | |
| AlexaFluor 594, NHS ester | ThermoFischer Scientific | A37572 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| AlexaFluor 647, NHS ester | ThermoFischer Scientific | A37573 | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| anti-HA | Thermo Fisher Scientific | 2-2.2.14 | Mouse monoclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| anti-HTP-3 | a gift from Abby F. Dernburg | MacQueen et al., 2005 | Chicken polyclonal, 1:250 (SMLM), 1:1,000 (STED Microscopy) |
| Caenorhabditis elegans strain YKM349 | a gift from Yumi Kim | Hurlock et al., 2020 | syp-5(kim9[syp-5::HA]) I; meIs8[pie-1p::GFP::cosa-1, unc-119(+)] II |
| CF6680, NHS ester | Biotium | 92139 | Dissolved in DMSO to 1mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Circular cover glass 12 mm No. 1 | Menzel-Gläser; VWR | 631-0713 | |
| Circular cover glass 24 mm No. 1.5 | Carl Roth | PK26.1 | |
| Cylindrical lenses | Thorlabs | LJ1516RM-A, LK1002RM-A | |
| Egg Buffer (10x) | Edgar 1995 | 250 mM HEPES, 1.18 M NaCl, 480 mM KCl, 20 mM EDTA, 5 mM EGTA, pH 7.4 | |
| Ethanol (absolute for analysis) | Merck | 64-17-5 | |
| F(ab’)2 fragment anti-chicken IgY | Jackson Immunoresearch | AB_2340347 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| F(ab’)2 fragment anti-mouse IgG | Jackson Immunoresearch | AB_2340761 | Donkey polyclonal, 1:100 (SMLM), 1:1,000 (STED Microscopy) |
| Fisherbrand Microscope slides T/F Ground 0.8-1.0 mm thick | Fisher scientific | 7107 | |
| Gauge Worm Pick 30 diameter 0.254 mm - Iridium 10% | Kisker | 789265 | |
| Glucose oxidase/Catalase enzyme mix (GlOX/Cat ) | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 20x, 1916 U/mL glucose oxidase (Sigma G7141), 42350 U/mL catalase (Sigma C3155), 50 mM Tris-HCl pH 8.0, 51% glycerol, MilliQ water. Stored at -20 °C. |
| Imaging buffer base | a gift from Jonas Ries | Hoess, Mund, Reitberger, & Ries, 2018 | 50 mM Tris-HCl, pH 8.0, 10 mM NaCl, 10% D-Glucose. Aliquoted to a single-use volume (950 μL), frozen, and kept at -80 °C. |
| Invitrogen ProLong Glass Antifade Mountant | ThermoFischer Scientific | P36982 | |
| Leica Stellaris 8 STED FALCON | Leica | N/A | The microscope is equiped with the latest generation white light laser, a 775nm pulsed STED laser, the FALCON Fluorescence Lifetime IMaging module, HC PL APO CS2 100x/1.40 oil objective, and Leica HyD X detector. The system is capable of FLIM module enhanced Tau-STED which measures the specific fluorescence lifetime of a dye and is therefore capable of removing background signal based on differences in fluorescence lifetimes of the dyes, and dye conditions in the sample. Additionally, the resolution is increased by accounting for the variation of fluorescence lifetimes in different areas of the depletion donut. |
| Longwave channel emission filter | AHF Analysentechnik | F47-702 | 700/100 nm bandpass |
| Methanol (absolute for analysis) | Merck | 67-56-1 | |
| NaHCO3 | Sigma-Aldrich/Merck | S5761-500G | 100 mM NaHCO3, pH 8.3 |
| Near-infrared fiber-coupled laser | Toptica | IBEAM-SMART-PT-CD | Custom Design, 808 nm - 75mW |
| Objective lens piezo mount (PIFOC ) | Physik Instrumente | P-726.1.CD | 100 µm travel range |
| Orca Fusion BT sCMOS camera | Hamamatsu | C15440-20UP | |
| PCR tubes | Greiner Bio-One | 673283 | 0.2 mL |
| Phosphate Saline Buffer (PBS 10x) | N/A | 137 mM NaCl, 2.7 mM KCl, 10 mM Na2HPO4, 1.8 mM KH2PO4, pH 7.4 | |
| Pierce 16% formaldehyde (w/v), methanol free | ThermoFischer Scientific | 28906 | 16% formaldehyde is transferred from the original glass ampule into 1.5 mL tube and kept at room temperature. |
| PlasmaPrep2 plasma cleaner | GaLa Instrumente GmbH | N/A | |
| Poly-L-lysine hydrobromide | Sigma-Aldrich/Merck | P2636-25MG | 0.1% w/v solution was prepared in Milli-Q water, and stored in aliquots at -20 °C. |
| Primary dichroic (illumination reflecting) | AHF Analysentechnik | F73-866S | quad bandpass @ 405, 488, 561, 640 |
| Quadnotch filter | AHF Analysentechnik | F40-072 | 405/488/561/640 nm |
| Quadrant photodiode (QPD) | Laser Components | SD197-23-21-041, LC301DQD-PV | |
| Razor blades | Apollo Herkenrath Solinger | N/A | |
| Refractive beam shaper | AdlOptica | PiShaper 6_6_VIS | |
| Roche Blocking Reagent | Roche | 11096176001 | 10x solution was prepared according to recommendation. Frozen aliquots were stored at -20 °C. |
| Scalpel blade (Feather brand #11, No. 3) | Heinz Herenz Medizinalbedarf GmbH | 1110911 | |
| Scalpel removal box | Fisher scientific | 10002-50 | |
| Secondary dichroic (emission reflecting) | AHF Analysentechnik | F38-785S | 750 nm longpass |
| Shortpass filter | Semrock | BSP01-785R-25 | 750 nm |
| Shortwave channel emission filter | AHF Analysentechnik | F37-677 | 676/37 nm bandpass |
| Single molecule localization microscope | EMBL Imaging Centre | Diekmann et al., 2020 with modifications | The microscope provides widefield epi-illumination via a single-mode fiber-coupled laser engine, additional booster laser, and refractive beam shaper to provide a uniform illumination field (Stehr et al, 2019). Widefield images are captured on a sCMOS camera and appropriate relay optics for a system magnification of 61x and a pixel size of 106 nm. For ratiometric imaging of spectrally overlapping far-red dyes, an image splitter produces two spectrally distinct images on the camera (splitting dichroic: 665 nm long pass, shortwave channel emission filter: 676/37 nm bandpass, longwave emission filter: 700/100 nm bandpass. An additional 405/488/561/640 nm quadnotch filter and 750 nm shortpass filter are common to the two paths and provide additional laser blocking). A compound cylindrical lens provides the astigmatism required for 3D imaging. To maintain a fixed focus across acquisitions exceeding 2 hours in time (comprising 200 000 - 250 000 images), focus locking is achieved by total internal reflection of a near-infrared fiber-coupled laser from the coverslip and subsequent height sensitive detection on a quadrant photodiode (QPD). The QPD signal provided closed-loop control of the objective lens piezo mount. For access to this microscope, refer to https://www.embl.org/about/info/imaging-centre or contact ic-contact@embl.de |
| Single-mode fiber-coupled multi-laser engine | Toptica | iCHROME MLE-LFA-HP | Provides widefield epi-illumination of 100 mW at 405, 488, 561, 640 nm |
| Splitting dichroic | AHF Analysentechnik | F48-665SG | 665 nm long pass |
| Square cover glass 22 x 22 mm No.1 | Menzel-Gläser; VWR | 630-2882 | |
| STAR 635P, NHS ester | Abberior | ST635P-0002-1MG | Dissolved in DMSO to 1 mM solution, aliquoted to single use volume, frozen and kept at -80 °C |
| Stereo microscope Stemi 305 Stand K LAB | Zeiss | N/A | |
| Tetramisole hydrochloride | Sigma-Aldrich/Merck | T1512-2G | 1% (w/v) solution was prepared in Milli-Q water. Frozen aliquots were stored at -20 °C. Thawed aliquot was kept at 4 °C and used for several months. |
| TetraSpeck Microspheres | ThermoFischer Scientific | T7279 | 0.1 µm, fluorescent blue/green/orange/dark red |
| Tris Saline Buffer (TBS 10x) | N/A | 200 mM Tris-HCl, 1.5 M NaCl, pH 7.5 | |
| TWEEN 20 | Sigma-Aldrich/Merck | P9416-50ML | Kept at room temperature in original packaging. |
| WormStuff worm pick | Kisker | 789277 | |
| XY microscope stage | Smaract | N/A | Custom Design |
| Zeba Micro Spin Desalting Column | ThermoFischer Scientific | 89877 | 7K MWCO, 75 µL |
Ссылки
- Zickler, D., Kleckner, N. Meiotic chromosomes: integrating structure and function. Annual Review of Genetics. 33, 603(1999).
- Ur, S. N., Corbett, K. D. Architecture and dynamics of meiotic chromosomes. Annual Review of Genetics. 55, 497-526 (2021).
- Fawcett, D. W. The fine structure ot chromosomes in the meiotic prophase of vertebrate spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (4), 403-406 (1956).
- Moses, M. J. Chromosomal structures in crayfish spermatocytes. The Journal of Biophysical and Biochemical Cytology. 2 (2), 215-218 (1956).
- Hillers, K. J., Jantsch, V., Martinez-Perez, E., Yanowitz, J. L. Meiosis. WormBook. , 433-434 (2017).
- Pasierbek, P., et al. A Caenorhabditis elegans cohesion protein with functions in meiotic chromosome pairing and disjunction. Genes & Development. 15 (11), 1349-1360 (2001).
- Severson, A. F., Ling, L., Van Zuylen, V., Meyer, B. J. The axial element protein HTP-3 promotes cohesin loading and meiotic axis assembly in C. elegans to implement the meiotic program of chromosome segregation. Genes & Development. 23 (15), 1763-1778 (2009).
- Zetka, M. C., Kawasaki, I., Strome, S., Müller, F. Synapsis and chiasma formation in Caenorhabditis elegans require HIM-3, a meiotic chromosome core component that functions in chromosome segregation. Genes & Development. 13 (17), 2258-2270 (1999).
- Martinez-Perez, E. HTP-1-dependent constraints coordinate homolog pairing and synapsis and promote chiasma formation during C. elegans meiosis. Genes & Development. 19 (22), 2727-2743 (2005).
- Couteau, F., Zetka, M. HTP-1 coordinates synaptonemal complex assembly with homolog alignment during meiosis in C. elegans. Genes & Development. 19 (22), 2744-2756 (2005).
- Goodyer, W., et al. HTP-3 Links DSB Formation with Homolog Pairing and Crossing Over during C. elegans Meiosis. Developmental Cell. 14 (2), 263-274 (2008).
- Colaiácovo, M. P., et al. Synaptonemal complex assembly in C. elegans is dispensable for loading strand-exchange proteins but critical for proper completion of recombination. Developmental Cell. 5 (3), 463-474 (2003).
- MacQueen, A. J., Colaiácovo, M. P., McDonald, K., Villeneuve, A. M. Synapsis-dependent and -independent mechanisms stabilize homolog pairing during meiotic prophase in C. elegans. Genes & Development. 16 (18), 2428-2442 (2002).
- Smolikov, S., et al. Synapsis-defective mutants reveal a correlation between chromosome conformation and the mode of double-strand break repair during Caenorhabditis elegans meiosis. Genetics. 176 (4), 2027-2033 (2007).
- Smolikov, S., Schild-Prüfert, K., Colaiácovo, M. P. A yeast two-hybrid screen for SYP-3 interactors identifies SYP-4, a component required for synaptonemal complex assembly and chiasma formation in Caenorhabditis elegans meiosis. PLoS Genetics. 5 (10), 1000669(2009).
- Hurlock, M. E., et al. Identification of novel synaptonemal complex components in C. Elegants. The Journal of Cell Biology. 219 (5), (2020).
- Zhang, Z., et al. Multivalent weak interactions between assembly units drive synaptonemal complex formation. The Journal of Cell Biology. 219 (5), (2020).
- Schild-Prüfert, K., et al. Organization of the synaptonemal complex during meiosis in Caenorhabditis elegans. Genetics. 189 (2), 411-421 (2011).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. The interaction of crossover formation and the dynamic architecture of the synaptonemal complex during meiosis. bioRxiv. , (2020).
- Chen, F., Tillberg, P. W., Boyden, E. S. Expansion microscopy. Science. 347 (6621), 543-548 (2015).
- Klar, T. A., Jakobs, S., Dyba, M., Egner, A., Hell, S. W. Fluorescence microscopy with diffraction resolution barrier broken by stimulated emission. Proceedings of the National Academy of Sciences. 97 (15), 8206-8210 (2000).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nature Methods. 3 (10), 793-796 (2006).
- Betzig, E., et al. Imaging intracellular fluorescent proteins at nanometer resolution. Science. 313 (5793), 1642-1645 (2006).
- Schücker, K., Holm, T., Franke, C., Sauer, M., Benavente, R. Elucidation of synaptonemal complex organization by super-resolution imaging with isotropic resolution. Proceedings of the National Academy of Sciences. 112 (7), 2029-2033 (2015).
- Cahoon, C. K., et al. Superresolution expansion microscopy reveals the three-dimensional organization of the Drosophila synaptonemal complex. Proceedings of the National Academy of Sciences. 114 (33), 6857-6866 (2017).
- Zwettler, F. U., et al. Tracking down the molecular architecture of the synaptonemal complex by expansion microscopy. Nature Communications. 11 (1), 1-11 (2020).
- Yoon, S., Choi, E. H., Kim, J. W., Kim, K. P. Structured illumination microscopy imaging reveals localization of replication protein A between chromosome lateral elements during mammalian meiosis. Experimental & Molecular Medicine. 50 (8), 1-12 (2018).
- Prakash, K., et al. Superresolution imaging reveals structurally distinct periodic patterns of chromatin along pachytene chromosomes. Proceedings of the National Academy of Sciences. 112 (47), 14635-14640 (2015).
- Xu, H., et al. Molecular organization of mammalian meiotic chromosome axis revealed by expansion STORM microscopy. Proceedings of the National Academy of Sciences. 116 (37), 18423-18428 (2019).
- Köhler, S., Wojcik, M., Xu, K., Dernburg, A. F. Superresolution microscopy reveals the three-dimensional organization of meiotic chromosome axes in intact Caenorhabditis elegans tissue. Proceedings of the National Academy of Sciences. 114 (24), 4734-4743 (2017).
- Hell, S. W. Far-field optical nanoscopy. Science. 316 (5828), 1153-1158 (2007).
- Hein, B., Willig, K. I., Hell, S. W. Stimulated emission depletion (STED) nanoscopy of a fluorescent protein-labeled organelle inside a living cell. Proceedings of the National Academy of Sciences. 105 (38), 14271-14276 (2008).
- Jahr, W., Velicky, P., Danzl, J. G. Strategies to maximize performance in STimulated Emission Depletion (STED) nanoscopy of biological specimens. Methods. 174, 27-41 (2019).
- Thevathasan, J. V., et al. Nuclear pores as versatile reference standards for quantitative superresolution microscopy. Nature Methods. 16 (10), 1045-1053 (2019).
- Xu, K., Shim, S. -H., Zhuang, X. Super-resolution imaging through stochastic switching and localization of single molecules: an overview. Far-Field Optical Nanoscopy. , 27-64 (2013).
- Wang, Y., et al. Localization events-based sample drift correction for localization microscopy with redundant cross-correlation algorithm. Optics Express. 22 (13), 15982(2014).
- Winterflood, C. M., Platonova, E., Albrecht, D., Ewers, H. Dual-color 3D superresolution microscopy by combined spectral-demixing and biplane imaging. Biophysical Journal. 109 (1), 3-6 (2015).
- Diekmann, R., et al. Optimizing imaging speed and excitation intensity for single molecule localization microscopy. Nature Methods. 17 (9), 909(2020).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-dimensional super-resolution imaging by stochastic optical reconstruction microscopy. Science. 319 (5864), 810-813 (2008).
- Phillips, C. M., McDonald, K. L., Dernburg, A. F. Cytological analysis of meiosis in Caenorhabditis elegans. Methods in Molecular Biology. 558, 171-195 (2009).
- Edgar, L. G. Blastomere culture and analysis. Methods in Cell Biology. 48, 303-321 (1995).
- MacQueen, A. J., et al. Chromosome sites play dual roles to establish homologous synapsis during meiosis in C. elegans. Cell. 123 (6), 1037-1050 (2005).
- Stehr, F., Stein, J., Schueder, F., Schwille, P., Jungmann, R. Flat-top TIRF illumination boosts DNA-PAINT imaging and quantification. Nature Communications. 10 (1), 1-8 (2019).
- Hoess, P., Mund, M., Reitberger, M., Ries, J. Dual-color and 3D super-resolution microscopy of multi-protein assemblies. Methods in Molecular Biology. 1764, 237-251 (2018).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer Control of microscopes using µManager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Edelstein, A. D., et al. Advanced methods of microscope control using µManager software. Journal of Biological Methods. 1 (2), 10(2014).
- Deschamps, J., Ries, J. EMU: reconfigurable graphical user interfaces for Micro-Manager. BMC Bioinformatics. 21 (1), 1-13 (2020).
- Ries, J. SMAP: a modular super-resolution microscopy analysis platform for SMLM data. Nature Methods. 17 (9), 870-872 (2020).
- Li, Y., et al. Global fitting for high-accuracy multi-channel single-molecule localization. Nature Communications. 13 (1), 1-11 (2022).
- Nieuwenhuizen, R. P. J., et al. Measuring image resolution in optical nanoscopy. Nature Methods. 10 (6), 557-562 (2013).
- Banterle, N., Bui, K. H., Lemke, E. A., Beck, M. Fourier ring correlation as a resolution criterion for super-resolution microscopy. Journal of Structural Biology. 183 (3), 363-367 (2013).
- Preibisch, S., Saalfeld, S., Tomancak, P. Globally optimal stitching of tiled 3D microscopic image acquisitions. Bioinformatics. 25 (11), 1463-1465 (2009).
- Shi, X., Lim, J., Ha, T. Acidification of the oxygen scavenging system in single-molecule fluorescence studies: in situ sensing with a ratiometric dual-emission probe. Analytical Chemistry. 82 (14), 6132-6138 (2010).
- Olivier, N., Keller, D., Rajan, V. S., Gönczy, P., Manley, S. Simple buffers for 3D STORM microscopy. Biomedical Optics Express. 4 (6), 885-899 (2013).
- Mund, M., et al. Superresolution microscopy reveals partial preassembly and subsequent bending of the clathrin coat during endocytosis. bioRxiv. , (2022).
- Mund, M., et al. Systematic nanoscale analysis of endocytosis links efficient vesicle formation to patterned actin nucleation. Cell. 174 (4), 884-896 (2018).
- Sabinina, V. J., et al. Three-dimensional superresolution fluorescence microscopy maps the variable molecular architecture of the nuclear pore complex. Molecular Biology of the Cell. 32 (17), 1523-1533 (2021).
- Cieslinski, K., et al. Nanoscale structural organization and stoichiometry of the budding yeast kinetochore. bioRxiv. , (2021).
- Sieben, C., Banterle, N., Douglass, K. M., Gönczy, P., Manley, S. Multicolor single-particle reconstruction of protein complexes. Nature Methods. 15 (10), 777-780 (2018).
- Sarkans, U., et al. The BioStudies database—one stop shop for all data supporting a life sciences study. Nucleic Acids Research. 46, (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены