Method Article
فحص المخدرات العضوية متعددة المعلمات للورم باستخدام تصوير الخلايا الحية واسع المجال للتحليل السائب والعضوي الفردي
In This Article
Summary
يصف هذا البروتوكول طريقة شبه آلية لفحوصات الأدوية العضوية متوسطة إلى عالية الإنتاجية وبرامج تحليل الصور الآلية غير المحايدة للمجهر لتحديد وتصور استجابات الأدوية متعددة المعلمات وأحادية العضوية لالتقاط عدم التجانس داخل الورم.
Abstract
تحمل عضويات الورم المشتقة من المريض (PDTOs) وعدا كبيرا للبحوث قبل السريرية والانتقالية والتنبؤ باستجابة علاج المريض من فحوصات الأدوية خارج الجسم الحي . ومع ذلك ، فإن فحوصات فحص الأدوية الحالية القائمة على أدينوسين ثلاثي الفوسفات (ATP) لا تلتقط تعقيد استجابة الدواء (تثبيط الخلايا أو السامة للخلايا) وعدم التجانس داخل الورم الذي ثبت أنه يتم الاحتفاظ به في PDTOs بسبب قراءات بالجملة. يعد التصوير بالخلايا الحية أداة قوية للتغلب على هذه المشكلة وتصور استجابات الأدوية بشكل أكثر تعمقا. ومع ذلك ، غالبا ما لا يتم تكييف برنامج تحليل الصور مع الأبعاد الثلاثية ل PDTOs ، أو يتطلب أصباغ صلاحية فلورية ، أو غير متوافق مع تنسيق الصفيحة الدقيقة 384 بئرا. تصف هذه الورقة منهجية شبه آلية لزرع ومعالجة وتصوير PDTOs بتنسيق عالي الإنتاجية ، 384 بئرا باستخدام أنظمة تصوير الخلايا الحية التقليدية واسعة المجال. بالإضافة إلى ذلك ، قمنا بتطوير برنامج تحليل صور خال من علامات الجدوى لتحديد مقاييس الاستجابة للأدوية القائمة على معدل النمو والتي تعمل على تحسين قابلية التكاثر وتصحيح اختلافات معدل النمو بين خطوط PDTO المختلفة. باستخدام مقياس الاستجابة للأدوية الطبيعي ، الذي يسجل استجابة الدواء بناء على معدل النمو الطبيعي لحالة التحكم الإيجابية والسلبية ، وصبغة موت الخلايا الفلورية ، يمكن بسهولة تمييز استجابات الأدوية السامة للخلايا والمثبطة للخلايا ، مما يحسن بشكل عميق تصنيف المستجيبين وغير المستجيبين. بالإضافة إلى ذلك ، يمكن تحديد عدم تجانس الاستجابة للأدوية من خلال تحليل استجابة الدواء العضوي الأحادي لتحديد الحيوانات المستنسخة المحتملة والمقاومة. في النهاية ، تهدف هذه الطريقة إلى تحسين التنبؤ باستجابة العلاج السريري من خلال التقاط توقيع استجابة دوائية متعددة المعلمات ، والتي تشمل توقف النمو الحركي والقياس الكمي لموت الخلايا.
Introduction
في السنوات الأخيرة ، انتقل اكتشاف أدوية السرطان في المختبر ، وفحص الأدوية ، والبحوث الأساسية من استخدام نماذج السرطان التقليدية ثنائية الأبعاد (2D) مع خطوط الخلايا الخالدة إلى نماذج سرطان ثلاثية الأبعاد (3D) أكثر صلة من الناحية الفسيولوجية. وقد حفز هذا اعتماد كرويات الورم مع خطوط الخلايا السرطانية الراسخة ، والتي تعيد إنشاء تفاعلات وهياكل أكثر تعقيدا من خلية إلى خلية موجودة في الأورام الصلبة. حاليا ، تعد عضويات الورم المشتقة من المريض (PDTOs) أكثر نماذج السرطان 3D تقدما وذات الصلة من الناحية الفسيولوجية المتاحة لأبحاث السرطان في المختبر ، لأنها توفر مزايا إضافية على كرويات الورم ، وهي عدم التجانس الموجود في مرضى السرطان1. يتم إنشاء PDTOs من أنسجة الورم الناشئة عن مرضى السرطان ، وبالتالي تحتفظ بكل من النمط الظاهري للورم والنمط الجيني. على هذا النحو ، أصبحت PDTOs لا تقدر بثمن لأبحاث السرطان الأساسية والانتقالية ولديها القدرة على تحسين علم الأورام الدقيق بشكل كبير2.
على الرغم من إمكاناتها الواعدة ، غالبا ما يتم استخدام نماذج السرطان 3D المتطورة في المختبر بسبب نقص طرق التحليل المتقدمة. يحدد الفحص الأكثر استخداما عدد الخلايا القابلة للحياة في PDTO عن طريق القياس الكمي ل ATP3 داخل الخلايا. عادة ما تكون هذه المقايسات عبارة عن تحليلات مجمعة ذات نقطة زمنية واحدة ، وبالتالي تتجاهل الاستجابات الحرجة المعتمدة على الوقت وتهمل الاستجابات النسيلية. على وجه التحديد ، فإن القدرة على مراقبة نمو PDTOs (معدل النمو) واستجابتها لعلاجات محددة ذات أهمية عالية 4,5. الاستجابة الدوائية الطبيعية (NDR) ، التي تسجل استجابة الدواء بناء على معدل النمو الطبيعي إلى حالة إيجابية (ctrl +) والسيطرة السلبية (ctrl-) ، تم الإبلاغ عنها مؤخرا لتكون مقياسا حاسما لتقييم حساسية أدوية السرطان من خلال الفحص القائم على الخلايا ، على الرغم من أن هذا تم في الغالب لخطوط الخلايا ثنائية الأبعاد6. لذلك ، هناك حاجة إلى طرق تحليل أكثر تطورا للاستفادة الكاملة من نماذج السرطان 3D الأكثر تمثيلا سريريا وتعقيدا. يعتبر الفحص المجهري نهجا قويا لدراسة مدى تعقيد هذه النماذج العضوية7.
تصف هذه الورقة طريقة لمراقبة الاستجابات الدوائية الحركية في نماذج السرطان 3D ، باستخدام المجاهر التقليدية واسعة المجال وأنظمة تصوير الخلايا الحية. تم إجراء تعديلات على البروتوكول الذي وصفه Driehuis et al.4 ليكون متوافقا مع الأتمتة باستخدام روبوت ماصة ، وموزع أدوية رقمي ، ونظام تصوير الخلايا الحية لزيادة قابلية التكاثر وتقليل عدد ساعات العمل "العملية". تسمح هذه الطريقة بفحص الأدوية المتوسطة إلى العالية الإنتاجية لكل من الكرويات السرطانية ذات خطوط الخلايا السرطانية الثابتة (انظر الجدول التكميلي S1 لخطوط الخلايا المختبرة) ، بالإضافة إلى PDTOs ، في شكل صفيحة مجهرية ومتعددة الأعضاء من 384 بئرا. باستخدام عملية التعلم الآلي للشبكة التلافيفية ، يمكن إجراء التحديد الآلي وتتبع الأجسام الكروية الفردية للورم أو PDTOs فقط من التصوير الساطع وبدون استخدام أصباغ وضع العلامات على الخلايا الحية الفلورية8. هذا مفيد للغاية ، لأن معظم التعرف على التصوير الساطع يتطلب شرحا يدويا (وهو أمر شاق ويستغرق وقتا طويلا) أو يتطلب إضافة أصباغ فلورية ، والتي يمكن أن تربك الاستجابات الدوائية المتعلقةبالإجهاد التأكسدي الناجم عن الضوئية9.
يعمل برنامج تحليل الصور الناتج الذي تم تطويره داخليا على توسيع وظائف أنظمة التصوير التقليدية للخلايا الحية ، حيث أن وحدات تحليل الصور ثلاثية الأبعاد إما غير متوفرة أو مقيدة بالنظام الأساسي أو غير متوافقة مع الألواح الدقيقة ذات 384 بئرا والتصوير الكامل. بالإضافة إلى ذلك ، غالبا ما تكون هذه الوحدات باهظة الثمن وتقدم قراءات عضوية سائبة محدودة. لذلك ، فإن هذه الطريقة وثيقة الصلة بالعلماء الذين لديهم إمكانية الوصول إلى أنظمة تصوير الخلايا الحية المتاحة على نطاق واسع ويهدفون إلى استخراج المزيد من المعلومات حول استجابة الدواء مقارنة بالمعيار الذهبي ولكن الفحص البدائي القائم على ATP. مع إضافة مؤشرات محددة لموت الخلايا ، يمكن تمييز استجابات الأدوية المثبطة للخلايا عن الاستجابات السامة للخلايا ، مما يوفر مزيدا من التبصر في الإجراءات الدوائية الآلية التي لا يمكن تحقيقها حاليا من تحليل نقطة زمنية واحدة. أخيرا ، يسمح تصوير الخلايا الحية بتتبع الأعضاء الفردية للحصول على مقاييس استجابة واحدة للأدوية العضوية لالتقاط عدم تجانس الاستجابة وتحديد الحيوانات الفرعية المقاومة المحتملة.
الهدف من هذه الطريقة وبرنامج تحليل الصور المرتبط بها هو تنفيذ أتمتة منخفضة التكلفة في فحص الأدوية العضوية للحد من تدخل المستخدم وتقليل التباين في المناولة وتحليل الصور وتحليل البيانات. لجعل هذا البرنامج متاحا للباحثين ، فهو محايد للمجهر والنظام الأساسي ، ويتم توفير تطبيق قائم على السحابة. وبالتالي ، من خلال دعم أنظمة التصوير التقليدية للخلايا الحية ، نهدف أيضا إلى تحسين وظائفها لتطبيقات الزراعة 3D والتحليل.
Protocol
تم استخدام السرطانات الغدية البنكرياسية البشرية (PDAC) المشتقة من المريض. تم الحصول على شظايا استئصال الأنسجة من المرضى الذين يخضعون لجراحة علاجية في مستشفى جامعة أنتويرب. تم الحصول على موافقة خطية مستنيرة من جميع المرضى ، وتمت الموافقة على الدراسة من قبل لجنة أخلاقيات UZA (المرجع 14/47/480). يتم توفير التفاصيل المتعلقة بجميع المواد والكواشف والمعدات والبرامج المستخدمة في هذا البروتوكول في جدول المواد. يتم تقديم نظرة عامة على سير العمل في الشكل 1. يتم توفير أمثلة على البيانات في المواد التكميلية لإعادة إنتاج البروتوكول.
1. اليوم 0: تحضير المواد العضوية القديمة لمدة 2 أو 3 أيام
- سخن الألواح الدقيقة عند 37 درجة مئوية طوال الليل وقم بإذابة المصفوفة خارج الخلية (ECM) عند 4 درجات مئوية.
- قم بإعداد وسط زراعة عضوي كامل PDAC: مكمل ADF +++ (DMEM / F12 متقدم ، مكمل جلوتامين 1٪ ، 1٪ HEPES ، و 1٪ بنسلين / ستربتومايسين) مع 0.5 نانومتر بروتين بديل WNT-Fc-Fusion ، 4٪ بروتين Noggin-Fc Fusion وسط مكيف ، 4٪ Rpso3-Fc Fusion Protein وسط مكيف ، 1x B27 ، 1 mM N-acetyl cysteine (NAC) ، 5 mM نيكوتيناميد ، 500 نانومتر A83-01 ، 100 نانوغرام / مل FGF10 ، و 10 نانومتر غاسترين).
- إنشاء PDTOs وفقا لطريقة الاختيار.
ملاحظة: يتم توفير بروتوكول مفصل بواسطة Driehuis et al. ، والذي يصف الطريقة التقليدية لإنشاء وثقافة ومرور PDTOs في قباب ECM4. - فصل الأنزيمية العضوية في قباب ECM.
- نضح الوسط واغسل 1x بمحلول ملحي مخزن بالفوسفات (PBS). أضف إنزيم التفكك (على سبيل المثال ، 2 مل في صفيحة مجهرية ذات 6 آبار) وماصة لأعلى ولأسفل 10x مع ماصة 1 مل لفصل المواد العضوية وقباب ECM ميكانيكيا.
- احتضن لمدة 10 دقائق عند 37 درجة مئوية ، ماصة لأعلى ولأسفل ، وتحقق مما إذا كانت الكائنات العضوية منفصلة إلى خلايا مفردة. كرر هذه الخطوة إذا لزم الأمر.
- اجمع معلق الخلية في أنبوب سعة 15 مل ، وأضف ADF +++ إلى حجم 10 مل ، وأجهزة طرد مركزي لمدة 5 دقائق عند 450 × جم في درجة حرارة الغرفة ، واستنشاق المادة الطافية باستخدام ماصة باستور ومضخة شفط.
- أعد تعليق الحبيبات في 100-200 ميكرولتر من الوسط الكامل اعتمادا على حجم الحبيبات واحسب عدد الخلايا باستخدام طريقة الاختيار. على سبيل المثال: امزج 10 ميكرولتر من تعليق الخلية + 10 ميكرولتر من Trypan Blue وعد باستخدام عداد خلية آلي.
- لوحة خلايا واحدة في قباب ECM.
- تمييع تعليق الخلية وإضافة 2/3 ECM وفقا للجدول 1. ماصة تصل إلى عشر قطرات 20 ميكرولتر لكل بئر في لوحة مسخنة مسبقا من 6 آبار. اقلب الطبق واحتضانه لمدة 30 دقيقة عند 37 درجة مئوية.
- تراكب مع وسيط كامل تستكمل مع 10 μM Y-27632 واحتضان لمدة 2-3 أيام في حاضنة.
ملاحظة: عادة ما تكون عشر قباب تحتوي كل منها على 75000 خلية كافية لملء صفيحة دقيقة واحدة من 384 بئرا بتركيز 200 مادة عضوية / بئر ، باستثناء الآبار الموجودة على الحافة.
2. الأيام 2 - 3: الحصاد والبذور العضوية القديمة لمدة 2 أو 3 أيام
- جمع المواد العضوية سليمة من قباب ECM.
ملاحظة: تميل المواد العضوية إلى الالتصاق بالأسطح البلاستيكية (مثل الأنابيب وأطراف الماصة). لتجنب ذلك ، يمكن شطف الأدوات البلاستيكية مسبقا باستخدام محلول ألبومين مصل البقر (BSA) / PBS بنسبة 0.1٪.- نضح الوسط وغسل 1x مع برنامج تلفزيوني. أضف 1-2 مل من محلول الحصاد العضوي البارد (4 درجات مئوية) إلى صفيحة مكونة من 6 آبار اعتمادا على عدد قباب ECM واحتضانها على الجليد على منصة اهتزاز لمدة 10 دقائق.
- ماصة لأعلى ولأسفل باستخدام ماصة سعة 1 مل لفصل قباب ECM ، واحتضانها لمدة 10 دقائق إضافية على الجليد ، وتحقق بصريا تحت المجهر مما إذا كانت ECM منفصلة أم لا.
- اختياري: إذا كان يفضل توزيع حجم أكثر اتساقا ، فقم بتصفية التعليق من خلال مصفاة خلية 70 ميكرومتر قبل الطرد المركزي.
- اجمع المواد العضوية في أنبوب سعة 15 مل مطلي مسبقا بنسبة 0.1٪ BSA / PBS ، وأضف ADF +++ حتى 10 مل ، وأجهزة طرد مركزي لمدة 5 دقائق عند 200 × جم عند 4 درجات مئوية. قم بشفط المادة الطافية وأعد تعليق الحبيبات بما يصل إلى 1,000 ميكرولتر من وسط عضوي PDAC كامل اعتمادا على حجم الحبيبات للحصول على تركيز >6,000 عضوي / مل.
- عد الكائنات العضوية باستخدام أي طريقة عد من اختيارك ، ويفضل أن تكون طريقة قائمة على الصور.
- بذرة المواد العضوية.
ملاحظة: انظر جدول المواد لمعرفة الحد الأدنى للحجم /البئر لنوعين مختلفين من الألواح الدقيقة المكونة من 384 بئرا المستخدمة في هذا البروتوكول.- قم بتبريد جميع الأدوات البلاستيكية عند -20 درجة مئوية أو على الثلج لمدة 20 دقيقة على الأقل قبل الاستخدام لتجنب تصلب ECM.
- قم بإعداد محلول البذر من 1 مل من محلول المخزون العضوي (الخطوة 2.1.6) باستخدام الوسط الكامل للبذرة ~ 200 مادة عضوية لكل بئر في 50 ميكرولتر ، وهو الحد الأدنى للحجم المستخدم لملء البئر. استخدم الملف التكميلي 1 لحساب كمية محلول البذر العضوي. أضف حجما متبقيا يبلغ 1500 ميكرولتر عند استخدام خزان سعة 25 مل وماصة متعددة القنوات أو روبوت ماصة ماصة .
- بذر المواد العضوية باستخدام روبوت ماصة العينات.
ملاحظة: يجب تبريد كل من محلول البذر والصفيحة الدقيقة عند 4 درجات مئوية أثناء السحب لتجنب تصلب ECM. لذلك ، تمت طباعة خزان سعة 25 مل وحامل لوحة دقيقة 3D لاستخدامهما مع روبوت السحب الذي يمكنه الاحتفاظ بعناصر التبريد المدرجة في جدول المواد. يتم توفير ملفات STL للطباعة ثلاثية الأبعاد للأدوات المعملية المخصصة (الملف التكميلي 2 والملف التكميلي 3) وملفات JSON المخصصة لروبوت السحب (الملف التكميلي 4 والملف التكميلي 5).- صمم بروتوكول التوزيع باستخدام أداة مصمم البروتوكول عبر الإنترنت. يتم توفير مثال لملف JSON (الملف التكميلي 6) ، حيث يتم بالفعل تحميل أدوات المختبر المخصصة واستخدام ماصة p300 (Gen2) ذات ثماني قنوات مع أطراف ماصة مقابلة.
- افتح تطبيق التحكم في روبوت السحب ، وحدد البروتوكولات ، وانقر فوق استيراد ، واسحب الملف التكميلي 6 وأفلته في الحقل المعين.
- حدد البروتوكول المستورد وضع جميع أدوات المختبر، بما في ذلك عناصر التبريد والأدوات البلاستيكية، في الطوابق وفقا للتخطيط الموضح في حقل إعداد سطح السفينة . استخدم الفتحة اليسرى للخزان سعة 25 مل وعنصر التبريد كما هو موضح في الملف التكميلي 7.
- انقر فوق تشغيل البروتوكول وانتقل إلى الإعداد. افتح علامة التبويب إعداد Labware ، وانقر فوق تشغيل فحص موضع Labware ، واتبع التعليمات لمعايرة روبوت السحب إلى الجهاز الجديد.
ملاحظة: يمكن تخزين بيانات إزاحة Labware لوقت لاحق، ولكن يوصى بإجراء فحص موضع البرامج المعملية قبل كل تشغيل. - املأ الخزان سعة 25 مل (الموجود أعلى عنصر التبريد) بمحلول البذر العضوي المبرد وانقر فوق بدء التشغيل.
ملاحظة: تمتلئ الآبار العلوية والسفلية أيضا بمحلول التعليق العضوي بسبب استخدام الماصة ذات القنوات الثمانية. - جهاز طرد مركزي للصفيحة الدقيقة لمدة 1 دقيقة عند 100 × جم عند 4 درجات مئوية.
- احتضان عند 37 درجة مئوية لمدة 30 دقيقة على الأقل.
- املأ الآبار الخارجية الفارغة بما لا يقل عن 50 ميكرولتر من H2O لتجنب التبخر.
- احتضن عند 37 درجة مئوية طوال الليل لإزالة أي فقاعات في البئر يمكن أن تتداخل مع تحليل الصورة.
3. اليوم الرابع: العلاج من تعاطي المخدرات والاستغناء عن الكاشف مع موزع المخدرات الرقمي
- قم بإنشاء بروتوكول صرف الأدوية باستخدام برنامج التحكم الرقمي في موزع الأدوية.
- مرر مؤشر الماوس فوق اللوحة 1 أعلى تخطيط اللوحة ، وحدد تحرير سمات اللوحة ، واملأ نوع اللوحة: 384 بئرا ، الحجم الإضافي (ميكرولتر): 50 ، وحد DMSO (٪): 1.
- أضف السوائل بالنقر فوق الزر + بجوار السوائل. انقر نقرا مزدوجا فوق السائل الذي تم إنشاؤه حديثا وقم بتسميته ؛ حدد الفئة (القائمة على DMSO أو المائية + توين 20) والتركيز.
ملاحظة: يجب إذابة جميع الأدوية والكواشف في 100٪ DMSO أو 0.3٪ Tween-20. يمكن استخدام محلول مخزون 1-10 مللي متر ، مع مراعاة تركيز DMSO الأقصى البالغ <1٪. يقدم الجدول 2 أمثلة على التخفيفات المطلوبة للكواشف والعلاجات الفلورية الشائعة. - تخطيط اللوحة
- بالنسبة لمعايرة الأدوية ، حدد الآبار وانقر على المعايرة. بالنسبة للسوائل ، حدد الدواء محل الاهتمام ، واختر أعلى تركيز (على سبيل المثال ، 2000 نانومتر) ، وأقل تركيز (على سبيل المثال ، 10 نانومتر) ؛ بالنسبة للنسخ المتماثل، اختر 2 كحد أدنى، واختر نمط المعايرة بالتحليل الحجمي المطلوب.
ملاحظة: يعتمد نمط المعايرة بالتحليل الحجمي على العديد من العوامل، بما في ذلك مقدار المركب الذي يجب وضعه في لوحة واحدة، وما إذا كانت الآبار ستكون عشوائية، وعدد النسخ المتماثلة وأدوات التحكم. - للتحكم الإيجابي ، حدد ثلاثة آبار ، وانقر فوق تعيين القيمة ، واملأ 2 ميكرومتر من الستوروسبورين من مخزون 10 مللي متر في DMSO ، مما سيؤدي إلى أقصى موت للخلية.
- بالنسبة إلى Cytotox Green ، حدد جميع الآبار المستخدمة ، وانقر فوق تعيين القيمة ، وأدخل 60 نانومتر / بئر.
ملاحظة: يشير تلطيخ الفلورسنت الأخضر Cytotox إلى الخلايا التي ماتت ، وبالتالي لن تتداخل مع مراقبة الاستجابة للدواء. هنا ، لا يلزم وجود علامة فلورية للخلايا الحية. - للتحكم السلبي وتطبيع DMSO ، حدد جميع الآبار مع أربعة آبار إضافية للتحكم في السيارة ، وانقر بزر الماوس الأيمن ، وحدد التطبيع ، وحدد تطبيع فئة السوائل: المستندة إلى DMSO ، وقم بالتطبيع إلى أعلى حجم فئة للحصول على تركيز DMSO متساو في كل بئر.
ملاحظة: يجب أن تكون تركيزات DMSO <1٪. يتم توفير مثال على ملف معايرة الأدوية TDD (الملف التكميلي 8). - انقر فوق السهم الموجود أسفل Run في الزاوية اليسرى العليا ، وحدد المحاكاة دائما ، وانقر فوق محاكاة لتحديد أي أخطاء والحصول على أحجام كل دواء ليتم تحضيره.
ملاحظة: للتغلب على تحذير عندما يكون حجم التوزيع الأولي منخفضا جدا، "يوصى باستخدام بئر تحذير الاستغناء عن 30 nL أو أكثر لكل سائل على كل لوحة"، حدد بئرين على الحافة مملوءتين بالماء، وحدد Set Value، وأدخل 10 ميكرومتر من الدواء الذي يحدث التحذير من أجله. هذا يهيئ خرطوشة الدواء بحجم أعلى من 30 nL. يمكن استخدام هذه الآبار نفسها لتجهيز خرطوشة DMSO عن طريق ضبط التطبيع على٪ من إجمالي قيمة الحجم (على سبيل المثال ، 0.5٪).
- بالنسبة لمعايرة الأدوية ، حدد الآبار وانقر على المعايرة. بالنسبة للسوائل ، حدد الدواء محل الاهتمام ، واختر أعلى تركيز (على سبيل المثال ، 2000 نانومتر) ، وأقل تركيز (على سبيل المثال ، 10 نانومتر) ؛ بالنسبة للنسخ المتماثل، اختر 2 كحد أدنى، واختر نمط المعايرة بالتحليل الحجمي المطلوب.
- قم بإلغاء تحديد محاكاة دائما تحت زر التشغيل ؛ انقر فوق تشغيل لبدء بروتوكول صرف الدواء واتبع التعليمات.
- ضع غشاء الختم على الصفيحة الدقيقة لمنع التبخر.
- احتضان صبغة Cytotox Green 1-2 ساعة عند 37 درجة مئوية في الحاضنة وانتقل إلى الخطوة 4.
4. الحصول على الصور باستخدام جهاز تصوير الخلايا الحية
ملاحظة: بالنسبة لمعدل النمو و NDR ، يجب الحصول على مسح في النقطة الزمنية 0 (T0 = بدء العلاج) بعد 1-2 ساعة من إضافة Cytotox Green.
- افتح برنامج التحكم في تصوير الخلية الحية ، وحدد محرر الطريقة جديد ، وانتقل إلى ملف > استيراد ، وحدد مثال ملف XML للطريقة (ملف تكميلي 9). بدلا من ذلك ، قم بإنشاء ملف جديد وحدد Plate: (CORE384fb_OpticalImaging) - Corning 384 Flat Black (Corning # 4588) ، بدون غطاء ولا كاسيت رطوبة ؛ التطبيق: الصور فقط. الهدف: 4 أضعاف؛ نمط: المركزية. تحقق من القنوات برايتفيلد والأخضر (شدة LED (٪) = 40 ؛ وقت التعرض (مللي ثانية) = 200).
ملاحظة: تعمل إعدادات القناة الخضراء بشكل جيد لتركيز 60 نانومتر Cytotox Green. يمكن استخدام خيار Live Viewer لضبط إزاحة التركيز و / أو إعدادات LED في الوقت الفعلي. - انقر فوق ابدأ لبدء المسح في T0.
- كرر الفحص كل 24 ساعة لمدة تصل إلى 5 أيام باستخدام نفس الطريقة. بدلا من ذلك، لتشغيل قياس الفاصل الزمني تلقائيا، اضبط الطريقة في برنامج التحكم في تصوير الخلايا الحية على تجربة حركية عن طريق النقر فوق علامة التبويب Kinetic Loop وسحبها إلى حقل الطريقة. وبالمثل ، يجب سحب علامات تبويب درجة الحرارة والغاز إلى حقل الطريقة لضبط النظام على 37 درجة مئوية و 5٪ CO2 لضمان الظروف الصحيحة داخل تصوير الخلية الحية أثناء التجربة.
5. تحليل الصور والبيانات
- دمج وضغط البيانات
- يقوم برنامج التحكم في تصوير الخلايا الحية بإنشاء مجلد لكل فحص في كل نقطة زمنية. أنشئ مجلدا جديدا، وانسخ مجلدات التجارب الفردية إلى هذا المجلد الأصل الجديد، وأضف _0h و _24h و _48h و _72h و _96h و _120h إلى أسماء مجلدات التجربة المقابلة.
- قم بإعداد خريطة لوحة XLSX من برنامج التحكم في موزع الأدوية الرقمي عن طريق النقر بزر الماوس الأيمن على تخطيط خريطة اللوحة من بروتوكول صرف الأدوية ونسخ جميع الآبار ؛ الصق البيانات في ملف XLSX. قم بإزالة بيانات Cytotox Green و staurosporine وأضف مصفوفة ل Cell Line و Replicate. أدخل ctrl- و ctrl+. انظر الملف التكميلي 10 للحصول على مثال لخريطة اللوحة.
- افتح أداة ضغط البيانات ، وانقر فوق تصفح ، وحدد المجلد الأصل ، وانقر فوق تشغيل لبدء ضغط بيانات الصورة. يتم ضغط جميع ملفات صور TIFF للنقاط الزمنية المختلفة في HDF5 واحد لكل بئر في مجلد مجموعات بيانات جديد داخل المجلد الأصل.
- تحليل الصور
- انتقل إلى النظام الأساسي لتطبيق الويب لتحليل الصور ، وقم بتسجيل الدخول ، وانقر فوق إضافة مشروع جديد في علامة التبويب الصفحة الرئيسية . أدخل اسم المشروع، وتابع، وحدد إضافة تجربة جديدة، وقم بتحميل مجلد مجموعات البيانات الذي يحتوي على ملفات HDF5.
- بعد التحميل ، انتقل إلى مجلد المشروع والتجربة وانقر فوق تحميل Platemap للحصول على وظائف إضافية. انقر فوق تشغيل التحليل ، وحدد تحليل متعدد الأعضاء ، والمعلمات الافتراضية ، وانقر فوق تحليل لبدء تحليل الصورة.
- انقر فوق تنزيل النتائج لتنزيل جداول البيانات الأولية التي تحتوي على قياسات كل بئر (على سبيل المثال ، إجمالي مساحة حقل السطوع ، وإجمالي المساحة الخضراء الفلورية ، وما إلى ذلك) والصور / مقاطع الفيديو المجزأة لتأكيد دقة التحليل ومعالجة البيانات الإضافية.
- مقاييس الاستجابة الدوائية القائمة على معدل النمو والاستجابة الطبيعية للأدوية
- حدد ملف Raw_NDR.xlsx من مجلد النتائج (خريطة اللوحة مطلوبة) (الملف التكميلي 11) وقم بتحميله في البرنامج النصي R Official_NDR_7point (الملف التكميلي 12) لإنشاء جداول قيم GR (تمت تسويتها إلى ctrl-) وNDR (تمت تسويتها إلى ctrl- و ctrl+) تلقائيا (الملف التكميلي 13 والملف التكميلي 14 والملف التكميلي 15 والملف التكميلي 16 ). وتحسب قيم الموارد الوراثية والأرقام غير المحايدة من المعلمة كما هو موضح في المعادلة (1) باستخدام البرنامج النصي R (الملف التكميلي 12).
إجمالي مساحة البقاء = إجمالي مساحة برايتفيلد - إجمالي المساحة الخضراء (1)
حيث 0 < NDR <1 = تأثير تثبيط الخلايا (توقف النمو) ، و NDR < 0 = الاستجابة السامة للخلايا (موت الخلية).
ملاحظة: تم اقتباس نص R من Gupta et al.6. - من الجدول clonal_data.xlsx ، استرجع بيانات الاستجابة أحادية العضوية وارسمها كمخطط فقاعة.
- استخدم العامل Z10 لتقييم جودة شاشة الدواء للتشغيل (انظر المعادلة (2)). تجاهل تجربة مع عامل Z < 0.5.
 (2)
(2)
- حدد ملف Raw_NDR.xlsx من مجلد النتائج (خريطة اللوحة مطلوبة) (الملف التكميلي 11) وقم بتحميله في البرنامج النصي R Official_NDR_7point (الملف التكميلي 12) لإنشاء جداول قيم GR (تمت تسويتها إلى ctrl-) وNDR (تمت تسويتها إلى ctrl- و ctrl+) تلقائيا (الملف التكميلي 13 والملف التكميلي 14 والملف التكميلي 15 والملف التكميلي 16 ). وتحسب قيم الموارد الوراثية والأرقام غير المحايدة من المعلمة كما هو موضح في المعادلة (1) باستخدام البرنامج النصي R (الملف التكميلي 12).
النتائج
يضمن بروتوكول السحب الآلي توزيعا متساويا ل PDTOs PDAC_060 في جميع أعمدة الصفيحة الدقيقة 384 بئرا (الشكل 2 أ). كما هو متوقع ، لوحظ تباين في عدد ومتوسط مساحة PDTOs بين الآبار (الشكل 2 أ ، ب). تجمع منطقة البقاء الإجمالية (إجمالي مساحة برايتفيلد - إجمالي المساحة الخضراء) بين تجزئة العضوية الخالية من الملصقات وإشارة موت الخلايا القائمة على التألق وهي ، في تجربتنا ، أقوى معلمة لدراسة استجابات الدواء بمرور الوقت (الشكل 2C)8. لحساب الاختلافات في بذر الخلية وحجم العضوية ، يجب استخدام المقاييس القائمة على معدل النمو لتقليل الاختلافات بين النسخ المتماثلة ، كما هو موضح في أشرطة الخطأ المخفضة في الشكل 2D مقابل الشكل 2C ، وعامل Z أعلى يشير إلى جودة شاشة الدواء المحسنة بشدة (الشكل 2E).
من الواضح أن منحنى الاستجابة للجرعة NDR (الشكل 2G) ، الذي تم تسويته إلى ctrl- و ctrl + ، يتفوق بشكل واضح على منحنى الاستجابة للجرعة GR (الشكل 2F) ، الذي تم تسويته إلى ctrl- ، لأنه يزيد من فصل منحنيات الاستجابة للدواء ويمثل بشكل أكثر دقة استجابات الأدوية السامة للخلايا. يوضح الشكل 3 مثالا على الصور المرتبطة ب ctrl- و ctrl + و 400 نانومتر gemcitabine / 80 nM paclitaxel PDTO المعالج. ملاحظة مثيرة للاهتمام هي أن التأثير السام للخلايا للجيمسيتابين كان سائدا في العلاج المركب حيث لم يلاحظ أي قيمة مضافة للباكليتاكسيل.
بعد ذلك ، تم استخدام خطين إضافيين PDTO ، PDAC_052 و PDAC_087. ولوحظ اختلاف واضح في معدل النمو بين هذه الخطوط (الشكل 4A)، مما يدعم استخدام مقاييس الموارد الوراثية. مرة أخرى ، أدت منحنيات الاستجابة للجرعة NDR (الشكل 4C) إلى زيادة النطاق الديناميكي والفصل بين المرضى الثلاثة المختلفين مقارنة بمنحنيات GR (الشكل 4B). علاوة على ذلك ، يسمح البروتوكول بتحديد NDR بمرور الوقت ويظهر أن PDAC_052 و PDAC_060 كان لديهما استجابة دوائية متشابهة جدا لتثبيط الخلايا لجرعة منخفضة من gem-pac (الشكل 4D) ، في حين يمكن ملاحظة استجابة تفاضلية واضحة للخلوي مقابل استجابة سامة للخلايا للوسط (الشكل 4E) والجرعات العالية (الشكل 4F) من gem-pac. كانت هذه الاستجابات الدوائية متسقة مع الاستجابات السريرية التي لوحظت في المرضى (الشكل 4G).
أخيرا ، تتمثل إحدى الفوائد الرئيسية للنهج والبرمجيات في أنه يمكن قياس استجابات الأدوية أحادية العضوية لدراسة عدم تجانس الاستجابة وتحديد الحيوانات المستنسخة الفرعية التي يحتمل أن تكون مقاومة. يقدم الشكل 5 نظرة عامة واضحة على الديناميات النسيلية للمرضى المختلفين ويوضح أن PDAC-087 كان لديه أكثر الحيوانات المستنسخة مقاومة بعد العلاج ، وهو ما يتوافق مع المرض العدواني والمقاوم للغاية الذي لوحظ في المريض. ومن المثير للاهتمام أن هذا المريض كان أيضا الأقل حساسية ل ctrl + staurosporin.
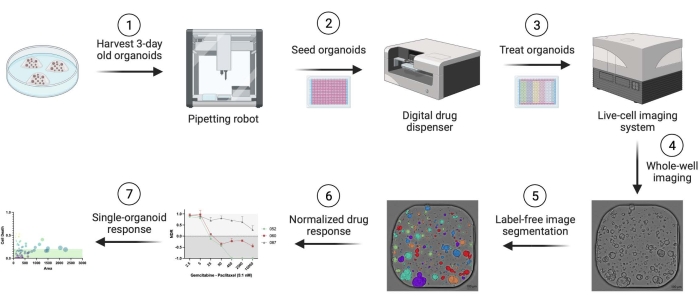
الشكل 1: نظرة عامة على سير العمل. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
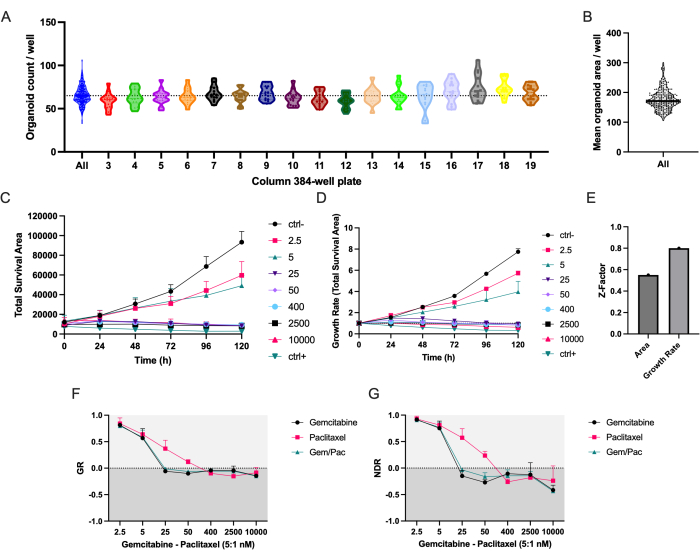
الشكل 2: دقة البذر ومقاييس الاستجابة للدواء . (أ) عدد / بئر عضوي من PDAC_060 PDTOs المصنفة في صفيحة مجهرية 384 بئرا باستخدام روبوت السحب. تمثل كل نقطة العد في بئر واحد ويتم فصل قطع الأراضي بواسطة أعمدة الألواح الدقيقة المكونة من 384 بئرا. (ب) تعني منطقة / بئر PDTO. (ج) إجمالي مساحة البقاء على قيد الحياة (إجمالي مساحة برايتفيلد - إجمالي المساحة الخضراء) و (د) معدل النمو (إجمالي مساحة البقاء على قيد الحياة الطبيعية إلى T0 = 1) من PDAC_060 PDTOs المعالجة بنسبة 5: 1 من gemcitabine / paclitaxel. (ه) عامل Z كمقياس لجودة الفحص. (F) معدل النمو - منحنى الاستجابة للجرعة الطبيعي إلى ctrl- و (G) منحنى الاستجابة للدواء الطبيعي الطبيعي إلى ctrl- و ctrl +. تشير أشرطة الخطأ إلى متوسط ± SD لبئرين. الاختصارات: PDAC = سرطان غدي البنكرياس القنوي. PDTO = ورم عضوي مشتق من المريض ؛ GR = معدل النمو ؛ NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
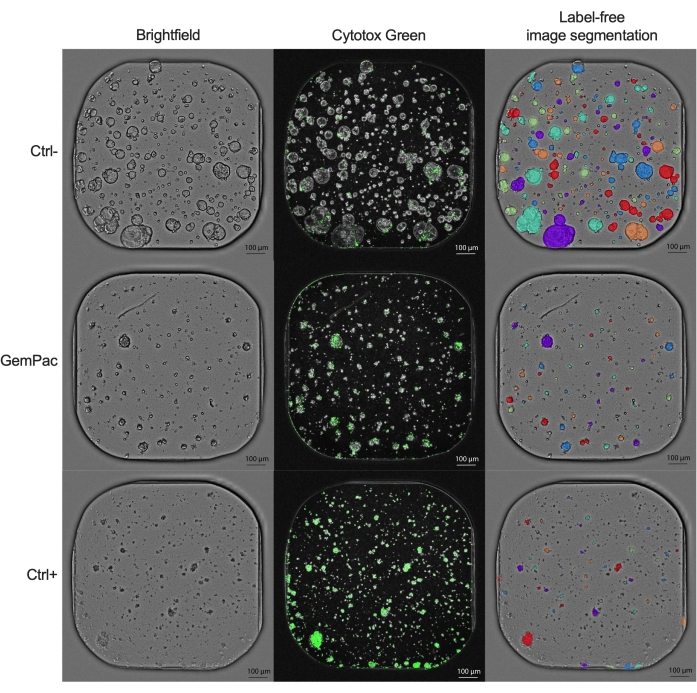
الشكل 3: أمثلة على الصور. صور تمثيلية ل PDAC_060 PDTO معالج بمركبة (ctrl-) ، 400 نانومتر جيمسيتابين / 80 نانومتر باكليتاكسيل ، و 2 ميكرومتر ستوروسبورين (ctrl+). يعرض العمود الأيسر صور برايتفيلد ، ويظهر العمود الأوسط إشارة الفلورسنت Cytotox Green ، ويعرض العمود الأيمن صور برايتفيلد المشروحة الخالية من الملصقات باستخدام وحدة التحليل العضوي. قضبان المقياس = 100 ميكرومتر. الاختصارات: PDAC = سرطان غدي البنكرياس القنوي. PDTO = ورم عضوي مشتق من المريض ؛ جيمباك = جيمسيتابين / باكليتاكسيل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
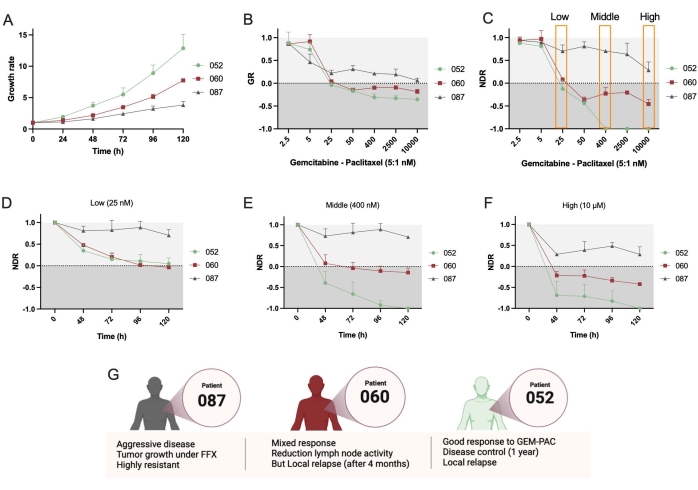
الشكل 4: مقارنة الاستجابة الدوائية للمرضى الداخليين . (أ) مقارنة معدل النمو (بناء على إجمالي مساحة البقاء على قيد الحياة) لخطوط PDAC_052 و PDAC_060 و PDAC_087 PDTO. (ب) معدل النمو - منحنى الاستجابة للجرعة الطبيعي إلى ctrl- و (C) منحنى الاستجابة للدواء الطبيعي الطبيعي إلى ctrl- و ctrl +. NDR الحركية من (D) منخفضة ، (E) متوسطة ، و (F) جرعة عالية من gemcitabine / paclitaxel (نسبة 5: 1). (ز) الخصائص السريرية لمرضى PDAC. تشير أشرطة الخطأ إلى متوسط ± SD لبئرين. الاختصارات: PDAC = سرطان غدي البنكرياس القنوي. PDTO = ورم عضوي مشتق من المريض ؛ GR = معدل النمو ؛ NDR = الاستجابة الدوائية الطبيعية ؛ FFX = فولفيرينوكس. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
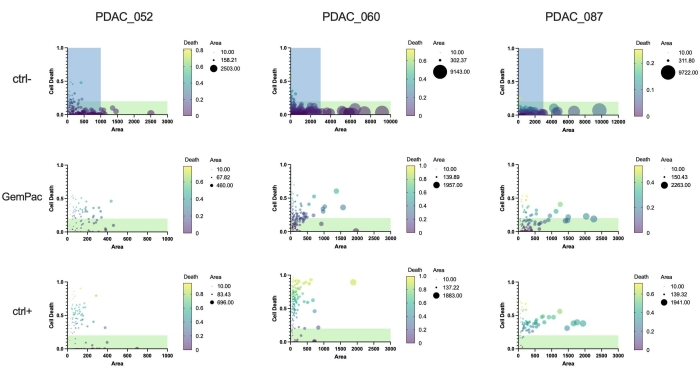
الشكل 5: مقاييس عضوية مفردة. استجابة جرعة عضوية واحدة بناء على موت الخلايا (المنطقة الخضراء / منطقة برايتفيلد) والمنطقة (برايتفيلد) من PDAC_052 و PDAC_060 و PDAC_087 PDTOs المعالجة بالمركبة (ctrl-) ، 400 نانومتر جيمسيتابين / 80 نانومتر باكليتاكسيل ، و 2 ميكرومتر ستوروسبورين (ctrl +). تشير المناطق الخضراء إلى عضويات قابلة للحياة ؛ تشير المناطق الزرقاء إلى نطاق x-as لمؤامرات GemPac و ctrl +. الاختصارات: PDAC = سرطان غدي البنكرياس القنوي. PDTO = ورم عضوي مشتق من المريض ؛ جيمباك = جيمسيتابين / باكليتاكسيل. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
| مخزون تعليق الخلية | الخلايا / قطرة | # قطرات (20 ميكرولتر) | مخزون (1/3) | إي سي إم (2/3) |
| 1.13 × 107 خلايا / مل | 75,000 | 10 | 75 ميكرولتر | 150 ميكرولتر |
| 1.13 × 107 خلايا / مل | 75,000 | 5 | 40 ميكرولتر | 80 ميكرولتر |
الجدول 1: التخفيف للطلاء في قباب ECM. اختصار: ECM = مصفوفة خارج الخلية.
| مركب | تركيز المخزون | التخفيف | تركيز العمل | المذيبات | تركيز جيد | التعليقات |
| سيتوتوكس جرين | 1 مللي متر (DMSO) | 1/10 | 10 ميكرومتر | دمسو | 60 نانومتر | علامة موت الخلية |
| سيتوتوكس الأحمر | 1 مللي متر (DMSO) | 1/10 | 10 ميكرومتر | دمسو | 250 نانومتر | علامة موت الخلية |
| كاسباس 3/7 أخضر | 5 مللي متر (DMSO) | 1/2 | 2.5 مللي متر | دمسو | 2.5 ميكرومتر | علامة موت الخلايا المبرمج |
| هويشت | 20 مللي أمبير (H2O) | 1/200 | 100 ميكرومتر | 0.33٪ توين / برنامج تلفزيوني | 50 نانومتر | علامة نووية |
| ستوروسبورين | 10 مللي واط (DMSO) | / | 1 - 10 مللي متر | / | 2 – 5 ميكرومتر | السيطرة الإيجابية |
| جيمسيتابين | 10 مللي واط (DMSO) | / | 1 - 10 مللي متر | / | معايره | العلاج الكيميائي |
| باكليتاكسيل | 10 مللي واط (DMSO) | / | 1 - 10 مللي متر | / | معايره | العلاج الكيميائي |
| سيسبلاتين | 5 مليمتر (0.9٪ كلوريد الصوديوم) | 1/2 | 2.5 مللي متر | 0.6٪ توين / برنامج تلفزيوني | معايره | العلاج الكيميائي |
الجدول 2: مثال على التخفيفات للعقاقير والكواشف الفلورية المستخدمة بكثرة. يجب إذابة كل مركب إما في 100٪ DMSO أو 0.3٪ Tween / PBS.
الجدول التكميلي S1: نظرة عامة على خطوط الخلايا السرطانية المتوافقة. ثابت: الكرويات ليست مهاجرة. دمج: تهاجر الأجسام الكروية نحو بعضها البعض وتندمج معا. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 1: أداة حساب محلول البذر العضوي. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 2: ملف STL للطباعة ثلاثية الأبعاد أدوات المختبر المخصصة "حامل الصفيحة الدقيقة". الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 3: ملف STL للطباعة ثلاثية الأبعاد أدوات المختبر المخصصة "حامل خزان 2 × 25 مل". الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 4: ملف JSON لروبوت ماصة أدوات المختبر المخصص "حامل الصفيحة الدقيقة". الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 5: ملف JSON لروبوت ماصات أدوات المختبر المخصص "2 × 25 مل خزان Holder_WithCooler". الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 6: ملف JSON لبروتوكول روبوت السحب "Plating_ PDO_384well_Cooled_Row2-23". الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 7: نظرة عامة على إعداد مكتب روبوت سحب العينات. أ: عناصر التبريد، و(ب) الخزان والصفيحة الدقيقة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 8: ملف TDD لبروتوكول موزع الأدوية الرقمي. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 9: ملف XML لبروتوكول تصوير الخلية الحية للتصوير الساطع والفلوري. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 10: مثال على خريطة اللوحة. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 11: مثال على ملف إدخال لنص NDR R. اختصار: NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 12: البرنامج النصي NDR R للاستجابة للأدوية الطبيعية. اختصار: NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 13: مثال على ملف إخراج لقيم GR النصية NDR R. الاختصارات: GR = معدل النمو ؛ NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 14: مثال على ملف إخراج البرنامج النصي NDR R مع قيم الموارد الوراثية المنقولة. الاختصارات: GR = معدل النمو ؛ NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
Sالملف التفاضي 15: مثال على ملف إخراج NDR لقيم NDR النصية NDR. اختصار: NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
الملف التكميلي 16: مثال على ملف إخراج البرنامج النصي NDR R مع قيم NDR المنقولة. اختصار: NDR = استجابة الدواء الطبيعية. الرجاء الضغط هنا لتنزيل هذا الملف.
Discussion
غالبا ما يعتمد فحص أدوية PDTO متوسط إلى عالي الإنتاجية على قراءات تستخرج جزءا صغيرا فقط من المعلومات التي يمكن أن توفرها الكائنات العضوية. لقد أصبح من الواضح بشكل متزايد أنه من أجل أن تحقق التكنولوجيا العضوية سريعة التطور إمكانات علمية وسريرية أكبر ، فإن فحوصات 3D الأكثر تقدما ، والقراءات ، وطرق التحليل مطلوبة بشدة. هنا ، يتم وصف خط أنابيب الفحص المتقدم ، والذي لا يزيد من قابلية التكاثر فحسب ، بل يعزز أيضا بشكل كبير قابلية الترجمة السريرية من خلال دمج قراءات تصوير الخلايا الحية التي تعتمد على الذكاء الاصطناعي. بالإضافة إلى برامج التحليل التي تم تطويرها داخليا ، يتم تنفيذ استخدام مقياس الاستجابة للأدوية الطبيعي (NDR) ، والذي يوضح بوضوح قدرته على تحديد الاختلافات الخاصة بالمريض في الاستجابة للعلاج6.
سيكون إدراج مقياس التطبيع هذا بلا شك ذا قيمة هائلة ، مع التذكير بأن العديد من الدراسات تهدف إلى تحديد استجابات العلاج بناء على الاختلافات الطفيفة في المنطقة الواقعة تحت المنحنى (AUC) أو التركيز المثبط نصف الأقصى (IC50) (حيث تتداخل معظم منحنيات الجرعة والاستجابة / تقع بالقرب من بعضها البعض)11,12 . تم بالفعل تنفيذ مقاييس معدل النمو في بروتوكولات فحص الأدوية العضوية باستخدام الفحص القائم على ATP ولكنها تعتمد على تطبيع الآبار المرجعية المحللة في النقطة الزمنية 04. في المقابل ، تسمح هذه الطريقة بتطبيع معدل النمو داخل البئر ، والذي لا يفسر فقط الاختلافات بين المرضى في معدل نمو PDTO ولكن أيضا الاختلافات بين الآبار الناتجة عن الاختلافات في كثافة البذر والتأثيرات المعتمدة على موقع اللوحة لزيادة التكاثر. علاوة على ذلك ، قمنا بتكييف NDR لزيادة فصل استجابة PDTO للمرضى الداخليين من خلال تضمين تحكم إيجابي للتطبيع 6,8.
علاوة على ذلك ، يمكن للتحليل ، المتوافق مع تنسيقات الإنتاجية العالية والأتمتة ، اكتشاف الاستجابات العضوية الفردية بدقة ، مما يتيح القياس الكمي للمقاومة تحت النسيلة - القوة الدافعة الرئيسية لانتكاس الورم وتقدمه13. على سبيل المثال ، على الرغم من أن PDAC052 و PDAC060 أظهرا استجابة جيدة للعلاج في المختبر (بناء على NDR) ، إلا أن التحليل العضوي الفردي الإضافي كان قادرا على اكتشاف مجموعة صغيرة (أكبر من السكان مع PDAC060) من المستنسخات الفرعية التي لا تستجيب للعلاج. ومن المثير للاهتمام ، أن هذا يتوافق بشكل كبير مع الملاحظة السريرية ، بالنظر إلى أن PDAC052 و PDAC060 كان لهما استجابة دائمة (لم يتم اكتشاف أي نشاط للورم) ولكن في النهاية تم تشخيصهما بتطور الورم المحلي (بسبب وجود استنساخ مقاوم). بالمقارنة مع قراءات 3D التقليدية (الفحص القائم على ATP والحجم / الأرقام) ، من المتوقع أن يزيد خط أنابيب الفحص المتقدم هذا من الأداء التنبئي من خلال استخراج المزيد من المعلومات ذات الصلة سريريا من هؤلاء "المرضى في المختبر". يتم الآن اختبار هذه الفرضية عن طريق فحص عينات PDTO السريرية في مختبر المؤلفين بهذه الطريقة لربط خارج الجسم الحي بالاستجابة في الجسم الحي والنتيجة السريرية.
للحصول على مزيد من الأفكار حول آليات الاستجابة الدوائية ، تتوافق كواشف التصوير الفلورية التقليدية للخلايا الحية ، بالإضافة إلى أصباغ السمية الخلوية ، مع هذه الطريقة لدراسة آليات موت الخلايا. لقد أظهرنا سابقا توافق هذه الطريقة مع الكاشف الأخضر Sartorius Caspase 3/7 لدراسة تحريض موت الخلايا المبرمج المعتمد على caspase بعد علاج سيسبلاتين8. لا يزال يتعين اختبار التوافق مع الأصباغ الأخرى لدراسة الإجهاد التأكسدي (كواشف CellOX) أو نقص الأكسجة (كواشف نقص الأكسجة Image-iT). ومع ذلك ، فقد تم بالفعل استخدام هذه الكواشف بنجاح في نماذج 3D في المختبر 14,15.
يتوافق برنامج تحليل الصور أيضا مع تنسيقات الألواح الأخرى أو طرق الزراعة (على سبيل المثال ، لوحات التجاويف الدقيقة ، وقباب ECM) إذا كان من الممكن التقاط صور واضحة ومركزة للكائنات العضوية. غالبا ما يمثل هذا تحديا للعضويات المستزرعة في القباب لأنها تنمو في مستويات z مختلفة ، الأمر الذي يتطلب وظيفة تكديس z للمجهر غير المتوفرة دائما. لذلك ، ننصح باستخدام الألواح الدقيقة ULA 384-well ذات القاع المسطح لضمان صور ذات جودة كافية.
بالإضافة إلى ذلك ، يتوافق التحليل مع أنظمة تصوير الخلايا الحية الأخرى ، كما هو موضح سابقا لصور تباين الطور الملتقطة باستخدام نظام IncuCyte ZOOM8. أحد قيود نظام تصوير الخلايا الحية Spark Cyto الذي تم استخدامه في هذه المخطوطة هو سعة اللوحة الواحدة للقياسات الحركية. ومع ذلك ، فإن توسعة Spark Motion تزيد من قدرتها إلى ما يصل إلى 40 لوحة صغيرة يمكن فحصها بكميات كبيرة. سيتم توسيع توافق البرامج التي تم تطويرها داخليا لتشمل هذه الأنظمة وغيرها لتقديم حل محايد للنظام الأساسي ، بهدف توحيد وأتمتة خطوط أنابيب تحليل الصور والبيانات. سيتضمن التطبيق المستند إلى الويب أيضا أدوات رسوم بيانية تفاعلية وحسابات آلية لقياس الأدوية ، كما هو موضح في هذه الورقة ، لتقليل وقت التحليل اليدوي.
تم تدريب خوارزمية تجزئة PDTO الخالية من الملصقات واختبارها على العديد من النماذج الكروية المزروعة داخليا و PDTO مع اختلافات مورفولوجية مميزة (صلبة ، شبه صلبة ، كيسية) ، وبالتالي يمكنها اكتشافها بدقة عالية8. أحد قيود النموذج هو أن إدراج PDTOs الكيسية زاد من الكشف غير المرغوب فيه عن الفقاعات الموجودة في البئر بعد البذر. ومع ذلك ، كانت الحضانة الليلية كافية لإزالة معظم هذه الفقاعات ، مما يسمح بمسح زمني نوعي 0. يجب التحقق من دقة تجزئة الصورة العضوية والطريقة من قبل مستخدمين آخرين ، وبناء على ملاحظاتهم ، يمكن تدريب البرنامج بشكل أكبر للحصول على خوارزمية تحليل صور قوية وآلية. بالإضافة إلى ذلك ، نهدف إلى الحصول على المزيد من البيانات السريرية لربط استجابة الدواء خارج الجسم الحي التي تم تحديدها كميا بهذه الطريقة بالاستجابة السريرية لدى المريض لتحديد أفضل المعلمات للتنبؤ باستجابة العلاج وتطوير هذه الطريقة لطب السرطان الدقيق الوظيفي16.
Disclosures
يعلن المؤلفون عدم وجود تضارب في المصالح.
Acknowledgements
تم تمويل جزء من هذا البحث من خلال تبرعات من مانحين مختلفين ، بما في ذلك Dedert Schilde vzw والسيد Willy Floren. يتم تمويل هذا العمل جزئيا من قبل مؤسسة البحوث الفلمنكية ، 12S9221N (A.L.) ، G044420N (S.V. ، A.L. ، على سبيل المثال) ، 1S27021N (M.L) ، ومن قبل صندوق البحوث الصناعية بجامعة أنتويرب ، PS ID 45151 (S.V. ، A.L. ، C.D.). تم إنشاء الشكل 1 مع BioRender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 6-well plate | Greiner | 657160 | |
| 8-Channel p300 (GEN 2) pipette | Opentrons | ||
| 300 µL Tips | Opentrons | ||
| 384-well flat-bottom ULA microplate | Corning | 4588 | minimum volume 50 µL |
| 384-well flat-bottom ULA Phenoplate | Perkin Elmer | 6057802 | minimum volume 75 µL |
| A8301 | Tocris Bioscience | 2939 | |
| ADF+++ | Advanced DMEM/F12, 1% GlutaMAX, 1% HEPES, 1% penicillin/streptomycin | ||
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634 | |
| B27 | ThermoFisher Scientific | 17504044 | |
| Breathe easy sealing membrane | Sigma-Aldrich | Z380059 | |
| Caspase 3/7 Green | Sartorius | 4440 | |
| Cell Counting Slides for TC10/TC20 | Bio-Rad Laboratories | 1450017 | |
| CellTiter-Glo 3D | Promega | G9681 | ATP-assay |
| Cooler for 25 mL reservoir | VWR (Diversified Biotech) | 490006-908 | |
| Cooling element 12 x 8 x 3 cm | Bol.com | 9200000107744702 | For custom microplate holder OT-2 |
| Cultrex Organoid Harvesting Solution | R&D systems | 3700-100-01 | |
| Cultrex PathClear Reduced Growth Factor BME, Type 2 | R&D systems | 3533-010-02 | extracellular matrix (ECM) |
| Cytotox Green | Sartorius | 4633 | |
| Cytotox Red | Sartorius | 4632 | |
| D300e | Tecan | Digital drug dispenser | |
| D300e Control v3.3.5 | Tecan | Control software D300e | |
| FGF10 | Peprotech | 100-26 | |
| Full Medium | ADF+++ supplemented with 0.5 nM WNT surrogate-Fc-Fusion protein, 4% Noggin-Fc Fusion Protein conditioned medium, 4% Rpso3-Fc Fusion Protein conditioned medium, 1x B27, 1 mM N-acetyl cysteine (NAC), 5 mM nicotinamide, 500 nM A83-01, 100 ng/mL FGF10, and 10 nM Gastrin | ||
| Gastrin | Sigma-Aldrich | G9145 | |
| Gemcitabine | Selleck Chemicals | S1714 | |
| GlutaMAX | ThermoFisher Scientific | 35050 | |
| HEPES | ThermoFisher Scientific | 15630056 | |
| Hoechst 33342 Solution (20 mM) | ThermoFisher Scientific | 62259 | |
| Human pancreatic ductal adenocarcinoma (PDAC) patient-derived organoids | Biobank@uza (Antwerp, Belgium; ID: BE71030031000; Belgian Virtual Tumorbank funded by the National Cancer Plan) | ||
| N-acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Nicotinamide | Sigma-Aldrich | N0636-100G | |
| Noggin-Fc Fusion Protein conditioned medium | Immunoprecise | N002 | |
| Opentrons App v6.0.1 | Opentrons | OT-2 control software | |
| Opentrons Protocol Designer Tool | Opentrons | https://designer.opentrons.com/ | |
| Orbits data compression tool | www.orbits-oncology.com or contact corresponding author | ||
| Orbits image analysis webapp | University of Antwerp | www.orbits-oncology.com or contact corresponding author | |
| OT-2 | Opentrons | Pipetting robot | |
| Paclitaxel | Selleck Chemicals | S1150 | |
| Pasteur Pipette 230 mm | Novolab | A33696 | |
| Peniciline-Streptomycin | ThermoFisher Scientific | 15140 | |
| Prism 9 | GraphPad | ||
| Rspo3-Fc Fusion Protein conditioned medium | Immunoprecise | N003 | |
| Spark Cyto 600 | Tecan | Live-cell imaging and multi-mode platereader | |
| SparkControl v3.1 | Tecan | Spark Cyto control software | |
| Staurosporine | Tocris Bioscience | 1285 | |
| Sterile 25 mL reservoir | VWR (Diversified Biotech) | 10141-922 | |
| T8 plus cassette | Tecan | ||
| TC20 | Bio-Rad Laboratories | automated cell counter | |
| TrypLE | ThermoFisher Scientific | 12604-021 | dissociation enzyme |
| Tween-20 | Acros Organics | 233360010 | |
| WNT Surrogate-Fc-Fusion protein | Immunoprecise | N001 | |
| Y-27632 | Selleck Chemicals | S1049 |
References
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Le Compte, M., et al. Patient-derived organoids as individual patient models for chemoradiation response prediction in gastrointestinal malignancies. Critical Reviews in Oncology/Hematology. 157, 103190(2021).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature Methods. 13 (6), 521-527 (2016).
- Gupta, A., Gautam, P., Wennerberg, K., Aittokallio, T. A normalized drug response metric improves accuracy and consistency of anticancer drug sensitivity quantification in cell-based screening. Communications Biology. 3 (1), 42(2020).
- Rios, A. C., Clevers, H. Imaging organoids: a bright future ahead. Nature Methods. 15 (1), 24-26 (2018).
- Deben, C., Cardenas, E., et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cellular Oncology. , (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), (2017).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Engel, R. M., et al. Patient-derived colorectal cancer organoids upregulate revival stem cell marker genes following chemotherapeutic treatment. Journal of Clinical Medicine. 9 (1), 128(2020).
- Hennig, A., et al. Detecting drug resistance in pancreatic cancer organoids guides optimized chemotherapy treatment. The Journal of Pathology. 257 (5), 607-619 (2022).
- D'Alterio, C., Scala, S., Sozzi, G., Roz, L., Bertolini, G. Paradoxical effects of chemotherapy on tumor relapse and metastasis promotion. Seminars in Cancer Biology. 60, 351-361 (2020).
- Njoroge, R. N., et al. Organoids model distinct Vitamin E effects at different stages of prostate cancer evolution. Scientific Reports. 7 (1), 16285(2017).
- Godet, I., et al. Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis. Nature Communications. 10 (1), 4862(2019).
- Letai, A. Functional precision cancer medicine-moving beyond pure genomics. Nature Medicine. 23 (9), 1028-1035 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved