Method Article
Toplu ve Tek-Organoid Analizi için Geniş Alan Canlı Hücre Görüntüleme Kullanılarak Multiparametrik Tümör Organoid İlaç Taraması
Bu Makalede
Özet
Bu protokol, orta ila yüksek verimli organoid ilaç taramaları için yarı otomatik bir yöntemi ve intratümör heterojenitesini yakalamak için multiparametrik, tek organoid ilaç yanıtlarını ölçmek ve görselleştirmek için mikroskoptan bağımsız, otomatik görüntü analiz yazılımını açıklamaktadır.
Özet
Hasta kaynaklı tümör organoidleri (PDTO'lar), klinik öncesi ve translasyonel araştırmalar ve ex vivo ilaç taramalarından hasta tedavisi yanıtını tahmin etmek için büyük umut vaat etmektedir. Bununla birlikte, mevcut adenozin trifosfat (ATP) bazlı ilaç tarama testleri, bir ilaç yanıtının (sitostatik veya sitotoksik) karmaşıklığını ve toplu okuma nedeniyle PDTO'larda tutulduğu gösterilen intratümör heterojenliğini yakalamaz. Canlı hücre görüntüleme, bu sorunun üstesinden gelmek ve ilaç yanıtlarını daha derinlemesine görselleştirmek için güçlü bir araçtır. Bununla birlikte, görüntü analiz yazılımı genellikle PDTO'ların üç boyutluluğuna uyarlanmaz, floresan canlılık boyaları gerektirir veya 384 kuyucuklu bir mikroplaka formatıyla uyumlu değildir. Bu makalede, PDTO'ları geleneksel, geniş alan, canlı hücre görüntüleme sistemlerini kullanarak yüksek verimli, 384 kuyucuklu bir formatta tohumlamak, işlemek ve görüntülemek için yarı otomatik bir metodoloji açıklanmaktadır. Buna ek olarak, tekrarlanabilirliği artıran ve farklı PDTO hatları arasındaki büyüme oranı varyasyonlarını düzelten büyüme hızına dayalı ilaç yanıt metriklerini ölçmek için uygulanabilirlik belirteci içermeyen görüntü analiz yazılımı geliştirdik. Pozitif ve negatif bir kontrol koşuluna normalleştirilmiş büyüme hızına ve floresan hücre ölüm boyasına göre ilaç yanıtını puanlayan normalleştirilmiş ilaç yanıtı metriği kullanılarak, sitotoksik ve sitostatik ilaç yanıtları kolayca ayırt edilebilir ve yanıt verenlerin ve yanıt vermeyenlerin sınıflandırılmasını derinden geliştirir. Ek olarak, ilaç yanıtı heterojenliği, potansiyel, dirençli klonları tanımlamak için tek organoid ilaç yanıtı analizinden ölçülebilir. Nihayetinde, bu yöntem, kinetik büyüme durması ve hücre ölümü miktarını içeren multiparametrik bir ilaç yanıtı imzası yakalayarak klinik tedavi yanıtının tahminini iyileştirmeyi amaçlamaktadır.
Giriş
Son yıllarda, in vitro kanser ilacı keşfi, ilaç taraması ve temel araştırmalar, ölümsüzleştirilmiş hücre hatlarına sahip geleneksel iki boyutlu (2D) kanser modellerinin kullanımından, fizyolojik olarak daha alakalı üç boyutlu (3D) kanser modellerine geçmektedir. Bu, katı tümörlerde bulunan daha karmaşık hücreden hücreye etkileşimleri ve yapıları yeniden yaratan yerleşik kanser hücre hatlarına sahip tümör sferoidlerinin benimsenmesini teşvik etmiştir. Şu anda, hasta kaynaklı tümör organoidleri (PDTO'lar), in vitro kanser araştırmaları için mevcut olan en gelişmiş ve fizyolojik olarak ilgili 3D kanser modelidir, çünkü tümör sferoidlerine, yani kanser hastalarında bulunan heterojenliğe göre ek avantajlar sağlarlar1. PDTO'lar kanser hastalarından kaynaklanan tümör dokusundan kurulur ve bu nedenle hem tümör fenotipini hem de genotipini korur. Bu nedenle, PDTO'lar temel ve translasyonel kanser araştırmaları için paha biçilmez hale gelmektedir ve hassas onkolojiyi büyük ölçüde geliştirme potansiyeline sahiptir2.
Umut verici potansiyellerine rağmen, bu sofistike 3D in vitro kanser modelleri, gelişmiş analiz yöntemlerinin eksikliği nedeniyle genellikle az kullanılmaktadır. En sık kullanılan tahlil, hücre içi ATP3'ün nicelleştirilmesi yoluyla PDTO'daki canlı hücrelerin sayısını belirler. Bu testler normalde tek zaman noktası, toplu analizlerdir, bu nedenle kritik zamana bağlı yanıtları görmezden gelir ve klonal yanıtları ihmal eder. Spesifik olarak, PDTO'ların büyümesini (büyüme hızı) ve spesifik tedavilere yanıtlarını izleme yeteneği yüksek ilgi çekicidir 4,5. Pozitif (ctrl+) ve negatif kontrol (ctrl-) durumuna normalleştirilmiş büyüme hızına göre ilaç yanıtını puanlayan normalleştirilmiş ilaç yanıtı (NDR), son zamanlarda hücre bazlı tarama ile kanser ilacı duyarlılığını değerlendirmek için çok önemli bir metrik olduğu bildirilmiştir, ancak bu ağırlıklı olarak 2D hücre hatları6 için yapılmıştır. Bu nedenle, bu daha klinik olarak temsili ve karmaşık 3D kanser modellerinden tam olarak yararlanmak için daha sofistike analiz yöntemlerine ihtiyaç vardır. Mikroskopi, bu organoid modellerin karmaşıklığını incelemek için güçlü bir yaklaşım olarak kabul edilir7.
Bu yazıda, 3D kanser modellerinde kinetik ilaç yanıtlarını izlemek için geleneksel geniş alan mikroskopları ve canlı hücre görüntüleme sistemleri kullanılarak bir yöntem açıklanmaktadır. Driehuis ve ark.4 tarafından tanımlanan protokole, tekrarlanabilirliği artırmak ve 'uygulamalı' çalışma saatlerinin sayısını azaltmak için bir pipetleme robotu, dijital ilaç dağıtıcısı ve canlı hücre görüntüleme sistemi kullanılarak otomasyonla uyumlu olacak şekilde uyarlamalar yapılmıştır. Bu yöntem, hem yerleşik kanser hücresi hatlarına sahip tümör sferoidlerinin (test edilmiş hücre hatları için Ek Tablo S1'e bakınız) hem de PDTO'ların 384 kuyucuklu bir mikroplaka ve çok organoid formatta orta ila yüksek verimli ilaç taramasına izin verir. Evrişimli bir ağ makine öğrenme süreci kullanılarak, bireysel tümör sferoidlerinin veya PDTO'ların otomatik olarak tanımlanması ve izlenmesi, yalnızca parlak alan görüntülemeden ve floresan canlı hücre etiketleme boyalarıkullanılmadan gerçekleştirilebilir 8. Bu oldukça avantajlıdır, çünkü parlak alan görüntüleme ile çoğu tanımlama manuel ek açıklama gerektirir (zahmetli ve zaman alıcıdır) veya fokutoksisiteye bağlı oksidatif stres ile ilgili ilaç yanıtlarını karıştırabilen floresan boyaların eklenmesini gerektirir9.
Şirket içinde geliştirilen görüntü analiz yazılımı, geleneksel canlı hücre görüntüleme sistemlerinin işlevselliğini genişletir, çünkü 3D görüntü analiz modülleri ya mevcut değildir, platform kısıtlıdır ya da 384 kuyucuklu mikroplakalar ve tam iyi görüntüleme ile uyumlu değildir. Ek olarak, bu modüller genellikle yüksek fiyatlıdır ve sınırlı toplu organoid okumaları sunar. Bu nedenle, bu yöntem, yaygın olarak bulunan canlı hücre görüntüleme sistemlerine erişimi olan ve altın standart ancak ilkel ATP tabanlı tahlillere kıyasla bir ilaç yanıtı hakkında daha fazla bilgi elde etmeyi amaçlayan bilim adamları için oldukça önemlidir. Spesifik hücre ölüm göstergelerinin eklenmesiyle, sitostatik ilaç yanıtları sitotoksik yanıtlardan ayırt edilebilir, böylece şu anda tek zaman noktası analizinden elde edilemeyen mekanik ilaç eylemleri hakkında daha fazla bilgi sağlar. Son olarak, canlı hücre görüntüleme, yanıt heterojenliğini yakalamak ve potansiyel dirençli alt klonları tanımlamak için tek organoid ilaç yanıt metrikleri elde etmek için bireysel organoid izlemeye izin verir.
Bu yöntemin ve ilgili görüntü analiz yazılımının amacı, kullanıcı müdahalesini sınırlamak ve kullanım, görüntü analizi ve veri analizindeki değişkenliği azaltmak için organoid ilaç taramasında düşük maliyetli otomasyon uygulamaktır. Bu yazılımı araştırmacıların kullanımına sunmak için mikroskop ve platformdan bağımsızdır ve bulut tabanlı bir uygulama kullanıma sunulmuştur. Bu nedenle, geleneksel canlı hücre görüntüleme sistemlerini destekleyerek, 3D kültürleme uygulamaları ve analizleri için işlevselliklerini geliştirmeyi de amaçlıyoruz.
Protokol
İnsan pankreas duktal adenokarsinomu (PDAC) hasta kaynaklı organoidler kullanıldı. Doku rezeksiyon parçaları Antwerp Üniversitesi Hastanesi'nde küratif cerrahi uygulanan hastalardan elde edildi. Tüm hastalardan yazılı bilgilendirilmiş onam alınmış ve çalışma UZA Etik Kurulu tarafından onaylanmıştır (ref. 14/47/480). Bu protokolde kullanılan tüm malzemeler, reaktifler, ekipman ve yazılımlarla ilgili ayrıntılar Malzeme Tablosunda verilmiştir. İş akışına genel bir bakış Şekil 1'de sunulmuştur. Protokolü yeniden üretmek için ek materyalde örnek veriler sağlanmıştır.
1. Gün 0: 2 veya 3 günlük organoidlerin hazırlanması
- Mikroplakaları gece boyunca 37 ° C'de önceden ısıtın ve hücre dışı matrisi (ECM) 4 ° C'de çözün.
- Tam PDAC organoid kültür ortamı hazırlayın: 0.5 nM WNT vekil-Fc-Füzyon proteini,% 4 Noggin-Fc Füzyon Proteini,% 4 Rpso3-Fc Füzyon Proteini şartlandırılmış ortam,% 4 Rpso3-Fc Füzyon Proteini şartlandırılmış ortam, 1x B27, 1 mM N-asetil sistein (NAC), 5 mM nikotinamid , 500 nM A83-01, 100 ng / mL FGF10 ve 10 nM Gastrin ile ADF + ++ (Gelişmiş DMEM / F12,% 1 glutamin takviyesi,% 1 HEPES ve% 1 penisilin / streptomisin) takviyesi.
- PDTO'ları tercih edilen yönteme göre oluşturun.
NOT: Driehuis ve ark. tarafından, ECM kubbeleri4'te PDTO'ları kurmak, kültürlemek ve geçmek için geleneksel yöntemi tanımlayan ayrıntılı bir protokol sağlanmıştır. - ECM kubbelerindeki organoidleri enzimatik olarak ayrıştırır.
- Ortamı aspire edin ve 1x'i fosfat tamponlu salin (PBS) ile yıkayın. Organoidleri ve ECM kubbelerini mekanik olarak ayırmak için ayrışma enzimi (örneğin, 6 delikli bir mikro plakada 2 mL) ve 1 mL'lik bir pipetle 10x yukarı ve aşağı pipet ekleyin.
- 37 °C'de 10 dakika boyunca inkübe edin, yukarı ve aşağı pipet yapın ve organoidlerin tek hücrelere ayrışıp ayrışmadığını kontrol edin. Gerekirse bu adımı tekrarlayın.
- Hücre süspansiyonunu 15 mL'lik bir tüpte toplayın, 10 mL'lik bir hacme ADF + ++ ekleyin, oda sıcaklığında 450 × g'da 5 dakika santrifüj yapın ve süpernatantı bir Pasteur pipet ve emme pompası ile aspire edin.
- Peletin boyutuna bağlı olarak peleti 100-200 μL tam ortamda yeniden askıya alın ve seçilen yöntemi kullanarak hücre sayısını sayın. Örneğin: 10 μL hücre süspansiyonunu + 10 μL Trypan Blue'yu karıştırın ve otomatik bir hücre sayacı ile sayın.
- ECM kubbelerinde plakalı tek hücreler.
- Hücre süspansiyonunu seyreltin ve Tablo 1'e göre 2/3 ECM ekleyin. Önceden ısıtılmış 6 delikli bir plakada kuyucuk başına on adede kadar 20 μL damlacık içeren pipet. Plakayı ters çevirin ve 37 ° C'de 30 dakika boyunca inkübe edin.
- 10 μM Y-27632 ile desteklenmiş tam orta boy ile örtün ve bir inkübatörde 2-3 gün boyunca inkübe edin.
NOT: Her biri 75.000 hücre içeren on kubbe, kenardaki kuyucuklar hariç, genellikle 200 organoid / kuyu konsantrasyonunda bir 384 delikli mikro plakayı doldurmak için yeterlidir.
2. Gün 2 - 3: 2 veya 3 günlük organoidleri hasat edin ve tohumlayın
- ECM kubbelerinden sağlam organoidleri toplayın.
NOT: Organoidler plastik yüzeylere yapışma eğilimindedir (örneğin, tüpler, pipet uçları). Bunu önlemek için, plastik eşyalar% 0.1'lik bir sığır serum albümini (BSA) / PBS çözeltisi ile prerine edilebilir.- Ortamı aspire edin ve PBS ile 1x'i yıkayın. ECM kubbelerinin sayısına bağlı olarak 6 delikli bir plakaya 1-2 mL soğuk (4 °C) organoid hasat çözeltisi ekleyin ve 10 dakika boyunca sallanan bir platformda buz üzerinde inkübe edin.
- ECM kubbelerini ayırmak için 1 mL'lik bir pipetle yukarı ve aşağı pipet, buz üzerinde 10 dakika daha inkübe edin ve ECM'nin ayrışıp ayrışmadığını mikroskop altında görsel olarak kontrol edin.
- İsteğe bağlı: Daha düzgün bir boyut dağılımı tercih edilirse, santrifüjlemeden önce süspansiyonu 70 μm'lik bir hücre süzgecinden süzün.
- Organoidleri% 0.1 BSA / PBS ile önceden kaplanmış 15 mL'lik bir tüpte toplayın, 10 mL'ye kadar ADF + ++ ekleyin ve 4 ° C'de 200 × g'de 5 dakika boyunca santrifüj yapın. Süpernatantı aspire edin ve peletin boyutuna bağlı olarak peleti 1.000 μL'ye kadar tam PDAC organoid ortamında yeniden askıya alarak >6.000 organoid / mL konsantrasyonu elde edin.
- Organoidleri, tercih edilen herhangi bir sayma yöntemini, tercihen görüntü tabanlı bir yöntemi kullanarak sayın.
- Organoidleri tohumlayın.
NOT: Bu protokolde kullanılan iki farklı tipte 384 delikli mikro plaka için minimum hacim/kuyu için Malzeme Tablosuna bakınız.- ECM'nin katılaşmasını önlemek için tüm plastik eşyaları kullanımdan önce -20 °C'de veya buz üzerinde en az 20 dakika önceden soğutun.
- Tohumlama çözeltisini 1 mL organoid stok çözeltisinden (adım 2.1.6) tam orta kullanarak hazırlayın ve bir kuyuyu doldurmak için kullanılan minimum hacim olan 50 μL'de kuyu başına ~ 200 organoid tohumlayın. Organoid tohumlama çözeltisinin miktarını hesaplamak için Ek Dosya 1'i kullanın. 25 mL'lik bir rezervuar ve çok kanallı pipet veya pipetleme robotu kullanırken 1.500 μL'lik bir artık hacim ekleyin.
- Bir pipetleme robotu kullanarak organoidleri tohumlayın.
NOT: ECM'nin katılaşmasını önlemek için pipetleme sırasında hem tohumlama çözeltisinin hem de mikro plakanın 4 °C'de soğutulması gerekir. Bu nedenle, 25 mL'lik bir rezervuar ve mikro plaka tutucu, Malzeme Tablosunda listelenen soğutma elemanlarını tutabilen pipetleme robotu ile birlikte kullanılmak üzere 3D olarak basılmıştır. Özel laboratuvar yazılımlarını 3B yazdırmak için STL dosyaları (Ek Dosya 2 ve Ek Dosya 3) ve pipetleme robotu için özel laboratuvar yazılımı JSON dosyaları (Ek Dosya 4 ve Ek Dosya 5) sağlanır.- Çevrimiçi Protokol Tasarımcısı Aracı'nı kullanarak dağıtım protokolünü tasarlayın. Özel laboratuvar gereçlerinin zaten yüklü olduğu ve karşılık gelen pipet uçlarına sahip sekiz kanallı bir p300 (Gen2) pipetinin kullanıldığı örnek bir JSON dosyası (Ek Dosya 6) sağlanmıştır.
- Pipetleme robotu kontrol uygulamasını açın, protokolleri seçin, İçe Aktar'a tıklayın ve Ek Dosya 6'yı belirtilen alana sürükleyip bırakın.
- İçe aktarılan protokolü seçin ve soğutma elemanları ve plastik eşyalar da dahil olmak üzere tüm laboratuvar gereçlerini Deck Setup (Güverte Kurulumu ) alanında gösterilen düzene göre güvertelere yerleştirin. Ek Dosya 7'de gösterildiği gibi 25 mL rezervuar ve soğutma elemanı için sol yuvayı kullanın.
- Protokolü Çalıştır'a tıklayın ve Kurulum'a devam edin. Labware Kurulumu sekmesini açın, Labware Konum Denetimini Çalıştır'a tıklayın ve pipetleme robotunu yeni donanıma kalibre etmek için talimatları izleyin.
NOT: Labware ofset verileri daha sonra saklanmak üzere saklanabilir, ancak her çalıştırmadan önce labware konum denetiminin çalıştırılması önerilir. - 25 mL'lik rezervuarı (soğutma elemanının üstüne yerleştirilmiş) soğutulmuş organoid tohumlama çözeltisiyle doldurun ve Çalıştırmayı Başlat'a tıklayın.
NOT: Üst ve alt kuyucuklar ayrıca sekiz kanallı pipet kullanımı nedeniyle organoid süspansiyon çözeltisi ile doldurulur. - Mikroplakayı 100 × g'da 4 °C'de 1 dakika boyunca santrifüj yapın.
- En az 30 dakika boyunca 37 ° C'de inkübe edin.
- Buharlaşmayı önlemek için dış boş kuyucukları en az 50 μLH2O ile doldurun.
- Görüntü analizine müdahale edebilecek kuyudaki kabarcıkları gidermek için gece boyunca 37 ° C'de inkübe edin.
3. Gün 4: Dijital ilaç dağıtıcı ile ilaç tedavisi ve reaktif dağıtımı
- Dijital ilaç dağıtıcı kontrol yazılımını kullanarak ilaç dağıtım protokolünü oluşturun.
- İmleci plaka düzeninin üzerindeki Plaka 1'in üzerine getirin, plaka özelliklerini düzenle'yi seçin ve plaka türünü doldurun: 384 kuyu, ek hacim (μL): 50 ve DMSO sınırı (%): 1.
- Sıvılar'ın yanındaki + düğmesine tıklayarak sıvı ekleyin. Yeni oluşturulan sıvıya çift tıklayın ve adlandırın; sınıfı (DMSO bazlı veya sulu + Ara 20) ve konsantrasyonu seçin.
NOT: Tüm ilaçlar ve reaktifler %100 DMSO veya %0,3 Ara-20 içinde çözülmelidir. Maksimum %<1'lik DMSO konsantrasyonu dikkate alınarak 1-10 mM'lik bir stok çözeltisi kullanılabilir. Tablo 2 , yaygın floresan reaktifleri ve tedavileri için gerekli seyreltmelere örnekler sunmaktadır. - Plaka düzeni
- İlaç titrasyonu için kuyuları seçin ve Titrasyon'a tıklayın. Sıvı için, ilgilendiğiniz ilacı seçin, en yüksek konsantrasyonu (örneğin, 2.000 nM) ve en düşük konsantrasyonu (örneğin, 10 nM) seçin; çoğaltmalar için en az 2 tane seçin ve istediğiniz titrasyon modelini seçin.
NOT: Titrasyon modeli, tek bir plakaya ne kadar bileşiğin sığdırılacağı, kuyucukların rastgele seçilip seçilmeyeceği ve replikasyon ve kontrol sayısı gibi birçok faktöre bağlı olacaktır. - Pozitif kontrol için üç kuyucuk seçin, Değer Ayarla'ya tıklayın ve DMSO'daki 10 mM stoktan 2 μM staurosporin doldurun, bu da maksimum hücre ölümüne neden olur.
- Sitotoks Yeşili için, kullanılan tüm kuyucukları seçin, Değer Ayarla'ya tıklayın ve 60 nm / kuyu girin.
NOT: Sitotoks Yeşil floresan boyaması, ölen hücreleri gösterir ve bu nedenle ilaç yanıtı izlemesine müdahale etmeyecektir. Burada, canlı hücreler için floresan işaretleyici gerekli değildir. - Negatif kontrol ve DMSO normalizasyonu için, araç kontrolü için ek dört kuyu bulunan tüm kuyuları seçin, sağ tıklayın, normalleştirmeyi seçin, sıvı sınıfını normalleştir: DMSO tabanlı ve her kuyuda eşit bir DMSO konsantrasyonu elde etmek için en yüksek sınıf hacmine normalleştirin.
NOT: DMSO konsantrasyonları %<1 olmalıdır. Örnek bir TDD ilaç titrasyon dosyası (Ek Dosya 8) verilmiştir. - Sol üst köşedeki Çalıştır'ın altındaki oka tıklayın, Her Zaman Simüle Et'i seçin ve herhangi bir hatayı tanımlamak ve hazırlanacak her ilacın hacimlerini elde etmek için Simüle Et'e tıklayın.
NOT: İlk dağıtım hacmi çok düşük olduğunda bir uyarının üstesinden gelmek için, "Her plakadaki her sıvı için 30 nL veya daha büyük Dağıtım Uyarısı kuyusu önerilir", kenarda suyla doldurulmuş iki kuyucuk seçin, Değer Ayarla'yı seçin ve uyarının gerçekleştiği ilacın 10 μM'sini girin. Bu, ilaç kartuşunu 30 nL'den daha yüksek bir hacme sahip olarak hazırlar. Aynı kuyucuklar, normalleştirmeyi toplam hacim değerinin % 'sine (örneğin, %0,5) ayarlayarak DMSO kartuşunu astarlamak için kullanılabilir.
- İlaç titrasyonu için kuyuları seçin ve Titrasyon'a tıklayın. Sıvı için, ilgilendiğiniz ilacı seçin, en yüksek konsantrasyonu (örneğin, 2.000 nM) ve en düşük konsantrasyonu (örneğin, 10 nM) seçin; çoğaltmalar için en az 2 tane seçin ve istediğiniz titrasyon modelini seçin.
- Çalıştır düğmesinin altındaki Her Zaman Simüle Et seçeneğinin işaretini kaldırın; İlaç dağıtım protokolünü başlatmak için Çalıştır'a tıklayın ve talimatları izleyin.
- Buharlaşmayı önlemek için sızdırmazlık membranını mikro plakaya uygulayın.
- Sitotoks Yeşil boyasını inkübatörde 37 °C'de 1-2 saat inkübe edin ve adım 4'e geçin.
4. Canlı hücre görüntüleyici ile görüntüler elde edin
NOT: Büyüme hızı ve NDR için, 0 zaman noktasında (T0 = tedaviye başlama) bir tarama, Sitotoks Yeşili eklendikten 1-2 saat sonra alınmalıdır.
- Canlı hücre görüntüleyici Denetim yazılımını açın, Yöntem Düzenleyicisi Yeni'yi seçin, içe aktarmak > dosyaya gidin ve örnek yöntem XML dosyasını (Ek Dosya 9) seçin. Alternatif olarak, yeni bir dosya oluşturun ve Plaka: (CORE384fb_OpticalImaging) - Corning 384 Düz Siyah (Corning #4588), Kapaksız ve Nem kaseti yok; Uygulama: Yalnızca görüntüler; Amaç: 4x; Desen: Merkez; Kontrol kanalları Brightfield ve Green (Led yoğunluğu (%) = 40; Maruz kalma süresi (ms) = 200).
NOT: Yeşil kanal ayarları 60 nM Sitotoks Yeşil konsantrasyonu için iyi çalışır. Canlı görüntüleyici seçeneği, odak ofsetini ve/veya led ayarlarını gerçek zamanlı olarak ayarlamak için kullanılabilir. - T0'da taramayı başlatmak için Başlat'a tıklayın.
- Aynı yöntemi kullanarak taramayı her 24 saatte bir 5 güne kadar tekrarlayın. Alternatif olarak, zaman atlamalı ölçümü otomatik olarak çalıştırmak için, Kinetik Döngü sekmesini tıklayıp yöntem alanına sürükleyerek canlı hücre görüntüleyici Kontrol yazılımındaki yöntemi kinetik bir deneye ayarlayın. Benzer şekilde, deney sırasında canlı hücre görüntüleyici içinde doğru koşulları sağlamak için sistemi 37 ° C ve% 5 CO2'ye ayarlamak için Sıcaklık ve Gaz sekmelerinin yöntem alanına sürüklenmesi gerekir.
5. Görüntü ve veri analizi
- Verileri birleştirme ve sıkıştırma
- Canlı hücre görüntüleyici Kontrol yazılımı, her zaman noktasında her tarama için bir klasör oluşturur. Yeni bir klasör oluşturun, tek tek deneme klasörlerini bu yeni üst klasöre kopyalayın ve ilgili deneme klasörü adlarına _0h, _24h, _48h, _72h, _96h ve _120h ekleyin.
- İlaç dağıtım protokolünden plaka haritası düzenine sağ tıklayarak dijital ilaç dağıtıcı Kontrol yazılımından bir XLSX plaka haritası hazırlayın ve tüm kuyucukları kopyalayın; verileri bir XLSX dosyasına yapıştırın. Sitotoks Yeşili ve staurosporin verilerini çıkarın ve Hücre Hattı ve Çoğaltmak için bir matris ekleyin. Ctrl ve ctrl+ girin. Örnek bir plaka haritası için Ek Dosya 10'a bakın.
- Veri Sıkıştırma Aracı'nı açın, Gözat'a tıklayın, üst klasörü seçin ve görüntü veri sıkıştırmasını başlatmak için Çalıştır'a tıklayın. Farklı zaman noktaları için tüm TIFF görüntü dosyaları, ebeveyn klasöründeki yeni bir veri kümeleri klasöründeki her kuyucuk için tek bir HDF5'e sıkıştırılır.
- Görüntü analizi
- Görüntü analizi web uygulaması platformuna gidin, giriş yapın ve Giriş sekmesinde Yeni Proje Ekle'ye tıklayın. Proje adını girin, devam edin, Yeni Deneme Ekle'yi seçin ve HDF5 dosyalarını içeren veri kümeleri klasörünü karşıya yükleyin.
- Yükledikten sonra, proje ve deneme klasörüne gidin ve ek işlevler için Platemap Yükle'ye tıklayın. Analizi Çalıştır'a tıklayın, Multi-Organoid analizi, Varsayılan Parametreler'i seçin ve görüntü analizini başlatmak için Analiz Et'e tıklayın.
- Analizin doğruluğunu ve daha fazla veri işlemeyi onaylamak için her bir kuyucuğun ölçümlerini (örneğin, toplam parlak alan alanı, toplam floresan yeşil alanı, vb.) içeren ham veri tablolarını ve bölümlere ayrılmış görüntüleri/videoları indirmek için Sonuçları İndir'e tıklayın.
- Büyüme hızına dayalı ilaç yanıtı metrikleri ve normalleştirilmiş ilaç yanıtı
- Sonuçlar klasöründen Raw_NDR.xlsx dosyasını seçin (plaka eşlemesi gerekli) (Ek Dosya 11) ve GR (ctrl- olarak normalleştirilmiş) ve NDR (ctrl- ve ctrl+ olarak normalleştirilmiş) değer tablolarını (Ek Dosya 13, Ek Dosya 14, Ek Dosya 15 ve Ek Dosya 16) otomatik olarak oluşturmak için bunu Official_NDR_7point R-betiğine (Ek Dosya 12) yükleyin ). GR ve NDR değerleri, denklem (1)'de gösterildiği gibi parametreden R-betiği (Ek Dosya 12) kullanılarak hesaplanır.
Toplam Hayatta Kalma Alanı = Toplam Parlak Alan Alanı - Toplam Yeşil Alan (1)
Burada 0 < NDR <1 = sitostatik etki (büyüme durması) ve NDR < 0 = sitotoksik yanıt (hücre ölümü).
NOT: R-script Gupta ve ark.6'dan uyarlanmıştır. - clonal_data.xlsx tablosundan, tek organoid yanıt verilerini alın ve bunları bir kabarcık grafiği olarak çizin.
- Bir koşunun ilaç tarama kalitesini değerlendirmek için Z-faktörü10'u kullanın (bkz. denklem (2)). Z faktörü < 0,5 olan bir deneyi atın.
 (2)
(2)
- Sonuçlar klasöründen Raw_NDR.xlsx dosyasını seçin (plaka eşlemesi gerekli) (Ek Dosya 11) ve GR (ctrl- olarak normalleştirilmiş) ve NDR (ctrl- ve ctrl+ olarak normalleştirilmiş) değer tablolarını (Ek Dosya 13, Ek Dosya 14, Ek Dosya 15 ve Ek Dosya 16) otomatik olarak oluşturmak için bunu Official_NDR_7point R-betiğine (Ek Dosya 12) yükleyin ). GR ve NDR değerleri, denklem (1)'de gösterildiği gibi parametreden R-betiği (Ek Dosya 12) kullanılarak hesaplanır.
Sonuçlar
Otomatik pipetleme protokolü, 384 delikli mikro plakanın tüm sütunlarında PDAC_060 PDTO'ların eşit dağılımını sağlar (Şekil 2A). Beklendiği gibi, kuyular arasında PDTO'ların sayısında ve ortalama alanında bir değişiklik gözlenmiştir (Şekil 2A,B). Toplam hayatta kalma alanı (toplam parlak alan alanı - toplam yeşil alan), etiketsiz organoid segmentasyonunu floresan bazlı hücre ölüm sinyaliyle birleştirir ve deneyimlerimize göre, zaman içinde ilaç yanıtlarını incelemek için en sağlam parametredir (Şekil 2C)8. Hücre tohumlama ve organoid boyutundaki varyasyonları hesaba katmak için, Şekil 2B'ye karşı Şekil 2C'deki azaltılmış hata çubukları ve güçlü bir şekilde iyileştirilmiş bir ilaç ekran kalitesini gösteren daha yüksek bir Z-faktörü (Şekil 2E) ile gösterildiği gibi, replikalar arasındaki varyasyonları azaltmak için büyüme hızına dayalı metrikler kullanılmalıdır.
Ctrl ve ctrl- olarak normalize edilen NDR doz-yanıt eğrisi (Şekil 2G), ilaç yanıt eğrilerinin ayrılmasını arttırdığı ve sitotoksik ilaç yanıtlarını daha doğru bir şekilde temsil ettiği için, GR doz-yanıt eğrisinden (Şekil 2F) açıkça üstündür. Ctrl-, ctrl+ ve 400 nM gemsitabin/80 nM paklitaksel ile muamele edilmiş PDTO için ilişkili görüntülerin bir örneği Şekil 3'te gösterilmiştir. İlginç bir gözlem, gemsitabinin sitotoksik etkisinin, paklitakselin katma değeri gözlenmediği için kombinasyon terapisinde baskın olmasıdır.
Daha sonra, PDAC_052 ve PDAC_087 olmak üzere iki ek PDTO hattı kullanıldı. Bu çizgiler arasındaki büyüme hızında net bir fark gözlenmiştir (Şekil 4A), bu da GR metriklerinin kullanımını desteklemektedir. Yine, NDR doz-yanıt eğrileri (Şekil 4C), GR eğrilerine kıyasla üç farklı hasta arasında artan bir dinamik aralık ve ayrılma ile sonuçlanmıştır (Şekil 4B). Ayrıca, protokol zaman içinde NDR'nin belirlenmesine izin verir ve PDAC_052 ve PDAC_060 düşük dozda gem-pac'a (Şekil 4D) çok benzer bir sitostatik ilaç yanıtına sahip olduğunu gösterirken, orta (Şekil 4E) ve yüksek dozlarda (Şekil 4F) gem-pac için açık bir diferansiyel sitostatik ve sitotoksik yanıt gözlenebilir. Bu ilaç yanıtları hastalarda gözlenen klinik yanıtlarla tutarlıydı (Şekil 4G).
Son olarak, yaklaşımın ve yazılımın önemli bir yararı, yanıt heterojenliğini incelemek ve potansiyel olarak dirençli alt klonları tanımlamak için tek organoid ilaç yanıtlarının nicelleştirilebilmesidir. Şekil 5 , farklı hastaların klonal dinamiklerine net bir genel bakış sağlar ve PDAC-087'nin tedaviden sonra en dirençli alt klonlara sahip olduğunu gösterir, bu da hastada gözlenen agresif ve yüksek dirençli hastalıkla tutarlıdır. İlginç bir şekilde, bu hasta aynı zamanda ctrl + staurosporine en az duyarlı olanıydı.
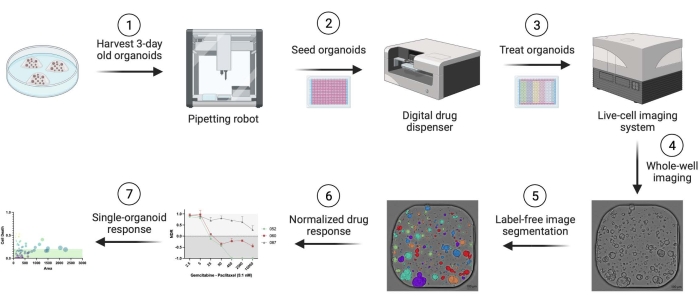
Şekil 1: İş akışına genel bakış. Bu şeklin daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
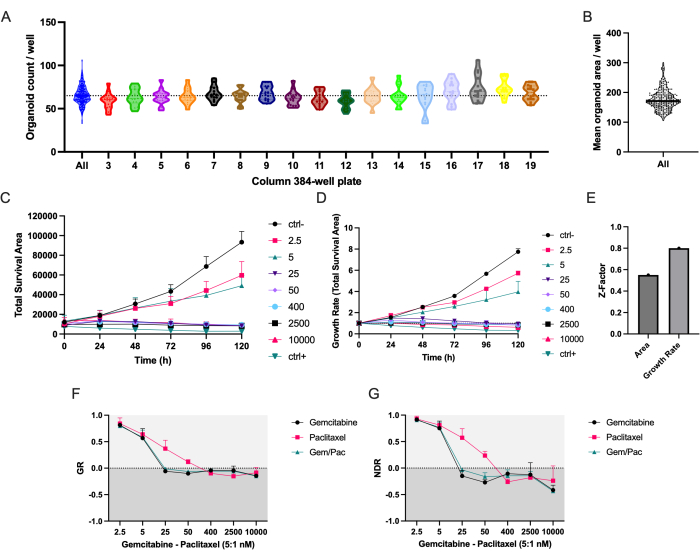
Şekil 2: Tohumlama doğruluğu ve ilaç yanıt metrikleri . (A) Pipetleme robotu kullanılarak 384 delikli bir mikro plakaya tohumlanan PDAC_060 PDTO'ların organoid sayımları/kuyusu. Her nokta, sayımı tek bir kuyucukta temsil eder ve grafikler 384 kuyucuklu mikro plaka sütunlarıyla ayrılır. (B) Ortalama PDTO alanı/kuyusu. (C) 5: 1 oranında gemsitabin / paklitaksel ile tedavi edilen PDAC_060 PDTO'ların toplam sağkalım alanı (toplam parlak alan alanı - toplam yeşil alan) ve (D) büyüme oranı (T0 = 1'e normalleştirilmiştir). (E) Tahlil kalitesi için bir metrik olarak Z-faktörü. (F) Büyüme hızı-doz yanıt eğrisi ctrl- ve (G) normalleştirilmiş ilaç yanıt eğrisi ctrl- ve ctrl- olarak normalleştirilmiştir. Hata çubukları, iki kuyucuğun ortalama ± SD'sini gösterir. Kısaltmalar: PDAC = pankreatik duktal adenokarsinom; PDTO = hasta kaynaklı tümör organoidi; GR = büyüme oranı; NDR = normalleştirilmiş ilaç yanıtı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
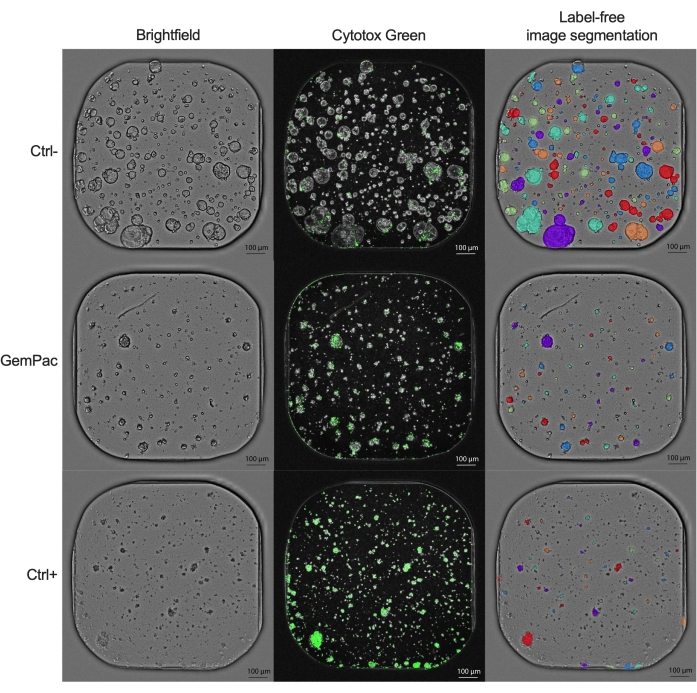
Şekil 3: Örnek görüntüler. Araç (ctrl-), 400 nM gemsitabin/80 nM paklitaksel ve 2 μM staurosporin (ctrl+) ile tedavi edilen PDAC_060 PDTO'nun temsili görüntüleri. Sol sütun parlak alan görüntülerini, orta sütun Sitotoks Yeşili floresan sinyalini ve sağ sütun organoid analiz modülünü kullanarak etiketsiz açıklamalı parlak alan görüntülerini gösterir. Ölçek çubukları = 100 μm. Kısaltmalar: PDAC = pankreatik duktal adenokarsinom; PDTO = hasta kaynaklı tümör organoidi; GemPac = gemsitabin/paklitaksel. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
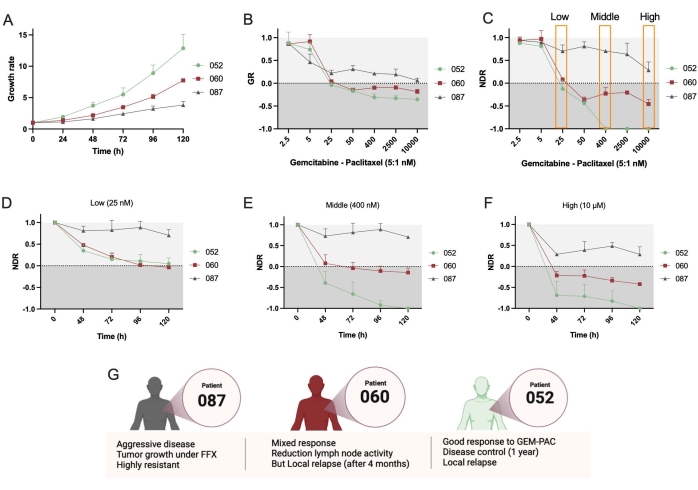
Şekil 4: Hastalar arası ilaç yanıtının karşılaştırılması . (A) PDAC_052, PDAC_060 ve PDAC_087 PDTO hatlarının büyüme hızının (toplam sağkalım alanına göre) karşılaştırılması. (B) Büyüme hızı-doz yanıt eğrisi ctrl- ve (C) normalleştirilmiş ilaç yanıt eğrisi ctrl- ve ctrl- olarak normalleştirilmiştir. Kinetik NDR'nin (D) düşük, (E) orta ve (F) yüksek dozda gemsitabin / paklitaksel (5: 1 oranı). (G) PDAC hastalarının klinik özellikleri. Hata çubukları, iki kuyucuğun ortalama ± SD'sini gösterir. Kısaltmalar: PDAC = pankreatik duktal adenokarsinom; PDTO = hasta kaynaklı tümör organoidi; GR = büyüme oranı; NDR = normalleştirilmiş ilaç yanıtı; FFX = folfirinox. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
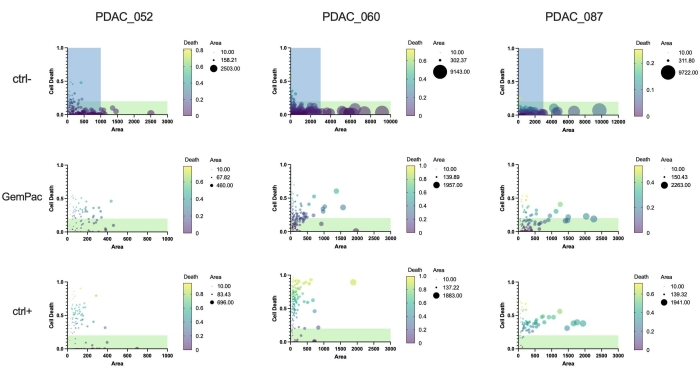
Şekil 5: Tek organoid metrikler. Tek organoid doz yanıtı, araç (ctrl-), 400 nM gemsitabin/80 nM paklitaksel ve 2 μM staurosporin (ctrl+) ile tedavi edilen PDAC_052, PDAC_060 ve PDAC_087 PDTO'ların hücre ölümüne (yeşil alan/parlak alan alanı) ve alanına (parlak alan) dayanmaktadır. Yeşil bölgeler canlı organoidleri gösterir; mavi bölgeler, GemPac ve ctrl+ grafiklerinin x-as aralığını gösterir. Kısaltmalar: PDAC = pankreatik duktal adenokarsinom; PDTO = hasta kaynaklı tümör organoidi; GemPac = gemsitabin/paklitaksel. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Hücre süspansiyon stoğu | Hücreler/Damla | # Damla (20 μL) | Stok (1/3) | ECM (2/3) |
| 1.13 × 107 hücre/mL | 75,000 | 10 | 75 uL | 150 μL |
| 1.13 × 107 hücre/mL | 75,000 | 5 | 40 uL | 80 μL |
Tablo 1: ECM kubbelerinde kaplama için seyreltme. Kısaltma: ECM = hücre dışı matris.
| Bileşik | Stok konsantrasyonu | Seyreltme | Çalışma konsantrasyonu | Çözücü | Kuyu konsantrasyonu | Yorum |
| Sitotoks Yeşil | 1 mM (DMSO) | 1/10 | 10 μM | cesaret | 60 nM | Hücre ölüm belirteci |
| Sitotoks Kırmızı | 1 mM (DMSO) | 1/10 | 10 μM | cesaret | 250 nM | Hücre ölüm belirteci |
| Kaspaz 3/7 Yeşil | 5 mM (DMSO) | 1/2 | 2,5 mM | cesaret | 2,5 μM | Apoptotik belirteç |
| Arjantin | 20 mM (Y 2O) | 1/200 | 100 μM | %0,33 Ara/PBS | 50 nM | Nükleer belirteç |
| Staurosporin | 10 mM (DMSO) | / | 1 - 10 mM | / | 2 – 5 μM | Pozitif kontrol |
| Gemsitabin | 10 mM (DMSO) | / | 1 - 10 mM | / | Titrasyon | Kemoterapi |
| Paklitaksel | 10 mM (DMSO) | / | 1 - 10 mM | / | Titrasyon | Kemoterapi |
| Cisplatin | 5 mM (%0,9 NaCl) | 1/2 | 2,5 mM | %0,6 Ara/PBS | Titrasyon | Kemoterapi |
Tablo 2: Sık kullanılan ilaçların ve floresan reaktiflerin örnek seyreltmeleri. Her bileşiğin% 100 DMSO veya% 0.3 Ara / PBS içinde çözülmesi gerekir.
Ek Tablo S1: Uyumlu kanser hücre hatlarına genel bakış. Statik: Sferoidler göçmen değildir. Birleştirme: Küreseller birbirlerine doğru göç eder ve birleşirler. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 1: Organoid tohumlama çözeltisi hesaplama aracı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 2: 3D baskı için STL dosyası özel labware 'Microplate Holder'. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 3: 3D baskı için STL dosyası özel laboratuvar yazılımı '2 x 25 mL Rezervuar Tutucu'. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 4: Özel labware pipetleme robotu 'Microplate Holder' için JSON dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 5: Özel labware pipetleme robotu '2 x 25 mL Rezervuar Holder_WithCooler' için JSON dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 6: Pipetleme robotu protokolü 'Plating_ PDO_384well_Cooled_Row2-23' için JSON dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 7: Pipetleme robot masası kurulumuna genel bakış. (A) Soğutma elemanları ve (B) rezervuar ve mikroplaka. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 8: Dijital ilaç dağıtıcısının protokolü için TDD dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 9: Parlak alan ve floresan görüntüleme için canlı hücre görüntüleyicisinin protokolü için XML dosyası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 10: Örnek plaka haritası. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 11: NDR R komut dosyası için örnek giriş dosyası. Kısaltma: NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 12: Normalleştirilmiş ilaç yanıtı NDR R betiği. Kısaltma: NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 13: NDR R komut dosyası GR değerlerinin örnek çıktı dosyası. Kısaltmalar: GR = büyüme oranı; NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 14: GR değerleri aktarılan NDR R komut dosyasının örnek çıktı dosyası. Kısaltmalar: GR = büyüme oranı; NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Stamamlayıcı Dosya 15: NDR R komut dosyası NDR değerlerinin örnek çıktı dosyası. Kısaltma: NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 16: NDR değerleri aktarılan NDR R komut dosyasının örnek çıktı dosyası. Kısaltma: NDR = normalleştirilmiş ilaç yanıtı. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Orta ila yüksek verimli PDTO ilaç taraması genellikle organoidlerin potansiyel olarak sağlayabileceği bilgilerin yalnızca bir kısmını çıkaran okumalara dayanır. Hızla gelişen organoid teknolojinin daha büyük bilimsel ve klinik potansiyeli gerçekleştirmesi için, daha gelişmiş 3D tahlillerin, okumaların ve analiz yöntemlerinin kritik olarak gerekli olduğu giderek daha açık hale gelmiştir. Burada, sadece tekrarlanabilirliği arttırmakla kalmayıp, aynı zamanda AI güdümlü, canlı hücre görüntüleme okumasını dahil ederek klinik çevrilebilirliği de önemli ölçüde artıran gelişmiş bir tarama boru hattı tanımlanmıştır. Şirket içinde geliştirilen analiz yazılımına ek olarak, normalleştirilmiş ilaç yanıt metriğinin (NDR) kullanımı uygulanmaktadır ve bu da tedavi yanıtındaki hastaya özgü farklılıkları tanımlama yeteneğini açıkça göstermektedir6.
Bu normalizasyon metriğinin dahil edilmesi, çok sayıda çalışmanın, eğrinin altındaki alandaki (AUC) veya yarı-maksimal inhibitör konsantrasyonundaki (IC50) küçük farklılıklara dayanarak tedavi yanıtlarını tanımlamayı amaçladığını hatırlatarak şüphesiz muazzam bir değere sahip olacaktır (doz-yanıt eğrilerinin çoğu birbiriyle örtüştüğü / birbirine yakın yerleştirildiği için)11,12 . Büyüme hızı metrikleri, ATP tabanlı tahlil kullanılarak organoid ilaç tarama protokollerinde zaten uygulanmıştır, ancak 04 zaman noktasında lize edilen referans kuyularının normalleştirilmesine dayanmaktadır. Buna karşılık, bu yöntem sadece PDTO büyüme hızındaki hastalar arası farklılıkları değil, aynı zamanda tekrarlanabilirliği artırmak için tohumlama yoğunluğundaki değişikliklerden ve plaka konumuna bağlı etkilerden kaynaklanan interwell farklılıklarını da hesaba katan intrawell büyüme hızı normalizasyonuna izin verir. Ayrıca, NDR'yi, normalizasyon 6,8 için pozitif bir kontrol ekleyerek hastalar arası PDTO yanıtının ayrılmasını daha da artırmak için uyarladık.
Ayrıca, yüksek verimli ve otomasyon formatlarıyla uyumlu olan analiz, bireysel organoid yanıtları doğru bir şekilde tespit edebilir ve tümör nüksünün ve progresyonunun ana itici gücü olan subklonal direncin ölçülmesini sağlar13. Örneğin, PDAC052 ve PDAC060 in vitro (NDR'ye dayanarak) tedaviye iyi bir yanıt göstermesine rağmen, ek tek organoid analiz, tedaviye cevap vermeyen küçük (PDAC060 ile daha büyük bir popülasyon) alt klon popülasyonunu tespit edebildi. İlginç bir şekilde, PDAC052 ve PDAC060'ın kalıcı bir yanıta sahip olduğu (tümör aktivitesi tespit edilmediği) ancak sonunda her ikisine de lokal tümör progresyonu teşhisi konduğu (dirençli klonların varlığı nedeniyle) göz önüne alındığında, bu klinik gözlemle yüksek oranda örtüşüyordu. Geleneksel 3D okumalarla (ATP tabanlı tahlil ve boyut / sayılar) karşılaştırıldığında, bu gelişmiş tarama boru hattının, bu 'laboratuvardaki hastalardan' klinik olarak daha alakalı bilgiler çıkararak öngörücü performansı artırması beklenmektedir. Bu hipotez şimdi ex vivo ile in vivo yanıt ve klinik sonuç arasında korelasyon sağlamak için yazarların laboratuvarında klinik PDTO örneklerinin bu yöntemle taranmasıyla test edilmektedir.
Bir ilaç yanıtının mekanizmaları hakkında daha fazla bilgi edinmek için, geleneksel floresan canlı hücre görüntüleme reaktifleri, sitotoksisite boyalarına ek olarak, hücre ölümü mekanizmalarını incelemek için bu yöntemle uyumludur. Bu yöntemin Sartorius Caspase 3/7 Yeşil Reaktif ile uyumluluğunu, sisplatin tedavisi8'i takiben apoptozun kaspaza bağımlı indüksiyonunu incelemek için daha önce göstermiştik. Oksidatif stres (CellROX reaktifleri) veya hipoksi (Image-iT Hipoksi reaktifleri) üzerinde çalışmak için diğer boyalarla uyumluluk test edilmeye devam etmektedir. Bununla birlikte, bu reaktifler14,15 in vitro modellerde 3D olarak başarıyla kullanılmıştır.
Görüntü analiz yazılımı, organoidlerin net, odak içi görüntüleri yakalanabiliyorsa, diğer plaka formatları veya kültürleme yöntemleri (örneğin, mikro boşluk plakaları, ECM kubbeleri) ile de uyumludur. Bu genellikle kubbelerde kültürlenen organoidler için zordur, çünkü farklı z-düzlemlerinde büyürler, bu da mikroskopun her zaman mevcut olmayan z-istifleme işlevselliğini gerektirir. Bu nedenle, yeterli kalitede görüntüler sağlamak için düz tabanlı ULA 384 kuyucuklu mikro plakaların kullanılmasını öneririz.
Ek olarak, analiz, daha önce bir IncuCyte ZOOM sistemi8 ile yakalanan faz kontrastlı görüntüler için gösterildiği gibi, diğer canlı hücre görüntüleme sistemleriyle uyumludur. Bu makalede kullanılan Spark Sitosu canlı hücre görüntüleme sisteminin bir sınırlaması, kinetik ölçümler için tek plakalı kapasitedir. Bununla birlikte, Spark Motion genişletme, kapasitesini toplu olarak taranabilen 40 mikro plakaya kadar artırır. Şirket içinde geliştirilen yazılımın uyumluluğu, görüntü ve veri analizi işlem hatlarını standartlaştırmak ve otomatikleştirmek amacıyla platformdan bağımsız bir çözüm sunmak için bu ve diğer sistemlere genişletilecektir. Web tabanlı uygulama ayrıca, manuel analiz süresini azaltmak için bu makalede gösterildiği gibi etkileşimli grafik araçları ve otomatik ilaç metrik hesaplamaları içerecektir.
Etiketsiz PDTO segmentasyon algoritması, farklı morfolojik farklılıklara (katı, yarı katı, kistik) sahip çeşitli şirket içi yetiştirilen küresel ve PDTO modelleri üzerinde eğitilmiş ve test edilmiştir ve sonuç olarak bunları yüksek doğrulukla tespit edebilir8. Modelin bir sınırlaması, kistik PDTO'ların dahil edilmesinin, kuyu takip eden tohumlamada bulunan kabarcıkların istenmeyen tespitini arttırmasıdır. Bununla birlikte, gece boyunca inkübasyon, bu kabarcıkların çoğunu çıkarmak için yeterliydi ve kalitatif bir zaman noktası 0 taramasına izin verdi. Organoid görüntü segmentasyonunun ve yöntemin doğruluğunun diğer kullanıcılar tarafından doğrulanması gerekir ve geri bildirimlerine dayanarak, yazılım sağlam ve otomatik bir görüntü analiz algoritması elde etmek için daha fazla eğitilebilir. Ek olarak, tedavi yanıtını tahmin etmek için en iyi parametreleri belirlemek ve fonksiyonel hassas kanser tıbbı için bu yöntemi daha da geliştirmek için bu yöntemle ölçülen ex vivo ilaç yanıtını hastadaki klinik yanıtla ilişkilendirmek için daha fazla klinik veri elde etmeyi amaçlıyoruz16.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu araştırmanın bir kısmı, Dedert Schilde vzw ve Bay Willy Floren de dahil olmak üzere farklı bağışçıların bağışlarıyla finanse edildi. Bu çalışma kısmen Flaman Araştırma Vakfı, 12S9221N (A.L.), G044420N (S.V., A.L., E.G.), 1S27021N (M.L) ve Anvers Üniversitesi Endüstriyel Araştırma Fonu, PS ID 45151 (S.V., A.L., C.D.) tarafından finanse edilmektedir. Şekil 1 , BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 6-well plate | Greiner | 657160 | |
| 8-Channel p300 (GEN 2) pipette | Opentrons | ||
| 300 µL Tips | Opentrons | ||
| 384-well flat-bottom ULA microplate | Corning | 4588 | minimum volume 50 µL |
| 384-well flat-bottom ULA Phenoplate | Perkin Elmer | 6057802 | minimum volume 75 µL |
| A8301 | Tocris Bioscience | 2939 | |
| ADF+++ | Advanced DMEM/F12, 1% GlutaMAX, 1% HEPES, 1% penicillin/streptomycin | ||
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634 | |
| B27 | ThermoFisher Scientific | 17504044 | |
| Breathe easy sealing membrane | Sigma-Aldrich | Z380059 | |
| Caspase 3/7 Green | Sartorius | 4440 | |
| Cell Counting Slides for TC10/TC20 | Bio-Rad Laboratories | 1450017 | |
| CellTiter-Glo 3D | Promega | G9681 | ATP-assay |
| Cooler for 25 mL reservoir | VWR (Diversified Biotech) | 490006-908 | |
| Cooling element 12 x 8 x 3 cm | Bol.com | 9200000107744702 | For custom microplate holder OT-2 |
| Cultrex Organoid Harvesting Solution | R&D systems | 3700-100-01 | |
| Cultrex PathClear Reduced Growth Factor BME, Type 2 | R&D systems | 3533-010-02 | extracellular matrix (ECM) |
| Cytotox Green | Sartorius | 4633 | |
| Cytotox Red | Sartorius | 4632 | |
| D300e | Tecan | Digital drug dispenser | |
| D300e Control v3.3.5 | Tecan | Control software D300e | |
| FGF10 | Peprotech | 100-26 | |
| Full Medium | ADF+++ supplemented with 0.5 nM WNT surrogate-Fc-Fusion protein, 4% Noggin-Fc Fusion Protein conditioned medium, 4% Rpso3-Fc Fusion Protein conditioned medium, 1x B27, 1 mM N-acetyl cysteine (NAC), 5 mM nicotinamide, 500 nM A83-01, 100 ng/mL FGF10, and 10 nM Gastrin | ||
| Gastrin | Sigma-Aldrich | G9145 | |
| Gemcitabine | Selleck Chemicals | S1714 | |
| GlutaMAX | ThermoFisher Scientific | 35050 | |
| HEPES | ThermoFisher Scientific | 15630056 | |
| Hoechst 33342 Solution (20 mM) | ThermoFisher Scientific | 62259 | |
| Human pancreatic ductal adenocarcinoma (PDAC) patient-derived organoids | Biobank@uza (Antwerp, Belgium; ID: BE71030031000; Belgian Virtual Tumorbank funded by the National Cancer Plan) | ||
| N-acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Nicotinamide | Sigma-Aldrich | N0636-100G | |
| Noggin-Fc Fusion Protein conditioned medium | Immunoprecise | N002 | |
| Opentrons App v6.0.1 | Opentrons | OT-2 control software | |
| Opentrons Protocol Designer Tool | Opentrons | https://designer.opentrons.com/ | |
| Orbits data compression tool | www.orbits-oncology.com or contact corresponding author | ||
| Orbits image analysis webapp | University of Antwerp | www.orbits-oncology.com or contact corresponding author | |
| OT-2 | Opentrons | Pipetting robot | |
| Paclitaxel | Selleck Chemicals | S1150 | |
| Pasteur Pipette 230 mm | Novolab | A33696 | |
| Peniciline-Streptomycin | ThermoFisher Scientific | 15140 | |
| Prism 9 | GraphPad | ||
| Rspo3-Fc Fusion Protein conditioned medium | Immunoprecise | N003 | |
| Spark Cyto 600 | Tecan | Live-cell imaging and multi-mode platereader | |
| SparkControl v3.1 | Tecan | Spark Cyto control software | |
| Staurosporine | Tocris Bioscience | 1285 | |
| Sterile 25 mL reservoir | VWR (Diversified Biotech) | 10141-922 | |
| T8 plus cassette | Tecan | ||
| TC20 | Bio-Rad Laboratories | automated cell counter | |
| TrypLE | ThermoFisher Scientific | 12604-021 | dissociation enzyme |
| Tween-20 | Acros Organics | 233360010 | |
| WNT Surrogate-Fc-Fusion protein | Immunoprecise | N001 | |
| Y-27632 | Selleck Chemicals | S1049 |
Referanslar
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Le Compte, M., et al. Patient-derived organoids as individual patient models for chemoradiation response prediction in gastrointestinal malignancies. Critical Reviews in Oncology/Hematology. 157, 103190(2021).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature Methods. 13 (6), 521-527 (2016).
- Gupta, A., Gautam, P., Wennerberg, K., Aittokallio, T. A normalized drug response metric improves accuracy and consistency of anticancer drug sensitivity quantification in cell-based screening. Communications Biology. 3 (1), 42(2020).
- Rios, A. C., Clevers, H. Imaging organoids: a bright future ahead. Nature Methods. 15 (1), 24-26 (2018).
- Deben, C., Cardenas, E., et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cellular Oncology. , (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), (2017).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Engel, R. M., et al. Patient-derived colorectal cancer organoids upregulate revival stem cell marker genes following chemotherapeutic treatment. Journal of Clinical Medicine. 9 (1), 128(2020).
- Hennig, A., et al. Detecting drug resistance in pancreatic cancer organoids guides optimized chemotherapy treatment. The Journal of Pathology. 257 (5), 607-619 (2022).
- D'Alterio, C., Scala, S., Sozzi, G., Roz, L., Bertolini, G. Paradoxical effects of chemotherapy on tumor relapse and metastasis promotion. Seminars in Cancer Biology. 60, 351-361 (2020).
- Njoroge, R. N., et al. Organoids model distinct Vitamin E effects at different stages of prostate cancer evolution. Scientific Reports. 7 (1), 16285(2017).
- Godet, I., et al. Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis. Nature Communications. 10 (1), 4862(2019).
- Letai, A. Functional precision cancer medicine-moving beyond pure genomics. Nature Medicine. 23 (9), 1028-1035 (2017).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır