Method Article
使用宽场活细胞成像进行批量和单类器官分析的多参数肿瘤类器官药物筛选
摘要
该协议描述了一种用于中高通量类器官药物筛选的半自动化方法和与显微镜无关的自动图像分析软件,以量化和可视化多参数,单类器官药物反应以捕获肿瘤内异质性。
摘要
患者来源的肿瘤类器官(PDTO)在临床前和转化研究以及预测 离体 药物筛选的患者治疗反应方面具有巨大的前景。然而,目前基于三磷酸腺苷(ATP)的药物筛选测定无法捕获药物反应(细胞抑制或细胞毒性)和肿瘤内异质性的复杂性,由于大量读数,这些异质性已被证明保留在PDTO中。活细胞成像是克服这个问题并更深入地可视化药物反应的强大工具。然而,图像分析软件通常不适应PDTO的三维性,需要荧光活性染料,或者与384孔微孔板格式不兼容。本文描述了一种半自动化方法,使用传统的宽场活细胞成像系统以高通量、384 孔格式接种、处理和成像 PDTO。此外,我们开发了无活力标记的图像分析软件,以量化基于生长速率的药物反应指标,从而提高可重复性并纠正不同PDTO系之间的生长速率变化。使用归一化药物反应指标(根据归一化为阳性和阴性对照条件的生长速率对药物反应进行评分)和荧光细胞死亡染料,可以轻松区分细胞毒性和细胞抑制药物反应,从而深刻改善应答者和无应答者的分类。此外,药物反应异质性可以通过从单类器官药物反应分析中量化来鉴定潜在的耐药克隆。最终,该方法旨在通过捕获多参数药物反应特征(包括动力学生长停滞和细胞死亡定量)来改善临床治疗反应的预测。
引言
近年来, 体外 癌症药物发现、药物筛选和基础研究已经从使用具有永生化细胞系的传统二维(2D)癌症模型过渡到更具生理相关性的三维(3D)癌症模型。这刺激了具有已建立癌细胞系的肿瘤球状体的采用,这些细胞系重建了实体瘤中存在的更复杂的细胞间相互作用和结构。目前,患者来源的肿瘤类器官(PDTO)是可用于体外癌症研究的最先进和生理相关的3D癌症模型,因为它们比肿瘤球状 体 具有额外的优势,即在癌症患者中发现的异质性1。PDTO由源自癌症患者的肿瘤组织建立,因此保留了肿瘤表型和基因型。因此,PDTO对于基础和转化癌症研究变得非常宝贵,并有可能大大提高肿瘤学的精准性2。
尽管这些复杂的3D体外癌症模型潜力巨大,但由于缺乏先进的分析方法,它们往往未得到充分利用。最常用的测定法通过细胞内ATP3的定量来确定PDTO中活细胞的数量。这些检测通常是单时间点的批量分析,因此忽略了关键的时间依赖性反应,忽略了克隆反应。具体来说,监测PDTOs生长(增长率)及其对特定疗法的反应的能力引起了人们的高度关注4,5。标准化药物反应(NDR)根据标准化为阳性(ctrl+)和阴性对照(ctrl-)条件的生长速率对药物反应进行评分,最近也有报道称,这是通过基于细胞的筛选评估癌症药物敏感性的关键指标,尽管这主要是针对2D细胞系6进行的。因此,需要更复杂的分析方法来充分利用这些更具临床代表性和更复杂的3D癌症模型。显微镜被认为是研究这些类器官模型复杂性的有力方法7。
本文描述了一种使用传统的宽场显微镜和活细胞成像系统监测3D癌症模型中动力学药物反应的方法。对Driehuis等人描述的方案进行了调整4,以与 使用移液机器人,数字药物分配器和活细胞成像系统的自动化兼容,以提高可重复性并减少"动手"劳动时间的数量。该方法允许以384孔微孔板和多类器官形式对具有已建立癌细胞系的肿瘤球状体(参见测试细胞系的 补充表S1 )以及PDTO进行中到高通量的药物筛选。通过使用卷积网络机器学习过程,可以仅通过明场成像进行单个肿瘤球状体或PDTO的自动识别和跟踪,而无需使用荧光活细胞标记染料8。这是非常有利的,因为大多数明场成像的鉴定需要手动注释(费力且耗时)或需要添加荧光染料,这可能会混淆与光毒性诱导的氧化应激相关的药物反应9。
内部开发的图像分析软件扩展了传统活细胞成像系统的功能,因为3D图像分析模块要么不可用,要么平台受限,要么与384孔微孔板和全孔成像不兼容。此外,这些模块通常价格高昂,并且提供有限的批量类器官读数。因此,与金标准但基本的基于ATP的测定相比,该方法与可以使用广泛可用的活细胞成像系统并旨在提取有关药物反应的更多信息的科学家高度相关。通过添加特定的细胞死亡指标,可以将细胞抑制药物反应与细胞毒性反应区分开来,从而进一步了解目前无法通过单时间点分析实现的机制药物作用。最后,活细胞成像允许单个类器官跟踪,以获得单个类器官药物反应指标,以捕获反应异质性并鉴定潜在的耐药亚克隆。
该方法和相关图像分析软件的目标是在类器官药物筛选中实现低成本自动化,以限制用户干预并减少处理、图像分析和数据分析的可变性。为了使该软件可供研究人员使用,它与显微镜和平台无关,并且提供了基于云的应用程序。因此,通过支持传统的活细胞成像系统,我们还旨在改进其在3D培养应用和分析中的功能。
研究方案
使用人胰腺导管腺癌(PDAC)患者来源的类器官。从安特卫普大学医院接受根治性手术的患者身上获得组织切除碎片。获得了所有患者的书面知情同意,该研究得到了UZA伦理委员会的批准(参考文献14/47/480)。与本协议中使用的所有材料、试剂、设备和软件有关的详细信息,请参见 材料表。 图 1 概述了该工作流。补充材料中提供了示例数据以重现协议。
1. 第 0 天:制备 2 或 3 天大的类器官
- 将微孔板在37°C下预热过夜,并在4°C下解冻细胞外基质(ECM)。
- 制备完整的 PDAC 类器官培养基:补充 ADF+++(高级 DMEM/F12、1% 谷氨酰胺补充剂、1% HEPES 和 1% 青霉素/链霉素)与 0.5 nM WNT 替代物-Fc-融合蛋白、4% Noggin-Fc 融合蛋白条件培养基、4% Rpso3-Fc 融合蛋白条件培养基、1x B27、1 mM N-乙酰半胱氨酸 (NAC)、5 mM 烟酰胺、500 nM A83-01、100 ng/mL FGF10 和 10 nM 胃泌素)。
- 根据选择的方法建立PDTO。
注意:Driehuis等人提供了详细的协议,其中描述了在ECM圆顶4中建立,培养和传代PDTO的常规方法。 - 酶解离ECM圆顶中的类器官。
- 吸出培养基并用磷酸盐缓冲盐水(PBS)洗涤1x。加入解离酶(例如,6 孔微孔板中的 2 mL),并用 1 mL 移液器上下移液 10 倍,以机械方式解离类器官和 ECM 圆顶。
- 在37°C孵育10分钟,上下移液,并检查类器官是否解离为单细胞。如有必要,请重复此步骤。
- 将细胞悬液收集在 15 mL 管中,加入 ADF+++ 至 10 mL 体积,在室温下以 450 × g 离心 5 分钟,并用巴斯德移液器和抽吸泵吸出上清液。
- 根据沉淀的大小将沉淀重悬于100-200μL全培养基中,并使用所选方法计数细胞数。例如:混合 10 μL 细胞悬液 + 10 μL 台盼蓝,并使用自动细胞计数仪计数。
- 在ECM圆顶中接种单个细胞。
- 稀释细胞悬液并根据 表1加入2/3 ECM。在预热的 6 孔板中每孔最多移取 10 个 20 μL 液滴。倒置板并在37°C孵育30分钟。
- 用补充有10μM Y-27632的完整培养基覆盖,并在培养箱中孵育2-3天。
注意:每个包含75,000个细胞的十个圆顶通常足以填充一个384孔微孔板,浓度为200个类器官/孔,不包括边缘的孔。
2. 第 2 - 3 天:收获并播种 2 或 3 天大的类器官
- 从ECM圆顶中收集完整的类器官。
注意:类器官倾向于粘附在塑料表面(例如,管子、移液器吸头)。为避免这种情况,塑料器皿可以用0.1%的牛血清白蛋白(BSA)/PBS溶液预冲洗。- 吸出培养基并用PBS洗涤1次。根据ECM圆顶的数量,将1-2mL冷(4°C)类器官收获溶液加入6孔板中,并在振荡平台上的冰上孵育10分钟。
- 用 1 mL 移液器上下移液以解离 ECM 圆顶,在冰上再孵育 10 分钟,并在显微镜下目视检查 ECM 是否解离。
- 可选:如果优选更均匀的尺寸分布,请在离心前通过 70 μm 细胞过滤器过滤悬浮液。
- 将类器官收集在预涂有0.1%BSA / PBS的15mL管中,加入ADF + ++至10mL,并在4°C下以200× g 离心5分钟。 吸出上清液并将沉淀重悬于多达 1,000 μL 的全 PDAC 类器官培养基中,具体取决于沉淀的大小,以获得 >6,000 个类器官/mL 的浓度。
- 使用任何选择的计数方法对类器官进行计数,最好是基于图像的方法。
- 播种类器官。
注意:有关本协议中使用的两种不同类型的384孔微孔板的最小体积/孔,请参阅 材料表 。- 使用前将所有塑料器皿在-20°C或冰上预冷至少20分钟,以避免ECM凝固。
- 使用全培养基从 1 mL 类器官储备溶液(步骤 2.1.6)制备接种溶液,在 50 μL 中每孔接种 ~200 个类器官,这是用于填充孔的最小体积。使用 补充文件1 计算类器官接种溶液的量。使用 25 mL 储液槽和多通道移液器或移液机器人时,添加 1,500 μL 的残留体积。
- 使用移液机器人播种类器官。
注意:在移液过程中,接种溶液和微孔板都需要在4°C下冷却,以避免ECM凝固。因此,3D打印了一个25 mL储液槽和微孔板支架,与移液机器人结合使用,移液机器人可以容纳材料表中列出的冷却元件。提供了用于3D打印定制实验室器皿的STL文件(补充文件2和补充文件3)和移液机器人的定制实验室器皿JSON文件(补充文件4和补充文件5)。- 使用在线方案设计器工具设计分液方案。提供了一个示例JSON文件(补充文件6),其中已经加载了定制实验室器皿,并使用了带有相应移液器吸头的八通道p300(Gen2)移液器。
- 打开移液机器人控制应用程序,选择 方案, 单击导入,然后将 补充文件6 拖放到指定字段中。
- 选择导入的实验方案,并根据 "录机设置 "字段中显示的布局将所有实验室器具(包括冷却元件和塑料器皿)放入工作台中。使用左侧插槽放置 25 mL 储液槽和冷却元件,如 补充文件 7 所示。
- 单击 运行协议 并 继续设置。打开 "实验室器皿设置"选项卡,单击 "运行实验室器皿位置检查",然后按照说明将移液机器人校准到新硬件。
注意:实验室器皿偏移数据可以存储以备后用,但建议在每次运行之前运行实验室器皿位置检查。 - 用冷却的类器官接种溶液填充 25 mL 储液槽(放置在冷却元件顶部),然后单击开始 运行。
注意:由于使用了八通道移液器,顶部和底部孔也充满了类器官悬浮液。 - 将微孔板在4°C下以100× g 离心1分钟。
- 在37°C孵育至少30分钟。
- 用至少 50 μL 的 H2O 填充外部空白孔以避免蒸发。
- 在37°C孵育过夜,以去除孔中可能干扰图像分析的任何气泡。
3. 第4天:使用数字药物分配器进行药物治疗和试剂分配
- 使用数字药物分配器控制软件创建药物分配方案。
- 将鼠标悬停在板布局上方的板 1 上,选择编辑板属性,然后填写板类型:384 孔,附加体积 (μL):50,DMSO 限制 (%):1。
- 通过单击流体旁边的 + 按钮添加流体。双击新创建的流体并命名;选择类别(DMSO基或水+吐温20)和浓度。
注意:所有药物和试剂必须溶解在100%DMSO或0.3%吐温-20中。可以使用1-10 mM储备溶液,考虑到最大DMSO浓度为<1%。 表2 提供了常见荧光试剂和疗法所需稀释度的示例。 - 板布局
- 对于药物滴定,选择孔并单击滴 定。对于 液体,选择 感兴趣的药物,选择 最高浓度 (例如,2,000 nM)和 最低浓度 (例如,10 nM);对于 重复,至少选择 2个,然后选择所需的 滴定模式。
注意:滴定模式将取决于许多因素,包括单个板中要容纳多少化合物,孔是否随机化以及重复和对照的次数。 - 对于 阳性对照,选择三个孔,单击 设置值,并从DMSO中的10mM储备液中填充2μM星形孢菌素,这将诱导最大细胞死亡。
- 对于Cytotox Green,选择所有使用的孔,单击 设置值,然后输入60 nM/孔。
注意:Cytotox Green 荧光染色指示细胞已死亡,因此不会干扰药物反应监测。在这里,不需要活细胞的荧光标记物。 - 对于阴性对照和DMSO归一化,选择所有孔,另外四个孔用于载体对照,右键单击,选择归一化,选择归一化流体类别:基于DMSO,并归一化到最高等级体积以获得每个孔中相等的DMSO浓度。
注意:DMSO浓度应为<1%。提供了一个示例TDD药物滴定文件(补充文件8)。 - 单击左上角"运行"下的箭头,选择"始终模拟",然后单击"模拟"以识别任何错误并获取要制备的每种药物的体积。
注意:要克服初始分液量过低时的警告,"建议对每块板上的每种液体分配 30 nL 或更大的警告孔",在边缘选择两个充满水的孔,选择 设置值,然后输入 10 μM 发生警告的药物。这会以高于 30 nL 的体积启动药筒。这些相同的孔可用于通过设置 归一化到总体积值的百分比 (例如,0.5%)来灌注DMSO柱。
- 对于药物滴定,选择孔并单击滴 定。对于 液体,选择 感兴趣的药物,选择 最高浓度 (例如,2,000 nM)和 最低浓度 (例如,10 nM);对于 重复,至少选择 2个,然后选择所需的 滴定模式。
- 取消检查 始终模拟 在 下面 运行 按钮;单击 "运行 "以启动药物分配方案并按照说明进行操作。
- 将密封膜涂在微孔板上以防止蒸发。
- 在培养箱中将Cytotox Green染料在37°C孵育1-2小时,然后继续步骤4。
4. 使用活细胞成像仪采集图像
注意:对于生长速率和NDR,必须在添加Cytotox Green后1-2小时在时间点0(T0 =开始治疗)进行扫描。
- 打开活细胞成像仪控制软件,选择 方法编辑器新建,转到 文件>导入,然后选择 示例方法XML文件 (补充文件9)。或者,创建一个新文件并选择 板:(CORE384fb_OpticalImaging) - 康宁 384 平黑 (康宁 #4588),无盖和无湿度盒;应用:仅图像;目标: 4 倍;图案:中央;检查通道明场和绿色(LED强度(%)= 40;曝光时间(毫秒)= 200)。
注意:绿色通道设置适用于浓度为 60 nM 的绿色细胞毒素。实时 查看器 选项可用于实时调整焦点偏移和/或 LED 设置。 - 单击 "开始 "以在 T0 处启动扫描。
- 使用相同的方法每24小时重复扫描最多5天。或者,要自动运行延时测量,请将活细胞成像仪控制软件中的方法调整为动力学实验,方法是单击动力学 循环 选项卡并将其拖动到 方法 字段中。同样,必须将 温度 和 气体 选项卡拖到 方法 字段中,将系统设置为37 °C和 5%CO2 ,以确保实验期间活细胞成像仪内的条件正确。
5. 图像和数据分析
- 合并和压缩数据
- 活细胞成像仪控制软件在每个时间点为每次扫描生成一个文件夹。创建一个新文件夹,将各个实验文件夹复制到此新的父文件夹中,并将 _0h、_24h、_48h、_72h、_96h 和 _120h 添加到相应的实验文件夹名称。
- 通过右键单击药物分配方案中的板图布局,从数字药物分配器控制软件准备XLSX 板图 并复制所有孔;将数据粘贴到 XLSX 文件中。去除Cytotox Green和星形孢菌素数据,并添加细胞系和复制的基质。输入 ctrl- 和 ctrl+。有关示例板图,请参阅 补充文件 10 。
- 打开数据压缩工具,单击浏览,选择父文件夹,然后单击运行以启动图像数据压缩。不同时间点的所有TIFF图像文件被压缩到一个HDF5中,每个孔位于父文件夹内的新数据集文件夹中。
- 图像分析
- 转到图像分析 Web 应用程序平台,登录,然后单击主页选项卡中的添加新项目。输入项目名称,继续,选择"添加新试验",然后上传包含 HDF5 文件的数据集文件夹。
- 上传后,转到 项目 和 实验文件夹 ,然后单击上传 板图 以获取其他功能。单击 运行分析, 选择多类器官分析, 默认参数,然后单击分析以启动图像 分析 。
- 单击 下载结果 以下载原始数据表,其中包含每个孔的测量值(例如,总明场面积、总荧光绿区等)和分割的图像/视频,以确认分析和进一步数据处理的准确性。
- 基于增长率的药物反应指标和标准化药物反应
- 从结果文件夹(需要板图)(补充文件 11)中选择Raw_NDR.xlsx文件并将其加载到Official_NDR_7point R 脚本(补充文件 12)中,以自动生成 GR(规范化为 ctrl-)和 NDR(规范化为 ctrl- 和 ctrl+)值表(补充文件 13、补充文件 14、补充文件 15 和补充文件 16)).GR 和 NDR 值是根据公式 (1) 中所示的参数使用 R 脚本(补充文件 12)计算得出的。
总生存面积 = 明场总面积 - 总绿地面积 (1)
其中 0 < NDR <1 = 细胞抑制效应(生长停滞),NDR < 0 = 细胞毒性反应(细胞死亡)。
注意:R脚本改编自Gupta等人6。 - 从clonal_data.xlsx表中,检索单类器官响应数据并将其绘制为气泡图。
- 使用 Z 因子10 评估运行的药物筛选质量(参见公式 (2))。放弃 Z 因子< 0.5 的实验。
 (二)
(二)
- 从结果文件夹(需要板图)(补充文件 11)中选择Raw_NDR.xlsx文件并将其加载到Official_NDR_7point R 脚本(补充文件 12)中,以自动生成 GR(规范化为 ctrl-)和 NDR(规范化为 ctrl- 和 ctrl+)值表(补充文件 13、补充文件 14、补充文件 15 和补充文件 16)).GR 和 NDR 值是根据公式 (1) 中所示的参数使用 R 脚本(补充文件 12)计算得出的。
结果
自动移液方案可确保PDAC_060个PDTO均匀分布在384孔微孔板的所有色谱柱中(图2A)。正如预期的那样,在孔之间观察到PDTO的数量和平均面积的变化(图2A,B)。总生存面积(总明场面积 - 总绿色面积)将无标记类器官分割与基于荧光的细胞死亡信号相结合,根据我们的经验,是研究药物反应随时间变化的最可靠参数(图2C)8。为了解释细胞接种和类器官大小的变化,应使用基于生长速率的指标来减少重复之间的差异,如图2D与图2C中减少的误差线所示,以及较高的Z因子表明药物筛选质量显着提高(图2E)。
NDR剂量 - 反应曲线(图2G),标准化为ctrl-和ctrl+,明显优于GR剂量 - 反应曲线(图2F),标准化为ctrl-,因为它增加了药物反应曲线的分离并更准确地表示细胞毒性药物反应。ctrl-、ctrl+和400 nM吉西他滨/80 nM紫杉醇处理的PDTO的相关图像示例如图 3所示。一个有趣的观察结果是,吉西他滨的细胞毒性作用在联合治疗中占主导地位,因为没有观察到紫杉醇的附加值。
接下来,使用了另外两条PDTO线,PDAC_052和PDAC_087。观察到这些线之间的增长率存在明显差异(图4A),这支持使用遗传资源指标。同样,与GR曲线(图4B)相比,NDR剂量反应曲线(图4C)导致三个不同患者之间的动态范围和分离增加。此外,该方案允许随着时间的推移确定 NDR,并表明 PDAC_052 和 PDAC_060 对低剂量的 gem-pac 具有非常相似的细胞抑制药物反应(图 4D),而对于中等(图 4E)和高剂量(图 4F)的 gem-pac,可以观察到明显的细胞抑制与细胞毒性反应差异。这些药物反应与在患者中观察到的临床反应一致(图4G)。
最后,该方法和软件的一个主要优点是可以量化单类器官药物反应,以研究反应异质性并鉴定潜在的耐药亚克隆。 图5 清晰地概述了不同患者的克隆动力学,并显示PDAC-087在治疗后具有最耐药的亚克隆,这与在患者中观察到的侵袭性和高度耐药性疾病一致。有趣的是,这名患者对ctrl+星形孢菌素也是最不敏感的。
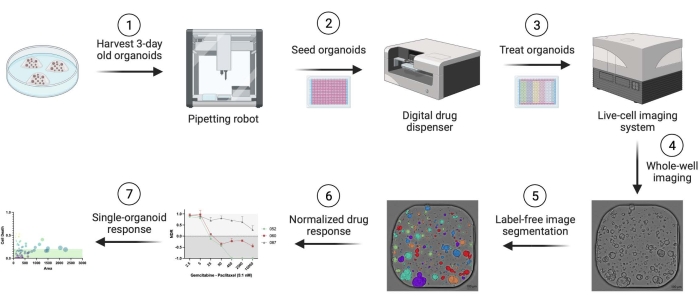
图 1:工作流概述。请单击此处查看此图的大图。
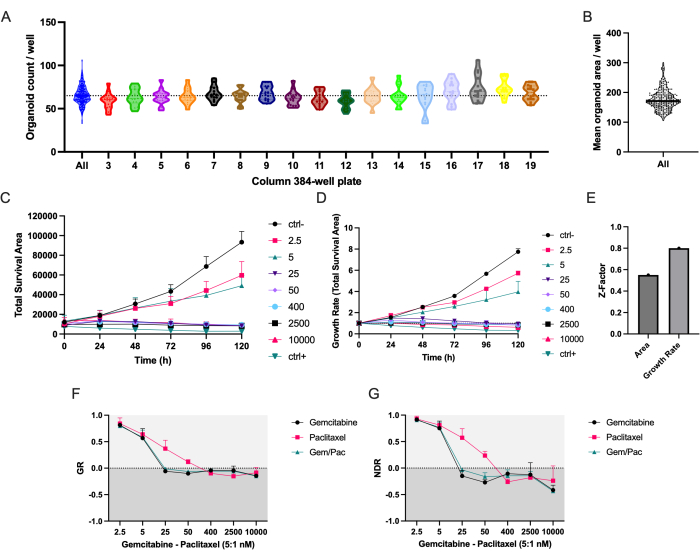
图 2:播种准确性和药物反应指标 。 (A) 使用移液机器人接种在 384 孔微孔板中的 PDAC_060 个 PDTO 的类器官计数/孔。每个点代表单个孔中的计数,图由384孔微孔板柱隔开。(B) 平均PDTO面积/井。(C)用吉西他滨/紫杉醇比例为5:1处理的PDAC_060 PDTOs的总生存面积(总明场面积-总绿地面积)和(D)生长速率(归一化为T0 = 1)。(E)Z因子作为测定质量的指标。(F)生长速率剂量反应曲线归一化为ctrl-和(G)归一化为ctrl-和ctrl+的归一化药物反应曲线。误差线表示两个孔的平均±标准偏差。缩写:PDAC = 胰腺导管腺癌;PDTO = 患者来源的肿瘤类器官;GR = 增长率;NDR = 标准化药物反应。 请点击此处查看此图的大图。
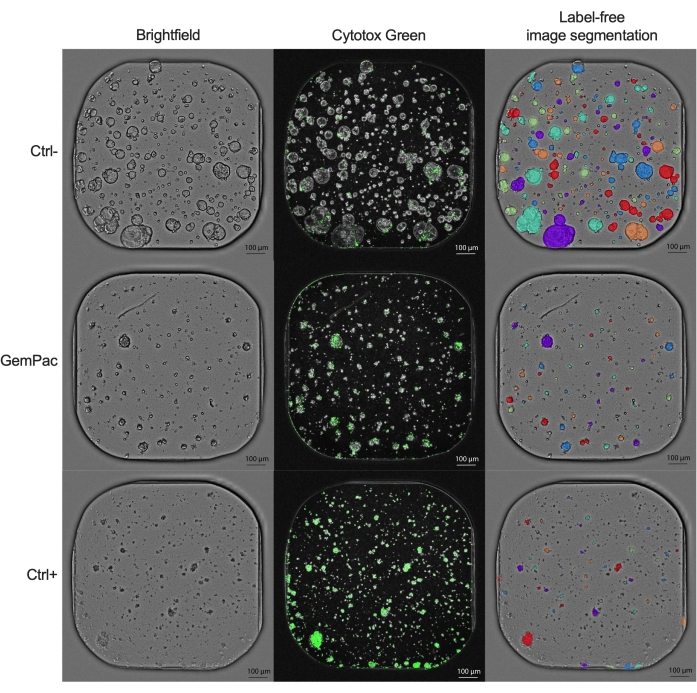
图 3:示例图像。 用载体 (ctrl-)、400 nM 吉西他滨/80 nM 紫杉醇和 2 μM 星形菌素 (ctrl+) 处理的 PDAC_060 PDTO 的代表性图像。左列显示明场图像,中间列显示Cytotox Green荧光信号,右列显示使用类器官分析模块的无标记注释明场图像。比例尺 = 100 μm。缩写:PDAC = 胰腺导管腺癌;PDTO = 患者来源的肿瘤类器官;GemPac = 吉西他滨/紫杉醇。 请点击此处查看此图的大图。
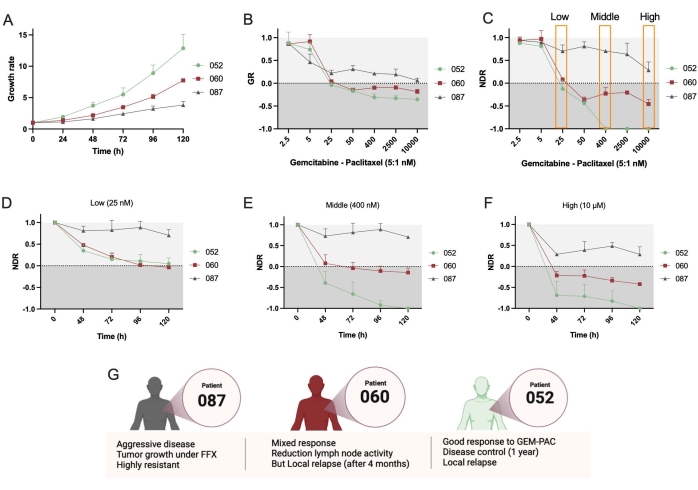
图4:比较患者间药物反应 。 (A)PDAC_052、PDAC_060和PDAC_087 PDTO系的增长率(基于总生存面积)比较。(B)生长速率-剂量反应曲线归一化为ctrl-和(C)归一化为ctrl-和ctrl+的归一化药物反应曲线。(D) 低剂量、(E) 中剂量和 (F) 高剂量吉西他滨/紫杉醇(5:1 比率)的动力学 NDR。(七)PDAC患者的临床特征。误差线表示两个孔的平均±标准偏差。缩写:PDAC = 胰腺导管腺癌;PDTO = 患者来源的肿瘤类器官;GR = 增长率;NDR = 标准化药物反应;FFX = folfirinox。 请点击此处查看此图的大图。
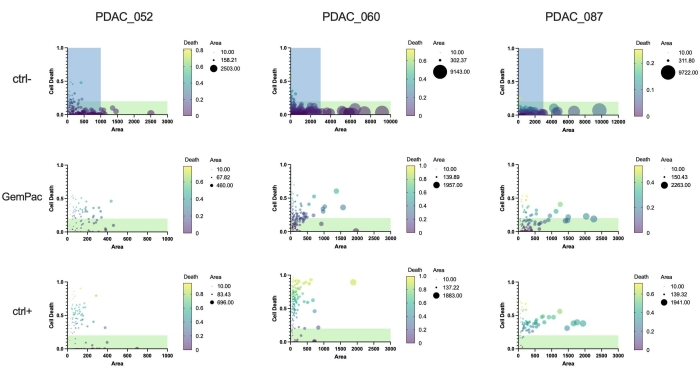
图 5:单个类器官指标。 基于用载体 (ctrl-)、400 nM 吉西他滨/80 nM 紫杉醇和 2 μM 星形孢菌素 (ctrl+) 处理的 PDAC_052、PDAC_060 和 PDAC_087 PDTO 的细胞死亡(绿色区域/明场区域)和面积(明场)的单类器官剂量反应。绿色区域表示活的类器官;蓝色区域表示 GemPac 和 ctrl+ 图的 x 范围。缩写:PDAC = 胰腺导管腺癌;PDTO = 患者来源的肿瘤类器官;GemPac = 吉西他滨/紫杉醇。 请点击此处查看此图的大图。
| 细胞悬液 | 细胞/滴 | # 滴 (20 μL) | 库存 (1/3) | 内容管理(2/3) |
| 1.13 × 107 细胞/mL | 75,000 | 10 | 75 uL | 150 微升 |
| 1.13 × 107 细胞/mL | 75,000 | 5 | 40 uL | 80 微升 |
表1:用于在ECM圆顶中电镀的稀释液。 缩写:ECM = 细胞外基质。
| 复合 | 库存集中度 | 稀释 | 工作专注度 | 溶剂 | 井浓度 | 评论 |
| 细胞毒素绿 | 1 毫米(二甲基单甲基异质体) | 1/10 | 10 微米 | 二甲基亚胺 | 60 毫米 | 细胞死亡标志物 |
| 细胞毒素红 | 1 毫米(二甲基单甲基异质体) | 1/10 | 10 微米 | 二甲基亚胺 | 250 纳米 | 细胞死亡标志物 |
| 半胱天冬酶 3/7 绿色 | 5 毫米(二甲基单甲基异丙烷) | 1/2 | 2.5 毫米 | 二甲基亚胺 | 2.5微米 | 凋亡标志物 |
| 赫斯特 | 20 毫米(高2O) | 1/200 | 100微米 | 0.33% 吐温/公共广播公司 | 50 纳米 | 核标记物 |
| 星孢菌素 | 10 毫米(二甲基单甲基异丙烷) | / | 1 - 10 毫米 | / | 2 – 5 微米 | 阳性对照 |
| 吉西他滨 | 10 毫米(二甲基单甲基异丙烷) | / | 1 - 10 毫米 | / | 滴定 | 化学疗法 |
| 紫杉醇 | 10 毫米(二甲基单甲基异丙烷) | / | 1 - 10 毫米 | / | 滴定 | 化学疗法 |
| 顺铂 | 5毫米(0.9%氯化钠) | 1/2 | 2.5 毫米 | 0.6% 吐温/公共广播电视纤维 | 滴定 | 化学疗法 |
表2:常用药物和荧光试剂的稀释示例。 每种化合物都需要溶解在100%DMSO或0.3%吐温/PBS中。
补充表S1:兼容癌细胞系概述。 静态:球体不是迁移的。合并:球体相互迁移并合并在一起。 请点击此处下载此文件。
补充文件1:类器官接种溶液计算工具。请点击此处下载此文件。
补充文件2:用于3D打印定制实验室器具"微孔板支架"的STL文件。请点击此处下载此文件。
补充文件3:用于3D打印定制实验室器具"2 x 25 mL储液槽支架"的STL文件。请点击此处下载此文件。
补充文件4:定制实验室器皿移液机器人"微孔板支架"的JSON文件。请点击此处下载此文件。
补充文件 5:定制实验室器皿移液机器人"2 x 25 mL 储液槽Holder_WithCooler"的 JSON 文件。请点击此处下载此文件。
补充文件6:移液机器人实验方案"Plating_ PDO_384well_Cooled_Row2-23"的JSON文件。请点击此处下载此文件。
补充文件7:移液工作站设置概述。 (A)冷却元件和(B)储液罐和微孔板。 请点击此处下载此文件。
补充文件8:数字药物分配器协议的TDD文件。请点击此处下载此文件。
补充文件9:用于明场和荧光成像的活细胞成像仪协议的XML文件。请点击此处下载此文件。
补充文件10:示例板图。请点击此处下载此文件。
补充文件 11:NDR R 脚本的示例输入文件。 缩写:NDR = 标准化药物反应。 请点击此处下载此文件。
补充文件 12:规范化药物反应 NDR R 脚本。 缩写:NDR = 标准化药物反应。 请点击此处下载此文件。
补充文件 13:NDR R 脚本 GR 值的示例输出文件。 缩写:GR = 增长率;NDR = 标准化药物反应。 请点击此处下载此文件。
补充文件 14:转置 GR 值的 NDR R 脚本的示例输出文件。 缩写:GR = 增长率;NDR = 标准化药物反应。 请点击此处下载此文件。
S升级文件 15:NDR R 脚本 NDR 值的示例输出文件。 缩写:NDR = 标准化药物反应。 请点击此处下载此文件。
补充文件 16:NDR R 脚本的示例输出文件,其中 NDR 值转置。 缩写:NDR = 标准化药物反应。 请点击此处下载此文件。
讨论
中高通量PDTO药物筛选通常依赖于读数,而读数只能提取类器官可能提供的一小部分信息。越来越清楚的是,为了使快速发展的类器官技术实现更大的科学和临床潜力,迫切需要更先进的3D测定、读数和分析方法。这里描述了一种先进的筛选管道,它不仅增加了可重复性,而且通过结合人工智能驱动的活细胞成像读数,大大提高了临床可转化性。除了内部开发的分析软件外,还实施了标准化药物反应指标(NDR)的使用,这清楚地表明了其定义患者特定治疗反应差异的能力6。
纳入这一标准化指标无疑将具有巨大的价值,回顾许多研究旨在根据曲线下面积(AUC)或半最大抑制浓度(IC50)的微小差异(因为大多数剂量 - 反应曲线重叠/彼此靠近)描绘治疗反应11,12.生长速率指标已经使用基于ATP的测定在类器官药物筛选方案中实施,但依赖于在时间点04裂解的参比孔的标准化。相比之下,该方法允许井内生长速率归一化,这不仅解释了PDTO生长速率的患者间差异,还解释了由接种密度变化和板位置依赖性效应引起的孔间差异,以提高可重复性。此外,我们调整了NDR,通过纳入标准化阳性对照6,8来进一步增加患者间PDTO反应的分离。
此外,该分析与高通量和自动化格式兼容,可以准确检测单个类器官反应,从而能够量化亚克隆耐药性 - 肿瘤复发和进展的主要驱动力13。例如,尽管PDAC052和PDAC060对体外治疗表现出良好的反应(基于NDR),但额外的单类器官分析能够检测到对治疗无反应的一小部分(PDAC060的较大群体)亚克隆群体。有趣的是,这与临床观察结果高度吻合,因为PDAC052和PDAC060具有持久的反应(未检测到肿瘤活性),但最终都被诊断为局部肿瘤进展(由于存在耐药克隆)。与传统的3D读数(基于ATP的测定和大小/数字)相比,这种先进的筛选管道有望通过从这些"实验室患者"中提取更多临床相关信息来提高预测性能。现在正在通过用这种方法在作者实验室中筛选临床PDTO样本来测试这一假设,以将离体与体内反应和临床结果相关联。
为了更深入地了解药物反应的机制,除了细胞毒性染料外,常规荧光活细胞成像试剂与该方法兼容,以研究细胞死亡的机制。我们之前已经证明了该方法与赛多利斯半胱天冬酶3/7绿色试剂的兼容性,以研究顺铂治疗后半胱天冬酶依赖性细胞凋亡诱导8。与其他染料研究氧化应激(CellROX试剂)或缺氧(Image-iT缺氧试剂)的相容性仍有待测试。然而,这些试剂已经成功地用于3D 体外 模型14,15。
如果可以捕获类器官的清晰、聚焦图像,图像分析软件还与其他板格式或培养方法(例如,微腔板、ECM 圆顶)兼容。这对于在圆顶中培养的类器官来说通常具有挑战性,因为它们在不同的z平面中生长,这需要显微镜的z堆叠功能,而这些功能并不总是可用的。因此,我们建议使用平底ULA 384孔微孔板,以确保图像质量足够。
此外,该分析与其他活细胞成像系统兼容,如前所示,使用IncuCyte ZOOM系统8捕获的相差图像。本手稿中使用的Spark Cyto活细胞成像系统的一个局限性是用于动力学测量的单板容量。然而,Spark Motion扩展将其容量增加到最多40个可以批量筛选的微孔板。内部开发的软件的兼容性将扩展到这些系统和其他系统,以提供与平台无关的解决方案,目标是标准化和自动化图像和数据分析管道。如本文所示,基于网络的应用程序还将包括交互式图形工具和自动药物指标计算,以减少手动分析时间。
无标记PDTO分割算法在具有明显形态差异(固体,半固体,囊性)的各种内部生长的球体和PDTO模型上进行训练和测试,因此可以高精度地检测这些8。该模型的一个局限性是,囊性PDTO的加入增加了播种后孔中存在的气泡的不需要的检测。然而,过夜孵育足以去除大部分这些气泡,允许定性时间点0扫描。类器官图像分割和方法的准确性需要其他用户进行验证,并根据他们的反馈,对软件进行进一步训练,以获得稳健的自动化图像分析算法。此外,我们的目标是获得更多的临床数据,将该方法量化的 离体 药物反应与患者的临床反应相关联,以确定预测治疗反应的最佳参数,并进一步开发该方法用于功能性精准癌症医学16。
披露声明
作者声明不存在利益冲突。
致谢
这项研究的一部分是由不同捐助者的捐款资助的,包括Dedert Schilde vzw和Willy Floren先生。这项工作部分由佛兰芒研究基金会资助,12S9221N (A.L.),G044420N (S.V.,A.L.,E.G),1S27021N (M.L),以及安特卫普大学工业研究基金,PS ID 45151(S.V.,A.L.,C.D.)。 图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 6-well plate | Greiner | 657160 | |
| 8-Channel p300 (GEN 2) pipette | Opentrons | ||
| 300 µL Tips | Opentrons | ||
| 384-well flat-bottom ULA microplate | Corning | 4588 | minimum volume 50 µL |
| 384-well flat-bottom ULA Phenoplate | Perkin Elmer | 6057802 | minimum volume 75 µL |
| A8301 | Tocris Bioscience | 2939 | |
| ADF+++ | Advanced DMEM/F12, 1% GlutaMAX, 1% HEPES, 1% penicillin/streptomycin | ||
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634 | |
| B27 | ThermoFisher Scientific | 17504044 | |
| Breathe easy sealing membrane | Sigma-Aldrich | Z380059 | |
| Caspase 3/7 Green | Sartorius | 4440 | |
| Cell Counting Slides for TC10/TC20 | Bio-Rad Laboratories | 1450017 | |
| CellTiter-Glo 3D | Promega | G9681 | ATP-assay |
| Cooler for 25 mL reservoir | VWR (Diversified Biotech) | 490006-908 | |
| Cooling element 12 x 8 x 3 cm | Bol.com | 9200000107744702 | For custom microplate holder OT-2 |
| Cultrex Organoid Harvesting Solution | R&D systems | 3700-100-01 | |
| Cultrex PathClear Reduced Growth Factor BME, Type 2 | R&D systems | 3533-010-02 | extracellular matrix (ECM) |
| Cytotox Green | Sartorius | 4633 | |
| Cytotox Red | Sartorius | 4632 | |
| D300e | Tecan | Digital drug dispenser | |
| D300e Control v3.3.5 | Tecan | Control software D300e | |
| FGF10 | Peprotech | 100-26 | |
| Full Medium | ADF+++ supplemented with 0.5 nM WNT surrogate-Fc-Fusion protein, 4% Noggin-Fc Fusion Protein conditioned medium, 4% Rpso3-Fc Fusion Protein conditioned medium, 1x B27, 1 mM N-acetyl cysteine (NAC), 5 mM nicotinamide, 500 nM A83-01, 100 ng/mL FGF10, and 10 nM Gastrin | ||
| Gastrin | Sigma-Aldrich | G9145 | |
| Gemcitabine | Selleck Chemicals | S1714 | |
| GlutaMAX | ThermoFisher Scientific | 35050 | |
| HEPES | ThermoFisher Scientific | 15630056 | |
| Hoechst 33342 Solution (20 mM) | ThermoFisher Scientific | 62259 | |
| Human pancreatic ductal adenocarcinoma (PDAC) patient-derived organoids | Biobank@uza (Antwerp, Belgium; ID: BE71030031000; Belgian Virtual Tumorbank funded by the National Cancer Plan) | ||
| N-acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Nicotinamide | Sigma-Aldrich | N0636-100G | |
| Noggin-Fc Fusion Protein conditioned medium | Immunoprecise | N002 | |
| Opentrons App v6.0.1 | Opentrons | OT-2 control software | |
| Opentrons Protocol Designer Tool | Opentrons | https://designer.opentrons.com/ | |
| Orbits data compression tool | www.orbits-oncology.com or contact corresponding author | ||
| Orbits image analysis webapp | University of Antwerp | www.orbits-oncology.com or contact corresponding author | |
| OT-2 | Opentrons | Pipetting robot | |
| Paclitaxel | Selleck Chemicals | S1150 | |
| Pasteur Pipette 230 mm | Novolab | A33696 | |
| Peniciline-Streptomycin | ThermoFisher Scientific | 15140 | |
| Prism 9 | GraphPad | ||
| Rspo3-Fc Fusion Protein conditioned medium | Immunoprecise | N003 | |
| Spark Cyto 600 | Tecan | Live-cell imaging and multi-mode platereader | |
| SparkControl v3.1 | Tecan | Spark Cyto control software | |
| Staurosporine | Tocris Bioscience | 1285 | |
| Sterile 25 mL reservoir | VWR (Diversified Biotech) | 10141-922 | |
| T8 plus cassette | Tecan | ||
| TC20 | Bio-Rad Laboratories | automated cell counter | |
| TrypLE | ThermoFisher Scientific | 12604-021 | dissociation enzyme |
| Tween-20 | Acros Organics | 233360010 | |
| WNT Surrogate-Fc-Fusion protein | Immunoprecise | N001 | |
| Y-27632 | Selleck Chemicals | S1049 |
参考文献
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Le Compte, M., et al. Patient-derived organoids as individual patient models for chemoradiation response prediction in gastrointestinal malignancies. Critical Reviews in Oncology/Hematology. 157, 103190(2021).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature Methods. 13 (6), 521-527 (2016).
- Gupta, A., Gautam, P., Wennerberg, K., Aittokallio, T. A normalized drug response metric improves accuracy and consistency of anticancer drug sensitivity quantification in cell-based screening. Communications Biology. 3 (1), 42(2020).
- Rios, A. C., Clevers, H. Imaging organoids: a bright future ahead. Nature Methods. 15 (1), 24-26 (2018).
- Deben, C., Cardenas, E., et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cellular Oncology. , (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), (2017).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Engel, R. M., et al. Patient-derived colorectal cancer organoids upregulate revival stem cell marker genes following chemotherapeutic treatment. Journal of Clinical Medicine. 9 (1), 128(2020).
- Hennig, A., et al. Detecting drug resistance in pancreatic cancer organoids guides optimized chemotherapy treatment. The Journal of Pathology. 257 (5), 607-619 (2022).
- D'Alterio, C., Scala, S., Sozzi, G., Roz, L., Bertolini, G. Paradoxical effects of chemotherapy on tumor relapse and metastasis promotion. Seminars in Cancer Biology. 60, 351-361 (2020).
- Njoroge, R. N., et al. Organoids model distinct Vitamin E effects at different stages of prostate cancer evolution. Scientific Reports. 7 (1), 16285(2017).
- Godet, I., et al. Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis. Nature Communications. 10 (1), 4862(2019).
- Letai, A. Functional precision cancer medicine-moving beyond pure genomics. Nature Medicine. 23 (9), 1028-1035 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。