Method Article
Triagem de Drogas Organoides Tumorais Multiparamétricas Usando Imagem de Células Vivas de Campo Amplo para Análise a Granel e Organoide Único
Neste Artigo
Resumo
Este protocolo descreve um método semi-automatizado para rastreios de drogas organoides de médio a alto rendimento e software de análise de imagem automatizado e agnóstico ao microscópio para quantificar e visualizar respostas multiparamétricas de drogas organoides únicas para capturar a heterogeneidade intratumoral.
Resumo
Os organoides tumorais derivados do paciente (PDTOs) são uma grande promessa para pesquisas pré-clínicas e translacionais e para a previsão da resposta à terapia do paciente a partir de exames de drogas ex vivo. No entanto, os ensaios atuais de triagem de drogas à base de trifosfato de adenosina (ATP) não capturam a complexidade de uma resposta medicamentosa (citostática ou citotóxica) e a heterogeneidade intratumoral que demonstrou ser retida em PDTOs devido a uma leitura em massa. A imagem de células vivas é uma ferramenta poderosa para superar esse problema e visualizar as respostas aos medicamentos com mais profundidade. No entanto, o software de análise de imagem muitas vezes não é adaptado à tridimensionalidade dos PDTOs, requer corantes de viabilidade fluorescente ou não é compatível com um formato de microplaca de 384 poços. Este artigo descreve uma metodologia semi-automatizada para semear, tratar e visualizar PDTOs em um formato de 384 poços de alto rendimento usando sistemas de imagem convencionais, de campo amplo e de células vivas. Além disso, desenvolvemos um software de análise de imagem livre de marcadores de viabilidade para quantificar métricas de resposta a medicamentos baseadas em taxa de crescimento que melhoram a reprodutibilidade e corrigem as variações da taxa de crescimento entre diferentes linhas de PDTO. Usando a métrica normalizada de resposta medicamentosa, que pontua a resposta ao medicamento com base na taxa de crescimento normalizada para uma condição de controle positiva e negativa, e um corante de morte celular fluorescente, as respostas citotóxicas e citostáticas a drogas podem ser facilmente distinguidas, melhorando profundamente a classificação de respondedores e não respondedores. Além disso, a heterogeneidade da resposta medicamentosa pode ser quantificada a partir da análise da resposta a um único organoide a medicamentos para identificar clones potenciais e resistentes. Em última análise, este método visa melhorar a predição da resposta à terapia clínica, capturando uma assinatura multiparamétrica de resposta medicamentosa, que inclui a parada cinética do crescimento e a quantificação da morte celular.
Introdução
Nos últimos anos, a descoberta de medicamentos contra o câncer in vitro , a triagem de medicamentos e a pesquisa fundamental têm transitado do uso de modelos tradicionais de câncer bidimensional (2D) com linhagens celulares imortalizadas para modelos de câncer tridimensionais (3D) mais fisiologicamente relevantes. Isso estimulou a adoção de esferoides tumorais com linhas celulares de câncer estabelecidas, que recriam interações e estruturas célula a célula mais complexas presentes em tumores sólidos. Atualmente, os organoides tumorais derivados do paciente (PDTOs) são o modelo de câncer 3D mais avançado e fisiologicamente relevante disponível para a pesquisa do câncer in vitro , pois proporcionam vantagens adicionais sobre os esferoides tumorais, ou seja, a heterogeneidade encontrada em pacientes com câncer1. Os PDTOs são estabelecidos a partir de tecido tumoral originário de pacientes com câncer e, portanto, retêm tanto o fenótipo quanto o genótipo do tumor. Como tal, os PDTOs estão se tornando inestimáveis para a pesquisa fundamental e translacional do câncer e têm o potencial de melhorar muito a oncologia de precisão2.
Apesar de seu potencial promissor, esses sofisticados modelos de câncer in vitro 3D são frequentemente subutilizados devido à falta de métodos avançados de análise. O ensaio mais comumente utilizado determina o número de células viáveis no PDTO através da quantificação de ATP3 intracelular. Esses ensaios são normalmente análises em massa de ponto de tempo único, negligenciando assim as respostas críticas dependentes do tempo e negligenciando as respostas clonais. Especificamente, a capacidade de monitorar o crescimento dos PDTOs (taxa de crescimento) e sua resposta a terapias específicas é de alto interesse 4,5. A resposta medicamentosa normalizada (NDR), que pontua a resposta ao medicamento com base na taxa de crescimento normalizada para uma condição de controle positivo (ctrl +) e negativo (ctrl-), também foi relatada recentemente como uma métrica crucial para avaliar a sensibilidade ao medicamento contra o câncer com triagem baseada em células, embora isso tenha sido feito predominantemente para linhagens celulares 2D6. Portanto, métodos de análise mais sofisticados são necessários para aproveitar plenamente esses modelos de câncer 3D mais representativos e complexos. A microscopia é considerada uma abordagem poderosa para estudar a complexidade desses modelos organoides7.
Este artigo descreve um método para monitorar respostas cinéticas a medicamentos em modelos de câncer 3D, usando microscópios convencionais de campo largo e sistemas de imagem de células vivas. Adaptações foram feitas no protocolo descrito por Driehuis et al.4 para ser compatível com a automação usando um robô pipetador, dispensador digital de medicamentos e sistema de imagem de células vivas para aumentar a reprodutibilidade e reduzir o número de horas de trabalho 'hands-on'. Este método permite a triagem de drogas de médio a alto rendimento de ambos os esferoides tumorais com linhagens celulares de câncer estabelecidas (ver Tabela Suplementar S1 para linhas celulares testadas), bem como os PDTOs, em um formato de microplaca de 384 poços e multi-organóides. Usando um processo de aprendizado de máquina de rede convolucional, a identificação e o rastreamento automatizados de esferoides tumorais individuais ou PDTOs poderiam ser realizados exclusivamente a partir de imagens de campo brilhante e sem o uso de corantes fluorescentes de marcação de células vivas8. Isso é altamente vantajoso, pois a maior parte da identificação com imagens de campo brilhante requer anotação manual (que é trabalhosa e demorada) ou requer a adição de corantes fluorescentes, o que pode confundir as respostas dos medicamentos relacionadas ao estresse oxidativo induzido pela fotoxicidade9.
O software de análise de imagem resultante desenvolvido internamente amplia a funcionalidade dos sistemas convencionais de imagem de células vivas, já que os módulos de análise de imagem 3D não estão disponíveis, com restrição de plataforma ou não são compatíveis com microplacas de 384 poços e imagens de poços inteiros. Além disso, esses módulos geralmente têm um preço alto e oferecem leituras limitadas de organoides em massa. Portanto, esse método é altamente relevante para cientistas que têm acesso a sistemas de imagem de células vivas amplamente disponíveis e visam extrair mais informações sobre uma resposta a medicamentos em comparação com o ensaio baseado em ATP padrão-ouro, mas rudimentar. Com a adição de indicadores específicos de morte celular, as respostas citostáticas de drogas podem ser distinguidas das respostas citotóxicas, fornecendo assim mais informações sobre as ações mecanicistas de drogas atualmente inatingíveis a partir da análise de ponto de tempo único. Finalmente, a imagem de células vivas permite o rastreamento organoide individual para obter métricas de resposta a medicamentos organoides únicos para capturar a heterogeneidade da resposta e identificar potenciais subclones resistentes.
O objetivo deste método e do software de análise de imagem associado é implementar automação de baixo custo na triagem de medicamentos organoides para limitar a intervenção do usuário e reduzir a variabilidade no manuseio, análise de imagens e análise de dados. Para disponibilizar esse software aos pesquisadores, ele é independente de microscópio e plataforma, e um aplicativo baseado em nuvem é disponibilizado. Assim, ao suportar sistemas convencionais de imagem de células vivas, também pretendemos melhorar a sua funcionalidade para aplicações e análises de cultura 3D.
Protocolo
Foram utilizados organoides derivados de pacientes de adenocarcinoma ductal pancreático humano (PDAC). Fragmentos de ressecção tecidual foram obtidos de pacientes submetidos à cirurgia curativa no Hospital Universitário de Antuérpia. O termo de consentimento livre e esclarecido foi obtido de todos os pacientes, e o estudo foi aprovado pelo Comitê de Ética da UZA (ref. 14/47/480). Detalhes relacionados a todos os materiais, reagentes, equipamentos e softwares utilizados neste protocolo são fornecidos na Tabela de Materiais. Uma visão geral do fluxo de trabalho é apresentada na Figura 1. Dados de exemplo são fornecidos no material suplementar para reproduzir o protocolo.
1. Dia 0: Preparação de organoides de 2 ou 3 dias de idade
- Pré-aqueça as microplacas a 37 °C durante a noite e descongele a matriz extracelular (MEC) a 4 °C.
- Prepare o meio de cultura organoide PDAC completo: suplemento ADF+++ (Advanced DMEM/F12, suplemento de glutamina a 1%, 1% de HEPES e 1% de penicilina/estreptomicina) com proteína de transtorno-fusão WNT a 0,5 nM, meio condicionado à proteína de fusão Noggin-Fc a 4%, meio condicionado à proteína de fusão Rpso3-Fc a 4%, 1x B27, 1 mM N-acetilcisteína (NAC), 5 mM nicotinamida, 500 nM A83-01, 100 ng/mL FGF10 e 10 nM de gastrina).
- Estabeleça os PDTOs de acordo com o método de escolha.
NOTA: Um protocolo detalhado é fornecido por Driehuis et al., que descreve o método convencional para estabelecer, cultivar e passar PDTOs em cúpulas de ECM4. - Dissociar enzimaticamente os organoides nas cúpulas de ECM.
- Aspirar o meio e lavar 1x com solução salina tamponada com fosfato (PBS). Adicione a enzima de dissociação (por exemplo, 2 mL em uma microplaca de 6 poços) e a pipeta para cima e para baixo 10x com uma pipeta de 1 mL para dissociar mecanicamente os organoides e as cúpulas de ECM.
- Incubar durante 10 minutos a 37 °C, pipetar para cima e para baixo e verificar se os organoides estão dissociados a células individuais. Repita esta etapa, se necessário.
- Recolher a suspensão celular num tubo de 15 ml, adicionar ADF+++ a um volume de 10 ml, centrifugar durante 5 min a 450 × g à temperatura ambiente e aspirar o sobrenadante com uma pipeta Pasteur e uma bomba de sucção.
- Ressuscite o pellet em 100-200 μL de meio completo, dependendo do tamanho do pellet e conte o número de células usando o método de escolha. Por exemplo: misture 10 μL da suspensão celular + 10 μL de Trypan Blue e conte com um contador de células automatizado.
- Células únicas de placa em cúpulas de ECM.
- Diluir a suspensão celular e adicionar 2/3 ECM de acordo com o quadro 1. Pipetar até dez gotículas de 20 μL por poço em uma placa pré-aquecida de 6 poços. Inverter a placa e incubar durante 30 min a 37 °C.
- Sobreponha com meio completo suplementado com 10 μM Y-27632 e incube por 2-3 dias em uma incubadora.
NOTA: Dez cúpulas contendo 75.000 células cada são geralmente suficientes para preencher uma microplaca de 384 poços a uma concentração de 200 organoides / poço, excluindo os poços na borda.
2. Dias 2 - 3: Colheita e semente de organoides de 2 ou 3 dias de idade
- Colete organoides intactos das cúpulas de ECM.
NOTA: Os organoides tendem a aderir a superfícies plásticas (por exemplo, tubos, pontas de pipeta). Para evitar isso, os produtos de plástico podem ser pré-enxaguados com uma solução de albumina sérica bovina a 0,1% (BSA)/PBS.- Aspirar o meio e lavar 1x com PBS. Adicione 1-2 mL de solução de colheita organoide fria (4 °C) a uma placa de 6 poços, dependendo do número de cúpulas de ECM e incube no gelo em uma plataforma de agitação por 10 min.
- Pipeta para cima e para baixo com uma pipeta de 1 mL para dissociar as cúpulas de ECM, incubar por mais 10 minutos no gelo e verificar visualmente sob um microscópio se a ECM está dissociada.
- Opcional: se preferir uma distribuição de tamanho mais uniforme, filtre a suspensão através de um filtro de células de 70 μm antes da centrifugação.
- Coletar os organoides em um tubo de 15 mL pré-revestido com BSA/PBS a 0,1%, adicionar ADF+++ até 10 mL e centrifugar por 5 min a 200 × g a 4 °C. Aspirar o sobrenadante e ressuspender o pellet em até 1.000 μL de meio organoide PDAC completo, dependendo do tamanho do pellet, para obter uma concentração de >6.000 organoides/mL.
- Conte os organoides usando qualquer método de contagem de escolha, de preferência um baseado em imagem.
- Semeie os organoides.
NOTA: Consulte a Tabela de Materiais para o volume/poço mínimo para dois tipos diferentes de microplacas de 384 poços usadas neste protocolo.- Pré-arrefecer todos os produtos de plástico a -20 °C ou sobre gelo durante, pelo menos, 20 minutos antes da utilização, a fim de evitar a solidificação da MEC.
- Preparar a solução de semeadura a partir do 1 ml de solução-mãe organoide (passo 2.1.6) utilizando o meio completo para semear ~200 organoides por poço em 50 μL, o volume mínimo utilizado para encher um poço. Use o Arquivo Suplementar 1 para calcular a quantidade de solução de semeadura de organoides. Adicione um volume residual de 1.500 μL ao usar um reservatório de 25 mL e uma pipeta multicanal ou robô de pipetagem.
- Semeia os organoides usando um robô de pipetagem.
NOTA: Tanto a solução de semeadura como a microplaca têm de ser arrefecidas a 4 °C durante a pipetagem para evitar a solidificação da ECM. Portanto, um reservatório de 25 mL e um suporte de microplaca foram impressos em 3D para serem usados em combinação com o robô de pipetagem que pode conter elementos de resfriamento listados na Tabela de Materiais. Arquivos STL para impressão 3D do material de laboratório personalizado (Arquivo Suplementar 2 e Arquivo Suplementar 3) e arquivos JSON de laboratório personalizados para o robô de pipetagem (Arquivo Suplementar 4 e Arquivo Suplementar 5) são fornecidos.- Projete o protocolo de distribuição usando a ferramenta online Protocol Designer. Um exemplo de arquivo JSON (Arquivo Suplementar 6) é fornecido, no qual o material de laboratório personalizado já está carregado e uma pipeta p300 (Gen2) de oito canais com as pontas de pipeta correspondentes é usada.
- Abra o aplicativo de controle do robô de pipetagem, selecione protocolos, clique em Importar e arraste e solte Arquivo Suplementar 6 no campo designado.
- Selecione o protocolo importado e coloque todo o material de laboratório, incluindo elementos de resfriamento e plástico, nos decks de acordo com o layout mostrado no campo Configuração do deck . Use o slot esquerdo para o reservatório de 25 mL e o elemento de resfriamento, conforme mostrado no Arquivo Suplementar 7.
- Clique em Executar protocolo e prossiga para a instalação. Abra a guia Configuração do Labware, clique em Executar verificação de posição do Labware e siga as instruções para calibrar o robô de pipetagem para o novo hardware.
Observação : dados de deslocamento de Labware podem ser armazenados para mais tarde, mas é recomendável executar a verificação de posição de laboratório antes de cada execução. - Encha o reservatório de 25 mL (colocado em cima do elemento de resfriamento) com a solução de semeadura organoide resfriada e clique em Start Run.
NOTA: Os poços superior e inferior também ficam cheios de solução de suspensão organoide devido ao uso da pipeta de oito canais. - Centrifugar a microplaca durante 1 min a 100 × g a 4 °C.
- Incubar a 37 °C durante, pelo menos, 30 min.
- Encher os poços exteriores em branco com, pelo menos, 50 μL de H2O para evitar a evaporação.
- Incubar a 37 °C durante a noite para remover quaisquer bolhas no poço que possam interferir com a análise da imagem.
3. Dia 4: Tratamento medicamentoso e dispensação de reagente com dispensador de medicamento digital
- Crie o protocolo de dispensação de medicamentos usando o software de controle de dispensador de medicamentos digital.
- Passe o mouse sobre a Placa 1 acima do layout da placa, selecione os atributos da placa de edição e preencha o tipo de placa: 384 poços, volume adicional (μL): 50 e limite de DMSO (%): 1.
- Adicione fluidos clicando no botão + ao lado de Fluidos. Clique duas vezes no fluido recém-criado e nomeie-o; selecionar classe (baseada em DMSO ou aquosa+Tween 20) e concentração.
NOTA: Todos os medicamentos e reagentes devem ser dissolvidos em 100% de DMSO ou 0,3% de Tween-20. Uma solução-mãe de 1-10 mM pode ser usada, levando em conta uma concentração máxima de DMSO de <1%. A Tabela 2 fornece exemplos das diluições necessárias para reagentes fluorescentes comuns e terapias. - Layout da placa
- Para titulação de drogas, selecione poços e clique em Titulação. Para fluido, selecione o medicamento de interesse, escolha a maior concentração (por exemplo, 2.000 nM) e a menor concentração (por exemplo, 10 nM); para replicações, escolha um mínimo de 2 e escolha o padrão de titulação desejado.
NOTA: O padrão de titulação dependerá de muitos fatores, incluindo a quantidade de composto a ser ajustado em uma única placa, se os poços devem ser randomizados e o número de repetições e controles. - Para o controle positivo, selecione três poços, clique em Definir Valor e preencha 2 μM de estaurosporina de estoque de 10 mM em DMSO, o que induzirá a morte celular máxima.
- Para Cytotox Green, selecione todos os poços usados, clique em Definir Valor e insira 60 nM/poço.
NOTA: A coloração fluorescente Cytotox Green indica células que morreram e, portanto, não interferirá no monitoramento da resposta ao medicamento. Aqui, nenhum marcador fluorescente para células vivas é necessário. - Para o controle negativo e normalização DMSO, selecione todos os poços com quatro poços adicionais para o controle do veículo, clique com o botão direito do mouse, selecione normalização, selecione normalizar classe de fluido: baseada em DMSO e normalize para o volume de classe mais alta para obter uma concentração igual de DMSO em cada poço.
NOTA: As concentrações de DMSO devem ser de <1%. Um exemplo de arquivo de titulação de drogas TDD (Arquivo Suplementar 8) é fornecido. - Clique na seta em Executar no canto superior esquerdo, selecione Sempre Simular e clique em Simular para identificar quaisquer erros e obter os volumes de cada medicamento a ser preparado.
NOTA: Para superar um aviso quando o volume de dosagem inicial é muito baixo, "Recomenda-se um poço de aviso de dosagem de 30 nL ou mais para cada fluido em cada placa", selecione dois poços na borda que estão cheios de água, selecione Valor definido e insira 10 μM do medicamento para o qual o aviso ocorre. Isso prepara o cartucho de drogas com um volume superior a 30 nL. Esses mesmos poços podem ser usados para preparar o cartucho DMSO definindo uma normalização para % do valor do volume total (por exemplo, 0,5%).
- Para titulação de drogas, selecione poços e clique em Titulação. Para fluido, selecione o medicamento de interesse, escolha a maior concentração (por exemplo, 2.000 nM) e a menor concentração (por exemplo, 10 nM); para replicações, escolha um mínimo de 2 e escolha o padrão de titulação desejado.
- Desmarque Sempre Simular no botão Executar ; clique em Executar para iniciar o protocolo de dispensação de medicamentos e siga as instruções.
- Aplique a membrana de vedação na microplaca para evitar a evaporação.
- Incubar o corante Cytotox Green 1-2 h a 37 °C na incubadora e prosseguir para o passo 4.
4. Adquira imagens com o gerador de imagens de célula ao vivo
NOTA: Para a taxa de crescimento e NDR, uma varredura no ponto de tempo 0 (T0 = iniciar o tratamento) deve ser adquirida 1-2 h após a adição de Cytotox Green.
- Abra o software de controle do gerador de imagens de célula dinâmica, selecione Editor de Método Novo, vá para o arquivo > importar e selecione o arquivo XML do método de exemplo (Arquivo Suplementar 9). Como alternativa, crie um novo arquivo e selecione Placa: (CORE384fb_OpticalImaging) - Corning 384 Flat Black (Corning #4588), Sem tampa e Sem de umidade; Aplicação: Somente imagens; Objetivo: 4x; Padrão: Central; Verifique os canais Brightfield e Green (Intensidade de Led (%) = 40; Tempo de Exposição (ms) = 200).
NOTA: As configurações de canal verde funcionam bem para uma concentração de 60 nM Cytotox Green. A opção Visualizador ao vivo pode ser usada para ajustar o deslocamento de foco e/ou as configurações de led em tempo real. - Clique em Iniciar para iniciar a digitalização em T0.
- Repita a varredura a cada 24 horas por até 5 dias usando o mesmo método. Como alternativa, para executar a medição de timelapse automaticamente, ajuste o método no software de controle de imagens de células vivas para um experimento cinético clicando e arrastando a guia Kinetic Loop para o campo do método . Da mesma forma, as guias Temperatura e Gás devem ser arrastadas para o campo do método para definir o sistema para 37 °C e 5% de CO2 para garantir as condições corretas dentro do imageador de células vivas durante o experimento.
5. Análise de imagens e dados
- Mesclando e compactando dados
- O software de controle de imageador de célula dinâmica gera uma pasta para cada varredura em cada ponto de tempo. Crie uma nova pasta, copie as pastas de experimento individuais para essa nova pasta pai e adicione _0h, _24h, _48h, _72h, _96h e _120h aos nomes de pastas de experimento correspondentes.
- Prepare um mapa de placas XLSX a partir do software digital de controle de dispensador de medicamentos clicando com o botão direito do mouse no layout do mapa de placas do protocolo de dispensação de medicamentos e copie todos os poços; cole os dados em um arquivo XLSX. Remova os dados de Cytotox Green e estaurosporina e adicione uma matriz para Cell Line e Replicate. Digite ctrl- e ctrl+. Consulte Arquivo Suplementar 10 para obter um exemplo de mapa de placas.
- Abra a Ferramenta de Compactação de Dados, clique em Procurar, selecione a pasta pai e clique em Executar para iniciar a compactação de dados de imagem. Todos os arquivos de imagem TIFF para os diferentes pontos de tempo são compactados em um único HDF5 para cada poço em uma nova pasta de conjuntos de dados dentro da pasta parental.
- Análise de imagem
- Vá para a plataforma webapp de análise de imagens, faça login e clique em Adicionar Novo Projeto na guia Página Inicial . Digite o nome do projeto, continue, selecione Adicionar novo experimento e carregue a pasta de conjuntos de dados que contém os arquivos HDF5.
- Após o upload, vá para a pasta de projeto e experimento e clique em Upload Platemap para funcionalidades adicionais. Clique em Executar Análise, selecione Análise Multi-Organóide, Parâmetros Padrão e clique em Analisar para iniciar a análise da imagem.
- Clique em Download Results para baixar as tabelas de dados brutos que contêm as medições para cada poço (por exemplo, área total de campo brilhante, área verde de fluorescência total, etc.) e as imagens / vídeos segmentados para confirmar a precisão da análise e processamento de dados posteriores.
- Métricas de resposta a medicamentos baseadas em taxa de crescimento e resposta normalizada a medicamentos
- Selecione o arquivo Raw_NDR.xlsx na pasta de resultados (mapa de placa necessário) (Arquivo Suplementar 11) e carregue-o no script R Official_NDR_7point (Arquivo Suplementar 12) para gerar automaticamente tabelas de valores GR (normalizado para ctrl-) e NDR (normalizado para ctrl- e ctrl+) (Arquivo Suplementar 13, Arquivo Suplementar 14, Arquivo Suplementar 15 e Arquivo Suplementar 16 ). Os valores de GR e NDR são calculados a partir do parâmetro, conforme mostrado na equação (1), usando o script R (Arquivo Suplementar 12).
Área de Sobrevivência Total = Área Total de Brightfield - Área Verde Total (1)
Onde 0 < NDR <1 = efeito citostático (parada de crescimento) e NDR < 0 = resposta citotóxica (morte celular).
NOTA: O roteiro R foi adaptado de Gupta et al.6. - Na tabela clonal_data.xlsx, recupere dados de resposta de um único organoide e plote-os como um gráfico de bolhas.
- Use o fator Z10 para avaliar a qualidade da triagem de drogas de uma corrida (ver equação (2)). Descartar um experimento com um fator Z < 0,5.
 (2)
(2)
- Selecione o arquivo Raw_NDR.xlsx na pasta de resultados (mapa de placa necessário) (Arquivo Suplementar 11) e carregue-o no script R Official_NDR_7point (Arquivo Suplementar 12) para gerar automaticamente tabelas de valores GR (normalizado para ctrl-) e NDR (normalizado para ctrl- e ctrl+) (Arquivo Suplementar 13, Arquivo Suplementar 14, Arquivo Suplementar 15 e Arquivo Suplementar 16 ). Os valores de GR e NDR são calculados a partir do parâmetro, conforme mostrado na equação (1), usando o script R (Arquivo Suplementar 12).
Resultados
O protocolo de pipetagem automatizada garante uma distribuição uniforme de PDTOs PDAC_060 em todas as colunas da microplaca de 384 poços (Figura 2A). Como esperado, observou-se variação no número e na área média dos PDTOs entre os poços (Figura 2A,B). A área de sobrevida total (área total de campo brilhante - área verde total) combina a segmentação organoide livre de rótulo com o sinal de morte celular baseado em fluorescência e é, em nossa experiência, o parâmetro mais robusto para estudar as respostas de medicamentos ao longo do tempo (Figura 2C)8. Para levar em conta as variações na semeadura celular e no tamanho dos organoides, métricas baseadas na taxa de crescimento devem ser usadas para reduzir as variações entre as replicações, como mostrado pelas barras de erro reduzidas na Figura 2D versus Figura 2C, e um fator Z mais alto, indicando uma qualidade de triagem de drogas fortemente melhorada (Figura 2E).
A curva dose-resposta da NDR (Figura 2G), normalizada para ctrl- e ctrl+, é claramente superior à curva dose-resposta da GR (Figura 2F), normalizada para ctrl-, pois aumenta a separação das curvas de resposta ao fármaco e representa com maior precisão as respostas citotóxicas aos medicamentos. Um exemplo das imagens associadas para PDTO tratado com ctrl-, ctrl+ e gemcitabina de 400 nM/80 nM tratado com paclitaxel é mostrado na Figura 3. Uma observação interessante é que o efeito citotóxico da gemcitabina foi dominante na terapia de combinação, uma vez que não foi observado valor acrescentado do paclitaxel.
Em seguida, foram utilizadas duas linhas adicionais de PDTO, PDAC_052 e PDAC_087. Observou-se uma clara diferença na taxa de crescimento entre essas linhas (Figura 4A), o que corrobora o uso de métricas de GR. Novamente, as curvas dose-resposta da NDR (Figura 4C) resultaram em um aumento da faixa dinâmica e da separação entre os três pacientes diferentes em comparação com as curvas GR (Figura 4B). Além disso, o protocolo permite a determinação da NDR ao longo do tempo e mostra que PDAC_052 e PDAC_060 tiveram uma resposta citostática muito semelhante a uma baixa dose de gem-pac (Figura 4D), enquanto uma clara resposta citostática diferencial versus citotóxica pôde ser observada para as doses média (Figura 4E) e alta (Figura 4F) de gem-pac. Essas respostas medicamentosas foram consistentes com as respostas clínicas observadas nos pacientes (Figura 4G).
Finalmente, um grande benefício da abordagem e do software é que as respostas de um único medicamento organoide podem ser quantificadas para estudar a heterogeneidade da resposta e identificar subclones potencialmente resistentes. A Figura 5 fornece uma visão clara da dinâmica clonal dos diferentes pacientes e mostra que o PDAC-087 teve os subclones mais resistentes após o tratamento, o que é consistente com a doença agressiva e altamente resistente observada no paciente. Curiosamente, este paciente também foi o menos sensível à estaurosporina ctrl+.
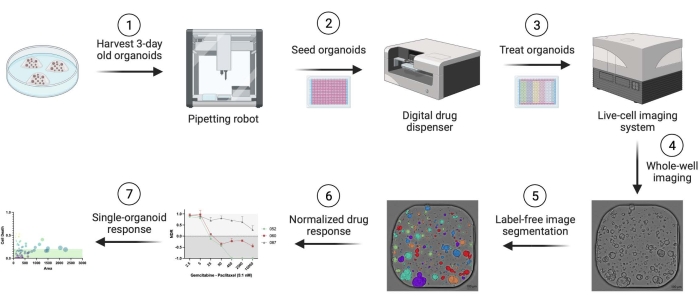
Figura 1: Visão geral do fluxo de trabalho. Clique aqui para exibir uma versão maior dessa figura.
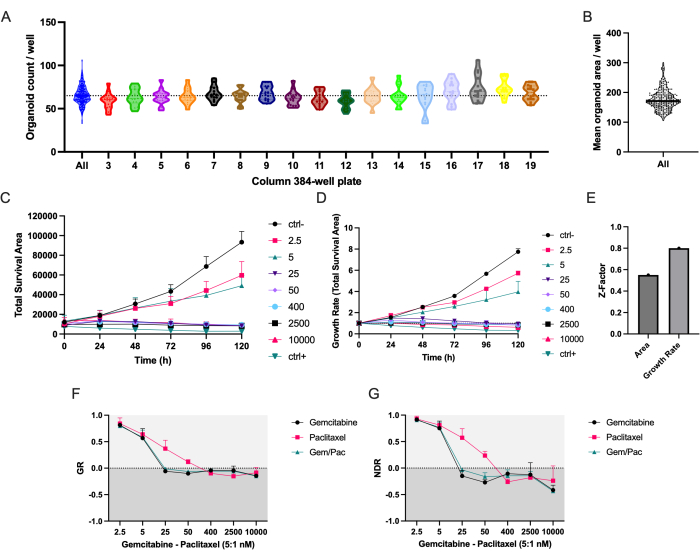
Figura 2: Precisão de semeadura e métricas de resposta a medicamentos . (A) Contagens organoides/poço de PDTOs PDAC_060 semeados em uma microplaca de 384 poços usando o robô pipetador. Cada ponto representa a contagem em um único poço e os gráficos são separados pelas colunas de microplacas de 384 poços. (B) Área média de PDTO/poço. (C) Área de sobrevivência total (área total de campo brilhante - área verde total) e (D) taxa de crescimento (área de sobrevivência total normalizada para T0 = 1) de PDAC_060 PDTOs tratados com uma proporção de 5:1 de gemcitabina/paclitaxel. (E) Fator Z como uma métrica para a qualidade do ensaio. (F) Curva de resposta à dose de taxa de crescimento normalizada para ctrl- e (G) curva de resposta medicamentosa normalizada para ctrl- e ctrl+. As barras de erro indicam ± DP médio de dois poços. Abreviaturas: PDAC = adenocarcinoma ductal pancreático; PDTO = organoide tumoral derivado do paciente; GR = taxa de crescimento; NDR = resposta medicamentosa normalizada. Por favor, clique aqui para ver uma versão maior desta figura.
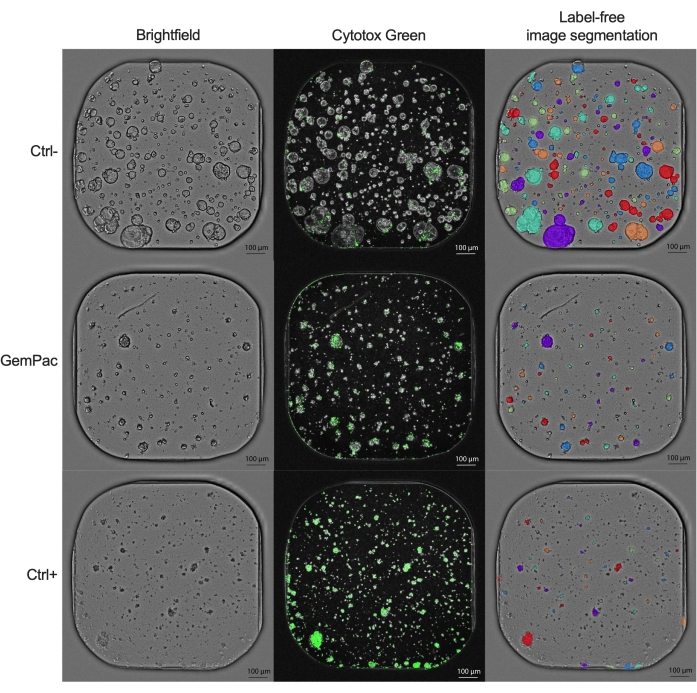
Figura 3: Imagens de exemplo. Imagens representativas de PDAC_060 PDTO tratados com veículo (ctrl-), gemcitabina 400 nM/paclitaxel 80 nM e estaurosporina 2 μM (ctrl+). A coluna da esquerda mostra imagens de campo brilhante, a coluna do meio mostra o sinal fluorescente Cytotox Green e a coluna da direita mostra as imagens de campo brilhante anotadas sem rótulo usando o módulo de análise organoide. Barras de escala = 100 μm. Abreviaturas: PDAC = adenocarcinoma ductal pancreático; PDTO = organoide tumoral derivado do paciente; GemPac = gemcitabina/paclitaxel. Por favor, clique aqui para ver uma versão maior desta figura.
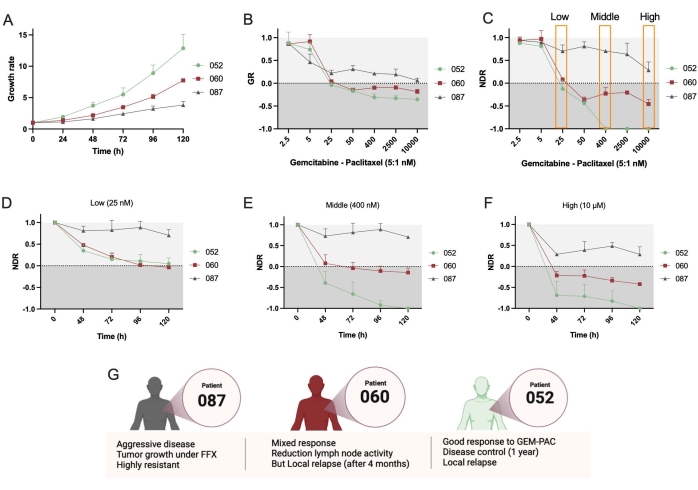
Figura 4: Comparando a resposta medicamentosa interpaciente . (A) Comparação da taxa de crescimento (com base na área de sobrevida total) das linhas de PDAC_052, PDAC_060 e PDAC_087 PDTO. (B) Curva de resposta à dose e taxa de crescimento normalizada para ctrl- e (C) curva normalizada de resposta ao fármaco normalizada para ctrl- e ctrl+. NDR cinética de uma dose (D) baixa, (E) média e (F) alta de gemcitabina/paclitaxel (proporção 5:1). (G) Características clínicas dos pacientes com PDAC. As barras de erro indicam ± DP médio de dois poços. Abreviaturas: PDAC = adenocarcinoma ductal pancreático; PDTO = organoide tumoral derivado do paciente; GR = taxa de crescimento; NDR = resposta medicamentosa normalizada; FFX = folfirinox. Por favor, clique aqui para ver uma versão maior desta figura.
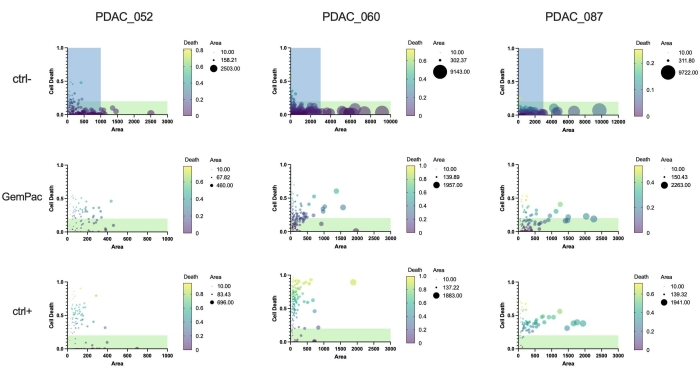
Figura 5: Métricas organoides únicas. Resposta à dose organoide única com base na morte celular (área verde/área de campo brilhante) e área (campo brilhante) de PDAC_052, PDAC_060 e PDAC_087 PDTOs tratados com veículo (ctrl-), gemcitabina de 400 nM/paclitaxel de 80 nM e estaurosporina de 2 μM (ctrl+). Regiões verdes indicam organoides viáveis; as regiões azuis indicam o intervalo x-as dos gráficos GemPac e ctrl+. Abreviaturas: PDAC = adenocarcinoma ductal pancreático; PDTO = organoide tumoral derivado do paciente; GemPac = gemcitabina/paclitaxel. Por favor, clique aqui para ver uma versão maior desta figura.
| Suspensão celular | Células/Queda | # Gotas (20 μL) | Estoque (1/3) | ECM (2/3) |
| 1,13 × 107 células/mL | 75,000 | 10 | 75 uL | 150 μL |
| 1,13 × 107 células/mL | 75,000 | 5 | 40 uL | 80 μL |
Tabela 1: Diluição para chapeamento em cúpulas de ECM. Abreviação: ECM = matriz extracelular.
| Composto | Concentração de existências | Diluição | Concentração de trabalho | Solvente | Concentração do poço | Comentários |
| Citotox Verde | 1 mM (DMSO) | 1/10 | 10 μM | DMSO | 60 nM | Marcador de morte celular |
| Citotox Vermelho | 1 mM (DMSO) | 1/10 | 10 μM | DMSO | 250 nM | Marcador de morte celular |
| Caspase 3/7 Verde | 5 mM (DMSO) | 1/2 | 2,5 mM | DMSO | 2,5 μM | Marcador apoptótico |
| Hoechst | 20 mM (H2O) | 1/200 | 100 μM | 0,33% Interpolação/PBS | 50 nM | Marcador nuclear |
| Staurosporin | 10 mM (DMSO) | / | 1 - 10 mM | / | 2 – 5 μM | Controle positivo |
| Gecitabina | 10 mM (DMSO) | / | 1 - 10 mM | / | Titulação | Quimioterapia |
| Paclitaxel | 10 mM (DMSO) | / | 1 - 10 mM | / | Titulação | Quimioterapia |
| Cisplatina | 5 mM (0,9% NaCl) | 1/2 | 2,5 mM | 0,6% Interpolação/PBS | Titulação | Quimioterapia |
Tabela 2: Exemplo de diluições de fármacos e reagentes fluorescentes de uso frequente. Cada composto precisa ser dissolvido em 100% de DMSO ou 0,3% de interpolação/PBS.
Tabela Suplementar S1: Visão geral de linhagens celulares de câncer compatíveis. Estático: os esferoides não são migratórios. Mesclagem: os esferoides migram um em direção ao outro e se fundem. Clique aqui para baixar este arquivo.
Arquivo Suplementar 1: Ferramenta de cálculo da solução de semeadura de organoides. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: Arquivo STL para impressão 3D de material de laboratório personalizado 'Microplate Holder'. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: Arquivo STL para impressão 3D de material de laboratório personalizado '2 x 25 mL Reservoir Holder'. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: Arquivo JSON para robô de pipetagem de labware personalizado 'Microplate Holder'. Clique aqui para baixar este arquivo.
Arquivo Suplementar 5: Arquivo JSON para robô de pipetagem de labware personalizado '2 x 25 mL Reservoir Holder_WithCooler'. Clique aqui para baixar este arquivo.
Arquivo suplementar 6: Arquivo JSON para pipetar o protocolo do robô 'Plating_ PDO_384well_Cooled_Row2-23'. Clique aqui para baixar este arquivo.
Arquivo Suplementar 7: Visão geral da configuração da mesa do robô de pipetagem. (A) Elementos de arrefecimento e (B) reservatório e microplaca. Clique aqui para baixar este arquivo.
Arquivo Suplementar 8: Arquivo TDD para protocolo do dispensador digital de medicamentos. Clique aqui para baixar este arquivo.
Arquivo suplementar 9: Arquivo XML para protocolo do gerador de imagens de células vivas para imagens de campo brilhante e fluorescência. Clique aqui para baixar este arquivo.
Arquivo Suplementar 10: Exemplo de mapa de placas. Clique aqui para baixar este arquivo.
Arquivo Suplementar 11: Exemplo de arquivo de entrada para o script NDR R. Abreviação: NDR = resposta normalizada ao medicamento. Clique aqui para baixar este arquivo.
Arquivo Suplementar 12: Script R de NDR de resposta medicamentosa normalizada. Abreviação: NDR = resposta normalizada ao medicamento. Clique aqui para baixar este arquivo.
Arquivo Suplementar 13: Exemplo de arquivo de saída de valores GR do script NDR R. Abreviaturas: GR = taxa de crescimento; NDR = resposta medicamentosa normalizada. Clique aqui para baixar este arquivo.
Arquivo Suplementar 14: Exemplo de arquivo de saída do script NDR R com valores GR transpostos. Abreviaturas: GR = taxa de crescimento; NDR = resposta medicamentosa normalizada. Clique aqui para baixar este arquivo.
Supplementary Arquivo 15: Exemplo de arquivo de saída de valores NDR script R NDR. Abreviação: NDR = resposta normalizada ao medicamento. Clique aqui para baixar este arquivo.
Arquivo Suplementar 16: Exemplo de arquivo de saída do script NDR R com valores de NDR transpostos. Abreviação: NDR = resposta normalizada ao medicamento. Clique aqui para baixar este arquivo.
Discussão
A triagem de medicamentos PDTO de médio a alto rendimento geralmente depende de leituras que extraem apenas uma fração da informação que os organoides poderiam potencialmente fornecer. Tornou-se cada vez mais claro que, para que a tecnologia organoide em rápida evolução realize um maior potencial científico e clínico, ensaios 3D mais avançados, leituras e métodos de análise são criticamente necessários. Aqui, um pipeline de triagem avançada é descrito, o que não apenas aumenta a reprodutibilidade, mas também aumenta consideravelmente a traduzibilidade clínica, incorporando uma leitura de imagem de células vivas orientada por IA. Além do software de análise desenvolvido internamente, é implementado o uso da métrica normalizada de resposta medicamentosa (NDR), o que demonstra claramente sua capacidade de definir diferenças específicas do paciente na resposta ao tratamento6.
A inclusão dessa métrica de normalização será, sem dúvida, de enorme valor, lembrando que inúmeros estudos visam delinear as respostas ao tratamento com base em pequenas diferenças na área sob a curva (AUC) ou na concentração inibitória semimáxima (IC50) (já que a maioria das curvas dose-resposta se sobrepõe/está localizada próxima uma da outra)11,12 . As métricas da taxa de crescimento já foram implementadas em protocolos de triagem de medicamentos organoides usando o ensaio baseado em ATP, mas dependem da normalização dos poços de referência lisados no ponto de tempo 04. Em contraste, esse método permite a normalização da taxa de crescimento intra-poço, o que não apenas explica as diferenças interpacientes na taxa de crescimento da PDTO, mas também as diferenças interwell resultantes de variações na densidade de semeadura e nos efeitos dependentes da localização da placa para aumentar a reprodutibilidade. Além disso, adaptamos a notificação de notificação de falha na entrega para aumentar ainda mais a separação da resposta da PDTO interpaciente, incluindo um controle positivo para a normalização 6,8.
Além disso, a análise, que é compatível com formatos de alto rendimento e automação, pode detectar com precisão respostas organoides individuais, permitindo a quantificação da resistência subclonal - a principal força motriz da recidiva e progressão tumoral13. Por exemplo, embora PDAC052 e PDAC060 tenham mostrado uma boa resposta ao tratamento in vitro (com base na NDR), a análise adicional de um único organoide foi capaz de detectar uma população pequena (maior com PDAC060) de subclones que não respondem ao tratamento. Curiosamente, isso correspondeu muito com a observação clínica, dado que PDAC052 e PDAC060 tiveram uma resposta durável (nenhuma atividade tumoral detectada), mas eventualmente ambos foram diagnosticados com progressão tumoral local (devido à presença de clones resistentes). Em comparação com as leituras 3D convencionais (ensaio baseado em ATP e tamanho / números), espera-se que esse pipeline de triagem avançada aumente o desempenho preditivo extraindo informações clinicamente mais relevantes desses "pacientes no laboratório". Esta hipótese está agora a ser testada através da triagem de amostras clínicas de PDTO no laboratório dos autores com este método para correlacionar ex vivo com a resposta in vivo e o desfecho clínico.
Para obter mais insights sobre os mecanismos de resposta a uma droga, reagentes fluorescentes convencionais de imagem de células vivas, além de corantes de citotoxicidade, são compatíveis com este método para estudar mecanismos de morte celular. Mostramos anteriormente a compatibilidade desse método com o Sartorius Caspase 3/7 Green Reagent para estudar a indução de apoptose dependente de caspase após o tratamento comcisplatina 8. A compatibilidade com outros corantes para estudar o estresse oxidativo (reagentes CellROX) ou hipóxia (reagentes de hipóxia Image-iT) ainda precisa ser testada. No entanto, esses reagentes já foram utilizados com sucesso em modelos 3D in vitro 14,15.
O software de análise de imagens também é compatível com outros formatos de placas ou métodos de cultivo (por exemplo, placas de microcavidade, cúpulas de ECM) se imagens claras e em foco dos organoides puderem ser capturadas. Isso geralmente é um desafio para organoides cultivados em cúpulas, uma vez que crescem em diferentes planos z, o que requer a funcionalidade de empilhamento z do microscópio que nem sempre está disponível. Portanto, aconselhamos o uso de microplacas de fundo plano ULA 384-well para garantir imagens de qualidade suficiente.
Além disso, a análise é compatível com outros sistemas de imagem de células vivas, como mostrado anteriormente para imagens de contraste de fase capturadas com um sistema IncuCyte ZOOM8. Uma limitação do sistema de imagem de células vivas Spark Cyto que foi usado neste manuscrito é a capacidade de uma placa para medições cinéticas. No entanto, a expansão Spark Motion aumenta sua capacidade para até 40 microplacas que podem ser peneiradas a granel. A compatibilidade do software desenvolvido internamente será expandida para esses e outros sistemas para oferecer uma solução independente de plataforma, com o objetivo de padronizar e automatizar pipelines de imagem e análise de dados. O aplicativo baseado na Web também incluirá ferramentas gráficas interativas e cálculos automatizados de métricas de medicamentos, como mostrado neste artigo, para reduzir o tempo de análise manual.
O algoritmo de segmentação PDTO sem rótulo foi treinado e testado em vários modelos esferoides e PDTO cultivados internamente com diferenças morfológicas distintas (sólido, semissólido, cístico), podendo, consequentemente, detectá-los com alta precisão8. Uma limitação do modelo é que a inclusão de PDTOs císticos aumentou a detecção indesejada de bolhas presentes no poço seguinte à semeadura. No entanto, a incubação durante a noite foi suficiente para remover a maioria dessas bolhas, permitindo uma varredura qualitativa do ponto de tempo 0. A precisão da segmentação da imagem organoide e do método precisa ser validada por outros usuários e, com base em seu feedback, o software pode ser treinado ainda mais para obter um algoritmo de análise de imagem robusto e automatizado. Além disso, nosso objetivo é obter mais dados clínicos para correlacionar a resposta medicamentosa ex vivo quantificada por esse método com a resposta clínica no paciente, a fim de identificar os melhores parâmetros para predizer a resposta terapêutica e desenvolver ainda mais esse método para a medicina funcional de precisão do câncer16.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Parte desta pesquisa foi financiada por doações de diferentes doadores, incluindo Dedert Schilde vzw e Sr. Willy Floren. Este trabalho é parcialmente financiado pela Fundação de Investigação Flamenga, 12S9221N (A.L.), G044420N (S.V., A.L., E.G.), 1S27021N (M.L.), e pelo Fundo de Investigação Industrial da Universidade de Antuérpia, PS ID 45151 (S.V., A.L., C.D.). A Figura 1 foi criada com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 6-well plate | Greiner | 657160 | |
| 8-Channel p300 (GEN 2) pipette | Opentrons | ||
| 300 µL Tips | Opentrons | ||
| 384-well flat-bottom ULA microplate | Corning | 4588 | minimum volume 50 µL |
| 384-well flat-bottom ULA Phenoplate | Perkin Elmer | 6057802 | minimum volume 75 µL |
| A8301 | Tocris Bioscience | 2939 | |
| ADF+++ | Advanced DMEM/F12, 1% GlutaMAX, 1% HEPES, 1% penicillin/streptomycin | ||
| Advanced DMEM/F-12 | ThermoFisher Scientific | 12634 | |
| B27 | ThermoFisher Scientific | 17504044 | |
| Breathe easy sealing membrane | Sigma-Aldrich | Z380059 | |
| Caspase 3/7 Green | Sartorius | 4440 | |
| Cell Counting Slides for TC10/TC20 | Bio-Rad Laboratories | 1450017 | |
| CellTiter-Glo 3D | Promega | G9681 | ATP-assay |
| Cooler for 25 mL reservoir | VWR (Diversified Biotech) | 490006-908 | |
| Cooling element 12 x 8 x 3 cm | Bol.com | 9200000107744702 | For custom microplate holder OT-2 |
| Cultrex Organoid Harvesting Solution | R&D systems | 3700-100-01 | |
| Cultrex PathClear Reduced Growth Factor BME, Type 2 | R&D systems | 3533-010-02 | extracellular matrix (ECM) |
| Cytotox Green | Sartorius | 4633 | |
| Cytotox Red | Sartorius | 4632 | |
| D300e | Tecan | Digital drug dispenser | |
| D300e Control v3.3.5 | Tecan | Control software D300e | |
| FGF10 | Peprotech | 100-26 | |
| Full Medium | ADF+++ supplemented with 0.5 nM WNT surrogate-Fc-Fusion protein, 4% Noggin-Fc Fusion Protein conditioned medium, 4% Rpso3-Fc Fusion Protein conditioned medium, 1x B27, 1 mM N-acetyl cysteine (NAC), 5 mM nicotinamide, 500 nM A83-01, 100 ng/mL FGF10, and 10 nM Gastrin | ||
| Gastrin | Sigma-Aldrich | G9145 | |
| Gemcitabine | Selleck Chemicals | S1714 | |
| GlutaMAX | ThermoFisher Scientific | 35050 | |
| HEPES | ThermoFisher Scientific | 15630056 | |
| Hoechst 33342 Solution (20 mM) | ThermoFisher Scientific | 62259 | |
| Human pancreatic ductal adenocarcinoma (PDAC) patient-derived organoids | Biobank@uza (Antwerp, Belgium; ID: BE71030031000; Belgian Virtual Tumorbank funded by the National Cancer Plan) | ||
| N-acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Nicotinamide | Sigma-Aldrich | N0636-100G | |
| Noggin-Fc Fusion Protein conditioned medium | Immunoprecise | N002 | |
| Opentrons App v6.0.1 | Opentrons | OT-2 control software | |
| Opentrons Protocol Designer Tool | Opentrons | https://designer.opentrons.com/ | |
| Orbits data compression tool | www.orbits-oncology.com or contact corresponding author | ||
| Orbits image analysis webapp | University of Antwerp | www.orbits-oncology.com or contact corresponding author | |
| OT-2 | Opentrons | Pipetting robot | |
| Paclitaxel | Selleck Chemicals | S1150 | |
| Pasteur Pipette 230 mm | Novolab | A33696 | |
| Peniciline-Streptomycin | ThermoFisher Scientific | 15140 | |
| Prism 9 | GraphPad | ||
| Rspo3-Fc Fusion Protein conditioned medium | Immunoprecise | N003 | |
| Spark Cyto 600 | Tecan | Live-cell imaging and multi-mode platereader | |
| SparkControl v3.1 | Tecan | Spark Cyto control software | |
| Staurosporine | Tocris Bioscience | 1285 | |
| Sterile 25 mL reservoir | VWR (Diversified Biotech) | 10141-922 | |
| T8 plus cassette | Tecan | ||
| TC20 | Bio-Rad Laboratories | automated cell counter | |
| TrypLE | ThermoFisher Scientific | 12604-021 | dissociation enzyme |
| Tween-20 | Acros Organics | 233360010 | |
| WNT Surrogate-Fc-Fusion protein | Immunoprecise | N001 | |
| Y-27632 | Selleck Chemicals | S1049 |
Referências
- Drost, J., Clevers, H. Organoids in cancer research. Nature Reviews Cancer. 18 (7), 407-418 (2018).
- Veninga, V., Voest, E. E. Tumor organoids: Opportunities and challenges to guide precision medicine. Cancer Cell. 39 (9), 1190-1201 (2021).
- Le Compte, M., et al. Patient-derived organoids as individual patient models for chemoradiation response prediction in gastrointestinal malignancies. Critical Reviews in Oncology/Hematology. 157, 103190(2021).
- Driehuis, E., Kretzschmar, K., Clevers, H. Establishment of patient-derived cancer organoids for drug-screening applications. Nature Protocols. 15 (10), 3380-3409 (2020).
- Hafner, M., Niepel, M., Chung, M., Sorger, P. K. Growth rate inhibition metrics correct for confounders in measuring sensitivity to cancer drugs. Nature Methods. 13 (6), 521-527 (2016).
- Gupta, A., Gautam, P., Wennerberg, K., Aittokallio, T. A normalized drug response metric improves accuracy and consistency of anticancer drug sensitivity quantification in cell-based screening. Communications Biology. 3 (1), 42(2020).
- Rios, A. C., Clevers, H. Imaging organoids: a bright future ahead. Nature Methods. 15 (1), 24-26 (2018).
- Deben, C., Cardenas, E., et al. OrBITS: label-free and time-lapse monitoring of patient derived organoids for advanced drug screening. Cellular Oncology. , (2022).
- Icha, J., Weber, M., Waters, J. C., Norden, C. Phototoxicity in live fluorescence microscopy, and how to avoid it. Bioessays. 39 (8), (2017).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A simple statistical parameter for use in evaluation and validation of high throughput screening assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Engel, R. M., et al. Patient-derived colorectal cancer organoids upregulate revival stem cell marker genes following chemotherapeutic treatment. Journal of Clinical Medicine. 9 (1), 128(2020).
- Hennig, A., et al. Detecting drug resistance in pancreatic cancer organoids guides optimized chemotherapy treatment. The Journal of Pathology. 257 (5), 607-619 (2022).
- D'Alterio, C., Scala, S., Sozzi, G., Roz, L., Bertolini, G. Paradoxical effects of chemotherapy on tumor relapse and metastasis promotion. Seminars in Cancer Biology. 60, 351-361 (2020).
- Njoroge, R. N., et al. Organoids model distinct Vitamin E effects at different stages of prostate cancer evolution. Scientific Reports. 7 (1), 16285(2017).
- Godet, I., et al. Fate-mapping post-hypoxic tumor cells reveals a ROS-resistant phenotype that promotes metastasis. Nature Communications. 10 (1), 4862(2019).
- Letai, A. Functional precision cancer medicine-moving beyond pure genomics. Nature Medicine. 23 (9), 1028-1035 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados