Method Article
نموذج الأمعاء على رقاقة لدراسة محور ميكروبيوم الأمعاء والجهاز العصبي
In This Article
Summary
neuroHuMiX هو نموذج متقدم للأمعاء على رقاقة لدراسة تفاعلات الخلايا البكتيرية والظهارية والخلايا العصبية في ظل ظروف الزراعة المشتركة القريبة والتمثيلية. يسمح هذا النموذج بكشف الآليات الجزيئية الكامنة وراء الاتصال بين ميكروبيوم الأمعاء والجهاز العصبي.
Abstract
يتم استعمار جسم الإنسان من قبل نفس العدد على الأقل من الخلايا الميكروبية التي تتكون من الخلايا البشرية ، وتقع معظم هذه الكائنات الحية الدقيقة في الأمعاء. على الرغم من أن التفاعل بين ميكروبيوم الأمعاء والمضيف قد تمت دراسته على نطاق واسع ، إلا أن كيفية تفاعل ميكروبيوم الأمعاء مع الجهاز العصبي المعوي لا تزال غير معروفة إلى حد كبير. حتى الآن ، لا يوجد ممثل فسيولوجي في نموذج المختبر لدراسة تفاعلات ميكروبيوم الأمعاء والجهاز العصبي.
لسد هذه الفجوة ، قمنا بتطوير نموذج الحديث المتبادل بين الإنسان والميكروبات (HuMiX) من خلال إدخال الخلايا العصبية المعوية المستحثة المشتقة من الخلايا الجذعية متعددة القدرات في الجهاز. يسمح النموذج الناتج ، "neuroHuMiX" ، بالزراعة المشتركة للخلايا البكتيرية والظهارية والعصبية عبر قنوات الموائع الدقيقة ، مفصولة بأغشية شبه منفذة. على الرغم من فصل أنواع الخلايا المختلفة ، يمكن للخلايا التواصل مع بعضها البعض من خلال عوامل قابلة للذوبان ، مما يوفر في نفس الوقت فرصة لدراسة كل نوع من أنواع الخلايا على حدة. يسمح هذا الإعداد برؤى أولية حول كيفية تأثير ميكروبيوم الأمعاء على الخلايا العصبية المعوية. هذه خطوة أولى حاسمة في دراسة وفهم محور ميكروبيوم الأمعاء البشرية والجهاز العصبي.
Introduction
يلعب ميكروبيوم الأمعاء البشرية دورا حاسما في صحة الإنسان ومرضه. لقد تمت دراسته على نطاق واسع على مدى العقد ونصف العقد الماضيين ، وتم الآن تأسيس دوره المحتمل في تعديل الصحة والمرض1. تم افتراض حدوث اضطراب في الميكروبيوم يؤدي إلى مجتمع ميكروبي غير متوازن (dysbiosis) للمشاركة في التسبب في العديد من الاضطرابات المزمنة ، مثل السمنة ومرض التهاب الأمعاء وسرطان القولون والمستقيم ، أو حتى الأمراض التنكسية العصبية مثل مرض باركنسون 2,3.
على الرغم من أن ميكروبيوم الأمعاء البشرية قد ارتبط بالحالات العصبية ، إلا أنه لا يزال من غير الواضح كيف يتواصل ميكروبيوم الأمعاء مع الجهاز العصبي المعوي ويؤثر عليه. نظرا لأنه لا يمكن الوصول بسهولة إلى الجهاز العصبي المعوي البشري للدراسة الفورية ، فقد تم استخدام النماذج الحيوانية في التجارب حتى الآن4. ومع ذلك ، نظرا للاختلافات الواضحة بين النماذج الحيوانية والبشر5 ، فإن تطوير نماذج في المختبر تحاكي الأمعاء البشرية له أهمية فورية. في هذا السياق ، سمح لنا المجال المزدهر والمتقدم للخلايا الجذعية متعددة القدرات التي يسببها الإنسان (iPSCs) بالحصول على الخلايا العصبية المعوية التمثيلية (ENs)6. تسمح ENs المشتقة من iPSC بدراسة الجهاز العصبي المعوي في نماذج الثقافة المختبرية ، مثل إدخالات زراعة الخلايا أو المواد العضوية أو الأعضاء على رقاقة 7,8.
نموذج الحديث المتبادل بين الإنسان والميكروبات (HuMiX) هو نموذج القناة الهضمية على رقاقة يحاكي القناة الهضميةالبشرية 9. استوعب نموذج HuMiX الأولي (المشار إليه فيما يلي باسم الجهاز الأولي) الخلايا الظهارية (Caco-2) والخلايا البكتيرية10,11. ومع ذلك ، لدراسة ارتباط ميكروبيوم الأمعاء والجهاز العصبي ، تم أيضا إدخال ENs6 المشتقة من iPSC في النظام (الشكل 1). تسمح الثقافة المشتركة القريبة للخلايا العصبية والظهارية والبكتيرية بتحليل أنواع الخلايا المختلفة بشكل فردي ودراسة التفاعلات بين أنواع الخلايا المختلفة في بيئة تحاكي بيئة الأمعاء البشرية.
في السنوات الأخيرة ، تم إحراز تقدم في تطوير نماذج لدراسة الأعضاء بطرق أكثر تمثيلا من الناحية الفسيولوجية باستخدام نماذج الأعضاء على رقاقة (على سبيل المثال ، الأمعاء على رقاقة). هذه النماذج أكثر تمثيلا لبيئة الأمعاء البشرية بسبب الإمداد المستمر بالمغذيات وإزالة النفايات ، بالإضافة إلى المراقبة في الوقت الفعلي ، على سبيل المثال ، لمستويات الأكسجين أو سلامة الحاجز 8,12. تسمح هذه النماذج على وجه التحديد بدراسة آثار بكتيريا الأمعاء على الخلايا المضيفة. ومع ذلك ، لتكون قادرا على استخدام الأعضاء على رقاقة لدراسة العلاقات المتبادلة بين ميكروبيوم الأمعاء والجهاز العصبي ، يجب دمج الخلايا العصبية في مثل هذه الأنظمة. لذلك ، كان الهدف من مواصلة تطوير HuMiX وإنشاء نظام neuroHuMiX (المشار إليه فيما يلي باسم الجهاز) هو تطوير نموذج الأمعاء على رقاقة ، والذي يتضمن الخلايا العصبية المعوية في الثقافة المشتركة القريبة مع الخلايا الظهارية المعوية والبكتيريا.
Protocol
1. زراعة الخلايا والفرز
- الخلايا العصبية المعوية المستحثة متعددة القدرات المشتقة من الخلايا الجذعية
ملاحظة: iPSCs الثقافة قبل 6 أسابيع من بدء الجري. تم تكييف بروتوكول التمايز ل ENs من Fattahi et al.6.- استزرع iPSCs على صفيحة مصفوفة مغلفة بالهلام 6 آبار في 2 مل / بئر من وسط استزراع iPSC مع 1٪ بنسلين-ستربتومايسين (P / S).
- عند التقاء 80٪ -90٪ ، قم بتمرير الخلايا ، والبذور في صفيحة مغلفة بالهلام باستخدام نفس الوسط ، واحتضانها عند 37 درجة مئوية ، و 5٪ CO2 ، و 90٪ رطوبة نسبية (RH).
- بالنسبة لاشتقاق iPSC ، بعد مرورين بعد الذوبان ، عند التقاء 80٪ -90٪ ، قم بزرع الخلايا في صفيحة 6 آبار مغلفة بالهلام بكثافة 100000 خلية / بئر. احتضان في الوسائط الموصوفة أعلاه + مثبط ROCK Y-27632 (1: 2000) لمدة 24 ساعة عند 37 درجة مئوية.
- بعد 24 ساعة ، استبدل الوسط الطافي بوسط اليوم 0 ، وفقا للجدول 1. قم بتضمين بئر تحكم واحد لاستخدامه كعنصر تحكم سلبي أثناء فرز الخلايا لعملية الاشتقاق. حافظ على عنصر التحكم جيدا في تكوين وسائط اليوم 0 لفترة الاشتقاق بأكملها. قم بتغيير الوسيط كل يومين من الأيام 2 إلى 10 ، وفقا للجدول 1.
- في اليوم 11 ، قم بفرز الخلايا للخلايا الموجبة CD49d ، والتي سيتم استخدامها في الخطوات التالية من هذا البروتوكول.
- قم بتجميع الخلايا المراد فرزها بناء على الخلايا الإيجابية CD49d ، بالإضافة إلى بئر التحكم. أجهزة الطرد المركزي الخلايا لمدة 3 دقائق في 300 × غرام. أعد تعليق حبيبات الخلية في 2٪ ألبومين مصل بقري (BSA) + 1٪ P / S في 1x محلول ملحي مخزن بالفوسفات (PBS).
- قسم كل مجموعة خلايا (مجمعة وضوابط) إلى قسمين: صبغ جزء واحد بجسم مضاد CD49d مضاد للإنسان ، والجزء الآخر بجسم مضاد للتحكم في النمط المتماثل.
- قم ببوابة مجموعة الخلايا الرئيسية ثم بوابة الخلايا المفردة ، والتي سيتم على أساسها اختيار الخلايا التي تقدم CD49d على سطحها. اجمع هذه الخلايا للخطوة التالية من التمايز.
ملاحظة: عادة ما تكون 30٪ -40٪ من الخلايا التي تم فرزها إيجابية CD49d.
- انقل مليونين إلى أربعة ملايين خلية تم فرزها إلى لوحة واحدة ذات 6 آبار من لوحة ربط منخفضة للغاية في وسائط N2B27 (انظر الجدول 2) + FGF2 + CHIR لمدة 4 أيام للسماح بتكوين كروي.
- في اليوم 15 ، أعد طلاء الكرات على لوحة بولي L-ornithine / laminin / fibronectin (P / L / F) - المغلفة ب 6 آبار في 2 مل / بئر من وسائط N2B27 مع GDNF وحمض الأسكوربيك (AA). استبدل الوسيط كل 2-3 أيام.
ملاحظة: نسبة الطلاء: بولي L- أورنيثين ، 15 ميكروغرام / مل ؛ لامينين ، 2 ميكروغرام / مل ؛ فيبرونيكتين ، 2 ميكروغرام / مل في 1x PBS. - بعد 3 أسابيع ، استخدم الخلايا للتلقيح في الجهاز.
- كاكو-2
ملاحظة: ذوبان خلايا Caco-2 قبل أسبوع واحد على الأقل من الجري.- زرع قارورة T75 مع 1 × 106 خلايا Caco-2 في مكمل الجلوتامين RPMI 1640 + HEPES + مصل بقري جنيني 10٪ (FBS) ؛ احتضان عند 37 درجة مئوية ، 5٪ CO2 ، و 90٪ رطوبة نسبية.
ملاحظة: بالنسبة لهذه التجارب ، استخدم Caco-2 بشكل مثالي في الممر الأول أو الثاني بعد الذوبان.
- زرع قارورة T75 مع 1 × 106 خلايا Caco-2 في مكمل الجلوتامين RPMI 1640 + HEPES + مصل بقري جنيني 10٪ (FBS) ؛ احتضان عند 37 درجة مئوية ، 5٪ CO2 ، و 90٪ رطوبة نسبية.
2. إعداد تشغيل HuMiX
- تحضير غطاء البولي كربونات والطلاء
- الأوتوكلاف زوج من أغطية البولي كربونات (PC) (الشكل 2) مع أربعة مسامير باستخدام دورة أداة الجهاز الأولية (انظر الجدول 3 للحصول على التفاصيل).
- في خزانة السلامة البيولوجية ، أدخل أربعة مسامير في كل ركن من أركان غطاء الكمبيوتر السفلي (انظر الشكل 3) وانقله إلى طبق بتري مربع معقم لعملية طلاء من خطوتين.
- في اليوم الأول ، أضف 2 مل من 1.5٪ بولي L-ornithine في PBS (1x) إلى منتصف غطاء الكمبيوتر. احتضان بين عشية وضحاها عند 37 درجة مئوية ، 5 ٪ CO2 ، و 90 ٪ RH.
- في اليوم التالي ، قم بإزالة المحلول واستبدله بمحلول يحتوي على 0.2٪ لامينين و 0.2٪ فيبرونيكتين في PBS (1x) لتغطية سطح غرفة الخلايا العصبية. احتضان الغطاء طوال الليل عند 37 درجة مئوية ، 5٪ CO2 ، و 90٪ رطوبة نسبية.
- بعد الحضانة ، احتفظ بمحلول الطلاء على غطاء الكمبيوتر وأغلق طبق بتري بفيلم مانع للتسرب. ضعها على حرارة 4 درجات مئوية للتخزين حتى الاستخدام.
- قبل الاستخدام ، قم بإزالة محلول الطلاء ، وجففه في الهواء في خزانة السلامة الحيوية لمدة 30 دقيقة حتى يجف الطلاء تماما.
- إعداد طوقا والطلاء
ملاحظة: يصف هذا القسم كيفية تحضير الحشيات عن طريق لصق الأغشية شبه المنفذة بحشيات السيليكون. بعد خطوة التعقيم الأولية ، يتم طلاء الحشيات بالكولاجين أو الميوسين للسماح بالتصاق الخلايا الظهارية المعوية أو البكتيريا. يحاكي الغشاء المغلف بالميوسين حاجز المخاط الموجود في الأمعاء البشرية.- قم بتوصيل غشاء بولي كربونات بحجم 1 ميكرومتر بحشية الكولاجين وغشاء بولي كربونات بحجم 50 نانومتر بين حشوات الساندويتش السفلية والعلوية. الأوتوكلاف الحشوات مع الأغشية المرفقة باستخدام دورة أداة الجهاز الأولية (انظر الجدول 3).
- لطلاء الأغشية ، ضع كل حشية في طبق مربع معقم.
ملاحظة: يتم الطلاء في ظروف معقمة في خزانة السلامة الحيوية.- بالنسبة لحشية الكولاجين ، أضف 3 مل من الكولاجين (50 ميكروغرام / مل) إلى الغشاء واحتضانها لمدة 3 ساعات عند 37 درجة مئوية.
ملاحظة: احرص على عدم لمس الغشاء بطرف الماصة عند إضافة الكولاجين لتجنب إتلاف الغشاء. - بالنسبة لطلاء الميوسين ، ضع حشية الساندويتش مع جانب الحشية العلوي لأعلى في طبق بتري لتغطية الجانب العلوي من الغشاء ب 3 مل من الميوسين (0.025 مجم / مل). احتضان الحشيات عند 37 درجة مئوية لمدة 1 ساعة.
- بالنسبة لحشية الكولاجين ، أضف 3 مل من الكولاجين (50 ميكروغرام / مل) إلى الغشاء واحتضانها لمدة 3 ساعات عند 37 درجة مئوية.
- بعد وقت الحضانة ، قم بشفط محاليل الكولاجين والموسين من الحشيات الخاصة بكل منهما وجفف الغشاء بالهواء في خزانة السلامة الحيوية لمدة 30 دقيقة. أغلق الأطباق ، وأغلقها بغشاء مانع للتسرب في المختبر ، وقم بتخزين الحشيات على حرارة 4 درجات مئوية حتى الاستخدام.
- تجميع الأنابيب
ملاحظة: يوضح هذا القسم كيفية تجميع الأنبوب لتروية الجهاز. قبل التجميع ، الأوتوكلاف جميع القطع و / أو شراء تلك التي يتم تعبئتها بشكل فردي في حزمة معقمة. ضع جميع المكونات في خزانة السلامة الحيوية.- استخدم ثلاثة خطوط أنبوبية لكل جهاز ولكل خط أنبوب ، قطعة واحدة من خط أنابيب المضخة ، قطعتان من أنابيب ماربرين الطويلة (20 سم) ، قطعتان من أنابيب ماربرين القصيرة (8 سم) ، إبرة واحدة 40 مم لزجاجة التدفق الخارجي ، إبرة واحدة 120 مم لزجاجات التدفق 250 مل أو إبرة 80 مم لزجاجات التدفق الأصغر ، ثلاثة ذكور بالإضافة إلى سبع إناث من Luer إلى موصلات الشائكة ، وثلاثة محولات Luer ، وصمامان محبسان ثلاثي الاتجاهات.
- قم بتجميع خطوط الأنابيب من اليسار إلى اليمين باستخدام المكونات المعقمة والمعقمة المذكورة أعلاه (الشكل 4).
ملاحظة: رش كل مكون ب 70٪ إيثانول بين كل خطوة توصيل.
- الإعداد الإعلامي
ملاحظة: يصف هذا القسم كيفية تحضير الوسط لأنواع الخلايا المختلفة في الجهاز ، وكذلك كيفية نقل الوسط إلى زجاجات المصل بطريقة معقمة.- مكمل RPMI 1640 مع FBS المفلتر بنسبة 10٪ 0.22 ميكرومتر والمعطل بالحرارة. استكمل وسائط N2B27 حديثا باستخدام GDNF و AA.
- نقل المتوسطة إلى زجاجات المصل تحت ظروف معقمة. انقل 200 مل من وسائط RPMI 1640 إلى زجاجات سعة 250 مل و30 مل من وسائط N2B27 إلى زجاجات سعة 50 مل.
- تحضير الوسط البكتيري (RPMI 1640 + 10٪ FBS + 5٪ وسط زراعة De Man و Rogosa و Shapre [MRS]) في مرحلة لاحقة ، لأن هذا مطلوب فقط خلال ال 24 ساعة الأخيرة من التجربة.
- أغلق الزجاجات بحاجز ، وقم بتجعيدها من الألومنيوم ، والأوتوكلاف.
- لنقل الوسائط ، قم بإزالة تجعيد الألومنيوم باستخدام أداة إزالة الغطاء المناسبة (القطر = 20 مم). إزالة الحاجز كذلك. صب بعناية الوسط المحضر في زجاجات المصل دون لمس الزجاجة.
- للتعقيم ، قم بإشعال فتحة الزجاجة باستخدام موقد بنسن محمول. أغلق الزجاجات عن طريق رش الحاجز بنسبة 70٪ من الإيثانول ، وإضافته إلى الزجاجة ، وإغلاقه بتجعيد من الألومنيوم باستخدام مكشكش مانع للتسرب.
- ضع الزجاجات المغلقة في الحاضنة عند 37 درجة مئوية ، 5٪ CO2 لمدة 24 ساعة لتسخين الوسط إلى 37 درجة مئوية ، وكذلك لضمان عدم وجود علامات واضحة للتلوث قبل استخدام زجاجات الوسائط للجهاز.
3. بدء HuMiX
- تجميع NeuroHuMiX
ملاحظة: يشرح هذا القسم كيفية تجميع الجهاز. باختصار ، يتم تعقيم نظام التثبيت وإعادة إحكامه ، وبعد ذلك يتم وضع غطاء الكمبيوتر السفلي على قاعدة المشبك. بعد ذلك ، يتم تكديس الحشيات المطلية وأغطية الكمبيوتر العلوية على بعضها البعض ، متبوعة بالجزء العلوي من المشبك. أخيرا ، يتم شد المشبك لضغط الحشيات وجعل النظام خاليا من التسرب ومانعا للغاز. يوضح الشكل 4 الأجزاء المختلفة اللازمة للتجميع.- الأوتوكلاف المشابك واثنين من أغطية الكمبيوتر (أعلى وأسفل) قبل التجميع.
- أحكم ربط البراغي المستخدمة لتجميع الأجزاء العلوية والسفلية من المشبك (الشكل 4C ، D). افتح البراغي قبل عملية التعقيم وأعد شدها لاحقا.
- انقل غطاء الكمبيوتر السفلي المطلي والمجفف (الخطوة 2.2.3) (الشكل 4 A1) من طبق بتري المربع إلى الجزء العلوي من أساس المشبك عن طريق تثبيت البراغي الأربعة في زوايا غطاء الكمبيوتر.
ملاحظة: تجنب لمس غطاء الكمبيوتر لتقليل خطر التلوث. - ضع حشية الغرفة الظهارية متجهة لأعلى (أي مع وجود الغشاء في الأعلى) على غطاء الكمبيوتر باستخدام ملاقط معقمة. استخدم البراغي لمحاذاة الحشية وغطاء الكمبيوتر لضمان محاذاة منافذ المدخل والمخرج في زوايا الغطاء مع الفتحات الموجودة في الحشية (الشكل 3).
- باستخدام الملقط المعقم ، ضع حشية الساندويتش أعلى حشية الكولاجين ، بحيث يكون الجانب العلوي متجها لأعلى.
- ضع غطاء الكمبيوتر العلوي أعلى حشية الساندويتش. لتقليل خطر التلوث ، قم بذلك عن طريق لمس حواف الغطاء فقط (لا تلمس الجزء العلوي أو السفلي من الغطاء). تأكد من محاذاة الأشواك الموجودة على غطاء المشبك مع فتحة المدخل والمخرج في مجموعة الغشاء ، وأن البراغي الموجودة من غطاء الكمبيوتر السفلي تتناسب مع فتحة غطاء الكمبيوتر العلوي.
- لإغلاق الجهاز ، ضع غطاء المشبك (الجزء العلوي من المشبك) أعلى غطاء الكمبيوتر. تأكد من أن فتحات الغطاء تتزامن مع أشواك مدخل ومخرج غطاء الكمبيوتر العلوي. أغلق المزالج. احتفظ بالجهاز المغلق (الشكل 5) تحت الغطاء للاتصال بخطوط الأنابيب المهيأة (الخطوة 3.2.6).
- فتيلة خطوط الأنابيب
ملاحظة: يصف هذا القسم كيفية توصيل الأنبوب بزجاجات التدفق الداخلي والخارج ، وكذلك بالمضخة ، ثم تجهيز الأنبوب بوسيط لإزالة أي منتجات متبقية تستخدم أثناء التنظيف والتعقيم ، والتأكد من عدم وجود فقاعات في الأنبوب.- يتم تنفيذ فتيلة خطوط الأنابيب في خزانة السلامة البيولوجية. أدخل إبر التهوية مع مرشحات في حاجز كل زجاجة تدفق وتدفق. باستخدام ملاقط نظيفة ومعقمة ، أدخل الإبر مقاس 120 مم في زجاجات المصل سعة 250 مل. أدخل الإبر مقاس 80 مم في زجاجات المصل سعة 50 مل.
- أدخل الإبر مقاس 40 مم ، في نهاية كل خط أنابيب ، في زجاجة مصل التدفق. لكل جهاز ، هناك زجاجتان للتدفق الخارجي لخطوط الأنابيب الثلاثة. يتم توصيل الإبر مقاس 40 مم لخطوط الأنابيب الظهارية والعصبية بنفس زجاجة التدفق الخارجي للتخلص المتوسط. يذهب خط الأنبوب البكتيري إلى زجاجة التدفق الثانية.
- أدخل خطوط أنابيب المضخة في أشرطة المضخة. تأكد من أن جميع المحابس ثلاثية الاتجاهات لخطوط الأنابيب مفتوحة.
- في البداية ، اضبط المضخة التمعجية لتوجيه الوسائط من التدفق إلى زجاجة التدفق الخارجي بسرعة 5 دورات في الدقيقة (انظر الجدول 4).
ملاحظة: أثناء تحضير خط الأنابيب ، يمكن زيادة السرعة حتى 10 دورات في الدقيقة لتسريع العملية. - ابدأ تشغيل المضخة بالضغط على زر البدء وتأكد من أن اتجاه حركة الضخ في اتجاه عقارب الساعة. بمجرد سقوط الوسائط في زجاجات التدفق الخارجي ، تأكد من عدم وجود تسريبات وعدم ترك فقاعات هواء في خطوط الأنابيب ونقاط الاتصال. قم بإزالة أي فقاعات متبقية عن طريق النقر على الأنبوب والموصلات أو عن طريق زيادة سرعة المضخة.
- عندما تسقط جميع خطوط الأنبوب في زجاجات التدفق الخارجي ، اضبط معدل التدفق على 2 دورة في الدقيقة لتوصيل الجهاز الأولي.
- فتيلة الجهاز
ملاحظة: يصف هذا القسم كيفية تجهيز الجهاز بوسط زراعة الخلايا لضمان ملء جميع الغرف وتغطيتها مسبقا بالوسط ، بحيث لا تترك فقاعات في النظام ويمكن للخلايا أن تلتصق بسهولة أثناء التلقيح.- يتم تنفيذ فتيلة الجهاز في خزانة السلامة البيولوجية في ظل ظروف معقمة. لتوصيل الجهاز ، ابدأ بتوصيل الخط العصبي ، الغرفة السفلية للجهاز.
- لتوصيل خط ، أغلق صمامات المحبس ثلاثية الاتجاهات (الشكل 5C) ، بدءا أولا من جانب التدفق الخارجي ، حيث يتم فصل الأنبوب القصير عن موصل Luer الأنثوي وتوصيله بمنفذ المخرج من الجهاز ، عن طريق دفع الأنبوب فوق الشوكة. لضمان التوصيل المناسب وتقليل فرصة حدوث تسرب و / أو تلوث ، تأكد من أن الأنبوب ملامس للغطاء عن طريق دفعه لأسفل فوق الموصل. قم بتوصيل أنبوب التدفق بنفس الطريقة. بمجرد توصيل سطر واحد بالكامل بالجهاز (التدفق الداخلي والخارج) ، افتح محبس ثلاثي الاتجاهات.
- كرر الخطوة السابقة مع الخط الظهاري ، ثم مع الخط البكتيري. حافظ على المضخة بمعدل تدفق 2 دورة في الدقيقة. قم بزيادة سرعة المضخة إلى 2.5 دورة في الدقيقة ، ولكن ليس أعلى ، لتجنب التسرب بسبب تراكم الضغط. اسمح للمضخة بتجهيز الغرف في الجهاز.
- راقب زجاجات مصل التدفق الخارجي في جميع الأوقات. إذا علقت فقاعات الهواء في الغرف أو الخطوط أو الموصل ، فلن يسقط خط الأنبوب الذي يحتوي على فقاعة هواء بداخله في غرفة التدفق الخارج. للتخلص من فقاعات الهواء ، اترك الأجهزة تعمل أولا لبضع دقائق. إذا لم يؤد ذلك إلى حل المشكلة، أغلق أحد الخطوط الأخرى التي تنخفض لفترة قصيرة من الوقت عن طريق إغلاق محبس ثلاثي الاتجاهات للتدفق الخارجي.
- بمجرد تجهيز جميع غرف الجهاز بالكامل - تمتلئ جميع الغرف بوسط زراعة الخلايا ولا تبقى فقاعات في الجهاز - قلل سرعة المضخة إلى 0.5 دورة في الدقيقة. الجهاز جاهز الآن لتلقيح الخلايا.
4. إعداد الخلايا والتلقيح
ملاحظة: يصف هذا القسم كيفية تحضير أنواع الخلايا المختلفة اللازمة لتلقيح الجهاز ، وكذلك كيفية تلقيحها في الجهاز بطريقة معقمة ودون إدخال فقاعات هواء. علاوة على ذلك ، فإنه يصف كيفية إجراء المرطبات المتوسطة للخلايا العصبية ، وكيفية تحضير الوسط للثقافة البكتيرية في الجهاز.
- الخلايا الظهارية
- افصل خلايا Caco-2 عن القارورة باستخدام حمض التربسين-إيثيلين ديامينيترايتيك (EDTA) ، وأعد التعليق في RPMI 1640 + 10٪ FBS ، وعد في عداد خلايا نيوباور باستخدام مقايسة استبعاد التريبان الأزرق. قم بطرد مركزي لتعليق خلية Caco-2 (3 دقائق ، 300 × جم) ، وتخلص من المادة الطافية لإزالة التربسين-EDTA المتبقي. أعد تعليق خلايا Caco-2 في RMPI 1640 + 10٪ FBS للحصول على تعليق 350000 خلية / مل. لكل جهاز ، هناك حاجة إلى حجم 1.5 مل.
- انقل 1.5 مل من معلق خلية Caco-2 إلى حقنة معقمة سعة 2 مل وقم بإزالة أي هواء أو فقاعات متبقية في المحقنة.
- أغلق صمامات المحبس ثلاثية الاتجاهات لأنابيب الغرف البكتيرية والعصبية. افصل أنبوب الغرف البكتيرية والعصبية عن المضخة عن طريق إزالة الكاسيتات مع الأنبوب المعني من الدوار.
- افتح غطاء صمام المحبس ثلاثي الاتجاهات لأنبوب التدفق المؤدي إلى الغرفة الظهارية وقم بتدوير صمام المحبس ثلاثي الاتجاهات لإعادة توجيه التدفق المتوسط من الجهاز إلى "الموصل المفتوح" (الشكل 5C). اترك الوسط يتدفق حتى تظهر قطرة من الوسط في الطرف المفتوح لصمام المحبس ثلاثي الاتجاهات.
- أدخل المحقنة التي تحتوي على الخلايا الظهارية في "الموصل المفتوح" باستخدام طريقة التوصيل بإسقاط وإسقاط للسماح بإدخال المحقنة في الموصل دون إدخال فقاعات هواء. أدر صمام المحبس ثلاثي الاتجاهات لإيقاف تدفق الوسط من زجاجة التدفق (عبر المضخة) وللسماح بالتدفق من المحقنة المتصلة إلى الجهاز الأولي. افصل القناة الظهارية عن المضخة.
- اضغط ببطء على المحقنة لتلقيح الغرفة الظهارية بتعليق الخلية. تأكد من أن قطرة واحدة تقريبا لكل 3 ثوان تسقط في زجاجة التدفق الخارج.
- أضف 1.5 مل من تعليق الخلية ، ثم أغلق صمام محبس التدفق ثلاثي الاتجاهات. افصل المحقنة وأغلق الطرف المفتوح للمحبس ثلاثي الاتجاهات بالغطاء. حافظ على الغرفة مغلقة لمدة 2 ساعة على الأقل. في غضون ذلك ، تلقيح الخلايا العصبية.
- الخلايا العصبية
- افصل الخلايا العصبية عن البئر عن طريق إعادة تعليق الخلايا الموجودة في الوسائط من الآبار المعنية باستخدام ماصة. قم بتلقيح كل جهاز بخلايا متقاربة بالكامل من بئر واحد (9.6 سم2) من لوحة ذات 6 آبار.
- أعد تعليق حبيبات الخلية في الحجم المتوسط N2B27 المقابل (1.5 مل من الوسائط لكل جهاز) + 1 ميكرولتر من الفبرونيكتين / مل من تعليق الخلية. انقل 1.5 مل من معلق الخلية المعاد تعليقه إلى حقنة سعة 2 مل وقم بإزالة أي فقاعات هواء متبقية في المحقنة. ضع المحقنة المملوءة في أنبوب مخروطي معقم سعة 50 مل وانقله إلى خزانة السلامة البيولوجية التي تحتوي على جهاز HuMiX المجهز.
- اتبع نفس عملية التلقيح كما هو موضح سابقا لتلقيح الغرفة الظهارية ، باستثناء تغيير خط الأنبوب. هنا ، افصل خطوط الأنابيب البكتيرية والظهارية عن المضخة.
- بعد تلقيح الخلايا العصبية ، أغلق جميع المحبس ثلاثي الاتجاهات لخطوط الأنبوب وافصله عن المضخة. ضع الجهاز في الحاضنة عند 37 درجة مئوية و 5٪ CO2. احتفظ بجميع القنوات مغلقة لمدة 2 ساعة للسماح للخلايا بالتعلق.
- بعد 2 ساعة ، قم بتوصيل القنوات البكتيرية والظهارية بالمضخة وافتح محبس التدفق والتدفق ثلاثي الاتجاهات لكلا الخطين. حافظ على إغلاق الغرفة العصبية خلال ال 14 يوما القادمة من تشغيل الجهاز الأولي ، باستثناء أثناء التغيير المتوسط.
- خلال 14 يوما ، قم بتغيير وسيط الغرفة العصبية كل 3-4 أيام. للتحديث المتوسط ، قم بإعداد 3 مل من وسط N2B27 الطازج لكل جهاز وانقله إلى زجاجة مصل معقمة سعة 20 مل. أغلق زجاجة المصل بوسط باستخدام حاجز معقم وختم تجعيد من الألومنيوم.
- أدخل تهوية وإبرة 80 مم في حاجز الزجاجة الجديدة. استبدل زجاجة الوسائط القديمة بالأخرى الجديدة في الحاضنة عن طريق فصل الذكر Luer من إبرة الزجاجة القديمة إلى إبرة الزجاجة الجديدة.
- قم بتوصيل الكاسيت بأنبوب المضخة للغرفة العصبية بالمضخة وافتح المحبس ثلاثي الاتجاهات. دع الوسائط تتدفق عند 0.5 دورة في الدقيقة لمدة 2 ساعة قبل إغلاق المحبس ثلاثي الاتجاهات للأنبوب العصبي وفصله عن المضخة ، حتى التبادل المتوسط التالي.
5. الثقافة البكتيرية والتلقيح
ملاحظة: في هذه الدراسة ، في اليوم 12 ، تم إعادة تنشيط مزرعة سائلة من سلالة Limosilactobacillus reuteri F275 من مخزون الجلسرين. اعتمادا على الاحتياجات أو تصميمات الدراسة ، يمكن استخدام الأنواع البكتيرية الأخرى.
- تحضير ثلاثة أنابيب مع 5 مل من مرق MRS - أنبوب تحكم معقم واحد واثنان لتلقيح L. reuteri. باستخدام حلقة التلقيح ، اكشط الجزء العلوي من مخزون الجلسرين وانقله إلى أنبوب واحد. كرر مع أنبوب تلقيح ثان. احتضان الأنابيب عند 37 درجة مئوية ، 170 دورة في الدقيقة بين عشية وضحاها.
ملاحظة: لا تدع مخزون الجلسرين يذوب. - قم بإعداد وسيط جديد للأجهزة الأولية عن طريق خلط معهد روزويل بارك التذكاري (RPMI) 1640 + 10٪ FBS مع مرق MRS 5٪. تحضير 25 مل لكل جهاز ونقلها إلى زجاجات مصل 100 مل في ظروف معقمة. أغلق الزجاجات بحاجز معقم وتجعيد من الألومنيوم. ضع الزجاجات في الحاضنة عند 37 درجة مئوية ، 5٪ CO2 طوال الليل.
- قبل توصيل الزجاجات بخط الأنبوب البكتيري ، أضف إبرة تهوية وإبرة 80 مم إلى كل زجاجة من وسائط RPMI 1640 / MRS.
- قم بإعداد أنابيب جديدة ، تحتوي كل منها على 3 مل من RPMI 1640 + 10٪ FBS + 5٪ مرق MRS. قم بإعداد أنبوبين على الأقل ، تحكم واحد وأنبوب واحد لكل جهاز. تلقيح 15 ميكرولتر من مزرعة L. reuteri الليلية (الكثافة البصرية [OD] > 2) في اثنين من الأنابيب المعدة حديثا.
- احتضان الأنابيب لمدة 1 ساعة عند 37 درجة مئوية ، 170 دورة في الدقيقة ، وبعد ذلك يتم الوصول إلى OD من 0.05-0.10 ، المقابلة ل ~ 1 × 107 وحدات تشكيل مستعمرة (CFU) / مل. انقل 1.5 مل إلى حقنة سعة 2 مل (واحدة لكل جهاز). استخدم بقية المعلق البكتيري لطلاء CFU والبقع الحية / الميتة.
- للتلقيح البكتيري للجهاز ، اتبع نفس الإجراء كما هو مذكور في الخطوة 4.1 ، باستثناء أنه هنا يتم إغلاق خطوط الأنابيب العصبية والظهارية.
- بعد التلقيح ، أغلق خط الأنبوب البكتيري أيضا ، عن طريق إغلاق الصمامات وفصلها عن المضخة لمدة 30 دقيقة. قم بتوصيل خطوط الأنابيب الظهارية والبكتيرية وافتحها مرة أخرى. دع الأجهزة تعمل لمدة 24 ساعة أخرى عند 37 درجة مئوية و 0.5 دورة في الدقيقة.
6. فتح HuMiX وأخذ العينات
ملاحظة: يصف القسم أدناه أخذ عينات من أنواع الخلايا المختلفة. على سبيل المثال ، تستخدم كريات الخلايا العصبية لاستخراج الحمض النووي الريبي وتفاعل البلمرة المتسلسل الكمي اللاحق (qPCR) ، والكريات البكتيرية لاستخراج الحمض النووي وتسلسل جين 16S rRNA ، والطافات لمقايسات الممتز المناعي المرتبط بالإنزيم (ELISAs) والمقايسات الأخرى (على سبيل المثال ، مقايسة اللاكتات).
- في اليوم 14 ، يوم الافتتاح ، أغلق جميع المحبس ثلاثي الاتجاهات ، وافصل الأنابيب عن المضخة ، وأخرج جهاز الحاضنة إلى مقعد المختبر.
ملاحظة: عند تحريك الجهاز، تأكد من إبقاء الجهاز الفعلي أفقيا. - قم بإزالة خطوط الأنابيب المتصلة بالجهاز قبل فتح المشبك ببطء وإزالة غطاء المشبك. بحذر ، قم بإزالة غطاء الكمبيوتر العلوي ، وجمع الوسائط في أنبوب طرد مركزي دقيق سعة 1.5 مل ، وضعه على الجليد.
- قم بإزالة حشية الساندويتش برفق ، أثناء جمع الوسائط من الغرفة الظهارية ؛ احرص على عدم لمس طبقة الخلية. ضع حشية الساندويتش في طبق بتري مربع وأضف محلول كلوريد الصوديوم المعقم 0.9٪ في H2O إلى الغرفة البكتيرية حتى يتم تغطية الحجرة بالكامل (حوالي 1 مل).
- قم بإزالة حشية الكولاجين ببطء أثناء جمع الوسائط من الغرفة العصبية ونقلها إلى أنبوب طرد مركزي دقيق. ضع جميع أنابيب الوسائط على الثلج. ضع حشية الكولاجين في طبق مربع وأضف برفق بضعة ملليلتر من 1x PBS إلى طبقة Caco-2 حتى يتم تغطية طبقة الخلية بالكامل.
- ضع غطاء الكمبيوتر السفلي في طبق بتري مربع وأضف برفق حوالي 2 مل من 1x PBS فوق الخلايا العصبية ، حتى لا تجف أثناء عملية أخذ العينات.
- جهاز طرد مركزي أنبوب الوسائط البكتيرية عند 5000 × جم لمدة 5 دقائق عند 4 درجات مئوية. أجهزة الطرد المركزي أنابيب الوسائط الظهارية والعصبية عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. بعد الطرد المركزي ، انقل طاف كل أنبوب إلى أنبوب طرد مركزي جديد وضعه على الفور على الثلج الجاف.
- الخلايا الظهارية
- قم بإزالة PBS برفق من الحشية واجمعه في أنبوب مخروطي سعة 15 مل. أضف 2 مل من التربسين إلى الخلايا واحتضان الحشية لمدة 5 دقائق عند 37 درجة مئوية ، 5٪ CO2. أضف 2 مل من RPMI 1640 إلى الحشية بعد الحضانة ، وأعد تعليق الخلايا ، واجمع في أنبوب مخروطي آخر سعة 15 مل.
- أجهزة الطرد المركزي كلا الأنبوبين لمدة 5 دقائق عند 300 × جم. تخلص من المادة الطافية. أعد تعليق الحبيبات من غسيل PBS في 300 ميكرولتر من PBS وحبيبات الخلية في 1 مل من PBS.
- انقل 50 ميكرولتر من كل أنبوب إلى أنبوب طرد مركزي دقيق سعة 0.5 مل لعداد الخلايا الآلي وعدد خلايا مقايسة الاستبعاد الأزرق trypan. انقل حبيبات الخلايا المعاد تعليقها (1 مل) إلى أنبوب 1.5 مل وأجهزة طرد مركزي عند 300 × جم لمدة 5 دقائق.
- قم بإزالة المادة الطافية وأعد تعليق حبيبات الخلية في 250 ميكرولتر من محلول التحلل + 1٪ بيتا ميركابتوإيثانول وضع الأنبوب على الثلج الجاف.
- الخلايا العصبية
- خذ طبق بتري المربع ، مع غطاء الكمبيوتر السفلي الشفاف مع الخلايا العصبية من الخطوة السابقة (6.5) إلى مجهر تباين الطور المقلوب.
ملاحظة: أثناء تحريك غطاء الكمبيوتر مع وجود PBS فوقه ، كن لطيفا جدا ، حيث تنفصل الشبكة العصبية بسهولة بالغة. - قم بإجراء فحص أخير للجودة قبل التلقيح من خلال مراقبة التشكل وكثافة الخلايا للخلايا العصبية باستخدام مجهر برايتفيلد. تحقق من أن الخلايا قد هاجرت من الأجسام الكروية وأن شبكة عصبية قد تشكلت. يجب أن تكون الشبكة العصبية متقاربة بنسبة 90٪ تقريبا. لمزيد من التفاصيل، يرجى الرجوع إلى Fattahi et al.6.
- على مقاعد البدلاء ، أعد تعليق الخلايا في PBS وجمعها في أنبوب سعة 1.5 مل. الطرد المركزي الأنبوب في 300 × غرام لمدة 3 دقائق. تخلص من المادة الطافية ، وأعد تعليق حبيبات الخلية في 250 ميكرولتر من محلول التحلل + 1٪ بيتا ميركابتوإيثانول ، وضعها على الثلج الجاف.
ملاحظة: يمكن إجراء تلطيخ المناعي (IF) على الخلايا العصبية على غطاء الكمبيوتر الشخصي. إذا كان تلطيخ IF هو الفحص المفضل حتى لا يتم تدمير الشبكة العصبية ، فيجب تثبيت الخلايا على غطاء الكمبيوتر الشخصي بنسبة 4٪ بارافورمالدهايد (PFA) ، مما يعيق إعادة استخدام غطاء الكمبيوتر الشخصي في التجارب المستقبلية.
- خذ طبق بتري المربع ، مع غطاء الكمبيوتر السفلي الشفاف مع الخلايا العصبية من الخطوة السابقة (6.5) إلى مجهر تباين الطور المقلوب.
- الخلايا البكتيرية
- أعد تعليق الخلايا البكتيرية المرتبطة بالغشاء في محلول كلوريد الصوديوم 0.9٪. إذا كانت الخلايا متصلة بإحكام ، فاستخدم مكشطة الخلايا برفق لفصل الخلايا البكتيرية عن الغشاء.
ملاحظة: يمكن أن يؤدي استخدام مكشطة إلى تلف الخلايا ، مما يزيد من احتمال رؤية المزيد من الخلايا الميتة. - اجمع معلق الخلية في أنبوب مخروطي سعة 15 مل. أضف الحبيبات المتبقية من الوسائط التي تم جمعها مسبقا إلى الأنبوب المخروطي سعة 15 مل. جهاز طرد مركزي عند 5000 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من المادة الطافية وأعد تعليق حبيبات الخلية في 1 مل من محلول كلوريد الصوديوم 0.9٪.
- قسم هذا الحجم إلى ثلاثة أجزاء: واحد لتجميد حبيبات بكتيرية لاستخراج الحمض النووي (650 ميكرولتر) ، وواحد لطلاء CFU (50 ميكرولتر) على ألواح MRS ، وواحد للتلطيخ الحي / الميت (300 ميكرولتر). لتحضير الحبيبات لاستخراج الحمض النووي ، انقل تعليق الخلية إلى أنبوب طرد مركزي دقيق ، جهاز طرد مركزي عند 5000 × جم لمدة 5 دقائق عند 4 درجات مئوية وتخلص من المادة الطافية. ضع بيليه الخلية على الثلج الجاف.
- في نهاية أخذ العينات ، انقل جميع الأنابيب الموجودة على الثلج الجاف إلى مجمد -80 درجة مئوية لتخزينها لإجراء تحليلات لاحقة في اتجاه مجرى النهر.
ملاحظة: يمكن استخدام الطافات أيضا لتحليل كروماتوغرافيا الغاز - قياس الطيف الكتلي (GC-MS). علاوة على ذلك ، أثناء الفتح ، يمكن تقسيم الغشاء المطلي بالكولاجين إلى أجزاء مختلفة لإجراء تحليلات مختلفة - نصفه يستخدم في تلطيخ انسداد IF ، وجزء آخر لاستخراج الحمض النووي الريبي لمزيد من تحليل التعبير الجيني ، وجزء آخر لعد الخلايا.
- أعد تعليق الخلايا البكتيرية المرتبطة بالغشاء في محلول كلوريد الصوديوم 0.9٪. إذا كانت الخلايا متصلة بإحكام ، فاستخدم مكشطة الخلايا برفق لفصل الخلايا البكتيرية عن الغشاء.
النتائج
في neuroHuMiX ، شاركنا في زراعة ثلاثة أنواع مختلفة من الخلايا معا - الخلايا البكتيرية والظهارية والخلايا العصبية (الشكل 1). للتأكد من أن جميع الخلايا قابلة للحياة ، أجرينا فحوصات مختلفة على أنواع الخلايا المختلفة. على سبيل المثال ، أجرينا تعداد CFU على الخلايا البكتيرية ، وعدد الخلايا وفحوصات صلاحية الخلية على الخلايا الظهارية ، بينما تم تقييم الخلايا العصبية من خلال التحليلات المجهرية.
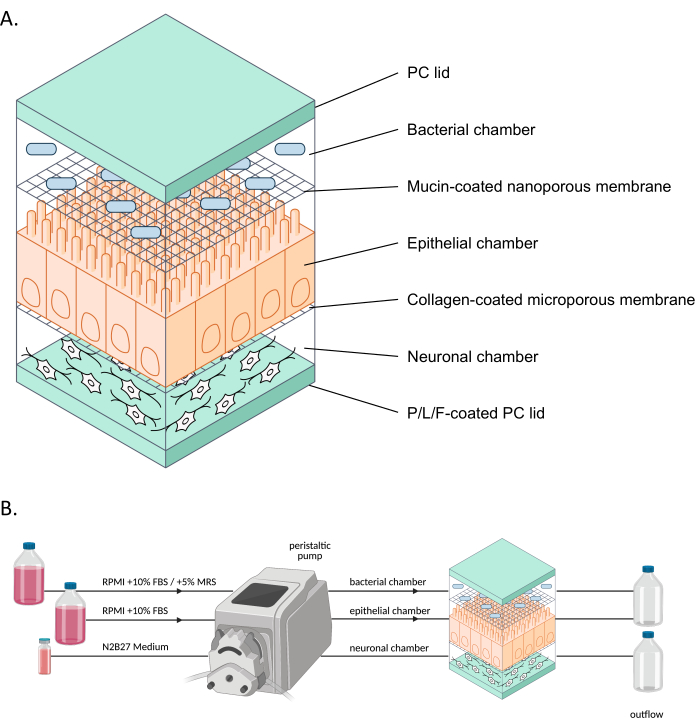
الشكل 1: التمثيل التخطيطي ل neuroHuMiX وإعداده التجريبي . (أ) توضع الغرف الثلاث بين غطاءين للكمبيوتر لإبقائها مغلقة. تمتلئ كل غرفة بوسط معين للخلايا المزروعة في الداخل. يتم فصل الغرف المختلفة بواسطة أغشية شبه منفذة تسمح باتصال الخلية عبر عوامل قابلة للذوبان تمر عبر الأغشية. ب: تمثيل إعداد الجهاز العصبي HuMiX. كل غرفة متصلة بزجاجات وسائط مختلفة. بالنسبة للغرفة البكتيرية ، خلال أول 12.5 يوما ، يتم توصيل الغرفة ب RPMI + 10٪ FBS ، قبل تغييرها لآخر 36 ساعة إلى RPMI + 10٪ FBS + 5٪ MRS. الاختصارات: PC = البولي ؛ P / L / F = بولي L- أورنيثين / لامينين / فيبرونيكتين. RPMI = وسط زراعة الخلايا في معهد روزويل بارك التذكاري ؛ MRS = وسط ثقافة دي مان وروجوسا وشابري. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتحديد ما إذا كانت الخلايا متصلة بشكل مناسب ، عند فتح الأجهزة ، قمنا بتقييم تكوين طبقة خلية على الغشاء المطلي بالكولاجين (الشكل 6 أ). للتأكد من أن الخلايا الموجودة في الجهاز قابلة للحياة ، تم إجراء عدد عداد الخلايا الآلي (الشكل 6B) وعدد خلايا مقايسة استبعاد تريبان الأزرق (الشكل 6C). تم إجراء المقايسات على خلايا Caco-2 من ثلاثة إعدادات HuMiX مختلفة: (i) Caco-2 في الثقافة مع ENs ، (ii) Caco-2 في الثقافة مع L. reuteri ، و (iii) الجهاز الذي يتضمن الزراعة المشتركة لجميع أنواع الخلايا الثلاثة. لم تسفر الاختبارات الإحصائية باستخدام ANOVA أحادي الاتجاه عن أي اختلافات ذات دلالة إحصائية بين أنواع الخلايا ، مما يشير إلى أن خلايا Caco-2 ظلت قابلة للحياة في جميع إعدادات الجهاز الأولية هذه والظروف التي تم اختبارها في هذه الدراسة. هذا يؤكد حقيقة أن الكثافة البكتيرية التي تم الوصول إليها خلال الزراعة المشتركة ل L. reuteri ونوعي الخلايا البشرية ليس لها تأثيرات سامة للخلايا على الخلايا البشرية.
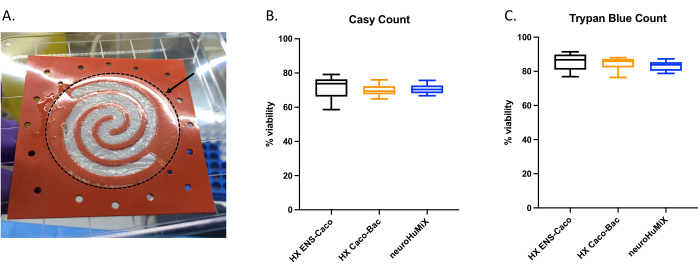
الشكل 6: تقييم خلايا Caco-2 على الغشاء المغلف بالكولاجين. أ: طبقة من خلايا Caco-2 على الغشاء المغلف بالكولاجين بعد الفتح. يشير السهم إلى الغشاء المطلي بالكولاجين ، المحاط بدائرة متقطعة. كانت خلايا Caco-2 تنمو على الشكل الحلزوني على الغشاء. صلاحية الخلية لخلايا Caco-2 بعد 14 يوما في HuMiX. تم الحصول على عدد الخلايا باستخدام (B) عداد الخلايا الآلي و (C) عدد خلايا مقايسة الاستبعاد الأزرق trypan. تم تحديد عدد خلايا Caco-2 من إعدادات الثقافة المختلفة في الجهاز الأولي: الثقافة المشتركة مع الخلايا العصبية المعوية (ENs) (أسود) ، والثقافة المشتركة مع L. reuteri (برتقالي) ، وفي الجهاز (ENs و L. reuteri) (أزرق). تم إجراء ANOVA أحادي الاتجاه ، مما يدل على عدم وجود فرق كبير بين إعدادات الثقافة المختلفة (ANOVA أحادي الاتجاه ، p = 0.1234 [ns] ؛ تشير أشرطة الخطأ إلى خطأ قياسي). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتكون قادرة على زراعة L. reuteri مع خلايا الثدييات ، قمنا أولا بتحسين وتكييف وسائط الاستزراع لاستخدامها في الجهاز. وجدنا أن مزيج 5٪ من MRS في RPMI 1640 (مكمل ب 10٪ FBS) كان مناسبا بشكل مثالي لنمو L. reuteri ، بينما لم يكن ساما للخلايا لخلايا الثدييات المستخدمة في هذه المقايسات. بعد ذلك ، تم إجراء عدد CFU لتقييم نمو L. reuteri عند استزراعه في الجهاز لمدة 24 ساعة. تم تقييم عدد CFU لإعدادين أوليين مختلفين للجهاز (الشكل 7) -L. reuteri مشترك مع Caco-2 و L. reuteri في الجهاز . في كلا الإعدادين ، كان عدد CFU مختلفا بشكل كبير عن لقاح HuMiX والخلايا المحصودة (ANOVA أحادي الاتجاه ، p = 0.0002) ، مما يشير إلى نمو الخلايا البكتيرية داخل الجهاز الأولي.
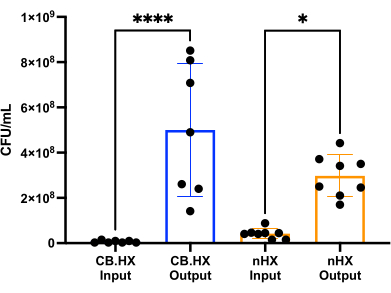
الشكل 7: Limosilactobacillus reuteri CFU عدد اللقاح (مخفف 1: 100000) وبعد 24 ساعة في HuMiX. إعدادان مختلفان: خلايا Caco-2 في الثقافة المشتركة مع L. reuteri والجهاز. يظهر ANOVA أحادي الاتجاه فرقا كبيرا (p = 0.0002 [***]) بين اللقاح والخلايا المحصودة ، مما يعني أن البكتيريا تنمو داخل HuMiX. تشير أشرطة الخطأ إلى الخطأ القياسي. الاختصارات: CB. HX = بكتيريا Caco-2 HuMiX ؛ nHX = neuroHuMiX. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
لتقييم ما إذا كان زرع ENs داخل الجهاز سيغير النمط الظاهري للخلايا ، لوحظ التشكل الإجمالي ل ENs باستخدام مجهر تباين الطور المقلوب. خلال هذه الخطوة ، تم تقييم كل من التقاء ومورفولوجيا EN. يشير إنشاء شبكة عصبية متقاربة إلى أن الخلايا قد تعلقت جيدا بغطاء الكمبيوتر الشخصي للجهاز المطلي. الأهم من ذلك ، أن هذا يسلط الضوء على فكرة أنهم نشأوا في ثقافة مشتركة مع Caco-2 و L. reuteri. كانت الحافة بين الشبكة العصبية المتقاربة واللولب المحدد بالحشية واضحة بوضوح (الشكل 8).
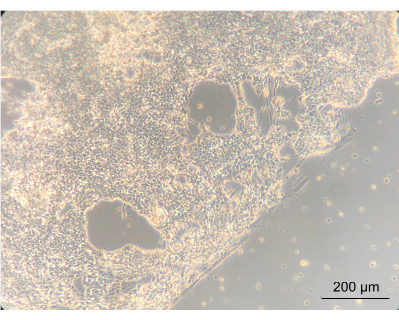
الشكل 8: الخلايا العصبية المعوية بعد 14 يوما من الزراعة في الجهاز. على الجانب الأيسر من الصورة ، نمت الخلايا العصبية إلى طبقة متقاربة على اللولب. الحافة ، بين الطبقة العصبية والفضاء بدون خلايا ، هي حافة اللولب. مكبرة 10x ، شريط المقياس = 200 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: الأغطية المستخدمة في الجهاز. تظهر الصور أغطية الكمبيوتر العلوية (اليسرى) والسفلية (اليمنى). كل جانب من غطاء الكمبيوتر الشخصي 6.4 سم. اختصار: PC = البولي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: حشية الغرفة الظهارية على غطاء الكمبيوتر السفلي. منظر علوي لحشية الغرفة الظهارية الموضوعة على غطاء الكمبيوتر السفلي (يسار) ، ومنظر سفلي (يمين) يوضح محاذاة حشية الغرفة الظهارية مع مداخل ومنافذ غطاء الكمبيوتر السفلي. يبلغ طول كل جانب من جوانب الحشيات ، وكذلك غطاء الكمبيوتر الشخصي ، 6.4 سم. اختصار: PC = البولي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تجميع الجهاز. (أ) أجزاء مختلفة لتجميع HuMiX: (1) غطاء الكمبيوتر السفلي ؛ (2) حشية بغشاء صغير يسهل اختراقه مطلي بالكولاجين ، والذي يوضع فوق (1) ؛ (3) حشية شطيرة مع غشاء نانوي مسامي مطلي بالميوسين بينهما وتوضع فوق (2) ؛ (4) غطاء الكمبيوتر العلوي الموضوع أعلى (3). يبلغ قياس كل جانب من جوانب الحشيات وأغطية الكمبيوتر 6.4 سم. (ب) جميع الأجزاء من (أ) موضوعة معا. (ج، د) عرض الجهاز المجمع (يسار) والجانب (يمين). يتم وضع B في نظام التثبيت لإغلاق النظام. (ج) قياس كل جانب من المشبك العلوي 8 سم. اختصار: PC = البولي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
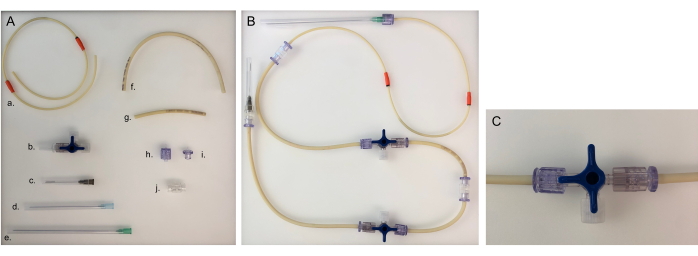
الشكل 5: الأجزاء اللازمة لخط الأنابيب وخط الأنابيب المجمع لغرفة واحدة. (أ) أجزاء مختلفة لبناء خط الأنابيب: أ. خط أنابيب المضخة. ب. محبس ثلاثي الاتجاهات. ج. إبرة 40 مم ؛ د. إبرة 80 مم ؛ ه. إبرة 120 مم ؛ و. خط أنابيب طويل (20 سم) ؛ ز. خط أنابيب قصير (8 سم) ؛ ح. ذكر لوير. ط. أنثى لوير. J. محول. ب: خط أنابيب مجمع للحجرة البكتيرية أو الطلائية. بالنسبة للغرفة العصبية ، يجب تغيير الإبرة التي يبلغ قطرها 120 مم إلى إبرة مقاس 80 مم. (C) تحول صمام المحبس ثلاثي الاتجاهات لإعادة توجيه التدفق المتوسط من الجهاز إلى "الموصل المفتوح" وإغلاق الحجرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| يوم | 0 | 2 | 4 | 6 | 8 | 10 |
| التركيب الإعلامي | 100٪ E6 | 100٪ E6 | 75٪ E6 | 50٪ E6 | 25٪ E6 | 100٪ N2 |
| + LDN | + LDN | 25٪ N2 | 50٪ N2 | 75٪ N2 | + LDN | |
| + SB | + SB | + LDN | + LDN | + LDN | + SB | |
| + شير | + SB | + SB | + SB | + شير | ||
| + شير | + شير | + شير | + را | |||
| + را | + را | |||||
| جزيء | [تركيز] | |||||
| LDN | 100 نيوتن متر | |||||
| س.ب | 10 ميكرومتر | |||||
| شير | 3 ميكرومتر | |||||
| حمض الريتينويك (RA) | 1 ميكرومتر |
الجدول 1: تكوين وسائل الإعلام.
| وسائط | المكونات (التركيزات المدرجة في جدول المواد) | الحجم (مل) |
| وسائط N2 (50 مل) | DMEM-F12 | 48 |
| ملحق N2 | 0.5 | |
| إل-جلوتامين | 0.5 | |
| البنسلين / الستربتومايسين | 0.5 | |
| نيا | 0.5 | |
| وسائط N2B27 / ENS (50 مل) | العصبية القاعدية | 48 |
| ملحق N2 | 0.5 | |
| إل-جلوتامين | 0.5 | |
| البنسلين / الستربتومايسين | 0.5 | |
| ب٢٧-أ | 0.5 |
الجدول 2: وصفات الوسائط.
| درجة حرارة التعقيم (°C) | 116 |
| وقت التعقيم (دقيقة) | 20 |
| وقت الجفاف (دقيقة) | 10 |
| البقول | 3 |
| درجة الحرارة النهائية (°C) | 99 |
الجدول 3: تشغيل الأوتوكلاف HuMiX.
| الدورات في الدقيقة (دورة في الدقيقة) | متوسط معدل التدفق (ميكرولتر / دقيقة) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
الجدول 4: معدلات تدفق المضخة التمعجية.
Discussion
ثبت الآن أن ميكروبيوم الأمعاء البشرية يؤثر على صحة المضيف ومرضه. على الرغم من المعرفة التي تشير إلى أهمية الميكروبيوم لدينا ، وخاصة في الاضطرابات العصبية مثل مرض الزهايمر أو مرض باركنسون3،13 ، لا يزال من غير المعروف إلى حد كبير كيف يتفاعل ميكروبيوم الأمعاء مع الجهاز العصبي المعوي ، وبعد ذلك ، مع الدماغ.
لم يتوفر حتى الآن نموذج تمثيلي لدراسة التفاعلات بين ميكروبيوم الأمعاء والجهاز العصبي. تم إجراء الدراسات المتعلقة بمحور الأمعاء والدماغ تقليديا باستخدام نماذج الفئران13. تشترك الفئران والبشر في 85٪ من تسلسلاتهم الجينومية14 ، ولكن هناك اختلافات كبيرة يجب مراعاتها عند مقارنة الفئران بالبشر. فيما يتعلق بالقناة الهضمية ، من المهم ملاحظة أنه بالمقارنة مع البشر ، فإن الفئران هي عاشبة حصرية. نتيجة لذلك ، يختلف الجهاز الهضمي في الطول والخصائص ، مثل "إفراغ المعدة"14. تظهر أدمغة الفئران أيضا اختلافات مهمة ، حيث يختلف الهيكل العام بين الفئران والبشر15. الأهم من ذلك ، أن البشر لديهم أوقات أطول لدورة الخلايا من الأسلاف العصبية15. وبالتالي ، من المهم تطوير نماذج تمثيلية تشمل الخلايا المشتقة من الإنسان ، بما في ذلك الخلايا المعوية والعصبية5. في هذا السياق ، فإن تطوير المزيد من النماذج البحثية القابلة للتكرار عبر المختبر يقلل من الحاجة إلى استخدام النماذج الحيوانية ويحسن قابلية التكاثر.
neuroHuMiX هو نسخة متقدمة من طراز HuMiX السابق9. HuMiX هو نموذج القناة الهضمية على رقاقة يسمح بالثقافات المشتركة القريبة والتمثيلية للخلايا الظهارية والبكتيرية. الاتصال بين الخلايا والخلايا ممكن من خلال الزراعة المشتركة القريبة ونشر العوامل المفرزة والمستقلبات عبر الأغشية شبه المنفذة. ومع ذلك ، لتوسيع فائدة الجهاز الأولي لدراسة بيئة الأمعاء البشرية ، يلزم إدخال نوع إضافي من الخلايا. لمعالجة هذا الأمر ، يتيح neuroHuMiX ، الذي تم تطويره مع إدخال ENs المشتقة من iPSC ، زراعة مشتركة قريبة للبكتيريا والخلايا الظهارية المعوية و ENs. يسمح لنا النموذج الناتج في المختبر بمعالجة الأسئلة المتعلقة بميكروبيوم الأمعاء البشرية فيما يتعلق بالجهاز العصبي البشري. يواجه الاستزراع المشترك لأنواع مختلفة من الخلايا ، وخاصة المزارع المشتركة لخلايا الثدييات والبكتيريا ، العديد من التحديات ، بما في ذلك فقدان الصلاحية ، وضعف الالتصاق ، والخسارة الإجمالية في التقاء16. هنا ، أثبتنا أنه داخل هذا الجهاز ، نحن قادرون على المشاركة في زراعة ثلاثة أنواع مختلفة من الخلايا داخل نفس النظام مع الحفاظ على صلاحية الخلية عالية.
تتمثل الخطوة الحاسمة في البروتوكول في ضمان التقاء الخلايا العصبية - 80٪ -90٪ من التقاء الخلايا وصلاحيتها - قبل التلقيح في الجهاز. نظرا لأنه من غير الممكن تقييم نمو الخلايا أثناء الجري ، فمن الأهمية بمكان التأكد من أن الخلايا متقاربة وتنمو بشكل جيد قبل إدخالها في النموذج. في حين أن هذا قد يكون عاملا مقيدا ، إلا أن الجدوى العامة والالتقاء الملاحظ داخل الجهاز مرتفعان بشكل عام.
يتم توصيل الجهاز عبر خطوط الأنابيب بمضخة تمعجية. كل غرفة خلية لها خط أنابيب خاص بها. يتكون الأنبوب من أنبوب مضخة يسمح باستخدام مضخة تمعجية لتروية الوسط ، بالإضافة إلى أنبوب يربط أنبوب المضخة بالجهاز وأنبوب يربط الجهاز بزجاجات التدفق / النفايات. يتم تضمين منافذ أخذ العينات قبل الجهاز وبعده ، للسماح بتلقيح وأخذ عينات من وسط التدفق الخارجي. يمكن توصيل كل غرفة بوسط مختلف ، مما يتيح أفضل ظروف الثقافة لكل نوع من أنواع الخلايا الفردية. يمكن فتح أو إغلاق كل غرفة حسب الاحتياجات المحددة للإمداد المتوسط. في الجهاز ، تظل الغرفة العصبية مغلقة لمعظم التجربة ، في حين أن الغرف البكتيرية والظهارية مفتوحة طوال الوقت ، مما يعني أنها تحصل على وسط جديد طوال فترة التجربة بأكملها. للتأكد من تدفق الوسيط دون انقطاع ، من الضروري عدم ترك أي هواء في الأنابيب أو الموصلات أو في الجهاز. لذلك ، من المهم أولا ترك الأجهزة تعمل لبضع دقائق في خطوة التحضير. هذا غالبا ما يحل المشكلة. إذا لم يكن الأمر كذلك ، فيمكن إغلاق أحد الخطوط الأخرى التي تنخفض لفترة قصيرة من الوقت عن طريق إغلاق المحبس ثلاثي الاتجاهات للتدفق الخارجي. يؤدي هذا إلى إعادة توجيه الوسيط إلى الخط مع فقاعة الهواء ، وبالتالي حل المشكلة عن طريق دفع الفقاعة للخارج عبر الأنبوب.
بالنسبة لأي تجربة لزراعة الخلايا ، يعد الوسط مكونا رئيسيا ، حيث يكون لكل نوع خلية وسطه الخاص. في إعداد الثقافة المشتركة ، يجب أن يكون الوسيط متوافقا ليس فقط مع نوع الخلية الذي ينمو فيه ، ولكن أيضا مع أنواع الخلايا الأخرى داخل الثقافة المشتركة. لا يختلف هذا بالنسبة للجهاز ، مما يشكل تحديا إضافيا حيث لدينا ثلاث حجرات مختلفة مع ثلاثة أنواع مختلفة من الخلايا داخل الخلايا البكتيرية والظهارية والعصبية. ومع ذلك ، فقد أظهرنا أنه من خلال تعديل الوسائط البكتيرية - مع إضافة 5٪ MRS إلى RPMI 1640 مع 10٪ FBS - يمكن زراعة جميع أنواع الخلايا ، وخاصة الخلايا البكتيرية والظهارية ، بنجاح داخل النظام. ومع ذلك ، في الجهاز ، يتم زراعة أنواع مختلفة من الخلايا بشكل قريب ، وبالتالي فهي ليست على اتصال مباشر مع بعضها البعض. على الرغم من أن هذا لا يمثل تماما الاتصال المباشر بين الخلايا في الأمعاء البشرية ، وبالتالي فهو قيد ، فإن حالة الثقافة المشتركة القريبة والتمثيلية هي قوة للتحليلات النهائية. تبادل العوامل القابلة للذوبان بين الغرف المختلفة وأنواع الخلايا. ومن ثم ، لا تزال الخلايا تتفاعل مع بعضها البعض. بالإضافة إلى ذلك ، فإن حقيقة أنه يمكن حصاد أنواع الخلايا وتحليلها بشكل منفصل تسمح لنا بدراسة تأثير الميكروبيوم الصحي و / أو المريض على أنواع الخلايا المختلفة (بما في ذلك الخلايا العصبية) وبالتالي تحديد / استرداد القراءات الخاصة بنوع الخلية. هناك قيد آخر وهو أنه لا يمكن متابعة مورفولوجيا الخلايا أثناء التشغيل التجريبي ، حيث لا يمكن فتح الجهاز إلا وفحص الخلايا في نهاية كل تجربة.
على حد علمنا ، فإن neuroHuMiX هو أول نموذج للأمعاء على رقاقة بما في ذلك ENs. هذه خطوة نحو توضيح التواصل بين ميكروبيوتا الأمعاء والجهاز العصبي المعوي. إنه نموذج يسمح بالتحقيق في التفاعل بين الأنواع البكتيرية والطبقة الظهارية و ENs. يسمح لنا تصميمه بدراسة تبادل العوامل القابلة للذوبان التي تفرزها أنواع الخلايا المختلفة وتأثيرها على بعضها البعض. من الآن فصاعدا ، سيكون من المهم ليس فقط وجود ENs مشتقة من iPSC ، ولكن أيضا الخلايا الظهارية المشتقة من iPSC داخل الجهاز ، لنقل الجهاز إلى نموذج مخصص. الأهم من ذلك ، يمكن استخدام هذا النموذج الشخصي لاختبار ما قبل ومؤيد و synbiotics 10,11 وربما تطوير الفحص الشخصي والأساليب العلاجية17. يمكن أن يلقي NeuroHuMiX الشخصي الضوء في النهاية على "المادة المظلمة" لميكروبيوم الأمعاء البشرية وتفاعلاته مع الجهاز العصبي على طول محور ميكروبيوم الأمعاء والجهاز العصبي ، مما يمهد الطريق للتقييم والتدخلات العلاجية.
يمكننا أن نستنتج أن القدرة على الحصول على أمعاء على رقاقة بما في ذلك الجهاز العصبي المعوي أمر بالغ الأهمية للتقدم في دراسة وفهم التفاعلات على طول محور الجهاز العصبي لميكروبيوم الأمعاء. يسمح لنا NeuroHuMiX بدراسة تأثيرات الأنواع البكتيرية على الخلايا المضيفة ويوفر لنا أساسا جيدا لتحسين النموذج بشكل أكبر بطريقة أكثر تمثيلا من الناحية الفسيولوجية.
Disclosures
تعلن شركة P.W. عن إدراجها كمخترع في البراءات PCT/EP2013/056607 وPCT/EP2016/062024 وPCT/US2017/061602 وPCT/EP2019/081424. P.W. و CS و L.G. يعلنون إدراجهم كمخترعين في LU503075 براءات الاختراع.
Acknowledgements
يود المؤلفون أن يشكروا الدكتور جاريد ستيرنيكرت على تزويدنا بالخلايا من خط K7. نود أيضا أن نشكر المتعاونين منذ فترة طويلة الدكتور فريدريك زينهاوزر وماثيو دبليو باريت من جامعة أريزونا على مساعدتهم في الجوانب الهندسية. نود أيضا أن نعرب عن تقديرنا للدكتورة فالنتينا غالاتا لمساعدتها في تصميم التمثيل التخطيطي ل neuroHuMiX. تلقى هذا المشروع تمويلا من مجلس البحوث الأوروبي (ERC) في إطار برنامج البحث والابتكار Horizon 2020 التابع للاتحاد الأوروبي (اتفاقية المنحة 863664). تم إنشاء الشكل 1 جزئيا باستخدام Biorender.com.
Materials
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
References
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved