Method Article
Um modelo Gut-on-a-Chip para estudar o eixo microbioma intestinal-sistema nervoso
Neste Artigo
Resumo
neuroHuMiX é um modelo avançado de gut-on-a-chip para estudar as interações de células bacterianas, epiteliais e neuronais sob condições de co-cultura proximal e representativa. Este modelo permite desvendar os mecanismos moleculares subjacentes à comunicação entre o microbioma intestinal e o sistema nervoso.
Resumo
O corpo humano é colonizado por pelo menos o mesmo número de células microbianas que é composto por células humanas, e a maioria desses microrganismos está localizada no intestino. Embora a interação entre o microbioma intestinal e o hospedeiro tenha sido extensivamente estudada, como o microbioma intestinal interage com o sistema nervoso entérico permanece em grande parte desconhecido. Até o momento, não existe um modelo in vitro fisiologicamente representativo para estudar as interações microbioma intestinal-sistema nervoso.
Para preencher essa lacuna, desenvolvemos ainda mais o modelo gut-on-chip de crosstalk humano-microbiano (HuMiX), introduzindo neurônios entéricos derivados de células-tronco pluripotentes induzidos no dispositivo. O modelo resultante, 'neuroHuMiX', permite o co-cultivo de células bacterianas, epiteliais e neuronais através de canais microfluídicos, separados por membranas semipermeáveis. Apesar da separação dos diferentes tipos celulares, as células podem se comunicar entre si através de fatores solúveis, proporcionando simultaneamente uma oportunidade de estudar cada tipo celular separadamente. Essa configuração permite os primeiros insights sobre como o microbioma intestinal afeta as células neuronais entéricas. Este é um primeiro passo crítico no estudo e compreensão do eixo microbioma intestinal humano-sistema nervoso.
Introdução
O microbioma intestinal humano desempenha um papel crucial na saúde e na doença humanas. Tem sido extensivamente estudada ao longo da última década e meia, e seu potencial papel na modulação da saúde e da doença está agora estabelecido1. Uma ruptura no microbioma levando a uma comunidade microbiana desequilibrada (disbiose) tem sido postulada como envolvida na patogênese de muitas doenças crônicas, como obesidade, doença inflamatória intestinal e câncer colorretal, ou mesmo doenças neurodegenerativas, como a doença de Parkinson 2,3.
Embora o microbioma intestinal humano tenha sido associado a condições neurológicas, ainda não está claro como o microbioma intestinal se comunica e afeta o sistema nervoso entérico. Como o sistema nervoso entérico humano não é facilmente acessível para estudo imediato, modelos animais têm sido utilizados em experimentos até o momento4. No entanto, dadas as aparentes diferenças entre modelos animais e humanos5, o desenvolvimento de modelos in vitro mimetizando o intestino humano é de interesse imediato. Nesse contexto, o crescente e avançado campo das células-tronco pluripotentes induzidas humanas (iPSCs) tem permitido a obtenção de neurônios entéricos (NEs) representativos6. As NE derivadas de iPSC permitem o estudo do sistema nervoso entérico em modelos de cultura in vitro, como inserções de cultura celular, organoides ou organs-on-a-chip 7,8.
O modelo crosstalk humano-microbiano (HuMiX) é um modelo gut-on-a-chip que imita o intestino humano9. O modelo inicial de HuMiX (doravante denominado dispositivo inicial) acomodava células epiteliais (Caco-2) e bacterianas10,11. No entanto, para estudar a ligação microbioma intestinal-sistema nervoso, ENs6 derivadas da iPSC também foram introduzidas no sistema (Figura 1). O co-cultivo proximal de células neuronais, epiteliais e bacterianas permite a análise dos diferentes tipos celulares individualmente e o estudo das interações entre os diferentes tipos celulares em um ambiente que mimetiza o do intestino humano.
Nos últimos anos, avanços têm sido feitos no desenvolvimento de modelos para estudar órgãos de maneiras fisiologicamente mais representativas, usando modelos de órgãos em um chip (por exemplo, intestino em um chip). Esses modelos são mais representativos do ambiente intestinal humano devido ao constante suprimento de nutrientes e remoção de resíduos, bem como ao monitoramento em tempo real, por exemplo, dos níveis de oxigênio ou da integridade da barreira 8,12. Esses modelos permitem especificamente o estudo dos efeitos das bactérias intestinais nas células hospedeiras. No entanto, para poder usar órgãos em um chip para estudar as inter-relações entre o microbioma intestinal e o sistema nervoso, as células neuronais precisam ser integradas a esses sistemas. Portanto, o objetivo de desenvolver ainda mais o HuMiX e estabelecer o sistema neuroHuMiX (doravante referido como o dispositivo) foi desenvolver um modelo gut-on-a-chip, que inclui células neuronais entéricas em co-cultura proximal com células epiteliais intestinais e bactérias.
Protocolo
1. Cultura e triagem celular
- Neurônios entéricos pluripotentes derivados de células-tronco pluripotentes induzidos
NOTA: Cultura iPSCs 6 semanas antes do início de uma corrida. O protocolo de diferenciação para as NE foi adaptado de Fattahi et al.6.- Cultivar as iPSCs em placa matriz de 6 poços revestida com gel em 2 mL/poço de meio de cultura iPSC suplementado com penicilina-estreptomicina a 1% (P/S).
- Na confluência de 80%-90%, as células, semeada em uma placa de matriz revestida com gel usando o mesmo meio, incubar a 37 °C, 5% CO2 e 90% de umidade relativa (UR).
- Para a derivação iPSC, após duas passagens após o descongelamento, com 80%-90% de confluência, semeie as células em uma placa de matriz de 6 poços revestida com gel a uma densidade de 100.000 células/poço. Incubar no meio acima descrito + inibidor de ROCK Y-27632 (1:2.000) por 24 h a 37 °C.
- Após 24 h, substituir o sobrenadante pelo meio Dia 0, conforme Tabela 1. Inclua um poço de controle para ser usado como um controle negativo durante a classificação de células para o processo de derivação. Mantenha o controle bem na composição da mídia do Dia 0 durante todo o período de derivação. Trocar o meio em dias alternados dos dias 2 a 10, conforme Tabela 1.
- No dia 11, classificar as células para células CD49d-positivas, que serão utilizadas nas etapas seguintes deste protocolo.
- Agrupe as células a serem classificadas com base em células CD49d-positivas, bem como o controle bem. Centrifugar as células durante 3 min a 300 × g. Ressuspender o pellet celular em albumina de soro bovino (BSA) a 2% + P/S a 1% em solução salina tamponada com fosfato (PBS) 1x.
- Divida cada lote de células (agrupadas e controles) em duas: corar uma fração com anticorpo anti-humano CD49d e a outra fração com um anticorpo de controle de isotipo.
- Portar a população celular principal e, em seguida, portar células únicas, com base no qual as células que apresentam CD49d em sua superfície serão selecionadas. Colete essas células para a próxima etapa de diferenciação.
NOTA: Normalmente, 30%-40% das células classificadas são CD49d-positivas.
- Transfira dois a quatro milhões de células selecionadas para uma placa de 6 poços de uma placa de fixação ultrabaixa em meio N2B27 (ver Tabela 2) + FGF2 + CHIR por 4 dias para permitir a formação de esferoides.
- No 15º dia, repor os esferoides em uma placa de 6 poços revestida com poli L-ornitina/laminina/fibronectina (P/L/F) em 2 mL/poço de meio N2B27 com GDNF e ácido ascórbico (AA). Substitua o meio a cada 2-3 dias.
NOTA: Relação de revestimento: poli L-ornitina, 15 μg/mL; laminina, 2 μg/mL; fibronectina, 2 μg/mL em 1x PBS. - Após 3 semanas, utilizar as células para inoculação no dispositivo.
- Caco-2
NOTA: Descongelar células Caco-2 pelo menos 1 semana antes de uma corrida.- Seme um frasco T75 com 1 × 106 células Caco-2 em suplemento de glutamina RPMI 1640 + HEPES + 10% de soro fetal bovino (SFB); incubar a 37 °C, 5% CO2 e 90% UR.
NOTA: Para esses experimentos, o ideal é usar Caco-2 em sua primeira ou segunda passagem após o descongelamento.
- Seme um frasco T75 com 1 × 106 células Caco-2 em suplemento de glutamina RPMI 1640 + HEPES + 10% de soro fetal bovino (SFB); incubar a 37 °C, 5% CO2 e 90% UR.
2. Preparação da corrida HuMiX
- Preparação e revestimento de tampas de policarbonato
- Autoclave um par de tampas de policarbonato (CP) (Figura 2) juntamente com quatro parafusos usando o ciclo de instrumentos inicial do dispositivo (ver Tabela 3 para detalhes).
- Em um gabinete de biossegurança, insira quatro parafusos em cada canto da tampa inferior do PC (ver Figura 3) e transfira para uma placa de Petri quadrada estéril para um processo de revestimento de duas etapas.
- No primeiro dia, adicionar 2 mL de poli L-ornitina a 1,5% em PBS (1x) ao meio da tampa do PC. Incubar durante a noite a 37 °C, 5% CO2 e 90% UR.
- No dia seguinte, retirar a solução e substituí-la por uma solução contendo laminina a 0,2% e fibronectina a 0,2% em PBS (1x) para cobrir a superfície da câmara celular neuronal. Incubar a tampa durante a noite a 37 °C, 5% CO2 e 90% UR.
- Após a incubação, mantenha a solução de revestimento na tampa do PC e feche a placa de Petri com uma película de vedação. Colocá-los a 4 °C para conservação até à utilização.
- Antes de usar, remova a solução de revestimento e seque ao ar em um armário de biossegurança por 30 minutos até que o revestimento esteja completamente seco.
- Preparação e revestimento de juntas
NOTA: Esta seção descreve como preparar juntas aderindo membranas semipermeáveis a juntas de silicone. Após uma etapa inicial de autoclavagem, as juntas são revestidas com colágeno ou mucina para permitir a adesão de células epiteliais intestinais ou bactérias. A membrana revestida com mucina imita a barreira de muco que está presente no intestino humano.- Anexe uma membrana de policarbonato de tamanho de poro de 1 μm à junta de colágeno e uma membrana de policarbonato de tamanho de poro de 50 nm entre as juntas de sanduíche inferior e superior. Autoclave as juntas com as membranas conectadas usando o ciclo inicial do instrumento do dispositivo (ver Tabela 3).
- Para revestir as membranas, coloque cada junta em um prato quadrado estéril.
OBS: O revestimento é feito em condições estéreis em um gabinete de biossegurança.- Para a junta de colágeno, adicionar 3 mL de colágeno (50 μg/mL) à membrana e incubar por 3 h a 37 °C.
NOTA: Tenha cuidado para não tocar a membrana com a ponta da pipeta ao adicionar o colágeno para evitar danificar a membrana. - Para o revestimento de mucina, coloque a junta do sanduíche com o lado da junta superior para cima em uma placa de Petri para revestir o lado superior da membrana com 3 mL de mucina (0,025 mg/mL). Incubar as juntas a 37 °C durante 1 h.
- Para a junta de colágeno, adicionar 3 mL de colágeno (50 μg/mL) à membrana e incubar por 3 h a 37 °C.
- Após o tempo de incubação, aspirar as soluções de colágeno e mucina de suas respectivas juntas e secar a membrana em um gabinete de biossegurança por 30 min. Feche os pratos, sele com filme de vedação de laboratório e guarde as juntas a 4 °C até usar.
- Montagem de tubos
Observação : esta seção descreve como montar a tubulação para a perfusão do dispositivo. Antes da montagem, autoclave todas as peças e/ou compre aquelas que são embaladas individualmente em uma embalagem estéril. Coloque todos os componentes em um armário de biossegurança.- Use três linhas de tubo para cada dispositivo e para cada linha de tubo, uma peça de linha de tubulação de bomba, duas peças de tubulação longa Marprene (20 cm), duas peças de tubulação Marprene curta (8 cm), uma agulha de 40 mm para o frasco de saída, uma agulha de 120 mm para os frascos de entrada de 250 mL ou agulha de 80 mm para frascos de entrada menores, três machos e sete fêmeas Luer para conectores farpados, três adaptadores Luer e duas válvulas de torneira de três vias.
- Montar linhas de tubulação da esquerda para a direita usando os componentes autoclavados e esterilizados listados acima (Figura 4).
OBS: Borrifar cada componente com etanol 70% entre cada etapa de ligação.
- Preparação da mídia
NOTA: Esta seção descreve como preparar o meio para os diferentes tipos de células no dispositivo, bem como transferir o meio para frascos de soro de maneira estéril.- Suplemento RPMI 1640 com 10% 0,22 μm filtrado, FBS inativado pelo calor. Complemente a mídia N2B27 com GDNF e AA.
- Transfira o meio para frascos de soro em condições estéreis. Transfira 200 mL de mídia RPMI 1640 para frascos de 250 mL e 30 mL de mídia N2B27 para frascos de 50 mL.
- Preparar o meio bacteriano (RPMI 1640 + 10% FBS + 5% De Man, Rogosa e meio de cultura Shapre [MRS]) em um estágio posterior, pois isso só é necessário durante as 24 h finais do experimento.
- Feche os frascos com um septo, crimpe-os de alumínio e autoclave.
- Para transferir o meio, remova a crimpagem de alumínio usando um decapper apropriado (diâmetro = 20 mm). Remova o septo também. Despeje cuidadosamente o meio preparado nos frascos de soro sem tocar no frasco.
- Para esterilizar, chame a abertura do frasco usando um queimador portátil de Bunsen. Sele os frascos borrifando o septo com etanol 70%, adicionando-o ao frasco e fechando-o com uma crimpagem de alumínio usando um crimper de vedação.
- Coloque os frascos fechados na incubadora a 37 °C, 5% CO2 durante 24 h para aquecer o meio a 37 °C, bem como para garantir que não existem sinais visíveis de contaminação antes de utilizar frascos de meio para o dispositivo.
3. Início do HuMiX
- Montagem do NeuroHuMiX
Observação : esta seção explica como montar o dispositivo. Em suma, o sistema de fixação é esterilizado e reapertado, após o que a tampa inferior do PC é colocada na base da braçadeira. Em seguida, as juntas revestidas e as tampas superiores do PC são empilhadas umas sobre as outras, seguidas pela parte superior da braçadeira. Finalmente, a braçadeira é apertada para comprimir as juntas e tornar o sistema livre de vazamentos e estanque ao gás. A Figura 4 mostra as diferentes peças necessárias para a montagem.- Autoclave as abraçadeiras e as duas tampas do PC (superior e inferior) antes da montagem.
- Aperte os parafusos utilizados para montar as partes superior e inferior da pinça (Figura 4C,D). Abra os parafusos antes do processo de autoclavagem e aperte-os novamente.
- Transfira a tampa inferior do PC revestida e seca (passo 2.2.3) (Figura 4 A1) da placa de Petri quadrada para o topo da base da pinça, segurando os quatro parafusos nos cantos da tampa do PC.
NOTA: Evite tocar na tampa do PC para reduzir o risco de contaminação. - Coloque a junta da câmara epitelial voltada para cima (ou seja, com a membrana na parte superior) na tampa do PC usando uma pinça estéril. Use os parafusos para alinhar a junta e a tampa do PC para garantir que as portas de entrada e saída nos cantos da tampa estejam alinhadas com as aberturas na junta (Figura 3).
- Usando a pinça estéril, coloque a junta do sanduíche em cima da junta de colágeno, com o lado superior voltado para cima.
- Coloque a tampa superior do PC em cima da junta do sanduíche. Para reduzir o risco de contaminação, faça isso tocando apenas nas bordas da tampa (não toque na parte superior ou inferior da tampa). Certifique-se de que as farpas na tampa da braçadeira estejam alinhadas com a abertura de entrada e saída no conjunto de membrana e que os parafusos da tampa inferior do PC se encaixem na abertura da tampa superior do PC.
- Para fechar o dispositivo, coloque a tampa da braçadeira (a parte superior da braçadeira) sobre a tampa do PC. Certifique-se de que as aberturas da tampa coincidam com as farpas de entrada e saída da tampa superior do PC. Feche as travas. Manter o dispositivo fechado (figura 5) sob o capô para ligar às linhas de tubos preparadas (passo 3.2.6).
- Escorvamento de linhas de tubulação
NOTA: Esta seção descreve como conectar a tubulação aos frascos de entrada e saída, bem como à bomba, subsequentemente primer a tubulação com meio para remover quaisquer produtos residuais usados durante a limpeza e esterilização e garantir que nenhuma bolha esteja presente na tubulação.- O priming das linhas de tubulação é realizado no gabinete de biossegurança. Inserir agulhas de aeração com filtros no septo de cada frasco de entrada e saída. Usando pinças limpas e estéreis, insira as agulhas de 120 mm nos frascos de soro de 250 mL. Insira as agulhas de 80 mm nos frascos de soro de 50 mL.
- Insira as agulhas de 40 mm, no final de cada linha de tubagem, em um frasco de soro de saída. Por dispositivo, há duas garrafas de saída para as três linhas de tubulação. As agulhas de 40 mm das linhas de tubos epiteliais e neuronais são conectadas ao mesmo frasco de saída para descarte médio. A linha do tubo bacteriano vai para o segundo frasco de saída.
- Insira as linhas de tubulação da bomba nos da bomba. Certifique-se de que as torneiras de três vias das linhas de tubulação estejam todas abertas.
- No início, ajuste a bomba peristáltica para direcionar o meio da entrada para a garrafa de saída a uma velocidade de 5 rpm (ver Tabela 4).
NOTA: Durante o escorvamento da linha de tubulação, a velocidade pode ser aumentada até 10 rpm para acelerar o processo. - Ligue a bomba pressionando o botão de partida e verifique se a direção da ação de bombeamento está no sentido horário. Uma vez que a mídia está caindo nas garrafas de saída, certifique-se de que não há vazamentos e nenhuma bolhas de ar são deixadas nas linhas de tubulação e pontos de conexão. Remova quaisquer bolhas restantes tocando na tubulação e nos conectores ou aumentando a velocidade da bomba.
- Quando todas as linhas de tubo estiverem caindo nas garrafas de saída, defina a taxa de fluxo para 2 rpm para conectar o dispositivo inicial.
- Escorvamento do dispositivo
NOTA: Esta seção descreve como primer o dispositivo com meio de cultura celular para garantir que todas as câmaras sejam preenchidas e pré-revestidas com meio, para que não sejam deixadas bolhas no sistema e as células possam aderir facilmente durante a inoculação.- O escorvamento do dispositivo é realizado no gabinete de biossegurança em condições estéreis. Para conectar o dispositivo, comece conectando a linha neuronal, a câmara inferior do dispositivo.
- Para conectar uma linha, feche as válvulas de torneira de três vias (Figura 5C), começando primeiro pelo lado de saída, onde a tubulação curta é desconectada do conector Luer fêmea e conectada à porta de saída do dispositivo, empurrando a tubulação sobre a farpa. Para garantir a conexão adequada e reduzir a chance de haver vazamentos e/ou contaminação, certifique-se de que a tubulação esteja em contato com a tampa, empurrando-a até o fim sobre o conector. Conecte a tubulação de entrada da mesma maneira. Uma vez que uma linha esteja completamente conectada ao dispositivo (entrada e saída), abra as torneiras de três vias.
- Repita o passo anterior com a linha epitelial e, em seguida, com a linha bacteriana. Mantenha a bomba a uma vazão de 2 rpm. Aumente a velocidade da bomba para 2,5 rpm, mas não mais, a fim de evitar vazamentos devido ao acúmulo de pressão. Deixe a bomba apertar as câmaras do dispositivo.
- Monitore os frascos de soro de saída em todos os momentos. Se as bolhas de ar ficarem presas nas câmaras, linhas ou conector, uma linha de tubulação com uma bolha de ar dentro não cairá mais na câmara de saída. Para se livrar das bolhas de ar, primeiro deixe os dispositivos funcionarem por alguns minutos. Se isso não resolver o problema, feche uma das outras linhas que estão caindo por um curto período de tempo, fechando a torneira de três vias do fluxo de saída.
- Uma vez que todas as câmaras do dispositivo estejam totalmente preparadas - todas as câmaras são preenchidas com meio de cultura celular e não restam bolhas no dispositivo - reduza a velocidade da bomba para 0,5 rpm. O dispositivo já está pronto para inoculação celular.
4. Preparo celular e inoculação
NOTA: Esta seção descreve como preparar os diferentes tipos de células necessários para inocular o dispositivo, bem como como inocular-los no dispositivo de forma estéril e sem introduzir bolhas de ar. Além disso, descreve como realizar o refresco do meio para as células neuronais e como preparar o meio para a cultura bacteriana no dispositivo.
- Células epiteliais
- Retirar as células Caco-2 do frasco com ácido tripsina-etilenodiaminotetracético (EDTA), ressuspender em RPMI 1640 + FBS 10% e contar em contador de células de Neubauer utilizando o ensaio de exclusão com azul de tripano. Centrifugar a suspensão celular de Caco-2 (3 min, 300 × g) e descartar o sobrenadante para remover o restante de tripsina-EDTA. Ressuspender as células Caco-2 em RMPI 1640 + FBS 10% para obter uma suspensão de 350.000 células/mL. Para cada dispositivo, é necessário um volume de 1,5 mL.
- Transfira 1,5 mL da suspensão celular de Caco-2 para uma seringa estéril de 2 mL e remova qualquer ar ou bolhas que permaneçam na seringa.
- Feche as válvulas de torneira de três vias da tubulação das câmaras bacterianas e neuronais. Desconecte a tubulação das câmaras bacteriana e neuronal da bomba, removendo os com a respectiva tubulação do rotor.
- Abra a tampa da válvula de torneira de três vias da tubulação de entrada que leva à câmara epitelial e gire a válvula de torneira de três vias para redirecionar o fluxo médio do dispositivo para o "conector aberto" (Figura 5C). Deixe o meio fluir até que uma gota de meio apareça na extremidade aberta da válvula de torneira de três vias.
- Insira a seringa que contém as células epiteliais no «conector aberto» utilizando o método de ligação drop-drop para permitir a inserção da seringa no conector sem a introdução de bolhas de ar. Gire a válvula da torneira de três vias para parar o fluxo do meio a partir do frasco de entrada (através da bomba) e para permitir o fluxo da seringa conectada para o dispositivo inicial. Desconecte o canal epitelial da bomba.
- Pressione lentamente a seringa para inocular a câmara epitelial com a suspensão celular. Certifique-se de que aproximadamente uma gota a cada 3 s caia na garrafa de saída.
- Adicionar 1,5 mL da suspensão celular e, em seguida, fechar a válvula da torneira de saída de três vias. Desconecte a seringa e feche a extremidade aberta da torneira de três vias com a tampa. Mantenha a câmara fechada por pelo menos 2 h. Enquanto isso, inocular as células neuronais.
- Células neuronais
- Separar as células neuronais do poço ressuspendendo as células no meio dos respectivos poços usando uma pipeta. Inocular cada dispositivo com células totalmente confluentes de um poço (9,6 cm2) de uma placa de 6 poços.
- Ressuspender o pellet de células no volume correspondente do meio N2B27 (1,5 mL de meio por dispositivo) + 1 μL de fibronectina/mL de suspensão celular. Transfira 1,5 ml da suspensão celular ressuspensa para uma seringa de 2 ml e remova as bolhas de ar que permanecem na seringa. Coloque a seringa cheia em um tubo cônico estéril de 50 mL e transfira para o gabinete de biossegurança contendo o dispositivo HuMiX preparado.
- Seguir o mesmo processo de inoculação descrito anteriormente para a inoculação da câmara epitelial, exceto para a troca da linha de tubo. Aqui, desconecte as linhas de tubos bacterianos e epiteliais da bomba.
- Após a inoculação das células neuronais, feche todas as torneiras de três vias das linhas de tubo e desconecte-se da bomba. Colocar o dispositivo na incubadora a 37 °C e 5% CO2. Mantenha todos os canais fechados por 2 h para permitir que as células se conectem.
- Após 2 h, conecte os canais bacterianos e epiteliais à bomba e abra as torneiras de entrada e saída de três vias de ambas as linhas. Manter a câmara neuronal fechada durante os próximos 14 dias após a execução inicial do dispositivo, exceto durante a troca do meio.
- Durante a corrida de 14 dias, troque o meio da câmara neuronal a cada 3-4 dias. Para uma atualização média, prepare 3 mL de meio N2B27 fresco por dispositivo e transfira para um frasco estéril de soro de 20 mL. Feche o frasco de soro com o meio usando um septo estéril e um selo de crimpagem de alumínio.
- Insira uma aeração e uma agulha de 80 mm no septo do novo frasco. Substitua o frasco de mídia antigo pelo novo na incubadora, desconectando o Luer macho da agulha do frasco antigo para a agulha do novo frasco.
- Conecte o com a tubulação da bomba da câmara neuronal à bomba e abra as torneiras de três vias. Deixe o meio fluir a 0,5 rpm por 2 h antes de fechar as torneiras de três vias da tubulação neuronal e desconectar da bomba, até a próxima troca média.
5. Cultura bacteriana e inoculação
NOTA: Neste estudo, no dia 12, uma cultura líquida de Limosilactobacillus reuteri cepa F275 foi reanimada a partir de um estoque de glicerol. Dependendo das necessidades ou desenhos de estudo, outras espécies bacterianas podem ser utilizadas.
- Preparar três tubos com 5 mL de caldo MRS - um tubo controle estéril e dois para inoculação de L. reuteri. Com um ciclo de inoculação, raspe a parte superior do estoque de glicerol e transfira-o para um tubo. Repetir com um segundo tubo de inoculação. Incubar os tubos a 37 °C, 170 rpm durante a noite.
OBS: Não deixe o estoque de glicerol descongelar. - Prepare o meio fresco para os dispositivos iniciais misturando Roswell Park Memorial Institute (RPMI) 1640 + 10% FBS com caldo MRS 5%. Preparar 25 mL por dispositivo e transferir para frascos de soro de 100 mL em condições estéreis. Feche os frascos com septo estéril e friso de alumínio. Coloque os frascos na incubadora a 37 °C, 5% CO2 durante a noite.
- Antes de conectar os frascos à linha de tubo bacteriano, adicione uma agulha de aeração e uma agulha de 80 mm a cada frasco de mídia RPMI 1640/MRS.
- Preparar novos tubos, cada um com 3 mL de RPMI 1640 + 10% FBS + 5% caldo MRS. Prepare pelo menos dois tubos, um controle e um tubo por dispositivo. Inocular 15 μL da cultura noturna de L. reuteri (densidade óptica [DO] > 2) em dois dos tubos recém-preparados.
- Incubar os tubos por 1 h a 37 °C, 170 rpm, após o que se atinge um DO de 0,05-0,10, correspondendo a ~1 ×10 7 unidades formadoras de colônias (UFC)/mL. Transfira 1,5 mL para uma seringa de 2 mL (uma por dispositivo). Use o restante da suspensão bacteriana para revestimento de UFC e coloração viva/morta.
- Para a inoculação bacteriana do dispositivo, siga o mesmo procedimento mencionado no passo 4.1, exceto que aqui as linhas do tubo neuronal e epitelial estão fechadas.
- Após a inoculação, feche também a linha do tubo bacteriano, fechando as válvulas e desconectando-se da bomba por 30 min. Conecte as linhas de tubos epiteliais e bacterianos e abra novamente. Deixe os dispositivos funcionarem por mais 24 h a 37 °C e 0,5 rpm.
6. Abertura e amostragem do HuMiX
NOTA: A seção abaixo descreve a amostragem de diferentes tipos de células. Por exemplo, pellets de células neuronais são usados para extração de RNA e subsequente reação em cadeia da polimerase quantitativa (qPCR), pellets bacterianos para extração de DNA e sequenciamento do gene 16S rRNA, e sobrenadantes para ensaios imunoenzimáticos (ELISAs) e outros ensaios (por exemplo, ensaio de lactato).
- No dia 14, dia de abertura, feche todas as torneiras de três vias, desconecte as tubulações da bomba e leve o dispositivo da incubadora para a bancada do laboratório.
NOTA: Ao mover o dispositivo, certifique-se de manter o dispositivo real na horizontal. - Remova as linhas de tubulação conectadas ao dispositivo antes de abrir lentamente a braçadeira e remova a tampa da braçadeira. Com cuidado, remova a tampa superior do PC, colete o meio em um tubo de microcentrífuga de 1,5 mL e coloque-o no gelo.
- Remova suavemente a junta do sanduíche, enquanto coleta o meio da câmara epitelial; Tenha cuidado para não tocar na camada celular. Coloque a junta do sanduíche em uma placa de Petri quadrada e adicione solução estéril de NaCl a 0,9% em H2O à câmara bacteriana até que a câmara esteja totalmente coberta (aproximadamente 1 mL).
- Remova lentamente a junta de colágeno enquanto coleta o meio da câmara neuronal e o transfere para um tubo de microcentrífuga. Coloque todos os tubos de mídia no gelo. Coloque a junta de colágeno em um prato quadrado e adicione suavemente alguns mililitros de 1x PBS à camada de Caco-2 até que a camada de células esteja totalmente coberta.
- Coloque a tampa inferior do PC em uma placa de Petri quadrada e adicione suavemente aproximadamente 2 mL de 1x PBS sobre as células neuronais, para que elas não sequem durante o processo de amostragem.
- Centrifugar o tubo do meio bacteriano a 5.000 × g por 5 min a 4 °C. Centrifugar os tubos epiteliais e médios neuronais a 300 × g durante 5 min a 4 °C. Após a centrifugação, transfira o sobrenadante de cada tubo para um novo tubo de microcentrífuga e coloque-o imediatamente sobre gelo seco.
- Células epiteliais
- Retire suavemente o PBS da junta e colete em um tubo cônico de 15 mL. Adicionar 2 mL de tripsina às células e incubar a junta por 5 min a 37 °C, 5% CO2. Adicionar 2 mL de RPMI 1640 à junta após a incubação, ressuspender as células e coletar em outro tubo cônico de 15 mL.
- Centrifugar ambos os tubos por 5 min a 300 × g. Descarte o sobrenadante. Ressuspender o pellet da lavagem com PBS em 300 μL de PBS e o pellet de células em 1 mL de PBS.
- Transferir 50 μL de cada tubo para um tubo de microcentrífuga de 0,5 mL para o contador automático de células e contagem de células do ensaio de exclusão com azul de tripano. Transfira o pellet de célula ressuspensa (1 mL) para um tubo de 1,5 mL e centrifuja a 300 × g por 5 min.
- Retire o sobrenadante e ressuspenda o pellet celular em 250 μL de tampão de lise + 1% de beta-mercaptoetanol e coloque o tubo sobre gelo seco.
- Células neuronais
- Pegue a placa de Petri quadrada, com a tampa de PC inferior transparente com células neuronais do passo anterior (6.5) para um microscópio de contraste de fase invertida.
NOTA: Ao mover a tampa do PC com PBS em cima dela, seja muito gentil, pois a rede neuronal se desprende com muita facilidade. - Realizar uma última verificação de qualidade antes da inoculação, observando a morfologia e a densidade celular das células neuronais usando microscopia de campo claro. Verifique se as células migraram dos esferoides e se uma rede neuronal se formou. A rede neuronal deve ser aproximadamente 90% confluente. Para mais detalhes, consultar Fattahi et al.6.
- Na bancada, ressuspender as células em PBS e coletar em tubo de 1,5 mL. Centrifugar o tubo a 300 × g durante 3 min. Descarte o sobrenadante, ressuspenda a pastilha celular em 250 μL de tampão de lise + 1% de beta-mercaptoetanol e coloque no gelo seco.
NOTA: A coloração de imunofluorescência (IF) pode ser feita nas células neuronais na tampa do PC. Se a coloração de IF for o ensaio preferencial para não destruir a rede neuronal, as células devem ser fixadas na tampa do CP com paraformaldeído (PFA) a 4%, o que impede a reutilização da pálpebra do CP em experimentos futuros.
- Pegue a placa de Petri quadrada, com a tampa de PC inferior transparente com células neuronais do passo anterior (6.5) para um microscópio de contraste de fase invertida.
- Células bacterianas
- Ressuspender as células bacterianas aderidas à membrana em solução de NaCl a 0,9%. Se as células estiverem firmemente ligadas, faça uso suave de um raspador de células para separar as células bacterianas da membrana.
NOTA: Usar um raspador pode danificar as células, aumentando a probabilidade de ver mais células mortas. - Recolher a suspensão celular num tubo cónico de 15 ml. Adicione o pellet que sobrou do meio previamente coletado ao tubo cônico de 15 mL. Centrifugar a 5.000 × g por 5 min a 4 °C. Eliminar o sobrenadante e ressuspender o pellet de células em 1 mL de solução de NaCl a 0,9%.
- Divida esse volume em três partes: uma para congelamento de um pellet bacteriano para extração de ácido nucleico (650 μL), uma para revestimento de UFC (50 μL) em placas de MRS e uma para coloração viva/morta (300 μL). Para a preparação do pellet para extração de ácido nucleico, transferir a suspensão celular para um tubo de microcentrífuga, centrifugar a 5.000 × g por 5 min a 4 °C e descartar o sobrenadante. Coloque o pellet de célula sobre gelo seco.
- No final da amostragem, transfira todos os tubos em gelo seco para um congelador de -80 °C para armazenamento para análises posteriores a jusante.
NOTA: O sobrenadante pode ainda ser usado para análise por cromatografia gasosa acoplada à espectrometria de massas (GC-MS). Além disso, durante a abertura, a membrana revestida com colágeno pode ser dividida em diferentes partes para diferentes análises - uma metade para ser usada para coloração de ocludina IF, outra parte para extração de RNA para análise adicional da expressão gênica e outra parte para contagem celular.
- Ressuspender as células bacterianas aderidas à membrana em solução de NaCl a 0,9%. Se as células estiverem firmemente ligadas, faça uso suave de um raspador de células para separar as células bacterianas da membrana.
Resultados
No neuroHuMiX, co-cultivamos três tipos diferentes de células juntas: bacterianas, epiteliais e neuronais (Figura 1). Para garantir que as células fossem todas viáveis, realizamos diferentes ensaios nos diferentes tipos celulares. Por exemplo, realizamos contagens de UFC em células bacterianas, contagem de células e ensaios de viabilidade celular nas células epiteliais, enquanto as células neuronais foram avaliadas por meio de análises microscópicas.
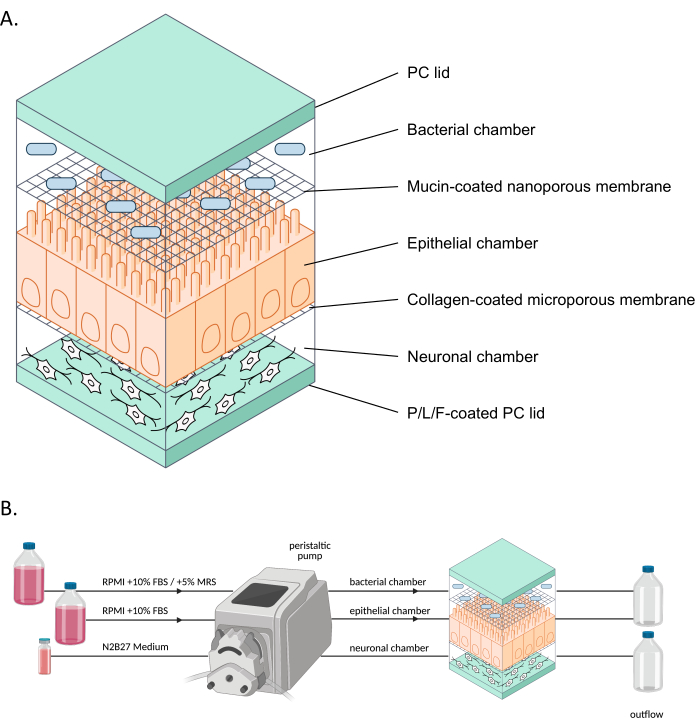
Figura 1: Representação esquemática do neuroHuMiX e sua configuração experimental . (A) As três câmaras são mantidas entre duas tampas de PC para mantê-las fechadas. Cada câmara é preenchida com um meio específico para as células cultivadas em seu interior. As diferentes câmaras são separadas por membranas semipermeáveis permitindo a comunicação celular através de fatores solúveis que passam pelas membranas. (B) Representação da configuração do neuroHuMiX. Cada câmara é conectada a diferentes frascos de mídia. Para a câmara bacteriana, nos primeiros 12,5 dias, a câmara é conectada ao RPMI + 10% FBS, antes de ser trocada nas últimas 36 h para RPMI + 10% FBS + 5% MRS. Abreviações: PC = policarbonato; P/L/F = poli L-ornitina/laminina/fibronectina; RPMI = meio de cultura celular Roswell Park Memorial Institute; MRS = Meio de cultura De Man, Rogosa e Shapre. Clique aqui para ver uma versão maior desta figura.
Para determinar se as células estavam adequadamente aderidas, ao abrir os dispositivos, avaliou-se a formação de uma camada celular sobre a membrana revestida de colágeno (Figura 6A). Para garantir a viabilidade das células do dispositivo, foi realizada uma contagem automática de células (Figura 6B) e uma contagem de células do ensaio de exclusão com azul de tripano (Figura 6C). Os ensaios foram realizados em células Caco-2 de três diferentes configurações de HuMiX: (i) Caco-2 em cultura com NEs, (ii) Caco-2 em cultura com L. reuteri, e (iii) o dispositivo envolvendo co-cultura dos três tipos celulares. O teste estatístico usando ANOVA one-way não produziu diferenças significativas entre os tipos celulares, sugerindo que as células Caco-2 permaneceram viáveis em todas essas configurações iniciais de dispositivos e condições testadas neste estudo. Isso reforça o fato de que a densidade bacteriana atingida durante o co-cultivo de L. reuteri e os dois tipos celulares humanos não têm efeitos citotóxicos sobre as células humanas.
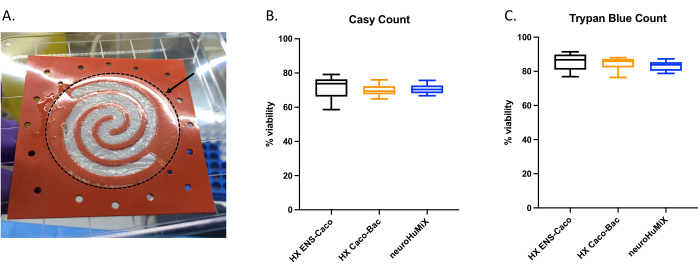
Figura 6: Avaliação das células Caco-2 na membrana revestida com colágeno. (A) Camada de células Caco-2 na membrana revestida com colágeno após a abertura. A seta indica a membrana revestida de colágeno, que é cercada por um círculo tracejado. As células Caco-2 estavam crescendo na forma espiral na membrana. Viabilidade celular de células Caco-2 após 14 dias em HuMiX. As contagens celulares foram obtidas usando (B) o contador automático de células e (C) a contagem de células do ensaio de exclusão com azul de tripano. A contagem de células Caco-2 foi determinada a partir de diferentes configurações de cultura no dispositivo inicial: co-cultura com neurônios entéricos (NEs) (preto), co-cultura com L. reuteri (laranja) e no dispositivo (ENs e L. reuteri) (azul). Uma ANOVA one-way foi realizada, mostrando que não há diferença significativa entre os diferentes ajustes de cultura (ANOVA one-way, p = 0,1234 [ns]; barras de erro indicam erro padrão). Clique aqui para ver uma versão maior desta figura.
Para poder cultivar L. reuteri com células de mamíferos, primeiro otimizamos e adaptamos o meio de cultura para uso no dispositivo. Descobrimos que uma mistura de 5% de MRS em RPMI 1640 (suplementada com 10% de FBS) foi idealmente adequada para o crescimento de L. reuteri, embora não seja citotóxica para as células de mamíferos usadas nesses ensaios. Posteriormente, uma contagem de UFC foi realizada para avaliar o crescimento de L. reuteri quando cultivada no dispositivo por 24 horas. A contagem de UFC foi avaliada para dois diferentes setups iniciais do dispositivo (Figura 7) - L. reuteri co-cultivado com Caco-2 e L. reuteri no dispositivo. Em ambos os setups, as contagens de UFC foram significativamente diferentes do inóculo HuMiX e das células colhidas (ANOVA one-way, p = 0,0002), indicando crescimento das células bacterianas dentro do dispositivo inicial.
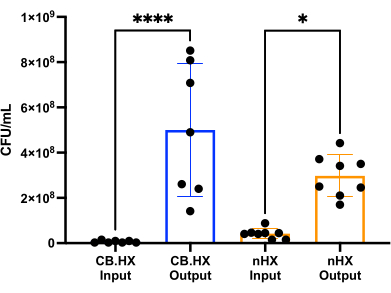
Figura 7: Contagem de UFC de Limosilactobacillus reuteri do inóculo (diluído 1:100.000) e após 24 h em HuMiX. Dois setups diferentes: células Caco-2 em co-cultura com L. reuteri e o dispositivo. Uma ANOVA one-way mostra uma diferença significativa (p = 0,0002 [***]) entre o inóculo e as células colhidas, o que significa que as bactérias estão crescendo dentro do HuMiX. As barras de erro indicam o erro padrão. Abreviações: CB. HX = bactéria Caco-2 HuMiX; nHX = neuroHuMiX. Clique aqui para ver uma versão maior desta figura.
Para avaliar se a cultura dos NEs dentro do dispositivo alteraria o fenótipo das células, a morfologia macroscópica dos NEs foi observada usando um microscópio de contraste de fase invertido. Durante essa etapa, tanto a confluência quanto a morfologia da NE foram avaliadas. O estabelecimento de uma rede neuronal confluente indicou que as células haviam se aderido bem à tampa do PC do dispositivo revestido. É importante ressaltar que isso destaca a noção de que eles cresceram em co-cultura com Caco-2 e L. reuteri. A borda entre a rede neuronal confluente e a espiral delimitada pela junta era claramente aparente (Figura 8).
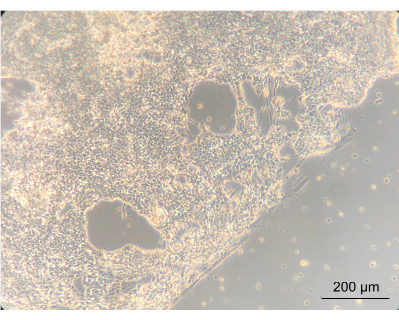
Figura 8: Neurônios entéricos após 14 dias de cultura no dispositivo. No lado esquerdo da imagem, os neurônios cresceram para uma camada confluente na espiral. A borda, entre a camada neuronal e o espaço sem células, é a borda da espiral; ampliado 10x, barra de escala = 200 μm. Clique aqui para ver uma versão maior desta figura.

Figura 2: Tampas utilizadas no dispositivo. As imagens mostram as tampas superiores (esquerda) e inferiores (direita) do PC. Cada lado da tampa do PC tem 6,4 cm. Abreviação: PC = policarbonato. Clique aqui para ver uma versão maior desta figura.

Figura 3: Junta da câmara epitelial na tampa inferior do PC. Vista superior da junta da câmara epitelial colocada na tampa inferior do PC (esquerda) e vista inferior (direita) mostrando o alinhamento da junta da câmara epitelial com as entradas e saídas da tampa inferior do PC. Cada lado das juntas, bem como a tampa do PC, mede 6,4 cm. Abreviação: PC = policarbonato. Clique aqui para ver uma versão maior desta figura.

Figura 4: Montagem do dispositivo. (A) Diferentes peças para montagem do HuMiX: (1) tampa inferior do PC; (2) junta com membrana microporosa revestida de colágeno, que é colocada sobre (1); (3) junta sanduíche com uma membrana nanoporosa revestida de mucina entre e colocada sobre (2); (4) tampa superior do PC colocada em cima de (3). Cada lado das juntas e tampas do PC mede 6,4 cm. (B) Todas as partes de (A) colocadas juntas. (C,D) Vista superior (esquerda) e lateral (direita) do dispositivo montada. B é colocado no sistema de fixação para fechar o sistema. (C) Cada lado da braçadeira superior mede 8 cm. Abreviação: PC = policarbonato. Clique aqui para ver uma versão maior desta figura.
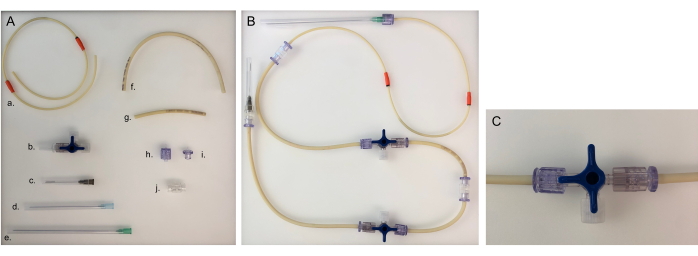
Figura 5: Peças necessárias para a linha de tubulação e linha de tubulação montada para uma câmara. (A) Diferentes partes para construir uma linha de tubulação: a. linha de tubulação de bomba; b. torneira de três vias; c. agulha de 40 mm; d. agulha de 80 mm; e. agulha de 120 mm; f. tubulação longa (20 cm); g. tubulação curta (8 cm); h. Luer masculino; i. Luer fêmea; j. adaptador. (B) Linha de tubulação montada para a câmara bacteriana ou epitelial. Para a câmara neuronal, a agulha de 120 mm precisaria ser trocada por uma agulha de 80 mm. (C) Válvula de torneira de três vias girada para redirecionar o fluxo médio do dispositivo para o "conector aberto" e fechar a câmara. Clique aqui para ver uma versão maior desta figura.
| Dia | 0 | 2 | 4 | 6 | 8 | 10 |
| Composição de Mídia | 100% E6 | 100% E6 | 75% E6 | 50% E6 | 25% E6 | 100% N2 |
| + LDN | + LDN | 25% N2 | 50% N2 | 75% N2 | + LDN | |
| + SB | + SB | + LDN | + LDN | + LDN | + SB | |
| + CHIR | + SB | + SB | + SB | + CHIR | ||
| + CHIR | + CHIR | + CHIR | + AR | |||
| + AR | + AR | |||||
| Molécula | [concentração] | |||||
| LDN | 100 nM | |||||
| SB | 10 μM | |||||
| CHIR | 3 μM | |||||
| Ácido Retinóico (AR) | 1 μM |
Tabela 1: Composição da mídia.
| Mídia | Componentes (concentrações indicadas na Tabela de materiais) | Volume (mL) |
| Meios N2 (50 mL) | DMEM-F12 | 48 |
| Suplemento N2 | 0.5 | |
| L-Glutamina | 0.5 | |
| Penicilina/estreptomicina | 0.5 | |
| NEAA | 0.5 | |
| Meios N2B27/ENS (50 mL) | Neurobasal | 48 |
| Suplemento N2 | 0.5 | |
| L-Glutamina | 0.5 | |
| Penicilina/estreptomicina | 0.5 | |
| B27-A | 0.5 |
Tabela 2: Receitas de mídia.
| Temperatura de Esterilização (°C) | 116 |
| Tempo de Esterilização (min) | 20 |
| Tempo de Secagem (min) | 10 |
| Pulsos | 3 |
| Temperatura final (°C) | 99 |
Tabela 3: Execução da autoclave HuMiX.
| Rotações por minuto (rpm) | Vazão média (μL/min) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
Tabela 4: Vazões da bomba peristáltica.
Discussão
Agora está estabelecido que o microbioma intestinal humano influencia a saúde e a doença do hospedeiro. Apesar do conhecimento sugerir a importância do nosso microbioma, especialmente em distúrbios neurológicos como Alzheimer ou doença de Parkinson 3,13, permanece em grande parte desconhecido como o microbioma intestinal interage com o sistema nervoso entérico e, posteriormente, com o cérebro.
Um modelo representativo para estudar as interações entre o microbioma intestinal e o sistema nervoso até agora não está disponível. Estudos referentes ao eixo intestino-cérebro têm sido tradicionalmente realizados utilizando modelos murinos13. Camundongos e humanos compartilham 85% de suas sequências genômicas14, mas há diferenças significativas a serem consideradas ao comparar camundongos com humanos. Em relação ao intestino, é importante notar que, em comparação com os humanos, os camundongos são exclusivamente herbívoros. Como resultado, seu trato gastrointestinal difere em comprimento e características, como o "esvaziamento gástrico"14. Os cérebros murinos também apresentam diferenças importantes, em que a estrutura geral entre camundongos e humanos é diferente15. É importante ressaltar que os seres humanos têm tempos de ciclo celular mais longos dos progenitores neurais15. Consequentemente, é importante desenvolver modelos representativos que incluam células derivadas do homem, incluindo células intestinais eneuronais5. Nesse contexto, o desenvolvimento de pesquisas mais reprodutíveis via modelos in vitro reduz a necessidade do uso de modelos animais e melhora a reprodutibilidade.
neuroHuMiX é uma versão avançada do modelo anterior HuMiX9. HuMiX é um modelo gut-on-a-chip que permite co-culturas proximais e representativas de células epiteliais e bacterianas. A comunicação célula-célula é possível através da co-cultura proximal e difusão de fatores secretados e metabólitos via membranas semipermeáveis. No entanto, para expandir a utilidade do dispositivo inicial para estudar o ambiente intestinal humano, a introdução de um tipo celular adicional é necessária. Para resolver isso, o neuroHuMiX, desenvolvido com a introdução de ENs derivadas de iPSC, permite uma co-cultura proximal de bactérias, células epiteliais intestinais e ENs. O modelo in vitro resultante permite abordar questões relativas ao microbioma intestinal humano em relação ao sistema nervoso humano. O co-cultivo de diferentes tipos celulares, especialmente co-culturas de células e bactérias de mamíferos, tem vários desafios, incluindo a perda de viabilidade, baixa adesão e perda global de confluência16. Aqui, demonstramos que, dentro deste dispositivo, somos capazes de co-cultivar três tipos diferentes de células dentro do mesmo sistema, mantendo a viabilidade celular alta.
Uma etapa crítica no protocolo é garantir a confluência das células neuronais - 80%-90% de confluência e viabilidade celular - antes de inocular no dispositivo. Como não é possível avaliar o crescimento celular durante a corrida, é de extrema importância garantir que as células estejam confluentes e crescendo bem antes de introduzi-las no modelo. Embora isso possa ser um fator limitante, a viabilidade geral e a confluência observadas dentro do dispositivo são geralmente altas.
O dispositivo é conectado através de linhas de tubulação a uma bomba peristáltica. Cada câmara celular tem sua linha de tubulação específica. A tubulação é composta por uma tubulação de bomba que permite o uso de uma bomba peristáltica para a perfusão do meio, bem como tubulação conectando a tubulação da bomba ao dispositivo e tubulação conectando o dispositivo aos frascos de saída/resíduos. As portas de amostragem são incluídas antes e depois do dispositivo, para permitir a inoculação e amostragem do meio de escoamento. Cada câmara pode ser conectada a um meio diferente, permitindo as melhores condições de cultura para cada tipo de célula individual. Cada câmara pode ser aberta ou fechada dependendo das necessidades específicas de abastecimento médio. No dispositivo, a câmara neuronal permanece fechada durante a maior parte do experimento, enquanto as câmaras bacterianas e epiteliais estão abertas o tempo todo, o que significa que recebem meio fresco durante toda a execução experimental. Para garantir que o meio esteja fluindo sem interrupção, é crucial não ter mais ar nas tubulações, conectores ou no dispositivo. Portanto, é importante primeiro deixar os dispositivos funcionarem por alguns minutos na etapa de priming. Isso geralmente resolve o problema. Caso contrário, uma das outras linhas que estão caindo pode ser fechada por um curto período de tempo, fechando a torneira de três vias da vazão. Isso redireciona o meio para a linha com a bolha de ar, resolvendo assim o problema empurrando a bolha para fora através da tubulação.
Para qualquer experimento de cultura celular, o meio é um componente-chave, onde cada tipo celular tem seu respectivo meio. Em uma configuração de co-cultura, o meio precisa ser compatível não apenas para o tipo de célula que cresce nele, mas também para os outros tipos de células dentro da co-cultura. Isso não é diferente para o dispositivo, que representa um desafio adicional, pois temos três compartimentos diferentes com três tipos diferentes de células dentro - bacterianas, epiteliais e neuronais. No entanto, mostramos que, modificando o meio bacteriano - com a adição de MRS a 5% ao RPMI 1640 com 10% de SFB - todos os tipos celulares, em particular células bacterianas e epiteliais, podem ser co-cultivados com sucesso dentro do sistema. No entanto, no dispositivo, diferentes tipos de células são co-cultivados em proximidade e, portanto, não estão em contato direto uns com os outros. Embora isso não seja totalmente representativo do contato direto entre células no intestino humano e, portanto, uma limitação, a condição de co-cultura proximal e representativa é um ponto forte para análises a jusante. Troca de fatores solúveis entre as diferentes câmaras e tipos celulares; portanto, as células ainda estão interagindo umas com as outras. Além disso, o fato de que os tipos celulares podem ser colhidos e analisados separadamente nos permite estudar o efeito de um microbioma saudável e/ou doente em diferentes tipos de células (incluindo células neuronais) e, assim, determinar/recuperar leituras específicas do tipo celular. Outra limitação é que a morfologia das células não pode ser acompanhada durante a execução experimental, pois o dispositivo só pode ser aberto e as células verificadas ao final de cada experimento.
Até onde sabemos, o neuroHuMiX é o primeiro modelo gut-on-a-chip, incluindo ENs. Este é um passo para elucidar a comunicação entre a microbiota intestinal e o sistema nervoso entérico. É um modelo que permite investigar a interação entre uma espécie bacteriana, uma camada epitelial e ENs. Seu desenho permite estudar a troca de fatores solúveis secretados pelos diferentes tipos celulares e seus efeitos uns sobre os outros. No futuro, seria importante não apenas ter ENs derivadas de iPSC, mas também células epiteliais derivadas de iPSC dentro do dispositivo, para fazer a transição do dispositivo para um modelo personalizado. É importante ressaltar que esse modelo personalizado poderia ser usado para testar pré, pró e simbióticos 10,11 e potencialmente desenvolver rastreamento personalizado e abordagens terapêuticas17. O neuroHuMiX personalizado poderia eventualmente lançar luz sobre a "matéria escura" do microbioma intestinal humano e suas interações com o sistema nervoso ao longo do eixo microbioma intestinal-sistema nervoso, abrindo caminho para avaliação terapêutica e intervenções.
Podemos concluir que ser capaz de ter um intestino-em-um-chip incluindo o sistema neuronal entérico é crucial para progredir no estudo e compreensão das interações ao longo do eixo microbioma intestinal-sistema nervoso. O NeuroHuMiX permite-nos estudar os efeitos das espécies bacterianas nas células hospedeiras e fornece-nos uma boa base para melhorar ainda mais o modelo de uma forma ainda mais fisiologicamente representativa.
Divulgações
P.W. declara estar listado como inventor nas patentes PCT/EP2013/056607, PCT/EP2016/062024, PCT/US2017/061602 e PCT/EP2019/081424. P.W., C.S. e L.G. declaram estar listados como inventores em LU503075 de patente.
Agradecimentos
Os autores gostariam de agradecer ao Dr. Jared Sterneckert por nos fornecer as células da linha K7. Também queremos agradecer aos colaboradores de longa data Dr. Frederic Zenhausern e Matthew W. Barret, da Universidade do Arizona, por sua assistência com os aspectos de engenharia. Também gostaríamos de agradecer à Dra. Valentina Galata por sua ajuda na concepção da representação esquemática do neuroHuMiX. Este projeto recebeu financiamento do Conselho Europeu de Investigação (ERC) no âmbito do programa de investigação e inovação Horizonte 2020 da União Europeia (convenção de subvenção 863664). A Figura 1 foi parcialmente criada com Biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
Referências
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados