Method Article
Модель «кишечник-на-чипе» для изучения оси микробиом-нервная система кишечника
В этой статье
Резюме
neuroHuMiX — это усовершенствованная модель «кишечник-на-чипе» для изучения взаимодействия бактериальных, эпителиальных и нейрональных клеток в проксимальных и репрезентативных условиях кокультуры. Эта модель позволяет разгадать молекулярные механизмы, лежащие в основе связи между микробиомом кишечника и нервной системой.
Аннотация
Человеческое тело колонизировано, по крайней мере, таким же количеством микробных клеток, как и человеческими клетками, и большинство этих микроорганизмов находится в кишечнике. Хотя взаимодействие между микробиомом кишечника и организмом хозяина было тщательно изучено, то, как микробиом кишечника взаимодействует с энтеральной нервной системой, остается в значительной степени неизвестным. На сегодняшний день физиологически репрезентативной модели in vitro для изучения взаимодействия микробиома кишечника и нервной системы не существует.
Чтобы восполнить этот пробел, мы усовершенствовали модель перекрестных помех человека и микроба (HuMiX), введя в устройство индуцированные плюрипотентные энтеральные нейроны, полученные из стволовых клеток. Получившаяся модель, «neuroHuMiX», позволяет совместно культивировать бактериальные, эпителиальные и нейрональные клетки через микрофлюидные каналы, разделенные полупроницаемыми мембранами. Несмотря на разделение различных типов клеток, клетки могут взаимодействовать друг с другом с помощью растворимых факторов, одновременно предоставляя возможность изучать каждый тип клеток отдельно. Эта установка позволяет получить первое представление о том, как микробиом кишечника влияет на нейрональные клетки кишечника. Это важнейший первый шаг в изучении и понимании оси микробиом кишечника и нервной системы человека.
Введение
Микробиом кишечника человека играет решающую роль в здоровье и болезнях человека. Он был широко изучен в течение последних полутора десятилетий, и его потенциальная роль в модуляции здоровья иболезни в настоящее время установлена. Нарушение микробиома, приводящее к несбалансированному микробному сообществу (дисбиозу), предположительно участвует в патогенезе многих хронических заболеваний, таких как ожирение, воспалительные заболевания кишечника и колоректальный рак, или даже нейродегенеративных заболеваний, таких как болезнь Паркинсона.
Хотя микробиом кишечника человека связан с неврологическими заболеваниями, до сих пор неясно, как микробиом кишечника взаимодействует с энтеральной нервной системой и влияет на нее. Поскольку энтеральная нервная система человека не так легко доступна для немедленного изучения, до сих пор в экспериментах использовались животные модели. Однако, учитывая очевидные различия между животными моделямии людьми, разработка моделей in vitro, имитирующих кишечник человека, представляет непосредственный интерес. В этом контексте растущая и развивающаяся область индуцированных плюрипотентных стволовых клеток человека (ИПСК) позволила нам получить репрезентативные энтеральные нейроны (ЭН)6. ЭН, полученные из ИПСК, позволяют исследовать энтеральную нервную систему на моделях культур in vitro, таких как вставки клеточных культур, органоиды или органы-на-чипе 7,8.
Модель перекрестных помех между человеком и микробами (HuMiX) представляет собой модель «кишечник-на-чипе», имитирующую кишечник человека9. Первоначальная модель HuMiX (далее именуемая исходным устройством) содержала эпителиальные клетки (Caco-2) и бактериальные клетки10,11. Тем не менее, для изучения связи между микробиомом кишечника и нервной системой в систему также были введены ENs6, полученные из iPSC (рис. 1). Проксимальная кокультура нейрональных, эпителиальных и бактериальных клеток позволяет анализировать различные типы клеток по отдельности и изучать взаимодействия между различными типами клеток в среде, имитирующей кишечник человека.
В последние годы были достигнуты успехи в разработке моделей для изучения органов более физиологически репрезентативными способами с использованием моделей «органы-на-чипе» (например, «кишечник-на-чипе»). Эти модели более репрезентативны для кишечной среды человека благодаря постоянному поступлению питательных веществ и удалению отходов, а также мониторингу в режиме реального времени, например, уровня кислорода или целостности барьера 8,12. Эти модели, в частности, позволяют изучать влияние кишечных бактерий на клетки хозяина. Однако для того, чтобы иметь возможность использовать органы-на-чипе для изучения взаимосвязей между микробиомом кишечника и нервной системой, нейронные клетки должны быть интегрированы в такие системы. Таким образом, целью дальнейшей разработки HuMiX и создания системы neuroHuMiX (далее именуемой устройством) была разработка модели кишечника на чипе, которая включает в себя кишечные нейрональные клетки в проксимальной кокультуре с эпителиальными клетками кишечника и бактериями.
протокол
1. Культивирование и сортировка клеток
- Индуцированные плюрипотентные энтеральные нейроны, полученные из стволовых клеток
ПРИМЕЧАНИЕ: Культивируйте ИПСК за 6 недель до начала прогона. Протокол дифференциации для ЭН был адаптирован из Fattahi et al.6.- Культивирование ИПСК на матричной 6-луночной планшете, покрытой гелем, в 2 мл/лунку питательной среды ИПСК с добавлением 1% пенициллина-стрептомицина (P/S).
- При слиянии 80%-90% пассажируют клетки, засеивают в матричную пластину, покрытую гелем, используя ту же среду, инкубируют при 37 °C, 5%CO2 и относительной влажности (RH) 90%.
- Для получения ИПСК, после двух проходов после размораживания, при слиянии 80%-90%, клетки засевают в матричную 6-луночную пластину с гелевым покрытием с плотностью 100 000 клеток/лунку. Инкубируют в вышеописанной среде + ингибитор ROCK Y-27632 (1:2,000) в течение 24 ч при 37 °C.
- Через 24 ч замените надосадочную среду средой для приема на 0-й день в соответствии с таблицей 1. Включите одну контрольную лунку, которая будет использоваться в качестве отрицательного контроля во время сортировки клеток для процесса деривации. Хорошо держать контроль в составе среды Дня 0 в течение всего периода деривации. Меняйте среду через день со 2 по 10 день в соответствии с таблицей 1.
- На 11-й день отсортируйте клетки на CD49d-положительные клетки, которые будут использоваться на следующих этапах этого протокола.
- Объедините клетки, подлежащие сортировке, на основе CD49d-положительных клеток, а также контрольную скважину. Центрифугируют клетки в течение 3 мин при 300 × г. Ресуспендант клеточной гранулы в 2% бычьем сывороточном альбумине (BSA) + 1% P/S в 1x фосфатно-солевом буфере (PBS).
- Разделите каждую партию клеток (объединенную и контрольную) на две части: одну фракцию окрасьте антителами к CD49d, а другую — антителами к контролю изотипа.
- Гейт основной клеточной популяции, а затем гейт одиночных клеток, на основе которого будут отобраны клетки, представляющие CD49d на своей поверхности. Соберите эти клетки для следующего этапа дифференцировки.
ПРИМЕЧАНИЕ: Обычно 30%-40% отсортированных клеток являются CD49d-положительными.
- Переложите от двух до четырех миллионов отсортированных клеток на одну 6-луночную пластину сверхнизкого присоединения в среде N2B27 (см. таблицу 2) + FGF2 + CHIR на 4 дня, чтобы обеспечить образование сфероида.
- На 15-й день перенесите сфероиды на 6-луночный планшет с покрытием из поли-L-орнитина/ламинина/фибронектина (P/L/F) в 2 мл/лунку среды N2B27 с GDNF и аскорбиновой кислотой (AA). Заменяйте средство каждые 2-3 дня.
ПРИМЕЧАНИЕ: Соотношение покрытия: поли-L-орнитин, 15 мкг/мл; ламинин, 2 мкг/мл; фибронектин, 2 мкг/мл в 1х ПБС. - Через 3 недели используйте клетки для посева в аппарате.
- Какао-2
ПРИМЕЧАНИЕ: Разморозьте клетки Caco-2 не менее чем за 1 неделю до запуска.- Засейте колбу T75 с 1 × 106 клеток Caco-2 в добавке глютамина RPMI 1640 + HEPES + 10% фетальной бычьей сыворотки (FBS); инкубируют при 37 °C, 5%CO2 и относительной влажности 90%.
ПРИМЕЧАНИЕ: Для этих экспериментов в идеале используйте Caco-2 при их первом или втором прохождении после оттаивания.
- Засейте колбу T75 с 1 × 106 клеток Caco-2 в добавке глютамина RPMI 1640 + HEPES + 10% фетальной бычьей сыворотки (FBS); инкубируют при 37 °C, 5%CO2 и относительной влажности 90%.
2. Подготовка к запуску HuMiX
- Подготовка и покрытие крышки из поликарбоната
- Автоклавируйте пару крышек из поликарбоната (ПК) (рис. 2) вместе с четырьмя винтами, используя начальный приборный цикл устройства (подробнее см. Таблицу 3 ).
- В шкафу биобезопасности вставьте по четыре винта в каждый угол нижней крышки ПК (см. рисунок 3) и перенесите в стерильную квадратную чашку Петри для двухступенчатого процесса нанесения покрытия.
- В первый день добавьте 2 мл 1,5% поли-L-орнитина в PBS (1x) в середину крышки ПК. Инкубируйте в течение ночи при температуре 37 °C, 5%CO2 и относительной влажности 90%.
- На следующий день удалите раствор и замените его раствором, содержащим 0,2% ламинина и 0,2% фибронектина в PBS (1x), чтобы покрыть поверхность клеточной камеры нейрона. Инкубируйте крышку в течение ночи при температуре 37 °C, 5%CO2 и относительной влажности 90%.
- После инкубации держите раствор покрытия на крышке ПК и закройте чашку Петри герметизирующей пленкой. Поместите их при температуре 4 °C для хранения до использования.
- Перед использованием удалить раствор покрытия и высушить на воздухе в шкафу биобезопасности в течение 30 минут до полного высыхания покрытия.
- Подготовка прокладок и нанесение покрытия
ПРИМЕЧАНИЕ: В этом разделе описывается, как подготовить прокладки путем приклеивания полупроницаемых мембран к силиконовым прокладкам. После начального этапа автоклавирования прокладки покрываются коллагеном или муцином, чтобы обеспечить адгезию эпителиальных клеток кишечника или бактерий. Мембрана, покрытая муцином, имитирует слизистый барьер, присутствующий в кишечнике человека.- Прикрепите поликарбонатную мембрану размером 1 мкм к коллагеновой прокладке и поликарбонатную мембрану размером 50 нм между нижней и верхней сэндвич-прокладками. Автоклавируют прокладки с прикрепленными мембранами, используя начальный приборный цикл устройства (см. таблицу 3).
- Чтобы покрыть мембраны, поместите каждую прокладку в стерильную квадратную посуду.
ПРИМЕЧАНИЕ: Нанесение покрытия производится в стерильных условиях в шкафу биобезопасности.- Для коллагеновой прокладки добавьте 3 мл коллагена (50 мкг/мл) в мембрану и инкубируйте в течение 3 ч при 37 °C.
ПРИМЕЧАНИЕ: Будьте осторожны, не касайтесь мембраны наконечником пипетки при добавлении коллагена, чтобы не повредить мембрану. - Для покрытия муцином поместите сэндвич-прокладку верхней стороной вверх в чашку Петри, чтобы покрыть верхнюю сторону мембраны 3 мл муцина (0,025 мг/мл). Инкубируют прокладки при 37 °C в течение 1 ч.
- Для коллагеновой прокладки добавьте 3 мл коллагена (50 мкг/мл) в мембрану и инкубируйте в течение 3 ч при 37 °C.
- По истечении инкубационного периода аспирируйте растворы коллагена и муцина из соответствующих прокладок и высушите мембрану на воздухе в шкафу биобезопасности в течение 30 минут. Закройте посуду, закройте лабораторной уплотнительной пленкой и храните прокладки при температуре 4 °C до использования.
- Монтаж насосно-компрессорных труб
ПРИМЕЧАНИЕ: В этом разделе описывается, как собрать трубку для перфузии устройства. Перед сборкой автоклавируйте все детали и/или купите те, которые упакованы по отдельности в стерильную упаковку. Поместите все компоненты в шкаф биобезопасности.- Используйте три трубки для каждого устройства и для каждой трубной линии, одну часть трубопровода насоса, две части длинных марпреновых трубок (20 см), две короткие марпреновые трубки (8 см), одну иглу 40 мм для бутылки для слива, одну иглу 120 мм для бутылок для притока 250 мл или иглу 80 мм для небольших бутылок для притока, три штекерных и семь гнездовых соединителей Luer-to-barb, три адаптера Luer и два трехходовых запорных крана.
- Соберите трубопроводы слева направо, используя автоклавные и стерилизованные компоненты, перечисленные выше (Рисунок 4).
ПРИМЕЧАНИЕ: Распыляйте на каждый компонент 70% этанола между каждым этапом соединения.
- Подготовка материала
ПРИМЕЧАНИЕ: В этом разделе описывается, как подготовить среду для различных типов клеток в устройстве, а также как стерильно перенести среду во флаконы с сывороткой.- Дополните RPMI 1640 10% фильтром 0,22 мкм, термоинактивированным FBS. Дополните носитель N2B27 новыми GDNF и AA.
- Перелейте средство во флаконы с сывороткой в стерильных условиях. Перенесите 200 мл среды RPMI 1640 во флаконы по 250 мл и 30 мл среды N2B27 во флаконы по 50 мл.
- Приготовьте бактериальную среду (RPMI 1640 + 10% FBS + 5% De Man, Rogosa и культуральную среду Shapre [MRS]) на более позднем этапе, так как это требуется только в течение последних 24 часов эксперимента.
- Закройте бутылки перегородкой, обжмите их алюминием и автоклавом.
- Для переноса носителя снимите алюминиевый обжим с помощью соответствующего укупорщика (диаметр = 20 мм). Также удалите перегородку. Осторожно разлейте приготовленное средство по флаконам с сывороткой, не прикасаясь к флакону.
- Для стерилизации подожгите отверстие бутылки с помощью портативной горелки Бунзена. Запечатайте бутылки, распылив на перегородку 70% этилового спирта, добавив его в бутылку и закрыв ее алюминиевым обжимом с помощью обжимного устройства для уплотнения.
- Закрытые флаконы поместить в инкубатор при температуре 37 °С, 5%СО2 на 24 ч для прогрева среды до 37 °С, а также убедиться в отсутствии видимых признаков загрязнения перед использованием флаконов со средой для устройства.
3. Запуск HuMiX
- Сборка NeuroHuMiX
ПРИМЕЧАНИЕ: В этом разделе объясняется, как собрать устройство. Короче говоря, зажимная система стерилизуется и снова затягивается, после чего нижняя крышка из поликарбоната помещается на основание зажима. Затем прокладки с покрытием и верхние крышки из поликарбоната укладываются друг на друга, а затем верхняя часть хомута. Наконец, зажим затягивается, чтобы сжать прокладки и сделать систему герметичной и газонепроницаемой. На рисунке 4 показаны различные детали, необходимые для сборки.- Перед сборкой автоклавируйте зажимы и две крышки из поликарбоната (верхнюю и нижнюю).
- Затяните винты, используемые для сборки верхней и нижней частей зажима (Рисунок 4C, D). Откройте винты перед процессом автоклавирования и затяните их позже.
- Переместите покрытую и высушенную (шаг 2.2.3) нижнюю крышку ПК (Рисунок 4 A1) из квадратной чашки Петри в верхнюю часть основания зажима, удерживая четыре винта в углах крышки ПК.
ПРИМЕЧАНИЕ: Не прикасайтесь к крышке ПК, чтобы снизить риск загрязнения. - Стерильным пинцетом поместите прокладку эпителиальной камеры вверх (т.е. мембраной сверху) на крышку поликарбоната. С помощью винтов выровняйте прокладку и крышку из поликарбоната, чтобы впускные и выпускные отверстия в углах крышки совпали с отверстиями в прокладке (Рисунок 3).
- С помощью стерильного пинцета поместите прокладку для сэндвича поверх коллагеновой прокладки верхней стороной вверх.
- Поместите верхнюю крышку ПК поверх сэндвич-прокладки. Чтобы снизить риск загрязнения, делайте это, прикасаясь только к краям крышки (не прикасайтесь к верхней или нижней части крышки). Убедитесь, что заусеницы на крышке зажима совпадают с входным и выпускным отверстиями мембраны в сборе, а винты от нижней крышки ПК входят в отверстие верхней крышки ПК.
- Чтобы закрыть устройство, поместите зажимную крышку (верхнюю часть зажима) поверх крышки ПК. Убедитесь, что отверстия крышки совпадают с входными и выпускными зазубринами верхней крышки из поликарбоната. Закройте защелки. Держите закрытое устройство (Рисунок 5) под колпаком, чтобы подключить его к загрунтованным трубопроводам (шаг 3.2.6).
- Грунтовка насосно-компрессорных труб
ПРИМЕЧАНИЕ: В этом разделе описывается, как подсоединить трубку к бутылкам для входа и выхода, а также к насосу, затем заправить трубку средой для удаления любых остатков продуктов, используемых во время очистки и стерилизации, и убедиться, что в трубке нет пузырьков.- Грунтовка насосно-компрессорных труб производится в шкафу биобезопасности. Вставьте аэрационные иглы с фильтрами в перегородку каждой входной и выходной бутылки. Чистым стерильным пинцетом вставьте иглы диаметром 120 мм во флаконы с сывороткой объемом 250 мл. Вставьте иглы диаметром 80 мм во флаконы с сывороткой объемом 50 мл.
- Вставьте иглы диаметром 40 мм в конце каждой трубки во флакон с сывороткой. В каждом устройстве имеется две выпускные бутылки для трех трубопроводных линий. 40-миллиметровые иглы линии эпителиальных и нейрональных трубок соединены с одной и той же бутылкой для слива среды. Линия бактериальной трубки идет ко второму выпускному флакону.
- Вставьте трубопроводы насоса в кассеты насоса. Убедитесь, что все трехходовые запорные краны трубопроводов открыты.
- В начале настройте перистальтический насос так, чтобы он направлял среду из впускной бутылки в бутылку для слива со скоростью 5 об/мин (см. таблицу 4).
ПРИМЕЧАНИЕ: Во время заливки трубопровода скорость может быть увеличена до 10 об/мин для ускорения процесса. - Запустите насос, нажав кнопку запуска , и убедитесь, что направление откачки - по часовой стрелке. После того, как среда попадет в бутылки для слива, убедитесь, что в трубопроводах трубок и точках соединения не осталось утечек и пузырьков воздуха. Удалите оставшиеся пузырьки, постукивая по трубкам и соединителям или увеличивая скорость насоса.
- Когда все трубные линии опускаются в бутылки для слива, установите скорость потока на 2 об/мин для подключения начального устройства.
- Грунтовка прибора
ПРИМЕЧАНИЕ: В этом разделе описывается, как заправить устройство питательной средой для клеток, чтобы убедиться, что все камеры заполнены и предварительно покрыты средой, чтобы в системе не осталось пузырьков и клетки могли легко прилипнуть во время инокуляции.- Грунтовка прибора производится в шкафу биобезопасности в стерильных условиях. Чтобы подключить устройство, начните с подключения нейронной линии, нижней камеры устройства.
- Чтобы подключить линию, закройте трехходовые запорные краны (Рисунок 5C), начиная сначала со стороны выхода, где короткая трубка отсоединяется от гнездового соединителя Луэра и подключается к выпускному порту устройства, проталкивая трубку через зазубрину. Чтобы обеспечить правильное соединение и снизить вероятность утечек и/или загрязнения, убедитесь, что трубка соприкасается с крышкой, надавив на нее до упора на соединитель. Таким же образом подсоедините впускную трубку. После того, как одна линия будет полностью подключена к устройству (приток и выпуск), откройте трехходовые запорные краны.
- Повторите предыдущий шаг с эпителиальной линией, а затем с бактериальной линией. Поддерживайте скорость потока насоса 2 об/мин. Увеличьте частоту вращения насоса до 2,5 об/мин, но не выше, чтобы избежать утечек из-за повышения давления. Дайте насосу заполнить камеры в устройстве.
- Постоянно контролируйте количество флаконов с сывороткой. Если пузырьки воздуха застревают в камерах, трубопроводах или соединителе, трубопровод с пузырьком воздуха внутри больше не будет опускаться в камеру слива. Чтобы избавиться от пузырьков воздуха, сначала дайте устройствам поработать в течение нескольких минут. Если это не решит проблему, закройте одну из других линий, которые падают, на короткое время, закрыв трехходовой запорный кран слива.
- После того, как все камеры аппарата будут полностью заполнены питательной средой для клеточных культур и в аппарате не останется пузырьков, уменьшите частоту вращения насоса до 0,5 об/мин. Теперь устройство готово к клеточной инокуляции.
4. Подготовка клеток и посев
ПРИМЕЧАНИЕ: В этом разделе описывается, как подготовить различные типы клеток, необходимых для инокуляции устройства, а также как засеять их в устройство стерильным способом и без введения пузырьков воздуха. Кроме того, в нем описывается, как выполнить освежение среды для нейрональных клеток и как подготовить среду для бактериальной культуры в устройстве.
- Эпителиальные клетки
- Отделите клетки Caco-2 от колбы с помощью трипсин-этилендиаминтетрауксусной кислоты (ЭДТА), ресуспендируйте в RPMI 1640 + 10% FBS и подсчитайте в счетчике клеток Нойбауэра с помощью анализа исключения трипанового синего. Центрифугируют клеточную суспензию Caco-2 (3 мин, 300 × г) и выбрасывают надосадочную жидкость для удаления оставшегося трипсина-ЭДТА. Ресуспендировать клетки Caco-2 в RMPI 1640 + 10% FBS для получения суспензии 350 000 клеток/мл. Для каждого прибора необходим объем 1,5 мл.
- Перелейте 1,5 мл клеточной суспензии Caco-2 в стерильный шприц объемом 2 мл и удалите весь воздух или пузырьки, оставшиеся в шприце.
- Закройте трехходовые запорные краны трубок бактериальной и нейрональной камер. Отсоедините трубки бактериальной и нейрональной камер от насоса, сняв кассеты с соответствующими трубками с ротора.
- Откройте крышку трехходового запорного клапана впускной трубки, ведущей к эпителиальной камере, и поверните трехходовой запорный клапан, чтобы перенаправить поток среды от устройства к «открытому соединителю» (рис. 5C). Дайте среде течь до тех пор, пока капля среды не появится на открытом конце трехходового запорного крана.
- Вставьте шприц, содержащий эпителиальные клетки, в «открытый коннектор», используя метод «капля-капля», чтобы шприц можно было ввести в коннектор без введения пузырьков воздуха. Поверните клапан трехходового запорного крана, чтобы остановить поток среды из входного флакона (через насос) и обеспечить поток из подключенного шприца к исходному устройству. Отсоедините эпителиальный канал от помпы.
- Медленно нажмите на шприц, чтобы засеять эпителиальную камеру клеточной суспензией. Следите за тем, чтобы примерно одна капля каждые 3 с попадала в сливную бутылку.
- Добавьте 1,5 мл суспензии ячейки, затем закройте клапан выпускного трехходового запорного крана. Отсоедините шприц и закройте открытый конец трехходового запорного крана колпачком. Держите камеру закрытой не менее 2 ч. Тем временем инокулируйте нейронные клетки.
- Нейрональные клетки
- Отделите нейрональные клетки от лунки, повторно суспендировав клетки среды из соответствующих лунок с помощью пипетки. Инокуляция каждого устройства полностью сливающимися клетками из одной лунки (9,6см2) 6-луночной пластины.
- Ресуспендант клеточной гранулы в соответствующем объеме среды N2B27 (1,5 мл среды на устройство) + 1 мкл фибронектина/мл клеточной суспензии. Перелейте 1,5 мл ресуспендированной клеточной суспензии в шприц объемом 2 мл и удалите все пузырьки воздуха, оставшиеся в шприце. Поместите заполненный шприц в стерильную коническую пробирку объемом 50 мл и перенесите в шкаф биобезопасности, содержащий загрунтованное устройство HuMiX.
- Следуйте тому же процессу посева, который был описан ранее для инокуляции эпителиальной камеры, за исключением замены линии трубки. Здесь отсоедините бактериальную и эпителиальную трубки от насоса.
- После посева нейрональных клеток закройте все трехходовые запорные краны трубных линий и отсоедините от насоса. Поместите прибор в инкубатор при температуре 37 °C и 5% CO2. Держите все каналы закрытыми в течение 2 часов, чтобы клетки могли прикрепиться.
- Через 2 ч подсоедините бактериальный и эпителиальный каналы к насосу и откройте входной и выпускной трехходовые запорные краны обеих линий. Держите нейронную камеру закрытой в течение следующих 14 дней после первоначального запуска устройства, за исключением времени смены среды.
- В течение 14-дневного бега меняйте среду нейронной камеры каждые 3-4 дня. Для среднего обновления приготовьте 3 мл свежей среды N2B27 на устройство и перелейте в стерильный флакон с сывороткой объемом 20 мл. Закройте флакон с сывороткой со средой, используя стерильную перегородку и алюминиевую обжимную пломбу.
- Вставьте аэрацию и иглу диаметром 80 мм в перегородку новой бутылки. Замените старую бутылку со средой на новую в инкубаторе, отсоединив самца Люэра от иглы старой бутылки к игле новой бутылки.
- Соедините кассету с трубкой насоса нейронной камеры к насосу и откройте трехходовые запорные краны. Дайте среде течь со скоростью 0,5 об/мин в течение 2 ч, прежде чем закрыть трехходовые запорные краны нейрональной трубки и отсоединиться от насоса до следующей замены среды.
5. Бактериальный посев и посев
ПРИМЕЧАНИЕ: В этом исследовании на 12-й день жидкую культуру Limosilactobacillus reuteri штамма F275 реанимировали из глицеринового запаса. В зависимости от потребностей или дизайна исследования могут быть использованы другие виды бактерий.
- Приготовьте три пробирки с 5 мл бульона MRS – одну стерильную контрольную пробирку и две для посева L. reuteri. С помощью инокуляционной петли соскребите верхнюю часть глицеринового бульона и переложите его в одну пробирку. Повторите то же самое со второй прививочной пробиркой. Инкубируйте пробирки при температуре 37 °C, 170 об/мин в течение ночи.
ПРИМЕЧАНИЕ: Не позволяйте бульону глицерина оттаять. - Приготовьте свежую среду для начальных устройств, смешав Roswell Park Memorial Institute (RPMI) 1640 + 10% FBS с 5% бульоном MRS. Приготовьте 25 мл на устройство и перелейте во флаконы с сывороткой по 100 мл в стерильных условиях. Закройте бутылки стерильной перегородкой и алюминиевым обжимом. Поместите бутылочки в инкубатор при температуре 37 °C, 5%CO2 на ночь.
- Перед подключением флаконов к бактериальной трубке добавьте аэрационную иглу и иглу 80 мм в каждый флакон с фильтрующим материалом RPMI 1640/MRS.
- Приготовьте новые пробирки, в каждой из которых будет 3 мл RPMI 1640 + 10% бульона FBS + 5% MRS. Подготовьте не менее двух пробирок, одну контрольную и одну пробирку на устройство. Посев 15 мкл ночной культуры L. reuteri (оптическая плотность [OD] > 2) в две из вновь подготовленных пробирок.
- Инкубируют пробирки в течение 1 ч при 37 °C, 170 об/мин, после чего достигают наружного диаметра 0,05-0,10, что соответствует ~1 × 107 колониеобразующих единиц (КОЕ)/мл. Перелейте 1,5 мл в шприц объемом 2 мл (по одному на устройство). Используйте оставшуюся бактериальную суспензию для покрытия КОЕ и окрашивания живым/мертвым цветом.
- Для бактериального посева устройства выполните ту же процедуру, что и на шаге 4.1, за исключением того, что здесь линии нейрональной и эпителиальной трубок закрыты.
- После инокуляции также закройте линию бактериальной трубки, закрыв клапаны и отключив от насоса на 30 минут. Соедините эпителиальную и бактериальную трубки и снова откройте. Дайте устройствам поработать еще 24 часа при температуре 37 °C и 0,5 об/мин.
6. Вскрытие и отбор проб HuMiX
ПРИМЕЧАНИЕ: В разделе ниже описана выборка различных типов ячеек. Например, гранулы нейрональных клеток используются для экстракции РНК и последующей количественной полимеразной цепной реакции (кПЦР), бактериальные гранулы — для экстракции ДНК и секвенирования гена 16S рРНК, а супернатанты — для иммуноферментного анализа (ИФА) и других анализов (например, анализа лактата).
- На 14-й день, в день открытия, закройте все трехходовые запорные краны, отсоедините трубки от насоса и выньте устройство инкубатора на лабораторный стол.
ПРИМЕЧАНИЕ: При перемещении устройства убедитесь, что оно находится в горизонтальном положении. - Перед медленным открытием зажима снимите трубки, подключенные к устройству, и снимите крышку зажима. Осторожно снимите верхнюю крышку ПК, соберите среду в пробирку для микроцентрифуги объемом 1,5 мл и поместите ее на лед.
- Аккуратно снимите сэндвич-прокладку, собирая при этом среду из эпителиальной камеры; Будьте осторожны, чтобы не прикоснуться к клеточному слою. Поместите прокладку для сэндвича в квадратную чашку Петри и добавьте стерильный 0,9% раствор NaCl вH2Oв бактериальную камеру до тех пор, пока камера не будет полностью покрыта (примерно 1 мл).
- Медленно извлеките коллагеновую прокладку, собирая среду из нейронной камеры и перенося ее в микроцентрифужную пробирку. Поместите все трубки носителя на лед. Поместите коллагеновую прокладку в квадратную чашку и осторожно добавьте несколько миллилитров 1x PBS в слой Caco-2, пока клеточный слой не будет полностью покрыт.
- Поместите нижнюю крышку ПК в квадратную чашку Петри и осторожно добавьте примерно 2 мл 1x PBS поверх нейрональных клеток, чтобы они не высохли в процессе отбора проб.
- Центрифугируют пробирку с бактериальной средой при 5 000 × г в течение 5 мин при 4 °C. Центрифугируют эпителиальные и нейрональные пробирки при 300 × г в течение 5 мин при 4 °С. После центрифугирования перелейте надосадочную жидкость из каждой пробирки в новую пробирку микроцентрифуги и сразу же поместите ее на сухой лед.
- Эпителиальные клетки
- Аккуратно снимите PBS с прокладки и соберите в коническую пробирку объемом 15 мл. Добавьте 2 мл трипсина к клеткам и инкубируйте прокладку в течение 5 мин при 37 °C, 5% CO2. Добавьте 2 мл RPMI 1640 в прокладку после инкубации, повторно суспендируйте клетки и соберите в другую коническую пробирку объемом 15 мл.
- Центрифугируют обе пробирки в течение 5 мин при 300 × г. Выбросьте надосадочную жидкость. Ресуспендируйте гранулу из промывки PBS в 300 мкл PBS и клеточную гранулу в 1 мл PBS.
- Перелейте 50 мкл каждой пробирки в пробирку для микроцентрифуги объемом 0,5 мл для автоматического счетчика клеток и подсчета клеток для анализа на трипановый синий эксклюзионный анализ. Переложите ресуспендированную клеточную гранулу (1 мл) в пробирку объемом 1,5 мл и центрифугу при 300 × г в течение 5 мин.
- Удалите надосадочную жидкость и повторно суспендируйте клеточную гранулу в 250 мкл лизисного буфера + 1% бета-меркаптоэтанола и поместите пробирку на сухой лед.
- Нейрональные клетки
- Возьмите квадратную чашку Петри с нижней прозрачной крышкой из поликарбоната с нейрональными клетками из предыдущего шага (6,5) для инвертированного фазово-контрастного микроскопа.
ПРИМЕЧАНИЕ: Перемещая крышку ПК с PBS поверх нее, будьте очень осторожны, так как нейронная сеть очень легко отсоединяется. - Выполните последнюю проверку качества перед инокуляцией, наблюдая за морфологией и плотностью клеток нейронов с помощью светлопольной микроскопии. Убедитесь, что клетки мигрировали из сфероидов и сформировалась нейронная сеть. Нейронная сеть должна сливаться примерно на 90%. Для получения более подробной информации см. Fattahi et al.6.
- На стенде ресуспендируйте клетки в PBS и соберите в пробирку объемом 1,5 мл. Центрифугируют пробирку при 300 × г в течение 3 мин. Выбросьте надосадочную жидкость, повторно суспендируйте клеточную гранулу в 250 мкл лизисного буфера + 1% бета-меркаптоэтанола и поместите на сухой лед.
ПРИМЕЧАНИЕ: Иммунофлуоресцентное (ИФ) окрашивание может быть выполнено на нейрональных клетках на крышке ПК. Если окрашивание ПФ является предпочтительным анализом, чтобы не разрушить нейронную сеть, клетки должны быть зафиксированы на крышке ПК с 4% параформальдегидом (PFA), что препятствует повторному использованию крышки ПК в будущих экспериментах.
- Возьмите квадратную чашку Петри с нижней прозрачной крышкой из поликарбоната с нейрональными клетками из предыдущего шага (6,5) для инвертированного фазово-контрастного микроскопа.
- Бактериальные клетки
- Ресуспендировать бактериальные клетки, прикрепленные к мембране, в 0,9% растворе NaCl. Если клетки прочно прикреплены, осторожно используйте скребок для клеток, чтобы отделить бактериальные клетки от мембраны.
ПРИМЕЧАНИЕ: Использование скребка может повредить клетки, увеличивая вероятность увидеть больше мертвых клеток. - Соберите клеточную суспензию в коническую пробирку объемом 15 мл. Добавьте гранулы, оставшиеся от ранее собранной среды, в коническую пробирку объемом 15 мл. Центрифугу при 5 000 × г в течение 5 мин при 4 °C. Выбросьте надосадочную жидкость и повторно суспендируйте клеточную гранулу в 1 мл 0,9% раствора NaCl.
- Разделите этот объем на три части: одну для замораживания бактериальной гранулы для экстракции нуклеиновых кислот (650 мкл), одну для покрытия КОЕ (50 мкл) на пластинах MRS и одну для живого/мертвого окрашивания (300 мкл). Для приготовления гранулы для экстракции нуклеиновых кислот переносят клеточную суспензию в микроцентрифужную пробирку, центрифугируют при 5 000 × г в течение 5 мин при 4 °С и выбрасывают надосадочную жидкость. Поместите клеточную гранулу на сухой лед.
- По окончании отбора проб переложите все пробирки на сухом льду в морозильную камеру с температурой -80 °C для хранения для последующего анализа.
ПРИМЕЧАНИЕ: Надосадочную жидкость можно в дальнейшем использовать для анализа газовой хромато-масс-спектрометрии (ГХ-МС). Кроме того, во время вскрытия мембрана, покрытая коллагеном, может быть разделена на разные части для различных анализов: одна часть будет использоваться для окклюдинового окрашивания, другая часть для экстракции РНК для дальнейшего анализа экспрессии генов, а третья часть для подсчета клеток.
- Ресуспендировать бактериальные клетки, прикрепленные к мембране, в 0,9% растворе NaCl. Если клетки прочно прикреплены, осторожно используйте скребок для клеток, чтобы отделить бактериальные клетки от мембраны.
Результаты
В neuroHuMiX мы совместно культивировали три различных типа клеток — бактериальные, эпителиальные и нейрональные клетки (рис. 1). Чтобы убедиться, что все клетки жизнеспособны, мы провели различные анализы на разных типах клеток. Например, мы проводили подсчет КОЕ бактериальных клеток, количество клеток и анализ жизнеспособности клеток на эпителиальных клетках, в то время как нейрональные клетки оценивались с помощью микроскопического анализа.
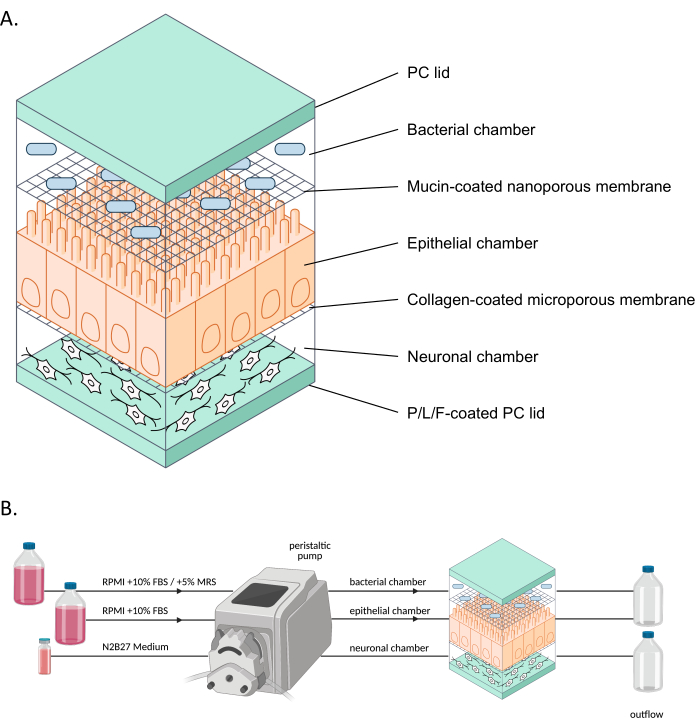
Рисунок 1: Схематическое изображение neuroHuMiX и его экспериментальная установка . (A) Три камеры удерживаются между двумя крышками ПК, чтобы держать их закрытыми. Каждая камера заполнена определенной средой для клеток, выращенных внутри. Различные камеры разделены полупроницаемыми мембранами, обеспечивающими связь между клетками через растворимые факторы, проходящие через мембраны. (Б) Представление настройки neuroHuMiX. Каждая камера соединена с различными бутылками для среды. Для бактериальной камеры в течение первых 12,5 дней камера подключается к RPMI + 10% FBS, а затем меняется в течение последних 36 ч на RPMI + 10% FBS + 5% MRS. Сокращения: PC = поликарбонат; P/L/F = полиL-орнитин/ламинин/фибронектин; RPMI = среда для культивирования клеток Мемориального института Розуэлл-Парка; MRS = среда культуры Де Ман, Рогоса и Шапре. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Чтобы определить, правильно ли прикреплены клетки, при вскрытии устройств мы оценили образование клеточного слоя на мембране, покрытой коллагеном (рис. 6А). Чтобы убедиться в жизнеспособности клеток в устройстве, был проведен автоматический счетчик клеток (Рисунок 6B) и анализ на трипановый синий (Рисунок 6C). Анализы проводились на клетках Caco-2 из трех различных установок HuMiX: (i) Caco-2 в культуре с ENs, (ii) Caco-2 в культуре с L. reuteri и (iii) устройстве, включающем совместное культивирование всех трех типов клеток. Статистическое тестирование с использованием одностороннего ANOVA не выявило каких-либо существенных различий между типами клеток, предполагая, что клетки Caco-2 оставались жизнеспособными во всех этих первоначальных установках устройств и условиях, протестированных в этом исследовании. Это подчеркивает тот факт, что бактериальная плотность, достигнутая при совместном культивировании L. reuteri и двух типов клеток человека, не оказывает цитотоксического действия на клетки человека.
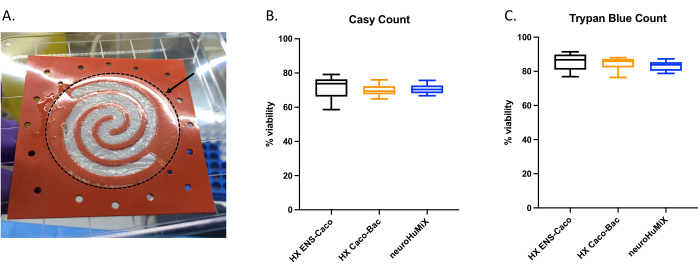
Рисунок 6: Оценка клеток Caco-2 на мембране, покрытой коллагеном. (A) Слой клеток Caco-2 на мембране, покрытой коллагеном, после вскрытия. Стрелка указывает на мембрану, покрытую коллагеном, которая окружена пунктирным кругом. Клетки Caco-2 росли на мембране по спиралевидной форме. Жизнеспособность клеток Caco-2 через 14 дней в HuMiX. Количество клеток было получено с помощью (B) автоматического счетчика клеток и (C) количества клеток для анализа исключения трипанового синего. Количество клеток Caco-2 определяли по различным культуральным установкам в исходном устройстве: кокультура с кишечными нейронами (ЭН) (черная), кокультура с L. reuteri (оранжевая) и в аппарате (ЭН и L. reuteri) (синяя). Был выполнен односторонний ANOVA, который показал, что нет существенной разницы между различными настройками культуры (односторонний ANOVA, p = 0,1234 [нс]; столбцы ошибки указывают на стандартную ошибку). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Чтобы иметь возможность культивировать L. reuteri с клетками млекопитающих, мы сначала оптимизировали и адаптировали питательные среды для использования в устройстве. Мы обнаружили, что 5%-ная смесь MRS в RPMI 1640 (дополненная 10% FBS) оптимально подходит для роста L. reuteri , но при этом не является цитотоксической для клеток млекопитающих, используемых в этих анализах. Затем был проведен подсчет КОЕ для оценки роста L. reuteri при культивировании в устройстве в течение 24 ч. Количество КОЕ оценивали для двух различных исходных установок устройства (рис. 7) - L. reuteri совместно культивировали с Caco-2 и L. reuteri в устройстве . В обоих случаях количество КОЕ достоверно отличалось от инокулята HuMiX и собранных клеток (односторонний ANOVA, p = 0,0002), что указывает на рост бактериальных клеток внутри исходного устройства.
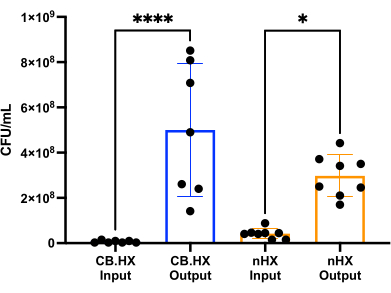
Рисунок 7: Подсчет КОЕ в КОЕ (разбавленном 1:100 000) и через 24 ч в HuMiX. Две различные установки: клетки Caco-2 в кокультуре с L. reuteri и устройство. Односторонний ANOVA показывает существенную разницу (p = 0,0002 [***]) между посевным материалом и собранными клетками, что означает, что бактерии растут внутри HuMiX. Полосы ошибок указывают на стандартную ошибку. Аббревиатуры: CB. HX = Caco-2 бактерии HuMiX; nHX = neuroHuMiX. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Чтобы оценить, изменит ли культивирование ЭН внутри устройства фенотип клеток, с помощью инвертированного фазово-контрастного микроскопа наблюдали общую морфологию ЭН. На этом этапе оценивались как слияние, так и морфология EN. Создание сливающейся нейронной сети показало, что клетки хорошо прикрепились к крышке ПК устройства с покрытием. Важно отметить, что это подчеркивает идею о том, что они росли в кокультуре с Caco-2 и L. reuteri. Граница между сливающейся нейронной сетью и спиралью, очерченной прокладкой, была отчетливо видна (рис. 8).
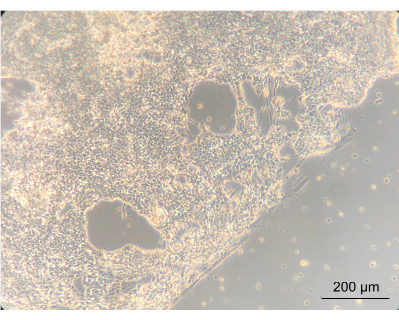
Рисунок 8: Кишечные нейроны после 14 дней культивирования в приборе. В левой части изображения нейроны срослись до сливающегося слоя на спирали. Край между нейронным слоем и пространством без клеток является краем спирали; Увеличение в 10 раз, масштабная линейка = 200 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Крышки, используемые в устройстве. На изображениях показаны верхняя (слева) и нижняя (справа) крышки ПК. Каждая сторона крышки из поликарбоната составляет 6,4 см. Аббревиатура: ПК = поликарбонат. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Прокладка эпителиальной камеры на нижней крышке поликарбоната. Вид сверху прокладки эпителиальной камеры, размещенной на нижней крышке поликарбоната (слева), и вид снизу (справа), показывающий совмещение прокладки эпителиальной камеры с входными и выходными отверстиями нижней крышки поликарбоната. Каждая сторона прокладок, а также крышка из поликарбоната имеют размеры 6,4 см. Аббревиатура: ПК = поликарбонат. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Сборка устройства. (A) Различные детали для сборки HuMiX: (1) нижняя крышка ПК; (2) прокладка с микропористой мембраной, покрытой коллагеном, которая размещена поверх (1); (3) многослойная прокладка с нанопористой мембраной, покрытой муцином между ними и размещенная поверх (2); (4) Верхняя крышка ПК размещена поверх (3). Каждая сторона прокладок и крышек из поликарбоната имеет размер 6,4 см. (B) Все детали из (A) размещены вместе. (С,Д) Устройство в собранном виде - вид сверху (слева) и сбоку (справа). B помещается в зажимную систему для закрытия системы. (C) Каждая сторона верхнего зажима имеет размер 8 см. Аббревиатура: ПК = поликарбонат. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
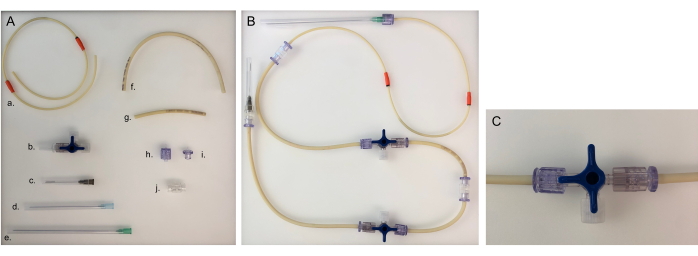
Иллюстрация 5: Детали, необходимые для трубопровода и сборного трубопровода для одной камеры. (A) Различные части для построения насосно-компрессорной линии: a. насосно-компрессорная линия; b. трехходовой запорный кран; игла 40 мм; г. игла 80 мм; e. игла 120 мм; f. длинный трубопровод (20 см); ж. короткая трубка (8 см); з. самец Луера; i. самка Луэра; Ж. Адаптер. (B) Сборная трубная линия для бактериальной или эпителиальной камеры. Для нейронной камеры иглу диаметром 120 мм необходимо заменить на иглу диаметром 80 мм. (C) Трехходовой запорный кран поворачивается для перенаправления потока среды из устройства в «открытый разъем» и для закрытия камеры. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| День | 0 | 2 | 4 | 6 | 8 | 10 |
| Медиа-композиция | 100% Е6 | 100% Е6 | 75% Е6 | 50% Е6 | 25% Е6 | 100% N2 |
| + ЛДН | + ЛДН | 25% N2 | 50% N2 | 75% N2 | + ЛДН | |
| + СБ | + СБ | + ЛДН | + ЛДН | + ЛДН | + СБ | |
| + ХИР | + СБ | + СБ | + СБ | + ХИР | ||
| + ХИР | + ХИР | + ХИР | + РА | |||
| + РА | + РА | |||||
| Молекула | [концентрация] | |||||
| ЛДН | 100 нМ | |||||
| СБ | 10 мкМ | |||||
| ЧИР | 3 мкМ | |||||
| Ретиноевая кислота (RA) | 1 мкМ |
Таблица 1: Состав СМИ.
| Медиа | Компоненты (концентрации, указанные в таблице материалов) | Объем (мл) |
| N2 среда (50 мл) | ДМЭМ-Ф12 | 48 |
| Дополнение N2 | 0.5 | |
| L-глютамин | 0.5 | |
| Пенициллин/Стрептомицин | 0.5 | |
| НИАА | 0.5 | |
| N2B27/ENS Среда (50 мл) | Нейробазальный | 48 |
| Дополнение N2 | 0.5 | |
| L-глютамин | 0.5 | |
| Пенициллин/Стрептомицин | 0.5 | |
| Б27-А | 0.5 |
Таблица 2: Рецепты сред.
| Температура стерилизации (°C) | 116 |
| Время стерилизации (мин) | 20 |
| Время высыхания (мин) | 10 |
| Импульсов | 3 |
| Конечная температура (°C) | 99 |
Таблица 3: Запуск автоклава HuMiX.
| Количество оборотов в минуту (об/мин) | Средний расход (мкл/мин) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
Таблица 4: Расход перистальтического насоса.
Обсуждение
В настоящее время установлено, что микробиом кишечника человека влияет на здоровье и болезнь хозяина. Несмотря на знания, свидетельствующие о важности нашего микробиома, особенно при неврологических расстройствах, таких как болезнь Альцгеймера или болезнь Паркинсона, остается в значительной степени неизвестным, как микробиом кишечника взаимодействует с энтеральной нервной системой, а следовательно, и с мозгом.
Репрезентативная модель для изучения взаимодействия между микробиомом кишечника и нервной системой до сих пор была недоступна. Исследования, касающиеся оси кишечник-мозг, традиционно проводились с использованием мышиных моделей13. У мышей и людей 85% общих геномных последовательностей, но при сравнении мышей и людей следует учитывать существенные различия. Что касается кишечника, важно отметить, что, по сравнению с человеком, мыши являются исключительно травоядными. В результате их желудочно-кишечный тракт различается по длине и характеристикам, таким как «опорожнение желудка»14. Мозг мышей также демонстрирует важные различия, в результате чего общая структура между мышами илюдьми отличается. Важно отметить, что у людей более длительное время клеточного цикла нейронных предшественников15. Следовательно, важно разработать репрезентативные модели, включающие клетки человеческого происхождения, включая клетки кишечника и нейроны5. В этом контексте разработка более воспроизводимых исследовательских моделей in vitro снижает потребность в использовании животных моделей и улучшает воспроизводимость.
neuroHuMiX — это усовершенствованная версия предыдущей модели HuMiX9. HuMiX — это модель «кишечник-на-чипе», позволяющая создавать проксимальные и репрезентативные кокультуры эпителиальных и бактериальных клеток. Межклеточная коммуникация возможна через проксимальную кокультуру и диффузию секретируемых факторов и метаболитов через полупроницаемые мембраны. Однако для расширения полезности исходного прибора для изучения среды кишечника человека требуется введение дополнительного типа клеток. Для решения этой проблемы neuroHuMiX, разработанный с введением ЭН, полученных из ИПСК, позволяет проводить проксимальную кокультуру бактерий, эпителиальных клеток кишечника и ЭН. Полученная модель in vitro позволяет ответить на вопросы, касающиеся микробиома кишечника человека в связи с нервной системой человека. Совместное культивирование различных типов клеток, особенно кокультур клеток и бактерий млекопитающих, сопряжено с рядом проблем, включая потерю жизнеспособности, плохую адгезию и общую потерю слияния16. Здесь мы продемонстрировали, что в рамках этого устройства мы можем совместно культивировать три различных типа клеток в рамках одной системы, сохраняя при этом высокую жизнеспособность клеток.
Критически важным этапом в протоколе является обеспечение слияния нейрональных клеток - 80%-90% слияния клеток и жизнеспособности - перед инокуляцией в устройство. Поскольку невозможно оценить рост клеток во время прогона, крайне важно убедиться, что клетки сливаются и хорошо растут, прежде чем вводить их в модель. Хотя это может быть ограничивающим фактором, общая жизнеспособность и слияние, наблюдаемые в устройстве, как правило, высоки.
Устройство подключается через трубопроводы к перистальтическому насосу. Каждая камера ячейки имеет свою специфическую линию трубок. Трубка включает в себя трубку насоса, которая позволяет использовать перистальтический насос для перфузии среды, а также трубку, соединяющую трубку насоса с устройством, и трубку, соединяющую устройство с бутылками для слива/отходов. Отверстия для отбора проб предусмотрены до и после устройства, что позволяет производить инокуляцию и отбор проб исходящей среды. Каждая камера может быть подключена к отдельной среде, что обеспечивает наилучшие условия культивирования для каждого отдельного типа клеток. Каждая камера может быть открыта или закрыта в зависимости от конкретных потребностей в подаче среды. В приборе нейронная камера остается закрытой на протяжении большей части эксперимента, в то время как бактериальная и эпителиальная камеры открыты все время, что означает, что они получают свежую среду на протяжении всего эксперимента. Чтобы убедиться, что среда течет без перебоев, очень важно, чтобы в трубках, соединителях или в устройстве не оставалось воздуха. Поэтому важно сначала дать устройствам поработать в течение нескольких минут на этапе заливки. Это часто решает проблему. В противном случае одну из других трубопроводов, которые опускаются, можно закрыть на короткое время, закрыв трехходовой запорный кран слива. Это перенаправляет среду на линию с пузырьком воздуха, тем самым решая проблему, выталкивая пузырь наружу через трубку.
Для любого эксперимента с клеточной культурой среда является ключевым компонентом, где для каждого типа клеток существует своя среда. При совместном культивировании среда должна быть совместима не только с растущим в ней типом клеток, но и с другими типами клеток в кокультуре. То же самое относится и к устройству, которое представляет собой дополнительную проблему, поскольку у нас есть три разных отсека с тремя различными типами клеток внутри: бактериальными, эпителиальными и нейрональными. Тем не менее, мы показали, что путем модификации бактериальной среды с добавлением 5% MRS к RPMI 1640 с 10% FBS все типы клеток, в частности бактериальные и эпителиальные клетки, могут быть успешно культивированы в системе. Тем не менее, в устройстве различные типы клеток культивируются в непосредственной близости и, следовательно, не находятся в прямом контакте друг с другом. Несмотря на то, что это не является полностью репрезентативным для прямого контакта между клетками кишечника человека и, следовательно, ограничением, проксимальное и репрезентативное состояние кокультуры является сильной стороной для последующих анализов. Обмен растворимыми факторами между различными камерами и типами клеток; Следовательно, клетки все еще взаимодействуют друг с другом. Кроме того, тот факт, что типы клеток могут быть собраны и проанализированы по отдельности, позволяет нам изучать влияние здорового и/или больного микробиома на различные типы клеток (включая нейрональные клетки) и, таким образом, определять/извлекать данные, специфичные для типа клеток. Еще одно ограничение заключается в том, что морфология клеток не может быть отслежена во время эксперимента, так как устройство можно открыть и проверить клетки только в конце каждого эксперимента.
Насколько нам известно, neuroHuMiX является первой моделью «кишечник-на-чипе», включающей ЭН. Это шаг к выяснению связи между микробиотой кишечника и энтеральной нервной системой. Это модель, позволяющая исследовать взаимодействие между видом бактерий, эпителиальным слоем и ЭН. Его конструкция позволяет изучать обмен растворимыми факторами, секретируемыми различными типами клеток, и их влияние друг на друга. В будущем было бы важно иметь внутри устройства не только ЭН, полученные из ИПСК, но и эпителиальные клетки, полученные из ИПСК, чтобы превратить устройство в персонализированную модель. Важно отметить, что эта персонализированная модель может быть использована для тестирования пре-, про- и синбиотиков 10,11 и потенциально для разработки персонализированных скрининговых и терапевтических подходов17. Персонализированный neuroHuMiX может в конечном итоге пролить свет на «темную материю» микробиома кишечника человека и его взаимодействие с нервной системой вдоль оси микробиом кишечника-нервная система, прокладывая путь для терапевтической оценки и вмешательства.
Мы можем заключить, что возможность иметь кишечник-на-чипе, включая энтеральную нейронную систему, имеет решающее значение для прогресса в изучении и понимании взаимодействий вдоль оси микробиом кишечника-нервной системы. NeuroHuMiX позволяет нам изучать влияние видов бактерий на клетки хозяина и дает нам хорошую основу для дальнейшего улучшения модели еще более физиологически репрезентативным способом.
Раскрытие информации
P.W. заявляет о том, что он указан в качестве изобретателя в патентах PCT/EP2013/056607, PCT/EP2016/062024, PCT/US2017/061602 и PCT/EP2019/081424. .В., К.С. и Л.Г. заявляют, что они указаны в качестве изобретателей в патентных LU503075.
Благодарности
Авторы хотели бы поблагодарить доктора Джареда Стернекерта за предоставленные нам клетки линии K7. Мы также хотим поблагодарить наших давних коллег д-ра Фредерика Зенхаузерна и Мэтью В. Баррета из Университета Аризоны за их помощь в инженерных аспектах. Мы также хотели бы поблагодарить доктора Валентину Галату за помощь в разработке схематического изображения neuroHuMiX. Этот проект получил финансирование от Европейского исследовательского совета (ERC) в рамках программы исследований и инноваций Европейского союза «Горизонт 2020» (грантовое соглашение 863664). Рисунок 1 был частично создан с помощью Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
Ссылки
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены