Method Article
用于研究肠道微生物组-神经系统轴的肠道芯片模型
摘要
neuroHuMiX是一种先进的肠道芯片模型,用于研究细菌、上皮细胞和神经元细胞在近端和代表性共培养条件下的相互作用。该模型可以揭示肠道微生物组和神经系统之间通信的分子机制。
摘要
人体被至少与人体细胞组成数量相同数量的微生物细胞定植,并且这些微生物中的大多数位于肠道中。尽管肠道微生物组和宿主之间的相互作用已被广泛研究,但肠道微生物组如何与肠道神经系统相互作用在很大程度上仍然未知。迄今为止,尚不存在用于研究肠道微生物组-神经系统相互作用的具有生理学代表性的 体 外模型。
为了填补这一空白,我们通过将诱导多能干细胞衍生的肠道神经元引入设备中,进一步开发了人微生物串扰 (HuMiX) 肠道芯片模型。由此产生的模型"neuroHuMiX"允许细菌、上皮和神经元细胞跨微流控通道共培养,由半透膜隔开。尽管分离了不同的细胞类型,但细胞可以通过可溶性因子相互交流,同时提供了单独研究每种细胞类型的机会。这种设置可以初步了解肠道微生物组如何影响肠道神经元细胞。这是研究和理解人类肠道微生物组-神经系统轴的关键第一步。
引言
人类肠道微生物组在人类健康和疾病中起着至关重要的作用。在过去的十五年里,它已被广泛研究,现已确定其在调节健康和疾病方面的潜在作用1.据推测,导致微生物群落失衡(生态失调)的微生物组破坏与许多慢性疾病的发病机制有关,例如肥胖、炎症性肠病和结直肠癌,甚至神经退行性疾病,例如帕金森病 2,3。
尽管人类肠道微生物组与神经系统疾病有关,但目前尚不清楚肠道微生物组如何与肠道神经系统沟通并影响肠道神经系统。由于人类肠道神经系统不容易立即进行研究,因此迄今为止已将动物模型用于实验4。然而,鉴于动物模型和人类之间的明显差异5,开发模拟人类肠道的体外模型是立即感兴趣的。在此背景下,人类诱导多能干细胞 (iPSC) 领域的蓬勃发展使我们能够获得具有代表性的肠神经元 (ENs)6。iPSC 衍生的 EN 允许在体外培养模型中研究肠神经系统,例如细胞培养插入物、类器官或器官芯片 7,8。
人类-微生物串扰 (HuMiX) 模型是一种模拟人类肠道9 的肠道芯片模型。初始HuMiX模型(以下称为初始装置)容纳上皮细胞(Caco-2)和细菌细胞10,11。然而,为了研究肠道微生物组-神经系统的联系,iPSC衍生的ENs6也被引入到系统中(图1)。神经元、上皮细胞和细菌细胞的近端共培养允许单独分析不同的细胞类型,并研究模拟人类肠道环境中不同细胞类型之间的相互作用。
近年来,通过使用器官芯片(例如,肠道芯片)模型,以更具生理学代表性的方式研究器官的模型开发取得了进展。这些模型更能代表人类肠道环境,因为持续的营养供应和废物清除,以及实时监测,例如氧气水平或屏障完整性8,12。这些模型专门用于研究肠道细菌对宿主细胞的影响。然而,为了能够使用器官芯片来研究肠道微生物组和神经系统之间的相互关系,需要将神经元细胞整合到这些系统中。因此,进一步开发HuMiX和建立neuroHuMiX系统(以下简称设备)的目的是开发一种肠道芯片模型,该模型包括肠道神经元细胞与肠道上皮细胞和细菌近端共培养。
研究方案
1. 细胞培养和分选
- 诱导多能干细胞来源的肠神经元
注意:在运行开始前 6 周培养 iPSC。EN 的分化方案改编自 Fattahi 等人 6。- 在补充有 1% 青霉素 - 链霉素 (P/S) 的 2 mL/孔 iPSC 培养基中培养基质凝胶包被的 6 孔板上的 iPSC。
- 在80%-90%汇合度下,传代细胞,使用相同的培养基在基质凝胶包被的板中接种,在37°C,5%CO2和90%相对湿度(RH)下孵育。
- 对于 iPSC 衍生,在解冻后两次传代后,以 80%-90% 的汇合度,以 100,000 个细胞/孔的密度将细胞接种在基质凝胶包被的 6 孔板中。在上述培养基+ROCK抑制剂Y-27632(1:2,000)中在37°C孵育24小时。
- 24小时后,根据 表1,用第0天培养基替换上清液培养基。包括一个对照孔,在衍生过程的细胞分选过程中用作阴性对照。在整个衍生期内,将对照保持在第0天培养基组成中。根据 表1,每隔一天从第2天到第10天更换培养基。
- 在第 11 天,对细胞进行 CD49d 阳性细胞的分选,这些细胞将用于本协议的以下步骤。
- 根据 CD49d 阳性细胞以及对照孔合并要分选的细胞。将细胞以300× g离心3分钟。将细胞沉淀重悬于2%牛血清白蛋白(BSA)+ 1%P / S的1x磷酸盐缓冲盐水(PBS)中。
- 将每个细胞批次(合并和对照)一分为二:用抗人CD49d抗体染色一个组分,用同型对照抗体染色另一个组分。
- 门控主要细胞群,然后门控单个细胞,在此基础上选择在其表面呈递 CD49d 的细胞。收集这些细胞用于下一步分化。
注意:通常,30%-40%的分选细胞是CD49d阳性。
- 将 2 至 400 万个分选细胞转移到 N2B27 培养基(见 表 2)+ FGF2 + CHIR 中的超低附着板的一个 6 孔板中 4 天,以形成球状体。
- 第 15 天,在含有 GDNF 和抗坏血酸 (AA) 的 2 mL/孔 N2B27 培养基中,将球状体重新铺在聚 L-鸟氨酸/层粘连蛋白/纤连蛋白 (P/L/F) 包被的 6 孔板上。每 2-3 天更换一次培养基。
注:包衣比例:聚L-鸟氨酸,15μg/mL;层粘连蛋白,2 μg/mL;纤连蛋白,2μg/mL,溶于1x PBS中。 - 3周后,将细胞用于在设备中接种。
- 可-2
注意:在运行前至少 1 周解冻 Caco-2 细胞。- 将装有 1 × 106 个 Caco-2 细胞的 T75 烧瓶接种在 RPMI 1640 谷氨酰胺补充剂 + HEPES + 10% 胎牛血清 (FBS) 中;在37°C,5%CO2和90%RH下孵育。
注意:对于这些实验,理想情况下,在解冻后的第一次或第二次通过时使用Caco-2。
- 将装有 1 × 106 个 Caco-2 细胞的 T75 烧瓶接种在 RPMI 1640 谷氨酰胺补充剂 + HEPES + 10% 胎牛血清 (FBS) 中;在37°C,5%CO2和90%RH下孵育。
2. HuMiX运行准备
- 聚碳酸酯盖的制备和涂层
- 使用初始设备仪器循环将一对聚碳酸酯(PC)盖(图2)与四个螺钉一起高压灭菌(有关详细信息,请参见 表3 )。
- 在生物安全柜中,在底部PC盖的每个角插入四个螺钉(见 图3),然后转移到无菌方形培养皿中进行两步包被过程。
- 第一天,在 PC 盖的中间加入 2 mL 的 1.5% 聚 L-鸟氨酸 PBS (1x) 溶液。在37°C,5%CO2和90%RH下孵育过夜。
- 第二天,除去溶液,用含有0.2%层粘连蛋白和0.2%纤连蛋白的PBS(1x)溶液代替,以覆盖神经元细胞腔的表面。将盖子在37°C,5%CO2和90%RH下孵育过夜。
- 孵育后,将涂层溶液保持在PC盖上,并用密封膜关闭培养皿。将它们置于4°C储存直至使用。
- 使用前,除去涂层溶液,并在生物安全柜中风干30分钟,直到涂层完全干燥。
- 垫片制备和涂层
注意: 本节介绍如何通过将半透膜粘在硅胶垫圈上来制备垫圈。在最初的高压灭菌步骤后,垫圈涂有胶原蛋白或粘蛋白,以使肠上皮细胞或细菌粘附。粘蛋白包被的膜模仿人体肠道中存在的粘液屏障。- 将孔径为 1 μm 的聚碳酸酯膜连接到胶原垫圈上,并在底部和顶部夹层垫圈之间连接孔径为 50 nm 的聚碳酸酯膜。使用初始设备仪器循环对带有附着膜的垫圈进行高压灭菌(见 表3)。
- 要涂覆膜,请将每个垫圈放入无菌方形培养皿中。
注意:涂层是在无菌条件下在生物安全柜中完成的。- 对于胶原垫片,向膜中加入3mL胶原蛋白(50μg/ mL),并在37°C下孵育3小时。
注意: 添加胶原蛋白时注意不要用移液器吸头接触膜,以免损坏膜。 - 对于粘蛋白包被,将顶部垫圈朝上的夹层垫圈放入培养皿中,用 3 mL 粘蛋白 (0.025 mg/mL) 涂覆膜的顶部。将垫圈在37°C孵育1小时。
- 对于胶原垫片,向膜中加入3mL胶原蛋白(50μg/ mL),并在37°C下孵育3小时。
- 孵育时间过后,从各自的垫圈中吸出胶原蛋白和粘蛋白溶液,并在生物安全柜中风干膜30分钟。关闭培养皿,用实验室密封膜密封,并将垫圈存放在4°C直至使用。
- 管路总成
注意: 本节介绍如何组装用于设备灌注的管道。在组装之前,对所有部件进行高压灭菌和/或购买单独包装在无菌包装中的部件。将所有组件放入生物安全柜中。- 每个设备和每条管线使用三条管线,一条泵管线,两根长 Marprene 管 (20 cm),两根短 Marprene 管 (8 cm),一根 40 mm 针头用于流出瓶,一根 120 mm 针头用于 250 mL 流入瓶,或 80 mm 针头用于较小的流入瓶, 3 个公头和 7 个母头鲁尔到倒钩连接器、三个鲁尔适配器和两个三通旋塞阀。
- 使用上面列出的高压灭菌和灭菌组件从左到右组装管道(图 4)。
注意: 在每个连接步骤之间用 70% 乙醇喷洒每个组件。
- 培养基制备
注:本节介绍如何为设备中的不同细胞类型制备培养基,以及如何以无菌方式将培养基转移到血清瓶中。- 用 10% 0.22 μm 过滤、热灭活的 FBS 补充 RPMI 1640。用 GDNF 和 AA 新鲜补充 N2B27 培养基。
- 在无菌条件下将培养基转移到血清瓶中。将 200 mL RPMI 1640 培养基转移到 250 mL 瓶中,将 30 mL N2B27 培养基转移到 50 mL 瓶中。
- 在后期制备细菌培养基(RPMI 1640 + 10%FBS + 5%De Man,Rogosa和Shapre培养基[MRS]),因为这仅在实验的最后24小时内需要。
- 用隔膜盖住瓶子,用铝压紧瓶子,然后高压灭菌。
- 要转移介质,请使用适当的开盖器(直径 = 20 毫米)取下铝压接。也要取出隔膜。小心地将准备好的培养基倒入血清瓶中,不要接触瓶子。
- 要消毒,请使用便携式本生炉点燃瓶子的开口。通过用 70% 乙醇喷洒隔膜,将其添加到瓶子中,然后使用密封压接器用铝压接器将其密封。
- 将封闭的瓶子置于37°C,5%CO2 的培养箱中24小时,以将培养基加热至37°C,并确保在将培养基瓶用于设备之前没有明显的污染迹象。
3. HuMiX启动
- NeuroHuMiX 组件
注意: 本节说明如何组装设备。简而言之,对夹紧系统进行消毒并重新拧紧,然后将底部PC盖放在夹具的底座上。然后,将涂层垫圈和顶部 PC 盖相互堆叠,然后是夹具的顶部。最后,拧紧夹具以压缩垫圈,使系统无泄漏和气密。 图 4 描述了装配所需的不同零件。- 组装前高压灭菌夹具和两个 PC 盖(顶部和底部)。
- 拧紧用于组装夹具顶部和底部的螺钉(图 4C、D)。在高压灭菌过程之前打开螺钉,稍后重新拧紧。
- 握住PC盖角的四个螺钉,将涂有和干燥的(步骤2.2.3)底部PC盖(图4 A1)从方形培养皿转移到夹具底座的顶部。
注意: 避免触摸 PC 盖以降低污染风险。 - 使用无菌镊子将上皮室垫圈朝上(即膜 在顶部)放在PC盖上。使用螺钉对齐垫圈和 PC 盖,以确保盖子角落的入口和出口与垫圈中的开口对齐(图 3)。
- 使用无菌镊子,将三明治垫圈放在胶原蛋白垫圈的顶部,顶部朝上。
- 将顶部 PC 盖放在三明治垫圈的顶部。为降低污染风险,请仅触摸盖子的边缘(不要触摸盖子的顶部或底部)。确保夹盖上的倒钩与膜组件上的入口和出口开口对齐,并且底部 PC 盖上的螺钉适合顶部 PC 盖的开口。
- 要关闭设备,请放置 clamp 盖(夹子的顶部)放在 PC 盖的顶部。确保盖子的开口与顶部 PC 盖的入口和出口倒钩重合。关闭闩锁。将封闭装置(图 5)保持在引擎盖下,以连接到灌注的管路(步骤 3.2.6)。
- 油管管线的灌注
注意: 本节介绍如何将管道连接到进瓶和流出瓶以及泵,随后用介质灌注管道以去除清洁和灭菌过程中使用的任何残留产品,并确保管道中不存在气泡。- 管道的灌注在生物安全柜中进行。将带有过滤器的曝气针插入每个流入和流出瓶的隔膜中。使用干净的无菌镊子,将 120 毫米针头插入 250 mL 血清瓶中。将 80 mm 针头插入 50 mL 血清瓶中。
- 将每根管线末端的 40 毫米针头插入流出的血清瓶中。每个设备有两个用于三条管路的流出瓶。上皮管和神经元管线的 40 mm 针头连接到同一个流出瓶以进行培养基丢弃。细菌管线进入第二个流出瓶。
- 将泵管管插入泵盒。确保油管管路的三通旋塞阀全部打开。
- 开始时,将蠕动泵设置为以 5 rpm 的速度将介质从流入瓶引导到流出瓶(见 表 4)。
注意: 在油管管线灌注期间,速度可以提高到 10 rpm 以加速该过程。 - 按下启动按钮 启动 泵,并确保泵送动作的方向是顺时针方向。一旦介质落入流出瓶中,请确保没有泄漏,并且管道管路和连接点中没有气泡。通过敲击管道和连接器或提高泵速来去除任何残留的气泡。
- 当所有管线都落入流出瓶中时,将流速设置为 2 rpm 以连接初始设备。
- 设备灌注
注意:本节介绍如何用细胞培养基灌注设备,以确保所有腔室都填充并预涂有培养基,以便在系统中不会留下气泡,并且细胞在接种过程中可以轻松粘附。- 设备的灌注在无菌条件下在生物安全柜中进行。要连接设备,首先连接神经元线,即设备的底部腔室。
- 要连接管路,请关闭三通旋塞阀(图 5C),首先从流出侧开始,将短管与母鲁尔连接器断开,并通过将管子推到倒钩上连接到设备的出口。为确保正确连接并减少泄漏和/或污染的机会,请将管道一直向下推到连接器上方,确保管道与盖子接触。以相同的方式连接流入管。一旦一条管线完全连接到设备(流入和流出),打开三通旋塞阀。
- 用上皮线重复上一步,然后用细菌线重复。将泵保持在 2 rpm 的流速。将泵速提高到 2.5 rpm,但不要更高,以避免因压力积聚而导致泄漏。让泵灌注设备中的腔室。
- 随时监测流出的血清瓶。如果气泡卡在腔室、管路或连接器中,则内部带有气泡的管路将不再掉落在流出室中。要去除气泡,首先让设备运行几分钟。如果这不能解决问题,请通过关闭流出的三通旋塞阀来关闭在短时间内下降的其他管线之一。
- 一旦设备的所有腔室都完全灌注 - 所有腔室都充满细胞培养基并且设备中没有气泡残留 - 将泵速降低到 0.5 rpm。该设备现在已准备好进行细胞接种。
4. 细胞制备和接种
注意:本节介绍如何制备接种设备所需的不同细胞类型,以及如何以无菌方式将它们接种在设备中,并且不引入气泡。此外,它还描述了如何对神经元细胞进行培养基刷新,以及如何为设备中的细菌培养物制备培养基。
- 上皮细胞
- 使用胰蛋白酶 - 乙二胺四乙酸(EDTA)从烧瓶中分离Caco-2细胞,重悬于RPMI 1640 + 10%FBS中,并使用台盼蓝排除测定法在Neubauer细胞计数器中计数。离心Caco-2细胞悬浮液(3分钟,300× g),弃去上清液以除去剩余的胰蛋白酶-EDTA。将 Caco-2 细胞重悬于 RMPI 1640 + 10% FBS 中,以获得 350,000 个细胞/mL 的悬浮液。对于每个设备,需要 1.5 mL 的体积。
- 将 1.5 mL Caco-2 细胞悬液转移到无菌 2 mL 注射器中,并去除残留在注射器中的任何空气或气泡。
- 关闭细菌室和神经元室管的三通旋塞阀。通过从转子上取下带有相应管子的盒式磁带,将细菌室和神经元室的管子与泵断开。
- 打开通向上皮室的流入管的三通旋塞阀的盖子,转动三通旋塞阀,将介质流从设备重定向到"开放式连接器"(图5C)。让介质流动,直到三通旋塞阀的开口端出现一滴介质。
- 使用滴滴式连接方法将含有上皮细胞的注射器插入"开放式连接器"中,以允许将注射器插入连接器中而不会引入气泡。转动三通旋塞阀的阀门,以阻止介质从流入瓶(通过 泵)流动,并允许从连接的注射器流向初始设备。断开上皮通道与泵的连接。
- 缓慢按压注射器,用细胞悬液接种上皮室。确保每 3 秒大约有一滴滴入流出瓶中。
- 加入 1.5 mL 细胞悬液,然后关闭流出三通旋塞阀的阀门。断开注射器并用盖子关闭三通旋塞阀的开口端。保持腔室关闭至少2小时。同时,接种神经元细胞。
- 神经元细胞
- 通过使用移液管将培养基中的细胞从相应的孔中重悬,将神经元细胞从孔中分离出来。用来自6孔板的一个孔(9.6cm2)的完全汇合的细胞接种每个装置。
- 将细胞沉淀重悬于相应的 N2B27 培养基体积(每个装置 1.5 mL 培养基)+ 1 μL 纤连蛋白/mL 细胞悬液中。将 1.5 mL 重悬的细胞悬液转移到 2 mL 注射器中,并去除残留在注射器中的任何气泡。将填充的注射器放入无菌的 50 mL 锥形管中,然后转移到装有灌注的 HuMiX 装置的生物安全柜中。
- 遵循与前面描述的上皮室接种相同的接种过程,除了管线的变化。在这里,断开细菌和上皮管管与泵的连接。
- 神经元细胞接种后,关闭管路的所有三通旋塞阀并断开与泵的连接。将设备置于37°C和5%CO2的培养箱中。保持所有通道关闭2小时,以使细胞附着。
- 2小时后,将细菌和上皮通道连接到泵,并打开两条管路的流入和流出三通旋塞阀。在初始设备运行的 14 天内保持神经元室关闭,培养基更换期间除外。
- 在 14 天的运行中,每 3-4 天更换一次神经元室的介质。对于培养基刷新,每个设备准备 3 mL 新鲜的 N2B27 培养基,并转移到无菌的 20 mL 血清瓶中。使用无菌隔膜和铝压接密封件用培养基关闭血清瓶。
- 将曝气器和 80 毫米针头插入新瓶的隔膜中。在培养箱中用新培养基瓶更换旧培养基瓶,方法是将公鲁尔从旧瓶的针头连接到新瓶的针头。
- 将带有神经元室的泵管的盒式磁带连接到泵并打开三通旋塞阀。让介质以0.5rpm流动2小时,然后关闭神经元管的三通旋塞阀并与泵断开连接,直到下一次介质交换。
5.细菌培养和接种
注:在这项研究中,在第 12 天,从甘油原液中复活罗伊 氏利莫西乳杆菌菌 株 F275 的液体培养物。根据需求或研究设计,可以使用其他细菌种类。
- 准备三管 5 mL MRS 肉汤 - 一个无菌对照管和两个用于 罗伊氏乳杆菌 接种。使用接种环,刮掉甘油原液的顶部并将其转移到一个管中。用第二个接种管重复。将试管在37°C,170rpm孵育过夜。
注意:不要让甘油原液解冻。 - 通过将罗斯威尔公园纪念研究所(RPMI)1640 + 10%FBS与5%MRS肉汤混合,为初始设备准备新鲜培养基。每个装置准备 25 mL,并在无菌条件下转移到 100 mL 血清瓶中。用无菌隔膜和铝压接器盖住瓶子。将瓶子置于37°C,5%CO2 的培养箱中过夜。
- 在将瓶子连接到细菌管线之前,向每瓶 RPMI 1640/MRS 培养基中添加曝气针和 80 毫米针。
- 准备新试管,每支试管含有 3 mL RPMI 1640 + 10% FBS + 5% MRS 肉汤。至少准备两根试管,每个设备一个对照试管和一个试管。在两个新制备的试管中接种 15 μL 罗伊氏乳杆 菌过夜培养物(光密度 [OD] > 2)。
- 将试管在37°C,170rpm下孵育1小时,之后OD达到0.05-0.10,相当于~1×107 个菌落形成单位(CFU)/ mL。将 1.5 mL 转移到 2 mL 注射器中(每个设备一个)。将剩余的细菌悬浮液用于CFU铺板和活/死染色。
- 对于装置的细菌接种,遵循与步骤4.1中提到的相同的程序,只是这里的神经元和上皮管线是闭合的。
- 接种后,关闭阀门并与泵断开连接30分钟,也关闭细菌管路。连接上皮管和细菌管线并再次打开。让设备在37°C和0.5rpm下再运行24小时。
6. HuMiX的开放和采样
注:以下部分描述了不同细胞类型的采样。例如,神经元细胞沉淀用于RNA提取和随后的定量聚合酶链反应(qPCR),细菌沉淀用于DNA提取和16S rRNA基因测序,上清液用于酶联免疫吸附测定(ELISA)和其他测定(例如乳酸测定)。
- 在第 14 天,即开放日,关闭所有三通旋塞阀,断开泵的管道,然后将培养箱的装置取出到实验室工作台上。
注意: 移动设备时,请确保保持实际设备水平。 - 在慢慢打开之前拆下连接到设备的管线amp 并取下 clamp 盖。小心地取下顶部PC盖,将培养基收集在1.5mL微量离心管中,然后将其置于冰上。
- 轻轻取下夹层垫圈,同时从上皮室收集培养基;注意不要接触细胞层。将三明治垫圈放入方形培养皿中,向细菌室中加入H2O中的无菌0.9%NaCl溶液,直至该室完全覆盖(约1mL)。
- 慢慢取出胶原垫圈,同时从神经元室收集培养基并将其转移到微量离心管中。将所有培养基管放在冰上。将胶原蛋白垫圈放入方形培养皿中,轻轻地向Caco-2层中加入几毫升1x PBS,直到细胞层完全覆盖。
- 将底部PC盖放入方形培养皿中,并在神经元细胞顶部轻轻加入约2mL 1x PBS,因此它们在采样过程中不会变干。
- 将细菌培养基管在4°C下以5,000× g 离心5分钟。 将上皮和神经元培养基管在4°C下以300× g 离心5分钟。 离心后,将每个试管的上清液转移到新的微量离心管中,并立即将其置于干冰上。
- 上皮细胞
- 轻轻地从垫圈中取出 PBS,并收集在 15 mL 锥形管中。向细胞中加入2mL胰蛋白酶,并将垫圈在37°C,5%CO2下孵育5分钟。孵育后向垫圈中加入 2 mL RPMI 1640,重悬细胞,并收集在另一个 15 mL 锥形管中。
- 将两个管以300× g离心5分钟。弃去上清液。将沉淀重悬于PBS中,在300μL的PBS中洗涤,将细胞沉淀重悬于1mL PBS中。
- 将每个试管的 50 μL 转移到 0.5 mL 微量离心管中,用于自动细胞计数仪和台盼蓝排除测定细胞计数。将重悬的细胞沉淀 (1 mL) 转移到 1.5 mL 管中,并以 300 × g 离心 5 分钟。
- 除去上清液,将细胞沉淀重悬于250μL裂解缓冲液+ 1%β-巯基乙醇中,并将试管置于干冰上。
- 神经元细胞
- 将带有底部透明PC盖的方形培养皿与上一步(6.5)中的神经元细胞一起放入倒置相差显微镜中。
注意:在移动带有 PBS 的 PC 盖时,要非常轻柔,因为神经元网络很容易分离。 - 通过使用明场显微镜观察神经元细胞的形态和细胞密度,在接种前进行最后一次质量检查。验证细胞是否已从球状体迁移,并且已形成神经元网络。神经元网络应约为 90% 汇合。有关详细信息,请参阅 Fattahi 等人 6。
- 在工作台上,将细胞重悬于PBS中并收集在1.5mL管中。将试管以300× g 离心3分钟。弃去上清液,将细胞沉淀重悬于 250 μL 裂解缓冲液 + 1% β-巯基乙醇中,并置于干冰上。
注:免疫荧光(IF)染色可以在PC盖上的神经元细胞上进行。如果IF染色是首选的测定方法,为了不破坏神经元网络,则应用4%多聚甲醛(PFA)将细胞固定在PC盖上,这阻碍了PC盖在未来实验中的重复使用。
- 将带有底部透明PC盖的方形培养皿与上一步(6.5)中的神经元细胞一起放入倒置相差显微镜中。
- 细菌细胞
- 将附着在膜上的细菌细胞重悬于0.9%NaCl溶液中。如果细胞牢固附着,则轻轻地使用细胞刮刀将细菌细胞从膜上分离出来。
注意:使用刮刀会损坏细胞,增加看到更多死细胞的可能性。 - 将细胞悬液收集在 15 mL 锥形管中。将先前收集的培养基中剩余的沉淀加入 15 mL 锥形管中。在4°C下以5,000× g 离心5分钟。 弃去上清液,将细胞沉淀重悬于1mL 0.9%NaCl溶液中。
- 将该体积分成三部分:一部分用于冷冻用于核酸提取的细菌沉淀(650μL),一部分用于MRS板上的CFU铺板(50μL),一部分用于活/死染色(300μL)。为了制备用于核酸提取的沉淀,将细胞悬浮液转移到微量离心管中,在4°C下以5,000× g 离心5分钟并弃去上清液。将细胞沉淀放在干冰上。
- 在取样结束时,将干冰上的所有试管转移到-80°C冰箱中储存,以备以后进行下游分析。
注:上清液可进一步用于气相色谱-质谱(GC-MS)分析。此外,在打开过程中,胶原包被的膜可以分成不同的部分进行不同的分析——一半用于IF闭塞素染色,另一部分用于RNA提取以进一步进行基因表达分析,另一部分用于细胞计数。
- 将附着在膜上的细菌细胞重悬于0.9%NaCl溶液中。如果细胞牢固附着,则轻轻地使用细胞刮刀将细菌细胞从膜上分离出来。
结果
在neuroHuMiX中,我们将三种不同的细胞类型——细菌细胞、上皮细胞和神经元细胞共培养在一起(图1)。为了确保细胞都是可行的,我们对不同的细胞类型进行了不同的检测。例如,我们对细菌细胞进行CFU计数,对上皮细胞进行细胞计数和细胞活力测定,同时 通过 显微镜分析评估神经元细胞。
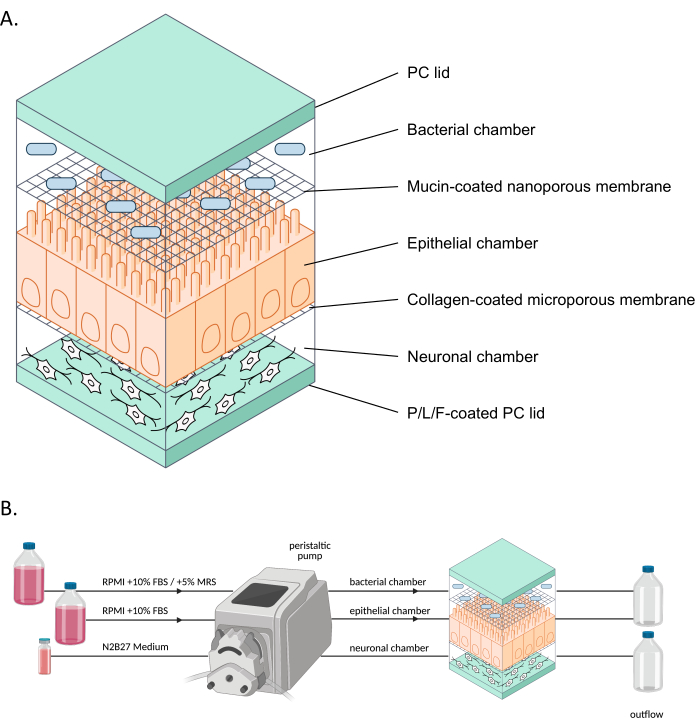
图 1:neuroHuMiX 及其实验装置的示意图 。 (A) 将三个腔室固定在两个 PC 盖之间以保持它们关闭。每个腔室都充满一种特定的培养基,用于内部生长的细胞。不同的腔室由半透膜隔开,允许细胞通过 通过 膜的可溶性因子进行通讯。(B) neuroHuMiX设置的表示。每个腔室都连接到不同的培养基瓶。对于细菌室,在前 12.5 天,室连接到 RPMI + 10% FBS,然后在最后 36 小时内更改为 RPMI + 10% FBS + 5% MRS。 缩写:PC = 聚碳酸酯;P/L/F = 聚 L-鸟氨酸/层粘连蛋白/纤连蛋白;RPMI = 罗斯威尔公园纪念研究所细胞培养基;MRS = De Man、Rogosa 和 Shapre 培养基。 请点击这里查看此图的较大版本.
为了确定细胞是否正确附着,在打开装置时,我们评估了胶原蛋白包被膜上细胞层的形成(图6A)。为确保设备中的细胞是可行的,进行了自动细胞计数计数(图6B)和台盼蓝排除测定细胞计数(图6C)。这些检测是在来自三种不同HuMiX设置的Caco-2细胞上进行的:(i)用ENs培养的Caco-2,(ii)用 罗伊氏乳杆 菌培养的Caco-2,以及(iii)涉及所有三种细胞类型共培养的装置。使用单因素方差分析的统计测试在细胞类型之间没有产生任何显着差异,这表明Caco-2细胞在本研究中测试的所有这些初始设备设置和条件下仍然存活。这强调了一个事实,即 在罗伊氏乳杆菌 和两种人类细胞类型共培养过程中达到的细菌密度对人体细胞没有细胞毒性作用。
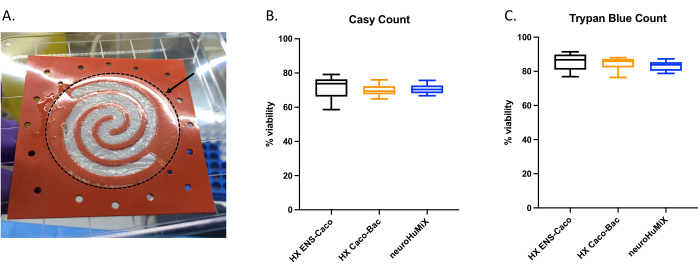
图 6:胶原包被膜上 Caco-2 细胞的评估。 (A) 打开后胶原包被膜上的 Caco-2 细胞层。箭头表示胶原蛋白包被的膜,周围有一个虚线圆圈。Caco-2细胞在膜上呈螺旋状生长。Caco-2 细胞在 HuMiX 中 14 天后的细胞活力。使用 (B) 自动细胞计数仪和 (C) 台盼蓝排除测定细胞计数获得细胞计数。Caco-2 细胞计数是通过初始装置中的不同培养装置测定的:与肠神经元 (EN)(黑色)、与罗伊氏乳杆菌共培养(橙色)和装置(EN 和罗伊氏乳杆菌)(蓝色)。进行了单因素方差分析,显示不同培养设置之间没有显著差异(单因素方差分析,p = 0.1234 [ns];误差线表示标准误差)。请点击这里查看此图的较大版本.
为了能够用哺乳动物细胞培养 罗伊氏乳杆菌 ,我们首先优化和调整了培养基以用于该设备。我们发现 RPMI 1640 中 5% 的 MRS 混合物(补充 10% FBS)最适合 罗伊氏乳杆 菌的生长,同时对这些测定中使用的哺乳动物细胞没有细胞毒性。随后,进行 CFU 计数以评估在装置中培养 24 小时时 罗伊氏乳杆菌 的生长情况。评估两种不同初始装置设置的 CFU 计数(图 7)-罗伊氏乳杆菌 与装置中的 Caco-2 和 罗伊氏乳杆 菌共培养。在两种设置中,CFU计数与HuMiX接种物和收获的细胞显着不同(单因素方差分析, p = 0.0002),表明初始装置内细菌细胞的生长。
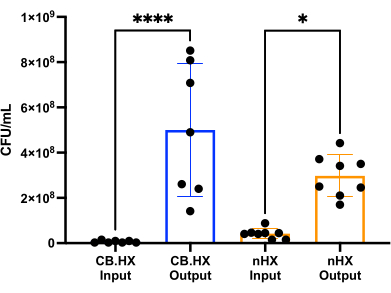
图7:接种物(1:100,000稀释)和HuMiX中24小时后的罗伊氏利莫西乳杆菌CFU计数。两种不同的设置:Caco-2 细胞与罗伊氏乳杆菌和装置共培养。单因素方差分析显示接种物和收获细胞之间存在显着差异(p = 0.0002 [***]),这意味着细菌在HuMiX内生长。误差线表示标准误差。缩写:CB。HX = Caco-2 细菌 HuMiX;nHX = 神经HuMiX。请点击这里查看此图的较大版本.
为了评估在设备内培养EN是否会改变细胞的表型,使用倒置相差显微镜观察EN的大体形态。在此步骤中,评估了汇合度和EN形态。汇合神经元网络的建立表明细胞已经很好地附着在涂层装置的PC盖上。重要的是,这突出了它们与Caco-2和 罗伊氏乳杆菌共同培养的概念。汇合的神经元网络和垫圈划定的螺旋之间的边缘很明显(图8)。
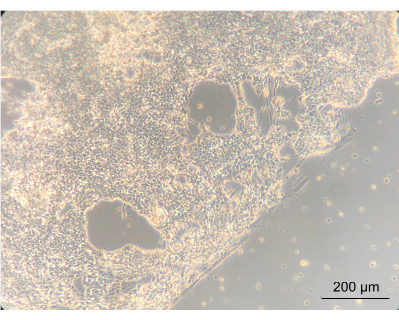
图 8:在设备中培养 14 天后的肠道神经元。 在图像的左侧,神经元已经生长到螺旋上的汇合层。在神经元层和没有细胞的空间之间的边缘是螺旋的边缘;放大 10 倍,比例尺 = 200 μm。 请点击这里查看此图的较大版本.

图 2:设备中使用的盖子。图像显示了顶部(左)和底部(右)PC 盖。 PC 盖的每一侧为 6.4 厘米。缩写:PC=聚碳酸酯。 请点击这里查看此图的较大版本.

图 3:底部 PC 盖上的上皮室垫圈。 放置在底部 PC 盖上的上皮室垫圈的顶视图(左)和底视图(右)显示上皮室垫圈与底部 PC 盖的入口和出口的对齐情况。垫圈的每一侧以及 PC 盖的尺寸为 6.4 厘米。缩写:PC=聚碳酸酯。 请点击这里查看此图的较大版本.

图 4:设备的组装。 (A)组装HuMiX的不同部件:(1)底部PC盖;(2)带有胶原包覆微孔膜的垫片,放置在(1)的顶部;(3)夹层垫片,中间有一粘蛋白包被的纳米多孔膜,放置在(2)的顶部;(4)顶部PC盖放在(3)的顶部。垫圈和 PC 盖的每一侧尺寸为 6.4 厘米。 (B) (A) 中的所有部件放在一起。(C,D)组装好的设备顶部(左)和侧面(右)视图。将 B 放入夹紧系统以关闭系统。(C) 顶部夹子的每一侧尺寸为 8 厘米。缩写:PC=聚碳酸酯。请点击这里查看此图的较大版本.
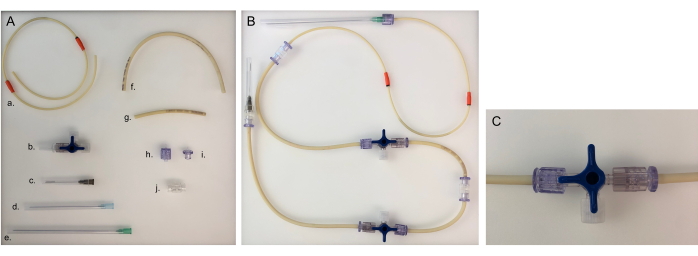
图 5:一个腔室的管路和组装管路所需的零件。 (一)搭建油管线的不同部分: a.泵油管管路;b. 三通旋塞阀;c. 40 毫米针;d. 80 毫米针;e. 120 毫米针;f. 长管线(20厘米);g. 短管线 (8 cm);h. 雄性鲁尔;i. 雌性鲁尔;J. 适配器。(B) 用于细菌室或上皮室的组装管线。对于神经元腔室,需要将 120 毫米的针头更换为 80 毫米的针头。(C) 转动三通旋塞阀,将介质流从设备重定向到"打开的连接器"并关闭腔室。请点击这里查看此图的较大版本.
| 日 | 0 | 2 | 4 | 6 | 8 | 10 |
| 媒体组成 | 100% E6 | 100% E6 | 75% E6 | 50% E6 | 25% E6 | 100% N2 |
| + 土地退化零增长 | + 土地退化零增长 | 25% N2 | 50% N2 | 75% N2 | + 土地退化零增长 | |
| + SB公司 | + SB公司 | + 土地退化零增长 | + 土地退化零增长 | + 土地退化零增长 | + SB公司 | |
| + CHIR | + SB公司 | + SB公司 | + SB公司 | + CHIR | ||
| + CHIR | + CHIR | + CHIR | + 类风湿性关节炎 | |||
| + 类风湿性关节炎 | + 类风湿性关节炎 | |||||
| 分子 | [浓度] | |||||
| 土地退化零增长 (LD | 100纳米 | |||||
| 某人 | 10微米 | |||||
| CHIR公司 | 3微米 | |||||
| 视黄酸 (RA) | 1微米 |
表 1:培养基成分。
| 媒体 | 成分(材料表中列出的浓度) | 体积 (mL) |
| N2 培养基 (50 mL) | DMEM-F12型 | 48 |
| N2 补充剂 | 0.5 | |
| L-谷氨酰胺 | 0.5 | |
| 青霉素/链霉素 | 0.5 | |
| 国家环境局 | 0.5 | |
| N2B27/ENS 培养基 (50 mL) | 神经基底 | 48 |
| N2 补充剂 | 0.5 | |
| L-谷氨酰胺 | 0.5 | |
| 青霉素/链霉素 | 0.5 | |
| B27-A型 | 0.5 |
表 2:培养基配方。
| 灭菌温度 (°C) | 116 |
| 灭菌时间(分钟) | 20 |
| 干燥时间(分钟) | 10 |
| 脉冲 | 3 |
| 结束温度 (°C) | 99 |
表3:HuMiX高压灭菌器运行。
| 每分钟转数 (rpm) | 平均流速 (μL/min) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
表 4:蠕动泵的流量。
讨论
现在已经确定,人类肠道微生物组会影响宿主的健康和疾病。尽管知识表明我们的微生物组很重要,特别是在阿尔茨海默氏症或帕金森氏病等神经系统疾病中 3,13,但肠道微生物组如何与肠道神经系统相互作用,随后与大脑相互作用,在很大程度上仍然未知。
迄今为止,还没有一个代表性的模型来研究肠道微生物组和神经系统之间的相互作用。传统上,有关肠脑轴的研究是使用小鼠模型进行的 13.小鼠和人类共享 85% 的基因组序列14,但在将小鼠与人类进行比较时需要考虑显着差异。关于肠道,需要注意的是,与人类相比,小鼠完全是食草动物。因此,他们的胃肠道在长度和特征上有所不同,例如"胃排空"14。小鼠的大脑也显示出重要的差异,因此小鼠和人类之间的整体结构是不同的15。重要的是,人类的神经祖细胞周期更长15。因此,开发包括人源性细胞(包括肠道和神经元细胞)的代表性模型非常重要5。在这种情况下, 通过体外 模型开发更具可重复性的研究减少了使用动物模型的需求并提高了可重复性。
neuroHuMiX是之前的HuMiX模型9的高级版本。HuMiX是一种肠道芯片模型,允许上皮细胞和细菌细胞的近端和代表性共培养。通过分泌因子和代谢物 通过半透 膜的近端共培养和扩散,可以实现细胞间通讯。然而,为了扩大初始设备研究人类肠道环境的效用,需要引入额外的细胞类型。为了解决这个问题,随着iPSC衍生EN的引入而开发的neuroHuMiX能够实现细菌、肠上皮细胞和EN的近端共培养。由此产生的 体外 模型使我们能够解决有关人类肠道微生物组与人类神经系统相关的问题。共培养不同的细胞类型,尤其是哺乳动物细胞和细菌的共培养,存在一些挑战,包括活力丧失、粘附性差和汇合度的整体损失 16。在这里,我们已经证明,在该设备中,我们能够在同一系统中共培养三种不同的细胞类型,同时保持高细胞活力。
该方案的一个关键步骤是在接种到设备之前确保神经元细胞的汇合度 - 80%-90%的细胞汇合度和活力。由于在运行过程中无法评估细胞生长,因此在将细胞引入模型之前,确保细胞汇合且生长良好至关重要。虽然这可能是一个限制因素,但在设备内观察到的整体活力和汇合度通常很高。
该装置 通过 管道连接到蠕动泵。每个细胞室都有其特定的管路。该管路包括允许使用蠕动泵灌注介质的泵管,以及将泵管连接到设备的管路和将装置连接到流出/废液瓶的管路。设备前后均有采样口,可对流出培养基进行接种和采样。每个腔室可以连接到不同的培养基,从而为每种细胞类型提供最佳培养条件。每个腔室都可以根据介质供应的具体需求打开或关闭。在该装置中,神经元腔室在实验的大部分时间里保持关闭状态,而细菌和上皮室始终处于打开状态,这意味着它们在整个实验运行过程中都会获得新鲜的培养基。为确保介质不间断地流动,管道、连接器或设备中不得有任何空气,这一点至关重要。因此,首先让设备在启动步骤中运行几分钟是很重要的。这通常可以解决问题。如果没有,可以通过关闭流出的三通旋塞阀在短时间内关闭其他一条正在下降的管线。这会将介质重定向到带有气泡的管路,从而通过将气泡向外推过管道来解决问题。
对于任何细胞培养实验,培养基都是关键成分,每种细胞类型都有其各自的培养基。在共培养装置中,培养基不仅需要与其中生长的细胞类型兼容,还需要与共培养中的其他细胞类型兼容。对于该设备来说,这没有什么不同,这带来了额外的挑战,因为我们有三个不同的隔室,里面有三种不同的细胞类型——细菌、上皮细胞和神经元细胞。然而,我们已经证明,通过修饰细菌培养基 - 将 5% MRS 添加到具有 10% FBS 的 RPMI 1640 中 - 所有细胞类型,特别是细菌和上皮细胞,都可以在系统内成功共培养。然而,在设备中,不同的细胞类型在附近共培养,因此彼此不直接接触。尽管这不能完全代表人体肠道中细胞之间的直接接触,因此存在局限性,但近端和代表性的共培养条件是下游分析的优势。可溶性因子在不同腔室和细胞类型之间交换;因此,细胞仍在相互作用。此外,细胞类型可以单独收获和分析,这一事实使我们能够研究健康和/或患病微生物组对不同细胞类型(包括神经元细胞)的影响,从而确定/检索细胞类型特异性读数。另一个限制是,在实验运行期间无法跟踪细胞的形态,因为只能在每次实验结束时打开设备并检查细胞。
据我们所知,neuroHuMiX是第一个包含EN的肠道芯片模型。这是阐明肠道微生物群和肠道神经系统之间交流的一步。该模型允许研究细菌种类、上皮层和EN之间的相互作用。它的设计使我们能够研究不同细胞类型分泌的可溶性因子的交换及其相互影响。展望未来,重要的是不仅要有iPSC衍生的EN,还要有iPSC衍生的上皮细胞在设备内部,以便将设备转变为个性化模型。重要的是,这种个性化模型可用于测试前生元、前生元和合生元 10,11,并可能开发个性化筛选和治疗方法17。个性化的neuroHuMiX最终可以揭示人类肠道微生物组的"暗物质"及其与肠道微生物组-神经系统轴线的神经系统的相互作用,为治疗评估和干预铺平道路。
我们可以得出结论,能够拥有包括肠道神经元系统在内的肠道芯片对于研究和理解肠道微生物组-神经系统轴的相互作用至关重要。NeuroHuMiX使我们能够研究细菌物种对宿主细胞的影响,并为我们提供了一个良好的基础,以更具生理学代表性的方式进一步改进模型。
披露声明
P.W.宣布被列为专利PCT/EP2013/056607、PCT/EP2016/062024、PCT/US2017/061602和PCT/EP2019/081424的发明人。P.W.、C.S. 和 L.G. 声明被列为专利LU503075的发明人。
致谢
作者要感谢 Jared Sterneckert 博士为我们提供了 K7 系的细胞。我们还要感谢长期合作者,来自亚利桑那大学的 Frederic Zenhausern 博士和 Matthew W. Barret 在工程方面的帮助。我们还要感谢 Valentina Galata 博士在设计 neuroHuMiX 示意图方面的帮助。该项目已根据欧盟地平线 2020 研究和创新计划(赠款协议 863664)获得了欧洲研究委员会 (ERC) 的资助。 图 1 部分是使用 Biorender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
参考文献
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。