Method Article
장내 마이크로바이옴-신경계 축을 연구하기 위한 gut-on-a-chip 모델
요약
neuroHuMiX는 근접 및 대표 공동 배양 조건에서 박테리아, 상피 및 신경 세포의 상호 작용을 연구하기 위한 고급 gut-on-a-chip 모델입니다. 이 모델을 통해 장내 마이크로바이옴과 신경계 사이의 통신의 기초가 되는 분자 메커니즘을 밝힐 수 있습니다.
초록
인체는 인간 세포로 구성된 미생물 세포와 적어도 동일한 수의 미생물 세포에 의해 군집화되어 있으며, 이러한 미생물의 대부분은 장에 있습니다. 장내 마이크로바이옴과 숙주 사이의 상호 작용은 광범위하게 연구되어 왔지만, 장내 마이크로바이옴이 장 신경계와 어떻게 상호 작용하는지는 아직 많이 알려져 있지 않습니다. 현재까지 장내 마이크로바이옴-신경계 상호작용을 연구하기 위한 생리학적으로 대표적인 체외 모델은 존재하지 않습니다.
이 간극을 메우기 위해 유도만능줄기세포 유래 장 뉴런을 장치에 도입하여 인간-미생물 누화(HuMiX) gut-on-chip 모델을 추가로 개발했습니다. 그 결과 'neuroHuMiX'라는 모델을 통해 반투과성 막으로 분리된 미세유체 채널을 통해 박테리아, 상피 및 신경 세포를 공동 배양할 수 있습니다. 서로 다른 세포 유형의 분리에도 불구하고 세포는 용해성 인자를 통해 서로 통신할 수 있으며 동시에 각 세포 유형을 개별적으로 연구할 수 있는 기회를 제공합니다. 이 설정을 통해 장내 마이크로바이옴이 장 신경 세포에 어떤 영향을 미치는지에 대한 첫 번째 통찰력을 얻을 수 있습니다. 이는 인간의 장내 마이크로바이옴-신경계 축을 연구하고 이해하는 데 있어 중요한 첫 번째 단계입니다.
서문
인간의 장내 마이크로바이옴은 인간의 건강과 질병에 중요한 역할을 합니다. 지난 10년 반 동안 광범위하게 연구되어 왔으며, 건강과 질병을 조절하는 잠재적인 역할이 이제 확립되었습니다1. 불균형한 미생물 군집(dysbiosis)으로 이어지는 마이크로바이옴의 교란은 비만, 염증성 장 질환, 대장암과 같은 많은 만성 질환 또는 파킨슨병과 같은 신경 퇴행성 질환의 발병에 관여하는 것으로 추정되었습니다 2,3.
인간의 장내 마이크로바이옴은 신경학적 상태와 관련이 있지만, 장내 마이크로바이옴이 장 신경계와 어떻게 소통하고 영향을 미치는지는 아직 명확하지 않습니다. 인간의 장 신경계는 즉각적인 연구가 쉽지 않기 때문에 지금까지 동물 모델을 실험에 사용했습니다4. 그러나, 동물 모델과 인간 5 사이의 명백한 차이점을 감안할 때, 인간의 장을 모방한 시험관 내 모델의 개발은 즉각적인 관심의 대상이다. 이러한 맥락에서 인간 유도만능줄기세포(iPSC)의 급성장하고 발전하는 분야는 대표적인 장 뉴런(EN)6을 얻을 수 있게 해주었습니다. iPSC 유래 EN을 사용하면 세포 배양 삽입물, 오가노이드 또는 장기 칩(organs-on-a-chip)과 같은 체외 배양 모델에서 장 신경계를 연구할 수 있습니다 7,8.
인간-미생물 누화(HuMiX) 모델은 인간의 장을 모방한 gut-on-a-chip 모델이다9. 초기 HuMiX 모델(이하 초기 장치라고 함)은 상피 세포(Caco-2) 및 박테리아 세포(10,11)를 수용했습니다. 그러나 장내 마이크로바이옴-신경계 연관성을 연구하기 위해 iPSC 유래ENs 6도 시스템에 도입되었습니다(그림 1). 신경 세포, 상피 세포 및 박테리아 세포의 근위 공동 배양을 통해 다양한 세포 유형을 개별적으로 분석하고 인간 장과 유사한 환경에서 서로 다른 세포 유형 간의 상호 작용을 연구할 수 있습니다.
최근 몇 년 동안 장기 온 칩(organs-on-a-chip)(예: gut-on-a-chip) 모델을 사용하여 보다 생리학적으로 대표적인 방식으로 장기를 연구하기 위한 모델 개발이 이루어졌습니다. 이러한 모델은 지속적인 영양소 공급 및 노폐물 제거뿐만 아니라 산소 수준 또는 장벽 무결성 8,12의 실시간 모니터링으로 인해 인간의 장내 환경을 더 잘 나타냅니다. 이러한 모델은 특히 장내 세균이 숙주 세포에 미치는 영향을 연구할 수 있습니다. 그러나 장내 마이크로바이옴과 신경계 사이의 상호 관계를 연구하기 위해 장기 칩을 사용할 수 있으려면 신경 세포가 이러한 시스템에 통합되어야 합니다. 따라서 HuMiX를 더욱 발전시키고 neuroHuMiX 시스템(이하 장치)을 구축하기 위한 목적은 장 신경 세포를 장 상피 세포 및 박테리아와 근위 공동 배양하는 것을 포함하는 gut-on-a-chip 모델을 개발하는 것이었습니다.
프로토콜
1. 세포 배양 및 분류
- 유도만능줄기세포 유래 장뉴런
참고: 달리기 시작 6주 전에 iPSC를 배양하십시오. EN에 대한 차별화 프로토콜은 Fattahi et al.6에서 채택되었습니다.- 1% 페니실린-스트렙토마이신(P/S)이 보충된 iPSC 배양 배지 2mL/웰의 매트릭스 겔 코팅된 6웰 플레이트에서 iPSC를 배양합니다.
- 80 % -90 % 밀도에서 세포를 통과시키고 동일한 배지를 사용하여 매트릭스 겔 코팅 판에 종자하고 37 °C, 5 % CO2 및 90 % 상대 습도 (RH)에서 배양합니다.
- iPSC 유도의 경우, 해동 후 두 번의 통로를 거쳐 80%-90% 밀도에서 100,000 cells/well의 밀도로 매트릭스 겔 코팅된 6웰 플레이트에 세포를 시드합니다. 37°C에서 24시간 동안 상기한 배지 + ROCK inhibitor Y-27632 (1:2,000)에서 배양합니다.
- 24시간 후, 표 1에 따라 상층액 배지를 Day 0 배지로 교체합니다. 유도 과정을 위한 세포 분류 중에 음성 대조군으로 사용할 대조군 웰 하나를 포함합니다. 전체 파생 기간 동안 Day 0 배지 구성에서 대조군을 잘 유지하십시오. 표 1에 따라 2일에서 10일까지 격일로 배지를 교체합니다.
- 11일째에 이 프로토콜의 다음 단계에서 사용될 CD49d 양성 세포에 대한 세포를 분류합니다.
- CD49d 양성 세포와 대조군 웰을 기준으로 정렬할 세포를 풀링합니다. 세포를 300× g에서 3분 동안 원심분리합니다. 세포 펠릿을 2% 소 혈청 알부민(BSA) + 1x 인산염 완충 식염수(PBS)의 1% P/S에 재현탁시킵니다.
- 각 세포 로트(통합 및 대조군)를 둘로 나눕니다: 한 분획을 항인간 CD49d 항체로 염색하고 다른 분획을 동형 대조 항체로 염색합니다.
- 주 세포 집단을 게이트한 다음 단일 세포를 게이트하면 표면에 CD49d를 나타내는 세포가 선택됩니다. 다음 분화 단계를 위해 이 세포를 수집합니다.
참고: 일반적으로 분류된 세포의 30%-40%는 CD49d 양성입니다.
- 분류된 세포 2-400만 개를 N2B27 배지( 표 2 참조) + FGF2 + CHIR에서 초저 부착 플레이트의 6웰 플레이트 1개에 4일 동안 전달하여 스페로이드 형성을 허용합니다.
- 15일째에 GDNF 및 아스코르브산(AA)을 사용하여 N2B27 배지의 2mL/웰에 있는 폴리 L-오르니틴/라미닌/피브로넥틴(P/L/F) 코팅된 6웰 플레이트에 스페로이드를 다시 플레이트합니다. 2-3일마다 배지를 교체하십시오.
참고: 코팅 비율: 폴리 L-오르니틴, 15μg/mL; 라미닌, 2 μg/mL; 피브로넥틴, 1x PBS에서 2μg/mL. - 3주 후 세포를 장치에 접종합니다.
- 카코-2
알림: 실행 최소 1주일 전에 Caco-2 세포를 해동하십시오.- RPMI 1640 글루타민 보충제 + HEPES + 10% 소 태아 혈청(FBS)에 1 × 106 Caco-2 세포가 포함된 T75 플라스크를 파종합니다. 37 °C, 5 % CO2 및 90 % RH에서 배양합니다.
알림: 이러한 실험의 경우 해동 후 첫 번째 또는 두 번째 통로에서 Caco-2를 사용하는 것이 이상적입니다.
- RPMI 1640 글루타민 보충제 + HEPES + 10% 소 태아 혈청(FBS)에 1 × 106 Caco-2 세포가 포함된 T75 플라스크를 파종합니다. 37 °C, 5 % CO2 및 90 % RH에서 배양합니다.
2. HuMiX 실행 준비
- 폴리카보네이트 뚜껑 준비 및 코팅
- 한 쌍의 폴리카보네이트(PC) 뚜껑(그림 2)을 초기 장치 기기 사이클을 사용하여 4개의 나사와 함께 오토클레이브합니다(자세한 내용은 표 3 참조).
- 생물 안전 작업대에서 하단 PC 뚜껑의 각 모서리에 4개의 나사를 삽입하고( 그림 3 참조) 2단계 코팅 공정을 위해 멸균 사각형 페트리 접시로 옮깁니다.
- 첫째 날, PBS의 1.5% 폴리 L-오르니틴 2mL(1x)를 PC 뚜껑 중앙에 추가합니다. 37 °C, 5 % CO2 및 90 % RH에서 밤새 배양합니다.
- 다음날 용액을 제거하고 PBS(1x)에 0.2% 라미닌과 0.2% 피브로넥틴을 함유한 용액으로 교체하여 신경 세포 챔버의 표면을 덮습니다. 37 ° C, 5 % CO2 및 90 % RH에서 밤새 뚜껑을 배양합니다.
- 배양 후 코팅 용액을 PC 뚜껑에 보관하고 밀봉 필름으로 페트리 접시를 닫습니다. 사용할 때까지 4 °C에서 보관하십시오.
- 사용하기 전에 코팅 용액을 제거하고 코팅이 완전히 마를 때까지 생물 안전 캐비닛에서 30분 동안 자연 건조합니다.
- 개스킷 준비 및 코팅
알림: 이 섹션에서는 실리콘 개스킷에 반투과성 멤브레인을 부착하여 개스킷을 준비하는 방법을 설명합니다. 초기 고압멸균 단계 후 개스킷은 콜라겐 또는 뮤신으로 코팅되어 장 상피 세포 또는 박테리아가 부착될 수 있습니다. 뮤신으로 코팅된 막은 인간의 장에 존재하는 점액 장벽을 모방합니다.- 1μm 기공 크기의 폴리카보네이트 멤브레인을 콜라겐 개스킷에 부착하고 하단과 상단 샌드위치 개스킷 사이에 50nm 기공 크기의 폴리카보네이트 멤브레인을 부착합니다. 초기 장치 기기 사이클을 사용하여 부착된 멤브레인으로 개스킷을 오토클레이브합니다( 표 3 참조).
- 멤브레인을 코팅하려면 각 개스킷을 멸균 된 정사각형 접시에 넣으십시오.
알림: 코팅은 생물 안전 캐비닛의 멸균 상태에서 수행됩니다.- 콜라겐 개스킷의 경우 멤브레인에 콜라겐 3mL(50μg/mL)를 추가하고 37°C에서 3시간 동안 배양합니다.
알림: 멤브레인 손상을 방지하기 위해 콜라겐을 추가할 때 피펫 팁이 있는 멤브레인을 만지지 않도록 주의하십시오. - 점액 코팅의 경우 상단 개스킷 면이 위로 향하도록 샌드위치 개스킷을 페트리 접시에 놓고 멤브레인의 윗면을 3mL의 점액(0.025mg/mL)으로 코팅합니다. 개스킷을 37°C에서 1시간 동안 배양합니다.
- 콜라겐 개스킷의 경우 멤브레인에 콜라겐 3mL(50μg/mL)를 추가하고 37°C에서 3시간 동안 배양합니다.
- 배양 시간 후, 각각의 개스킷에서 콜라겐과 뮤신 용액을 흡인하고 생물 안전 캐비닛에서 멤브레인을 30분 동안 자연 건조시킵니다. 접시를 닫고 실험실 밀봉 필름으로 밀봉한 다음 개스킷을 사용할 때까지 4°C에서 보관합니다.
- 튜빙 어셈블리
알림: 이 섹션에서는 장치의 관류를 위해 튜브를 조립하는 방법에 대해 설명합니다. 조립하기 전에 모든 조각을 고압멸균 및/또는 멸균 포장에 개별적으로 포장된 조각을 구입하십시오. 모든 구성 요소를 생물 안전 캐비닛에 넣습니다.- 각 장치 및 각 튜브 라인에 대해 3개의 튜브 라인, 펌프 튜브 라인 1개, 긴 마프렌 튜브(20cm) 2개, 짧은 마프렌 튜브(8cm) 2개, 유출 병용 40mm 바늘 1개, 250mL 유입 병용 120mm 바늘 1개 또는 작은 유입 병용 80mm 바늘, 3 명의 남성 및 7 명의 여성 루어 - 미늘 커넥터, 3 개의 루어 어댑터 및 2 개의 3 방향 스톱콕 밸브.
- 위에 나열된 오토클레이브 및 멸균 구성 요소를 사용하여 튜브 라인을 왼쪽에서 오른쪽으로 조립합니다(그림 4).
알림: 각 연결 단계 사이에 각 구성 요소에 70% 에탄올을 분사합니다.
- 배지 준비
참고: 이 섹션에서는 장치의 다양한 세포 유형에 대한 배지를 준비하는 방법과 멸균 방식으로 배지를 혈청 병으로 옮기는 방법에 대해 설명합니다.- RPMI 1640에 10% 0.22μm 여과, 열 비활성화 FBS를 보충합니다. N2B27 배지를 GDNF 및 AA로 신선하게 보완합니다.
- 무균 상태에서 배지를 혈청 병으로 옮깁니다. RPMI 1640 배지 200mL를 250mL 병에 옮기고 N2B27 배지 30mL를 50mL 병에 옮깁니다.
- 박테리아 배지(RPMI 1640 + 10% FBS + 5% De Man, Rogosa 및 Shapre 배양 배지[MRS])는 실험의 마지막 24시간 동안에만 필요하므로 나중에 준비합니다.
- 격막으로 병을 닫고 알루미늄으로 압착하고 오토클레이브합니다.
- 미디어를 옮기려면 적절한 디캐퍼(직경 = 20mm)를 사용하여 알루미늄 크림프를 제거합니다. 중격도 제거하십시오. 준비한 배지를 병을 만지지 않고 세럼 병에 조심스럽게 붓습니다.
- 살균하려면 휴대용 분젠 버너를 사용하여 병 입구를 불태우십시오. 격막에 70% 에탄올을 뿌리고 병에 첨가한 다음 씰 크림퍼를 사용하여 알루미늄 압착으로 밀봉하여 병을 밀봉합니다.
- 밀폐된 병을 37°C, 5% CO2 의 인큐베이터에 24시간 동안 넣어 배지를 37°C로 예열하고 장치에 미디어 병을 사용하기 전에 눈에 띄는 오염 징후가 없는지 확인합니다.
3. HuMiX 시작
- NeuroHuMiX 어셈블리
알림: 이 섹션에서는 장치를 조립하는 방법에 대해 설명합니다. 요컨대, 클램핑 시스템을 멸균하고 다시 조인 후 하단 PC 덮개를 클램프 바닥에 놓습니다. 그런 다음 코팅된 개스킷과 상단 PC 덮개를 서로 쌓은 다음 클램프의 상단 부분을 쌓습니다. 마지막으로 클램프를 조여 개스킷을 압축하고 시스템을 누출 방지 및 기밀 상태로 만듭니다. 그림 4 는 어셈블리에 필요한 다양한 부품을 보여줍니다.- 클램프와 두 개의 PC 뚜껑(상단 및 하단)을 조립하기 전에 오토클레이브합니다.
- 클램프의 상단 및 하단 부분을 조립하는 데 사용되는 나사를 조입니다(그림 4C,D). 오토클레이브 프로세스 전에 나사를 열고 나중에 다시 조입니다.
- 코팅 및 건조된(2.2.3단계) 하단 PC 뚜껑(그림 4 A1)을 정사각형 페트리 접시에서 클램프 상단으로 옮깁니다.amp PC 뚜껑 모서리에 있는 4개의 나사를 잡아 기준.
알림: 오염 위험을 줄이기 위해 PC 덮개를 만지지 마십시오. - 멸균 핀셋을 사용하여 상피 챔버 개스킷을 위를 향하게(즉, 멤브레인이 위에 오도록) PC 덮개에 놓습니다. 나사를 사용하여 개스킷과 PC 덮개를 정렬하여 덮개 모서리의 입구 및 출구 포트가 개스킷의 구멍에 맞춰지도록 합니다(그림 3).
- 멸균 핀셋을 사용하여 샌드위치 개스킷을 콜라겐 개스킷 위에 놓고 윗면이 위를 향하도록 합니다.
- 샌드위치 개스킷 위에 상단 PC 뚜껑을 놓습니다. 오염 위험을 줄이려면 뚜껑의 가장자리만 만져서 만져보세요(뚜껑의 상단 또는 하단 부분을 만지지 마십시오). 클램프 뚜껑의 미늘이 멤브레인 어셈블리의 입구 및 출구 개구부와 정렬되고 하단 PC 덮개의 나사가 상단 PC 덮개의 개구부에 맞는지 확인합니다.
- 장치를 닫으려면amp 덮개(cl의 상단 부분amp) PC 덮개 위에. 덮개의 구멍이 상단 PC 덮개의 입구 및 출구 미늘과 일치하는지 확인하십시오. 걸쇠를 닫습니다. 닫힌 장치(그림 5)를 후드 아래에 두어 프라이밍된 튜브 라인에 연결합니다(3.2.6단계).
- 튜빙 라인의 프라이밍
알림: 이 섹션에서는 튜브를 유입 및 유출 병과 펌프에 연결하는 방법을 설명하고, 튜브를 매체로 프라이밍하여 세척 및 멸균 중에 사용된 잔류 제품을 제거하고 튜브에 기포가 없는지 확인합니다.- 튜빙 라인의 프라이밍은 생물 안전 작업대에서 수행됩니다. 각 유입 및 유출 병의 격막에 필터가 있는 폭기 바늘을 삽입합니다. 깨끗하고 멸균된 핀셋을 사용하여 120mm 바늘을 250mL 혈청 병에 삽입합니다. 50mL 혈청 병에 80mm 바늘을 삽입합니다.
- 각 튜브 라인의 끝에 있는 40mm 바늘을 유출 혈청 병에 삽입합니다. 장치당 3개의 튜빙 라인에 대해 2개의 유출 병이 있습니다. 상피 및 신경 튜브 라인의 40mm 바늘은 배지 폐기를 위해 동일한 유출 병에 연결됩니다. 박테리아 튜브 라인은 두 번째 유출 병으로 이동합니다.
- 펌프 튜브 라인을 펌프 카세트에 삽입합니다. 튜빙 라인의 3방향 마개가 모두 열려 있는지 확인하십시오.
- 처음에는 5rpm의 속도로 유입에서 유출 병으로 매체를 보내도록 연동 펌프를 설정합니다( 표 4 참조).
알림: 튜빙 라인 프라이밍 중에 속도를 최대 10rpm까지 높여 프로세스를 가속화할 수 있습니다. - 시작 버튼을 눌러 펌프를 시작하고 펌핑 동작의 방향이 시계 방향인지 확인하십시오. 매체가 유출 병에 떨어지면 누출이 없고 튜브 라인과 연결 지점에 기포가 남아 있지 않은지 확인하십시오. 튜브와 커넥터를 두드리거나 펌프 속도를 높여 남아 있는 기포를 제거합니다.
- 모든 튜브 라인이 유출 병으로 떨어지면 초기 장치를 연결하기 위해 유속을 2rpm으로 설정합니다.
- 장치의 프라이밍
알림: 이 섹션에서는 모든 챔버가 채워지고 배지로 사전 코팅되어 시스템에 기포가 남지 않고 접종 중에 세포가 쉽게 부착될 수 있도록 세포 배양 배지로 장치를 프라이밍하는 방법을 설명합니다.- 장치의 프라이밍은 멸균 조건의 생물 안전 캐비닛에서 수행됩니다. 장치를 연결하려면 먼저 장치의 하단 챔버인 뉴런 라인을 연결합니다.
- 라인을 연결하려면 미늘 위로 튜빙을 밀어 짧은 튜빙이 암 루어 커넥터에서 분리되고 장치의 출구 포트에 연결되는 유출 측부터 먼저 시작하여 3방향 스톱콕 밸브(그림 5C)를 닫습니다. 적절한 연결을 보장하고 누출 및/또는 오염 가능성을 줄이려면 튜브를 커넥터 위로 끝까지 밀어 덮개와 접촉하도록 하십시오. 유입 튜브도 같은 방법으로 연결합니다. 한 라인이 장치에 완전히 연결되면(유입 및 유출) 3방향 스톱콕을 엽니다.
- 상피 라인으로 이전 단계를 반복한 다음 박테리아 라인으로 반복합니다. 펌프를 2rpm의 유속으로 유지하십시오. 압력 상승으로 인한 누출을 방지하기 위해 펌프 속도를 2.5rpm으로 높이되 더 높지 않게 높이십시오. 펌프가 장치의 챔버를 프라이밍하도록 합니다.
- 유출되는 혈청 병을 항상 모니터링하십시오. 기포가 챔버, 라인 또는 커넥터에 끼면 내부에 기포가 있는 튜브 라인이 유출 챔버에서 더 이상 떨어지지 않습니다. 기포를 제거하려면 먼저 장치를 몇 분 동안 작동시키십시오. 이렇게 해도 문제가 해결되지 않으면 유출의 3방향 스톱콕을 닫아 짧은 시간 동안 삭제되는 다른 라인 중 하나를 닫습니다.
- 장치의 모든 챔버가 완전히 프라이밍되면 모든 챔버가 세포 배양 배지로 채워지고 장치에 기포가 남지 않으면 펌프 속도를 0.5rpm으로 줄입니다. 이제 장치를 세포 접종할 준비가 되었습니다.
4. 세포 준비 및 접종
알림: 이 섹션에서는 장치를 접종하는 데 필요한 다양한 세포 유형을 준비하는 방법과 기포가 발생하지 않고 멸균 방식으로 장치에 접종하는 방법에 대해 설명합니다. 또한 신경 세포에 대한 배지 리프레시를 수행하는 방법과 장치에서 박테리아 배양을 위한 배지를 준비하는 방법을 설명합니다.
- 상피 세포
- 트립신-에틸렌디아민테트라아세트산(EDTA)을 사용하여 플라스크에서 Caco-2 세포를 분리하고, RPMI 1640 + 10% FBS에서 재현탁하고, 트리판 블루 배제 분석을 사용하여 Neubauer 세포 카운터에서 계수합니다. Caco-2 세포 현탁액(3분, 300× g)을 원심분리하고 상층액을 폐기하여 남아 있는 트립신-EDTA를 제거합니다. RMPI 1640 + 10% FBS에서 Caco-2 세포를 재현탁시켜 350,000세포/mL의 현탁액을 얻습니다. 각 장치에는 1.5mL의 부피가 필요합니다.
- Caco-2 세포 현탁액 1.5mL를 멸균 2mL 주사기에 옮기고 주사기에 남아 있는 공기나 기포를 제거합니다.
- 박테리아 및 신경 챔버 튜브의 3방향 스톱콕 밸브를 닫습니다. 로터에서 해당 튜브가 있는 카세트를 제거하여 박테리아 및 신경 챔버의 튜브를 펌프에서 분리합니다.
- 상피 챔버로 이어지는 유입 튜브의 3방향 스톱콕 밸브 캡을 열고 3방향 스톱콕 밸브를 돌려 장치의 매체 흐름을 '열린 커넥터'로 리디렉션합니다(그림 5C). 3방향 스톱콕 밸브의 열린 끝에 매체 한 방울이 나타날 때까지 매체가 흐르도록 합니다.
- 상피 세포가 포함된 주사기를 드롭-드롭 연결 방식을 사용하여 '열린 커넥터'에 삽입하면 기포가 유입되지 않고 커넥터에 주사기를 삽입할 수 있습니다. 3방향 마개의 밸브를 돌려 유입 병(펌프를 통해 )에서 매체의 흐름을 멈추고 연결된 주사기에서 초기 장치로 흐르도록 합니다. 펌프에서 상피 채널을 분리합니다.
- 주사기를 천천히 눌러 세포 현탁액으로 상피 챔버를 접종합니다. 3초에 약 한 방울이 유출 병에 떨어지도록 합니다.
- 1.5mL의 셀 현탁액을 추가한 다음 유출 3방향 마개의 밸브를 닫습니다. 주사기를 분리하고 캡으로 3방향 마개의 열린 끝을 닫습니다. 챔버를 최소 2시간 동안 닫아 두십시오. 그동안 신경 세포를 접종하십시오.
- 신경 세포
- 피펫을 사용하여 배지의 세포를 각 웰에서 재현탁하여 웰에서 신경 세포를 분리합니다. 6웰 플레이트의 한 웰(9.6cm2)에서 완전히 합류한 세포로 각 장치를 접종합니다.
- 해당 N2B27 배지 부피(장치당 배지 1.5mL) + 세포 현탁액 1μL의 피브로넥틴/mL에 세포 펠릿을 재현탁시킵니다. 재현탁 세포 현탁액 1.5mL를 2mL 주사기에 옮기고 주사기에 남아 있는 기포를 제거합니다. 충전된 주사기를 멸균된 50mL 코니컬 튜브에 넣고 프라이밍된 HuMiX 장치가 들어 있는 생물안전 작업대로 옮깁니다.
- 튜브 라인의 변경을 제외하고는 상피 챔버 접종에 대해 앞서 설명한 것과 동일한 접종 과정을 따릅니다. 여기에서 펌프에서 박테리아 및 상피 튜브 라인을 분리합니다.
- 신경 세포 접종 후 튜브 라인의 3방향 꼭지를 모두 닫고 펌프에서 분리합니다. 장치를 37°C 및 5%CO2의 인큐베이터에 넣습니다. 셀이 부착될 수 있도록 모든 채널을 2시간 동안 닫아 두십시오.
- 2시간 후 박테리아 및 상피 채널을 펌프에 연결하고 두 라인의 유입 및 유출 3방향 꼭지를 엽니다. 배지 변경 중을 제외하고 초기 장치 실행 후 14일 동안 신경 챔버를 닫은 상태로 유지하십시오.
- 14일 동안 3-4일마다 신경실의 배지를 교체합니다. 중간 리프레시의 경우 장치당 3mL의 신선한 N2B27 배지를 준비하고 멸균된 20mL 혈청 병에 옮깁니다. 멸균 격막과 알루미늄 크림프 씰을 사용하여 배지로 세럼 병을 닫습니다.
- 통기와 80mm 바늘을 새 병의 격막에 삽입합니다. 오래된 병의 바늘에서 새 병의 바늘까지 수컷 Luer를 분리하여 인큐베이터에서 오래된 미디어 병을 새 것으로 교체합니다.
- 뉴런 챔버의 펌프 튜브가 있는 카세트를 펌프에 연결하고 3방향 마개를 엽니다. 다음 배지 교환까지 뉴런 튜브의 3방향 꼭지를 닫고 펌프에서 분리하기 전에 배지를 0.5rpm으로 2시간 동안 흐르게 합니다.
5. 세균 배양 및 접종
참고: 이 연구에서는 12일째에 리모실락토바실러스 루테리 균주 F275의 액체 배양액을 글리세롤 스톡에서 되살렸습니다. 필요 또는 연구 설계에 따라 다른 박테리아 종을 사용할 수 있습니다.
- MRS 국물 5mL가 있는 튜브 3개(멸균 제어 튜브 1개)와 L. 루테리 접종용 튜브 2개를 준비합니다. 접종 루프를 사용하여 글리세롤 스톡의 상단을 긁어내어 하나의 튜브로 옮깁니다. 두 번째 접종 튜브로 반복합니다. 튜브를 37°C, 170rpm에서 밤새 배양합니다.
알림: 글리세롤 스톡을 해동하지 마십시오. - Roswell Park Memorial Institute(RPMI) 1640 + 10% FBS와 5% MRS 육수를 혼합하여 초기 장치용 신선한 배지를 준비합니다. 장치당 25mL를 준비하고 멸균 상태에서 100mL 혈청 병에 옮깁니다. 멸균 격막과 알루미늄 크림프로 병을 닫습니다. 병을 37°C, 5% CO2 의 인큐베이터에 밤새 넣습니다.
- 병을 박테리아 튜브 라인에 연결하기 전에 RPMI 1640/MRS 배지의 각 병에 폭기 바늘과 80mm 바늘을 추가합니다.
- 각각 3mL의 RPMI 1640 + 10% FBS + 5% MRS 육수가 포함된 새 튜브를 준비합니다. 장치당 최소 2개의 튜브, 하나의 제어 장치 및 하나의 튜브를 준비합니다. 새로 준비된 튜브 2개에 15μL의 L. 루테리 하룻밤 배양액(광학 밀도[OD] > 2)을 접종합니다.
- 37 ° C, 170 rpm에서 1 시간 동안 튜브를 배양 한 후 0.05-0.10의 OD에 도달하여 ~ 1 × 107 콜로니 형성 단위 (CFU) / mL에 해당합니다. 1.5mL를 2mL 주사기에 옮깁니다(장치당 1개). 나머지 박테리아 현탁액은 CFU 도금 및 살아있는/죽은 염색을 위해 사용하십시오.
- 장치의 박테리아 접종의 경우 여기에서 신경 및 상피 튜브 라인이 닫혀 있다는 점을 제외하고는 4.1단계에서 언급한 것과 동일한 절차를 따르십시오.
- 접종 후 밸브를 닫고 30분 동안 펌프에서 분리하여 박테리아 튜브 라인도 닫습니다. 상피 튜브 라인과 박테리아 튜브 라인을 연결하고 다시 엽니다. 장치를 24°C 및 37rpm에서 0.5시간 더 작동시킵니다.
6. HuMiX 개방 및 샘플링
참고: 아래 섹션에서는 다양한 세포 유형의 샘플링에 대해 설명합니다. 예를 들어, 신경 세포 펠릿은 RNA 추출 및 후속 정량적 중합효소 연쇄 반응(qPCR)에 사용되고, 박테리아 펠릿은 DNA 추출 및 16S rRNA 유전자 시퀀싱에 사용되며, 효소 결합 면역 흡착 분석(ELISA) 및 기타 분석(예: 젖산 분석)에는 상층액이 사용됩니다.
- 개장일인 14일째에는 3방향 마개를 모두 닫고 펌프에서 튜브를 분리한 다음 인큐베이터 장치를 실험실 벤치로 꺼냅니다.
알림: 장치를 이동할 때 실제 장치를 수평으로 유지해야 합니다. - cl을 천천히 열기 전에 장치에 연결된 튜브 라인을 제거하십시오.amp 그리고 cl을 제거하십시오.amp 뚜껑. 조심해서 상단 PC 뚜껑을 제거하고 1.5mL 마이크로 원심분리기 튜브에 배지를 모아 얼음 위에 놓습니다.
- 상피 챔버에서 배지를 수집하면서 샌드위치 개스킷을 부드럽게 제거합니다. 세포층을 만지지 않도록 주의하십시오. 샌드위치 개스킷을 정사각형 페트리 접시에 놓고 챔버가 완전히 덮일 때까지H2O의 멸균 0.9% NaCl 용액을 박테리아 챔버에 추가합니다(약 1mL).
- 콜라겐 개스킷을 천천히 제거하면서 신경 챔버에서 배지를 수집하여 마이크로 원심 분리 튜브로 옮깁니다. 모든 미디어 튜브를 얼음 위에 놓습니다. 콜라겐 개스킷을 정사각형 접시에 넣고 세포층이 완전히 덮일 때까지 Caco-1 층에 2x PBS 몇 밀리리터를 부드럽게 추가합니다.
- 하단 PC 뚜껑을 정사각형 페트리 접시에 놓고 신경 세포 위에 약 2mL의 1x PBS를 부드럽게 추가하여 샘플링 과정에서 마르지 않도록 합니다.
- 박테리아 배지 튜브를 5,000× g 에서 4°C에서 5분 동안 원심분리합니다. 상피 및 신경 배지 튜브를 300× g 에서 4°C에서 5분 동안 원심분리합니다. 원심분리 후 각 튜브의 상층액을 새 마이크로 원심분리기 튜브로 옮기고 즉시 드라이아이스 위에 놓습니다.
- 상피 세포
- 개스킷에서 PBS를 조심스럽게 제거하고 15mL 원뿔형 튜브에 모입니다. 2mL의 트립신을 세포에 추가하고 37 ° C, 5 % CO2 에서 5 분 동안 개스킷을 배양합니다. 배양 후 2mL의 RPMI 1640을 개스킷에 추가하고 세포를 재현탁시킨 다음 다른 15mL 코니컬 튜브에 수집합니다.
- 300× g에서 5분 동안 두 튜브를 원심분리합니다. 상층액을 버리십시오. PBS 세척에서 펠릿을 300μL의 PBS에 재현탁시키고 세포 펠릿을 PBS 1mL에 재현탁시킵니다.
- 각 튜브의 50μL를 0.5mL 마이크로 원심분리 튜브로 옮겨 자동 세포 계수기 및 트리판 블루 배제 분석 세포 계수를 수행합니다. 재현탁 세포 펠릿(1mL)을 1.5mL 튜브에 옮기고 300× g 에서 5분 동안 원심분리합니다.
- 상층액을 제거하고 세포 펠릿을 250μL의 용해 완충액 + 1% 베타-메르캅토에탄올에 재현탁시키고 튜브를 드라이아이스 위에 놓습니다.
- 신경 세포
- 이전 단계(6.5)의 신경 세포가 있는 바닥의 투명한 PC 뚜껑이 있는 정사각형 페트리 접시를 역 위상차 현미경으로 가져갑니다.
알림: PBS가 있는 PC 덮개를 이동하는 동안 신경 네트워크가 매우 쉽게 분리되므로 매우 부드럽게 하십시오. - 명시야 현미경을 사용하여 신경 세포의 형태와 세포 밀도를 관찰하여 접종 전 마지막 품질 검사를 수행합니다. 세포가 스페로이드에서 이동했는지, 신경 네트워크가 형성되었는지 확인합니다. 뉴런 네트워크는 약 90%가 합류해야 합니다. 자세한 내용은 Fattahi et al.6을 참조하십시오.
- 벤치에서 PBS에 세포를 재현탁시키고 1.5mL 튜브에 수집합니다. 튜브를 300× g 에서 3분 동안 원심분리합니다. 상층액을 버리고 세포 펠릿을 250μL의 용해 완충액 + 1% 베타-메르캅토에탄올에 재현탁시킨 다음 드라이아이스 위에 놓습니다.
참고: 면역형광(IF) 염색은 PC 뚜껑의 신경 세포에서 수행할 수 있습니다. 신경 네트워크를 파괴하지 않기 위해 IF 염색이 선호되는 분석법인 경우, 세포를 4% 파라포름알데히드(PFA)로 PC 뚜껑에 고정해야 하며, 이는 향후 실험에서 PC 뚜껑의 재사용을 방해합니다.
- 이전 단계(6.5)의 신경 세포가 있는 바닥의 투명한 PC 뚜껑이 있는 정사각형 페트리 접시를 역 위상차 현미경으로 가져갑니다.
- 박테리아 세포
- 멤브레인에 부착된 박테리아 세포를 0.9% NaCl 용액에 재현탁시킵니다. 세포가 단단히 부착된 경우 세포 스크레이퍼를 사용하여 멤브레인에서 박테리아 세포를 분리합니다.
알림: 스크레이퍼를 사용하면 세포가 손상되어 죽은 세포가 더 많이 보일 가능성이 높아집니다. - 15mL 코니컬 튜브에 세포 현탁액을 수집합니다. 이전에 수집한 배지에서 남은 펠릿을 15mL 코니컬 튜브에 추가합니다. 5,000 × g 에서 4 °C에서 5 분 동안 원심 분리합니다. 상층액을 버리고 세포 펠릿을 1mL의 0.9% NaCl 용액에 재현탁시킵니다.
- 이 부피를 세 부분으로 나눕니다: 하나는 핵산 추출(650μL)을 위한 박테리아 펠릿 동결용, 다른 하나는 MRS 플레이트의 CFU 도금용(50μL), 다른 하나는 살아있는/죽은 염색용(300μL)입니다. 핵산 추출을 위한 펠릿의 제조를 위해, 세포 현탁액을 마이크로 원심분리기 튜브에 옮기고, 4°C에서 5분 동안 5,000× g 으로 원심분리한 후 상층액을 버린다. 세포 펠릿을 드라이 아이스에 놓습니다.
- 샘플링이 끝나면 드라이아이스에 담긴 모든 튜브를 -80°C 냉동고로 옮겨 나중에 다운스트림 분석을 위해 보관합니다.
참고: 상층액은 가스 크로마토그래피-질량분석법(GC-MS) 분석에 추가로 사용할 수 있습니다. 또한, 개방 중에 콜라겐 코팅 멤브레인을 다른 분석을 위해 다른 부분으로 나눌 수 있습니다 - 절반은 IF 오클루딘 염색에 사용되고, 다른 부분은 추가 유전자 발현 분석을 위한 RNA 추출에 사용되고, 다른 부분은 세포 계수에 사용됩니다.
- 멤브레인에 부착된 박테리아 세포를 0.9% NaCl 용액에 재현탁시킵니다. 세포가 단단히 부착된 경우 세포 스크레이퍼를 사용하여 멤브레인에서 박테리아 세포를 분리합니다.
결과
neuroHuMiX에서는 박테리아, 상피 및 신경 세포의 세 가지 다른 세포 유형을 함께 공동 배양했습니다(그림 1). 세포가 모두 생존 가능한지 확인하기 위해 다양한 세포 유형에 대해 다양한 분석을 수행했습니다. 예를 들어, 박테리아 세포에 대한 CFU 수, 상피 세포에 대한 세포 수 및 세포 생존도 분석을 수행했으며 신경 세포는 현미경 분석을 통해 평가했습니다.
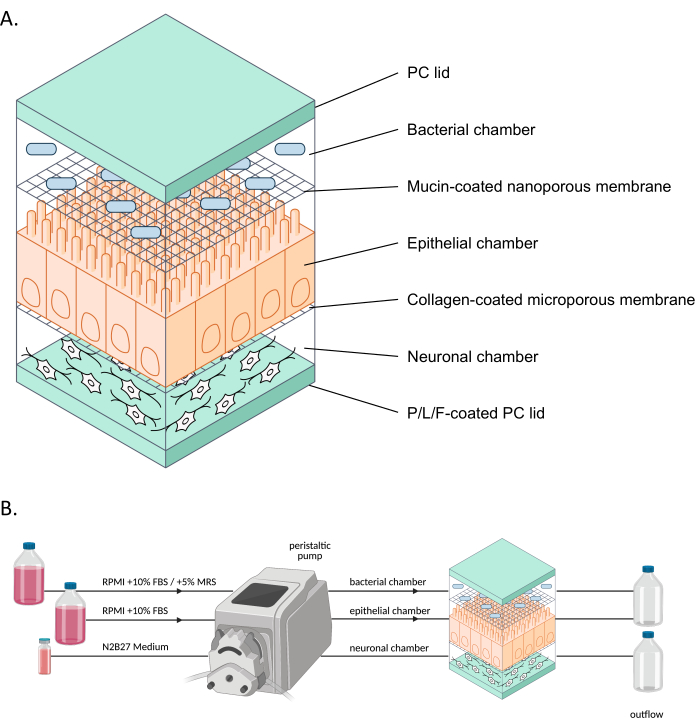
그림 1: neuroHuMiX 및 실험 설정의 개략도 . (A) 세 개의 챔버는 두 개의 PC 덮개 사이에 고정되어 닫힌 상태를 유지합니다. 각 챔버는 내부에서 자란 세포를 위한 특정 배지로 채워져 있습니다. 서로 다른 챔버는 반투과성 막으로 분리되어 멤브레인을 통과하는 용해성 인자를 통해 세포 통신이 가능합니다. (B) neuroHuMiX 설정의 표현. 각 챔버는 서로 다른 미디어 병에 연결되어 있습니다. 박테리아 챔버의 경우 처음 12.5일 동안 챔버는 RPMI + 10% FBS에 연결되고 마지막 36시간 동안 RPMI + 10% FBS + 5% MRS로 변경됩니다. 약어: PC = 폴리카보네이트; P/L/F = 폴리 L-오르니틴/라미닌/피브로넥틴; RPMI = 로스웰 파크 메모리얼 인스티튜트 세포 배양 배지; MRS = De Man, Rogosa, Shapre 배양 배지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
세포가 적절하게 부착되었는지 확인하기 위해 장치를 열 때 콜라겐 코팅 막에 세포층 형성을 평가했습니다(그림 6A). 장치의 세포가 생존 가능한지 확인하기 위해 자동 세포 카운터 계수(그림 6B)와 트리판 블루 배제 분석 세포 계수(그림 6C)를 수행했습니다. 분석은 (i) EN을 사용한 배양 중인 Caco-2, (ii) L. 루테리 를 사용한 배양 중인 Caco-2, (iii) 세 가지 세포 유형 모두의 공동 배양을 포함하는 장치의 세 가지 HuMiX 설정에서 Caco-2 세포에 대해 수행되었습니다. 일원 분산 분석(one-way ANOVA)을 사용한 통계적 테스트에서는 세포 유형 간에 유의미한 차이가 나타나지 않았으며, 이는 Caco-2 세포가 이 연구에서 테스트된 모든 초기 장치 설정 및 조건에서 생존 가능한 상태로 유지되었음을 시사합니다. 이는 L. 루테리 와 두 가지 인간 세포 유형의 공동 배양 중에 도달한 박테리아 밀도가 인간 세포에 대한 세포독성 효과를 갖지 않는다는 사실을 강조합니다.
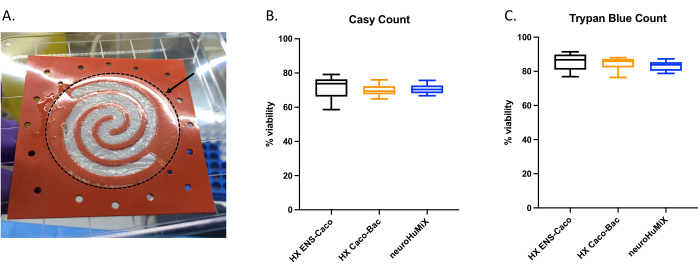
그림 6: 콜라겐 코팅 막의 Caco-2 세포 평가. (A) 개봉 후 콜라겐 코팅 막의 Caco-2 세포 층. 화살표는 점선 원으로 둘러싸인 콜라겐 코팅 막을 나타냅니다. Caco-2 세포는 막의 나선형 모양에서 자라고 있었습니다. HuMiX에서 14일 후 Caco-2 세포의 세포 생존율. 세포 계수는 (B) 자동화된 세포 카운터 및 (C) 트리판 블루 배제 분석 세포 계수를 사용하여 얻었다. Caco-2 세포 수는 초기 장치의 다양한 배양 설정, 즉 장 뉴런(EN)과의 공동 배양(검은색), L. 루테리와의 공동 배양(주황색) 및 장치(EN 및 L. 루테리)(파란색)에서 측정되었습니다. 일원 분산 분석(one-way ANOVA)을 수행하여 서로 다른 배양 설정 간에 유의한 차이가 없음을 보여주었습니다(일원 분산 분석, p = 0.1234 [ns]; 오차 막대는 표준 오차를 나타냄). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
포유류 세포로 L. 루테리 를 배양할 수 있도록 먼저 배양 배지를 장치에 사용할 수 있도록 최적화하고 조정했습니다. RPMI 1640(10% FBS 보충)의 MRS 5% 혼합은 L. 루테리 의 성장에 최적으로 적합하지만 이 분석에 사용된 포유류 세포에는 세포독성이 없음을 발견했습니다. 이어서, 24시간 동안 장치에서 배양했을 때 L. 루테리 의 성장을 평가하기 위해 CFU 계수를 수행했습니다. CFU 수는 두 가지 다른 초기 장치 설정에 대해 평가되었습니다(그림 7)-L. 루테리는 장치에서 Caco-2 및 L. 루테리 와 공동 배양되었습니다 . 두 설정 모두에서 CFU 수는 HuMiX 접종 및 수확된 세포(단방향 ANOVA, p = 0.0002)와 크게 달랐으며, 이는 초기 장치 내에서 박테리아 세포의 성장을 나타냅니다.
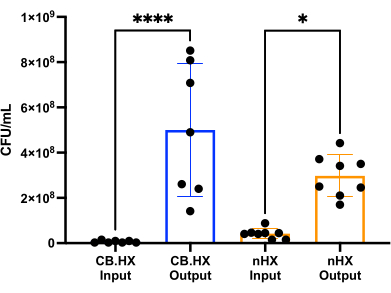
그림 7: 접종물의 리모실락토바실러스 루테리 CFU 수(1:100,000 희석) 및 HuMiX에서 24시간 후. 두 가지 다른 설정: L. 루테리 및 장치와 공동 배양 중인 Caco-2 세포. 일원 분산 분석은 접종물과 채취된 세포 사이에 유의미한 차이(p = 0.0002 [***])를 보여주며, 이는 박테리아가 HuMiX 내부에서 성장하고 있음을 의미합니다. 오차 막대는 표준 오차를 나타냅니다. 약기 : CB. HX = Caco-2 박테리아 HuMiX; nHX = neuroHuMiX입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
장치 내에서 EN을 배양하면 세포의 표현형이 변경되는지 여부를 평가하기 위해 도립 위상차 현미경을 사용하여 EN의 총 형태를 관찰했습니다. 이 단계에서 밀도와 EN 형태를 모두 평가했습니다. 합류 신경 네트워크의 구축은 세포가 코팅된 장치의 PC 뚜껑에 잘 부착되었음을 나타냅니다. 중요한 것은, 이것은 그들이 Caco-2 및 L. reuteri와 함께 공동 배양에서 성장했다는 개념을 강조합니다. 합류하는 뉴런 네트워크와 개스킷으로 묘사된 나선 사이의 가장자리는 분명하게 분명했습니다(그림 8).
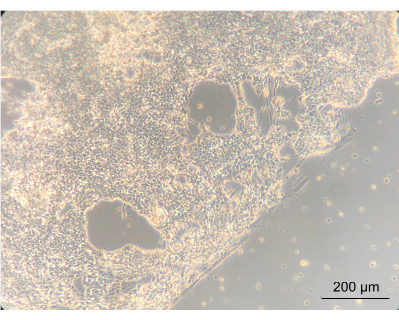
그림 8: 장치에서 14일 동안 배양한 후 장 뉴런. 이미지의 왼쪽에서 뉴런은 나선형의 합류 층으로 성장했습니다. 뉴런 층과 세포가 없는 공간 사이의 가장자리는 나선의 가장자리입니다. 10배 확대, 스케일 바 = 200μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 장치에 사용된 덮개. 이미지는 PC 덮개 상단(왼쪽) 및 하단(오른쪽)을 보여줍니다. PC 덮개의 각 면은 6.4cm입니다. 약어: PC = 폴리카보네이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 하단 PC 덮개의 상피 챔버 개스킷. 하단 PC 덮개에 놓인 상피 챔버 개스킷의 상단 모습(왼쪽)과 하단 뷰(오른쪽)는 상피 챔버 개스킷과 하단 PC 덮개의 입구 및 출구의 정렬을 보여줍니다. 개스킷의 각 측면과 PC 덮개의 크기는 6.4cm입니다. 약어: PC = 폴리카보네이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 장치 조립. (A) HuMiX 조립을 위한 다양한 부품: (1) 하단 PC 뚜껑; (2) (1) 위에 배치되는 콜라겐 코팅 미세 다공성 막이 있는 개스킷; (3) 그 사이에 뮤신-코팅된 나노다공성 멤브레인을 가지고, (2)의 상부에 놓인 샌드위치 개스킷; (4) 상단 PC 뚜껑을 (3) 위에 놓습니다. 개스킷과 PC 덮개의 각 측면은 6.4cm입니다. (B) (A)의 모든 부품을 함께 배치합니다. (씨,디) 조립된 장치 상단(왼쪽) 및 측면(오른쪽) view. B는 클램핑 시스템에 배치되어 시스템을 닫습니다. (C) 상단 클램프의 각 측면은 8cm입니다. 약어: PC = 폴리카보네이트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
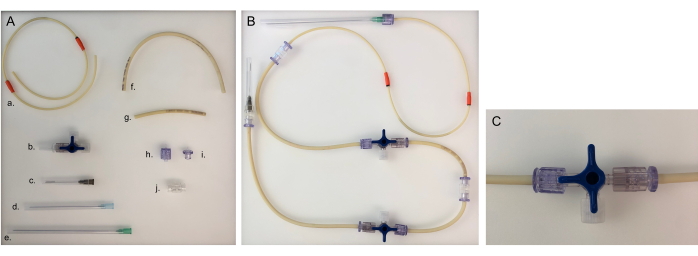
그림 5: 하나의 챔버에 대해 튜빙 라인과 조립된 튜빙 라인에 필요한 부품. (A) 튜빙 라인을 구축하기 위한 다른 부품: a. 펌프 튜빙 라인; b. 3방향 마개; c. 40mm 바늘; d. 80mm 바늘; e. 120mm 바늘; f. 긴 튜브 라인(20cm); g. 짧은 튜브 라인(8cm); h. 남성 루어; i. 여성 루어; J. 어댑터. (B) 박테리아 또는 상피 챔버를 위해 조립된 튜브 라인. 신경 챔버의 경우 120mm 바늘을 80mm 바늘로 변경해야 합니다. (C) 3방향 스톱콕 밸브를 돌려 장치의 매체 흐름을 '열린 커넥터'로 리디렉션하고 챔버를 닫습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 하루 | 0 | 2 | 4 | 6 | 8 | 10 |
| 미디어 구성 | 100% E6 | 100% E6 | 75% 6회 | 50% 6회 | 25% 6회 | 100% N2 |
| + LDN | + LDN | N2 25 % | 50% N2 | 75% N2 | + LDN | |
| + SB | + SB | + LDN | + LDN | + LDN | + SB | |
| + 짹짹 | + SB | + SB | + SB | + 짹짹 | ||
| + 짹짹 | + 짹짹 | + 짹짹 | + RA | |||
| + RA | + RA | |||||
| 분자 | [농도] | |||||
| 증권 시세 표시기 | 100 nM 수준 | |||||
| 에스비에스 | 10 마이크로미터 | |||||
| 차르 | 3 μM의 | |||||
| 레티노산(RA) | 1 μM의 |
표 1: 미디어 구성.
| 미디어 | 성분(농도는 재료 표에 나열됨) | 부피 (mL) |
| N2 배지(50mL) | DMEM-F12 시리즈 | 48 |
| N2 보충제 | 0.5 | |
| L-글루타민 | 0.5 | |
| 페니실린/스트렙토마이신 | 0.5 | |
| 네아(NEAA) | 0.5 | |
| N2B27/ENS 배지(50mL) | 신경기저(Neurobasal) | 48 |
| N2 보충제 | 0.5 | |
| L-글루타민 | 0.5 | |
| 페니실린/스트렙토마이신 | 0.5 | |
| 나27-ᅡ | 0.5 |
표 2: 미디어 레시피.
| 멸균 온도(°C) | 116 |
| 멸균 시간(분) | 20 |
| 건조 시간(분) | 10 |
| 펄스 | 3 |
| 끝 온도(°C) | 99 |
표 3: HuMiX 오토클레이브 실행.
| 분당 회전수(rpm) | 평균 유량(μL/min) |
| 0.5 | 13 |
| 2 | 79 |
| 5 | 180 |
표 4: 연동 펌프의 유량.
토론
인간의 장내 마이크로바이옴이 숙주의 건강과 질병에 영향을 미친다는 사실이 밝혀졌습니다. 특히 알츠하이머병이나 파킨슨병과 같은 신경 질환에서 마이크로바이옴의 중요성을 시사하는 지식에도 불구하고3,13 장내 마이크로바이옴이 장 신경계와 어떻게 상호 작용하는지, 그리고 더 나아가 뇌와 어떻게 상호 작용하는지는 거의 알려져 있지 않습니다.
장내 마이크로바이옴과 신경계 사이의 상호작용을 연구하는 대표적인 모델은 지금까지 발견되지 않았습니다. 장-뇌 축(gut-brain axis)에 관한 연구는 전통적으로 쥐 모델(murine model)을 사용하여 수행되어 왔다13. 생쥐와 인간은 게놈 염기서열의 85%를 공유하지만14, 생쥐와 인간을 비교할 때 고려해야 할 중요한 차이점이 있다. 장과 관련하여 인간에 비해 쥐는 독점적으로 초식 동물이라는 점에 유의하는 것이 중요합니다. 그 결과, 위장관의 길이와 특징이 다르는데, 예를 들어 '위 배출'(gastric emptying)이 그것이다.14 쥐의 뇌는 또한 쥐와 인간의 전체적인 구조가 다르다는 중요한 차이점을 보여준다15. 중요한 것은, 인간은 신경 전구 세포의 세포주기 시간이 더 길다는 것이다15. 따라서 장 및 신경 세포를 포함한 인간 유래 세포를 포함하는 대표 모델을 개발하는 것이 중요하다5. 이러한 맥락에서 시험관 모델을 통해 보다 재현성 있는 연구를 개발하면 동물 모델을 사용할 필요성이 줄어들고 재현성이 향상됩니다.
neuroHuMiX는 이전 HuMiX 모델9의 고급 버전입니다. HuMiX는 상피 세포와 박테리아 세포의 근접 및 대표 공동 배양을 가능하게 하는 gut-on-a-chip 모델입니다. 세포 간 통신은 반투과성 막을 통한 분비 인자 및 대사 산물의 근위 공동 배양 및 확산을 통해 가능합니다. 그러나 인간의 장내 환경을 연구하기 위한 초기 장치의 유용성을 확장하기 위해서는 추가적인 세포 유형의 도입이 필요합니다. 이 문제를 해결하기 위해 iPSC 유래 EN의 도입으로 개발된 neuroHuMiX는 박테리아, 장 상피 세포 및 EN의 근위 공동 배양을 가능하게 합니다. 그 결과로 나온 체외 모델을 통해 인간 신경계와 관련된 인간 장내 마이크로바이옴에 관한 질문을 해결할 수 있습니다. 서로 다른 세포 유형, 특히 포유류 세포와 박테리아의 공동 배양은 생존력 손실, 접착력 저하 및 합류16의 전반적인 손실을 포함하여 몇 가지 문제가 있습니다. 여기에서 우리는 이 장치 내에서 세포 생존율을 높게 유지하면서 동일한 시스템 내에서 세 가지 다른 세포 유형을 공동 배양할 수 있음을 입증했습니다.
프로토콜의 중요한 단계는 장치에 접종하기 전에 신경 세포의 밀도(80%-90% 세포 밀도 및 생존율)를 보장하는 것입니다. 실행 중에는 세포 성장을 평가할 수 없기 때문에 모델에 세포를 도입하기 전에 세포가 합류하고 잘 성장하는지 확인하는 것이 가장 중요합니다. 이것이 제한 요인이 될 수 있지만 장치 내에서 관찰되는 전반적인 생존 가능성과 밀도는 일반적으로 높습니다.
이 장치는 튜브 라인을 통해 연동 펌프에 연결됩니다. 각 셀 챔버에는 특정 튜빙 라인이 있습니다. 튜빙은 매체의 관류를 위해 연동 펌프를 사용할 수 있는 펌프 튜빙과 펌프 튜빙을 장치에 연결하는 튜빙 및 장치를 유출/폐기물 병에 연결하는 튜빙으로 구성됩니다. 샘플링 포트는 유출 매체의 접종 및 샘플링을 허용하기 위해 장치 전후에 포함됩니다. 각 챔버는 서로 다른 배지에 연결할 수 있어 각 개별 세포 유형에 가장 적합한 배양 조건을 제공할 수 있습니다. 각 챔버는 매체 공급에 대한 특정 요구 사항에 따라 열거나 닫을 수 있습니다. 이 장치에서 신경 챔버는 대부분의 실험 동안 닫힌 상태로 유지되는 반면 박테리아 및 상피 챔버는 항상 열려 있어 전체 실험 실행 동안 신선한 배지를 얻습니다. 매체가 중단 없이 흐르도록 하려면 튜브, 커넥터 또는 장치에 공기가 남아 있지 않도록 하는 것이 중요합니다. 따라서 먼저 프라이밍 단계에서 장치를 몇 분 동안 실행하는 것이 중요합니다. 이렇게 하면 문제가 해결되는 경우가 많습니다. 그렇지 않은 경우 유출의 3방향 스톱콕을 닫아 떨어지는 다른 라인 중 하나를 짧은 시간 동안 닫을 수 있습니다. 이렇게 하면 매체가 기포가 있는 라인으로 리디렉션되어 튜브를 통해 기포를 바깥쪽으로 밀어 문제를 해결합니다.
모든 세포 배양 실험에서 배지는 각 세포 유형마다 해당 배지가 있는 핵심 구성 요소입니다. 공동 배양 설정에서 배지는 배지에서 자라는 세포 유형뿐만 아니라 공동 배양 내의 다른 세포 유형과도 호환되어야 합니다. 이것은 장치에서도 다르지 않으며, 내부에 박테리아, 상피 및 신경 세포의 세 가지 다른 세포 유형이 있는 세 개의 다른 구획이 있기 때문에 추가적인 문제를 제기합니다. 그러나 우리는 10% FBS가 있는 RPMI 1640에 5% MRS를 추가하여 박테리아 배지를 변형시킴으로써 모든 세포 유형, 특히 박테리아 및 상피 세포가 시스템 내에서 성공적으로 공동 배양될 수 있음을 보여주었습니다. 그러나 장치에서는 서로 다른 세포 유형이 근접하여 공동 배양되므로 서로 직접 접촉하지 않습니다. 이것이 인간 장에서 세포 간의 직접적인 접촉을 완전히 대표하지 못하여 한계가 있지만, 근위부 및 대표성 공동 배양 조건은 다운스트림 분석에 강점이 됩니다. 용해성 인자는 서로 다른 챔버와 세포 유형 사이에서 교환됩니다. 따라서 세포는 여전히 서로 상호 작용하고 있습니다. 또한 세포 유형을 개별적으로 채취하고 분석할 수 있다는 사실을 통해 다양한 세포 유형(신경 세포 포함)에 대한 건강한 및/또는 질병 마이크로바이옴의 영향을 연구하여 세포 유형별 판독값을 결정/검색할 수 있습니다. 또 다른 한계는 각 실험이 끝날 때만 장치를 열고 세포를 확인할 수 있기 때문에 실험 실행 중에 세포의 형태를 추적할 수 없다는 것입니다.
우리가 아는 한, neuroHuMiX는 EN을 포함한 최초의 gut-on-a-chip 모델입니다. 이는 장내 미생물군과 장 신경계 사이의 통신을 밝히기 위한 단계입니다. 박테리아 종, 상피층 및 EN 간의 상호 작용을 조사할 수 있는 모델입니다. 그 설계를 통해 서로 다른 세포 유형에 의해 분비되는 용해성 인자의 교환과 서로에 미치는 영향을 연구할 수 있습니다. 앞으로는 iPSC 유래 EN뿐만 아니라 iPSC 유래 상피 세포를 장치 내부에 두어 장치를 개인화된 모델로 전환하는 것이 중요할 것입니다. 중요한 것은, 이 개인화된 모델은 프리바이오틱스(pre-biotics), 프로바이오틱스(pro-), 그리고 신바이오틱스(synbiotics)10,11를 테스트하고 잠재적으로 개인화된 스크리닝 및 치료적 접근법을 개발하기 위해 사용될 수 있다는 것이다 17. 개인화된 neuroHuMiX는 궁극적으로 인간 장내 마이크로바이옴의 '암흑 물질'과 장내 마이크로바이옴-신경계 축을 따라 신경계와의 상호 작용을 밝혀 치료 평가 및 개입을 위한 길을 열 수 있습니다.
우리는 장 신경계를 포함한 gut-on-a-chip을 가질 수 있다는 것이 장내 마이크로바이옴-신경계 축을 따른 상호 작용에 대한 연구와 이해를 진전시키는 데 중요하다는 결론을 내릴 수 있습니다. NeuroHuMiX를 사용하면 박테리아 종이 숙주 세포에 미치는 영향을 연구할 수 있으며 생리학적으로 훨씬 더 대표적인 방식으로 모델을 더욱 개선할 수 있는 좋은 기반을 제공합니다.
공개
P.W.는 특허 PCT/EP2013/056607, PCT/EP2016/062024, PCT/US2017/061602 및 PCT/EP2019/081424에 발명자로 등재됨을 선언합니다. P.W., C.S. 및 L.G.는 특허 LU503075에 발명자로 등재되어 있음을 선언합니다.
감사의 말
저자들은 K7 계열의 세포를 제공해준 Jared Sterneckert 박사에게 감사의 뜻을 전합니다. 또한 엔지니어링 측면에 도움을 준 애리조나 대학의 오랜 협력자인 Frederic Zenhausern 박사와 Matthew W. Barret 박사에게도 감사의 뜻을 전합니다. 또한 neuroHuMiX의 개략적인 표현을 설계하는 데 도움을 주신 Valentina Galata 박사님께도 감사드립니다. 이 프로젝트는 유럽 연합의 Horizon 2020 연구 및 혁신 프로그램(보조금 계약 863664)에 따라 유럽 연구 위원회(ERC)로부터 자금을 지원받았습니다. 그림 1 은 부분적으로 Biorender.com 사용하여 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-Mercaptoethanol | Sigma Aldrich | 10712 | |
| Aeration cannula (length: 1.10 diameter: 30 mm) | VWR (B.Braun) | BRAU4190050 | |
| Agar-agar | Merck Millipore | 1.01614.1000 | |
| Aluminium Crimp | Glasgerätebau Ochs | 102050 | |
| Ascorbic acid | Sigma Aldrich | A4544 | |
| B-27 Supplement Minus Vitamin A (50x) | Gibco | 12587-010 | |
| Bacterial Cell Membrane, pore size: 1 µm | VWR (Whatman) | 515-2084 | |
| Caco-2 cells | DSMZ | ACC169 | |
| Cell Counter & Analyzer CASY | OMNI Life Sceince | ||
| CHIR | Axon Mechem BV | CT99021 | |
| Collagen I, Rat Tail | Invitrogen | A1048301 | |
| Costar 6-well Clear Flat Bottom Ultra-Low Attachment Plates | Corning | 3471 | |
| Difco Lactobacilli MRS Broth | BD Biosciences | 288130 | |
| Discofix 3-way stopcock | B. Braun | BRAU40951111 | |
| DMEM/F12, no glutamine | Thermofisher Scientific | 21331020 | |
| Dulbecco's Phosphate-Buffered Saline, D-PBS | Sigma Aldrich | 14190-169 | |
| Essential 6 Medium | Thermofisher Scientific | A1516401 | |
| Essential 8 Medium | Thermofisher Scientific | A1517001 | |
| Female Luer Lock to Barb Connector | Qosina | 11733 | |
| FGF2 | R&D Systems | 233-FB | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Foetal Bovine Serum, FBS | Thermofisher Scientific | 10500-064 | |
| GDNF | PeproTech | 450-10 | |
| Human Cell Membrane, pore size: 50 nm | Sigma Aldrich (GE Healthcare) | WHA111703 | |
| HuMiX Gasket Collagen | Auer Precision | 216891-003 | |
| HuMiX Gasket Sandwich Bottom | Auer Precision | 216891-002 | |
| HuMiX Gasket Sandwich Top | Auer Precision | 216891-001 | |
| iPSC | Max Planck Institute for Molecular Biomedicine | K7 line | |
| L-Glutamine (200 mM) | Gibco | 25030081 | |
| Laminin from Engelbreth-Holmswarm | Sigma Aldrich | L2020 | |
| LDN193189 | Sigma Aldrich | SML0559 | |
| Limosilactobacillus reuteri | ATCC | 23272 | |
| Live/Dead BacLight Bacterial Viability kit | Thermofisher Scientific | L7012 | |
| Male Luer with Spin Lock to Barb | Qosina | 11735 | |
| Marprene tubing (0.8 mm x 1.6 mm) | Watson-Marlow | 902.0008.J16 | |
| Matrigel hESC-qualified matrix | Corning | 354277 | |
| Mucin, from porcine stomach | Sigma Aldrich | T3924 | |
| N2 Supplement (100x) | Gibco | 17502048 | |
| NEAA | Thermofisher Scientific | 11140050 | |
| Needle (length: 120 mm; diameter: 0.80 mm) | B.Braun (color code: green) | 466 5643 | |
| Needle (length: 40 mm; diameter: 0.70 mm) | Henke Sass Wolf (color code: black) | 4710007040 | |
| Needle (length: 80 mm; diameter: 0.60 mm) | B.Braun (color code: blue) | 466 5635 | |
| Neurobasal Medium | Gibco | 21103049 | |
| PE/Cy7 anti-human CD49d antibody | Biolegend | 304314 | |
| Penicillin-Streptomycin | Sigma Aldrich | P0781 | |
| Peristaltic pump | Watson-Marlow | 205CA | |
| Poly-L-ornithine Hydrobromide | Sigma Aldrich | P3655 | |
| Polycarbonate lids (HuMiX) | University of Arizona | HuMiX 1.0 / 2.0 | |
| Retinoic Acid | Sigma Aldrich | R2625 | |
| RLT Buffer (RNeasy Minikit) | Qiagen | 74104 | |
| RPMI 1640 Medium | Thermofisher Scientific | 72400-021 | |
| SB431542, ALK inhibitor | Abcam | ab120163 | |
| Serum bottles | Glasgerätebau Ochs | 102091 | |
| Syringe | BD Biosciences | 309110 | |
| Trypsin-EDTA solution | Sigma Aldrich | T3924 | |
| Y-27632 Dihydrochloride | R&D Systems | 1254 |
참고문헌
- Heintz-Buschart, A., Wilmes, P. Human gut microbiome: function matters. Trends in Microbiology. 26 (7), 563-574 (2018).
- Toor, D., et al. Dysbiosis disrupts gut immune homeostasis and promotes gastric diseases. International Journal of Molecular Sciences. 20 (10), 2432 (2019).
- Braak, H., de Vos, R. A. I., Bohl, J., Del Tredici, K. Gastric α-synuclein immunoreactive inclusions in Meissner's and Auerbach's plexuses in cases staged for Parkinson's disease-related brain pathology. Neuroscience Letters. 396 (1), 67-72 (2006).
- Schmit, K. J., et al. Dietary fibre deprivation and bacterial curli exposure shift gut microbiome and exacerbate Parkinson's disease-like pathologies in an alpha-synuclein-overexpressing mouse. bioRxiv. , (2022).
- Fritz, J. V., Desai, M. S., Shah, P., Schneider, J. G., Wilmes, P. From meta-omics to causality: experimental models for human microbiome research. Microbiome. 1 (1), 14 (2013).
- Fattahi, F., et al. Deriving human ENS lineages for cell therapy and drug discovery in Hirschsprung disease. Nature. 531 (7592), 105-109 (2016).
- Wu, Q., et al. Organ-on-a-chip: Recent breakthroughs and future prospects. BioMedical Engineering Online. 19 (1), 9 (2020).
- May, S., Evans, S., Parry, L. Organoids, organs-on-chips and other systems, and microbiota. Emerging Topics in Life Sciences. 1 (4), 385-400 (2017).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nature Communications. 7, 11535 (2016).
- Greenhalgh, K., et al. Integrated in vitro and in silico modeling delineates the molecular effects of a synbiotic regimen on colorectal-cancer-derived cells. Cell Reports. 27 (5), 1621-1632 (2019).
- Mao, J. H., et al. Genetic and metabolic links between the murine microbiome and memory. Microbiome. 8 (1), 53 (2020).
- Moysidou, C. M., Owens, R. M. Advances in modelling the human microbiome-gut-brain axis in vitro. Biochemical Society Transactions. 49 (1), 187-201 (2021).
- Kim, S., et al. Transneuronal propagation of pathologic α-synuclein from the gut to the brain models Parkinson's disease. Neuron. 103 (4), 627-641 (2019).
- Hugenholtz, F., de Vos, W. M. Mouse models for human intestinal microbiota research: a critical evaluation. Cellular and Molecular Life Sciences. 75 (1), 149-160 (2018).
- Marshall, J. J., Mason, J. O. Mouse vs man: Organoid models of brain development & disease. Brain Research. 1724, 146427 (2019).
- Goers, L., Freemont, P., Polizzi, K. M. Co-culture systems and technologies: taking synthetic biology to the next level. Journal of the Royal Society Interface. 11 (96), 20140065 (2014).
- Sedrani, C., Wilmes, P. Toward hypothesis-driven, personalized microbiome screening. Cell Reports Methods. 2 (1), 100139 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유