A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
عزل خلايا الكبد المتجددة بعد استئصال الكبد الجزئي في الفئران
In This Article
Summary
خلايا الكبد المحملة بالدهون متأصلة في تجديد الكبد ولكنها عادة ما تضيع عند الطرد المركزي المتدرج الكثافة. هنا ، نقدم بروتوكول عزل الخلايا الأمثل الذي يحتفظ بخلايا الكبد الدهنية ، مما ينتج عنه مجموعات تمثيلية من خلايا الكبد المتجددة بعد استئصال الكبد الجزئي في الفئران.
Abstract
تم استخدام استئصال الكبد الجزئي على نطاق واسع للتحقيق في تجديد الكبد في الفئران ، ولكن عزل الغلة العالية لخلايا الكبد القابلة للحياة لتطبيقات الخلية المفردة في المصب يمثل تحديا. لوحظ تراكم ملحوظ للدهون داخل خلايا الكبد المتجددة خلال أول 2 أيام من تجديد الكبد الطبيعي في الفئران. هذا ما يسمى بالتنكس الدهني المرتبط بالتجديد العابر (TRAS) مؤقت ولكنه يتداخل جزئيا مع المرحلة التكاثرية الرئيسية. تنقية تدرج الكثافة هي العمود الفقري لمعظم البروتوكولات الحالية لعزل خلايا الكبد الأولية. نظرا لأن التنقية المتدرجة تعتمد على كثافة الخلايا وحجمها ، فإنها تفصل بين مجموعات خلايا الكبد غير الدهنية والخلايا الكبدية الدهنية. لذلك ، غالبا ما تفقد خلايا الكبد الدهنية ، مما ينتج عنه أجزاء غير تمثيلية من خلايا الكبد.
يصف البروتوكول المقدم طريقة سهلة وموثوقة للعزل في الجسم الحي لتجديد خلايا الكبد بغض النظر عن محتواها من الدهون. يتم عزل خلايا الكبد من ذكور الفئران C57BL / 6 بعد 24-48 ساعة من استئصال الكبد من خلال نهج نضح كولاجيناز كلاسيكي من خطوتين. تدفع المضخة التمعجية القياسية المحاليل الدافئة عبر الوريد الأجوف السفلي القسطرة إلى البقايا ، باستخدام تقنية التروية الرجعية مع التدفق الخارجي عبر الوريد البابي. يتم فصل خلايا الكبد عن طريق كولاجيناز لإطلاقه من كبسولة جليسون. بعد الغسيل والطرد المركزي الدقيق ، يمكن استخدام خلايا الكبد لأي تحليلات المصب. في الختام ، تصف هذه الورقة تقنية مباشرة وقابلة للتكرار لعزل مجموعة تمثيلية من خلايا الكبد المتجددة بعد استئصال الكبد الجزئي في الفئران. قد تساعد هذه الطريقة أيضا في دراسة مرض الكبد الدهني.
Introduction
يمكن للكبد تجديد نفسه حتى بعد فقدان الأنسجة بشكل كبير. تتضح هذه القدرة التجديدية الفريدة بوضوح من خلال النموذج التجريبي لاستئصال الكبد الجزئي (70٪) ، والذي تم وصفه لأول مرة في الفئران من قبل هيغينز وأندرسون في عام 19311. في هذا النموذج ، تتم إزالة 70٪ من الكبد جراحيا من الحيوانات عن طريق قص فصوص الكبد الكبيرة. ثم تنمو الفصوص المتبقية من خلال تضخم تعويضي لاستعادة كتلة الكبد الأصلية في غضون أسبوع واحد تقريبا بعد الجراحة ، وإن كان ذلك دون استعادة بنية الكبد الأصلية 2,3. تم تطوير عمليات استئصال الكبد الإضافية بكميات متفاوتة من إزالة الأنسجة ، مثل استئصال الكبد الممتد بنسبة 86٪ حيث تكون بقايا الكبد صغيرة جدا بحيث لا يمكن استعادتها ، مما يؤدي في النهاية إلى فشل الكبد بعد استئصال الكبد (PHLF) والموت اللاحق في 30٪ -50٪ من الحيوانات4،5،6. تمكن هذه النماذج من دراسة تجديد الكبد الطبيعي والفاشل ، اعتمادا على كمية الأنسجة المقطوعة (الشكل 1).
على الرغم من أن نماذج الفئران من استئصال الكبد قد استخدمت بنجاح لسنوات عديدة ، إلا أن الأساليب التحليلية الأكثر تقدما لم تسمح إلا مؤخرا برؤية أعمق على مستوى الخلية الواحدة. بالنسبة لمعظم هذه الطرق ، ومع ذلك ، فإن وجود خلايا الكبد الفردية هو شرط أساسي أساسي. تعتمد معظم بروتوكولات عزل خلايا الكبد الأولية على تقنية نضح كولاجيناز من خطوتين وتنقية تدرج الكثافة اللاحقة لفصل خلايا الكبد القابلة للحياة عن الحطام وغير المتني ، وكذلك الخلايا الميتة7،8،9. تم وصف هذه الطريقة لأول مرة من قبل بيري وفريند في 196910 وتم تكييفها من قبل Seglen وزملائه في 197211,12. ومع ذلك ، نظرا لأن الطرد المركزي المتدرج يعتمد على كثافة الخلايا وحجمها ، فغالبا ما تفقد خلايا الكبد المحملة بالدهون أثناء التنقية القياسية. في حين أن هذه الخسارة قد تكون ضئيلة بالنسبة للعديد من الأسئلة البحثية ، إلا أنها جانب حاسم لتجديد الكبد المبكر. خلال أول 2 أيام ، تتراكم خلايا الكبد داخل كبد الفأر المتجدد الدهون ، وبالتالي تنمو في الحجم وتغمس في الكثافة. يعمل هذا التنكس الدهني العابر المرتبط بالتجديد (TRAS) على توفير وقود متجدد وهو مؤقت ، ولكنه يتداخل جزئيا مع المرحلة التكاثرية الرئيسية ويتم توزيعه بشكل غير متساو داخل فصيصات الكبد - الوحدات الوظيفية للكبد13,14. بعد استئصال الكبد الممتد بنسبة 86٪ ، يحدث TRAS أيضا ولكنه يستمر ، لأن التجدد متوقف ولا تتأكسد الدهون14. لذلك ، فإن التنقية المتدرجة لخلايا الكبد بعد استئصال الكبد بنسبة 70٪ أو 86٪ ستنتج كسور غير تمثيلية ، حيث يتم فقدان معظم خلايا الكبد المحملة بالدهون بسبب كثافتها المنخفضة15.
في بروتوكول العزل المعدل هذا ، يتم عزل خلايا الكبد من الفئران C57BL / 6 بعد 24-48 ساعة من استئصال الكبد من خلال نهج نضح كولاجيناز كلاسيكي من خطوتين. عادة ، يتم القنية والتروية من بقايا عزل الخلايا عن طريق الوريد البابي. ومع ذلك ، فإن المقاومة الوعائية البورتية في البقايا الصغيرة المتبقية بعد الاستئصال الكبير عالية16 ، وبالتالي فإن التروية حساسة. نظرا لأن الوريد الأجوف لا يتأثر باستئصال الكبد ، يمكن إجراء التروية بسهولة في الاتجاه الرجعي عن طريق قنية الوريد الأجوف. تدفع المضخة التمعجية القياسية المحاليل الدافئة عبر الوريد الأجوف السفلي القسطرة إلى بقايا الكبد ، باستخدام التروية الرجعية مع التدفق عبر الوريد البابي (الشكل التكميلي S1). يتم فصل خلايا الكبد عن طريق الكولاجين ويتم إطلاقها من كبسولة جليسون. بعد الغسيل والمعالجة الدقيقة لخلايا الكبد القابلة للحياة عن طريق العزل التدريجي باستخدام نهج الطرد المركزي منخفض السرعة ، يمكن استخدام خلايا الكبد لأي تحليلات المصب.
Protocol
كانت جميع التجارب على الحيوانات متوافقة مع اللوائح الفيدرالية السويسرية للحيوانات ووافق عليها المكتب البيطري في زيورخ (رقم 007/2017 ، 156/2019) لضمان رعاية الإنسان. تم الاحتفاظ بذكور الفئران C57BL / 6 الذين تتراوح أعمارهم بين 10-12 أسبوعا في دورة نهارية / ليلية لمدة 12 ساعة مع حرية الوصول إلى الطعام والماء. تألفت كل مجموعة تجريبية من ستة إلى ثمانية. راجع جدول المواد للحصول على التفاصيل المتعلقة بجميع المواد والمعدات والكواشف المستخدمة في هذا البروتوكول.
1. استئصال الكبد الجزئي في الفئران
- لاستئصال الكبد القياسي (70٪) ، قم بربط واستئصال الفص الجانبي الأيسر والجزء الأيمن من الفص المتوسط والجزء الأيسر من الفص المتوسط (الشكل 1 ب). لاستئصال الكبد الممتد (86٪)4 ، قم أيضا بإزالة الفصوص المذنبة والفص الأمامي الأيمن (الشكل 1C).
- ملاحظة: استئصال الكبد القياسي هو إجراء تم استخدامه في أبحاث تجديد الكبد لسنوات عديدة. تتوفر بروتوكولات لهذا الإجراء 3,17 ، بما في ذلك بروتوكول Mitchell and Willenbring 18 بمساعدة الفيديو. يمكن العثور على مزيد من التفاصيل حول التقنيات المستخدمة هنا لاستئصال الكبد في الملف التكميلي 1.
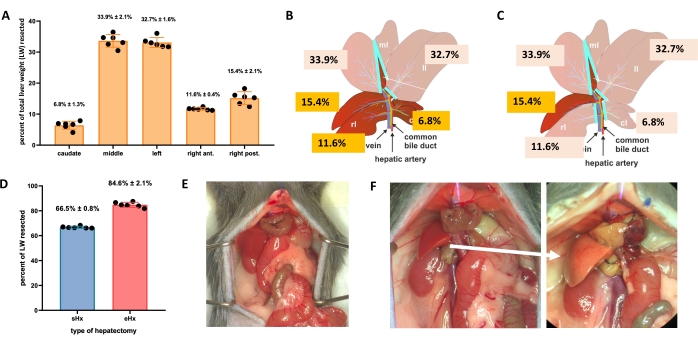
الشكل 1: استئصال الكبد القياسي (70٪) والممتد (86٪) في الفئران. أ: فصوص كبد الفأر الخمسة ومساهمات كل منها في الوزن الكلي للكبد. (ب) رسم تخطيطي لاستئصال الكبد بنسبة 70٪ في الفئران. تمثل الفصوص الداكنة بقايا الكبد المستقبلية. (ج) رسم تخطيطي لاستئصال الكبد بنسبة 86٪ في الفئران. تمثل الفصوص الداكنة بقايا الكبد المستقبلية. (د) الحجم الدقيق للأنسجة المقطوعة بعد استئصال الكبد بنسبة 70٪ و 86٪. (ه) بطن الفأر مباشرة بعد استئصال الكبد بنسبة 70٪ ؛ (F) بطن الفأر على الفور (يسار) و 48 ساعة (يمين) بعد 86٪ - استئصال الكبد. لاحظ اللون الشاحب للبقايا الصخرية (السهم الأبيض). ن = 6-7 / مجموعة. الاختصارات: sHx = استئصال الكبد القياسي. eHx = استئصال الكبد الممتد. LW = وزن الكبد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
2. تحضير محاليل التروية
- تحضير مخازن التروية والهضم والحفظ (انظر الجدول 1).
- اضبط الأس الهيدروجيني لجميع المحاليل العازلة عند 37 درجة مئوية عن طريق إضافة هيدروكسيد الصوديوم (NaOH) أو كلوريد الهيدروجين (HCl) حسب الحاجة. الرقم الهيدروجيني الأمثل للمخازن المؤقتة هو 7.4.
- ضع المخزن المؤقت للحفظ و Medium E من ويليامز على الجليد.
- تحضير المخزن المؤقت لقياس التدفق الخلوي وتخزينه على الجليد.
الجدول 1: المحاليل والمخازن المؤقتة المستخدمة لهضم وتنقية خلايا الكبد. الرجاء الضغط هنا لتنزيل هذا الجدول.
3. إعداد معدات التروية
- قم بتسخين حمام الماء إلى 42 درجة مئوية وضع محلول التروية (50 مل) ومخزن الهضم (10-20 مل) في حمام مائي. لا تضيف كولاجيناز إلى مخزن الهضم حتى الآن.
- تحضير المضخة التمعجية وإدخال الأنبوب. يوضح الشكل 2 الإعداد الكامل للتروية.
- قم بتوصيل قنية 26 G IV بنهاية مخرج الأنبوب باستخدام موصل قفل Luer. أدخل طرف مدخل الأنبوب في أنبوب التروية العازلة المسخن مسبقا في الحمام المائي. اغسل الأنبوب بنسبة 70٪ من الإيثانول ، متبوعا ب 50 مل من كلوريد الصوديوم المعقم (NaCl 0.9٪). قم بتجهيز الأنبوب بمخزن مؤقت للتروية الدافئة (سرعة المضخة 3 مل / دقيقة).
- قم بتخدير الفأر باستخدام تخدير استنشاق الأيزوفلوران (800 مل / دقيقة O 2 ، 3٪ -5٪ إيزوفلوران للتحريض و2٪ للصيانة أثناء العملية). تعامل مع الأيزوفلوران تحت غطاء المختبر ووفر تهوية كافية.
- يجب تطبيق البوبرينورفين تحت الجلد قبل 30 دقيقة من الجراحة بجرعة 0.1 ملغ/ كغ من وزن الجسم.
- لمنع انخفاض حرارة الجسم ، ضع الفأر المخدر على وسادة تدفئة وضع منديلا من القماش ملفوفا أسفل الجزء العلوي من البطن لرفع الكبد فوق الأعضاء الأخرى وتسهيل الوصول إلى الوريد الأجوف السفلي.
ملاحظة: لا تستخدم الأنسجة السميكة جدا لأن التواء الأوعية ممكن وستتأثر فعالية التروية. - أضف مرهم العين لمنع تلف القرنية.
- قبل البدء في الجراحة ، تأكد من تخدير الحيوان بشكل كاف عن طريق اختبار منعكس سحب الدواسة (قرصة وسادة القدم على كلا القدمين الخلفيتين). في حالة الاستجابة ، قم بتوفير تخدير إضافي وأعد الاختبار قبل بدء الإجراء.
- تنظيف البطن مع 70 ٪ من الإيثانول.
- أعد فتح شق خط الوسط عن طريق قطع الخيط وسحب حواف الجرح برفق. إذا كان استئصال الكبد أقدم من 24-48 ساعة ، فقم بإزالة الخيط وقطع الجلد بالمقص.
- ثبت خياطة البولي بروبلين 5-0 على القص ، واسحبها بشكل جمجمي ، وقم بإصلاحها في هذا الوضع. استخدم مبعدة أو مشابك بسيطة لإبقاء البطن مفتوحا. يجب كشف تجويف البطن قدر الإمكان لتحسين الوصول والتصور.
- حرك الأمعاء إلى اليمين باستخدام مسحات القطن للكشف عن الوريد البابي والوريد الأجوف. استخدم قطعة قماش مبللة للاحتفاظ بالأمعاء.
- ضع جسما ثقيلا يبلغ ارتفاعه حوالي 2 سم (على سبيل المثال ، حلقة وزن مطلية بالسيليكون للقوارير الحجمية) بجوار الأرجل الخلفية للفأر (الشكل التكميلي S2A). ضع الأنبوب مع قنية 26 G IV المتصلة على الجسم وضع الإبرة بعناية فوق الوريد الأجوف. اضبط طول الأنبوب.
- ضع محلول مخزون كولاجيناز المحضر في أنبوب عازلة للهضم المسخن مسبقا. أضف 250 ميكرولتر من محلول المرق إلى 10 مل من محلول الهضم. تحضير 10-20 مل من المخزن المؤقت الهضم لكل. بالنسبة للحيوانات الكبيرة أو تروية الكبد الكامل ، قم بإعداد ما يصل إلى 30 مل من محلول الهضم.
ملاحظة: يوصى بإضافة محلول مرق كولاجيناز إلى محلول الهضم الدافئ قبل 30 دقيقة تقريبا من بدء عملية الهضم.
الشكل 2: نظرة عامة على إعداد التروية. (أ) طاولة جراحية مع المعدات اللازمة للتروية. ب: المواد اللازمة لتحضير الكبد، وكذلك استخراج خلايا الكبد وعزلها. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
4. القنية والتروية
- اضبط سرعة المضخة على 3 مل / دقيقة وقم بتشغيل المضخة. دع المخزن المؤقت للتروية يصل إلى الإبرة. تخلص من أول 2-3 مل من محلول التروية.
- أداء قنية الوريد الأجوف السفلي.
- أثناء مرور المخزن المؤقت عبر الإبرة، أدخل قنية 26 G IV بزاوية ضحلة في الوريد الأجوف أسفل الكلى. تأكد من أن الإبرة مائلة تشير إلى الأعلى.
- استخدم قطعة قطن لسحب الوريد الأجوف برفق ذيليا أسفل موقع البزل بحيث يسهل التوتر المقدم إدخال القنية في الوريد. ابحث عن الدم في حجرة الفلاش للقسطرة عندما تدخل الإبرة التجويف.
- دفع الإبرة 2-3 مم إضافية للتأكد من أن طرف القسطرة البلاستيكية قد دخل الوريد أيضا.
- حرك القسطرة البلاستيكية فوق الإبرة وفي الوريد الأجوف 5 مم أخرى. قم بإزالة الإبرة ببطء وبعناية فائقة.
ملاحظة: لا ينصح بتثبيت القنية برباط. تستغرق هذه الخطوة وقتا طويلا حيث يجب أولا تشريح السفينة لهذا الغرض. إذا تم وضع القنية بشكل فضفاض ودعمها بجسم ما ، فلا يلزم إجراء مزيد من التثبيت (انظر إعداد التروية في الشكل التكميلي S2). لتثبيت موقع القنية ومنع التدفق العكسي ، يمكن إضافة قطرة واحدة من n-butyl-cyanoacrylate الأحادي إلى موقع القنية.
- عندما يسقط الدم من القنية ، املأه بمحلول التروية الدافئ باستخدام حقنة.
- أعد توصيل الأنبوب بالقنية ، ولا يزال يعمل بسرعة مضخة تبلغ 3 مل / دقيقة. دع المخزن المؤقت للتروية يدخل الكبد.
- بعد 2-3 ثوان ، ابحث عن بقع بيضاء تتشكل في الكبد و / أو توسع / تورم الوريد البابي ، مما يشير إلى أن مخزن التروية يتدفق عبر الكبد ويدخل فصيصات الكبد من الوريد المركزي (الشكل 3).
- انتظر حتى ينتفخ الوريد البابي بشكل واضح خلال 1-2 ثانية بعد ظهور بقع بيضاء على سطح الكبد. قطع الوريد البابي مع مقص بعيدا قدر الإمكان من هيلوس الكبد. استخدم مشبك وعاء صغير لتسمية (وليس إغلاق) موقع القطع (الشكل 3 ب).
ملاحظة: هذا يبسط تقييم التدفق عبر الكبد أثناء عملية التروية. ينظف الكبد من الدم على الفور ويتحول إلى اللون الأصفر والأبيض في غضون ثوان قليلة (الشكل 3C). يسهل القطع الإضافي عبر الجلد على الجانب الأيمن من فتحة البطن تدفق الدم وكذلك محلول التروية (الشكل 3B والشكل التكميلي S2B ، C). - زيادة التدفق حتى 4-7 مل / دقيقة اعتمادا على وزن الحيوان وحجم الكبد ومدى استئصال الكبد السابق.
- المشبك الوريد البابي مع ملاقط أو المشبك الوعائي لمدة 7-10 ثوان. تأكد من عدم مرور أي سوائل.
ملاحظة: يتضخم الكبد بشكل واضح أثناء التثبيت ويسترخي عند إطلاقه. هذا أمر بالغ الأهمية لطرد الكبد كله وتطهيره من أي دم متبقي. - قم بإجراء مشبك ثان بعد حوالي 30 ثانية وتأكد من تضخم الكبد واسترخاءه. استمر في طرد الحيوان حتى يصبح المخزن المؤقت المتدفق من الوريد البابي واضحا ، ولكن على الأقل لمدة 3-4 دقائق.
ملاحظة: تعتمد سرعة المضخة على الأنبوب وكذلك حجم الكبد. يجب تقييمه بشكل فردي. - في هذه المرحلة من الإجراء ، كان يجب أن يحدث القتل الرحيم بشكل ثانوي بعد الاستنزاف. تأكد من توقف الدورة الدموية الجهازية (لا توجد ضربات قلب أو وميض للقلب). لضمان الوفاة ، يتم إجراء استرواح الصدر الثنائي في هذه المرحلة من الإجراء كطريقة فيزيائية ثانوية للقتل الرحيم.
ملاحظة: قلل سرعة المضخة قليلا إذا توقفت الدورة الدموية الجهازية (لا توجد ضربات قلب أو وميض للقلب).
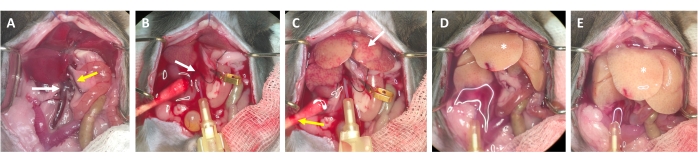
الشكل 3: عملية التروية من القنية إلى الهضم. أ: تشريح كبد الفأر مع الوريد الأجوف السفلي (السهم الأبيض) والوريد البابي (السهم الأصفر). ب: قنية الوريد الأجوف السفلي. يتم تأمين القنية برباط (سهم أبيض) ، ويتم تمييز موقع التدفق الخارجي عبر الوريد البابي المفتوح (غير مثبت) بمشبك وعاء صغير. (ج) لاحظ ظهور تراكيب غير مكتملة قبل أن يزيل مخزن التروية الكبد من كل الدم المتبقي (سهم أبيض). يتم شق الجلد (السهم الأصفر) ويتم وضع قطعة قطن لضمان تصريف الدم وسوائل التروية. يمكن إجراء لقط متقطع باستخدام مشبك أو ملاقط وعائية. (د) يجب تطهير الكبد من كل الدم (*). بعد دخول مخزن الهضم المحتوي على كولاجيناز إلى الكبد ، لن يسترخي بعد التثبيت وسيزداد حجم فصوص الكبد. (ه) بعد فترة، يمكن ملاحظة ظهور فقاعات على سطح الكبد (*). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
5. الهضم
- أوقف مضخة التروية مؤقتا وانقل أنبوب المدخل بسرعة من مخزن التروية المؤقت إلى محلول الهضم المسخن مسبقا. أعد تشغيل المضخة.
- قبل أن يصل المخزن المؤقت للهضم إلى الكبد ، قم بتثبيت الوريد البابي مرة أخرى لمدة 3-4 ثوان. تأكد من استرخاء الكبد عند إطلاق المشبك وبقاء سائل التروية صافيا.
ملاحظة: يحتوي محلول الهضم على الفينول الأحمر ويمكن تمييزه بسهولة عن المخزن المؤقت للتروية الشفافة. هذا يسمح لسهولة التتبع داخل الأنبوب. - بمجرد وصول المخزن المؤقت للهضم إلى الكبد ، قم بتثبيت الوريد البابي مرة أخرى بمشبك وعاء صغير.
ملاحظة: عند التثبيت ، يتضخم الكبد ولكنه لا يرتاح عند تحرير المشبك. هذا طبيعي. - لتسهيل عملية الهضم ، أغلق الوريد الأجوف العلوي بمشبك وعائي أسفل الحجاب الحاجز مباشرة للسماح لمخزن الهضم بالمرور من الوريد الأجوف السفلي إلى الكبد إلى التدفق الخارجي عبر الوريد البابي المفتوح.
ملاحظة: يضمن هذا التثبيت تجاوز الدورة الدموية الجهازية ومنع الاتصال غير الضروري بمكونات / مثبطات الدم المتبقية. هذه الخطوة اختيارية ، حيث يصعب الاقتراب من الوريد الأجوف العلوي خلف أنسجة الكبد المتضخمة بعد الجراحة الوهمية ، ولكن الوصول أسهل بكثير في الفئران التي تم استئصال الكبد. - هضم لمدة 4 دقائق تقريبا بمعدل تدفق 5 مل / دقيقة. مع تقدم عملية الهضم ، ابحث عن علامات بدء انتفاخ الكبد وأقسام صغيرة واضحة / شفافة على سطح الكبد. علاوة على ذلك ، لاحظ أن الكبد يأخذ نسيج قطعة قماش مبللة ويبدو رطبا تقريبا (الشكل 3E). تحقق من الاتساق عن طريق لمس بعناية بقطعة قطن مبللة.
- استمر في التروية حتى يمكن ملاحظة اختلاف ملحوظ في نسيج سطح الكبد. لاحظ أن الكبد يفترض لونا فاتحا جدا ومظهرا شمبانيا (الشكل 3E) ، وأن كبسولة جليسون (أي كيس الكبد) تنفصل عن الحمة. أوقف عملية الهضم بمجرد أن يكتسب الكبد هذه الخصائص ، لأن الإفراط في الهضم يمكن أن يتلف خلايا الكبد. قم بإزالة الإبرة قبل دخول الهواء إلى الكبد.
ملاحظة: عادة ما تكون هناك حاجة إلى 10-20 مل من محلول الهضم للوصول إلى الهضم الكافي. هذا يعتمد على حجم الحيوان ، ومدى استئصال الكبد ، وإعداد الأنابيب ، وجودة محلول الكولاجيناز. إذا لزم الأمر ، قم بزيادة وقت التروية بدلا من سرعة التروية. يمكن أن يؤدي الضغط الشديد في نظام الأوعية الدموية إلى انفجار الكبد وقد يفقد سائل التروية / الهضم في الفضاء خلف الصفاق.
6. تحضير الكبد
- إزالة الكبد بلطف من تجويف البطن. كن حذرا جدا لأنه الآن واهية وهشة للغاية.
- أمسك النسيج الضام المركزي بين الفصوص باستخدام الملقط وارفعه قليلا لأعلى ، باستخدامه كنقطة ربط.
- قطع جميع وصلات الكبد إلى الأعضاء الأخرى ، وإزالة المرارة ، ووضع الكبد في العازلة للحفاظ على الجليد.
ملاحظة: من الناحية المثالية ، يجب أن يتم استخراج خلايا الكبد والمعالجة الإضافية على الفور للحفاظ على صلاحية خلايا الكبد. ومع ذلك ، إذا لزم الأمر ، يمكن تخزين الكبد لفترة قصيرة عند 4 درجات مئوية (على سبيل المثال ، للنقل). يجب ألا يتجاوز هذا التأخير 30-40 دقيقة.
7. استخراج خلايا الكبد
- انقل الكبد إلى طبق بتري 10 سم وأضف 10 مل من Williams' Medium E المثلج.
- تمزق كبسولة جليسون بملاقط ذات أطراف دقيقة في مواقع قليلة على طول سطح الكبد. أمسك جزءا مركزيا (على سبيل المثال ، النسيج الضام في هيلوس الكبد) بزوجين من الملقط واسحبهما ببطء بعيدا ، مما يسمح للكبسولة بالتمزق دون إتلاف خلايا الكبد. حرر الخلايا عن طريق هز الكبسولة برفق (الشكل التكميلي S3).
ملاحظة: من الناحية المثالية ، يتمزق الكبد بسهولة ويطلق الخلايا. لا تستخدم القوة. يمكن أن تساعد مكشطة الخلايا في إزالة جميع الخلايا تماما وزيادة إنتاجية الخلايا. لا تقطع الكبد إلى قطع بالمقص. - قم بتصفية 5 مل من لب الكبد من خلال مصفاة خلية 100 ميكرومتر في أنبوب سعة 50 مل. شطف الفلتر مع 10 مل من وسط بارد الجليد الطازج. قم بتصفية 5 مل المتبقية من اللب من خلال مصفاة الخلية.
ملاحظة: استخدم ماصة مصلية سعة 25 مل لنقل لب الكبد مع خلايا الكبد المنفصلة (الشكل 4 أ). تزيد الماصات الأصغر ذات الفتحات الأصغر من إجهاد القص وتتلف خلايا الكبد بشكل لا رجعة فيه. - أضف ما مجموعه 30 مل من الوسط البارد لشطف طبق بتري ، وقم بترشيحه ، وأضف التعليق إلى أنبوب 50 مل حتى يمتلئ. جميع الخلايا المعزولة معلقة الآن (الشكل 4 ب).
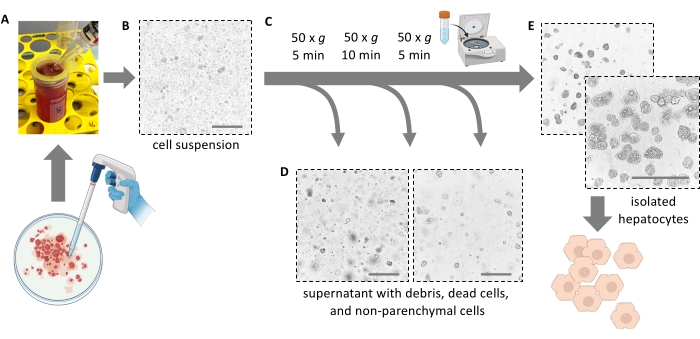
الشكل 4: التنقية بالطرد المركزي اللطيف. أ: تجانس الكبد المتبقي بعد خطوة الاستخراج. (ب) عرض مجهري (تكبير 20x) للمتجانسة ؛ لاحظ التلوث الملحوظ بالحطام. (ج) خطوات الطرد المركزي للتنقية، (د) المناظر المجهرية للطافات المراد التخلص منها. ه: المنظر المجهري لجزء الخلية الكبدية المنقاة. قضبان المقياس = 100 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
8. عزل خلايا الكبد
- تدور عند 50 × جم لمدة 5 دقائق عند 4 درجات مئوية (أقل تسارع وأقل فرامل ممكنة).
ملاحظة: خلايا الكبد أكثر كثافة من خلايا الكبد غير المتنية. بسبب قوة الطرد المركزي المنخفضة ، يتم تكوير خلايا الكبد فقط ، بينما تبقى الخلايا الأخرى (مثل الخلايا المناعية وكريات الدم الحمراء والخلايا الجيبية) في المادة الطافية. - نضح معظم المادة الطافية ، وترك 1 مل لإعادة تعليق الخلايا عن طريق تحريك الأنبوب برفق.
- أضف 40 مل من وسط Williams' E البارد وقم بتدويره مرة أخرى عند 50 × جم لمدة 10 دقائق عند 4 درجات مئوية (تسارع منخفض ، فرامل منخفضة) لإزالة خلايا الكبد الميتة وحطام الخلايا وخلايا الكبد الدهنية القابلة للحياة (الشكل 4C).
- تخلص من معظم المادة الطافية ، واترك 1 مل لإعادة تعليق الخلايا عن طريق تدوير الأنبوب.
- أضف 40 مل من وسط Williams' E البارد وقم بتدويره مرة أخرى عند 50 × جم لمدة 5 دقائق عند 4 درجات مئوية (تسارع منخفض ، فرامل منخفضة).
- نضح معظم المادة الطافية ، وترك 1 مل لإعادة تعليق الخلايا عن طريق تحريك الأنبوب برفق.
ملاحظة: لا توقف هذه العملية حتى يتم إصلاح الخلايا أو تحليلها. خلايا الكبد هشة للغاية وأي تأخير في عملية التروية والهضم والتنقية يمكن أن يتلف الخلايا. - حدد تركيز الخلية النهائي بعد إضافة التريبان الأزرق ، باستخدام غرفة عد محسنة من نيوباور.
ملاحظة: تمت الآن إزالة معظم الحطام والخلايا غير المتنية ، مما أدى إلى حبيبات نظيفة من حوالي 10-15 × 106 خلايا كبدية متبقية بعد استئصال الكبد بنسبة 70٪. - اعتمادا على التركيز المطلوب ، أضف المزيد من الوسط المثلج. استخدم معلق خلايا الكبد لأي تحليل نهائي أو ابدأ مزرعة خلية أولية.
ملاحظة: في هذه المرحلة ، يبقى عدد قليل فقط من الخلايا المناعية وغير المتنية (<5٪) في التعليق. إذا كنت ترغب في مزيد من التنقية ، فقم بإجراء اختيار سلبي لخلايا CD31 + و CD45 + عن طريق فرز الخلايا المنشط مغناطيسيا أو مضان (MACS / FACS). حتى الآن ، لا توجد علامة سطحية موثوقة وقوية لخلايا متني الكبد.
9. إعداد خلايا الكبد المعزولة لقياس التدفق الخلوي
- الطرد المركزي خلايا الكبد في 100 × غرام لمدة 5 دقائق.
- تخلص من المادة الطافية وأضف الكمية المطلوبة من المخزن المؤقت لقياس التدفق الخلوي ، اعتمادا على تركيز تعليق الخلية.
- أضف 1 مل من معلق الخلية في أنبوب قياس التدفق الخلوي. أجهزة الطرد المركزي لمدة 5 دقائق عند 100 × غرام والتخلص من المادة الطافية.
- أضف 100-200 ميكرولتر من صبغة الصلاحية الخضراء المخففة Alexa Fluor 488 Zombie (تركيز 1: 400) إلى الخلايا ورجها برفق. أعد تعليق خلايا الكبد بعناية عن طريق الاهتزاز اليدوي أو باستخدام خلاط دوامة بسرعة منخفضة (بحد أقصى 2-3) لمدة 2 ثانية.
ملاحظة: لا تستخدم أطراف الماصة الصغيرة لإعادة تعليق الخلايا. إنها هشة للغاية ويسبب إجهاد القص المطبق تلفا ويقلل من صلاحية الخلية. إذا لم يكن من الممكن تجنب السحب ، فاستخدم ماصة سعة 1000 ميكرولتر بعد قطع أصغر جزء من الطرف لتكبير القطر وماصة الخلايا ببطء شديد. - ضع الأنابيب على الثلج أو قم بتخزينها في درجة حرارة الغرفة ، اعتمادا على التلوين المطلوب. احتضان الخلايا لمدة 20-30 دقيقة في الظلام.
- أضف 2 مل من المخزن المؤقت لقياس التدفق الخلوي واغسل الخلايا 3x. طرد مركزي الخلايا بعد كل خطوة غسيل على 100 × غرام لمدة 5 دقائق.
- أضف 2 مل من المخزن المؤقت للتثبيت (1: 1 4٪ PFA و PBS). أعد تعليق خلايا الكبد بعناية عن طريق الاهتزاز اليدوي أو باستخدام خلاط دوامة بسرعة منخفضة (بحد أقصى 2-3) لمدة 2 ثانية.
- إصلاح الخلايا لمدة 30 دقيقة.
- جهاز طرد مركزي عند 100 × جم لمدة 5 دقائق أخرى ، وتخلص من المادة الطافية ، وأضف محلول قياس التدفق الخلوي.
ملاحظة: يمكن تخزين الخلايا في مخزن مؤقت لقياس التدفق الخلوي قبل التحليل حتى 72 ساعة بعد العزل.
10. تحليل خلايا الكبد مع قياس التدفق الخلوي
- تحليل خلايا الكبد باستخدام فارز الخلايا المنشط بالتألق.
ملاحظة: ضع في اعتبارك الحجم الكبير نسبيا لخلايا الكبد واضبط الفولتية. ابدأ بجهد منخفض ولا تزيد عن 350 فولت للتشتت الأمامي (FSC) و 220 فولت للتشتت الجانبي (SSC).- اضبط الفولتية ل FSC و SSC على الحجم الكبير المقدر للخلايا. تحديد عدد خلايا الكبد وتسجيل جميع الأحداث باستخدام SSC-A و FSC-A (الشكل 5A).
- لاحظ أن الحطام والخلايا غير المتنية معروضة في الزاوية اليسرى السفلية من مخطط كثافة FSC مقابل SSC ويتم استبعادها (الشكل 5A).
- نظرا لأن الخلايا المزدوجة يمكن أن تؤثر على التحليل ، فقم بإنشاء مخطط كثافة ارتفاع التشتت الجانبي (SSC-H) مقابل مساحة التشتت الجانبي (SSC-A) لاستبعاد الثنائيات ، كما هو موضح في الشكل 5B.
- حدد العدد النهائي لخلايا الكبد عن طريق بوابة خلايا CD31- (علامة البطانة) وخلايا CD45- (علامة المناعة) (الشكل 5C).
النتائج
يبلغ TRAS ذروته في 16 ساعة بعد استئصال الكبد ويختفي تدريجيا بعد 32-48 ساعة بعد استئصال الكبد القياسي ، لكنه يستمر بعد 48 ساعة بعد استئصال الكبد الممتد. من الناحية المجهرية ، يمكن رؤية TRAS بسهولة كبشرة شاحبة من بقايا الكبد (الشكل 1F) ويمكن ملاحظتها في الفئران التي تم استئصال الكبد في?...
Discussion
يوفر البروتوكول المنشور طريقة موثوقة ومباشرة لعزل غلة عالية من خلايا الكبد الفأر الطبيعية والدهنية لتحليلات المصب أحادية الخلية أو التحليل المجمع للخلايا بعد فرز FACS. الميزة المميزة لتنقية تدرج الكثافة هي أن محتوى الدهون الخلوية ليس له أي تأثير أساسي على العائد الفعال لخلايا الكبد. وبالت...
Disclosures
يعلن أصحاب البلاغ أنه ليس لديهم مصالح متنافسة.
Acknowledgements
تم دعم هذه الدراسة من قبل Swiss National Fond (منحة المشروع 310030_189262).
Materials
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
References
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N., Gayam, V., Engin, O. . Liver Pathology. , (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086 (2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222 (2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877 (2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, . Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved