Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento de hepatocitos regeneradores después de hepatectomía parcial en ratones
En este artículo
Resumen
Los hepatocitos cargados de lípidos son inherentes a la regeneración hepática, pero generalmente se pierden con la centrifugación por gradiente de densidad. Aquí, presentamos un protocolo de aislamiento celular optimizado que retiene hepatocitos esteatósicos, produciendo poblaciones representativas de hepatocitos regeneradores después de la hepatectomía parcial en ratones.
Resumen
La hepatectomía parcial se ha utilizado ampliamente para investigar la regeneración hepática en ratones, pero el aislamiento de altos rendimientos de hepatocitos viables para aplicaciones de células individuales aguas abajo es un desafío. Se observa una marcada acumulación de lípidos dentro de los hepatocitos regeneradores durante los primeros 2 días de regeneración hepática normal en ratones. Esta llamada esteatosis asociada a la regeneración transitoria (TRAS) es temporal, pero se superpone parcialmente a la fase proliferativa principal. La purificación por gradiente de densidad es la columna vertebral de la mayoría de los protocolos existentes para el aislamiento de hepatocitos primarios. Como la purificación de gradiente depende de la densidad y el tamaño de las células, separa las poblaciones de hepatocitos no esteatósicos de las esteatósicas. Por lo tanto, los hepatocitos grasos a menudo se pierden, produciendo fracciones de hepatocitos no representativas.
El protocolo presentado describe un método fácil y fiable para el aislamiento in vivo de hepatocitos regeneradores independientemente de su contenido lipídico. Los hepatocitos de ratones machos C57BL/6 se aíslan 24-48 h después de la hepatectomía mediante un enfoque clásico de perfusión de colagenasa de dos pasos. Una bomba peristáltica estándar impulsa las soluciones calentadas a través de la vena cava inferior cateterizada hacia el remanente, utilizando una técnica de perfusión retrógrada con flujo de salida a través de la vena porta. Los hepatocitos son disociados por la colagenasa para su liberación de la cápsula de Glisson. Después del lavado y la centrifugación cuidadosa, los hepatocitos se pueden usar para cualquier análisis posterior. En conclusión, este artículo describe una técnica sencilla y reproducible para el aislamiento de una población representativa de hepatocitos regeneradores después de la hepatectomía parcial en ratones. El método también puede ayudar al estudio de la enfermedad del hígado graso.
Introducción
El hígado puede regenerarse incluso después de una pérdida importante de tejido. Esta capacidad regenerativa única se ilustra explícitamente en el modelo experimental de hepatectomía parcial (70%), descrito por primera vez en ratas por Higgins y Anderson en 19311. En este modelo, el 70% del hígado se extirpa quirúrgicamente de los animales cortando lóbulos hepáticos más grandes. Los lóbulos restantes crecen a través de la hipertrofia compensatoria para restaurar la masa hepática original dentro de aproximadamente 1 semana después de la cirugía, aunque sin restauración de la arquitectura hepática original 2,3. Se han desarrollado hepatectomías adicionales con cantidades variables de extirpación de tejido, como la hepatectomía extendida al 86% donde el remanente hepático es demasiado pequeño para recuperarse, lo que finalmente conduce a insuficiencia hepática posthepatectomía (PHLF) y posterior muerte en 30% -50% de los animales 4,5,6. Estos modelos permiten estudiar la regeneración hepática normal y fallida, dependiendo de la cantidad de tejido resecado (Figura 1).
Aunque los modelos de hepatectomías en ratones se han utilizado con éxito durante muchos años, solo recientemente los métodos analíticos más avanzados han permitido una visión más profunda a nivel de una sola célula. Para la mayoría de estos métodos, sin embargo, la presencia de hepatocitos individuales es un requisito previo básico. La mayoría de los protocolos para el aislamiento de hepatocitos primarios se basan en una técnica de perfusión de colagenasa de dos pasos y la posterior purificación del gradiente de densidad para separar los hepatocitos viables de los desechos y no parenquimatosos, así como las células muertas 7,8,9. Este método fue descrito por primera vez por Berry y Friend en 196910 y adaptado por Seglen y colegas en 197211,12. Sin embargo, como la centrifugación por gradiente depende de la densidad y el tamaño de las células, los hepatocitos cargados de lípidos a menudo se pierden durante la purificación estándar. Si bien tal pérdida puede ser insignificante para muchas preguntas de investigación, es un aspecto crucial para la regeneración temprana del hígado. Durante los primeros 2 días, los hepatocitos dentro del hígado de ratón regenerador acumulan lípidos, creciendo así en tamaño y disminuyendo en densidad. Esta esteatosis asociada a la regeneración transitoria (TRAS) sirve para proporcionar combustible regenerativo y es temporal, pero se superpone parcialmente a la fase proliferativa principal y se distribuye de manera desigual dentro de los lóbulos hepáticos, las unidades funcionales del hígado13,14. Sin embargo, después de una hepatectomía extendida del 86%, la TRAS también ocurre pero persiste, porque la regeneración está estancada y los lípidos no se oxidan14. Por lo tanto, la purificación por gradiente de los hepatocitos después de hepatectomías al 70% u 86% producirá fracciones no representativas, ya que la mayoría de los hepatocitos cargados de lípidos se pierden debido a su baja densidad15.
En este protocolo de aislamiento modificado, los hepatocitos de ratones C57BL / 6 se aíslan 24-48 h después de la hepatectomía mediante un enfoque clásico de perfusión de colagenasa de dos pasos. Por lo general, la canulación y la perfusión del remanente para el aislamiento celular se realizan a través de la vena porta. Sin embargo, la resistencia portovascular en pequeños restos que quedan después de la resección mayor es alta16, y por lo tanto la perfusión es delicada. Debido a que la vena cava no se ve afectada por las hepatectomías, la perfusión se puede realizar fácilmente en la dirección retrógrada a través de la canulación de la vena cava . Una bomba peristáltica estándar impulsa las soluciones calentadas a través de la vena cava inferior cateterizada hacia el remanente hepático, utilizando perfusión retrógrada con flujo de salida a través de la vena porta (Figura suplementaria S1). Los hepatocitos son disociados por colagenasas y liberados de la cápsula de Glisson. Después del lavado y el procesamiento cuidadoso de hepatocitos viables mediante aislamiento gradual utilizando un enfoque de centrifugación de baja velocidad, los hepatocitos se pueden usar para cualquier análisis posterior.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todos los experimentos con animales fueron de acuerdo con las Regulaciones Federales Alimentarias Suizas y aprobados por la Oficina Veterinaria de Zurich (n° 007/2017, 156/2019) asegurando el cuidado humano. Los ratones machos C57BL / 6 de 10 a 12 semanas se mantuvieron en un ciclo de día / noche de 12 h con acceso gratuito a alimentos y agua. Cada grupo experimental consistió de seis a ocho animales. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, equipos y reactivos utilizados en este protocolo.
1. Hepatectomía parcial en ratones
- Para la hepatectomía estándar (70%), ligar y resecar el lóbulo lateral izquierdo, la porción derecha del lóbulo mediano y la porción izquierda del lóbulo mediano (Figura 1B). Para la hepatectomía prolongada (86%)4, también se eliminan los lóbulos caudados y el lóbulo anterior derecho (Figura 1C).
- NOTA: La hepatectomía estándar es un procedimiento que se ha utilizado en la investigación de la regeneración hepática durante muchos años. Los protocolos para este procedimiento están disponibles3,17, incluyendo el protocolo asistido por video de Mitchell y Willenbring18. Se pueden encontrar más detalles sobre las técnicas utilizadas aquí para las hepatectomías en el Archivo Suplementario 1.
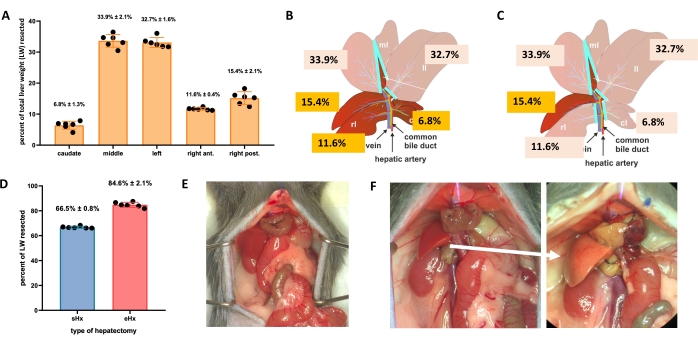
Figura 1: Hepatectomía estándar (70%) y extendida (86%) en ratones. (A) Los cinco lóbulos hepáticos del ratón y sus respectivas contribuciones al peso total del hígado. (B) Ilustración esquemática de hepatectomía al 70% en ratones. Los lóbulos oscuros representan el futuro remanente hepático. (C) Ilustración esquemática de hepatectomía al 86% en ratones. Los lóbulos oscuros representan el futuro remanente hepático. (D) Volumen preciso de tejido resecado después de la hepatectomía del 70% y 86%. (E) Abdomen de ratón inmediatamente después de la hepatectomía al 70%; (F) abdomen de ratón inmediatamente (izquierda) y 48 h (derecha) después de hepatectomía al 86%. Tenga en cuenta el color pálido del remanente esteatósico (flecha blanca). n = 6-7/grupo. Abreviaturas: sHx = hepatectomía estándar; eHx = hepatectomía prolongada; LW = peso del hígado. Haga clic aquí para ver una versión más grande de esta figura.
2. Preparación de las soluciones de perfusión
- Prepare los tampones de perfusión, digestión y conservación (ver Tabla 1).
- Ajustar el pH de todas las soluciones tampón a 37 °C añadiendo hidróxido de sodio (NaOH) o cloruro de hidrógeno (HCl) según sea necesario. El pH óptimo para los tampones es 7.4.
- Coloque el tampón de preservación y el Medio E de Williams en hielo.
- Prepare el tampón de citometría de flujo y guárdelo en hielo.
Tabla 1: Soluciones y tampones utilizados para la digestión y purificación de hepatocitos. Haga clic aquí para descargar esta tabla.
3. Preparación de equipos de perfusión
- Calentar el baño maría a 42 °C y colocar el tampón de perfusión (50 mL) y el tampón de digestión (10-20 mL) en el baño maría. No agregue colagenasa al tampón de digestión todavía.
- Prepare la bomba peristáltica e inserte el tubo. La configuración completa de la perfusión se muestra en la Figura 2.
- Conecte una cánula 26 G IV al extremo de salida del tubo mediante un conector de bloqueo Luer. Inserte el extremo de entrada del tubo en el tubo tampón de perfusión precalentado en el baño de agua. Enjuague el tubo con etanol al 70%, seguido de 50 ml de cloruro de sodio estéril (NaCl 0,9%). Prepare el tubo con tampón de perfusión caliente (velocidad de bombeo de 3 ml / min).
- Sedar al ratón con anestesia por inhalación de isoflurano (800 mL/minO2, 3% -5% isoflurano para inducción y 2% para mantenimiento durante el procedimiento). Manipule el isoflurano debajo de una campana de laboratorio y proporcione una ventilación adecuada.
- Administrar buprenorfina por vía subcutánea 30 min antes de la cirugía a una dosis de 0,1 mg/kg de peso corporal.
- Para prevenir la hipotermia, coloque el ratón sedado en una almohadilla de calentamiento y coloque un tejido de tela enrollado debajo de la parte superior del abdomen para elevar el hígado por encima de los otros órganos y facilitar el acceso a la vena cava inferior.
NOTA: No utilice tejido demasiado grueso ya que es posible que los vasos se retuerzan y la eficacia de la perfusión se vea afectada. - Agregue ungüento para los ojos para prevenir el daño corneal.
- Antes de comenzar la cirugía, asegúrese de que el animal esté adecuadamente anestesiado probando el reflejo de retirada del pedal (pellizco de la almohadilla del pie en ambas patas traseras). En caso de una respuesta, suministre anestesia adicional y vuelva a realizar la prueba antes de comenzar el procedimiento.
- Limpie el abdomen con etanol al 70%.
- Vuelva a abrir la incisión de la línea media cortando la sutura y separando suavemente los bordes de la herida. Si la hepatectomía tiene más de 24-48 h, retire la sutura y corte la piel con tijeras.
- Fije una sutura de polipropileno 5-0 al esternón, tire de él cranealmente y fíjelo en esta posición. Use un retractor o clips simples para mantener el abdomen abierto. La cavidad abdominal debe estar expuesta tanto como sea posible para optimizar el acceso y la visualización.
- Mueva los intestinos hacia la derecha usando hisopos de algodón para revelar la vena porta y la vena cava. Use un paño húmedo para retener los intestinos.
- Coloque un objeto pesado de aproximadamente 2 cm de altura (por ejemplo, un anillo de peso recubierto de silicona para matraces volumétricos) adyacente a las patas traseras del ratón (Figura suplementaria S2A). Coloque el tubo con la cánula 26 G IV conectada sobre el objeto y coloque la aguja cuidadosamente sobre la vena cava. Ajuste la longitud del tubo.
- Coloque la solución madre de colagenasa preparada en el tubo tampón de digestión precalentado. Añadir 250 μL de la solución madre a 10 ml de tampón de digestión. Prepare 10-20 ml de tampón de digestión por animal. Para animales más grandes o perfusión de hígados enteros, prepare hasta 30 ml de tampón de digestión.
NOTA: Se recomienda agregar la solución madre de colagenasa al tampón de digestión calentado aproximadamente 30 minutos antes del inicio del proceso de digestión.
Figura 2: Descripción general de la configuración de perfusión. (A) Mesa quirúrgica con el equipo necesario para la perfusión. (B) Los materiales necesarios para la preparación del hígado, así como la extracción y aislamiento de hepatocitos. Haga clic aquí para ver una versión más grande de esta figura.
4. Canulación y perfusión
- Ajuste la velocidad de la bomba a 3 ml/min y encienda la bomba. Deje que el tampón de perfusión precalentado llegue a la aguja. Deseche los primeros 2-3 ml de tampón de perfusión.
- Realizar la canulación de la vena cava inferior.
- Mientras el tampón pasa a través de la aguja, inserte la cánula 26 G IV en un ángulo poco profundo en la vena cava debajo del riñón. Asegúrese de que el bisel de la aguja apunte hacia arriba.
- Use un hisopo de algodón para tirar suavemente de la vena cava caudalmente por debajo del sitio de punción para que la tensión proporcionada facilite la inserción de la cánula en la vena. Busque sangre en la cámara de destello del catéter cuando la aguja entre en la luz.
- Avance la aguja 2-3 mm adicionales para asegurarse de que la punta del catéter de plástico también haya entrado en la vena.
- Deslice el catéter de plástico sobre la aguja y dentro de la vena cava otros 5 mm. Retire la aguja lentamente y con mucho cuidado.
NOTA: No se recomienda fijar la cánula con una ligadura. Este paso requiere mucho tiempo ya que el recipiente primero debe ser diseccionado para este propósito. Si la cánula está colocada libremente y apoyada con un objeto, no es necesaria ninguna fijación adicional (consulte la configuración de perfusión en la Figura suplementaria S2). Para estabilizar el sitio de la canulación y evitar el reflujo, se puede agregar una sola gota de n-butil-cianoacrilato monomérico en el sitio de la canulación .
- Cuando la sangre salga de la cánula, llénela con tampón de perfusión caliente con una jeringa.
- Vuelva a conectar el tubo a la cánula, que sigue funcionando a una velocidad de bombeo de 3 ml/min. Deje que el tampón de perfusión entre en el hígado.
- Después de 2-3 s, busque manchas blancas que se forman en el hígado y / o expansión / hinchazón de la vena porta, que indican que el tampón de perfusión fluye a través del hígado y entra en los lobulillos hepáticos desde la vena central (Figura 3).
- Espere a que la vena porta se hinche visiblemente dentro de 1-2 s después de la aparición de manchas blancas en la superficie del hígado. Corte la vena porta con tijeras lo más distalmente posible del hilio hepático. Use un clip de microrecipiente para etiquetar (no ocluir) el sitio de corte (Figura 3B).
NOTA: Esto simplifica la evaluación del flujo a través del hígado durante el proceso de perfusión. El hígado elimina la sangre instantáneamente y se vuelve amarillo-blanco en pocos segundos (Figura 3C). Un corte adicional a través de la piel en el lado derecho de la abertura abdominal facilita la salida de la sangre, así como la solución de perfusión (Figura 3B y Figura suplementaria S2B, C). - Aumentar el flujo hasta 4-7 mL/min dependiendo del peso del animal, el tamaño del hígado y la extensión de la hepatectomía previa.
- Pinza la vena porta con pinzas o pinza vascular durante 7-10 s. Asegúrese de que no esté pasando líquido.
NOTA: El hígado se hincha visiblemente durante el pinzamiento y se relaja al liberarse. Esto es crucial para limpiar todo el hígado y limpiarlo de cualquier resto de sangre. - Realice una segunda pinza después de aproximadamente 30 s y asegúrese de que el hígado se hinche y se relaje. Continúe enjuagando al animal hasta que el amortiguador que fluye fuera de la vena porta esté despejado, pero al menos durante 3-4 minutos.
NOTA: La velocidad de la bomba depende del tubo, así como del tamaño del hígado. Debe evaluarse individualmente. - En este punto del procedimiento, la eutanasia debería haber ocurrido secundaria a la exanguinación. Confirme que la circulación sistémica se ha detenido (sin latidos cardíacos ni parpadeo del corazón). Para asegurar la muerte, el neumotórax bilateral se realiza en esta etapa del procedimiento como método físico secundario de eutanasia.
NOTA: Reduzca ligeramente la velocidad de la bomba si la circulación sistémica se ha detenido (sin latidos cardíacos ni parpadeo del corazón).
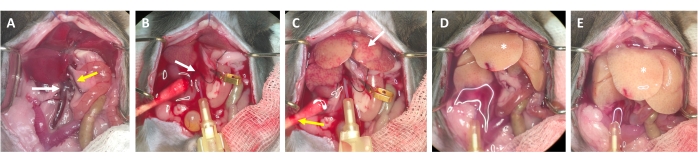
Figura 3: Proceso de perfusión desde la canulación hasta la digestión. (A) Anatomía del hígado del ratón con la vena cava inferior (flecha blanca) y la vena porta (flecha amarilla). (B) Canulación de la vena cava inferior. La cánula se asegura con una ligadura (flecha blanca), y la ubicación del flujo de salida a través de la vena porta abierta se marca (no se sujeta) con una abrazadera de microvaso. (C) Tenga en cuenta la aparición de estructuras irregulares antes de que el tampón de perfusión haya limpiado el hígado de toda la sangre restante (flecha blanca). La piel se incide (flecha amarilla) y se coloca un hisopo de algodón para asegurar el drenaje de la sangre y el líquido de perfusión. El pinzamiento intermitente se puede realizar con una pinza vascular o pinzas. (D) El hígado debe ser limpiado de toda la sangre (*). Después de que el tampón de digestión que contiene colagenasa haya entrado en el hígado, ya no se relajará después del pinzamiento y los lóbulos del hígado aumentarán de tamaño. (E) Después de un tiempo, se puede observar una apariencia burbujeante en la superficie del hígado (*). Haga clic aquí para ver una versión más grande de esta figura.
5. Digestión
- Pause la bomba de perfusión y transfiera rápidamente el tubo de entrada del tampón de perfusión al tampón de digestión precalentado. Reinicie la bomba.
- Antes de que el tampón de digestión llegue al hígado, sujete la vena porta una vez más durante 3-4 s. Asegúrese de que el hígado se relaje al liberar la pinza y que el líquido de perfusión permanezca limpio.
NOTA: El tampón de digestión contiene rojo fenol y es fácilmente distinguible del tampón de perfusión transparente. Esto permite un fácil seguimiento dentro del tubo. - Tan pronto como el tampón de digestión haya llegado al hígado, sujete la vena porta una vez más con un clip de microvaso.
NOTA: Al pinzar, el hígado se hincha pero no se relaja al soltar la pinza. Esto es normal. - Para facilitar el proceso de digestión, cierre la vena cava superior con una pinza vascular directamente debajo del diafragma para permitir que el tampón de digestión pase de la vena cava inferior al hígado y a la salida a través de la vena porta abierta.
NOTA: Este pinzamiento asegura que se desvíe la circulación sistémica y se evite el contacto innecesario con componentes sanguíneos residuales/inhibidores. Este paso es opcional, ya que es difícil acercarse a la vena cava superior detrás del tejido hepático agrandado después de una cirugía simulada, pero el acceso es mucho más fácil en ratones hepatectomizados. - Digerir durante aproximadamente 4 min a un caudal de 5 mL/min. A medida que avanza la digestión, busque signos de que el hígado comienza a hincharse y pequeñas secciones claras / transparentes en la superficie del hígado. Además, observe que el hígado adquiere la textura de un trozo de tela húmedo y parece casi empapado (Figura 3E). Pruebe la consistencia tocando cuidadosamente con un hisopo de algodón húmedo.
- Continuar con la perfusión hasta que se pueda observar una marcada diferencia en la textura superficial del hígado. Observe que el hígado asume un color muy claro y una apariencia burbujeante (Figura 3E), y la cápsula de Glisson (es decir, el saco hepático) se separa del parénquima. Detenga el proceso de digestión tan pronto como el hígado haya adquirido estas propiedades, ya que la digestión excesiva puede dañar los hepatocitos. Retire la aguja antes de que el aire entre en el hígado.
NOTA: Por lo general, se necesitan 10-20 ml de tampón de digestión para alcanzar una digestión suficiente. Esto depende del tamaño del animal, la extensión de la hepatectomía, la configuración del tubo y la calidad de la solución de colagenasa. Si es necesario, aumente el tiempo de perfusión en lugar de la velocidad de perfusión. Demasiada presión en el sistema vascular puede hacer que el hígado reviente y el líquido de perfusión/digestión se pierda en el espacio retroperitoneal.
6. Preparación del hígado
- Retire el hígado suavemente de la cavidad abdominal. Tenga mucho cuidado ya que ahora es muy endeble y frágil.
- Agarre el tejido conectivo central entre los lóbulos con fórceps y levántelo ligeramente hacia arriba, usándolo como punto de anclaje.
- Corte todas las conexiones del hígado a otros órganos, retire la vesícula biliar y coloque el hígado en el tampón de preservación helado.
NOTA: Idealmente, la extracción de hepatocitos y el procesamiento posterior deben realizarse inmediatamente para mantener la viabilidad de los hepatocitos. Sin embargo, si es necesario, el hígado puede almacenarse durante un corto período de tiempo a 4 °C (por ejemplo, para el transporte). Este retraso no debe exceder los 30-40 minutos.
7. Extracción de hepatocitos
- Transfiera el hígado a una placa de Petri de 10 cm y agregue 10 ml de Medium E de Williams helado.
- Rompa la cápsula de Glisson con pinzas de punta fina en algunos lugares a lo largo de la superficie del hígado. Agarre una parte central (por ejemplo, tejido conectivo en el hilio hepático) con dos pares de pinzas y separe lentamente, permitiendo que la cápsula se desgarre sin dañar los hepatocitos. Liberar las células agitando suavemente la cápsula (Figura suplementaria S3).
NOTA: Idealmente, el hígado se desgarra fácilmente y libera las células. No aplique fuerza. Un raspador de células puede ayudar a eliminar completamente todas las células y aumentar el rendimiento celular. No corte el hígado en pedazos con tijeras. - Filtrar 5 ml de pulpa hepática a través de un filtro de células de 100 μm en un tubo de 50 ml. Enjuague el filtro con 10 ml de medio fresco helado. Filtre los 5 ml restantes de pulpa a través del filtro celular.
NOTA: Utilice una pipeta serológica de 25 ml para transferir la pulpa hepática con los hepatocitos disociados (Figura 4A). Las pipetas más pequeñas con aberturas más pequeñas aumentan el esfuerzo cortante y dañan irreversiblemente los hepatocitos. - Agregue un total de 30 ml de medio frío para enjuagar la placa de Petri, filtre y agregue la suspensión al tubo de 50 ml hasta que esté llena. Todas las células aisladas están ahora en suspensión (Figura 4B).
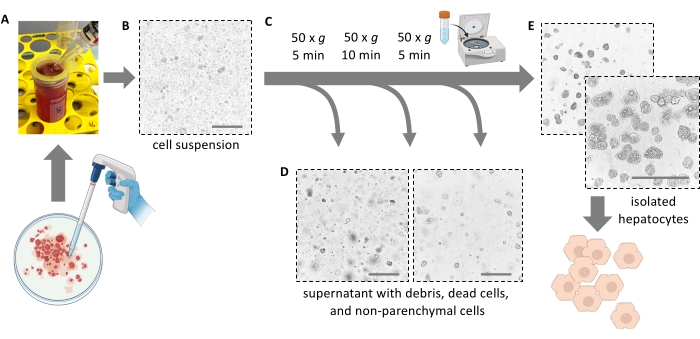
Figura 4: Purificación por centrifugación suave . (A) Homogeneizado hepático que queda después de la etapa de extracción. (B) Vista microscópica (aumento de 20x) del homogeneizado; Tenga en cuenta la marcada contaminación con escombros. (C) Pasos de centrifugación de purificación y (D) vistas microscópicas de los sobrenadantes que deben desecharse. (E) Vista microscópica de la fracción de hepatocitos purificada. Barras de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
8. Aislamiento de hepatocitos
- Girar a 50 × g durante 5 min a 4 °C (menor aceleración y menor frenado posible).
NOTA: Los hepatocitos son más densos que las células hepáticas no parenquimatosas. Debido a la baja fuerza de centrifugación, solo los hepatocitos se peletan, mientras que otras células (por ejemplo, células inmunes, eritrocitos y células sinusoidales) permanecen en el sobrenadante. - Aspire la mayor parte del sobrenadante, dejando 1 ml para resuspender las células girando suavemente el tubo.
- Añadir 40 ml de medio E de Williams frío y girar de nuevo a 50 × g durante 10 min a 4 °C (baja aceleración, freno bajo) para eliminar aún más los hepatocitos muertos y los restos celulares y los hepatocitos viables y grasos de pellets (Figura 4C).
- Deseche la mayor parte del sobrenadante, dejando 1 ml para resuspender las células girando el tubo.
- Añadir 40 ml de medio E de Williams frío y girar de nuevo a 50 × g durante 5 min a 4 °C (baja aceleración, bajo freno).
- Aspire la mayor parte del sobrenadante, dejando 1 ml para resuspender las células girando suavemente el tubo.
NOTA: No detenga este proceso hasta que las celdas estén fijadas o analizadas. Los hepatocitos son muy frágiles y cualquier retraso en el proceso de perfusión, digestión y purificación puede dañar las células. - Determinar la concentración celular final después de la adición de azul de tripano, utilizando una cámara de conteo mejorada con Neubauer.
NOTA: La mayoría de los desechos y células no parenquimatosas ahora se han eliminado, lo que resulta en un pellet limpio de aproximadamente 10-15 × 106 hepatocitos que quedan después de la hepatectomía al 70%. - Dependiendo de la concentración deseada, agregue más medio helado. Utilice la suspensión de células de hepatocitos para cualquier análisis posterior o inicie un cultivo celular primario.
NOTA: En esta etapa, solo quedan unas pocas células inmunes y no parenquimatosas (<5%) en la suspensión. Si se desea una purificación adicional, realice una selección negativa de células CD31+ y CD45+ mediante clasificación celular activada magnética o fluorescente (MACS/FACS). Hasta la fecha, no existe un marcador de superficie confiable y robusto para las células del parénquima hepático.
9. Preparación de los hepatocitos aislados para citometría de flujo
- Centrifugar los hepatocitos a 100 × g durante 5 min.
- Deseche el sobrenadante y agregue la cantidad deseada de tampón de citometría de flujo, dependiendo de la concentración de la suspensión celular.
- Agregue 1 ml de suspensión celular en un tubo de citometría de flujo. Centrifugar durante 5 min a 100 × g y desechar el sobrenadante.
- Agregue 100-200 μL del colorante de viabilidad verde Alexa Fluor 488 Zombie diluido (concentración 1:400) a las células y agítelas suavemente. Resuspender cuidadosamente los hepatocitos agitando manualmente o usando un mezclador de vórtice a baja velocidad (máximo 2-3) durante 2 s.
NOTA: No utilice puntas de pipeta pequeñas para resuspender las células. Son muy frágiles y el esfuerzo cortante aplicado causa daño y reduce la viabilidad celular. Si el pipeteo no es evitable, utilice una pipeta de 1.000 μL después de cortar la parte más pequeña de la punta para agrandar el diámetro y pipetear las células muy lentamente. - Coloque los tubos sobre hielo o guárdelos a temperatura ambiente, dependiendo de la mancha deseada. Incubar las células durante 20-30 minutos en la oscuridad.
- Agregue 2 ml de tampón de citometría de flujo y lave las células 3x. Centrifugar las células después de cada paso de lavado a 100 × g durante 5 min.
- Añadir 2 ml de tampón de fijación (1:1 4% PFA y PBS). Resuspender cuidadosamente los hepatocitos agitando manualmente o usando un mezclador de vórtice a baja velocidad (máximo 2-3) durante 2 s.
- Fijar las celdas durante 30 min.
- Centrifugar a 100 × g durante otros 5 minutos, desechar el sobrenadante y añadir tampón de citometría de flujo.
NOTA: Las células pueden almacenarse en tampón de citometría de flujo antes del análisis hasta 72 h después del aislamiento.
10. Análisis de hepatocitos con citometría de flujo
- Analice los hepatocitos utilizando un clasificador celular activado por fluorescencia.
NOTA: Considere el tamaño relativamente grande de los hepatocitos y ajuste los voltajes. Comience con un voltaje bajo y no supere los 350 V para la dispersión directa (FSC) y 220 V para la dispersión lateral (SSC).- Ajuste los voltajes para FSC y SSC al tamaño grande estimado de las celdas. Identificar la población de hepatocitos y registrar todos los eventos utilizando SSC-A y FSC-A (Figura 5A).
- Observe que los desechos y las células no parenquimatosas se muestran en la esquina inferior izquierda del gráfico de densidad FSC versus SSC y se excluyen (Figura 5A).
- Como las celdas dobletes pueden afectar el análisis, construya un diagrama de densidad de altura de dispersión lateral (SSC-H) versus área de dispersión lateral (SSC-A) para excluir dobletes, como se muestra en la Figura 5B.
- Seleccione la población final de hepatocitos mediante la activación de las células CD31- (marcador endotelial) y CD45- (marcador inmune) (Figura 5C).
Access restricted. Please log in or start a trial to view this content.
Resultados
El TRAS alcanza su punto máximo a las 16 h después de la hepatectomía y desaparece gradualmente 32-48 h después de la hepatectomía estándar, pero persiste más allá de 48 h después de la hepatectomía prolongada. Macroscópicamente, TRAS es fácilmente visible como una tez pálida del remanente hepático (Figura 1F) y se puede observar en ratones hepatectomizados entre 16 h y 48 h después de la cirugía.
El rendimiento final estimado es de 10-15 × 10 6 h...
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo publicado proporciona un método fiable y sencillo para aislar un alto rendimiento de hepatocitos murinos normales y esteatósicos para análisis descendentes unicelulares o análisis masivos de células después de la clasificación FACS. La clara ventaja sobre la purificación del gradiente de densidad es que el contenido de lípidos celulares no tiene esencialmente ningún impacto en el rendimiento efectivo de los hepatocitos. Por lo tanto, la fracción de hepatocitos esteatósicos se retendrá e incluir?...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores declaran que no tienen intereses contrapuestos.
Agradecimientos
Este estudio fue apoyado por el Fondo Nacional Suizo (subvención del proyecto 310030_189262).
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
Referencias
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados