È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Isolamento di epatociti rigeneranti dopo epatectomia parziale nei topi
In questo articolo
Riepilogo
Gli epatociti carichi di lipidi sono inerenti alla rigenerazione del fegato, ma di solito vengono persi con la centrifugazione a gradiente di densità. Qui, presentiamo un protocollo di isolamento cellulare ottimizzato che mantiene gli epatociti steatosici, producendo popolazioni rappresentative di epatociti rigeneranti dopo epatectomia parziale nei topi.
Abstract
L'epatectomia parziale è stata ampiamente utilizzata per studiare la rigenerazione epatica nei topi, ma l'isolamento di alte rese di epatociti vitali per applicazioni a valle di singole cellule è impegnativo. Un marcato accumulo di lipidi all'interno degli epatociti rigeneranti si osserva durante i primi 2 giorni di normale rigenerazione epatica nei topi. Questa cosiddetta steatosi associata alla rigenerazione transitoria (TRAS) è temporanea ma si sovrappone parzialmente alla fase proliferativa principale. La purificazione a gradiente di densità è la spina dorsale della maggior parte dei protocolli esistenti per l'isolamento degli epatociti primari. Poiché la purificazione del gradiente si basa sulla densità e sulla dimensione delle cellule, separa le popolazioni di epatociti non steatotici da quelli steatotici. Pertanto, gli epatociti grassi spesso vengono persi, producendo frazioni epatocitarie non rappresentative.
Il protocollo presentato descrive un metodo semplice e affidabile per l'isolamento in vivo degli epatociti rigeneranti indipendentemente dal loro contenuto lipidico. Gli epatociti di topi maschi C57BL/6 vengono isolati 24-48 ore dopo l'epatectomia mediante un classico approccio di perfusione della collagenasi in due fasi. Una pompa peristaltica standard guida le soluzioni riscaldate attraverso la vena cava inferiore cateterizzata nel resto, utilizzando una tecnica di perfusione retrograda con deflusso attraverso la vena porta. Gli epatociti sono dissociati dalla collagenasi per il loro rilascio dalla capsula di Glisson. Dopo il lavaggio e un'attenta centrifugazione, gli epatociti possono essere utilizzati per eventuali analisi a valle. In conclusione, questo articolo descrive una tecnica semplice e riproducibile per l'isolamento di una popolazione rappresentativa di epatociti rigeneranti dopo epatectomia parziale nei topi. Il metodo può anche aiutare lo studio della malattia del fegato grasso.
Introduzione
Il fegato può rigenerarsi anche dopo una grave perdita di tessuto. Questa capacità rigenerativa unica è esplicitamente illustrata dal modello sperimentale di epatectomia parziale (70%), descritto per la prima volta nei ratti da Higgins e Anderson nel 19311. In questo modello, il 70% del fegato viene rimosso chirurgicamente dagli animali tagliando i lobi del fegato più grandi. I lobi rimanenti crescono quindi attraverso l'ipertrofia compensatoria per ripristinare la massa epatica originale entro circa 1 settimana dopo l'intervento chirurgico, anche se senza ripristino dell'architettura epatica originale 2,3. Sono state sviluppate ulteriori epatectomie con quantità variabili di rimozione tissutale, come l'epatectomia estesa all'86% in cui il residuo epatico è troppo piccolo per recuperare, portando infine a insufficienza epatica postepatectomia (PHLF) e successiva morte nel 30% -50% degli animali 4,5,6. Questi modelli consentono lo studio della rigenerazione epatica normale e fallita, a seconda della quantità di tessuto resecato (Figura 1).
Sebbene i modelli murini di epatectomie siano stati utilizzati con successo per molti anni, solo recentemente i metodi analitici più avanzati hanno permesso una visione più approfondita a livello di singola cellula. Per la maggior parte di questi metodi, tuttavia, la presenza di singoli epatociti è un prerequisito di base. La maggior parte dei protocolli per l'isolamento degli epatociti primari si basano su una tecnica di perfusione della collagenasi in due fasi e sulla successiva purificazione del gradiente di densità per separare gli epatociti vitali dai detriti e dalle cellule morte non parenchimali, nonché dalle cellule morte 7,8,9. Questo metodo è stato descritto per la prima volta da Berry e Friend nel 196910 e adattato da Seglen e colleghi nel 197211,12. Tuttavia, poiché la centrifugazione a gradiente si basa sulla densità e sulle dimensioni delle cellule, gli epatociti carichi di lipidi vengono spesso persi durante la purificazione standard. Mentre tale perdita può essere trascurabile per molte domande di ricerca, è un aspetto cruciale per la rigenerazione precoce del fegato. Durante i primi 2 giorni, gli epatociti all'interno del fegato di topo rigenerante accumulano lipidi, crescendo così di dimensioni e diminuendo in densità. Questa steatosi associata alla rigenerazione transitoria (TRAS) serve a fornire carburante rigenerativo ed è temporanea, ma si sovrappone parzialmente alla fase proliferativa principale ed è distribuita in modo non uniforme all'interno dei lobuli epatici - le unità funzionali del fegato13,14. Dopo l'epatectomia estesa all'86%, tuttavia, si verifica anche TRAS ma persiste, perché la rigenerazione è in stallo e i lipidi non vengono ossidati14. Pertanto, la purificazione a gradiente degli epatociti dopo epatectomie al 70% o all'86% produrrà frazioni non rappresentative, poiché la maggior parte degli epatociti carichi di lipidi viene persa a causa della loro bassa densità15.
In questo protocollo di isolamento modificato, gli epatociti di topi C57BL/6 vengono isolati 24-48 ore dopo l'epatectomia mediante un classico approccio di perfusione della collagenasi in due fasi. Di solito, l'incannulamento e la perfusione del residuo per l'isolamento cellulare vengono eseguiti tramite la vena porta. Tuttavia, la resistenza portovascolare nei piccoli resti lasciati dopo la resezione maggiore è alta16, e quindi la perfusione è delicata. Poiché la vena cava rimane inalterata dalle epatectomie, la perfusione può essere facilmente eseguita in direzione retrograda tramite incannulamento della vena cava. Una pompa peristaltica standard guida le soluzioni riscaldate attraverso la vena cava inferiore cateterizzata nel residuo epatico, utilizzando la perfusione retrograda con deflusso attraverso la vena porta (Figura supplementare S1). Gli epatociti sono dissociati dalle collagenasi e rilasciati dalla capsula di Glisson. Dopo il lavaggio e l'attenta lavorazione degli epatociti vitali mediante isolamento graduale utilizzando un approccio di centrifugazione a bassa velocità, gli epatociti possono essere utilizzati per qualsiasi analisi a valle.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Tutti gli esperimenti sugli animali sono stati conformi alle prescrizioni federali svizzere sugli animali e approvati dall'Ufficio veterinario di Zurigo (n. 007/2017, 156/2019) che garantisce l'assistenza umana. I topi maschi C57BL/6 di età compresa tra 10 e 12 settimane sono stati tenuti in un ciclo giorno/notte di 12 ore con libero accesso a cibo e acqua. Ogni gruppo sperimentale era composto da sei a otto animali. Vedere la tabella dei materiali per i dettagli relativi a tutti i materiali, le attrezzature e i reagenti utilizzati in questo protocollo.
1. Epatectomia parziale nei topi
- Per l'epatectomia standard (70%), legare e resecare il lobo laterale sinistro, la porzione destra del lobo mediano e la porzione sinistra del lobo mediano (Figura 1B). Per l'epatectomia estesa (86%)4, rimuovere anche i lobi caudati e il lobo anteriore destro (Figura 1C).
- NOTA: L'epatectomia standard è una procedura che è stata utilizzata nella ricerca sulla rigenerazione del fegato per molti anni. I protocolli per questa procedura sono disponibili3,17, incluso il protocollo video-assistito di Mitchell e Willenbring18. Ulteriori dettagli sulle tecniche utilizzate qui per le epatectomie sono disponibili nel file supplementare 1.
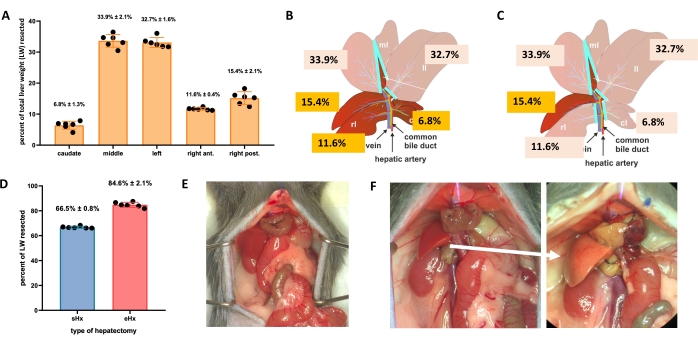
Figura 1: Epatectomia standard (70%) ed estesa (86%) nei topi. (A) I cinque lobi del fegato di topo e i loro rispettivi contributi al peso totale del fegato. (B) Illustrazione schematica dell'epatectomia al 70% nei topi. I lobi scuri rappresentano il futuro residuo di fegato. (C) Illustrazione schematica dell'epatectomia all'86% nei topi. I lobi scuri rappresentano il futuro residuo di fegato. (D) Volume preciso di tessuto resecato dopo epatectomia al 70% e all'86%. (E) Addome del topo immediatamente dopo 70%-epatectomia; (F) addome del topo immediatamente (a sinistra) e 48 ore (a destra) dopo l'86% di epatectomia. Si noti il colore pallido del residuo steatosico (freccia bianca). n = 6-7/gruppo. Abbreviazioni: sHx = epatectomia standard; eHx = epatectomia estesa; LW = peso del fegato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
2. Preparazione delle soluzioni di perfusione
- Preparare i tamponi di perfusione, digestione e conservazione (vedere Tabella 1).
- Regolare il pH di tutte le soluzioni tampone a 37 °C aggiungendo idrossido di sodio (NaOH) o acido cloridrico (HCl) secondo necessità. Il pH ottimale per i tamponi è 7,4.
- Posizionare il buffer di conservazione e il Medium E di Williams sul ghiaccio.
- Preparare il tampone citometrico a flusso e conservarlo sul ghiaccio.
Tabella 1: Soluzioni e tamponi utilizzati per la digestione e la purificazione degli epatociti. Clicca qui per scaricare questa tabella.
3. Preparazione dell'apparecchiatura di perfusione
- Riscaldare il bagnomaria a 42 °C e posizionare il tampone di perfusione (50 ml) e il tampone di digestione (10-20 ml) nel bagnomaria. Non aggiungere ancora collagenasi al tampone di digestione.
- Preparare la pompa peristaltica e inserire il tubo. La configurazione completa della perfusione è mostrata nella Figura 2.
- Collegare una cannula da 26 G IV all'estremità di uscita del tubo utilizzando un connettore Luer lock. Inserire l'estremità di ingresso del tubo nel tubo tampone di perfusione preriscaldato nel bagno d'acqua. Lavare il tubo con etanolo al 70%, seguito da 50 ml di cloruro di sodio sterile (NaCl 0,9%). Innescare il tubo con tampone di perfusione caldo (velocità della pompa di 3 mL/min).
- Sedare il topo usando l'anestesia per inalazione di isoflurano (800 mL/min O 2, 3%-5% isoflurano per l'induzione e2% per il mantenimento durante la procedura). Maneggiare l'isoflurano sotto una cappa da laboratorio e fornire un'adeguata ventilazione.
- Somministrare buprenorfina per via sottocutanea 30 minuti prima dell'intervento chirurgico alla dose di 0,1 mg/kg di peso corporeo.
- Per prevenire l'ipotermia, posizionare il topo sedato su un pad riscaldante e mettere un tessuto di stoffa arrotolato sotto l'addome superiore per elevare il fegato sopra gli altri organi e facilitare l'accesso alla vena cava inferiore.
NOTA: Non utilizzare tessuti troppo spessi in quanto è possibile attorcigliarsi dei vasi e l'efficacia della perfusione ne risenterebbe. - Aggiungi unguento per gli occhi per prevenire danni alla cornea.
- Prima di iniziare l'intervento, assicurarsi che l'animale sia adeguatamente anestetizzato testando il riflesso di ritiro del pedale (pizzico del cuscinetto su entrambi i piedi posteriori). In caso di risposta, fornire anestesia aggiuntiva e ripetere il test prima di iniziare la procedura.
- Pulire l'addome con etanolo al 70%.
- Riaprire l'incisione della linea mediana tagliando la sutura e separando delicatamente i bordi della ferita. Se l'epatectomia è più vecchia di 24-48 h, rimuovere la sutura e tagliare la pelle con le forbici.
- Fissare una sutura in polipropilene 5-0 allo sterno, tirarla cranicamente e fissarla in questa posizione. Utilizzare un divaricatore o semplici clip per mantenere l'addome aperto. La cavità addominale deve essere esposta il più possibile per ottimizzare l'accesso e la visualizzazione.
- Sposta l'intestino verso destra usando tamponi di cotone per rivelare la vena porta e la vena cava. Utilizzare un panno umido per trattenere l'intestino.
- Posizionare un oggetto pesante di circa 2 cm di altezza (ad esempio, un anello di peso rivestito di silicone per palloni volumetrici) accanto alle zampe posteriori del topo (figura supplementare S2A). Posizionare il tubo con la cannula 26 G IV collegata sull'oggetto e posizionare con attenzione l'ago sopra la vena cava. Regolare la lunghezza del tubo.
- Mettere la soluzione madre di collagenasi preparata nel tubo tampone di digestione preriscaldato. Aggiungere 250 μL della soluzione madre a 10 mL di tampone di digestione. Preparare 10-20 ml di tampone digestivo per animale. Per animali più grandi o perfusione di fegati interi, preparare fino a 30 ml di tampone digestivo.
NOTA: Si consiglia di aggiungere la soluzione madre di collagenasi al tampone di digestione riscaldato circa 30 minuti prima dell'inizio del processo di digestione.
Figura 2: Panoramica sulla configurazione della perfusione. (A) Tavolo chirurgico con l'attrezzatura necessaria per la perfusione. (B) I materiali necessari per la preparazione del fegato, nonché l'estrazione e l'isolamento degli epatociti. Fare clic qui per visualizzare una versione ingrandita di questa figura.
4. Incannulamento e perfusione
- Regolare la velocità della pompa a 3 ml/min e accendere la pompa. Lasciare che il tampone di perfusione preriscaldato raggiunga l'ago. Scartare i primi 2-3 ml di tampone di perfusione.
- Eseguire l'incannulamento della vena cava inferiore.
- Mentre il tampone scorre attraverso l'ago, inserire la cannula 26 G IV con un angolo poco profondo nella vena cava sotto il rene. Assicurarsi che la smussatura dell'ago punti verso l'alto.
- Utilizzare un batuffolo di cotone per tirare delicatamente la vena cava caudalmente sotto il sito di puntura in modo che la tensione fornita faciliti l'inserimento della cannula nella vena. Cerca sangue nella camera flash del catetere quando l'ago entra nel lume.
- Avanzare l'ago di altri 2-3 mm per assicurarsi che anche la punta del catetere di plastica sia entrata nella vena.
- Far scorrere il catetere di plastica sopra l'ago e nella vena cava di altri 5 mm. Rimuovere l'ago lentamente e con molta attenzione.
NOTA: Non è consigliabile fissare la cannula con una legatura. Questo passaggio richiede molto tempo in quanto la nave deve prima essere sezionata per questo scopo. Se la cannula è posizionata liberamente e sostenuta con un oggetto, non è necessaria alcuna ulteriore fissazione (vedere l'impostazione della perfusione nella figura supplementare S2). Per stabilizzare il sito di incannulazione e prevenire il riflusso, è possibile aggiungere una singola goccia di n-butil-cianoacrilato monomerico sul sito di incannulazione.
- Quando il sangue cade dalla cannula, riempirlo con tampone di perfusione caldo usando una siringa.
- Riattaccare il tubo alla cannula, ancora funzionante a una velocità della pompa di 3 ml/min. Lascia che il tampone di perfusione entri nel fegato.
- Dopo 2-3 secondi, cercare macchie bianche che si formano nel fegato e / o espansione / gonfiore della vena porta, che indicano che il tampone di perfusione scorre attraverso il fegato ed entra nei lobuli epatici dalla vena centrale (Figura 3).
- Attendere che la vena porta si gonfi visibilmente entro 1-2 secondi dopo la comparsa di macchie bianche sulla superficie del fegato. Tagliare la vena porta con le forbici il più distalmente possibile dall'ilo del fegato. Utilizzare una micro clip per recipienti per etichettare (non occludere) il sito di taglio (Figura 3B).
NOTA: Questo semplifica la valutazione del flusso attraverso il fegato durante il processo di perfusione. Il fegato si libera istantaneamente dal sangue e diventa giallo-bianco in pochi secondi (Figura 3C). Un ulteriore taglio attraverso la pelle sul lato destro dell'apertura addominale facilita il deflusso del sangue e la soluzione di perfusione (Figura 3B e Figura supplementare S2B,C). - Aumentare il flusso fino a 4-7 ml / min a seconda del peso dell'animale, delle dimensioni del fegato e dell'estensione dell'epatectomia precedente.
- Bloccare la vena porta con pinzette o morsetto vascolare per 7-10 s. Assicurarsi che non vi sia alcun fluido che stia attraversando.
NOTA: Il fegato si gonfia visibilmente durante il serraggio e si rilassa al momento del rilascio. Questo è fondamentale per lavare l'intero fegato e liberarlo da qualsiasi sangue residuo. - Eseguire un secondo morsetto dopo circa 30 secondi e assicurarsi che il fegato si gonfi e si rilassi. Continuare con il lavaggio dell'animale fino a quando il tampone che fuoriesce dalla vena porta è chiaro, ma almeno per 3-4 minuti.
NOTA: La velocità della pompa dipende dal tubo e dalle dimensioni del fegato. Deve essere valutato individualmente. - A questo punto della procedura, l'eutanasia avrebbe dovuto avvenire secondariamente al dissanguamento. Confermare che la circolazione sistemica si è fermata (nessun battito cardiaco o sfarfallio del cuore). Per garantire la morte, il pneumotorace bilaterale viene eseguito in questa fase della procedura come metodo fisico secondario di eutanasia.
NOTA: Ridurre leggermente la velocità della pompa se la circolazione sistemica si è fermata (nessun battito cardiaco o sfarfallio cardiaco).
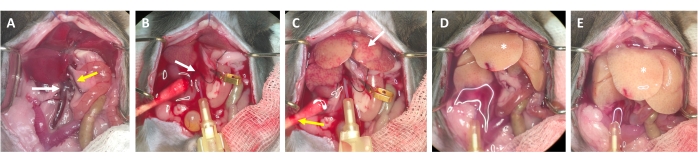
Figura 3: Processo di perfusione dall'incannulamento alla digestione. (A) Anatomia del fegato di topo con la vena cava inferiore (freccia bianca) e la vena porta (freccia gialla). (B) Incannulamento della vena cava inferiore. La cannula è fissata con una legatura (freccia bianca) e la posizione del deflusso attraverso la vena porta aperta è contrassegnata (non bloccata) con un morsetto micro vaso. (C) Notare la comparsa di strutture a chiazze prima che il tampone di perfusione abbia liberato il fegato da tutto il sangue rimanente (freccia bianca). La pelle viene incisa (freccia gialla) e viene posizionato un batuffolo di cotone per garantire il drenaggio del sangue e del liquido di perfusione. Il bloccaggio intermittente può essere eseguito con un morsetto vascolare o una pinzetta. (D) Il fegato deve essere eliminato da tutto il sangue (*). Dopo che il tampone di digestione contenente collagenasi è entrato nel fegato, non si rilasserà più dopo il serraggio e i lobi del fegato aumenteranno di dimensioni. (E) Dopo un po ', si può osservare un aspetto frizzante sulla superficie del fegato (*). Fare clic qui per visualizzare una versione ingrandita di questa figura.
5. Digestione
- Mettere in pausa la pompa di perfusione e trasferire rapidamente il tubo di ingresso dal tampone di perfusione al tampone di digestione preriscaldato. Riavviare la pompa.
- Prima che il tampone di digestione raggiunga il fegato, bloccare la vena porta ancora una volta per 3-4 s. Assicurarsi che il fegato si rilassi al rilascio del morsetto e che il liquido di perfusione rimanga chiaro.
NOTA: Il tampone di digestione contiene rosso fenolo ed è facilmente distinguibile dal tampone di perfusione chiaro. Ciò consente un facile tracciamento all'interno del tubo. - Non appena il tampone di digestione ha raggiunto il fegato, bloccare nuovamente la vena porta con una micro clip vascolare.
NOTA: Durante il bloccaggio, il fegato si gonfia ma non si rilassa al rilascio del morsetto. Questo è normale. - Per facilitare il processo di digestione, chiudere la vena cava superiore con un morsetto vascolare direttamente sotto il diaframma per consentire al tampone di digestione di passare dalla vena cava inferiore al fegato fino al deflusso attraverso la vena porta aperta.
NOTA: Questo bloccaggio assicura che la circolazione sistemica sia bypassata e che venga evitato il contatto non necessario con componenti / inibitori del sangue residui. Questo passaggio è facoltativo, in quanto è difficile avvicinarsi alla vena cava superiore dietro il tessuto epatico allargato dopo un intervento chirurgico fittizio, ma l'accesso è molto più facile nei topi epatectomizzati. - Digerire per circa 4 minuti ad una portata di 5 ml/min. Man mano che la digestione progredisce, cerca segni del fegato che inizia a gonfiarsi e piccole sezioni chiare / trasparenti sulla superficie del fegato. Inoltre, osservare che il fegato assume la consistenza di un pezzo di stoffa bagnato e appare quasi fradicio (Figura 3E). Sondare la consistenza toccando con attenzione con un batuffolo di cotone umido.
- Continuare con la perfusione fino a quando non si può osservare una marcata differenza nella consistenza superficiale del fegato. Si osservi che il fegato assume un colore molto chiaro e un aspetto frizzante (Figura 3E), e la capsula di Glisson (cioè il sacco del fegato) si separa dal parenchima. Interrompere il processo di digestione non appena il fegato ha acquisito queste proprietà, poiché l'eccessiva digestione può danneggiare gli epatociti. Rimuovere l'ago prima che l'aria entri nel fegato.
NOTA: Di solito sono necessari 10-20 ml di tampone di digestione per raggiungere una digestione sufficiente. Ciò dipende dalle dimensioni dell'animale, dall'estensione dell'epatectomia, dalla configurazione dei tubi e dalla qualità della soluzione di collagenasi. Se necessario, aumentare il tempo di perfusione piuttosto che la velocità di perfusione. Troppa pressione nel sistema vascolare può causare lo scoppio del fegato e il fluido di perfusione / digestione potrebbe essere perso nello spazio retroperitoneale.
6. Preparazione del fegato
- Rimuovere delicatamente il fegato dalla cavità addominale. Fate molta attenzione perché ora è molto fragile e fragile.
- Afferrare il tessuto connettivo centrale tra i lobi usando una pinza e sollevarlo leggermente verso l'alto, usandolo come punto di ancoraggio.
- Tagliare tutte le connessioni del fegato ad altri organi, rimuovere la cistifellea e posizionare il fegato nel tampone di conservazione ghiacciato.
NOTA: Idealmente, l'estrazione degli epatociti e l'ulteriore elaborazione dovrebbero avvenire immediatamente per mantenere la vitalità degli epatociti. Tuttavia, se necessario, il fegato può essere conservato per un breve periodo a 4 °C (ad es. per il trasporto). Questo ritardo non deve superare i 30-40 minuti.
7. Estrazione degli epatociti
- Trasferire il fegato in una capsula di Petri da 10 cm e aggiungere 10 ml di Medium E di Williams ghiacciato.
- Rompere la capsula di Glisson con pinzette a punta fine in alcuni punti lungo la superficie del fegato. Afferrare una parte centrale (ad esempio, tessuto connettivo all'ilo del fegato) con due paia di pinzette e separarle lentamente, permettendo alla capsula di strapparsi senza danneggiare gli epatociti. Rilasciare le cellule agitando delicatamente la capsula (Figura supplementare S3).
NOTA: Idealmente, il fegato si strappa facilmente e rilascia le cellule. Non applicare la forza. Un raschietto cellulare può aiutare a rimuovere completamente tutte le cellule e aumentare la resa cellulare. Non tagliare il fegato a pezzi con le forbici. - Filtrare 5 ml di polpa epatica attraverso un filtro cellulare da 100 μm in un tubo da 50 ml. Risciacquare il filtro con 10 ml di mezzo fresco ghiacciato. Filtrare i restanti 5 ml di polpa attraverso il filtro cellulare.
NOTA: Utilizzare una pipetta sierologica da 25 mL per trasferire la polpa epatica con gli epatociti dissociati (Figura 4A). Pipette più piccole con aperture più piccole aumentano lo sforzo di taglio e danneggiano irreversibilmente gli epatociti. - Aggiungere un totale di 30 ml di mezzo freddo per sciacquare la capsula di Petri, filtrarla e aggiungere la sospensione al tubo da 50 ml fino a quando non è pieno. Tutte le cellule isolate sono ora in sospensione (Figura 4B).
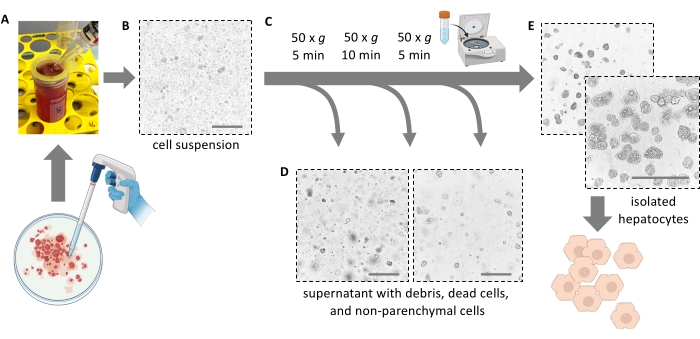
Figura 4: Purificazione mediante centrifugazione delicata . (A) Omogenato di fegato rimasto dopo la fase di estrazione. (B) Vista microscopica (ingrandimento 20x) dell'omogenato; Si noti la marcata contaminazione con detriti. (C) Fasi di centrifugazione di purificazione e (D) viste microscopiche dei surnatanti da eliminare. (E) Vista microscopica della frazione epatocitaria purificata. Barre di scala = 100 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.
8. Isolamento degli epatociti
- Girare a 50 × g per 5 minuti a 4 °C (accelerazione più bassa e freno più bassi possibili).
NOTA: Gli epatociti sono più densi delle cellule epatiche non parenchimali. A causa della bassa forza di centrifugazione, solo gli epatociti sono pellettati, mentre altre cellule (ad esempio, cellule immunitarie, eritrociti e cellule sinusoidali) rimangono nel surnatante. - Aspirare la maggior parte del surnatante, lasciando 1 mL per risospendere le cellule ruotando delicatamente il tubo.
- Aggiungere 40 ml di mezzo Williams' E freddo e ruotare nuovamente a 50 × g per 10 minuti a 4 °C (bassa accelerazione, freno basso) per rimuovere ulteriormente gli epatociti morti e i detriti cellulari e gli epatociti vitali e grassi del pellet (Figura 4C).
- Scartare la maggior parte del surnatante, lasciando 1 mL per risospendere le cellule ruotando il tubo.
- Aggiungere 40 mL di Williams' E medium freddo e girare di nuovo a 50 × g per 5 minuti a 4 °C (bassa accelerazione, freno basso).
- Aspirare la maggior parte del surnatante, lasciando 1 mL per risospendere le cellule ruotando delicatamente il tubo.
NOTA: non interrompere questo processo finché le celle non vengono fissate o analizzate. Gli epatociti sono molto fragili e qualsiasi ritardo nel processo di perfusione, digestione e purificazione può danneggiare le cellule. - Determinare la concentrazione finale della cellula dopo l'aggiunta di blu di tripano, utilizzando una camera di conteggio migliorata da Neubauer.
NOTA: La maggior parte dei detriti e delle cellule non parenchimali sono state rimosse, risultando in un pellet pulito di circa 10-15 × 106 epatociti rimasti dopo il 70% di epatectomia. - A seconda della concentrazione desiderata, aggiungere più mezzo ghiacciato. Utilizzare la sospensione di cellule epatocitarie per qualsiasi analisi a valle o iniziare una coltura cellulare primaria.
NOTA: In questa fase, solo poche cellule immunitarie e non parenchimali (<5%) rimangono nella sospensione. Se si desidera un'ulteriore purificazione, eseguire una selezione negativa delle celle CD31+ e CD45+ mediante selezione cellulare attivata magneticamente o a fluorescenza (MACS/FACS). Ad oggi, non esiste un marcatore di superficie affidabile e robusto per le cellule parenchimali del fegato.
9. Preparazione degli epatociti isolati per citometria a flusso
- Centrifugare gli epatociti a 100 × g per 5 minuti.
- Scartare il surnatante e aggiungere la quantità desiderata di tampone citometrico a flusso, a seconda della concentrazione della sospensione cellulare.
- Aggiungere 1 mL di sospensione cellulare in un tubo di citometria a flusso. Centrifugare per 5 minuti a 100 × g ed eliminare il surnatante.
- Aggiungere 100-200 μL del colorante vitalità verde Alexa Fluor 488 Zombie diluito (concentrazione 1:400) alle cellule e agitarle delicatamente. Risospendere con cautela gli epatociti agitando manualmente o utilizzando un miscelatore a vortice a bassa velocità (massimo 2-3) per 2 s.
NOTA: non utilizzare piccole punte di pipette per risospendere le celle. Sono molto fragili e lo stress di taglio applicato provoca danni e riduce la vitalità cellulare. Se il pipettaggio non è evitabile, utilizzare una pipetta da 1.000 μL dopo aver tagliato la parte più piccola dalla punta per allargare il diametro e pipettare le celle molto lentamente. - Posizionare i tubi sul ghiaccio o conservarli a temperatura ambiente, a seconda della colorazione desiderata. Incubare le cellule per 20-30 minuti al buio.
- Aggiungere 2 ml di tampone citometrico a flusso e lavare le cellule 3 volte. Centrifugare le celle dopo ogni fase di lavaggio a 100 × g per 5 minuti.
- Aggiungere 2 mL di tampone di fissazione (1:1 4% PFA e PBS). Risospendere con cautela gli epatociti agitando manualmente o utilizzando un miscelatore a vortice a bassa velocità (massimo 2-3) per 2 s.
- Fissare le celle per 30 minuti.
- Centrifugare a 100 × g per altri 5 minuti, eliminare il surnatante e aggiungere tampone citometrico a flusso.
NOTA: Le cellule possono essere conservate in tampone citometrico a flusso prima dell'analisi fino a 72 ore dopo l'isolamento.
10. Analisi degli epatociti con citometria a flusso
- Analizzare gli epatociti utilizzando un selezionatore cellulare attivato dalla fluorescenza.
NOTA: Considerare le dimensioni relativamente grandi degli epatociti e regolare le tensioni. Inizia con una bassa tensione e non andare oltre 350 V per la dispersione diretta (FSC) e 220 V per la dispersione laterale (SSC).- Regolare le tensioni per FSC e SSC in base alle grandi dimensioni stimate delle celle. Identificare la popolazione di epatociti e registrare tutti gli eventi utilizzando SSC-A e FSC-A (Figura 5A).
- Si osservi che i detriti e le celle non parenchimali sono visualizzati nell'angolo in basso a sinistra del grafico di densità FSC rispetto a SSC e sono esclusi (Figura 5A).
- Poiché le celle doppiette possono influenzare l'analisi, costruisci un grafico di densità SSC-H (side scatter height) rispetto a SSC-A (side scatter area) per escludere doppietti, come mostrato nella Figura 5B.
- Selezionare la popolazione finale di epatociti mediante il gating delle cellule CD31- (marcatore endoteliale) e CD45- (marcatore immunitario) (Figura 5C).
Access restricted. Please log in or start a trial to view this content.
Risultati
La TRAS raggiunge il picco a 16 ore dopo l'epatectomia e gradualmente scompare 32-48 ore dopo l'epatectomia standard, ma persiste oltre le 48 ore dopo l'epatectomia prolungata. Macroscopicamente, TRAS è facilmente visibile come una carnagione pallida del residuo epatico (Figura 1F) e può essere osservato in topi epatectomizzati tra 16 h e 48 h dopo l'intervento chirurgico.
La resa finale stimata è di 10-15 × 10 6 epatociti dopo epatectomia al 70% e ...
Access restricted. Please log in or start a trial to view this content.
Discussione
Il protocollo pubblicato fornisce un metodo affidabile e diretto per isolare un'alta resa di epatociti murini normali e steatotici per analisi a valle a singola cellula o analisi di massa di cellule dopo la selezione FACS. Il netto vantaggio rispetto alla purificazione del gradiente di densità è che il contenuto lipidico cellulare non ha essenzialmente alcun impatto sulla resa effettiva degli epatociti. Pertanto, la frazione di epatociti steatosici sarà mantenuta e inclusa nelle analisi a valle. Questo non è solo cru...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori dichiarano di non avere interessi concorrenti.
Riconoscimenti
Questo studio è stato sostenuto dal Fondo nazionale svizzero (sovvenzione 310030_189262).
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
Riferimenti
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon