Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement des hépatocytes régénérants après hépatectomie partielle chez la souris
Dans cet article
Résumé
Les hépatocytes chargés de lipides sont inhérents à la régénération du foie, mais sont généralement perdus lors de la centrifugation par gradient de densité. Ici, nous présentons un protocole d’isolement cellulaire optimisé qui conserve les hépatocytes stéatotiques, produisant des populations représentatives d’hépatocytes en régénération après hépatectomie partielle chez la souris.
Résumé
L’hépatectomie partielle a été largement utilisée pour étudier la régénération du foie chez la souris, mais l’isolement des rendements élevés d’hépatocytes viables pour des applications unicellulaires en aval est difficile. Une accumulation marquée de lipides au sein des hépatocytes en régénération est observée pendant les 2 premiers jours de régénération hépatique normale chez la souris. Cette stéatose associée à la régénération transitoire (TRAS) est temporaire mais chevauche partiellement la phase proliférative majeure. La purification par gradient de densité est l’épine dorsale de la plupart des protocoles existants pour l’isolement des hépatocytes primaires. Comme la purification par gradient repose sur la densité et la taille des cellules, elle sépare les populations d’hépatocytes non stéatotiques des populations d’hépatocytes stéatotiques. Par conséquent, les hépatocytes gras sont souvent perdus, produisant des fractions hépatocytes non représentatives.
Le protocole présenté décrit une méthode simple et fiable pour l’isolement in vivo des hépatocytes en régénération, quelle que soit leur teneur en lipides. Les hépatocytes de souris mâles C57BL/6 sont isolés 24 à 48 h après l’hépatectomie par une approche classique de perfusion de collagénase en deux étapes. Une pompe péristaltique standard conduit les solutions chauffées via la veine cave inférieure cathétérisée dans le reste, en utilisant une technique de perfusion rétrograde avec écoulement par la veine porte. Les hépatocytes sont dissociés par la collagénase pour leur libération de la capsule de Glisson. Après un lavage et une centrifugation soigneuse, les hépatocytes peuvent être utilisés pour toutes les analyses en aval. En conclusion, cet article décrit une technique simple et reproductible pour l’isolement d’une population représentative d’hépatocytes en régénération après hépatectomie partielle chez la souris. La méthode peut également aider à l’étude de la stéatose hépatique.
Introduction
Le foie peut se régénérer même après une perte tissulaire importante. Cette capacité de régénération unique est explicitement illustrée par le modèle expérimental d’hépatectomie partielle (70%), décrit pour la première fois chez le rat par Higgins et Anderson en 19311. Dans ce modèle, 70% du foie est enlevé chirurgicalement des animaux en coupant les lobes hépatiques plus gros. Les lobes restants se développent ensuite par hypertrophie compensatoire pour restaurer la masse hépatique d’origine dans environ 1 semaine après la chirurgie, mais sans restauration de l’architecture hépatique d’origine 2,3. D’autres hépatectomies avec des quantités variables d’ablation de tissus ont été développées, telles que l’hépatectomie étendue à 86% où le reste du foie est trop petit pour récupérer, conduisant éventuellement à une insuffisance hépatique post-hépatectomie (PHLF) et à la mort subséquente chez 30% à 50% des animaux 4,5,6. Ces modèles permettent d’étudier la régénération hépatique normale et défaillante, en fonction de la quantité de tissu réséqué (Figure 1).
Bien que les modèles murins d’hépatectomies soient utilisés avec succès depuis de nombreuses années, ce n’est que récemment que des méthodes analytiques plus avancées ont permis une compréhension plus approfondie au niveau de la cellule unique. Pour la plupart de ces méthodes, cependant, la présence d’hépatocytes individuels est une condition préalable de base. La plupart des protocoles d’isolement des hépatocytes primaires sont basés sur une technique de perfusion de collagénase en deux étapes et une purification subséquente par gradient de densité pour séparer les hépatocytes viables des débris et des cellules non parenchymateuses 7,8,9. Cette méthode a été décrite pour la première fois par Berry et Friend en 196910 et adaptée par Seglen et ses collègues en 197211,12. Cependant, comme la centrifugation par gradient dépend de la densité et de la taille des cellules, les hépatocytes chargés de lipides sont souvent perdus lors de la purification standard. Bien qu’une telle perte puisse être négligeable pour de nombreuses questions de recherche, il s’agit d’un aspect crucial pour la régénération précoce du foie. Au cours des 2 premiers jours, les hépatocytes dans le foie de souris en régénération accumulent des lipides, augmentant ainsi en taille et en densité. Cette stéatose transitoire associée à la régénération (TRAS) sert à fournir un carburant régénératif et est temporaire, mais chevauche partiellement la phase proliférative majeure et est inégalement répartie dans les lobules hépatiques - les unités fonctionnelles du foie13,14. Après une hépatectomie prolongée à 86%, cependant, TRAS se produit également mais persiste, car la régénération est bloquée et les lipides ne sont pas oxydés14. Par conséquent, la purification par gradient des hépatocytes après des hépatectomies à 70% ou 86% produira des fractions non représentatives, car la plupart des hépatocytes chargés de lipides sont perdus en raison de leur faible densité15.
Dans ce protocole d’isolement modifié, les hépatocytes de souris C57BL/6 sont isolés 24 à 48 h après l’hépatectomie par une approche classique de perfusion de collagénase en deux étapes. Habituellement, la canulation et la perfusion du reste pour l’isolement cellulaire se font via la veine porte. Cependant, la résistance portovasculaire dans les petits restes laissés après une résection majeure est élevée16, et donc la perfusion est délicate. Parce que la veine cave reste non affectée par les hépatectomies, la perfusion peut être facilement effectuée dans le sens rétrograde par canulation de la veine cave. Une pompe péristaltique standard conduit les solutions chauffées via la veine cave inférieure cathétérisée dans le reste du foie, en utilisant une perfusion rétrograde avec écoulement par la veine porte (figure supplémentaire S1). Les hépatocytes sont dissociés par les collagénases et libérés de la capsule de Glisson. Après lavage et traitement soigneux des hépatocytes viables par isolement progressif à l’aide d’une approche de centrifugation à basse vitesse, les hépatocytes peuvent être utilisés pour toutes les analyses en aval.
Access restricted. Please log in or start a trial to view this content.
Protocole
Toutes les expérimentations sur les animaux étaient conformes à la réglementation fédérale sur les animaux et approuvées par l’Office vétérinaire de Zurich (n° 007/2017, 156/2019) garantissant les soins aux humains. Les souris C57BL/6 mâles âgées de 10 à 12 semaines ont été maintenues sur un cycle jour/nuit de 12 h avec un accès gratuit à la nourriture et à l’eau. Chaque groupe expérimental était composé de six à huit animaux. Voir le tableau des matériaux pour plus de détails sur tous les matériaux, équipements et réactifs utilisés dans ce protocole.
1. Hépatectomie partielle chez la souris
- Pour l’hépatectomie standard (70 %), ligaturer et réséquer le lobe latéral gauche, la partie droite du lobe médian et la partie gauche du lobe médian (Figure 1B). Pour l’hépatectomie prolongée (86 %)4, enlever aussi les lobes caudés et le lobe antérieur droit (figure 1C).
- REMARQUE: L’hépatectomie standard est une procédure utilisée dans la recherche sur la régénération du foie depuis de nombreuses années. Les protocoles pour cette procédure sont disponibles3,17, y compris le protocole vidéo-assisté de Mitchell et Willenbring 18. De plus amples détails sur les techniques utilisées ici pour les hépatectomies se trouvent dans le dossier supplémentaire 1.
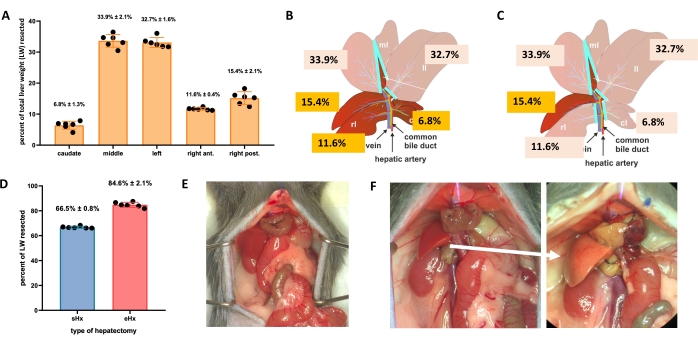
Figure 1 : Hépatectomie standard (70 %) et étendue (86 %) chez la souris. (A) Les cinq lobes hépatiques de souris et leurs contributions respectives au poids total du foie. (B) Illustration schématique de l’hépatectomie à 70% chez la souris. Les lobes sombres représentent le futur reste du foie. (C) Illustration schématique de l’hépatectomie à 86% chez la souris. Les lobes sombres représentent le futur reste du foie. (D) Volume précis de tissu réséqué après une hépatectomie à 70 % et 86 %. (E) Abdomen de souris immédiatement après une hépatectomie à 70%; (F) abdomen de souris immédiatement (gauche) et 48 h (droite) après 86%-hépatectomie. Notez la couleur pâle du reste stéatotique (flèche blanche). n = 6-7/groupe. Abréviations : sHx = hépatectomie standard; eHx = hépatectomie étendue; LW = poids du foie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Préparation des solutions de perfusion
- Préparer les tampons de perfusion, de digestion et de conservation (voir le tableau 1).
- Ajuster le pH de toutes les solutions tampons à 37 °C en ajoutant de l’hydroxyde de sodium (NaOH) ou du chlorure d’hydrogène (HCl) au besoin. Le pH optimal pour les tampons est de 7,4.
- Placez la zone tampon de préservation et le milieu E de Williams sur la glace.
- Préparez le tampon de cytométrie en flux et rangez-le sur de la glace.
Tableau 1 : Solutions et tampons utilisés pour la digestion et la purification des hépatocytes. Veuillez cliquer ici pour télécharger ce tableau.
3. Préparation de l’équipement de perfusion
- Réchauffer le bain-marie à 42 °C et placer le tampon de perfusion (50 mL) et le tampon de digestion (10-20 mL) dans le bain-marie. N’ajoutez pas encore de collagénase au tampon de digestion.
- Préparez la pompe péristaltique et insérez le tube. La configuration complète de la perfusion est illustrée à la figure 2.
- Connectez une canule IV 26 G à l’extrémité de sortie du tube à l’aide d’un connecteur Luer Lock. Insérez l’extrémité d’entrée du tube dans le tube tampon de perfusion préchauffé au bain-marie. Rincer le tube avec de l’éthanol à 70 %, puis 50 ml de chlorure de sodium stérile (NaCl 0,9 %). Amorcez le tube avec un tampon de perfusion chaud (vitesse de la pompe de 3 mL/min).
- Sédater la souris à l’aide d’une anesthésie par inhalation d’isoflurane (800 mL/minO2, 3 % à 5 % d’isoflurane pour l’induction et 2 % pour l’entretien pendant l’intervention). Manipuler l’isoflurane sous une hotte de laboratoire et assurer une ventilation adéquate.
- Administrer la buprénorphine par voie sous-cutanée 30 minutes avant la chirurgie à une dose de 0,1 mg / kg de poids corporel.
- Pour prévenir l’hypothermie, placez la souris sous sédation sur un coussin chauffant et placez un tissu en tissu roulé sous le haut de l’abdomen pour élever le foie au-dessus des autres organes et faciliter l’accès à la veine cave inférieure.
REMARQUE: N’utilisez pas de tissu trop épais car le pliage des vaisseaux est possible et l’efficacité de la perfusion serait affectée. - Ajouter une pommade pour les yeux pour prévenir les dommages à la cornée.
- Avant de commencer la chirurgie, assurez-vous que l’animal est anesthésié adéquatement en testant le réflexe de retrait de la pédale (pincement du coussinet plantaire sur les deux pattes postérieures). En cas de réponse, fournir une anesthésie supplémentaire et un nouveau test avant de commencer la procédure.
- Nettoyez l’abdomen avec de l’éthanol à 70%.
- Rouvrez l’incision médiane en coupant la suture et en écartant doucement les bords de la plaie. Si l’hépatectomie a plus de 24-48 h, retirez la suture et coupez la peau avec des ciseaux.
- Fixez une suture en polypropylène 5-0 au sternum, tirez-la crânienne et fixez-la dans cette position. Utilisez un rétracteur ou de simples clips pour garder l’abdomen ouvert. La cavité abdominale doit être exposée autant que possible pour optimiser l’accès et la visualisation.
- Déplacez les intestins vers la droite à l’aide de coton-tiges pour révéler la veine porte et la veine cave. Utilisez un chiffon humide pour retenir les intestins.
- Placez un objet lourd d’environ 2 cm de hauteur (p. ex., un anneau de poids recouvert de silicone pour les fioles jaugées) à côté des pattes postérieures de la souris (figure supplémentaire S2A). Placez le tube avec la canule IV 26 G connectée sur l’objet et positionnez soigneusement l’aiguille sur le dessus de la veine cave. Ajustez la longueur du tube.
- Mettez la solution mère de collagénase préparée dans le tube tampon de digestion préchauffé. Ajouter 250 μL de la solution mère à 10 mL de tampon de digestion. Préparer 10 à 20 ml de tampon de digestion par animal. Pour les gros animaux ou la perfusion de foies entiers, préparez jusqu’à 30 mL de tampon de digestion.
REMARQUE: Il est recommandé d’ajouter la solution mère de collagénase au tampon de digestion chauffé environ 30 minutes avant le début du processus de digestion.
Figure 2 : Vue d’ensemble de la configuration de la perfusion. (A) Table chirurgicale avec le matériel nécessaire à la perfusion. (B) Les matériaux nécessaires à la préparation du foie, ainsi qu’à l’extraction et à l’isolement des hépatocytes. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Canulation et perfusion
- Ajustez la vitesse de la pompe à 3 mL/min et allumez la pompe. Laissez le tampon de perfusion préchauffé atteindre l’aiguille. Jeter les 2 à 3 premiers mL de tampon de perfusion.
- Effectuer la canulation de la veine cave inférieure.
- Pendant que le tampon traverse l’aiguille, insérez la canule IV de 26 G à un angle peu profond dans la veine cave sous le rein. Assurez-vous que le biseau de l’aiguille pointe vers le haut.
- Utilisez un coton-tige pour tirer doucement la veine cave caudale sous le site de ponction afin que la tension fournie facilite l’insertion de la canule dans la veine. Recherchez du sang dans la chambre flash du cathéter lorsque l’aiguille pénètre dans la lumière.
- Avancez l’aiguille de 2 à 3 mm supplémentaires pour vous assurer que l’extrémité du cathéter en plastique est également entrée dans la veine.
- Faites glisser le cathéter en plastique sur l’aiguille et dans la veine cave encore 5 mm. Retirez l’aiguille lentement et très soigneusement.
REMARQUE: La fixation de la canule avec une ligature n’est pas recommandée. Cette étape prend beaucoup de temps car le récipient doit d’abord être disséqué à cette fin. Si la canule est positionnée lâchement et soutenue par un objet, aucune autre fixation n’est nécessaire (voir la configuration de la perfusion dans la figure supplémentaire S2). Pour stabiliser le site de canulation et éviter le refoulement, une seule goutte de n-butyl-cyanoacrylate monomère peut être ajoutée sur le site de canulation.
- Lorsque du sang tombe de la canule, remplissez-la avec un tampon de perfusion chaud à l’aide d’une seringue.
- Rattachez le tube à la canule, toujours en marche à une vitesse de pompe de 3 mL/min. Laissez le tampon de perfusion pénétrer dans le foie.
- Après 2-3 s, recherchez des taches blanches se formant dans le foie et/ou une expansion/gonflement de la veine porte, qui indiquent que le tampon de perfusion circule dans le foie et pénètre dans les lobules hépatiques à partir de la veine centrale (Figure 3).
- Attendez que la veine porte gonfle visiblement dans les 1-2 s après l’apparition de taches blanches à la surface du foie. Couper la veine porte avec des ciseaux aussi distalement que possible du hile du foie. Utiliser un microclip de récipient pour étiqueter (et non obstruer) le site de coupe (figure 3B).
REMARQUE: Cela simplifie l’évaluation du flux à travers le foie pendant le processus de perfusion. Le foie disparaît instantanément du sang et devient jaune-blanc en quelques secondes (Figure 3C). Une incision supplémentaire à travers la peau sur le côté droit de l’ouverture abdominale facilite l’écoulement du sang ainsi que la solution de perfusion (Figure 3B et Figure supplémentaire S2B,C). - Augmenter le débit jusqu’à 4-7 mL/min en fonction du poids de l’animal, de la taille du foie et de l’étendue de l’hépatectomie antérieure.
- Serrez la veine porte avec une pince à épiler ou une pince vasculaire pendant 7-10 s. Assurez-vous qu’aucun liquide ne passe.
REMARQUE: Le foie gonfle visiblement pendant le serrage et se détend lors de la libération. Ceci est crucial pour rincer tout le foie et le débarrasser de tout sang restant. - Effectuez une deuxième pince après environ 30 s et assurez-vous que le foie gonfle et se détend. Continuez à rincer l’animal jusqu’à ce que la zone tampon qui s’écoule de la veine porte soit claire, mais au moins pendant 3-4 minutes.
REMARQUE: La vitesse de la pompe dépend du tube ainsi que de la taille du foie. Il doit être évalué individuellement. - À ce stade de la procédure, l’euthanasie aurait dû avoir lieu à la suite de l’exsanguination. Confirmer que la circulation systémique a cessé (pas de battements cardiaques ou de scintillement du cœur). Pour assurer la mort, un pneumothorax bilatéral est effectué à ce stade de la procédure en tant que méthode physique secondaire d’euthanasie.
REMARQUE: Réduisez légèrement la vitesse de la pompe si la circulation systémique s’est arrêtée (pas de battement de cœur ou de scintillement du cœur).
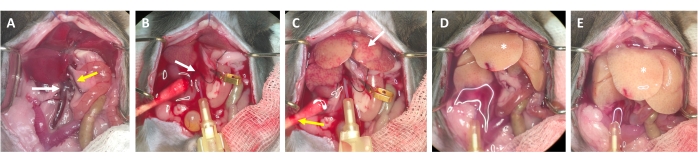
Figure 3 : Processus de perfusion de la canulation à la digestion. (A) Anatomie du foie de souris avec la veine cave inférieure (flèche blanche) et la veine porte (flèche jaune). (B) Canulation de la veine cave inférieure. La canule est fixée avec une ligature (flèche blanche) et l’emplacement de l’écoulement à travers la veine porte ouverte est marqué (non serré) avec une pince micro-vasculaire. (C) Notez l’apparition de structures inégales avant que le tampon de perfusion n’ait éliminé le foie de tout le sang restant (flèche blanche). La peau est incisée (flèche jaune) et un coton-tige est placé pour assurer le drainage du sang et du liquide de perfusion. Le clampage intermittent peut être effectué avec une pince vasculaire ou une pince à épiler. (D) Le foie doit être débarrassé de tout sang (*). Une fois que le tampon de digestion contenant de la collagénase est entré dans le foie, il ne se détendra plus après le serrage et les lobes du foie augmenteront en taille. (E) Après un certain temps, une apparence pétillante à la surface du foie peut être observée (*). Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. La digestion
- Mettez la pompe de perfusion en pause et transférez rapidement le tube d’admission du tampon de perfusion au tampon de digestion préchauffé. Redémarrez la pompe.
- Avant que le tampon de digestion n’atteigne le foie, serrez la veine porte une fois de plus pendant 3-4 s. Assurez-vous que le foie se détend lors de la libération de la pince et que le liquide de perfusion reste clair.
REMARQUE: Le tampon de digestion contient du rouge de phénol et se distingue facilement du tampon de perfusion clair. Cela permet un suivi facile dans le tube. - Dès que le tampon de digestion a atteint le foie, serrez à nouveau la veine porte avec un micro-clip vasculaire.
REMARQUE: Lors du serrage, le foie gonfle mais ne se relâche pas lors de la libération de la pince. C’est normal. - Pour faciliter le processus de digestion, fermez la veine cave supérieure avec une pince vasculaire directement sous le diaphragme pour permettre au tampon de digestion de passer de la veine cave inférieure au foie jusqu’à la sortie par la veine porte ouverte.
REMARQUE : Ce clampage permet de contourner la circulation systémique et d’éviter tout contact inutile avec des composants sanguins résiduels ou des inhibiteurs. Cette étape est facultative, car il est difficile d’approcher la veine cave supérieure derrière le tissu hépatique élargi après une chirurgie simulée, mais l’accès est beaucoup plus facile chez les souris hépatectomisées. - Assimiler pendant environ 4 minutes à un débit de 5 mL/min. Au fur et à mesure que la digestion progresse, recherchez des signes de gonflement du foie et de petites sections claires / transparentes à la surface du foie. De plus, observez que le foie prend la texture d’un morceau de tissu humide et semble presque détrempé (Figure 3E). Sondez la consistance en touchant soigneusement avec un coton-tige humide.
- Continuez avec la perfusion jusqu’à ce qu’une différence marquée dans la texture de surface du foie puisse être observée. Observez que le foie prend une couleur très claire et un aspect pétillant (Figure 3E), et que la capsule de Glisson (c’est-à-dire le sac de foie) se sépare du parenchyme. Arrêtez le processus de digestion dès que le foie a acquis ces propriétés, car une surdigestion peut endommager les hépatocytes. Retirez l’aiguille avant que l’air ne pénètre dans le foie.
REMARQUE: Habituellement, 10-20 mL de tampon de digestion sont nécessaires pour atteindre une digestion suffisante. Cela dépend de la taille de l’animal, de l’étendue de l’hépatectomie, de la configuration des tubes et de la qualité de la solution de collagénase. Si nécessaire, augmentez le temps de perfusion plutôt que la vitesse de perfusion. Trop de pression dans le système vasculaire peut provoquer l’éclatement du foie et le liquide de perfusion / digestion peut être perdu dans l’espace rétropéritonéal.
6. Préparation du foie
- Retirez doucement le foie de la cavité abdominale. Soyez très prudent car il est maintenant très fragile et fragile.
- Saisissez le tissu conjonctif central entre les lobes à l’aide d’une pince et soulevez-le légèrement vers le haut, en l’utilisant comme point d’ancrage.
- Coupez toutes les connexions du foie à d’autres organes, retirez la vésicule biliaire et placez le foie dans le tampon de conservation glacé.
NOTE: Idéalement, l’extraction des hépatocytes et le traitement ultérieur devraient avoir lieu immédiatement pour maintenir la viabilité des hépatocytes. Cependant, si nécessaire, le foie peut être stocké pendant une courte période à 4 °C (par exemple, pour le transport). Ce délai ne doit pas dépasser 30-40 min.
7. Extraction des hépatocytes
- Transférer le foie dans une boîte de Petri de 10 cm et ajouter 10 ml de Medium E de Williams glacé.
- Rupture de la capsule de Glisson avec une pince à épiler à pointe fine à quelques endroits le long de la surface du foie. Saisissez une partie centrale (par exemple, le tissu conjonctif au niveau du hile hépatique) avec deux paires de pinces à épiler et séparez-les lentement, permettant à la capsule de se déchirer sans endommager les hépatocytes. Relâchez les cellules en secouant doucement la capsule (Figure supplémentaire S3).
REMARQUE: Idéalement, le foie se déchire facilement et libère les cellules. N’appliquez pas la force. Un grattoir de cellules peut aider à éliminer complètement toutes les cellules et à augmenter le rendement cellulaire. Ne coupez pas le foie en morceaux avec des ciseaux. - Filtrer 5 mL de pulpe hépatique à travers une crépine cellulaire de 100 μm dans un tube de 50 mL. Rincer le filtre avec 10 ml de milieu frais glacé. Filtrer les 5 mL restants de pulpe à travers la passoire cellulaire.
REMARQUE : Utiliser une pipette sérologique de 25 mL pour transférer la pulpe hépatique avec les hépatocytes dissociés (figure 4A). Des pipettes plus petites avec des ouvertures plus petites augmentent la contrainte de cisaillement et endommagent irréversiblement les hépatocytes. - Ajouter un total de 30 ml de milieu froid pour rincer la boîte de Pétri, la filtrer et ajouter la suspension dans le tube de 50 ml jusqu’à ce qu’elle soit pleine. Toutes les cellules isolées sont maintenant en suspension (figure 4B).
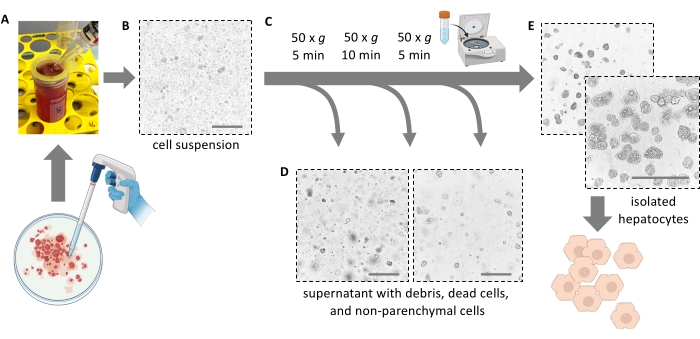
Figure 4 : Purification par centrifugation douce. (A) Homogénat hépatique laissé après l’étape d’extraction. (B) Vue microscopique (grossissement 20x) de l’homogénat; Notez la contamination marquée par des débris. (C) Étapes de centrifugation de purification et (D) vues microscopiques des surnageants à éliminer. (E) Vue microscopique de la fraction hépatocytaire purifiée. Barres d’échelle = 100 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
8. Isolement des hépatocytes
- Patinage à 50 × g pendant 5 min à 4 °C (accélération la plus faible et freinage le plus faible possible).
NOTE: Les hépatocytes sont plus denses que les cellules hépatiques non parenchymateuses. En raison de la faible force de centrifugation, seuls les hépatocytes sont granulés, tandis que d’autres cellules (par exemple, les cellules immunitaires, les érythrocytes et les cellules sinusoïdales) restent dans le surnageant. - Aspirer la majeure partie du surnageant, en laissant 1 mL pour remettre les cellules en suspension en faisant tourner doucement le tube.
- Ajouter 40 mL de milieu E froid de Williams et faire tourner de nouveau à 50 × g pendant 10 minutes à 4 °C (faible accélération, frein faible) pour éliminer davantage les hépatocytes morts et les débris cellulaires et les hépatocytes viables et gras en pastilles (figure 4C).
- Jeter la majeure partie du surnageant, en laissant 1 mL pour remettre les cellules en suspension en faisant tourbillonner le tube.
- Ajouter 40 ml de milieu mi froid de Williams et tourner de nouveau à 50 × g pendant 5 minutes à 4 °C (faible accélération, frein faible).
- Aspirer la majeure partie du surnageant, en laissant 1 mL pour remettre les cellules en suspension en faisant tourner doucement le tube.
Remarque : N’arrêtez pas ce processus tant que les cellules ne sont pas fixées ou analysées. Les hépatocytes sont très fragiles et tout retard dans le processus de perfusion, de digestion et de purification peut endommager les cellules. - Déterminer la concentration cellulaire finale après l’ajout de bleu de trypan, à l’aide d’une chambre de comptage améliorée par Neubauer.
REMARQUE: La plupart des débris et des cellules non parenchymateuses ont maintenant été enlevés, ce qui donne une pastille propre d’environ 10-15 × 106 hépatocytes laissés après une hépatectomie à 70%. - Selon la concentration désirée, ajouter plus de milieu glacé. Utiliser la suspension cellulaire hépatocytes pour toute analyse en aval ou initier une culture cellulaire primaire.
REMARQUE : À ce stade, seules quelques cellules immunitaires et non parenchymateuses (<5 %) restent dans la suspension. Si une purification supplémentaire est souhaitée, effectuer une sélection négative des cellules CD31+ et CD45+ par tri cellulaire activé par magnétence ou fluorescence (MACS/FACS). À ce jour, il n’existe aucun marqueur de surface fiable et robuste pour les cellules parenchymateuses du foie.
9. Préparation des hépatocytes isolés pour la cytométrie de flux
- Centrifuger les hépatocytes à 100 × g pendant 5 min.
- Jeter le surnageant et ajouter la quantité désirée de tampon de cytométrie en flux, en fonction de la concentration de la suspension cellulaire.
- Ajouter 1 mL de suspension cellulaire dans un tube de cytométrie en flux. Centrifuger pendant 5 min à 100 × g et jeter le surnageant.
- Ajoutez 100-200 μL du colorant de viabilité vert Alexa Fluor 488 Zombie dilué (concentration 1:400) aux cellules et secouez-les doucement. Remettez soigneusement les hépatocytes en suspension manuelle ou en utilisant un mélangeur vortex à basse vitesse (maximum 2-3) pendant 2 s.
REMARQUE: N’utilisez pas de petits embouts de pipette pour remettre les cellules en suspension. Ils sont très fragiles et la contrainte de cisaillement appliquée cause des dommages et réduit la viabilité cellulaire. Si le pipetage n’est pas évitable, utilisez une pipette de 1 000 μL après avoir coupé la plus petite partie de la pointe pour agrandir le diamètre et pipeter les cellules très lentement. - Placez les tubes sur de la glace ou conservez-les à température ambiante, selon la coloration souhaitée. Incuber les cellules pendant 20-30 min dans l’obscurité.
- Ajouter 2 mL de tampon de cytométrie en flux et laver les cellules 3x. Centrifuger les cellules après chaque étape de lavage à 100 × g pendant 5 min.
- Ajouter 2 mL de tampon de fixation (1:1 4% PFA et PBS). Remettez soigneusement les hépatocytes en suspension manuelle ou en utilisant un mélangeur vortex à basse vitesse (maximum 2-3) pendant 2 s.
- Fixez les cellules pendant 30 min.
- Centrifuger à 100 × g pendant encore 5 minutes, jeter le surnageant et ajouter un tampon de cytométrie en flux.
REMARQUE: Les cellules peuvent être stockées dans un tampon de cytométrie en flux avant l’analyse jusqu’à 72 heures après l’isolement.
10. Analyse des hépatocytes avec cytométrie en flux
- Analysez les hépatocytes à l’aide d’un trieur cellulaire activé par fluorescence.
REMARQUE: Considérez la taille relativement grande des hépatocytes et ajustez les tensions. Commencez avec une basse tension et ne dépassez pas 350 V pour la diffusion directe (FSC) et 220 V pour la diffusion latérale (SSC).- Ajustez les tensions pour FSC et SSC à la grande taille estimée des cellules. Identifier la population d’hépatocytes et consigner tous les événements à l’aide de SSC-A et FSC-A (Figure 5A).
- Observez que les débris et les cellules non parenchymateuses sont affichés dans le coin inférieur gauche du diagramme de densité FSC versus SSC et sont exclus (figure 5A).
- Comme les cellules doublets peuvent affecter l’analyse, construire un diagramme de densité de la hauteur de diffusion latérale (SSC-H) par rapport à la zone de diffusion latérale (SSC-A) pour exclure les doublets, comme le montre la figure 5B.
- Sélectionner la population finale d’hépatocytes en déclenchant les cellules CD31- (marqueur endothélial) et CD45- (marqueur immunitaire) (figure 5C).
Access restricted. Please log in or start a trial to view this content.
Résultats
Le TRAS culmine à 16 heures après l’hépatectomie et disparaît progressivement 32 à 48 heures après l’hépatectomie standard, mais persiste au-delà de 48 heures après une hépatectomie étendue. Macroscopiquement, TRAS est facilement visible comme un teint pâle du reste du foie (Figure 1F) et peut être observé chez les souris hépatectomisées entre 16 h et 48 h après la chirurgie.
Le rendement final estimé est de 10-15 × 10 6 hépatocytes après ...
Access restricted. Please log in or start a trial to view this content.
Discussion
Le protocole publié fournit une méthode fiable et simple pour isoler un rendement élevé d’hépatocytes murins normaux et stéatotiques pour des analyses en aval de cellules uniques ou une analyse en vrac de cellules après tri FACS. L’avantage distinct par rapport à la purification par gradient de densité est que la teneur en lipides cellulaires n’a essentiellement aucun impact sur le rendement effectif des hépatocytes. Ainsi, la fraction des hépatocytes stéatotiques sera retenue et incluse dans les analys...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts concurrents.
Remerciements
Cette étude a été soutenue par le Fonds national suisse (subvention de projet 310030_189262).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
Références
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon