需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
小鼠肝部分切除术后再生肝细胞的分离
摘要
富含脂质的肝细胞是肝脏再生所固有的,但通常在密度梯度离心时丢失。在这里,我们提出了一种优化的细胞分离方案,该方案保留了脂肪变性肝细胞,在小鼠部分肝切除术后产生具有代表性的再生肝细胞群。
摘要
部分肝切除术已被广泛用于研究小鼠的肝脏再生,但分离高产量的活肝细胞用于下游单细胞应用具有挑战性。在小鼠正常肝脏再生的前2天观察到再生肝细胞内脂质的显着积累。这种所谓的短暂再生相关脂肪变性(TRAS)是暂时的,但部分与主要增殖期重叠。密度梯度纯化是大多数现有原代肝细胞分离方案的支柱。由于梯度纯化依赖于细胞的密度和大小,因此它将非脂肪性肝细胞群与脂肪性肝细胞群分开。因此,脂肪肝细胞经常丢失,产生不具代表性的肝细胞分数。
所提出的方案描述了一种简单可靠的方法,用于 体内 分离再生肝细胞,无论其脂质含量如何。通过经典的两步胶原酶灌注方法在肝切除术后24-48小时分离来自雄性C57BL / 6小鼠的肝细胞。标准蠕动泵使用逆行灌注技术将加热的溶液 通过 导管下腔静脉驱动到残余静脉中,并通过门静脉流出。肝细胞被胶原酶解离,从Glisson的胶囊中释放出来。洗涤和仔细离心后,肝细胞可用于任何下游分析。总之,本文描述了一种直接且可重复的技术,用于分离小鼠部分肝切除术后代表性的再生肝细胞群体。该方法也可能有助于脂肪肝疾病的研究。
引言
即使在组织大量流失后,肝脏也可以自我再生。这种独特的再生能力在部分(70%)肝切除术的实验模型中得到了明确说明,希金斯和安德森于1931年首次在大鼠中描述了1。在这个模型中,通过手术从动物身上切除70%的肝脏,方法是通过剪掉较大的肝叶。然后,剩余的叶通过代偿性肥大生长,在手术后约1周内恢复原始肝脏肿块,尽管没有恢复原始肝脏结构2,3。已经开发了具有不同组织切除量的其他肝切除术,例如86%扩展的肝切除术,其中肝脏残留物太小而无法恢复,最终导致肝切除术后肝衰竭(PHLF)和随后30%-50%的动物死亡4,5,6。这些模型能够研究正常和失败的肝脏再生,具体取决于切除组织的数量(图1)。
尽管肝脏切除术的小鼠模型已经成功使用多年,但直到最近才有更先进的分析方法允许在单细胞水平上更深入地了解。然而,对于大多数这些方法,单个肝细胞的存在是一个基本的先决条件。大多数分离原代肝细胞的方案基于两步胶原酶灌注技术和随后的密度梯度纯化,以从碎片和非实质以及死细胞中分离活肝细胞7,8,9。这种方法首先由Berry和Friend在196910中描述,并由Seglen及其同事在197211,12中进行了改编。然而,由于梯度离心依赖于细胞的密度和大小,因此在标准纯化过程中通常会丢失富含脂质的肝细胞。虽然对于许多研究问题来说,这种损失可以忽略不计,但它是早期肝脏再生的一个关键方面。在前2天,再生小鼠肝脏内的肝细胞积累脂质,从而增大大小并降低密度。这种短暂的再生相关脂肪变性(TRAS)用于提供再生燃料,并且是暂时的,但部分重叠了主要的增殖阶段,并且在肝小叶(肝脏的功能单位)内分布不均匀13,14。然而,在延长86%肝切除术后,TRAS也发生但持续存在,因为再生停滞并且脂质没有被氧化14。因此,在70%或86%肝切除术后对肝细胞进行梯度纯化将产生不具代表性的组分,因为大多数含脂质的肝细胞由于其低密度而丢失15。
在这种改良的分离方案中,通过经典的两步胶原酶灌注方法在肝切除术后24-48小时分离来自C57BL / 6小鼠的肝细胞。通常,用于细胞分离的残余物的插管和灌注是通过门 静脉完成的 。然而,大切除后留下的小残留物的门血管阻力高达16,因此灌注很微妙。由于腔静脉不受肝切除术的影响,因此可以通过插管 腔静脉轻松地 在逆行方向进行灌注。标准蠕动泵通过导管插入的下腔静脉 将 加热的溶液驱动到肝脏残余物中,使用逆行灌注并通过门静脉流出(补充图S1)。肝细胞被胶原酶解离并从Glisson的胶囊中释放出来。在使用低速离心方法逐步分离和仔细处理活肝细胞后,肝细胞可用于任何下游分析。
Access restricted. Please log in or start a trial to view this content.
研究方案
所有动物实验均符合瑞士联邦动物法规,并经苏黎世兽医局批准(n° 007/2017,156/2019),确保人类护理。将10-12周龄的雄性C57BL / 6小鼠保持在12小时的昼夜循环中,并自由获取食物和水。每个实验组由六到八只动物组成。有关本协议中使用的所有材料、设备和试剂的详细信息,请参阅 材料表 。
1.小鼠肝部分切除术
- 对于标准肝切除术(70%),结扎并切除左外侧叶,正中叶的右侧和正中叶的左侧(图1B)。对于延长肝切除术(86%)4,还要切除尾状叶和右前叶(图1C)。
- 注意:标准肝切除术是一种已在肝脏再生研究中使用多年的程序。该程序的协议可用3,17,包括Mitchell和Willenbring18的视频辅助协议。有关此处用于肝切除术的技术的更多详细信息,请参见补充文件1。
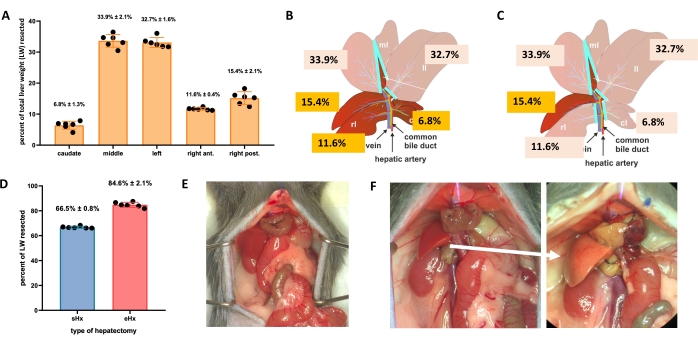
图1:小鼠的标准(70%)和扩展(86%)肝切除术 。 (A)五个小鼠肝叶及其各自对总肝重的贡献。(B)小鼠70%肝切除术示意图。深叶代表未来的肝脏残余物。(C)小鼠86%肝切除术的示意图。深叶代表未来的肝脏残余物。(D)70%和86%肝切除术后切除组织的精确体积。(E)70%肝切除术后立即出现小鼠腹部;(F)小鼠腹部立即(左)和48小时(右)后86%肝切除术。请注意脂肪变性残余物的浅色(白色箭头)。n = 6-7/组。缩写:sHx = 标准肝切除术;eHx = 扩展肝切除术;LW = 肝脏重量。 请点击此处查看此图的大图。
2. 灌注溶液的制备
- 准备灌注、消化和保存缓冲液(见 表1)。
- 根据需要通过添加氢氧化钠(NaOH)或氯化氢(HCl)来调节所有缓冲溶液在37°C的pH值。缓冲液的最佳pH值为7.4。
- 将保存缓冲液和威廉姆斯的中E放在冰上。
- 准备流式细胞术缓冲液并将其储存在冰上。
表1:用于肝细胞消化和纯化的溶液和缓冲液。请按此下载此表格。
3.灌注设备的制备
- 将水浴加热至42°C,并将灌注缓冲液(50mL)和消化缓冲液(10-20mL)置于水浴中。不要将胶原酶添加到消化缓冲液中。
- 准备蠕动泵并插入管道。完整的灌注设置如图 2所示。
- 使用鲁尔锁连接器将 26 G IV 插管连接到管道的出口端。将管的入口端插入水浴中预热的灌注缓冲管中。用 70% 乙醇冲洗管路,然后用 50 mL 无菌氯化钠 (NaCl 0.9%) 冲洗。用温热的灌注缓冲液(泵速为 3 mL/min)灌注管路。
- 使用异氟醚吸入麻醉(800mL / min O 2,3%-5%异氟醚用于诱导,2%用于在操作过程中维持)镇静小鼠。在实验室罩下处理异氟醚并提供足够的通风。
- 手术前30分钟皮下给予丁丙诺啡,剂量为0.1mg / kg体重。
- 为防止体温过低,将镇静的小鼠放在加热垫上,并在上腹部下方放置卷布组织,以使肝脏高于其他器官,并促进进入下腔静脉。
注意:不要使用太厚的组织,因为血管可能会扭结,并且灌注效果会受到影响。 - 添加眼膏以防止角膜损伤。
- 在开始手术之前,通过测试踏板撤回反射(双后脚捏住脚垫)来确保动物充分麻醉。如果出现反应,请在开始手术前提供额外的麻醉并重新测试。
- 用70%乙醇清洁腹部。
- 通过切断缝合线并轻轻拉开伤口边缘来重新打开中线切口。如果肝切除术年龄超过24-48小时,请拆下缝合线并用剪刀切割皮肤。
- 将5-0聚丙烯缝合线固定在胸骨上,颅骨拉动,并将其固定在此位置。使用牵开器或简单的夹子保持腹部开放。腹腔必须尽可能暴露,以优化可及性和可视化。
- 使用棉签将肠道向右移动,以显示门静脉和腔静脉。用湿布保留肠道。
- 将一个约2厘米高的重物(例如,用于容量瓶的硅胶涂层配重环)放在小鼠后腿附近(补充图S2A)。将连接的26 G IV插管放在物体上,并将针头小心地放在腔静脉顶部。调整管道的长度。
- 将制备好的胶原酶储备溶液放入预热的消化缓冲管中。将 250 μL 储备溶液加入 10 mL 消化缓冲液中。每只动物准备10-20毫升的消化缓冲液。对于较大的动物或整个肝脏的灌注,准备多达 30 mL 的消化缓冲液。
注意:建议在消化过程开始前约30分钟将胶原酶储备溶液添加到加热的消化缓冲液中。
图 2:灌注设置概述。 (A)手术台上装有灌注所需的设备。(二)制备肝脏以及肝细胞提取和分离所需的材料。请点击此处查看此图的大图。
4.插管和灌注
- 将泵速调整为 3 mL/min 并打开泵。让预热的灌注缓冲液到达针头。丢弃前 2-3 mL 灌注缓冲液。
- 进行下腔静脉插管。
- 当缓冲液穿过针头时,将 26 G IV 插管以浅角度插入肾脏下方的腔静脉。确保针斜面朝上。
- 使用棉签轻轻地将腔静脉向穿刺部位下方尾部拉动,以便提供的张力有助于将套管插入静脉。当针头进入管腔时,在导管的闪光腔中寻找血液。
- 将针头再推进 2-3 毫米,以确保塑料导管的尖端也已进入静脉。
- 将塑料导管滑过针头并进入腔静脉再5毫米。缓慢而小心地取出针头。
注意:不建议用结扎固定套管。此步骤非常耗时,因为必须首先为此目的解剖容器。如果套管位置松散并用物体支撑,则无需进一步固定(参见 补充图S2中的灌注设置)。为了稳定插管部位并防止回流,可以在插管部位添加一滴单体正丁基氰基丙烯酸酯。
- 当血液从套管中流出时,使用注射器用温热的灌注缓冲液填充。
- 将试管重新连接到套管上,仍以 3 mL/min 的泵速运行。让灌注缓冲液进入肝脏。
- 2-3秒后,寻找肝脏中形成的白点和/或门静脉的扩张/肿胀,这表明灌注缓冲液流经肝脏并从中央静脉进入肝小叶(图3)。
- 等待门静脉在肝脏表面出现白点后 1-2 秒内明显肿胀。用剪刀尽可能远离肝门切断门静脉。使用微型容器夹标记(而不是遮挡)切割部位(图3B)。
注意:这简化了灌注过程中通过肝脏的流量的评估。肝脏立即清除血液,并在几秒钟内变成黄白色(图3C)。通过腹部开口右侧皮肤的额外切口有助于血液和灌注溶液的流出(图3B 和 补充图S2B,C)。 - 根据动物的体重、肝脏大小和先前肝切除术的程度,将流量增加到 4-7 mL/min。
- 用镊子或血管夹夹住门静脉7-10秒。确保没有液体通过。
注意:肝脏在钳夹期间明显肿胀,释放时放松。这对于冲洗整个肝脏并清除任何剩余的血液至关重要。 - 大约30秒后进行第二次钳夹,并确保肝脏肿胀和放松。继续冲洗动物,直到流出门静脉的缓冲液清除,但至少3-4分钟。
注意:泵速取决于管子以及肝脏的大小。它必须单独评估。 - 在程序的这一点上,安乐死应该继发于放血。确认体循环已停止(无心跳或心脏闪烁)。为了确保死亡,在手术的这个阶段进行双侧气胸作为安乐死的次要物理方法。
注意:如果体循环停止(无心跳或心脏闪烁),请稍微降低泵速。
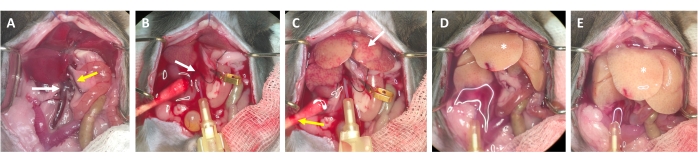
图3:从插管到消化的灌注过程 。 (A)小鼠肝脏与下腔静脉(白色箭头)和门静脉(黄色箭头)的解剖。(B)下腔静脉插管。套管用结扎(白色箭头)固定,并且用微血管夹标记(未夹紧)通过打开的门静脉流出的位置。(C)注意在灌注缓冲液清除肝脏所有剩余血液之前出现斑片状结构(白色箭头)。切开皮肤(黄色箭头),并放置棉签以确保血液和灌注液的排出。间歇夹紧可以用血管钳夹或镊子进行。(D)肝脏应清除所有血液(*)。含胶原酶的消化缓冲液进入肝脏后,夹紧后将不再松弛,肝叶增大。(E)一段时间后,可以观察到肝脏表面出现气泡(*)。 请点击此处查看此图的大图。
5. 消化
- 暂停灌注泵,快速将进样管从灌注缓冲液转移到预热的消解缓冲液。重新启动泵。
- 在 消化缓冲液到达肝脏之前,再次夹住门静脉3-4秒。确保释放钳夹后肝脏放松,灌注液保持清澈。
注意:消化缓冲液含有酚红,很容易与透明灌注缓冲液区分开来。这允许在管内轻松跟踪。 - 一旦消化缓冲液到达肝脏,用微血管夹再次夹住门静脉。
注意:夹紧时,肝脏肿胀,但在松开夹子后不会放松。这是正常的。 - 为了促进消化过程,用横膈膜正下方的血管夹关闭上腔静脉,以使消化缓冲液从下腔静脉通过肝脏,然后通过打开的门静脉流出。
注意:这种钳夹可确保绕过体循环,并防止与残留血液成分/抑制剂的不必要接触。这一步是可选的,因为在假手术后很难接近扩大的肝组织后面的上腔静脉,但在肝切除小鼠中更容易进入。 - 以 5 mL/min 的流速消解约 4 分钟。随着消化的进展,寻找肝脏开始肿胀的迹象和肝脏表面的小透明/透明切片。此外,观察肝脏呈现出湿布的质地,看起来几乎湿透(图3E)。用湿棉签小心地触摸稠度。
- 继续灌注,直到可以观察到肝脏表面纹理的显着差异。观察到肝脏呈现非常浅的颜色和气泡外观(图3E),并且Glisson的囊(即肝袋)与实质分离。一旦肝脏获得这些特性,就停止消化过程,因为过度消化会损害肝细胞。在空气进入肝脏之前取出针头。
注意:通常需要 10-20 mL 的消化缓冲液才能达到足够的消化。这取决于动物的大小、肝切除术的程度、管路设置和胶原酶溶液的质量。如果需要,增加灌注时间而不是灌注速度。血管系统中的压力过大会导致肝脏破裂,灌注/消化液可能会流失到腹膜后间隙。
6. 肝脏的准备
- 轻轻地从腹腔中取出肝脏。要非常小心,因为它现在非常脆弱和脆弱。
- 用镊子抓住叶之间的中央结缔组织,并将其稍微向上提起,将其用作锚点。
- 切断肝脏与其他器官的所有连接,取出胆囊,并将肝脏放入冰冷的保存缓冲区中。
注意:理想情况下,肝细胞提取和进一步处理应立即进行,以维持肝细胞的活力。然而,如果需要,肝脏可以在4°C下短时间储存(例如,用于运输)。此延迟不应超过 30-40 分钟。
7. 肝细胞提取
- 将肝脏转移到 10 厘米培养皿中,加入 10 mL 冰冷的威廉姆斯培养基 E。
- 在肝脏表面的几个位置用细尖镊子破裂Glisson的胶囊。用两对镊子抓住中央部分(例如肝门处的结缔组织),然后慢慢将它们拉开,让胶囊撕裂而不损伤肝细胞。通过轻轻摇动胶囊释放细胞(补充图S3)。
注意:理想情况下,肝脏很容易撕裂并释放细胞。不要用力。细胞刮刀可以帮助完全去除所有细胞并提高细胞产量。不要用剪刀将肝脏切成碎片。 - 通过 100 μm 细胞过滤器将 5 mL 肝髓过滤到 50 mL 管中。用 10 mL 新鲜冰冷培养基冲洗过滤器。通过细胞过滤器过滤剩余的 5 mL 纸浆。
注意:使用25 mL血清移液管将肝髓与解离的肝细胞一起转移(图4A)。较小的移液器具有较小的开口会增加剪切应力并不可逆转地损害肝细胞。 - 加入总共 30 mL 冷培养基以冲洗培养皿,过滤它,然后将悬浮液加入 50 mL 管中直至其充满。所有分离的细胞现在都处于悬浮状态(图4B)。
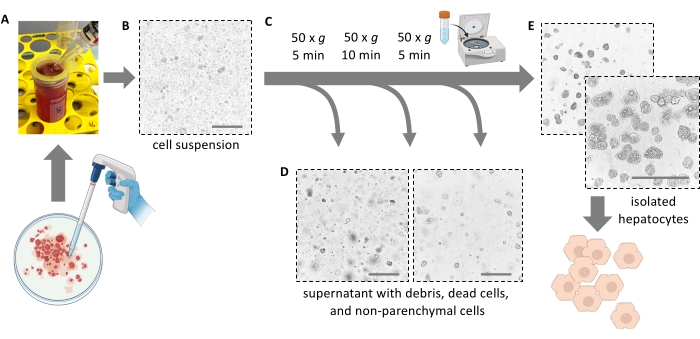
图4:通过温和离心纯化 。 (A)提取步骤后留下的肝匀浆。(B)匀浆的显微视图(20倍放大);注意有碎屑的明显污染。(C)纯化离心步骤和(D)待弃的上清液的显微视图。(E)纯化的肝细胞部分的显微镜视图。比例尺 = 100 μm。 请点击此处查看此图的大图。
8. 肝细胞分离
- 在4°C下以50× g 旋转5分钟(可能的最低加速度和最低的制动)。
注意:肝细胞比非实质肝细胞密度大。由于离心力低,只有肝细胞沉淀,而其他细胞(例如免疫细胞、红细胞和正弦细胞)保留在上清液中。 - 吸出大部分上清液,留下 1 mL 通过轻轻旋转试管重悬细胞。
- 加入 40 mL 冷威廉姆斯 E 培养基,并在 4 °C(低加速度、低制动)下以 50 × g 再次旋转 10 分钟,以进一步去除死的肝细胞和细胞碎片以及沉淀活和脂肪肝细胞(图 4C)。
- 丢弃大部分上清液,留下 1 mL 通过旋转管重悬细胞。
- 加入 40 mL 冷威廉姆斯 E 培养基,并在 4 °C(低加速度、低制动)下以 50 × g 再次旋转 5 分钟。
- 吸出大部分上清液,留下 1 mL 通过轻轻旋转试管重悬细胞。
注意:在固定或分析细胞之前,请勿停止此过程。肝细胞非常脆弱,灌注、消化和纯化过程中的任何延迟都会损害细胞。 - 使用Neubauer改进的计数室确定添加台盼蓝后的最终细胞浓度。
注意:大多数碎片和非实质细胞现已被去除,导致70%肝切除术后留下约10-15×106 个肝细胞的干净沉淀。 - 根据所需的浓度,添加更多的冰冷培养基。使用肝细胞悬液进行任何下游分析或启动原代细胞培养。
注意:在这个阶段,只有少数免疫和非实质细胞(<5%)留在悬浮液中。如果需要进一步纯化,通过磁性或荧光激活细胞分选(MACS/FACS)对CD31+ 和CD45 + 细胞进行阴性选择。迄今为止,没有可靠和强大的肝实质细胞表面标志物。
9. 流式细胞术用分离肝细胞的制备
- 将肝细胞以100× g 离心5分钟。
- 弃去上清液并加入所需量的流式细胞术缓冲液,具体取决于细胞悬液的浓度。
- 在流式细胞术管中加入 1 mL 细胞悬液。以100× g 离心5分钟,弃去上清液。
- 向细胞中加入 100-200 μL 稀释的 Alexa Fluor 488 僵尸绿色活力染料(浓度 1:400)并轻轻摇动。通过手动摇动或使用涡旋混合器以低速(最多2-3)小心地重悬肝细胞2秒。
注意:请勿使用小移液器吸头重悬细胞。它们非常脆弱,施加的剪切应力会导致损伤并降低细胞活力。如果移液不可避免,请在从吸头上切下最小的部分后使用 1,000 μL 移液器以扩大直径并非常缓慢地移液细胞。 - 将试管放在冰上或在室温下储存,具体取决于所需的染色。将细胞在黑暗中孵育20-30分钟。
- 加入 2 mL 流式细胞术缓冲液并洗涤细胞 3 倍。在每个洗涤步骤后以100× g 离心细胞5分钟。
- 加入 2 mL 固定缓冲液(1:1 4% PFA 和 PBS)。通过手动摇动或使用涡旋混合器以低速(最多2-3)小心地重悬肝细胞2秒。
- 固定细胞30分钟。
- 以100 ×g 离心5分钟,弃去上清液,加入流式细胞术缓冲液。
注意:细胞可以在分析前储存在流式细胞术缓冲液中,直到分离后72小时。
10. 流式细胞术分析肝细胞
- 使用荧光激活细胞分选仪分析肝细胞。
注意:考虑相对较大的肝细胞尺寸并调整电压。从低电压开始,前向散射 (FSC) 不要高于 350 V,侧向散射 (SSC) 不要高于 220 V。- 将FSC和SSC的电压调整到电池的估计大尺寸。鉴定肝细胞群并使用SSC-A和FSC-A记录所有事件(图5A)。
- 观察到碎片和非实质细胞显示在FSC与SSC密度图的左下角,并被排除在外(图5A)。
- 由于双峰细胞会影响分析,因此构建侧向散射高度 (SSC-H) 与侧向散射面积 (SSC-A) 密度图以排除双峰,如图 5B 所示。
- 通过门控CD31- (内皮标志物)和CD45- (免疫标志物)细胞来选择最终的肝细胞群(图5C)。
Access restricted. Please log in or start a trial to view this content.
结果
TRAS在肝切除术后16小时达到峰值,并在标准肝切除术后32-48小时逐渐消失,但在延长肝切除术后持续超过48小时。在肉眼上,TRAS很容易看到肝脏残留物的苍白肤色(图1F),并且可以在手术后16小时至48小时之间在肝切除小鼠中观察到。
估计的最终产量为70%肝切除术后10-15×106 肝细胞和延长86%肝切除术后4-9×106 肝细胞,平均最终生存能力分...
Access restricted. Please log in or start a trial to view this content.
讨论
已发布的方案提供了一种可靠且直接的方法来分离高产量的正常和脂肪变性小鼠肝细胞,用于单细胞下游分析或FACS分选后的细胞批量分析。与密度梯度纯化相比,其明显优势在于细胞脂质含量对肝细胞的有效产量基本上没有影响。因此,脂肪变性肝细胞的比例将被保留并包含在下游分析中。这不仅对于脂肪源性肝病的研究至关重要,而且对于主要肝切除术后的任何过程分析也至关重要,其中肝细...
Access restricted. Please log in or start a trial to view this content.
披露声明
提交人声明他们没有竞争利益。
致谢
这项研究得到了瑞士国家基金(项目赠款310030_189262)的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
参考文献
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。