JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
생쥐의 부분 간 절제술 후 재생 간세포의 분리
요약
지질이 함유된 간세포는 간 재생에 내재되어 있지만 일반적으로 밀도 구배 원심분리 시 손실됩니다. 여기에서 우리는 지방성 간세포를 유지하는 최적화된 세포 분리 프로토콜을 제시하여 마우스에서 부분 간 절제술 후 재생 간세포의 대표적인 집단을 생성합니다.
초록
부분 간 절제술은 생쥐의 간 재생을 조사하는 데 널리 사용되어 왔지만 다운스트림 단일 세포 적용을 위한 생존 가능한 간세포의 높은 수율의 분리는 어려운 일입니다. 재생 간세포 내 지질의 현저한 축적은 생쥐에서 정상적인 간 재생의 처음 2 일 동안 관찰됩니다. 이 소위 일시적인 재생 관련 지방증(TRAS)은 일시적이지만 주요 증식 단계와 부분적으로 겹칩니다. 밀도 구배 정제는 원발성 간세포의 분리를 위한 대부분의 기존 프로토콜의 중추입니다. 그래디언트 정제는 세포의 밀도와 크기에 의존하기 때문에 비지방성 간세포 집단과 지방성 간세포 집단을 분리합니다. 따라서 지방 간세포는 종종 손실되어 비대표성 간세포 분획을 생성합니다.
제시된 프로토콜은 지질 함량에 관계없이 재생 간세포의 생체 내 분리를 위한 쉽고 신뢰할 수 있는 방법을 설명합니다. 수컷 C57BL/6 마우스의 간세포는 고전적인 2단계 콜라게나제 관류 접근법에 의해 간 절제술 후 24-48시간 후에 분리됩니다. 표준 연동 펌프는 문맥을 통해 유출되는 역행 관류 기술을 사용하여 카테터가 삽입된 하대정맥을 통해 따뜻해진 용액을 잔여물로 구동합니다. 간세포는 Glisson 캡슐에서 방출하기 위해 콜라게나제에 의해 해리됩니다. 세척 및 신중한 원심분리 후, 간세포는 모든 다운스트림 분석에 사용될 수 있습니다. 결론적으로, 이 논문은 생쥐에서 부분 간 절제술 후 재생 간세포의 대표적인 집단을 분리하기 위한 간단하고 재현 가능한 기술을 설명합니다. 이 방법은 또한 지방간 질환의 연구에 도움이 될 수 있습니다.
서문
간은 주요 조직 손실 후에도 스스로 재생될 수 있습니다. 이 독특한 재생 능력은 1931년 Higgins와 Anderson이 쥐에서 처음 기술한 부분적(70%) 간 절제술의 실험 모델에 의해 명시적으로 설명됩니다1. 이 모델에서는 더 큰 간엽을 잘라내어 동물에서 간장의 70%를 외과적으로 제거합니다. 나머지 엽은 보상 비대를 통해 성장하여 수술 후 약 1 주일 이내에 원래의 간 덩어리를 회복하지만 원래의 간 구조를 복원하지는 않습니다 2,3. 간 잔여물이 너무 작아서 회복할 수 없는 86% 확장 간절제술과 같이 다양한 양의 조직 제거를 가진 추가 간 절제술이 개발되어 결국 간 절제술 후 간부전(PHLF) 및 동물의 30%-50%에서 후속 사망으로 이어집니다 4,5,6. 이 모델은 절제된 조직의 양에 따라 정상 및 실패한 간 재생에 대한 연구를 가능하게 합니다(그림 1).
간 절제술의 마우스 모델은 수년 동안 성공적으로 사용되어 왔지만 최근에야 단일 세포 수준에서 더 깊은 통찰력을 얻을 수 있는 고급 분석 방법이 있습니다. 그러나 이러한 방법의 대부분에서는 개별 간세포의 존재가 기본 전제 조건입니다. 원발성 간세포의 분리를 위한 대부분의 프로토콜은 2단계 콜라게나제 관류 기술과 사멸 세포뿐만 아니라 파편 및 비실질로부터 생존 가능한 간세포를 분리하기 위한 후속 밀도 구배 정제를 기반으로 합니다 7,8,9. 이 방법은 1969 년 Berry와 Friend에 의해 처음 기술되었으며 1972 년 Seglen과 동료들에 의해 채택되었습니다 11,12. 그러나 그래디언트 원심분리는 세포의 밀도와 크기에 의존하기 때문에 표준 정제 중에 지질이 함유된 간세포가 손실되는 경우가 많습니다. 이러한 손실은 많은 연구 질문에서 무시할 수 있지만 초기 간 재생에 중요한 측면입니다. 처음 2일 동안 재생 중인 마우스 간 내의 간세포는 지질을 축적하여 크기가 커지고 밀도가 떨어집니다. 이 일시적인 재생 관련 지방증 (TRAS)은 재생 연료를 제공하는 역할을하며 일시적이지만 주요 증식 단계와 부분적으로 겹치고 간 소엽 (간 기능 단위13,14) 내에 고르지 않게 분포되어 있습니다. 그러나 연장된 86% 간 절제술 이후에는 TRAS도 발생하지만 재생이 지연되고 지질이 산화되지 않기 때문에 지속된다14. 따라서 70% 또는 86% 간절제술 후 간세포의 기울기 정제는 대부분의 지질이 함유된 간세포가 저밀도로 인해 손실되기 때문에 비대표성 분획을 생성할 수 있다15.
이 수정된 분리 프로토콜에서 C57BL/6 마우스의 간세포는 고전적인 2단계 콜라게나제 관류 접근법에 의해 간 절제술 후 24-48시간 후에 분리됩니다. 일반적으로 세포 분리를 위한 잔류물의 캐뉼라 삽입 및 관류는 문맥을 통해 수행됩니다. 그러나, 대절제 후 남은 작은 잔해에서의 문맥혈관 저항성은 높으며16, 따라서 관류가 미묘하다. 대정맥은 간 절제술의 영향을 받지 않기 때문에 대정맥의 캐뉼라를 통해 역행 방향으로 관류를 쉽게 수행할 수 있습니다. 표준 연동 펌프는 문맥을 통한 유출과 함께 역행성 관류를 사용하여 카테터화된 하대정맥을 통해 따뜻해진 용액을 간 잔여물로 구동합니다(보충 그림 S1). 간세포는 콜라겐 분해 효소에 의해 해리되어 Glisson 캡슐에서 방출됩니다. 저속 원심분리 접근법을 사용하여 단계적 분리에 의해 생존 가능한 간세포를 세척하고 주의 깊게 처리한 후, 간세포는 모든 다운스트림 분석에 사용할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
모든 동물 실험은 스위스 연방 동물 규정에 따라 이루어졌으며 취리히 수의과(n° 007/2017, 156/2019)의 승인을 받아 인간의 보살핌을 보장했습니다. 10-12주령의 수컷 C57BL/6 마우스를 음식과 물에 자유롭게 접근할 수 있는 12시간 주야간 주기로 유지했습니다. 각 실험군은 6-8마리의 동물로 구성되었다. 이 프로토콜에 사용된 모든 재료, 장비 및 시약과 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 생쥐의 부분 간 절제술
- 표준 간 절제술(70%)의 경우 왼쪽 측엽, 정중엽의 오른쪽 부분 및 정중엽의 왼쪽 부분을 결찰 및 절제합니다(그림 1B). 확장 간 절제술 (86 % 4)의 경우 꼬리 엽과 우측 전엽도 제거하십시오 (그림 1C).
- 참고: 표준 간 절제술은 수년 동안 간 재생 연구에 사용되어 온 절차입니다. 이 절차에 대한 프로토콜은 Mitchell 및 Willenbring 18의 비디오 지원 프로토콜을 포함하여 3,17 사용할 수 있습니다. 간 절제술에 사용되는 기술에 대한 자세한 내용은 보충 파일 1에서 확인할 수 있습니다.
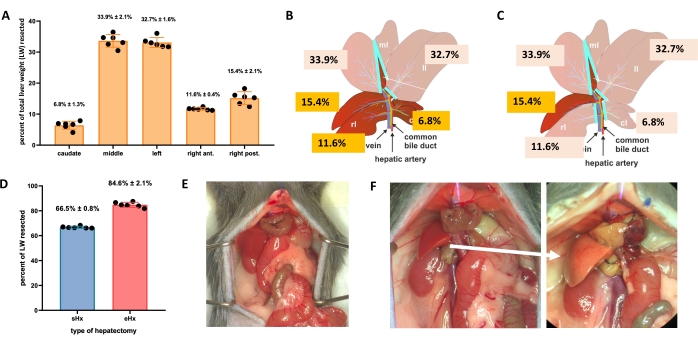
그림 1: 생쥐의 표준(70%) 및 확장(86%) 간 절제술. (A) 5 개의 마우스 간엽 및 총 간 중량에 대한 각각의 기여도. (B) 생쥐의 70% 간 절제술의 개략도. 어두운 엽은 미래의 간 잔해를 나타냅니다. (C) 생쥐의 86% 간 절제술의 개략도. 어두운 엽은 미래의 간 잔해를 나타냅니다. (D) 70% 및 86% 간 절제술 후 절제된 조직의 정확한 부피. (e) 70% 간 절제술 직후 마우스 복부; (F) 마우스 복부 즉시(왼쪽) 및 86% 간 절제술 후 48시간(오른쪽). 지방성 잔해의 옅은 색(흰색 화살표)에 주목하십시오. n = 6-7/그룹. 약어: sHx = 표준 간 절제술; eHx = 확장 간 절제술; LW = 간 무게. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 관류 용액의 제조
- 관류, 소화 및 보존 완충액을 준비합니다( 표 1 참조).
- 필요에 따라 수산화나트륨(NaOH) 또는 염화수소(HCl)를 첨가하여 모든 완충 용액의 pH를 37°C로 조정합니다. 완충액의 최적 pH는 7.4입니다.
- 보존 버퍼와 Williams의 Medium E를 얼음 위에 놓습니다.
- 유세포 분석 완충액을 준비하고 얼음 위에 보관하십시오.
표 1: 간세포의 소화 및 정제에 사용되는 용액 및 완충액. 이 표를 다운로드하려면 여기를 클릭하십시오.
3. 관류 설비의 준비
- 수조를 42°C로 가온하고 관류 완충액(50mL)과 소화 완충액(10-20mL)을 수조에 넣습니다. 아직 분해 완충액에 콜라게나아제를 첨가하지 마십시오.
- 연동 펌프를 준비하고 튜브를 삽입합니다. 전체 관류 설정은 그림 2에 나와 있습니다.
- Luer 잠금 커넥터를 사용하여 26G IV 캐뉼라를 튜브의 출구 끝에 연결합니다. 튜브의 입구 끝을 수조의 예열된 관류 완충 튜브에 삽입합니다. 튜브를 70% 에탄올로 세척한 다음 멸균 염화나트륨(NaCl 0.9%) 50mL로 세척합니다. 따뜻한 관류 완충액(펌프 속도 3mL/분)으로 튜브를 프라이밍합니다.
- 이소플루란 흡입 마취(800mL/분 O 2, 유도용 3%-5% 이소플루란 및 시술 중 유지용2%)를 사용하여 마우스를 진정시킵니다. 실험실 후드 아래에서 이소플루란을 취급하고 적절한 환기를 제공하십시오.
- 부프레노르핀을 수술 30분 전에 0.1mg/kg 체중의 용량으로 피하 투여합니다.
- 저체온증을 예방하려면 진정 된 마우스를 온난화 패드에 놓고 상복부 아래에 말아서 간을 다른 장기 위로 올리고 하대 정맥에 쉽게 접근 할 수 있도록합니다.
참고: 혈관이 꼬일 수 있고 관류 효능에 영향을 줄 수 있으므로 너무 두꺼운 티슈를 사용하지 마십시오. - 각막 손상을 방지하기 위해 눈 연고를 추가하십시오.
- 수술을 시작하기 전에 페달 철수 반사 (양쪽 뒷발에 발 패드 핀치)를 테스트하여 동물이 적절하게 마취되었는지 확인하십시오. 반응이 있는 경우 시술을 시작하기 전에 추가 마취를 하고 다시 검사하십시오.
- 70 % 에탄올로 복부를 청소하십시오.
- 봉합사를 절단하고 상처 가장자리를 부드럽게 당겨 정중선 절개를 다시 엽니다. 간 절제술이 24-48 시간보다 오래된 경우 봉합사를 제거하고 가위로 피부를 자릅니다.
- 5-0 폴리 프로필렌 봉합사를 흉골에 고정하고 두개골로 당긴 다음이 위치에 고정하십시오. 견인기 또는 간단한 클립을 사용하여 복부를 열어 두십시오. 복강은 접근과 시각화를 최적화하기 위해 가능한 한 많이 노출되어야 합니다.
- 면봉을 사용하여 장을 오른쪽으로 움직여 문맥과 대정맥을 드러냅니다. 젖은 천을 사용하여 내장을 유지하십시오.
- 약 2cm 높이의 무거운 물체(예: 부피 플라스크용 실리콘 코팅 추 링)를 마우스 뒷다리 옆에 놓습니다(보충 그림 S2A). 연결된 26G IV 캐뉼라가 있는 튜브를 물체에 놓고 바늘을 대정맥 위에 조심스럽게 놓습니다. 튜브의 길이를 조정하십시오.
- 준비된 콜라게나제 원액을 예열된 소화 완충 튜브에 넣습니다. 250 μL의 저장 용액을 10 mL의 소화 완충액에 첨가합니다. 동물 당 10-20 mL의 소화 완충액을 준비하십시오. 더 큰 동물 또는 전체 간 관류의 경우 최대 30mL의 소화 완충액을 준비하십시오.
알림: 분해 과정이 시작되기 약 30분 전에 따뜻해진 소화 완충액에 콜라게나제 원액을 추가하는 것이 좋습니다.
그림 2: 관류 설정에 대한 개요. (A) 관류에 필요한 장비가 있는 수술대. (B) 간 준비, 간세포 추출 및 분리에 필요한 재료. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 캐뉼라 및 관류
- 펌프 속도를 3mL/분으로 조정하고 펌프를 켭니다. 예열된 관류 완충액이 바늘에 닿도록 합니다. 처음 2-3mL의 관류 완충액을 폐기합니다.
- 하대정맥의 캐뉼라 삽입을 수행합니다.
- 완충액이 바늘을 통과하는 동안 26G IV 캐뉼라를 얕은 각도로 신장 아래의 대정맥에 삽입합니다. 바늘 경사가 위쪽을 향하도록 하십시오.
- 면봉을 사용하여 대정맥을 천자 부위 아래로 꼬리 방향으로 부드럽게 당겨 제공된 장력이 캐뉼라가 정맥에 쉽게 삽입되도록 합니다. 바늘이 내강에 들어갈 때 카테터의 플래시 챔버에서 혈액을 찾으십시오.
- 플라스틱 카테터의 끝 부분도 정맥에 들어갔는지 확인하기 위해 바늘을 2-3mm 더 전진시킵니다.
- 플라스틱 카테터를 바늘 위로 밀어 넣고 대정맥에 5mm 더 밀어 넣습니다. 바늘을 천천히 그리고 아주 조심스럽게 제거하십시오.
알림: 캐뉼라를 합자로 고정하는 것은 권장하지 않습니다. 이 단계는 이 목적을 위해 먼저 용기를 해부해야 하기 때문에 시간이 많이 걸립니다. 캐뉼라가 느슨하게 배치되고 물체로 지지되면 추가 고정이 필요하지 않습니다( 보충 그림 S2의 관류 설정 참조). 캐뉼레이션 부위를 안정화하고 역류를 방지하기 위해 단량체 n-부틸-시아노아크릴레이트 한 방울을 캐뉼레이션 부위에 추가할 수 있습니다.
- 캐뉼라에서 혈액이 떨어지면 주사기를 사용하여 따뜻한 관류 완충액으로 채 웁니다.
- 3mL/min의 펌프 속도로 작동하는 캐뉼라에 튜브를 다시 부착합니다. 관류 완충액이 간으로 들어가도록 합니다.
- 2-3초 후, 간에 흰 반점이 형성되거나 문맥의 확장/부종이 나타나는지 확인하는데, 이는 관류 완충액이 간을 통해 흐르고 중심 정맥에서 간 소엽으로 들어가고 있음을 나타냅니다(그림 3).
- 간 표면에 흰 반점이 나타난 후 1-2 초 내에 문맥이 눈에 띄게 부풀어 오를 때까지 기다리십시오. 간문에서 가능한 한 멀리 가위로 문맥을 자릅니다. 마이크로 용기 클립을 사용하여 절단 부위에 라벨을 붙입니다(폐색하지 않음).
참고: 이것은 관류 과정에서 간을 통한 흐름의 평가를 단순화합니다. 간은 즉시 혈액을 제거하고 몇 초 안에 황백색으로 변합니다(그림 3C). 복부 개구부의 오른쪽에 있는 피부를 추가로 절단하면 관류 용액뿐만 아니라 혈액의 유출이 용이해집니다(그림 3B 및 보충 그림 S2B,C). - 동물의 체중, 간 크기 및 이전 간 절제술의 정도에 따라 최대 4-7mL/분까지 유량을 증가시킵니다.
- 핀셋이나 혈관 클램프로 문맥을 7-10 초 동안 고정하십시오. 액체가 통과하지 않는지 확인하십시오.
참고: 간은 클램핑 중에 눈에 띄게 부풀어 오르고 방출 시 이완됩니다. 이것은 간 전체를 씻어내고 남아 있는 혈액을 제거하는 데 중요합니다. - 약 30 초 후에 두 번째 클램프를 수행하고 간이 부풀어 오르고 이완되는지 확인하십시오. 문맥에서 흘러 나오는 완충액이 깨끗해질 때까지 동물을 계속 씻어 내되 적어도 3-4 분 동안.
알림: 펌프 속도는 튜브와 간 크기에 따라 다릅니다. 개별적으로 평가해야 합니다. - 절차의 이 시점에서 안락사는 출혈에 이차적으로 발생했어야 합니다. 전신 순환이 멈췄는지 확인합니다(심장 박동이나 심장 깜박임 없음). 사망을 보장하기 위해 양측 기흉은 안락사의 2 차 물리적 방법으로 절차의이 단계에서 수행됩니다.
알림: 전신 순환이 멈춘 경우(심장 박동이나 심장 깜박임 없음) 펌프 속도를 약간 줄이십시오.
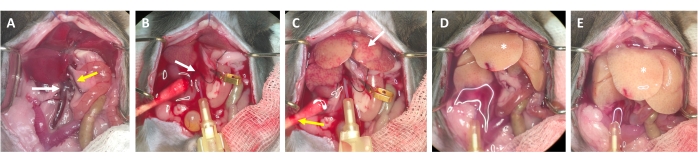
그림 3: 캐뉼라 삽입에서 소화까지의 관류 과정 . (A) 하대정맥(흰색 화살표)과 문맥(노란색 화살표)이 있는 마우스 간의 해부학. (B) 하대정맥의 캐뉼라. 캐뉼라는 합자 (흰색 화살표)로 고정되고 열린 문맥을 통한 유출 위치는 마이크로 용기 클램프로 표시됩니다 (고정되지 않음). (C) 관류 완충액이 남아 있는 모든 혈액에서 간을 제거하기 전에 고르지 못한 구조의 모양에 주목하십시오(흰색 화살표). 피부를 절개하고(노란색 화살표) 면봉을 넣어 혈액과 관류액의 배출을 보장합니다. 간헐적 클램핑은 혈관 클램프 또는 핀셋으로 수행 할 수 있습니다. (D) 간에서 모든 혈액을 제거해야합니다 (*). 콜라게나제 함유 소화 완충액이 간에 들어간 후에는 클램핑 후 더 이상 이완되지 않고 간엽의 크기가 증가합니다. (E) 잠시 후 간 표면에 거품이 많은 모양이 관찰 될 수 있습니다 (*). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
5. 소화
- 관류 펌프를 일시 중지하고 관류 완충액에서 예열된 소화 완충액으로 입구 튜브를 빠르게 옮깁니다. 펌프를 다시 시작하십시오.
- 소화 완충액이 간에 도달하기 전에 문맥을 3-4초 동안 한 번 더 고정합니다. cl을 놓을 때 간이 이완되는지 확인하십시오.amp 관류액이 깨끗하게 유지됩니다.
참고: 소화 완충액에는 페놀 레드가 포함되어 있으며 투명 관류 완충액과 쉽게 구별할 수 있습니다. 이를 통해 튜브 내에서 쉽게 추적할 수 있습니다. - 소화 완충액이 간에 도달하자마자 마이크로 혈관 클립으로 문맥을 다시 한 번 고정합니다.
알림: 클램핑할 때 간은 부풀어 오르지만 cl을 놓아도 이완되지 않습니다.amp. 이것은 정상입니다. - 소화 과정을 촉진하기 위해 횡격막 바로 아래에 있는 혈관 클램프로 상대정맥을 닫아 소화 완충액이 하대정맥에서 간으로 전달되어 열린 문맥을 통해 유출되도록 합니다.
알림: 이 클amping은 전신 순환을 우회하고 잔류 혈액 성분/억제제와의 불필요한 접촉을 방지합니다. 이 단계는 가짜 수술 후 확대 된 간 조직 뒤의 상대 정맥에 접근하기가 어렵 기 때문에 선택 사항이지만 간 절제술을받은 마우스에서는 접근이 훨씬 쉽습니다. - 5mL/분의 유속으로 약 4분 동안 분해합니다. 소화가 진행됨에 따라 간이 부풀어 오르기 시작하는 징후와 간 표면의 작고 투명하고 투명한 부분을 찾으십시오. 또한 간이 젖은 천 조각의 질감을 띠고 거의 눅눅해 보이는 것을 관찰하십시오(그림 3E). 젖은 면봉으로 조심스럽게 만져 일관성을 조사하십시오.
- 간 표면 질감의 현저한 차이가 관찰 될 때까지 관류를 계속하십시오. 간은 매우 밝은 색과 거품이 많은 모양을 취하고(그림 3E) Glisson 캡슐(즉, 간 자루)이 실질에서 분리되는 것을 관찰합니다. 과다 소화는 간세포를 손상시킬 수 있으므로 간이 이러한 특성을 획득하자마자 소화 과정을 중단하십시오. 공기가 간으로 들어가기 전에 바늘을 제거하십시오.
알림: 충분한 소화에 도달하려면 일반적으로 10-20mL의 소화 완충액이 필요합니다. 이것은 동물의 크기, 간 절제술의 정도, 튜브 설정 및 콜라게나제 용액의 품질에 따라 다릅니다. 필요한 경우 관류 속도보다는 관류 시간을 늘립니다. 혈관계에 너무 많은 압력이 가해지면 간이 파열되고 관류/소화액이 후복막 공간으로 손실될 수 있습니다.
6. 간 준비
- 복강에서 간을 부드럽게 제거하십시오. 지금은 매우 연약하고 깨지기 쉬우므로 매우 조심하십시오.
- 집게를 사용하여 돌출부 사이의 중앙 결합 조직을 잡고 앵커 포인트로 사용하여 약간 위로 들어 올립니다.
- 간과 다른 장기의 모든 연결을 끊고 담낭을 제거한 다음 간을 얼음처럼 차가운 보존 완충액에 넣습니다.
참고: 이상적으로는 간세포의 생존력을 유지하기 위해 간세포 추출 및 추가 처리가 즉시 이루어져야 합니다. 그러나, 필요하다면, 간은 4°C에서 짧은 시간 동안 저장될 수 있다(예를 들어, 수송을 위해). 이 지연은 30-40 분을 초과해서는 안됩니다.
7. 간세포 추출
- 간을 10cm 페트리 접시에 옮기고 얼음처럼 차가운 Williams의 Medium E 10mL를 추가합니다.
- 간 표면을 따라 몇 군데에 미세한 핀셋으로 Glisson의 캡슐을 파열시킵니다. 두 쌍의 핀셋으로 중앙 부분(예: 간 문골의 결합 조직)을 잡고 천천히 당겨 간세포를 손상시키지 않고 캡슐이 찢어지도록 합니다. 캡슐을 부드럽게 흔들어 세포를 방출합니다(보충 그림 S3).
참고: 이상적으로는 간이 쉽게 찢어지고 세포가 방출됩니다. 힘을 가하지 마십시오. 셀 스크레이퍼는 모든 셀을 완전히 제거하고 셀 수율을 높이는 데 도움이 될 수 있습니다. 가위로 간을 조각으로 자르지 마십시오. - 100μm 세포 여과기를 통해 5mL의 간 펄프를 50mL 튜브에 걸러냅니다. 신선한 얼음처럼 차가운 배지 10mL로 필터를 헹굽니다. 나머지 5mL의 펄프를 셀 스트레이너를 통해 여과합니다.
참고: 25mL 혈청학적 피펫을 사용하여 해리된 간세포와 함께 치수를 옮깁니다(그림 4A). 더 작은 개구부를 가진 더 작은 피펫은 전단 응력을 증가시키고 간세포를 돌이킬 수 없게 손상시킵니다. - 총 30mL의 차가운 배지를 추가하여 페트리 접시를 헹구고 여과한 다음 현탁액을 가득 찰 때까지 50mL 튜브에 추가합니다. 모든 분리된 세포는 이제 현탁액에 있습니다(그림 4B).
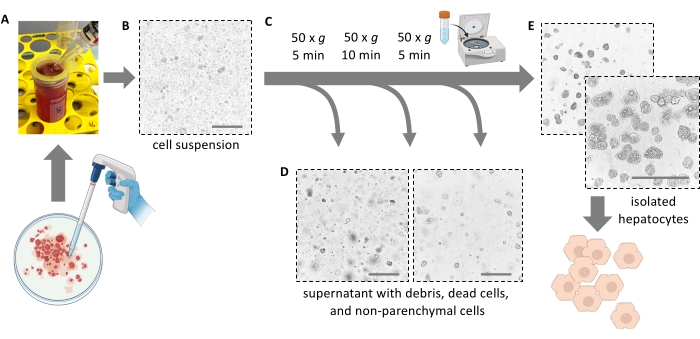
그림 4: 부드러운 원심분리에 의한 정제 . (a) 추출 단계 후 남은 간 균질액. (B) 균질액의 현미경 보기(20x 배율); 파편으로 표시된 오염에 유의하십시오. (c) 정제 원심분리 단계 및 (d) 폐기될 상층액의 현미경 보기. (E) 정제된 간세포 분획의 현미경 관찰. 스케일 바 = 100 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
8. 간세포 분리
- 4°C에서 50 ×g 에서 5분 동안 회전합니다(최저 가속 및 최저 브레이크 가능).
참고: 간세포는 실질이 아닌 간 세포보다 밀도가 높습니다. 원심분리력이 낮기 때문에 간세포만 펠릿화되고 다른 세포(예: 면역 세포, 적혈구 및 정현파 세포)는 상청액에 남아 있습니다. - 대부분의 상층액을 흡인하고 1mL를 남겨두고 튜브를 부드럽게 소용돌이치게 하여 세포를 재현탁합니다.
- 차가운 Williams' E 배지 40mL를 넣고 4°C(낮은 가속, 낮은 브레이크)에서 10분 동안 50× g 에서 다시 회전시켜 죽은 간세포와 세포 파편, 펠릿 생존 및 지방 간세포를 추가로 제거합니다(그림 4C).
- 대부분의 상층액을 버리고 1mL를 남겨두고 튜브를 소용돌이치게 하여 세포를 재현탁합니다.
- 차가운 Williams' E 배지 40mL를 넣고 50°C에서 5 분 동안 4g×g으로 다시 회전합니다(낮은 가속, 낮은 브레이크).
- 대부분의 상층액을 흡인하고 1mL를 남겨두고 튜브를 부드럽게 소용돌이치게 하여 세포를 재현탁합니다.
참고: 셀이 고정되거나 분석될 때까지 이 프로세스를 중지하지 마십시오. 간세포는 매우 약하며 관류, 소화 및 정제 과정이 지연되면 세포가 손상될 수 있습니다. - 트립판 블루를 첨가한 후, 노이바우어-개량된 계수 챔버를 사용하여 최종 세포 농도를 결정하였다.
참고: 대부분의 파편과 비실질 세포가 제거되어 70% 간 절제술 후 약 10-15 ×10 6 개의 간세포가 남게 되었습니다. - 원하는 농도에 따라 얼음처럼 차가운 매체를 더 추가합니다. 다운스트림 분석을 위해 간세포 세포 현탁액을 사용하거나 1차 세포 배양을 시작하십시오.
참고: 이 단계에서는 현탁액에 면역 세포와 비실질 세포(<5%)만 남아 있습니다. 추가 정제가 필요한 경우 자기 또는 형광 활성화 세포 분류(MACS/FACS)를 통해 CD31+ 및 CD45+ 세포의 음성 선택을 수행합니다. 현재까지 간 실질 세포에 대한 신뢰할 수 있고 강력한 표면 마커는 없습니다.
9. 유세포 분석을 위한 분리된 간세포의 제조
- 간세포를 100 × g 에서 5 분 동안 원심 분리합니다.
- 상청액을 버리고 세포 현탁액의 농도에 따라 원하는 양의 유세포 분석 완충액을 추가합니다.
- 유세포 분석 튜브에 세포 현탁액 1mL를 추가합니다. 100 × g 에서 5 분 동안 원심 분리하고 상층액을 버립니다.
- 희석된 Alexa Fluor 488 좀비 녹색 생존력 염료(농도 1:400)의 100-200μL를 세포에 넣고 부드럽게 흔듭니다. 수동으로 흔들거나 2 초 동안 저속 (최대 2-3)에서 와류 믹서를 사용하여 간세포를 조심스럽게 재현 탁하십시오.
알림: 작은 피펫 팁을 사용하여 세포를 다시 중단하지 마십시오. 그들은 매우 약하고 적용된 전단 응력은 손상을 일으키고 세포 생존력을 감소시킵니다. 피펫팅을 피할 수 없는 경우, 팁에서 가장 작은 부분을 잘라낸 후 1,000 μL 피펫을 사용하여 직경을 확대하고 세포를 매우 천천히 피펫팅합니다. - 튜브를 얼음 위에 놓거나 원하는 염색에 따라 실온에 보관하십시오. 어둠 속에서 20-30 분 동안 세포를 배양하십시오.
- 2mL의 유세포 분석 완충액을 넣고 세포를 3배 세척합니다. 각 세척 단계 후에 세포를 100 × g 에서 5분 동안 원심분리한다.
- 2mL의 고정 완충액(1:1 4% PFA 및 PBS)을 추가합니다. 수동으로 흔들거나 2 초 동안 저속 (최대 2-3)에서 와류 믹서를 사용하여 간세포를 조심스럽게 재현 탁하십시오.
- 30 분 동안 세포를 고정하십시오.
- 100 × g 에서 5 분 더 원심 분리하고, 상층액을 버리고, 유세포 분석 완충액을 첨가한다.
참고: 세포는 분리 후 최대 72시간까지 분석 전에 유세포 분석 버퍼에 보관할 수 있습니다.
10. 유세포 분석을 통한 간세포 분석
- 형광 활성화 세포 분류기를 사용하여 간세포를 분석합니다.
참고: 상대적으로 큰 크기의 간세포를 고려하고 전압을 조정하십시오. 낮은 전압으로 시작하고 순방향 산란(FSC)의 경우 350V, 측면 산란(SSC)의 경우 220V를 넘지 마십시오.- FSC 및 SSC의 전압을 셀의 예상 큰 크기로 조정합니다. SSC-A 및 FSC-A를 사용하여 간세포 집단을 식별하고 모든 이벤트를 기록합니다(그림 5A).
- 파편 및 비실질 세포가 FSC 대 SSC 밀도 플롯의 왼쪽 하단 모서리에 표시되고 제외되는지 관찰합니다(그림 5A).
- 이중선 세포가 분석에 영향을 미칠 수 있으므로 그림 5B와 같이 이중선을 제외하기 위해 측면 산란 높이(SSC-H) 대 측면 산란 면적(SSC-A) 밀도 플롯을 구성합니다.
- CD31- (내피 마커) 및 CD45- (면역 마커) 세포를 게이팅하여 최종 간세포 집단을 선택합니다(그림 5C).
Access restricted. Please log in or start a trial to view this content.
결과
TRAS는 간 절제술 후 16시간에 최고조에 달하고 표준 간 절제술 후 32-48시간 후에 점차 사라지지만 연장된 간 절제술 후 48시간 이상 지속됩니다. 거시적으로 TRAS는 간 잔여물의 창백한 안색으로 쉽게 볼 수 있으며(그림 1F) 수술 후 16시간에서 48시간 사이에 간 절제술을 받은 마우스에서 관찰할 수 있습니다.
추정 된 최종 수율은 마우스에서 70 % 간 절제술 후...
Access restricted. Please log in or start a trial to view this content.
토론
공개된 프로토콜은 FACS 분류 후 단일 세포 다운스트림 분석 또는 세포의 벌크 분석을 위해 정상 및 지방성 쥐 간세포의 높은 수율을 분리하는 신뢰할 수 있고 간단한 방법을 제공합니다. 밀도 구배 정제에 비해 뚜렷한 이점은 세포 지질 함량이 본질적으로 간세포의 효과적인 수율에 영향을 미치지 않는다는 것입니다. 따라서 지방성 간세포의 비율은 유지되고 다운스트림 분석에 포함됩니다. 이것?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 경쟁 이익이 없다고 선언합니다.
감사의 말
이 연구는 스위스 국립 재단(프로젝트 보조금 310030_189262)의 지원을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
참고문헌
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유