Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Farelerde Parsiyel Hepatektomi Sonrası Rejenere Hepatositlerin İzolasyonu
Bu Makalede
Özet
Lipid yüklü hepatositler karaciğer rejenerasyonuna özgüdür, ancak genellikle yoğunluk gradyan santrifüjleme ile kaybolurlar. Burada, steatotik hepatositleri tutan ve farelerde parsiyel hepatektomi sonrası rejenere hepatositlerin temsili popülasyonlarını veren optimize edilmiş bir hücre izolasyon protokolü sunuyoruz.
Özet
Parsiyel hepatektomi, farelerde karaciğer rejenerasyonunu araştırmak için yaygın olarak kullanılmaktadır, ancak aşağı akış tek hücreli uygulamalar için yüksek verimli hepatositlerin izolasyonu zordur. Farelerde normal karaciğer rejenerasyonunun ilk 2 günü boyunca rejenere hepatositler içinde belirgin bir lipit birikimi gözlenir. Geçici rejenerasyonla ilişkili steatoz (TRAS) olarak adlandırılan bu durum geçicidir ancak majör proliferatif faz ile kısmen örtüşür. Yoğunluk-gradyan saflaştırma, primer hepatositlerin izolasyonu için mevcut protokollerin çoğunun bel kemiğidir. Gradyan saflaştırma, hücrelerin yoğunluğuna ve boyutuna dayandığından, steatotik olmayanları steatotik hepatosit popülasyonlarından ayırır. Bu nedenle, yağlı hepatositler sıklıkla kaybolur ve temsili olmayan hepatosit fraksiyonları ortaya çıkar.
Sunulan protokol, lipid içeriğinden bağımsız olarak rejenere hepatositlerin in vivo izolasyonu için kolay ve güvenilir bir yöntem tanımlamaktadır. Erkek C57BL/6 farelerden alınan hepatositler, hepatektomiden 24-48 saat sonra klasik iki aşamalı kollajenaz perfüzyon yaklaşımı ile izole edilir. Standart bir peristaltik pompa, portal venden çıkışlı retrograd bir perfüzyon tekniği kullanarak, kateterize inferior vena kava yoluyla ısıtılmış çözeltileri kalıntıya yönlendirir. Hepatositler, Glisson kapsülünden salınmaları için kollajenaz ile ayrışır. Yıkama ve dikkatli santrifüjlemeden sonra, hepatositler herhangi bir aşağı akış analizi için kullanılabilir. Sonuç olarak, bu yazıda farelerde parsiyel hepatektomi sonrası temsili bir rejenere hepatosit popülasyonunun izolasyonu için basit ve tekrarlanabilir bir teknik anlatılmaktadır. Yöntem ayrıca yağlı karaciğer hastalığının çalışmasına da yardımcı olabilir.
Giriş
Karaciğer, büyük doku kaybından sonra bile kendini yenileyebilir. Bu eşsiz rejeneratif kapasite, ilk olarak 1931'de Higgins ve Anderson tarafından sıçanlarda tanımlanan kısmi (% 70) hepatektominin deneysel modeli ile açıkça gösterilmiştir1. Bu modelde, karaciğerin% 70'i daha büyük karaciğer loblarını keserek hayvanlardan cerrahi olarak çıkarılır. Kalan loblar daha sonra orijinal karaciğer mimarisinin restorasyonu olmadan da olsa, ameliyattan yaklaşık 1 hafta sonra orijinal karaciğer kütlesini geri yüklemek için telafi edici hipertrofi yoluyla büyür 2,3. Karaciğer kalıntısının iyileşmek için çok küçük olduğu% 86 genişletilmiş hepatektomi gibi, değişen miktarlarda doku çıkarılmasına sahip ek hepatektomiler geliştirilmiştir, sonuçta posthepatektomi karaciğer yetmezliğine (PHLF) ve ardından hayvanların% 30-50'sinde ölüme yol açmıştır 4,5,6. Bu modeller, rezeke edilen doku miktarına bağlı olarak normal ve başarısız karaciğer rejenerasyonunun incelenmesini sağlar (Şekil 1).
Hepatektomilerin fare modelleri uzun yıllardır başarıyla kullanılmasına rağmen, son zamanlarda tek hücre düzeyinde daha derin bir içgörü sağlayan daha gelişmiş analitik yöntemlere sahiptir. Bununla birlikte, bu yöntemlerin çoğu için, bireysel hepatositlerin varlığı temel bir önkoşuldur. Primer hepatositlerin izolasyonu için çoğu protokol, iki aşamalı bir kollajenaz perfüzyon tekniğine ve ardından canlı hepatositleri enkaz ve parankimal olmayan hücrelerden ayırmak için yoğunluk gradyanı saflaştırılmasına ve ayrıca ölü hücreleredayanmaktadır 7,8,9. Bu yöntem ilk olarak 1969 yılında Berry and Friend tarafından tanımlanmış10 ve Seglen ve meslektaşları tarafından 1972 yılında uyarlanmıştır11,12. Bununla birlikte, gradyan santrifüjleme hücrelerin yoğunluğuna ve boyutuna dayandığından, lipit yüklü hepatositler genellikle standart saflaştırma sırasında kaybolur. Bu tür bir kayıp birçok araştırma sorusu için ihmal edilebilir olsa da, erken karaciğer yenilenmesi için çok önemli bir husustur. İlk 2 gün boyunca, yenilenen fare karaciğeri içindeki hepatositler lipitleri biriktirir, böylece boyut olarak büyür ve yoğunluğa dalar. Bu geçici rejenerasyonla ilişkili steatoz (TRAS) rejeneratif yakıt sağlamaya hizmet eder ve geçicidir, ancak kısmen majör proliferatif faz ile örtüşür ve karaciğer lobülleri içinde eşit olmayan bir şekilde dağılır - karaciğerin fonksiyonel birimleri13,14. Bununla birlikte,% 86'lık uzatılmış hepatektomiden sonra, TRAS da ortaya çıkar, ancak devam eder, çünkü rejenerasyon durur ve lipitler oksitlenmez14. Bu nedenle,% 70 veya% 86 hepatektomiyi takiben hepatositlerin gradyan saflaştırılması, çoğu lipit yüklü hepatositin düşük yoğunluklu15 nedeniyle kaybolması nedeniyle temsili olmayan fraksiyonlar verecektir.
Bu modifiye izolasyon protokolünde, C57BL/6 farelerden alınan hepatositler, klasik iki aşamalı kollajenaz perfüzyon yaklaşımı ile hepatektomiden 24-48 saat sonra izole edilir. Genellikle, hücre izolasyonu için kalıntının kanülasyonu ve perfüzyonu portal ven yoluyla yapılır. Ancak majör rezeksiyon sonrası kalan küçük rezentlerde portovasküler direnç16 yüksekliğindedir ve bu nedenle perfüzyon hassastır. Vena kava hepatektomilerden etkilenmediği için, perfüzyon vena kavanın kanülasyonu yoluyla retrograd yönde kolayca yapılabilir. Standart bir peristaltik pompa, portal venden çıkışla retrograd perfüzyon kullanarak, kateterize inferior vena kava yoluyla ısıtılmış çözeltileri karaciğer kalıntısına yönlendirir (Ek Şekil S1). Hepatositler kollajenazlar tarafından ayrışır ve Glisson kapsülünden salınır. Düşük hızlı bir santrifüjleme yaklaşımı kullanılarak kademeli izolasyon ile canlı hepatositlerin yıkanması ve dikkatli bir şekilde işlenmesinden sonra, hepatositler herhangi bir aşağı akış analizi için kullanılabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm hayvan deneyleri İsviçre Federal Hayvan Yönetmeliklerine uygundur ve Zürih Veterinerlik Ofisi (n° 007/2017, 156/2019) tarafından onaylanmıştır. 10-12 haftalık erkek C57BL / 6 fareleri, yiyecek ve suya serbest erişimi olan 12 saatlik bir gündüz / gece döngüsünde tutuldu. Her deney grubu altı ila sekiz hayvandan oluşuyordu. Bu protokolde kullanılan tüm malzemeler, ekipmanlar ve reaktiflerle ilgili ayrıntılar için Malzeme Tablosu'na bakın.
1. Farelerde parsiyel hepatektomi
- Standart hepatektomi için (%70), sol lateral lobu, medyan lobun sağ kısmını ve median lobun sol kısmını ligate ve rezeke edin (Şekil 1B). Uzatılmış hepatektomi için (%86)4, kaudat loblarını ve sağ ön lobu da çıkarın (Şekil 1C).
- NOT: Standart hepatektomi, karaciğer rejenerasyon araştırmalarında uzun yıllardır kullanılan bir prosedürdür. Bu prosedür için protokoller, Mitchell ve Willenbring 18'in video destekli protokolü de dahil olmak üzere 3,17 oranında mevcuttur. Burada hepatektomiler için kullanılan teknikler hakkında daha fazla ayrıntı Ek Dosya 1'de bulunabilir.
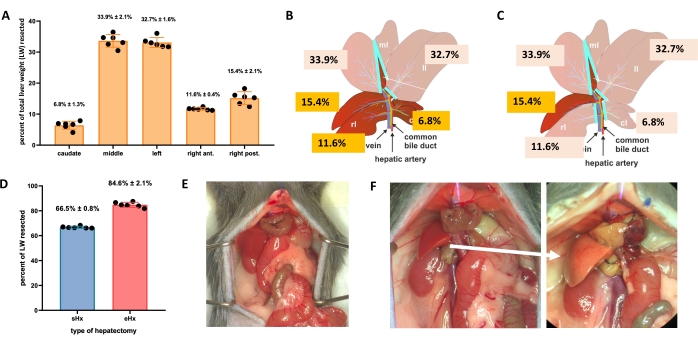
Şekil 1: Farelerde standart (%70) ve genişletilmiş (%86) hepatektomi . (A) Beş fare karaciğer lobu ve bunların toplam karaciğer ağırlığına katkıları. (B) Farelerde %70-hepatektominin şematik gösterimi. Koyu renkli loblar gelecekteki karaciğer kalıntılarını temsil eder. (C) Farelerde %86 hepatektominin şematik gösterimi. Koyu renkli loblar gelecekteki karaciğer kalıntılarını temsil eder. (D) Hepatektomi sonrası %70 ve %86 oranında rezeke edilen dokunun kesin hacmi. (E) %70 hepatektomiden hemen sonra fare karnı; (F) %86 hepatektomi sonrası fare karnı hemen (solda) ve 48 saat (sağda). Steatotik kalıntının soluk rengine dikkat edin (beyaz ok). n = 6-7/grup. Kısaltmalar: sHx = standart hepatektomi; eHx = genişletilmiş hepatektomi; LW = karaciğer ağırlığı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
2. Perfüzyon çözeltilerinin hazırlanması
- Perfüzyon, sindirim ve koruma tamponlarını hazırlayın (bkz. Tablo 1).
- Gerektiğinde sodyum hidroksit (NaOH) veya hidrojen klorür (HCl) ekleyerek tüm tampon çözeltilerinin pH'ını 37 °C'de ayarlayın. Tamponlar için optimum pH 7.4'tür.
- Koruma tamponunu ve Williams'ın Orta E'sini buzun üzerine yerleştirin.
- Akış sitometri tamponunu hazırlayın ve buz üzerinde saklayın.
Tablo 1: Hepatositlerin sindirimi ve saflaştırılması için kullanılan çözeltiler ve tamponlar. Bu tabloyu indirmek için lütfen tıklayınız.
3. Perfüzyon ekipmanlarının hazırlanması
- Su banyosunu 42 ° C'ye ısıtın ve perfüzyon tamponunu (50 mL) ve sindirim tamponunu (10-20 mL) su banyosuna yerleştirin. Sindirim tamponuna henüz kolajenaz eklemeyin.
- Peristaltik pompayı hazırlayın ve boruyu yerleştirin. Perfüzyon kurulumunun tamamı Şekil 2'de gösterilmiştir.
- Bir Luer kilit konektörü kullanarak borunun çıkış ucuna bir 26 G IV kanül bağlayın. Tüpün giriş ucunu su banyosundaki önceden ısıtılmış perfüzyon tampon tüpüne yerleştirin. Boruyu% 70 etanol, ardından 50 mL steril sodyum klorür (NaCl% 0.9) ile yıkayın. Boruyu sıcak perfüzyon tamponu ile astarlayın (pompa hızı 3 mL/dak).
- İzofluran inhalasyon anestezisi kullanarak fareyi sakinleştirin (800 mL / dakO2, indüksiyon için% 3-5 izofluran ve işlem sırasında bakım için% 2). İzofluranı bir laboratuvar başlığı altında tutun ve yeterli havalandırma sağlayın.
- Buprenorfin'i ameliyattan 30 dakika önce deri altından 0.1 mg / kg vücut ağırlığı dozajında uygulayın.
- Hipotermiyi önlemek için, yatıştırılmış fareyi bir ısıtma pedi üzerine yerleştirin ve karaciğeri diğer organların üzerine çıkarmak ve inferior vena kavaya erişimi kolaylaştırmak için üst karın altına haddelenmiş bir bez doku koyun.
NOT: Damarların bükülmesi mümkün olduğundan ve perfüzyon etkinliği etkileneceğinden çok kalın doku kullanmayın. - Kornea hasarını önlemek için göz merhemi ekleyin.
- Ameliyata başlamadan önce, pedal çekme refleksini test ederek hayvanın yeterince uyuşturulduğundan emin olun (ayak pedi her iki arka ayaktaki sıkışma). Bir yanıt durumunda, prosedüre başlamadan önce ek anestezi sağlayın ve tekrar test edin.
- Karnı% 70 etanol ile temizleyin.
- Dikişi keserek ve yara kenarlarını yavaşça çekerek orta hat insizyonunu tekrar açın. Hepatektomi 24-48 saatten eskiyse, dikişi çıkarın ve cildi makasla kesin.
- Sternuma 5-0 polipropilen sütür sabitleyin, kraniyal olarak çekin ve bu pozisyonda sabitleyin. Karnı açık tutmak için bir retraktör veya basit klipsler kullanın. Karın boşluğu, erişimi ve görselleştirmeyi optimize etmek için mümkün olduğunca açığa çıkarılmalıdır.
- Portal damarı ve vena kavayı ortaya çıkarmak için pamuklu çubuklarla bağırsakları sağa doğru hareket ettirin. Bağırsakları korumak için ıslak bir bez kullanın.
- Yaklaşık 2 cm yüksekliğinde ağır bir nesneyi (örneğin, hacimsel şişeler için silikon kaplı bir ağırlık halkası) farenin arka ayaklarının yanına yerleştirin (Ek Şekil S2A). Boruyu bağlı 26 G IV kanül ile nesnenin üzerine yerleştirin ve iğneyi dikkatlice vena kavanın üzerine yerleştirin. Borunun uzunluğunu ayarlayın.
- Hazırlanan kollajenaz stok çözeltisini önceden ısıtılmış sindirim tampon tüpüne koyun. 10 mL sindirim tamponuna 250 μL stok çözeltisi ekleyin. Hayvan başına 10-20 mL sindirim tamponu hazırlayın. Daha büyük hayvanlar veya bütün karaciğerlerin perfüzyonu için, 30 mL'ye kadar sindirim tamponu hazırlayın.
NOT: Kollajenaz stok çözeltisinin, sindirim işleminin başlamasından yaklaşık 30 dakika önce ısıtılmış sindirim tamponuna eklenmesi önerilir.
Şekil 2: Perfüzyon kurulumuna genel bakış. (A) Perfüzyon için gerekli ekipmanı içeren ameliyat masası. (B) Karaciğerin hazırlanması için gerekli malzemelerin yanı sıra hepatosit ekstraksiyonu ve izolasyonu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
4. Kanülasyon ve perfüzyon
- Pompa hızını 3 mL/dk'ya ayarlayın ve pompayı açın. Önceden ısıtılmış perfüzyon tamponunun iğneye ulaşmasına izin verin. İlk 2-3 mL perfüzyon tamponunu atın.
- İnferior vena kavanın kanülasyonunu gerçekleştirin.
- Tampon iğneden geçerken, 26 G IV kanülünü böbreğin altındaki vena kavaya sığ bir açıyla yerleştirin. İğne eğiminin yukarı doğru baktığından emin olun.
- Vena kavayı delinme bölgesinin altına dikkatlice çekmek için pamuklu bir çubuk kullanın, böylece sağlanan gerginlik kanülün damara sokulmasını kolaylaştırır. İğne lümene girdiğinde kateterin flaş odasında kan arayın.
- Plastik kateterin ucunun da damara girdiğinden emin olmak için iğneyi 2-3 mm daha ilerletin.
- Plastik kateteri iğnenin üzerinden ve vena kavaya 5 mm daha kaydırın. İğneyi yavaşça ve çok dikkatli bir şekilde çıkarın.
NOT: Kanülün bir bağ ile sabitlenmesi önerilmez. Bu adım zaman alıcıdır, çünkü geminin bu amaç için önce diseke edilmesi gerekir. Kanül gevşek bir şekilde konumlandırılmışsa ve bir nesneyle desteklenmişse, başka bir sabitlemeye gerek yoktur ( Ek Şekil S2'deki perfüzyon kurulumuna bakınız). Kanülasyon bölgesini stabilize etmek ve geri akışı önlemek için, kanülasyon bölgesine tek bir damla monomerik n-bütil-siyanoakrilat eklenebilir.
- Kanülden kan düştüğünde, bir şırınga kullanarak ılık perfüzyon tamponu ile doldurun.
- Tüpü kanüle yeniden takın, hala 3 mL / dak pompa hızında çalışıyor. Perfüzyon tamponunun karaciğere girmesine izin verin.
- 2-3 sn sonra, karaciğerde oluşan beyaz lekeleri ve / veya portal venin genişlemesini / şişmesini arayın, bu da perfüzyon tamponunun karaciğerden aktığını ve karaciğer lobüllerine merkezi venden girdiğini gösterir (Şekil 3).
- Portal venin karaciğer yüzeyinde beyaz lekelerin ortaya çıkmasından sonra 1-2 s içinde gözle görülür şekilde şişmesini bekleyin. Portal damarı makasla karaciğer hilusundan mümkün olduğunca distal olarak kesin. Kesme bölgesini etiketlemek (tıkaymak yerine) için bir mikro kap klipsi kullanın (Şekil 3B).
NOT: Bu, perfüzyon işlemi sırasında karaciğerden geçen akışın değerlendirilmesini kolaylaştırır. Karaciğer kanı anında temizler ve birkaç saniye içinde sarı-beyaza döner (Şekil 3C). Karın açıklığının sağ tarafındaki deriden ilave bir kesik, kanın dışarı akışını ve perfüzyon solüsyonunu kolaylaştırır (Şekil 3B ve Ek Şekil S2B, C). - Hayvanın ağırlığına, karaciğer büyüklüğüne ve önceki hepatektominin derecesine bağlı olarak akışı 4-7 mL / dak'ya kadar artırın.
- Portal damarı cımbızla veya vasküler kelepçeyle 7-10 s kelepçeleyin. Hiçbir sıvının geçmediğinden emin olun.
NOT: Karaciğer sıkıştırma sırasında gözle görülür şekilde şişer ve serbest bırakıldıktan sonra gevşer. Bu, tüm karaciğeri yıkamak ve kalan kanı temizlemek için çok önemlidir. - Yaklaşık 30 sn sonra ikinci bir kelepçe uygulayın ve karaciğerin şiştiğinden ve gevşediğinden emin olun. Portal damardan akan tampon temizlenene kadar hayvanı yıkamaya devam edin, ancak en az 3-4 dakika boyunca.
NOT: Pompa hızı tüpe ve karaciğerin boyutuna bağlıdır. Bireysel olarak değerlendirilmelidir. - İşlemin bu noktasında, ötenazi ekssanguinasyona ikincil olarak gerçekleşmiş olmalıdır. Sistemik dolaşımın durduğunu doğrulayın (kalp atışı veya kalbin titremesi yok). Ölümü sağlamak için, prosedürün bu aşamasında bilateral pnömotoraks, ikincil fiziksel ötenazi yöntemi olarak gerçekleştirilir.
NOT: Sistemik dolaşım durduysa pompa hızını biraz azaltın (kalp atışı veya kalp titremesi yok).
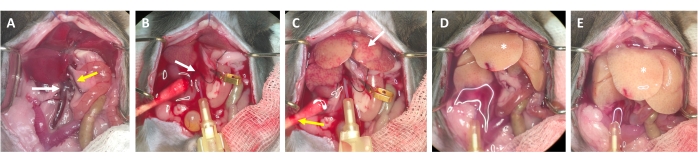
Şekil 3: Kanülasyondan sindirime kadar perfüzyon süreci . (A) Fare karaciğerinin inferior vena kava (beyaz ok) ve portal ven (sarı ok) ile anatomisi. (B) İnferior vena kavanın kanülasyonu. Kanül bir bağ (beyaz ok) ile sabitlenir ve açılan portal damardan çıkışın yeri bir mikro damar kelepçesi ile işaretlenir (kelepçelenmemiş). (C) Perfüzyon tamponu karaciğeri kalan tüm kandan (beyaz ok) temizlemeden önce yamalı yapıların görünümünü not edin. Cilt kesilir (sarı ok) ve kan ve perfüzyon sıvısının drenajını sağlamak için pamuklu çubukla yerleştirilir. Aralıklı kelepçeleme, vasküler bir kelepçe veya cımbızla yapılabilir. (D) Karaciğer tüm kandan arındırılmalıdır (*). Kollajenaz içeren sindirim tamponu karaciğere girdikten sonra, kelepçelendikten sonra artık gevşemeyecek ve karaciğer loblarının boyutu artacaktır. (E) Bir süre sonra, karaciğer yüzeyinde kabarcıklı bir görünüm gözlenebilir (*). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
5. Sindirim
- Perfüzyon pompasını duraklatın ve giriş borusunu perfüzyon tamponundan önceden ısıtılmış sindirim tamponuna hızlı bir şekilde aktarın. Pompayı yeniden başlatın.
- Sindirim tamponu karaciğere ulaşmadan önce, portal damarı 3-4 s için bir kez daha kelepçeleyin. Kelepçenin serbest bırakılmasından sonra karaciğerin gevşediğinden ve perfüzyon sıvısının berrak kaldığından emin olun.
NOT: Sindirim tamponu fenol kırmızısı içerir ve şeffaf perfüzyon tamponundan kolayca ayırt edilebilir. Bu, tüp içinde kolay izleme sağlar. - Sindirim tamponu karaciğere ulaşır ulaşmaz, portal damarı bir kez daha mikro damar klipsi ile sıkıştırın.
NOT: Kelepçeleme sırasında, karaciğer şişer, ancak kelepçenin serbest bırakılmasından sonra gevşemez. Bu normaldir. - Sindirim işlemini kolaylaştırmak için, sindirim tamponunun inferior vena kavadan karaciğere açılan portal venden çıkışa geçmesine izin vermek için superior vena kavayı diyaframın hemen altında vasküler bir kelepçe ile kapatın.
NOT: Bu kelepçeleme, sistemik dolaşımın atlanmasını ve artık kan bileşenleri/inhibitörleri ile gereksiz temasın önlenmesini sağlar. Bu adım isteğe bağlıdır, çünkü sahte ameliyattan sonra genişlemiş karaciğer dokusunun arkasındaki superior vena kavaya yaklaşmak zordur, ancak hepatetomize farelerde erişim çok daha kolaydır. - 5 mL/dak akış hızında yaklaşık 4 dakika sindirim. Sindirim ilerledikçe, karaciğerin şişmeye başladığına dair işaretleri ve karaciğer yüzeyinde küçük berrak / şeffaf bölümleri arayın. Ayrıca, karaciğerin ıslak bir bez parçasının dokusunu aldığını ve neredeyse ıslak göründüğünü gözlemleyin (Şekil 3E). Nemli bir pamuklu çubukla dikkatlice dokunarak tutarlılığı araştırın.
- Karaciğerin yüzey dokusunda belirgin bir fark gözlenene kadar perfüzyona devam edin. Karaciğerin çok açık bir renk ve kabarcıklı bir görünüm aldığını (Şekil 3E) ve Glisson'un kapsülünün (yani karaciğer çuvalı) parankimden ayrıldığını gözlemleyin. Karaciğer bu özellikleri kazanır kazanmaz sindirim sürecini durdurun, çünkü aşırı sindirim hepatositlere zarar verebilir. Hava karaciğere girmeden önce iğneyi çıkarın.
NOT: Yeterli sindirime ulaşmak için genellikle 10-20 mL sindirim tamponuna ihtiyaç vardır. Bu, hayvanın büyüklüğüne, hepatektominin derecesine, tüp kurulumuna ve kollajenaz çözeltisinin kalitesine bağlıdır. Gerekirse, perfüzyon hızı yerine perfüzyon süresini arttırın. Vasküler sistemdeki çok fazla basınç karaciğerin patlamasına neden olabilir ve perfüzyon / sindirim sıvısı retroperitoneal boşluğa kaybolabilir.
6. Karaciğerin hazırlanması
- Karaciğeri karın boşluğundan yavaşça çıkarın. Şimdi çok çürük ve kırılgan olduğu için çok dikkatli olun.
- Forseps kullanarak loblar arasındaki merkezi bağ dokusunu kavrayın ve bir ankraj noktası olarak kullanarak hafifçe yukarı doğru kaldırın.
- Karaciğerin diğer organlara olan tüm bağlantılarını kesin, safra kesesini çıkarın ve karaciğeri buz gibi soğuk koruma tamponuna yerleştirin.
NOT: İdeal olarak, hepatositlerin yaşayabilirliğini korumak için hepatosit ekstraksiyonu ve daha fazla işlem derhal yapılmalıdır. Bununla birlikte, gerekirse, karaciğer 4 ° C'de kısa bir süre saklanabilir (örneğin, taşıma için). Bu gecikme 30-40 dakikayı geçmemelidir.
7. Hepatosit ekstraksiyonu
- Karaciğeri 10 cm'lik bir Petri kabına aktarın ve 10 mL buz gibi soğuk Williams'ın Orta E'sini ekleyin.
- Glisson'un kapsülünü karaciğer yüzeyi boyunca birkaç yerde ince uçlu cımbızla yırtın. İki çift cımbızla merkezi bir kısmı (örneğin, karaciğer hilusundaki bağ dokusu) kavrayın ve yavaşça birbirinden ayırarak kapsülün hepatositlere zarar vermeden yırtılmasına izin verin. Kapsülü hafifçe sallayarak hücreleri serbest bırakın (Ek Şekil S3).
NOT: İdeal olarak, karaciğer kolayca parçalanır ve hücreleri serbest bırakır. Kuvvet uygulamayın. Bir hücre kazıyıcı, tüm hücrelerin tamamen çıkarılmasına ve hücre veriminin arttırılmasına yardımcı olabilir. Karaciğeri makasla parçalara ayırmayın. - 5 mL karaciğer posasını 100 μm'lik bir hücre süzgecinden 50 mL'lik bir tüpe filtreleyin. Filtreyi 10 mL taze buz gibi soğuk bir ortamla durulayın. Kalan 5 mL hamuru hücre süzgecinden süzün.
NOT: Karaciğer posasını ayrışmış hepatositlerle aktarmak için 25 mL'lik bir serolojik pipet kullanın (Şekil 4A). Daha küçük açıklıklara sahip daha küçük pipetler kayma gerilmesini arttırır ve hepatositlere geri dönüşü olmayan şekilde zarar verir. - Petri kabını durulamak için toplam 30 mL soğuk ortam ekleyin, süzün ve süspansiyonu dolana kadar 50 mL tüpe ekleyin. İzole edilen tüm hücreler şimdi süspansiyondadır (Şekil 4B).
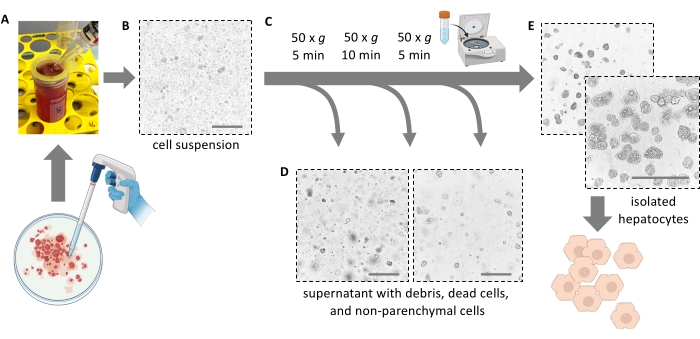
Şekil 4: Nazik santrifüjleme ile saflaştırma . (A) Ekstraksiyon adımından sonra bırakılan karaciğer homojenatı. (B) Homojenatın mikroskobik görünümü (20x büyütme); enkaz ile işaretlenmiş kontaminasyona dikkat edin. (C) Saflaştırma santrifüjleme adımları ve (D) atılacak süpernatantların mikroskobik görünümleri. (E) Saflaştırılmış hepatosit fraksiyonunun mikroskobik görünümü. Ölçek çubukları = 100 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
8. Hepatosit izolasyonu
- 4 °C'de 5 dakika boyunca 50 × g'da döndürün (mümkün olan en düşük hızlanma ve mümkün olan en düşük fren).
NOT: Hepatositler parankimal olmayan karaciğer hücrelerinden daha yoğundur. Düşük santrifüjleme kuvveti nedeniyle, sadece hepatositler peletlenirken, diğer hücreler (örneğin, bağışıklık hücreleri, eritrositler ve sinüzoidal hücreler) süpernatant içinde kalır. - Süper natantın çoğunu aspire edin, tüpü hafifçe döndürerek hücreleri yeniden askıya almak için 1 mL bırakın.
- 40 mL soğuk Williams' E ortamı ekleyin ve ölü hepatositleri ve hücre kalıntılarını ve pelet yaşayabilir ve yağlı hepatositleri daha da uzaklaştırmak için 4 ° C'de (düşük hızlanma, düşük fren) 10 dakika boyunca 50 × g'da tekrar döndürün (Şekil 4C).
- Süper natantın çoğunu atın, tüpü döndürerek hücreleri yeniden askıya almak için 1 mL bırakın.
- 40 mL soğuk Williams' E orta ekleyin ve 4 ° C'de 5 dakika boyunca 50 × g'da tekrar döndürün (düşük hızlanma, düşük fren).
- Süper natantın çoğunu aspire edin, tüpü hafifçe döndürerek hücreleri yeniden askıya almak için 1 mL bırakın.
NOT: Hücreler sabitlenene veya analiz edilene kadar bu işlemi durdurmayın. Hepatositler çok kırılgandır ve perfüzyon, sindirim ve saflaştırma sürecindeki herhangi bir gecikme hücrelere zarar verebilir. - Neubauer tarafından geliştirilmiş bir sayma odası kullanarak, tripan mavisinin eklenmesinden sonra son hücre konsantrasyonunu belirleyin.
NOT: Çoğu enkaz ve parankimal olmayan hücre şimdi çıkarılmıştır, bu da% 70 hepatektomiden sonra kalan yaklaşık 10-15 × 106 hepatositten oluşan temiz bir pelet ile sonuçlanmıştır. - İstenilen konsantrasyona bağlı olarak, daha fazla buz gibi soğuk ortam ekleyin. Herhangi bir aşağı akış analizi için hepatosit hücre süspansiyonunu kullanın veya birincil hücre kültürünü başlatın.
NOT: Bu aşamada, süspansiyonda sadece birkaç immün ve parankimal olmayan hücre (<% 5) kalır. Daha fazla saflaştırma isteniyorsa, manyetik veya floresan ile aktive edilmiş hücre sıralama (MACS / FACS) ile CD31 + ve CD45 + hücrelerinin negatif bir seçimini yapın. Bugüne kadar, karaciğer parankimal hücreleri için güvenilir ve sağlam bir yüzey belirteci yoktur.
9. İzole hepatositlerin akım sitometrisi için hazırlanması
- Hepatositleri 5 dakika boyunca 100 × g'da santrifüj edin.
- Süpernatantı atın ve hücre süspansiyonunun konsantrasyonuna bağlı olarak istenen miktarda akış sitometri tamponu ekleyin.
- Bir akış sitometri tüpüne 1 mL hücre süspansiyonu ekleyin. 100 × g'da 5 dakika santrifüj yapın ve süpernatanı atın.
- Hücrelere seyreltilmiş Alexa Fluor 488 Zombi yeşil canlılık boyasından (konsantrasyon 1:400) 100-200 μL ekleyin ve yavaşça sallayın. Hepatositleri manuel sallayarak veya 2 s boyunca düşük hızda (maksimum 2-3) bir vorteks karıştırıcı kullanarak dikkatlice askıya alın.
NOT: Hücreleri yeniden askıya almak için küçük pipet uçları kullanmayın. Çok kırılgandırlar ve uygulanan kesme stresi hasara neden olur ve hücre canlılığını azaltır. Pipetleme önlenemiyorsa, çapı büyütmek ve hücreleri çok yavaş pipetlemek için uçtaki en küçük parçayı kestikten sonra 1.000 μL'lik bir pipet kullanın. - Tüpleri buz üzerine yerleştirin veya istenen lekelenmeye bağlı olarak oda sıcaklığında saklayın. Hücreleri karanlıkta 20-30 dakika boyunca kuluçkaya yatırın.
- 2 mL akış sitometri tamponu ekleyin ve hücreleri 3x yıkayın. Her yıkama adımından sonra hücreleri 5 dakika boyunca 100 × g'da santrifüj edin.
- 2 mL fiksasyon tamponu ekleyin (%1:1 %4 PFA ve PBS). Hepatositleri manuel sallayarak veya 2 s boyunca düşük hızda (maksimum 2-3) bir vorteks karıştırıcı kullanarak dikkatlice askıya alın.
- Hücreleri 30 dakika boyunca sabitleyin.
- 100 × g'da 5 dakika daha santrifüj yapın, süpernatanı atın ve akış sitometri tamponu ekleyin.
NOT: Hücreler, izolasyondan sonra 72 saate kadar analizden önce akış sitometri tamponunda saklanabilir.
10. Hepatositlerin akış sitometrisi ile analizi
- Hepatositleri, floresan ile aktive edilmiş bir hücre sıralayıcısı kullanarak analiz edin.
NOT: Hepatositlerin nispeten büyük boyutunu göz önünde bulundurun ve voltajları ayarlayın. Düşük voltajla başlayın ve ileri saçılma (FSC) için 350 V'tan ve yan saçılma (SSC) için 220 V'tan daha yükseğe çıkmayın.- FSC ve SSC voltajlarını hücrelerin tahmini büyüklüğüne ayarlayın. Hepatosit popülasyonunu tanımlayın ve SSC-A ve FSC-A kullanarak tüm olayları kaydedin (Şekil 5A).
- Enkaz ve parankimal olmayan hücrelerin FSC'nin SSC yoğunluk grafiğine karşı sol alt köşesinde görüntülendiğini ve dışlandığını gözlemleyin (Şekil 5A).
- Çift hücreler analizi etkileyebileceğinden, Şekil 5B'de gösterildiği gibi, çiftleri dışlamak için bir yan saçılma yüksekliği (SSC-H) ve yan saçılma alanı (SSC-A) yoğunluk grafiği oluşturun.
- CD31- (endotel belirteci) ve CD45- (immün belirteç) hücrelerini geçerek son hepatosit popülasyonunu seçin (Şekil 5C).
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
RAS, hepatektomi sonrası 16 saatte zirve yapar ve standart hepatektomiden 32-48 saat sonra yavaş yavaş kaybolur, ancak genişletilmiş hepatektomiden sonra 48 saatin üzerinde devam eder. Makroskopik olarak, TRAS karaciğer kalıntısının soluk bir teni olarak kolayca görülebilir (Şekil 1F) ve ameliyattan sonra 16 saat ile 48 saat arasında hepatetomize farelerde görülebilir.
Tahmini nihai verim, farelerde %70 hepatektomi sonrası 10-15 × 10 6 hepatosit...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Yayınlanan protokol, tek hücreli aşağı akış analizleri veya FACS sıralamayı takiben hücrelerin toplu analizi için yüksek miktarda normal ve steatotik murin hepatositlerini izole etmek için güvenilir ve basit bir yöntem sağlar. Yoğunluk gradyanı saflaştırmaya göre belirgin avantaj, hücresel lipit içeriğinin hepatositlerin etkili verimi üzerinde esasen hiçbir etkisi olmamasıdır. Böylece, steatotik hepatositlerin fraksiyonu korunacak ve aşağı akış analizlerine dahil edilecektir. Bu sadece s...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar, rakip çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma İsviçre Ulusal Fonud (proje hibesi 310030_189262) tarafından desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Alexa Fluor 488 Zombie green | BioLegend | 423111 | Amine-reactive viability dye |
| Attane Isoflurane ad us. vet. 99.9% | Provet AG | QN01AB06 | CAUTION: needs ventilation |
| EDTA solution | Sigma-Aldrich | E8008-100ML | - |
| Ethanol | Sigma-Aldrich | V001229 | Dilute with water to 70% |
| Fetal bovine serum (FCS) | Gibco | A5256701 | - |
| Hanks' Balanced Salt Solution (HBSS), Ca2+, Mg2+, phenol red | Sigma-Aldrich | H9269-6x600ML | For digestion/preservation |
| Hanks' Balanced Salt solution (HBSS), w/o Ca2+, w/o Mg2+, no phenol red | Sigma-Aldrich | H6648-6x500ML | For perfusion buffer |
| HEPES solution, 1 M | Sigma-Aldrich | 83264-100ML-F | - |
| Histoacryl tissue adhesive (butyl-2-cyanoacrylate) | B. Braun | 1050052 | For stabilization of cannulation site |
| Hoechst 33258 Staining Dye Solution | Abcam | ab228550 | - |
| Liberase Research Grade | Roche | 5401119001 | Lyophilized collagenases I/II |
| NaCl 0.9% 500 mL Ecotainer | B. Braun | 123 | - |
| Paralube Vet Ointment | Dechra | 17033-211-38 | - |
| Phosphate buffered saline (PBS) | Gibco | A1286301 | - |
| Sudan IV – Lipid staining | Sigma-Aldrich | V001423 | - |
| Temgesic (Buprenorphine hydrochloride), Solution for Injection 0.3 mg/mL | Indivior Europe Ltd. | 345928 | Narcotics. Store securely. |
| Trypan blue, 0.4%, sterile-filtered | Sigma-Aldrich | T8154 | For cell counting |
| Williams’ Medium E | Sigma-Aldrich | W4128-500ML | - |
| Materials | |||
| 25 mL serological pipette, Greiner Cellstar | Merck | P7865 | - |
| 50 mL Falcon tubes | TPP | - | - |
| BD Neoflon, Pro IV Catheter 26 G | BD Falcon | 391349 | - |
| Cell scraper, rotating blade width 25 mm | TPP | 99004 | - |
| Falcon Cell Strainer 100 µm Nylon | BD Falcon | 352360 | - |
| Fenestrated sterile surgical drape | - | - | Reusable cloth material |
| Filling nozzle for size 16# tubing (ID 3.1 mm) | Drifton | FILLINGNOZZLE#16 | To go into the tubes |
| Flow cytometry tubes, 5 mL | BD Falcon | 352008 | - |
| Male Luer to Barb, Tubing ID 3.2 mm | Drifton | LM41 | Connection tube to syringe |
| Petri dishes, 96 x 21 mm | TPP | 93100 | - |
| Prolene 5-0 | Ethicon | 8614H | To retract the sternum |
| Prolene 6-0 | Ethicon | 8695H | For skin suture |
| Prolene 8-0 | Ethicon | EH7470E | Ligature gall bladder |
| Tube 16#, WT 1.6 mm, ID 3.2 mm, OD 6.4 mm | Drifton | SC0374T | Perfusion tube |
| Equipment | |||
| BD LSRFortessa Cell Analyzer Flow Cytometer | BD | - | - |
| Isis rodent shaver | Aesculap | GT421 | - |
| Isofluran station | Provet | - | - |
| Low-speed centrifuge – Scanspeed 416 | Labogene | - | - |
| Neubauer-improved counting chamber | Marienfeld | - | - |
| Oxygen concentrator – EverFlo | Philips | 1020007 | 0 – 5 L/min |
| Pipetboy – Pipettor Turbo-Fix | TPP | 94700 | - |
| Shenchen perfusion pump – YZ1515x | Shenchen | YZ1515x | - |
| Surgical microscope – SZX9 | Olympus | - | - |
| ThermoLux warming mat | Thermo Lux | - | - |
| Vortex Genie 2, 2700 UpM | NeoLab | 7-0092 | - |
| Water bath – Precision GP 02 | Thermo scientific | - | Adjust to 42 °C |
Referanslar
- Higgins, G., Anderson, R. Experimental pathology of liver. I. Restoration of liver of white rat following partial surgical removal. Archives of Pathology & Laboratory Medicine. 12, 186-202 (1931).
- Taub, R. Liver regeneration: from myth to mechanism. Nature Reviews Molecular Cell Biology. 5 (10), 836-847 (2004).
- Nevzorova, Y. A., Tolba, R., Trautwein, C., Liedtke, C. Partial hepatectomy in mice. Lab Animal. 49, 1 Suppl 81-88 (2015).
- Lehmann, K., et al. Liver failure after extended hepatectomy in mice is mediated by a p21-dependent barrier to liver regeneration. Gastroenterology. 143 (6), 1609-1619 (2012).
- Makino, H., et al. A good model of hepatic failure after excessive hepatectomy in mice. Journal of Surgical Research. 127 (2), 171-176 (2005).
- Lizardo Thiebaud, M. J., Cervantes-Alvarez, E., Navarro-Alvarez, N. Liver Pathology. Gayam, V., Engin, O. , IntechOpen. (2019).
- Charni-Natan, M., Goldstein, I. Protocol for primary mouse hepatocyte isolation. STAR Protocols. 1 (2), 100086(2020).
- Smedsrød, B., Pertoft, H. Preparation of pure hepatocytes and reticuloendothelial cells in high yield from a single rat liver by means of Percoll centrifugation and selective adherence. Journal of Leukocyte Biology. 38 (2), 213-230 (1985).
- Mederacke, I., Dapito, D. H., Affò, S., Uchinami, H., Schwabe, R. F. High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers. Nature Protocols. 10 (2), 305-315 (2015).
- Berry, M. N., Friend, D. S. High-yield preparation of isolated rat liver parenchymal cells: a biochemical and fine structural study. Journal of Cell Biology. 43 (3), 506-520 (1969).
- Seglen, P. O. Preparation of rat liver cells. I. Effect of Ca 2+ on enzymatic dispersion of isolated, perfused liver. Experimental Cell Research. 74 (2), 450-454 (1972).
- Seglen, P. O. Preparation of isolated rat liver cells. Methods in Cell Biology. 13, 29-83 (1976).
- Trotter, N. L. A fine structure study of lipid in mouse liver regenerating after partial hepatectomy. Journal of Cell Biology. 21 (2), 233-244 (1964).
- Kachaylo, E., et al. PTEN down-regulation promotes β-oxidation to fuel hypertrophic liver growth after hepatectomy in mice. Hepatology. 66 (3), 908-921 (2017).
- Jung, Y., Zhao, M., Svensson, K. J. Isolation, culture, and functional analysis of hepatocytes from mice with fatty liver disease. STAR Protocols. 1 (3), 100222(2020).
- Dold, S., et al. Portal hyperperfusion after extended hepatectomy does not induce a hepatic arterial buffer response (HABR) but impairs mitochondrial redox state and hepatocellular oxygenation. PLoS One. 10 (11), 0141877(2015).
- Boyce, S., Harrison, D. A detailed methodology of partial hepatectomy in the mouse. Laboratory Animals. 37 (11), 529-532 (2008).
- Mitchell, C., Willenbring, H. A reproducible and well-tolerated method for 2/3 partial hepatectomy in mice. Nature Protocols. 3 (7), 1167-1170 (2008).
- Chen, T., Oh, S., Gregory, S., Shen, X., Diehl, A. M. Single-cell omics analysis reveals functional diversification of hepatocytes during liver regeneration. JCI Insight. 5 (22), (2020).
- Chembazhi, U. V., Bangru, S., Hernaez, M., Kalsotra, A. Cellular plasticity balances the metabolic and proliferation dynamics of a regenerating liver. Genome Research. 31 (4), 576-591 (2021).
- Fiegel, H. C., Kaufmann, P. M., Kneser, U., Kluth, D., Rogiers, X. Priming of hepatocytes for cell culture by partial hepatectomy prior to cell isolation. Journal of Tissue Engineering. 6 (6), 619-626 (2000).
- Roche, Liberase TM Research Grade. , (2020).
- Giugliano, S., et al. Hepatitis C virus infection induces autocrine interferon signaling by human liver endothelial cells and release of exosomes, which inhibits viral replication. Gastroenterology. 148 (2), 392-402 (2015).
- Shetty, S., et al. Common lymphatic endothelial and vascular endothelial receptor-1 mediates the transmigration of regulatory T cells across human hepatic sinusoidal endothelium. The Journal of Immunology. 186 (7), 4147-4155 (2011).
- Edwards, S., Lalor, P. F., Nash, G. B., Rainger, G. E., Adams, D. H. Lymphocyte traffic through sinusoidal endothelial cells is regulated by hepatocytes. Hepatology. 41 (3), 451-459 (2005).
- Helling, T. S. Liver failure following partial hepatectomy. HPB. 8 (3), 165-174 (2006).
- Saran, U., Humar, B., Kolly, P., Dufour, J. F. Hepatocellular carcinoma and lifestyles. Journal of Hepatology. 64 (1), 203-214 (2016).
- Park, W. Y., et al. Sugar-sweetened beverage, diet soda, and nonalcoholic fatty liver disease over 6 years: the Framingham Heart Study. Clinical Gastroenteroly and Hepatology. , (2021).
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic fatty liver disease-related hepatocellular carcinoma: a problem of growing magnitude. Seminars in Liver Disease. 35 (3), 304-317 (2015).
- Roeb, E. Excess body weight and metabolic (dysfunction)-associated fatty liver disease (MAFLD). Visceral Medicine. 37 (4), 273-280 (2021).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır