Method Article
تحليل السكان والخلية المفردة لاستمرار المضادات الحيوية في الإشريكية القولونية
In This Article
Summary
يصف ثبات المضادات الحيوية قدرة المجموعات السكانية الفرعية الصغيرة داخل مجموعة سكانية حساسة متساوية المنشأ على تحمل جرعات عالية من المضادات الحيوية المبيدة للجراثيم بشكل عابر. يجمع البروتوكول الحالي بين مناهج لتوصيف النمط الظاهري لاستمرار المضادات الحيوية على المستويين الجزيئي والخلوي بعد تعريض الإشريكية القولونية لجرعات مميتة من أوفلوكساسين.
Abstract
يشير استمرار المضادات الحيوية إلى قدرة المجموعات الفرعية البكتيرية الصغيرة على تحمل جرعات عالية من المضادات الحيوية المبيدة للجراثيم بشكل عابر. عند العلاج بالمضادات الحيوية للجراثيم ، يتم قتل الجزء الأكبر من البكتيريا بسرعة. هذه المرحلة الأولى السريعة من القتل يتبعها انخفاض كبير في معدل القتل حيث تظل الخلايا الثابتة قابلة للحياة. تقليديا ، يتم تحديد الثبات على مستوى السكان من خلال مقايسات الوقت / القتل التي يتم إجراؤها بجرعات عالية من المضادات الحيوية ولأوقات التعرض المحددة. في حين أن هذه الطريقة توفر معلومات حول مستوى الخلايا الثابتة وحركية القتل ، إلا أنها تفشل في عكس عدم التجانس الجوهري من خلية إلى خلية الكامنة وراء ظاهرة الثبات. يجمع البروتوكول الموصوف هنا بين مقايسات الوقت / القتل الكلاسيكية وتحليل الخلية الواحدة باستخدام الفحص المجهري الفلوري في الوقت الفعلي. باستخدام مراسلي الفلورسنت المناسبين ، يمكن أن يوفر التصوير المجهري للخلايا الحية معلومات تتعلق بتأثيرات المضادات الحيوية على العمليات الخلوية ، مثل تكرار الكروموسوم وفصله ، واستطالة الخلايا ، وانقسام الخلايا. يسمح الجمع بين تحليل السكان والخلية الواحدة بالتوصيف الجزيئي والخلوي للنمط الظاهري للاستمرار.
Introduction
يهدف هذا البروتوكول إلى تحليل النمط الظاهري للثبات البكتيري استجابة لعلاج مضاد حيوي محدد على مستوى الخلية الواحدة والسكان. يصف الثبات قدرة المجموعات السكانية الفرعية الصغيرة داخل مجموعة متجانسة جينيا على تحمل جرعات عالية من المضادات الحيوية المبيدة للجراثيم (الفلوروكينولونات ، الأمينوغليكوزيدات ، β لاكتام ، إلخ) ، مع الحد الأدنى من التركيز المثبط (MIC) لما يسمى بالخلايا الثابتة مطابق لتركيز الجزء الأكبر من السكان. تكشف ديناميكيات القتل ثنائية الطور ، عند قياس بقاء البكتيريا بمرور الوقت في وجود مضاد حيوي ، عن وجود خلايا تتحمل الأدوية بشكل عابر ، مع استئصال سريع أولي للخلايا غير الثابتة ، يليه معدل قتل أبطأ بكثير للخلايا الثابتة. عند إزالة المضادات الحيوية ، تؤدي هذه الخلايا إلى ظهور مجموعة متطابقة وراثيا تعرض ديناميكيات قتل مماثلة عند معالجتها بنفس المضاد الحيوي 1,2. على عكس الثبات ، يتم تعريف مقاومة المضادات الحيوية على مستوى السكان وهي عموما نتيجة لطفرات دي نوفو أو النقل الجيني الأفقي للبلازميد3 الذي يمنح المقاومة. في حين أن الطفرات المسؤولة عن المقاومة تقع في الغالب في هدف الدواء أو في المناطق الترويجية لمضخات تدفق الدواء ، أثبتت الجينات التي تغير تردد الثبات الذي حددته مناهج تحليل الطفرات على مستوى الجينوم والمستهدفة أنها عديدة ومتنوعة2،3،4،5،6،7،8 . لذلك ، من المحتمل أن تدخل الخلايا البكتيرية إلى الحالة الثابتة من خلال مسارات متعددة9،10،11 ، وهناك حاجة إلى طرق للتحقيق في ظاهرة الثبات على مستوى الخلية الواحدة لتوصيف فسيولوجيا هذه الخلايا الثابتة.
مهد التطور الأخير لأدوات الموائع الدقيقة المستخدمة مع الفحص المجهري الفلوري الطريق لتوصيف النمط الظاهري للثبات وسلط الضوء على دور العمليات الخلوية الرئيسية ، مثل تكرار الكروموسوم 12 ، وإصلاح الحمض النووي13 ، وانقسام الخلايا14 ، في تكوين الخلايا الثابتة. في هذه الورقة ، نصف نهجا متكاملا يجمع بين فحوصات علم الأحياء الدقيقة الكلاسيكية والتصوير الحي أحادي الخلية لتوصيف الخلايا الثابتة المتولدة في مزارع الإشريكية القولونية المتنامية بشكل كبير والمعالجة بجرعة عالية من أوفلوكساسين. يمكن تطبيق البروتوكول الموصوف هنا لدراسة ظاهرة ثبات المضادات الحيوية في الأنواع البكتيرية الأخرى ، مثل Bacillus subtilis15 ، أو الظروف (على سبيل المثال ، استمرار المضادات الحيوية بعد العلاج β-lactam16) ويمكن تعديله بسهولة للتحقيق في العديد من الظواهر التي تنطوي على عدم تجانس النمط الظاهري 17،18،19 . علاوة على ذلك ، يمكن دمج الإعداد الموصوف في هذه الورقة مع مراسلين فلورسنت آخرين للتحقيق في المعلمات الخلوية المتميزة ذات الأهمية ، مثل المستويات داخل الخلايا من الرقم الهيدروجيني20 أو ATP21 على مستوى الخلية الواحدة ، والتي قد تنتج رؤى جديدة في ظاهرة استمرار المضادات الحيوية.
Protocol
ملاحظة: استخدم الأواني الزجاجية المعقمة ، وأطراف الماصة ، ووسط النمو. هنا ، نمت خلايا الإشريكية القولونية في وسط منخفض التألق الذاتي المحدد كيميائيا (انظر جدول المواد). تم إجراء عمليات التلقيح في وجود موقد بنسن لتقليل مخاطر التلوث.
1. زراعة الخلايا ومنحنى النمو
- قم بخط سلالة الاهتمام من مخزون الجلسرين المجمد على صفيحة أجار Luria-Bertaini (LB) (مكملة بمضاد حيوي انتقائي ، إذا لزم الأمر) ، واحتضانها عند 37 درجة مئوية طوال الليل (بين 15 ساعة و 19 ساعة) للحصول على مستعمرات مفردة.
ملاحظة: تستخدم التجربة المعروضة هنا سلالتين ، E. coli K-12 MG1655 المقابلة لسلالة wt وسلالة MG1655 hupA-mCherry متساوية المنشأ22. تعبر السلالة الأخيرة عن الوحدة الفرعية α الموسومة بالتألق للبروتين المرتبط بالنيوكليويد HU. تم دمج مراسل hupA-mCherry في الموقع الأصلي ل hupA. يعمل HU-mCherry كوكيل لمتابعة ديناميكيات النواة في الخلايا الحية لأنه يرتبط بالحمض النووي بطريقة غير محددة. - تلقيح 5 مل من الوسط (هنا ، 3- [N-morpholino] وسط قائم على حمض البروبان سلفونيك [MOPS] ؛ الجدول 1 والجدول 2 والجدول 3) مع استكمال الجلوكوز 0.4 ٪ والمضادات الحيوية الانتقائية (إذا لزم الأمر) مع مستعمرة معزولة في أنبوب زجاجي (≥25 مل) ، ووضع الأنبوب في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 180 دورة في الدقيقة (دورة في الدقيقة) بين عشية وضحاها (بين 15 ساعة و 19 ساعة). بدلا من ذلك ، يمكن استخدام الأنابيب البلاستيكية أو الزجاجية أو القوارير البلاستيكية (≥ 25 مل) بدلا من الأنابيب الزجاجية.
ملاحظة: تم استخدام وسط MOPS المكمل بالجلسرين بتركيز نهائي قدره 0.4٪ خلال التجارب الموصوفة في هذه الورقة ، باستثناء المزارع الليلية التي أجريت في MOPS glucose 0.4٪. وقت توليد الإشريكية القولونية في MOPS المكمل بالجلوكوز أقصر من ذلك الموجود في MOPS glycerol. يضمن استخدام MOPS الجلوكوز 0.4٪ بدلا من MOPS glycerol 0.4٪ في هذه الخطوة وصول الخلايا إلى المرحلة الثابتة في غضون 19 ساعة. يمكن أيضا استخدام وسائط نمو أخرى ، مثل M9 أو الوسط الغني المحدد (RDM) المكمل بمصادر كربون متميزة. ومع ذلك ، تجدر الإشارة إلى أن معدل النمو وتواتر الثبات يختلفان اعتمادا على الوسيط و / أو الكربون المستخدم23. - في صباح اليوم التالي ، جهاز طرد مركزي 1 مل من المزرعة عند 2300 × جم لمدة 3 دقائق ، وتخلص من المادة الطافية ، وأعد تعليق الحبيبات برفق في نفس الحجم من المحلول الملحي المخزن بالفوسفات (PBS). قم بقياس الكثافة البصرية عند 600 نانومتر (OD 600 نانومتر) ، واحسب الحجم المطلوب ل OD600 نانومتر أولي من 0.01 في حجم نهائي قدره 2 مل.
- ضع 2 مل من MOPS glycerol 0.4٪ في بئر من صفيحة 24 بئر صافية القاع ، وقم بالتلقيح بحجم الاستزراع المحسوب بين عشية وضحاها. ضع اللوحة المكونة من 24 بئرا في قارئ صفيحة مجهرية آلي (انظر جدول المواد) لمراقبة OD600 نانومتر لمدة 24 ساعة. اضبط قارئ الصفيحة الدقيقة لقياس OD600 نانومتر كل 15 دقيقة عند درجة حرارة 37 درجة مئوية وبدوران مداري عالي (140 دورة في الدقيقة).
ملاحظة: إذا كانت السلالة المستخدمة في التجربة تشفر مراسلا فلوريا ، فتأكد من أن معدل نموه مشابه لمعدل نمو الوزن لتجنب أي قطعة أثرية في التجارب اللاحقة ، حيث يؤثر معدل النمو على تردد ثبات المضادات الحيوية23. نظرا لقيود الكشف عند كثافات الخلايا المنخفضة جدا والتأثيرات المحتملة الخاصة بالإجهاد على علاقة OD600 نانومتر / وحدات تشكيل المستعمرة (CFU) ، يوصى بتقييم حركية النمو من خلال مراقبة CFU · mL-1 عند العمل مع سلالات غير مميزة.
2. تحديد الحد الأدنى من التركيز المثبط للمضادات الحيوية
ملاحظة: يتم تعريف الحد الأدنى للتركيز المثبط (MIC) على أنه أقل جرعة من المضادات الحيوية التي لا يلاحظ فيها نمو البكتيريا. يجب إجراء تحديد MIC لكل مضاد حيوي وسلالة. في التجارب الموصوفة هنا ، تم استخدام المضاد الحيوي الفلوروكينولون أوفلوكساسين (OFX). يسمح تحديد MIC بتأكيد أن محلول المضادات الحيوية قد تم تحضيره بشكل صحيح ، وأن المضاد الحيوي نشط ، وأن السلالات حساسة بنفس القدر للمضاد الحيوي. هنا ، تم إجراء طريقة تخفيف الآجار المنشورة لتحديد MIC إلى OFX للسلالات المختلفة المستخدمة24. يمكن أيضا تحديد MIC لمضاد حيوي معين لسلالة بكتيرية معينة عبر طريقة تخفيف المرق24.
- تحضير الألواح لتحديد الميكروفون
- تحضير محلول مخزون رئيسي للمضاد الحيوي المستخدم في التجارب عن طريق إذابة 5 ملغ من OFX في 1 مل من الماء عالي النقاء. أضف 20 ميكرولتر من 37٪ حمض الهيدروكلوريك لزيادة قابلية ذوبان OFX.
- قم بإذابة 100 مل من أجار LB المعقم ، واحتفظ به عند 55 درجة مئوية لتجنب التصلب. قم بإعداد ست قوارير زجاجية صغيرة (25 مل) ، وماصة 5 مل من وسط أجار LB السائل في كل قارورة باستخدام ماصة معقمة.
- قم بتخفيف 10 ميكرولتر من محلول المخزون الرئيسي 5 mg ·mL-1 OFX في 90 ميكرولتر من الماء عالي النقاء (تخفيف 1:10 للمخزون الرئيسي). أضف 0 ميكرولتر أو 2 ميكرولتر أو 4 ميكرولتر أو 6 ميكرولتر أو 8 ميكرولتر أو 10 ميكرولتر من محلول 500 ميكروغرام -1 OFX إلى كل من القوارير الزجاجية الستة التي تحتوي على 5 مل من وسط أجار LB لتوليد وسط أجار LB بتركيزات نهائية تبلغ 0 ميكروغرام · مل −1 ، 0.02 ميكروغرام · مل −1 ، 0.04 ميكروغرام · مل −1 ، 0.06 ميكروغرام · مل − 1 ، 0.08 ميكروغرام · مل − 1 ، و 0.1 ميكروغرام · مل -1 OFX ، على التوالي. امزج المحلول عن طريق تدوير القوارير عدة مرات.
ملاحظة: إذا كان الميكروفون للمضاد الحيوي محل الاهتمام معروفا ، فيجب أن يصل نطاق التركيزات من أسفل إلى أعلى من MIC الفعلي. إذا كان MIC غير معروف ، يوصى باستخدام مجموعة كبيرة من التركيزات مع سلسلة تخفيف log2 . تأكد من أن وسط أجار LB قد برد قبل إضافة المضاد الحيوي ، لأن درجات الحرارة المرتفعة قد تعطله. ومع ذلك ، من المهم عدم ترك وسط أجار LB يتصلب قبل إضافة المضاد الحيوي ، لأن هذا قد يؤدي إلى التوزيع غير المتجانس للمضاد الحيوي في وسط أجار LB. - صب 5 مل من كل من وسائط أجار LB الستة المحضرة في الخطوة 2.1.3 بطريقة زيادة الجرعة في صفيحة استزراع ذات 6 آبار باستخدام ماصة معقمة. دع الآجار يبرد حتى يصلب ، وجفف اللوحة قبل الاستخدام.
ملاحظة: قم بإعداد محلول المضادات الحيوية ، ولوحة الاستزراع في يوم إجراء الفحص.
- مقايسة تحديد الميكروفون
- قم بتلقيح 5 مل من وسط LB بمستعمرة معزولة في أنبوب زجاجي (≥25 مل) ، وضع الأنبوب الزجاجي في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 180 دورة في الدقيقة طوال الليل (بين 15 ساعة و 19 ساعة).
- في صباح اليوم التالي ، قم بقياس OD600 نانومتر ، وقم بتخفيف الثقافة في أنبوب اختبار إلى كثافة خلية نهائية تبلغ 1 × 107 CFU · mL-1 في PBS. بالنسبة للسلالات التي تم اختبارها هنا ، فإن 1 × 107 CFU · mL −1 يتوافق مع OD600 نانومتر من 0.0125.
ملاحظة: إذا كان الارتباط بين CFU · mL-1 و OD 600 نانومتر غير معروف ، فيجب إنشاء منحنى النمو الذي تحدده قياسات CFU و OD 600 نانومتر لحساب عامل الارتباط بين CFU · mL-1 و OD600 نانومتر. - ضع 2 ميكرولتر من المستنبتة المخففة مسبقا على كل بئر من اللوحة المجففة المكونة من 6 آبار. اترك البقع تجف قبل وضع الطبق في حاضنة عند 37 درجة مئوية طوال الليل (بين 15 ساعة و 19 ساعة).
- في اليوم التالي ، عد المستعمرات التي تشكلت في كل بئر. يتوافق MIC مع البئر مع الحد الأدنى من تركيز المضادات الحيوية حيث لا يتم الكشف عن نمو البكتيريا.
3. الفحص الفوري
ملاحظة: طريقة الفحص الموضعي هي نهج نوعي يسمح بتقدير عدد الخلايا القابلة للحياة (الخلايا القادرة على توليد مستعمرات بعد إجهاد المضادات الحيوية). يتم إجراء الفحص الموضعي قبل مقايسة القتل الزمني لتوفير نظرة ثاقبة حول صلاحية السلالة المستخدمة في الظروف التي تم اختبارها وللإبلاغ عن التخفيفات اللازمة أثناء اختبار القتل الزمني (انظر القسم 4).
- لتحضير ألواح أجار LB للمقايسات الموضعية ، صب 50 مل من أجار LB في طبق بتري مربع (144 سم2). تحضير طبق بتري مربع واحد لكل نقطة زمنية. دع أجار LB يصلب ، وجفف الألواح قبل الاستخدام.
- قم بتلقيح 5 مل من الوسط (MOPS glucose 0.4٪) بمستعمرة معزولة في أنبوب زجاجي (≥25 مل) ، وضع الأنبوب في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 180 دورة في الدقيقة طوال الليل (بين 15 ساعة و 19 ساعة).
- في اليوم التالي ، قم بقياس OD 600 نانومتر ، وقم بتخفيف الثقافة إلى وسط جديد معدل درجة الحرارة (37 درجة مئوية ، MOPS glycerol 0.4٪) في أنبوب زجاجي (≥25 مل) إلى OD نهائي600 نانومتر ~0.001 . دع الثقافة تنمو بين عشية وضحاها في حاضنة عند 37 درجة مئوية عند 180 دورة في الدقيقة (بين 15 ساعة و 19 ساعة).
- في اليوم التالي ، قم بقياس OD 600 نانومتر ، واحتضان الثقافة إلى OD600 نانومتر نهائي من 0.3.
- أثناء الحضانة ، قم بإعداد 96 صفيحة بئر عن طريق وضع 90 ميكرولتر من محلول 0.01 M MgSO4 في كل بئر باستثناء آبار الصف الأول (الصف A). سيتم استخدام لوحات 96 بئرا للتخفيف التسلسلي 10 أضعاف في الخطوة 3.7.
ملاحظة: في هذه التجربة ، تم اختبار سلالتين (سلالة wt و hupA-mCher ) في ثلاث نسخ في سبع نقاط زمنية مختلفة. نظرا لأن اللوحة الواحدة تتكون من 12 عمودا ، يمكن استخدام لوحة واحدة لنقطتين زمنيتين ، وبالتالي ، تم إعداد ما مجموعه أربع لوحات. - عند OD600 نانومتر من 0.3 ، اسحب 200 ميكرولتر من كل مزرعة بكتيرية. تتوافق هذه العينات مع النقطة الزمنية t0 (غير المعالجة) قبل العلاج بالمضادات الحيوية وتسمح بتحديد CFU · mL-1 قبل العلاج بالمضادات الحيوية.
- أجهزة الطرد المركزي العينات في 2300 × غرام لمدة 3 دقائق. خلال وقت الطرد المركزي ، أضف التركيز المطلوب من OFX إلى الثقافة السائلة ، واستمر في الاحتضان عند 37 درجة مئوية أثناء الهز.
ملاحظة: هنا ، تم استخدام OFX بتركيز 5 ميكروغرام · مل -1 (المقابلة لميكروفون مضروبا 83 ضعفا). في دراسة سابقة ، تم استخدام هذا التركيز لتوصيف ظاهرة الثبات تحت التعرض ل OFX25. يمكن أن يختلف تركيز المضادات الحيوية المستخدمة في مقايسات الوقت / القتل اعتمادا على المضاد الحيوي ووسط المزرعة وحالة نمو البكتيريا. - بعد الطرد المركزي ، أعد تعليق حبيبات الخلية في 200 ميكرولتر من محلول 0.01 M MgSO4 . ضع 100 ميكرولتر في البئر الفارغ للوحة 96 بئرا المحضرة في الخطوة 3.5. قم بإجراء التخفيف عن طريق نقل 10 ميكرولتر من البئر في الصف A إلى البئر في الصف B الذي يحتوي على 90 ميكرولتر من 0.01 M MgSO4. استمر في التخفيفات التسلسلية عن طريق نقل 10 ميكرولتر من البئر في الصف B إلى البئر في الصف C. كرر حتى الوصول إلى تخفيف 10−7 (مع كل عملية نقل تكون تخفيفا بمقدار 10 أضعاف).
ملاحظة: في هذه التجربة ، تم اختبار ست مزارع (ثلاثة لسلالة الوزن وثلاثة لسلالة hupA-mChere ) لكل نقطة زمنية. وفقا للبروتوكول ، يتم استخدام ماصة قناة المعطي لإجراء التخفيفات التسلسلية للسلالات الست في نفس الوقت. لتقليل الخطأ الفني ، يتم تغيير أطراف الماصة بين كل عملية نقل. - ضع 10 ميكرولتر من كل تخفيف على ألواح أجار LB المحضرة في الخطوة 3.1.
ملاحظة: يتم استخدام ماصة متعددة القنوات لتحديد نفس التخفيف في وقت واحد (على سبيل المثال ، تخفيف 10-4 ) للثقافات الست. أثناء الإكتشاف ، يجب استخدام المحطة الأولى للماصة متعددة القنوات دون الضغط على المحطة الثانية ، حيث يمكن أن يؤدي ذلك إلى توزيع قطرات صغيرة على اللوحة. - في النقاط الزمنية ذات الصلة بعد إضافة المضادات الحيوية ، اسحب 200 ميكرولتر من المزرعة ، وقم بإجراء التخفيفات التسلسلية كما هو موضح في الخطوة 3.8. حدد 10 ميكرولتر من كل تخفيف كما هو موضح في الخطوة 3.9.
ملاحظة: بالنسبة للتجربة الموصوفة هنا، تم جمع سبع نقاط زمنية (t0، t1h، t2h، t3h، t4h، t5h، t6h). بالنسبة للسلالات التي تظهر حساسية متزايدة للمضادات الحيوية مقارنة بالوزن ، يمكن إجراء غسلات متعددة في MgSO4 0.01 M لإزالة المضادات الحيوية المتبقية. - احتضان الألواح عند 37 درجة مئوية طوال الليل (بين 15 ساعة و 19 ساعة). في اليوم التالي ، احسب عدد المستعمرات في أعلى تخفيفين يمكن اكتشاف المستعمرات الخاصة بهما. من الناحية المثالية ، تحتوي البقع الموجودة على ألواح الآجار لهذه التخفيفات على ما بين 3 إلى 30 مستعمرة تسمح بالتحديد الدقيق ل CFU · mL-1 لكل عينة.
- احسب نسبة البقاء على قيد الحياة بقسمة CFU · mL-1 المحسوب لكل نقطة زمنية على CFU · mL-1 من السكان الأوليين عند t0.
4. مقايسات قتل الوقت
ملاحظة: في حين أن المقايسات الموضعية هي طريقة سهلة الاستخدام لتقدير معدل البقاء على قيد الحياة لسلالة معينة لمضاد حيوي معين ، فإن فحوصات قتل الوقت تعطي معدل بقاء أعلى دقة ويتم إجراؤها لتحديد صلاحية البكتيريا بدقة. يمكن استخدام ملف تعريف منحنى القتل لتحديد ما إذا كانت سلالة بكتيرية معينة حساسة أو متسامحة أو مقاومة للمضاد الحيوي في حالة معينة. علاوة على ذلك ، تسمح مقايسات القتل بالوقت بتحديد وقت التعرض للمضادات الحيوية اللازمة للكشف عن ظاهرة الثبات (بداية المنحدر الثاني لمنحنى القتل ثنائي الطور) بالإضافة إلى تكرار الثبات.
- قم بإعداد ألواح أجار LB لمقايسة طلاء قتل الوقت. صب 25 مل من أجار LB في طبق بتري (±57 سم2). قم بإعداد طبقين على الأقل من طبق بتري لكل نقطة زمنية (يتم طلاء تخفيفين لكل نقطة زمنية لكل سلالة).
- دع أجار LB يتجمد ، وجفف الألواح قبل إضافة خمس إلى ثماني حبات زجاجية معقمة إلى كل لوحة. اقلب اللوحات وقم بتسميتها وفقا للسلالة / الحالة / النقطة الزمنية.
ملاحظة: تسمح الحبيبات الزجاجية بانتشار البكتيريا على ألواح الآجار خلال الخطوتين 4.7 و 4.9. بدلا من ذلك ، يمكن تشتيت الخلايا على لوحة أجار باستخدام مفرشة. - لكل عينة ، قم بإعداد أنابيب زجاجية مخففة تسلسلية 10 أضعاف تحتوي على 900 ميكرولتر من محلول 0.01 M MgSO4 . يتوافق عدد الأنابيب الزجاجية المخففة لكل عينة يجب تحضيرها مع التخفيفات اللازمة للكشف عن المستعمرات في الفحص الموضعي.
- قم بتلقيح 5 مل من الوسط (MOPS glucose 0.4٪) بمستعمرة معزولة في أنبوب زجاجي (≥25 مل) ، وضع الأنبوب في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 180 دورة في الدقيقة طوال الليل (بين 15 ساعة و 19 ساعة).
- بعد 16 ساعة من النمو ، قم بقياس OD 600 نانومتر ، وقم بتخفيف الثقافة إلى وسط جديد معدل درجة الحرارة (37 درجة مئوية ، MOPS glycerol 0.4٪) في أنبوب زجاجي إلىOD 600 نانومتر نهائي ~ 0.001. دع الثقافة تنمو بين عشية وضحاها في حاضنة عند 37 درجة مئوية عند 180 دورة في الدقيقة (بين 15 ساعة و 19 ساعة).
- في اليوم التالي ، قم بقياس OD 600 نانومتر ، واحتضان الثقافة إلى OD600 نانومتر نهائي من 0.3.
- عند OD 600 نانومتر من 0.3 ، اسحب 100 ميكرولتر من المزرعة ، وقم بتخفيفه وفقا للبيانات التي تم الحصول عليها في الفحص الفوري (عند OD600 نانومتر من 0.3 وبدون مضاد حيوي ، عادة ما يعطي التخفيف 10-5 200-300 مستعمرة) ، ولوحة100 ميكرولتر على ألواح أجار LB المحضرة في الخطوات 4.1-4.2. هز الألواح برفق لتجنب ملامسة الخرزات لحواف الطبق ، حيث يمكن أن يؤدي ذلك إلى انتشار غير متجانس للخلايا البكتيرية على وسط أجار LB. تتوافق هذه العينة الأولى قبل العلاج بالمضادات الحيوية مع النقطة الزمنية t0 (CFU · mL-1 قبل العلاج بالمضادات الحيوية).
- أضف التركيز المطلوب من OFX ، واستمر في الاحتضان عند 37 درجة مئوية أثناء الرج.
ملاحظة: هنا ، تم استخدام OFX بتركيز 5 ميكروغرام · مل -1 (المقابلة لميكروفون مضروبا 83 ضعفا). - في النقاط الزمنية ذات الصلة بعد إضافة المضادات الحيوية ، اسحب 100 ميكرولتر من الثقافة ، وقم بتخفيفها وفقا للبيانات التي تم الحصول عليها في الفحص الفوري ، ولوحة 100 ميكرولتر على ألواح أجار LB المحضرة في الخطوات 4.1-4.2. قم بطلاء الخلايا كما هو موضح في الخطوة 4.7.
ملاحظة: بالنسبة للتجربة الموصوفة هنا، تم جمع سبع نقاط زمنية (t0، t1h، t2h، t3h، t4h، t5h، t6h). بالنسبة للسلالات التي تظهر حساسية متزايدة للمضادات الحيوية مقارنة بالوزن ، يمكن إجراء غسلات متعددة في MgSO4 0.01 M لإزالة المضادات الحيوية المتبقية. - احتضان الألواح عند 37 درجة مئوية طوال الليل (بين 15 ساعة و 19 ساعة). في اليوم التالي ، احسب عدد المستعمرات في أعلى تخفيفين يمكن اكتشاف المستعمرات الخاصة بهما. من الناحية المثالية ، يجب أن تحتوي الألواح على 30-300 مستعمرة للسماح بتحديد دقيق ل CFU · mL-1 في كل عينة.
- احسب نسبة البقاء على قيد الحياة عن طريق تطبيع CFU · mL-1 في كل نقطة زمنية بواسطة CFU · mL-1 عند t0. ارسم السجل10 CFU · mL-1 الطبيعي كدالة للوقت.
5. التصوير المجهري بفاصل زمني ميكروفلويديك
ملاحظة: يصف القسم التالي تحضير لوحة الموائع الدقيقة بالإضافة إلى إجراء الحصول على صور الفاصل الزمني وتحليل الصور. الهدف من هذه التجربة هو مراقبة وتحليل النمط الظاهري للاستمرار عند العلاج بالمضادات الحيوية على مستوى الخلية الواحدة. يمكن استخدام البيانات التي تم جمعها خلال هذه التجربة لتوليد مجموعة واسعة من النتائج اعتمادا على السؤال الموجه و / أو مراسلي الفلورسنت المستخدمين أثناء التجربة. في التجربة الموصوفة هنا ، تم إجراء تحليل كمي لطول الخلية ومضان HU-mCherry22 ، مما يعكس تنظيم النوكليويد في الخلايا الثابتة وغير الثابتة.
- زراعة الخلايا البكتيرية للفحص المجهري للفاصل الزمني للسوائع الدقيقة
- تلقيح 5 مل من الوسط (MOPS glycerol 0.4٪ ، مكمل بمضاد حيوي انتقائي إذا لزم الأمر) بمستعمرة معزولة في أنبوب زجاجي (≥25 مل) ، ووضع الأنبوب في حاضنة اهتزاز مضبوطة على 37 درجة مئوية و 180 دورة في الدقيقة طوال الليل (بين 15 ساعة و 19 ساعة).
- في اليوم التالي ، قم بقياس OD600 نانومتر ، وقم بتخفيف الثقافة في وسط جديد معدل درجة الحرارة (37 °C ، MOPS glycerol 0.4٪) في أنبوب زجاجي إلىOD 600 نانومتر نهائي ~ 0.001. دع الثقافة تنمو بين عشية وضحاها (بين 15 ساعة و 19 ساعة) في حاضنة اهتزاز عند 37 درجة مئوية و 180 دورة في الدقيقة للحصول على ثقافة المرحلة الأسية المبكرة في اليوم التالي.
- تحضير لوحة الموائع الدقيقة والتصوير المجهري بفاصل زمني
ملاحظة: يمكن إجراء تجارب الموائع الدقيقة في أجهزة الموائع الدقيقة المتاحة تجاريا (كما هو موضح هنا) أو في أنظمة الموائع الدقيقة المنتجة داخليا.- قم بإزالة محلول الحفظ (إن وجد) من كل بئر من صفيحة الموائع الدقيقة ، واستبدله بوسط استزراع جديد.
ملاحظة: إذا كانت لوحة الموائع الدقيقة تحتوي على بئر مخرج نفايات ، فيجب إزالة محلول الحفظ لبئر المخرج ولكن لا يتم استبداله بالوسيط. - قم بإغلاق لوحة الموائع الدقيقة بنظام المشعب بالنقر فوق زر الختم أو من خلال برنامج الموائع الدقيقة (حدد أولا الأداة ، متبوعة بلوحة الختم).
ملاحظة: لإغلاق اللوحة ، يجب تطبيق ضغط موحد على اللوحة والمشعب عن طريق الضغط يدويا على اللوحة ضد المشعب. إذا تم تنفيذها بشكل صحيح ، يجب أن تظهر الملاحظة "مختومة" على واجهة ONIX2. من المهم عدم ممارسة أي ضغط على الشريحة الزجاجية لتجنب أي خطر محتمل لكسر المشعب. - بمجرد الختم ، قم بإجراء تسلسل فتيلة أول (انقر فوق تشغيل تسلسل فتيلة السائل على واجهة برنامج الموائع الدقيقة).
ملاحظة: يتوافق تسلسل تشغيل التحضير السائل مع 5 دقائق من التروية عند 6.9 كيلو باسكال للآبار 1-5 ، تليها 5 دقائق من التروية عند 6.9 كيلو باسكال للبئر 8 ، وجولة التروية النهائية للبئر 6 لمدة 5 دقائق عند 6.9 كيلو باسكال. يسمح تسلسل تشغيل فتيلة السائل بإزالة محلول الحفظ الذي قد لا يزال موجودا في القنوات التي تربط الآبار المختلفة. - احتضان اللوحة في خزانة يتم التحكم فيها حراريا من المجهر عند درجة الحرارة المطلوبة (هنا ، 37 درجة مئوية) لمدة لا تقل عن 2 ساعة قبل بدء التصوير المجهري.
- ابدأ تسلسل تشغيل فتيلة السائل الثاني قبل بدء التجربة.
- قم بإغلاق لوحة الموائع الدقيقة بالنقر فوق إغلاق على واجهة برنامج الموائع الدقيقة. استبدل الوسط في البئر 1 والبئر 2 ب 200 ميكرولتر من الوسط الطازج ، في البئر 3 ب 200 ميكرولتر من الوسط الطازج الذي يحتوي على المضاد الحيوي (هنا ، OFX عند 5 ميكروغرام · مل − 1) ، في البئر 4 والبئر 5 مع 200 ميكرولتر من الوسط الطازج ، في البئر 6 مع 200 ميكرولتر من الوسط الطازج ، وفي البئر 8 مع 200 ميكرولتر من عينة الاستزراع (من الخطوة 5.1.2) مخففة إلى OD600 نانومتر من 0.01 في الوسط الطازج.
- أغلق لوحة الموائع الدقيقة كما هو موضح في الخطوة 5.2.2 ، وضع اللوحة على هدف المجهر داخل خزانة المجهر.
ملاحظة: تأكد من وضع قطرة من زيت الغمر على هدف المجهر قبل وضع لوحة الموائع الدقيقة. - في برنامج الموائع الدقيقة ، انقر فوق تحميل الخلية للسماح بتحميل الخلية في لوحة الموائع الدقيقة.
ملاحظة: تتكون خطوة تحميل الخلايا من 15 ثانية من التروية عند 13.8 كيلو باسكال للبئر 8 ، تليها 15 ثانية من التروية عند 27.6 كيلو باسكال للبئر 6 والبئر 8 ، وجولة التروية النهائية للبئر 6 لمدة 30 ثانية عند 6.9 كيلو باسكال. كثافة الخلايا في لوحة الموائع الدقيقة أمر بالغ الأهمية للتجربة. يتكون الجزء الأول من بروتوكول الموائع الدقيقة هذا من نمو البكتيريا لمدة 6 ساعات في وسط جديد قبل العلاج بالمضادات الحيوية. بعد 6 ساعات من النمو ، يجب أن تكون كثافة الخلية كافية للكشف عن الخلايا الثابتة النادرة (في الظروف المستخدمة في هذه الدراسة ، تولد الخلايا الثابتة بتردد 10-4). إذا كانت كثافة الخلية عالية جدا ، فمن الصعب التمييز بين الخلايا الفردية ، مما يمنع التحليل الدقيق للخلية الواحدة. نظرا لأن معدل النمو يعتمد بشكل مباشر على الوسط ، يجب تقييم كثافة الخلايا في حقول الفحص المجهري قبل بدء التجربة. - اضبط التركيز البؤري الأمثل باستخدام وضع الضوء المرسل ، وحدد عدة مناطق ذات أهمية (ROIs) حيث يتم ملاحظة رقم خلية مناسب (حتى 300 خلية لكل حقل).
ملاحظة: حدد 40 عائد استثمار على الأقل للتأكد من تصوير الخلايا الثابتة النادرة. - في برنامج الموائع الدقيقة ، انقر فوق إنشاء بروتوكول. برمجة حقن الوسط الطازج عند 6.9 كيلو باسكال لمدة 6 ساعات (بئر 1-2) ، يليه حقن الوسط الذي يحتوي على المضاد الحيوي عند 6.9 كيلو باسكال لمدة 6 ساعات (بئر 3) ، وأخيرا حقن وسط طازج عند 6.9 كيلو باسكال لمدة 20 ساعة (الآبار 4-5).
ملاحظة: تسمح المزرعة البكتيرية المخففة إلى OD600 نانومتر من 0.01 للبكتيريا بالنمو في غرفة الموائع الدقيقة لمدة 6 ساعات ، مما يضمن أن الخلايا في مرحلة النمو الأسي. اعتمادا على عدد الخلايا التي يتم إدخالها في جهاز الموائع الدقيقة أثناء خطوة التحميل (انظر الخطوة 5.2.8) ، يمكن تكييف مدة مرحلة النمو للحصول على ما يصل إلى 300 خلية لكل عائد استثمار. نظرا لأن الثبات ظاهرة نادرة ، فإن زيادة عدد الخلايا لكل عائد استثمار يحسن إمكانية مراقبة الخلايا الثابتة. ومع ذلك ، يجب ألا يتجاوز رقم الخلية 300 خلية لكل عائد استثمار ، لأن هذا يجعل تحليل الخلية الواحدة مملا. - قم بإجراء التصوير المجهري في وضع الفاصل الزمني بإطار واحد كل 15 دقيقة باستخدام الضوء المرسل ومصدر ضوء الإثارة لمراسل الفلورسنت. هنا ، تم استخدام مصدر ضوء إثارة 560 نانومتر لإشارة mCherry (580 نانومتر LED بقوة 10٪ مع مرشح 00 [530-585 ex ، 615LP em ، Zeiss] وتعرض 100 مللي ثانية ل mCherry). تم استخدام برنامج Zen3.2 المتوافق مع Zeiss.
- قم بإزالة محلول الحفظ (إن وجد) من كل بئر من صفيحة الموائع الدقيقة ، واستبدله بوسط استزراع جديد.
- تحليل الصور
ملاحظة: يتم فتح الصور المجهرية وتصورها باستخدام برنامج ImageJ/Fiji مفتوح المصدر (https://fiji.sc/)26. يتم إجراء التحليل الكمي للصور باستخدام برنامج ImageJ / Fiji مفتوح المصدر والمكون الإضافي MicrobeJ المجاني (https://microbej.com)27. في هذا البروتوكول ، تم استخدام إصدار MicrobeJ 5.13I (14).- افتح برنامج ImageJ/Fiji على الكمبيوتر، واسحب صور الفحص المجهري بفاصل زمني للمكدس التشعبي إلى شريط تحميل فيجي. استخدم لون > الصورة > Make Composite لدمج القنوات المختلفة للمكدس الفائق. إذا كانت قنوات تجربة الفاصل الزمني لا تتوافق مع اللون المطلوب (على سبيل المثال، يظهر تباين الطور باللون الأحمر بدلا من الرمادي)، استخدم Image > Color > Arrange Channels لتطبيق اللون المناسب على القنوات.
- افتح المكون الإضافي MicrobeJ ، واكتشف الخلايا البكتيرية باستخدام واجهة التحرير اليدوي. احذف الخلايا المكتشفة تلقائيا ، وحدد يدويا الخلايا الثابتة ذات الاهتمام إطارا تلو الآخر.
ملاحظة: يمكن استخدام إعدادات مختلفة لاكتشاف الخلايا الفردية تلقائيا. تم استخدام الكشف اليدوي هنا حيث تشكل الخلايا الثابتة التي تم تحليلها خيوطا طويلة ، والتي نادرا ما يتم اكتشافها بشكل صحيح باستخدام الكشف التلقائي. - بعد الاكتشاف ، استخدم رمز النتيجة في واجهة التحرير اليدوي MicrobeJ لإنشاء جدول ResultJ. احفظ ملف ResultJ ، واستخدم جدول ResultJ للحصول على رؤى حول المعلمات المختلفة ذات الأهمية لتحليل الخلية الواحدة. في حالة هذا البروتوكول ، تم تصدير متوسط مضان كثافة HU-mCherry وطول الخلية ومنطقة الخلية للخلايا الفردية.
النتائج
كما هو موضح أعلاه ، تم تمييز السلالات المستخدمة في تحليل النمط الظاهري أحادي الخلية للخلايا الثابتة في MOPS glycerol 0.4٪ medium. أظهرت مراقبة OD600nm بمرور الوقت عدم وجود فرق بين سلالات wt و hupA-mCherry (الشكل 1). يشير هذا إلى أن التعبير عن بروتين اندماج HU-mCherry لم يؤثر على النمو في هذه الظروف. وصلت الخلايا البكتيرية لكلا السلالتين الملقحة في البداية عند OD600 نانومتر من 0.01 إلى المرحلة الأسية ±8 ساعة بعد التلقيح.
تم تحديد MIC ل OFX بطرق موحدة (هنا ، تخفيف أجار تسلسلي)24. يتم تعريف MIC على أنه الحد الأدنى من التركيز حيث لا يتم الكشف عن نمو مرئي. تم تحديد ميكروفون OFX لكلتا السلالتين على أنه 0.06 ميكروغرام · مل − 1 ، مما يشير إلى أن اندماج hupA-mCherry لم يكن له أي تأثير على الحساسية ل OFX مقارنة بسلالة الوزن متساوي المنشأ (الشكل 2).
حددنا كذلك تأثير علاج OFX القاتل (83 ضعفا من MIC) على صلاحية كلتا السلالتين المستخدمتين في هذه الدراسة. مع انخفاض عدد الخلايا القابلة للحياة بمرور الوقت مع التعرض ل OFX ، يجب تعديل تخفيفات الثقافات البكتيرية بشكل مناسب للوصول إلى 30 إلى 300 مستعمرة لكل لوحة. لتحديد التخفيفات المناسبة بمرور الوقت ، تم إجراء فحص موضعي ، حيث تم وضع 10 ميكرولتر من 0 إلى 10−7 تخفيفات تسلسلية 10 أضعاف على أطباق بتري مربعة باستخدام ماصة متعددة القنوات. كانت التخفيفات المناسبة هي تلك التي كانت فيها الحيوانات المستنسخة المعزولة مرئية (على سبيل المثال ، عند t0 = 10−5 ، t1h = 10−4 / 10−3 ، t4h = 10−2/10−1) (الشكل 3).
في حين أن الفحص الفوري هو طريقة سهلة لاكتساب نظرة ثاقبة على حركية القتل بوساطة OFX ، إلا أنه يفشل في تحديد ديناميكيات القتل بدقة. عندما تمت مراقبة صلاحية الخلايا النامية بشكل كبير والمعالجة ب OFX بواسطة مقايسة قتل الوقت ، لوحظ منحنى ثنائي الطور نموذجي (الشكل 4). يعكس المنحدر الأول من المنحنى القتل السريع للسكان غير الثابتين (خط أحمر متقطع). في الظروف التي تم اختبارها هنا ، لم يتمكن ما يصل إلى 99.9٪ من الخلايا من تكوين مستعمرات بعد 3 ساعات في وجود OFX. تلي هذه المرحلة الأولى من القتل مرحلة ثانية ، تظهر معدل قتل أبطأ (خط متقطع أزرق) ، مما يكشف عن وجود خلايا ثابتة تتحمل المخدرات. في الظروف التي تم اختبارها ، بدأت المرحلة المستمرة حوالي 3 ساعات بعد إضافة OFX ، مما يسلط الضوء على ضرورة تعريض الخلايا ل OFX لمدة تزيد عن 3 ساعات للتحقيق في الأنماط الظاهرية الثابتة. الأهم من ذلك ، أن منحنى قتل الوقت يظهر أن بروتين اندماج hupA-mCherry لم يكن له أي تأثير على حركية قتل الوقت. وبالتالي ، يمكن استخدام السلالة التي تشفر الاندماج الفلوري الانتقالي لمراقبة الخلايا الثابتة باستخدام المجهر الفلوري.
واصلنا التحقيق في ظاهرة الثبات على مستوى الخلية الواحدة. للقيام بذلك ، تم إدخال سلالة hupA-mCherry في لوحة الموائع الدقيقة ، مما سمح بتغيير الظروف المتوسطة (هنا ، النمو والعلاج والتعافي) أثناء إجراء الفحص المجهري بفاصل زمني على عائد استثمار معين. خلال الخطوة الأولى من تجربة الموائع الدقيقة ، تم ترشيح الخلايا التي تم إدخالها في جهاز الموائع الدقيقة بوسط نمو (MOPS glycerol 0.4٪) ومقسمة مع وقت جيل ~ 2 ساعة (الشكل 5 والشكل 6). تشير هذه المرحلة الأولى من النمو إلى أن الخلايا كانت قابلة للحياة وتنقسم بنشاط قبل علاج OFX.
بعد هذه المرحلة الأولى من النمو ، تم تزويد الخلايا بوسط نمو مكمل ب 5 ميكروغرام من مل − 1 OFX لمدة 6 ساعات. بمجرد وصول المضاد الحيوي إلى الخلايا ، تم حظر انقسام الخلايا (الشكل 5 والشكل 6). بعد 6 ساعات من علاج OFX ، تم ترشيح الخلايا بوسط جديد. في حين أن الغالبية العظمى من الخلايا لم تكن قادرة على استئناف النمو (الشكل 5 والشكل 6) ، كانت مجموعة فرعية صغيرة من البكتيريا قادرة على استطالة وتوليد الخلاياالخيطية 25. يمكن تعريف هذه الخلايا ، التي كانت قادرة على الانقسام وتوليد خلايا ابنة قابلة للحياة بعد علاج OFX ، على أنها الخلايا الثابتة.
نظرا لأن هذا الإعداد يسمح بتصور الخلايا الثابتة قبل العلاج وأثناءه وبعده ، فإنه لا يوفر فقط معلومات حول النمط الظاهري الثابت أثناء مرحلة التعافي ولكن أيضا حول الحالة الفسيولوجية للخلايا الثابتة قبل العلاج (الشكل 6). في الظروف التي تم اختبارها ، انقسمت الخلايا الثابتة بشكل مشابه للخلايا غير الثابتة قبل علاج OFX ، مما يشير إلى أن الخلايا الثابتة المرصودة لم تنشأ من مجموعة فرعية نائمة (الشكل 6)25.
كشف تحليل طول الخلية للخلايا الثابتة خلال مرحلة التعافي أن كل خيط له معدل استطالة محدد. يختلف طول الخلية الذي وصل إليه كل ثابت قبل الانقسام الأول من ثابت إلى آخر. وبالمثل ، كان توقيت حدث القسم الأول غير متجانس للغاية (الشكل 6). ولدت خيوط الثبات المنقسمة خلايا ابنة متعددة ، والتي بدأت في النمو والانقسام ، في الغالب ، بشكل مشابه للخلايا غير المعالجة (الشكل 7). ثم أدى الانقسام المتتالي للخيوط إلى انخفاض تدريجي في طول الخلية ، مما أدى في النهاية إلى ظهور خلايا ابنة ذات طول خلية مماثل لما قبل معالجة OFX (الشكل 6 والشكل 7B). لم تتمكن الغالبية العظمى من الخلايا من إحداث خيوط بعد إزالة OFX. تتوافق هذه المجموعة الكبيرة من الخلايا مع الخلايا الميتة (الشكل 5 والشكل 6).
يسمح الانصهار الفلوري للبروتين HU المرتبط بالنيوكليويد بتصور ديناميكيات النوكليويد22. يمكن استخدام تحليل شدة التألق الكلية ل HU-mCherry داخل الخلية كوكيل لمحتوى الحمض النووي22,25. خلال مرحلة النمو (قبل معالجة OFX) ، اختلفت شدة مضان mCherry الكلية ، مما يعكس ديناميكيات تكرار الكروموسوم وفصله أثناء دورة الخلية (الشكل 8). بعد إضافة OFX ، زاد مضان mCherry في منتصف الخلية ، مما يدل على انضغاط النيوكليويد ، والذي ثبت أنه ناتج عن تكوين فواصل الحمض النووي مزدوجة الشريط28 (الشكل 5). فواصل الحمض النووي مزدوجة الخيط هي نتيجة لآلية عمل OFX ، التي تفسد النوع الثاني من topoisomerases DNA-gyrase و topoisomerase IV29,30. في الإشريكية القولونية ، DNA-gyrase هو الهدف الأساسي ل OFX29,30. من خلال ربط هدفه في خطوة حاسمة من آلية المرور المزدوج ، يمنع OFX هبوط خيوط الحمض النووي المشقوقة ، مما يؤدي في النهاية إلى إطلاق فواصل الحمض النووي مزدوجة الشريط30. كما هو موضح أعلاه ، بدأت الخلايا الثابتة لعلاج OFX في الفتيل أثناء الشفاء25 (الشكل 6). ارتبطت الزيادة في طول الخلية بزيادة في إجمالي كثافة مضان mCherry ، مما يعكس إعادة تشغيل النسخ المتماثل وزيادة وفرة النوكليويد في الفتيل25 (الشكل 7 أ والشكل 8). بالنسبة للخلايا الميتة ، ظلت كثافة مضان mCherry الكلية مستقرة أثناء العلاج وأثناء مرحلة الشفاء ، مما يشير إلى أن هذه الخلايا لم تكن قادرة على تكرار كروموسوماتها بعد إزالة OFX (الشكل 8). كما يتم عرض فيديو الموائع الدقيقة (الفيديو 1) لخلايا E. coli HU-mCherry قبل وأثناء وبعد العلاج بأوفلوكساسين.
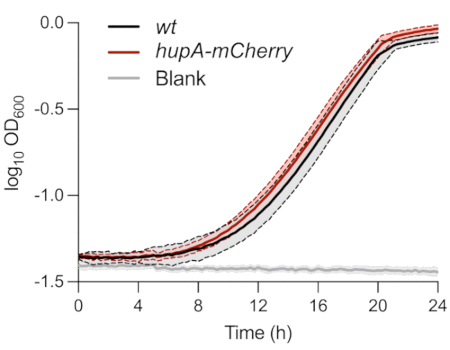
الشكل 1: مراقبة نمو سلالات الإشريكية القولونية بالوزن و hupA-mCherry E. coli. مراقبة الكثافة الضوئية (OD600 نانومتر) للوزن (أسود) و hupA-mCherry (أحمر). تشير الظلال والخطوط المتقطعة إلى الانحرافات المعيارية للثلاثية البيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
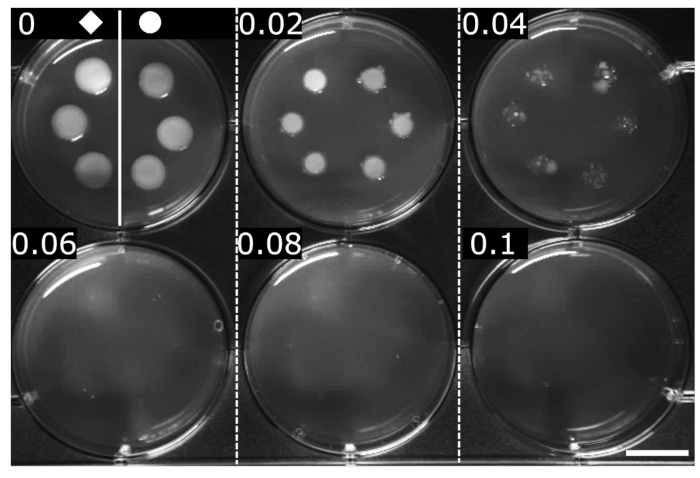
الشكل 2: تحديد ميكروفون OFX لسلالات wt و hupA-mCherry E. coli. تم زراعة الوزن () و hupA-mCherry (●) في وسط LB ، وتم رصد 2 ميكرولتر على التخفيفات التسلسلية لأجار LB المحتوي على OFX (♦ التركيز المشار إليه في كل لوحة في μg · mL − 1). يمكن رؤية تثبيط النمو عند الحد الأدنى 0.06 ميكروغرام · مل −1. الشكل هو تجربة تمثيلية للثلاثية البيولوجية. شريط المقياس = 1 سم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الشكل.
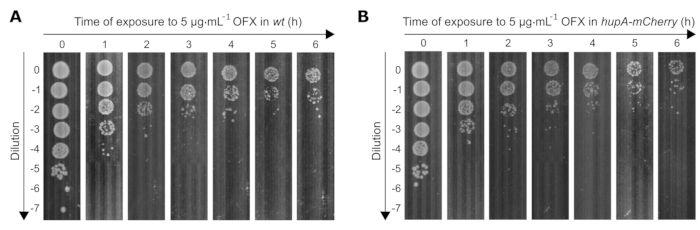
الشكل 3: الفحص الموضعي لسلالات الإشريكية القولونية بالوزن و hupA-mCherry عند التعرض ل OFX. نمت سلالات (A) بالوزن و (B) hupA-mCherry في MOPS glycerol 0.4٪ كما هو موضح في البروتوكول (القسم 3) ، وعولجت الخلايا النامية بشكل كبير (OD600 nm = 0.3) ب 5 ميكروغرام · مل −1 OFX. T0 يتوافق مع النقطة الزمنية قبل إضافة OFX. تتوافق T1 و T2 و T3 و T4 و T5 و T6 مع 1-6 ساعات بعد إضافة OFX. الشكل هو تجربة تمثيلية للثلاثية البيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
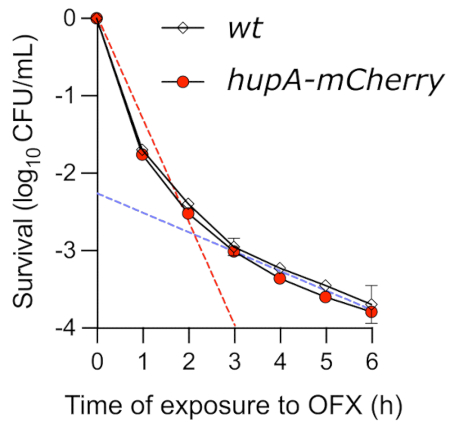
الشكل 4: مقايسة قتل الوقت لسلالات wt و hupA-mCherry E. coli عند التعرض ل OFX. نمت سلالات wt () و hupA-mCherry (●) في MOPS glycerol 0.4٪ كما هو موضح في البروتوكول (القسم 4) ، وعولجت الخلايا النامية أضعافا مضاعفة (♦ OD600 nm = 0.3) ب 5 ميكروغرام · مل −1 OFX. تشير الخطوط المتقطعة إلى مرحلة القتل "السريع" (الأحمر) الأولى ومرحلة القتل "البطيئة" (الزرقاء) الثانية ، المقابلة للمجموعات الفرعية الحساسة والمستمرة (التي تم الحصول عليها عن طريق الانحدار الخطي بين T0 و T2 ، وكذلك بين T3 و T6 ، على التوالي). تشير أشرطة الخطأ إلى الانحرافات المعيارية للثلاثية البيولوجية. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
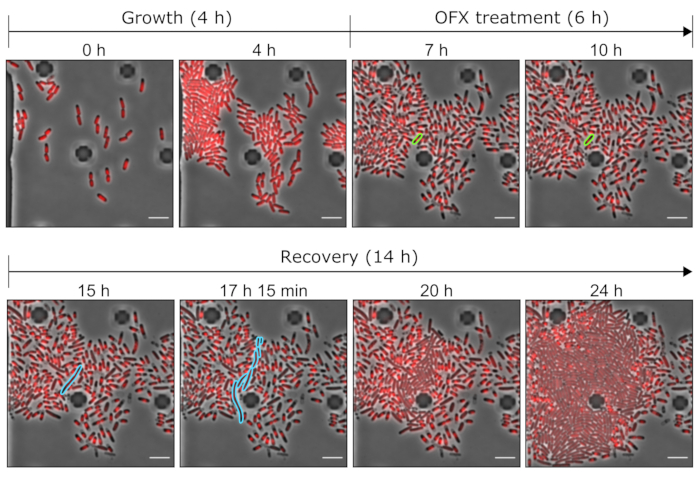
الشكل 5: صور تمثيلية للخلايا الثابتة والميتة OFX باستخدام أدوات الموائع الدقيقة. صور مجهرية تمثيلية توضح النقاط الزمنية ذات الصلة لتجربة الموائع الدقيقة التي أجريت مع سلالة hupA-mCherry (تباين الطور باللون الرمادي ، إشارة HU-mCherry باللون الأحمر). نمت الخلايا التي تعبر عن hupA-mCherry الموسوم في صفيحة الموائع الدقيقة (هنا ، 4 ساعات) ، متبوعة بتحدي OFX (5 ميكروغرام · مل − 1). بعد 6 ساعات في وجود OFX ، تم اختراق الخلايا بوسط جديد ، مما سمح للخلايا الثابتة بالتعافي. يتم تمييز الخلية الثابتة وخلايا ذريتها أثناء علاج OFX وبعد إزالة OFX باللون الأخضر والأزرق ، على التوالي. يشار إلى النقاط الزمنية المقابلة في كل لوحة. شريط المقياس = 5 ميكرومتر. يرجى النقر هنا لعرض نسخة أكبر من هذا الشكل.
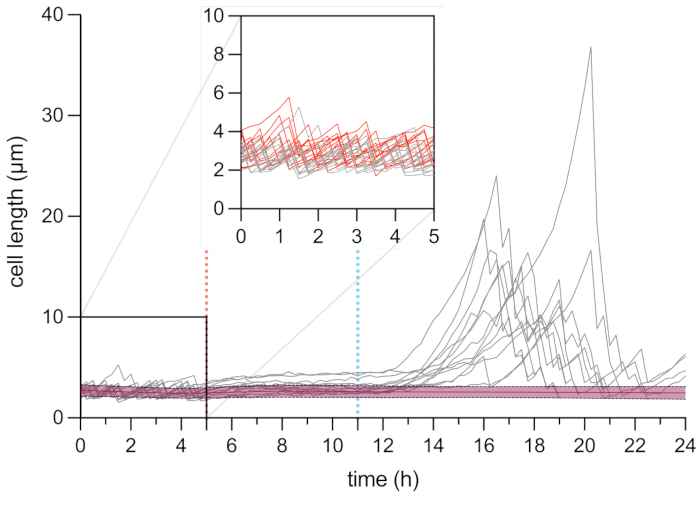
الشكل 6: تحليل الفاصل الزمني المجهري لطول الخلايا الثابتة والميتة. تحليل طول الخلية للخلايا الميتة (باللون الأحمر ، ن = 109) والخلايا الثابتة (باللون الرمادي ، ن = 13). يشار إلى بداية معالجة OFX (5 ميكروغرام · مل −1) بالخط الأحمر المتقطع (5 ساعات) ، ويشار إلى إزالة OFX بالخط المتقطع الأزرق. يتوافق الجزء الداخلي مع مرحلة النمو قبل إضافة OFX. أجريت التجارب في ثلاث نسخ. تشير الظلال والخطوط المتقطعة إلى الانحرافات المعيارية لسكان الخلايا الميتة (ن = 109). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
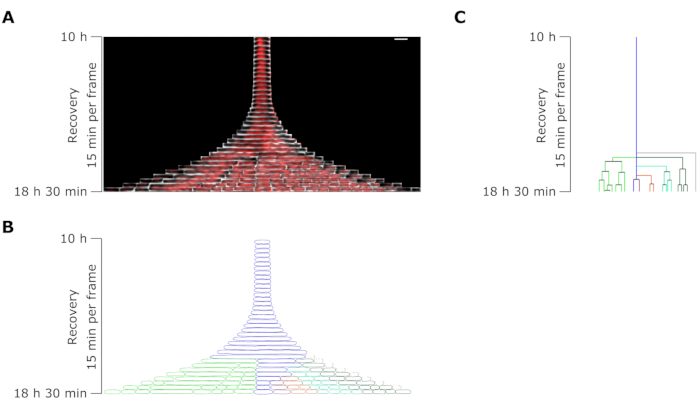
الشكل 7: تحليل الفاصل الزمني المجهري لمثابر تمثيلي ل OFX . (أ) كيموغراف لمثابر OFX تمثيلي وخلاياه الوليدة الناتجة عن انقسامات الخيوط خلال 8.5 ساعة بعد إزالة OFX (18.5 ساعة بعد بداية تجربة الموائع الدقيقة ، بما في ذلك 4 ساعات من النمو ، و 6 ساعات من 5 ميكروغرام من معالجة OFX ، و 8.5 ساعة من الانتعاش بعد إزالة OFX). إطار واحد يتوافق مع 15 دقيقة. شريط المقياس = 5 ميكرومتر. (ب) القناع الناتج عن الكيموغراف المثبت في A. يشار إلى الخلية الثابتة المراقبة بمخطط أزرق ، ويتم تمييز الخلايا الوليدة بألوان مميزة. (ج) تمثيل تخطيطي لسلالة الخلايا الثابتة المتولدة من B . الترميز اللوني مطابق ل B. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
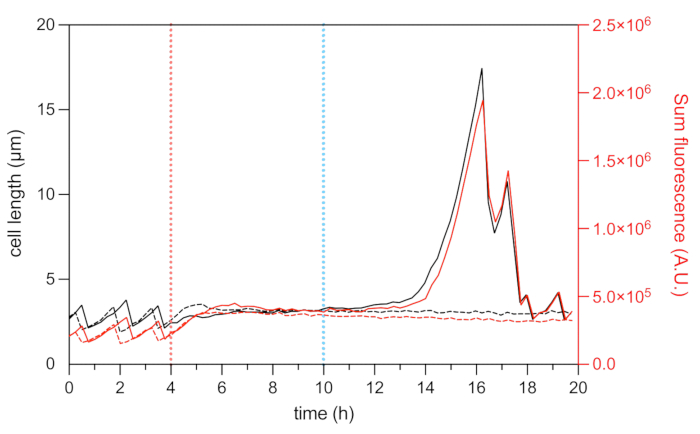
الشكل 8: طول الخلية وتحليل مضان mCherry للخلايا الثابتة والميتة التمثيلية. تحليل طول الخلية (المحور الأيسر) وشدة مضان HU-mCherry الكلية (المحور الأيمن ، كما هو موضح بوحدات تعسفية) لثابت تمثيلي (خطوط سوداء وحمراء صلبة) وخلية ميتة تمثيلية (خط أسود وأحمر متقطع) أثناء تجربة الفاصل الزمني للسوائع الدقيقة. يشار إلى بداية معالجة OFX (5 ميكروغرام · مل −1) بالخط الأحمر المتقطع ، وإزالة OFX بواسطة الخط المتقطع الأزرق. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
فيديو 1: فيديو الموائع الدقيقة لخلايا E. coli HU-mCherry قبل وأثناء وبعد علاج أوفلوكساسين. تصوير الموائع الدقيقة بفاصل زمني يظهر خلايا HU-mChere. نمت الخلايا لمدة 4 ساعات في MOPS الجلسرين 0.4 ٪. بعد 6 ساعات من علاج OFX (5 ميكروغرام · مل −1) ، تم استخدام الوسط الخالي من المضادات الحيوية في صفيحة الموائع الدقيقة للسماح للخلايا الثابتة بالتعافي. شريط المقياس = 5 ميكرومتر. يشار إلى الوقت (بالدقائق). يشار إلى مراحل النمو والانتعاش بواسطة "MOPS- Gly. 0.4٪" ومعالجة OFX بواسطة "OFX 5 ميكروغرام / مل". الرجاء الضغط هنا لتنزيل هذا الفيديو.
| 10x المماسح | |||
| حل الأسهم | حجم محلول المخزون ل 1 لتر من 10x MOPS | التركيز النهائي في قاعدة 10x MOPS | |
| حمض المماسح | 1 م (معدل إلى درجة الحموضة 7.4 باستخدام KOH) | 400 مل | 0.4 م |
| تريسين | 1 م (معدل إلى درجة الحموضة 7.4 باستخدام KOH) | 40 مل | 0.04 م |
| FeSO4.7H2O | 0.01 م | 10 مل | 0.0001 م |
| NH4سل | 1.9 م | 50 مل | 0.095 م |
| ك2سو4 | 0.276 م | 10 مل | 0.00276 م |
| كلوريد متعدد الكلور 2.2H2O | 0.0005 م | 10 مل | 0.000005 م |
| مغ سي سي ال 2.6H2O | 0.528 م | 10 مل | 0.00528 م |
| كلوريد الصوديوم | أضف مباشرة 29.2 غرام | 0.5 م | |
| ماء مقطر | 460 مل | ||
| المغذيات الدقيقة 1000x (انظر الجدول 2) | 10 مل | ||
الجدول 1: تكوين 10x MOPS.
| المغذيات الدقيقة 1000x | ||
| التركيز في محلول مخزون المغذيات الدقيقة 1000x | التركيز النهائي في قاعدة 10x MOPS | |
| (NH4)6Mo7O24.4H2O | 0.000003 م | 0.00000003 م |
| ح 3بو3 | 0.0004 م | 0.000004 م |
| CoCl 2.6H2 O | 0.00003 م | 0.0000003 م |
| كوسو4.5 ساعة2س | 0.00001 م | 0.0000001 م |
| MnCl 2.4H2 O | 0.00008 م | 0.0000008 م |
| ZnSO.7H2O | 0.00001 م | 0.0000001 م |
الجدول 2: تكوين 1000x المغذيات الدقيقة.
| MOPS الجلوكوز 0.4 ٪ أو MOPS الجلسرين 0.4 ٪ | |||
| حل الأسهم | حجم 1 لتر MOPS الجلوكوز 0.4 ٪ أو MOPS الجلسرين 0.4 ٪ | التركيز النهائي في MOPS الجلوكوز 0.4 ٪ أو MOPS glycerl 0.4 ٪ | |
| 10x المماسح | انظر الجدول 1 | 100 مل | |
| ك2هبو4 | 0.132 م | 10 مل | 0.00132 م |
| الجلوكوز (ل MOPS الجلوكوز 0.4 ٪) | 20٪ (20 جم في 100 مل من الماء المقطر) | 20 مل | 0.40% |
| الجلسرين (ل MOPS الجلسرين 0.4 ٪) | ≤99٪ | 4 مل | 0.40% |
| ماء مقطر | 870 مل لجلوكوز MOPS 0.4٪ أو 886 مل ل MOPS الجلسرين 0.4٪ | ||
الجدول 3: تكوين الجلوكوز MOPS 0.4 ٪ و MOPS الجلسرين 0.4 ٪.
Discussion
يسمح البروتوكول المقدم في هذه الورقة بتحليل النمط الظاهري للثبات الذي لوحظ استجابة للعلاج بالمضادات الحيوية على مستوى السكان والخلية الواحدة. أجريت التجارب باستخدام سلالة E. coli MG1655 ، التي نمت في وسط محدد كيميائيا (MOPS glycerol 0.4٪). تم إجراء فحوصات قتل الوقت وتجارب الفحص المجهري على ثقافات المرحلة الأسية. استخدمنا OFX ، وهو فلوروكينولون ، بتركيز 5 ميكروغرام · مل − 1 للكشف عن الخلايا الثابتة. يمكن تطبيق الأساليب الموضحة هنا على المضادات الحيوية الأخرى المبيدة للجراثيم ، مثل β-lactams أو aminoglycosides أو المركبات المضادة للميكروبات31. وفقا لذلك ، يمكن استخدام سلالات بكتيرية أخرى أو وسائط أو ظروف نمو. يمكن أن تكون مراقبة عمليات الاندماج الفلورية المختلفة في إعداد مشابه لتلك الموصوفة هنا مفيدة لمتابعة العمليات الخلوية مثل تكرار الحمض النووي 32 ، وإصلاح الحمض النووي25،33 ، وانقسام الخلايا34 قبل العلاج بالمضادات الحيوية وأثناءه وبعده. وبالمثل ، يمكن استغلال مراسلي الفلورسنت للتحقيق في جوانب متميزة من فسيولوجيا الخلية ، مثل مستويات الأس الهيدروجيني35 أو ATP36 أو ROS37 داخل الخلايا. بدلا من الانصهار الفلوري ، يمكن أيضا تطبيق الأصباغ الكيميائية. على سبيل المثال ، يمكن استبدال اندماج hupA-mCherry ب 4',6-diamidino-2-phenylindole (DAPI) ، وهي صبغة فلورية تلطخ الحمض النووي38. ومع ذلك ، يجب تجنب إجراء الفحص المجهري بفاصل زمني إلى جانب هذه الأصباغ الفلورية ، لأن تقنيات التلوين هذه يمكن أن تزعج ديناميكيات دورة الخلية أثناء تجارب الفاصل الزمني. بدلا من ذلك ، يمكن استبدال هذه التجارب بتحليلات الدورة الزمنية لتصوير اللقطات في النقاط الزمنية ذات الصلة.
في حين أن مثل هؤلاء المراسلين الفلورسنت مفيدون ، لا ينبغي إهمال كمية المعلومات التي يمكن استخراجها من خلال تحليل صور تباين الطور. هنا ، راقبنا تطور طول الخلية طوال مراحل النمو وعلاج OFX والتعافي. يمكن أيضا استخراج المعلمات الأخرى القائمة على صور تباين الطور ، مثل عرض الخلية وشدة تباين الطور وانحناءات الخلايا البكتيرية ، بسهولة باستخدام برامج مناسبة ، مثل MicrobeJ27.
باختصار ، يمكن تطبيق الإجراء الموصوف هنا على الحالات والأنواع البكتيرية الأخرى لمراقبة الاستجابات الخلوية للبيئات المتغيرة أو الضغوطات18,19. باستخدام مراسلين فلورسنت آخرين (مراسلون نسخيون ومتعدون ، صبغة كيميائية) بالاقتران مع تحليل السكان ، مثل قياس التدفق الخلوي / FACS ، يمكن معالجة الأسئلة المثيرة للاهتمام في إطار متعدد المقاييس.
Disclosures
يعلن المؤلفون عدم وجود مصالح متنافسة.
Acknowledgements
يتم دعم العمل في مختبر Van Melderen من خلال إجراءات ARC 2018-2023 ، الصندوق الوطني للبحوث العلمية (FNRS CDR J.0182.21F). يتم دعم TO من خلال زمالة ULB. يتم دعم T.S. من قبل زمالة FRIA (FNRS). يتم دعم JC من خلال زمالة ما بعد الدكتوراه "القائم بأعمال البحوث" (FNRS).
Materials
| Name | Company | Catalog Number | Comments |
| Axio Observer | Zeiss | Inverted fluorescence microscope | |
| CaCl2.2H2O | Merck | 1.02382.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CellASIC ONIX Microfluidic System | Merck | CAX2-S0000 | Microfluidic system |
| CellASIC ONIX2 FG | Merck | ONIX2 1.0.1 | Microfluidic software |
| CellASIC ONIX2 Manifold Basic | Merck | CAX2-MBC20 | Manifold system |
| CoCl2.6H2O | Merck | 1.02539.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CuSO4.5H2O | Merck | 1.02790.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| D-(+)-glucose | Sigma Aldrich | G7021-1KG | Carbon source for MOPS glucose 0.4% growth medium |
| E. coli K-12 MG1655 CF1648 (fnr+) | BE10 | wt reference strain, lab strain | |
| E. coli K-12 MG1655 CF1648 (fnr+) hupA-mCherry::FRT-kan-FRT | BE16 | HU-mCherry fusion integrated via P1 transduction at the native locus, lab strain | |
| FeSO4.7H2O | VWR Chemicals | 24244.232 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Fiji | ImageJ | https://fiji.sc/ | Image software; Schindelin et al. if used in publication |
| Glycerol | Merck | 56815 | Carbon source for MOPS glycerol 0.4% growth medium |
| Greiner CELLSTAR® multiwell culture plate | Merck | M8812-100EA | 24-well clear flat bottom 2ml volume culture plate for automated plate reader |
| H3BO3 | Sigma-Aldrich | B6768-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Hamamatsu ORCA Flash 4.0 digital camera | Hamamatsu | C13440-20CU | Digital Image Acqusition |
| K2HPO4 | Merck | 1.05099.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| KOH | Merck | 1.05029.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| K2SO4 | Merck | 1.05153.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Luria-Broth agar medium | Invitrogen | 22700041 | Growth medium for plating assay |
| Luria-Broth medium | Invitrogen | 12780029 | Growth medium for MIC determination |
| MgCl2.6H2O | Merck | 1.05832.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MgSO4 | Merck | 7487-88-9 | Dilution solution for bacterial survival assay used at 10mM |
| MicrobeJ | Imagej/Fiji plugin | https://www.microbej.com/ | Microscopy image analysis plugin. Ducret et al.for in publication; Detection settings: For bacteria : Area (μm2): 0,1-max; Length (μm): 0,5-max; Width (μm): 0,6-max; Range (μm): 0,5-max; Angularity (rad): 0-0,3; 0-max for all other parameters. |
| Microfluidic Plates CellASIC ONIX | Merck | B04A-03-5PK | Plate for microfluidic system |
| MnCl2.4H2O | Merck | 1.05927.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MOPS, Free Acid ULTROL® Grade | Merck | 475898-500GM | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NaCl | SIgma-Aldrich | S5886-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| (NH4)6Mo7O24.4H2O | Merck | 1.01180.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NH4Cl | Merck | 1.01145.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Ofloxacin | Merck | 82419-36-1 | Fluoroquinolone antibiotic used to treat the bacterial cells |
| Phosphate Buffered Saline (PBS) pH 7.4, 1x | Merck | P3813 | Dilution buffer |
| GENESYS 10S UV-Visible Spectrophotometer | Thermofisher Scientific | 840-208200 | UV-Visible Spectrophotometer, Single/Six Cell Holder with PrinterMeasurement of optical density OD600nm |
| SoftMax Pro | Molecular Devices | Microplate reader software | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| N-[Tris(hydroxyméthyl)-méthyl]-glycine | Merck | 1.08602.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Zeiss® immersion Oil 518F | Zeiss | Immersion oil to increase resolution of microscope | |
| Zen3.2 Pro | Zeiss | Microscopic image acquisition and processing software | |
| ZnSO4.7H2O | Merck | 1.08883.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
References
- Balaban, N. Q., et al. Definitions and guidelines for research on antibiotic persistence. Nature Reviews Microbiology. 17 (7), 441-448 (2019).
- Brauner, A., Fridman, O., Gefen, O., Balaban, N. Q. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nature Reviews Microbiology. 14 (5), 320-330 (2016).
- Pribis, J. P., Zhai, Y., Hastings, P. J., Rosenberg, S. M. Stress-induced mutagenesis, gambler cells, and stealth targeting antibiotic-induced evolution. mBio. 13 (3), 01074 (2022).
- Molina-Quiroz, R. C., Lazinski, D. W., Camilli, A., Levy, S. B. Transposon-sequencing analysis unveils novel genes involved in the generation of persister cells in uropathogenic Escherichia coli. Antimicrobial Agents and Chemotherapy. 60 (11), 6907-6910 (2016).
- Cameron, D. R., Shan, Y., Zalis, E. A., Isabella, V., Lewis, K. A genetic determinant of persister cell formation in bacterial pathogens. Journal of Bacteriology. 200 (17), 00303-00318 (2018).
- Cui, P., et al. Identification of genes involved in bacteriostatic antibiotic-induced persister formation. Frontiers in Microbiology. 9, 413 (2018).
- Li, T., et al. Identification of novel genes involved in Escherichia coli persistence to tosufloxacin. Frontiers in Cellular and Infection Microbiology. 10, 581986 (2020).
- Verstraeten, N., et al. Obg and membrane depolarization are part of a microbial bet-hedging strategy that leads to antibiotic tolerance. Molecular Cell. 59 (1), 9-21 (2015).
- Hofsteenge, N., van Nimwegen, E., Silander, O. K. Quantitative analysis of persister fractions suggests different mechanisms of formation among environmental isolates of E. coli. BMC Microbiology. 13 (1), 25 (2013).
- Huemer, M., Mairpady Shambat, S., Brugger, S. D., Zinkernagel, A. S. Antibiotic resistance and persistence-Implications for human health and treatment perspectives. EMBO Reports. 21 (12), 51034 (2020).
- Wilmaerts, D., Windels, E. M., Verstraeten, N., Michiels, J. General mechanisms leading to persister formation and awakening. Trends in Genetics. 35 (6), 401-411 (2019).
- Murawski, A. M., Brynildsen, M. P. Ploidy is an important determinant of fluoroquinolone persister survival. Current Biology. 31 (10), 2039-2050 (2021).
- Lemma, A. S., Soto-Echevarria, N., Brynildsen, M. P. Fluoroquinolone persistence in Escherichia coli requires DNA repair despite differing between starving populations. Microorganisms. 10 (2), 286 (2022).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Morawska, L. P., Kuipers, O. P. Antibiotic tolerance in environmentally stressed Bacillus subtilis: Physical barriers and induction of a viable but nonculturable state. microLife. 3, (2022).
- Windels, E. M., et al. Enrichment of persisters enabled by a ß-lactam-induced filamentation method reveals their stochastic single-cell awakening. Communications Biology. 2 (1), 426 (2019).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-Expanding the toolbox of microfluidic single-cell cultivations. Journal of Molecular Biology. 431 (23), 4569-4588 (2019).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli growth rate to osmotic shock. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7807-7812 (2014).
- Shi, H., et al. Starvation induces shrinkage of the bacterial cytoplasm. Proceedings of the National Academy of Sciences of the United States of America. 118 (24), 2104686118 (2021).
- Goode, O., et al. Persister Escherichia coli cells have a lower intracellular pH than susceptible cells but maintain their pH in response to antibiotic treatment. mBio. 12 (4), 00909-00921 (2021).
- Manuse, S., et al. Bacterial persisters are a stochastically formed subpopulation of low-energy cells. PLoS Biology. 19 (4), 3001194 (2021).
- Fisher, J. K., et al. Four-dimensional imaging of E. coli nucleoid organization and dynamics in living cells. Cell. 153 (4), 882-895 (2013).
- Cabral, D., Wurster, J., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. Pharmaceuticals. 11 (1), 14 (2018).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2), 163-175 (2008).
- Goormaghtigh, F., Van Melderen, L. Single-cell imaging and characterization of Escherichia coli persister cells to ofloxacin in exponential cultures. Science Advances. 5 (6), (2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ducret, A., Quardokus, E. M., Brun, Y. V. MicrobeJ, a tool for high throughput bacterial cell detection and quantitative analysis. Nature Microbiology. 1 (7), 16077 (2016).
- Odsbu, I., Skarstad, K. DNA compaction in the early part of the SOS response is dependent on RecN and RecA. Microbiology. 160 (5), 872-882 (2014).
- Pham, T. D. M., Ziora, Z. M., Blaskovich, M. A. T. Quinolone antibiotics. MedChemComm. 10 (10), 1719-1739 (2019).
- Drlica, K., et al. Quinolones: Action and resistance updated. Current Topics in Medicinal Chemistry. 9 (11), 981-998 (2009).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: From targets to networks. Nature Reviews Microbiology. 8 (6), 423-435 (2010).
- Reyes-Lamothe, R., Sherratt, D. J., Leake, M. C. Stoichiometry and architecture of active DNA replication machinery in Escherichia coli. Science. 328 (5977), 498-501 (2010).
- Lesterlin, C., Ball, G., Schermelleh, L., Sherratt, D. J. RecA bundles mediate homology pairing between distant sisters during DNA break repair. Nature. 506 (7487), 249-253 (2014).
- Alexeeva, S., Gadella, T. W. J., Verheul, J., Verhoeven, G. S., Den Blaauwen, T. Direct interactions of early and late assembling division proteins in Escherichia coli cells resolved by FRET: Bacterial division studied by spectral FRET. Molecular Microbiology. 77 (2), 384-398 (2010).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522 (2014).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Kapuscinski, J. DAPI: A DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved