Method Article
大腸菌における抗生物質持続性の集団および単一細胞解析
要約
抗生物質の持続性は、敏感な同質遺伝子集団内の小さな亜集団が高用量の殺菌性抗生物質に一時的に耐える能力を表します。.本プロトコルは、 大腸菌 を致死量のオフロキサシンに曝露した後の分子および細胞レベルで抗生物質持続表現型を特徴付けるためのアプローチを組み合わせたものです。
要約
抗生物質の持続性とは、少量の細菌亜集団が高用量の殺菌性抗生物質に一時的に耐える能力を指します。.殺菌性抗生物質処理により、細菌集団の大部分は急速に殺されます。この最初の急速な殺傷段階に続いて、持続性細胞が生存し続けるにつれて、殺傷率が大幅に低下します。古典的には、持続性は、高用量の抗生物質で、定義された曝露時間に対して実行される時間/キルアッセイによって集団レベルで決定されます。この方法は、持続性細胞のレベルと殺傷動態に関する情報を提供しますが、持続性現象の根底にある固有の細胞間の不均一性を反映していません。ここで説明するプロトコルは、従来のTime/Killアッセイとリアルタイム蛍光顕微鏡を使用したシングルセル分析を組み合わせたものです。適切な蛍光レポーターを使用することにより、生細胞の顕微鏡イメージングは、染色体の複製と分配、細胞伸長、細胞分裂などの細胞プロセスに対する抗生物質の影響に関する情報を提供できます。集団解析とシングルセル解析を組み合わせることで、持続性表現型の分子的および細胞的特性評価が可能になります。
概要
このプロトコルは、単一細胞および集団レベルでの特定の抗生物質治療に応答した細菌持続表現型を分析することを目的としています。持続性とは、同質遺伝子集団内の小さな亜集団が高用量の殺菌性抗生物質(フルオロキノロン、アミノグリコシド、βラクタムなど)に耐える能力を表し、いわゆる持続性細胞の最小阻害濃度(MIC)は集団の大部分と同じです。抗生物質の存在下で細菌の生存を経時的に測定する場合、二相性殺傷動態は、非持続性細胞の最初の急速な根絶、続いて持続性細胞のはるかに遅い殺傷率を伴う、一過性の薬剤耐性細胞の存在を明らかにする。抗生物質を除去すると、これらの細胞は遺伝的に同一の集団を生じさせ、同じ抗生物質で処理した場合と同様の殺傷動態を示します1,2。持続性とは対照的に、抗生物質耐性は集団レベルで定義され、一般にde novo変異または耐性付与プラスミド3の水平遺伝子導入のいずれかの結果です。耐性の原因となる変異は、主に薬物の標的または薬物排出ポンプのプロモーター領域にありますが、ゲノムワイドおよび標的変異体解析アプローチによって特定された持続頻度を変化させる遺伝子は、多数かつ多様であることが証明されています2,3,4,5,6,7,8 .したがって、細菌細胞は複数の経路9,10,11を介して持続性状態に入る可能性があり、これらの持続性細胞の生理機能を特徴付けるには、単一細胞レベルで持続現象を調べるアプローチが必要です。
蛍光顕微鏡と組み合わせて使用されるマイクロ流体ツールの最近の開発は、持続性表現型の特性評価への道を開き、染色体複製12、DNA修復13、細胞分裂14などの重要な細胞プロセスの役割を強調しました。この論文では、高用量のオフロキサシンで処理された指数関数的に成長する大腸菌培養物で生成された持続性細胞を特徴付けるために、古典的な微生物学アッセイとシングルセルライブイメージングを組み合わせた統合アプローチについて説明します。ここで説明するプロトコルは、枯草菌などの他の細菌種における抗生物質持続現象を研究するために適用することができ15、または条件(例えば、βラクタム治療後の抗生物質持続性16)を研究することができ、表現型の不均一性を含む多くの現象を調査するために容易に変更することができる17、18、19.さらに、この論文に記載されているセットアップを他の蛍光レポーターと組み合わせて、単一細胞レベルでのpH20またはATP21の細胞内レベルなど、関心のある明確な細胞パラメーターを調べることができ、抗生物質の持続現象に関する新しい洞察を生み出す可能性があります。
プロトコル
注:滅菌培養ガラス器具、ピペットチップ、および成長培地を使用してください。ここで、 大腸菌 細胞は、低自家蛍光化学的に規定された培地中で増殖させた( 材料の表を参照されたい)。接種は、汚染のリスクを最小限に抑えるためにブンゼンバーナーの存在下で行われました。
1. 細胞培養と成長曲線
- Luria-Bertaini(LB)寒天プレート(必要に応じて選択的抗生物質を補充)上の凍結グリセロールストックから目的の株をストリークし、37°Cで一晩(15時間から19時間の間)インキュベートして単一のコロニーを得ます。
注:ここで紹介する実験では、wt株に対応する大腸菌K-12 MG1655と同質遺伝子MG1655 hupA-mCherry株22の2つの株を使用します。後者の株は、HUヌクレオイド関連タンパク質の蛍光タグ付きαサブユニットを発現する。hupA-mCherryレポーターは、hupAのネイティブ遺伝子座に統合されています。HU-mCherryは、非特異的な方法でDNAに結合する生細胞の核様体動態を追跡するためのプロキシとして機能します。 - 5mLの培地(ここでは、3-[N-モルホリノ]プロパンスルホン酸系培地[MOPS];表1、表2、および表3)にグルコース0.4%および選択的抗生物質(必要な場合)を添加し、単離コロニーをガラスチューブ(≥25mL)に入れ、チューブを37°Cに設定した振とうインキュベーターに入れ、一晩(15時間から19時間の間)毎分180回転(rpm)した。あるいは、ガラスチューブの代わりにプラスチックチューブ、ガラス、またはプラスチックフラスコ(≥25mL)を使用することができる。
注:最終濃度0.4%のグリセロールを添加したMOPS培地は、MOPSグルコース0.4%で行われた一晩培養を除いて、この論文に記載されている実験全体で使用されました。グルコースを添加したMOPSにおける 大腸菌 の生成時間は、MOPSグリセロールにおけるそれよりも短い。このステップでMOPSグリセロール0.4%の代わりにMOPSグルコース0.4%を使用すると、細胞が19時間以内に固定期に到達することが保証されます。M9または異なる炭素源を添加したリッチ定義培地(RDM)などの他の増殖培地も使用することができる。しかしながら、成長率および持続頻度は、使用される培地および/または炭素によって異なることに注意すべきである23。 - 翌朝、培養液1 mLを2,300 x gで3分間遠心分離し、上清を捨て、ペレットを同容量のリン酸緩衝生理食塩水(PBS)に静かに再懸濁します。600 nm(OD 600 nm)での光学密度を測定し、最終容量2 mLで0.01の初期OD600 nmに必要な容量を計算します。
- 2 mLのMOPSグリセロール0.4%培地を透明な底部24ウェルプレートのウェルに入れ、計算した一晩培養量を接種します。24ウェルプレートを自動マイクロプレートリーダー( 材料の表を参照)に入れて、OD600 nm を24時間監視します。マイクロプレートリーダーをセットして、37°Cの温度と高い軌道回転(140rpm)で15分ごとにOD600nm を測定します。
注:実験で使用された菌株が蛍光レポーターをコードする場合、増殖速度は抗生物質の持続頻度に影響を与えるため、後続の実験でのアーティファクトを回避するために、その成長率が wt の成長率に匹敵することを確認してください23。非常に低い細胞密度での検出には限界があり、OD600 nm/コロニー形成単位(CFU)の関係に対する潜在的な株特異的な影響があるため、特性評価されていない株で作業する場合は、CFU·mL-1 を監視して増殖動態を評価することをお勧めします。
2.抗生物質の最小阻害濃度の決定
注:最小阻害濃度(MIC)は、細菌の増殖が観察されない抗生物質の最低用量として定義されます。.MICの決定は、抗生物質および株ごとに実行する必要があります。ここに記載の実験では、フルオロキノロン系抗生物質オフロキサシン(OFX)を使用した。MICの決定により、抗生物質溶液が正しく調製され、抗生物質が活性であり、株が抗生物質に対して同等に感受性であることを確認できます。ここでは、公開された寒天希釈法を用いて、使用した異なる菌株のMIC乃至OFXを決定した24。所与の細菌株に対する所与の抗生物質のMICは、ブロス希釈法24を介して決定することもできる。
- MIC測定のためのプレートの準備
- 実験で使用した抗生物質の原液は、OFX5mgを超純水1mLに溶解して調製します。OFXの溶解度を高めるために、37%HClを20μL添加します。
- 100 mLの滅菌LB寒天培地を溶かし、固化を避けるために55°Cに保ちます。6つの小さなガラスフラスコ(25 mL)を準備し、滅菌ピペットを使用して各フラスコに5 mLの液体LB寒天培地をピペットで入れます。
- 5 mg·mL-1 OFXマスターストック溶液10 μLを超純水90 μLで希釈します(マスターストックの1:10希釈)。5 mLのLB寒天培地を含む6つのガラスフラスコのそれぞれに0 μL、2 μL、4 μL、6 μL、8 μL、または10 μLの500 μg·mL-1 OFX溶液を加え、最終濃度0 μg・mL−1、0.02 μg・mL−1、0.04 μg・mL−1のLB寒天培地を生成します。 それぞれ0.06 μg·mL-1、0.08 μg·mL-1、および0.1 μg·mL-1 OFXです。フラスコを数回回転させて溶液を混合する。
注:目的の抗生物質のMICがわかっている場合、濃度の範囲は実際のMICの下から上に達する必要があります。MICが不明な場合は、log2 希釈系列を使用した広範囲の濃度が推奨されます。抗生物質を添加する前に、LB寒天培地が冷えていることを確認してください。それにもかかわらず、抗生物質を添加する前にLB寒天培地を固化させないことは、LB寒天培地中の抗生物質の不均一な分布につながる可能性があるため、重要です。 - ステップ 2.1.3 で調製した 6 つの LB 寒天培地のそれぞれ 5 mL を、滅菌ピペットを使用して用量を増加させる方法で 6 ウェル培養プレートに注ぎます。寒天が固まるまで冷まし、プレートを乾かしてからご使用ください。
注:抗生物質溶液と培養プレートをアッセイ実施当日に調製します。
- MIC測定アッセイ
- 5 mLのLB培地に単離されたコロニーをガラス管(≥25 mL)に接種し、ガラス管を37°Cおよび180 rpmに設定された振とうインキュベーターに一晩(15時間から19時間の間)入れます。
- 翌朝、OD600 nmを測定し、培養液をPBS中で最終細胞密度1 x 107 CFU・mL-1 に試験管に希釈した。ここでテストした菌株の場合、1 x 107 CFU·mL−1 は0.0125のOD600 nm に相当します。
注:CFU·mL-1とOD 600 nmの相関が不明な場合は、CFU·mL-1とOD600 nmの相関係数を計算するために、CFUとOD600 nmの測定によって決定された成長曲線を確立する必要があります。 - 以前に希釈した培養液を2 μL、乾燥した6ウェルプレートのすべてのウェルにスポットします。プレートを37°Cのインキュベーターに一晩(15時間から19時間の間)入れる前に、スポットを乾燥させます。
- 翌日、各ウェルに形成されたコロニーを数えます。MICは、細菌の増殖が検出されない抗生物質の最小濃度のウェルに対応します。
3. スポットアッセイ
注:スポットアッセイ法は、生細胞(抗生物質ストレス後にコロニーを生成できる細胞)の数を推定できる定性的アプローチです。スポットアッセイは、タイムキルアッセイの前に実行され、テストされた条件で使用される菌株の生存率に関する洞察を提供し、タイムキルアッセイ中に必要な希釈について通知します(セクション4を参照)。
- スポットアッセイ用のLB寒天プレートを調製するには、50 mLのLB寒天を正方形のペトリ皿(144 cm2)に注ぎます。時間ポイントごとに1つの正方形のペトリ皿を準備します。LB寒天を固め、プレートを乾燥させてから使用してください。
- 5 mLの培地(MOPSグルコース0.4%)に単離されたコロニーをガラスチューブ(≥25 mL)に接種し、チューブを37°Cおよび180 rpmに設定された振とうインキュベーターに一晩(15時間から19時間の間)置きます。
- 翌日、OD600 nmを測定し、培養液をガラスチューブ(≥25 mL)中の新鮮な温度調整培地(37°C、MOPSグリセロール0.4%)に希釈して、最終的なOD600 nm ~0.001にしました。培養液をインキュベーター内で37°C、180 rpm(15時間から19時間の間)で一晩増殖させます。
- 翌日、OD600 nmを測定し、0.3の最終OD600 nmになるまで培養液をインキュベートした。
- インキュベート中に、90 μLの0.01 M MgSO4 溶液を最初の列(行A)を除くすべてのウェルに配置して、96ウェルプレートを調製します。96ウェルプレートは、ステップ3.7で10倍の段階希釈に使用されます。
注:この実験では、2つの株(wt および hupA-mCherry 株)を7つの異なる時点で三重に試験した。1枚のプレートは12列で構成されているため、1枚のプレートを2つの時点に使用でき、合計4枚のプレートを用意しました。 - OD600 nm が 0.3 の状態で、各細菌培養物 200 μL を回収します。これらのサンプルは、抗生物質治療前のt0(未処理)時点に対応し、抗生物質治療前のCFU・mL-1 の決定を可能にします。
- サンプルを2,300 x g で3分間遠心分離します。遠心分離時間の間に、液体培養物に所望の濃度のOFXを添加し、振とうしながら37°Cでインキュベートを続ける。
注:ここでは、OFXは5μg・mL-1 の濃度で使用されました(MICに83倍を掛けたものに相当)。以前の研究では、この濃度はOFX曝露下での持続現象を特徴付けるために使用されました25。タイム/キルアッセイに使用される抗生物質濃度は、抗生物質、培地、および細菌の増殖状態によって異なります。 - 遠心分離後、細胞ペレットを200 μLの0.01 MMgSO4 溶液に再懸濁します。ステップ3.5で調製した96ウェルプレートの空のウェルに100μLを入れます。A列目のウェル10 μLを、0.01 M MgSO4を90 μLの0.01 M MgSO4を含むB行目のウェルに移して希釈を行います。10 μLのウェルをBのウェルをC列目のウェルに移して、段階希釈を続けます。10−7 の希釈に達するまで繰り返します(すべての転写は10倍希釈です)。
注:この実験では、6つの培養物( wt 株に3つ、 hupA-mCherry 株に3つ)をすべての時点でテストしました。プロトコルに従って、マルチチャンネルピペットを使用して、6つの菌株の段階希釈を同時に実行します。技術的なエラーを最小限に抑えるために、ピペットチップは転送ごとに交換されます。 - 各希釈液の10 μLを、ステップ3.1で調製したLB寒天プレートにスポットします。
注:マルチチャンネルピペットを使用して、6つの培養液に対して同じ希釈液(10-4 希釈など)を同時に見つけます。スポッティング中は、マイクロ液滴がプレートに分注される可能性があるため、マルチチャンネルピペットの最初のストップを2番目のストップを押さずに使用する必要があります。 - 抗生物質添加後の適切な時点で、200 μLの培養液を回収し、ステップ3.8に記載されているように段階希釈を実行します。ステップ3.9に記載されているように各希釈液を10μLスポットします。
注:ここで説明する実験では、7つの時点(t0、t1h、t2h、t3h、t4h、t5h、t6h)が収集されました。wtと比較して増加した抗生物質感受性を示す株については 、 残留抗生物質を除去するためにMgSO4 0.01M中で複数回の洗浄を行うことができる。 - プレートを37°Cで一晩(15時間から19時間)インキュベートします。翌日、コロニーを検出できる2つの最も高い希釈液でコロニーの数を数えます。理想的には、これらの希釈用の寒天プレート上のスポットには3〜30個のコロニーが含まれており、各サンプルのCFU・mL-1 を正確に測定できます。
- 各時点の計算されたCFU・mL-1をt0での初期母集団のCFU・mL-1で割ることによって生存率を計算します。
4. タイムキルアッセイ
注:スポットアッセイは、特定の抗生物質に対する特定の菌株の生存率を推定するための使いやすい方法ですが、タイムキルアッセイはより高い分解能の生存率を提供し、細菌の生存率を正確に定量するために実行されます。キリングカーブのプロファイルを使用して、特定の細菌株が特定の状態において抗生物質に対して感受性、耐性、または耐性であるかどうかを判断できます。さらに、タイムキルアッセイは、持続現象(二相性殺傷曲線の第2の傾きの始まり)および持続頻度を検出するために必要な抗生物質曝露の時間の決定を可能にする。
- タイムキルめっきアッセイ用のLB寒天プレートを準備します。25 mLのLB寒天をペトリ皿(±57 cm2)に注ぎます。タイムポイントごとに少なくとも2つのペトリ皿を準備します(株ごとにタイムポイントごとに2つの希釈液をメッキします)。
- LB寒天を固化させ、プレートを乾燥させてから、各プレートに5〜8個の滅菌ガラスビーズを追加します。ひずみ/条件/時点に従ってプレートを反転してラベルを付けます。
注意: ガラスビーズは、ステップ4.7およびステップ4.9の間に寒天プレート上にバクテリアを拡散させます。あるいは、細胞は、スプレッダーを用いて寒天プレート上に分散させることができる。 - 各サンプルについて、900 μLの0.01 M MgSO4 溶液を含む10倍の段階希釈ガラス管を準備します。調製が必要なサンプルあたりの希釈ガラスチューブの数は、スポットアッセイでコロニーを検出するために必要な希釈液に対応します。
- 5 mLの培地(MOPSグルコース0.4%)に単離されたコロニーをガラスチューブ(≥25 mL)に接種し、チューブを37°Cおよび180 rpmに設定された振とうインキュベーターに一晩(15時間から19時間の間)置きます。
- 16時間の増殖後、OD 600 nmを測定し、培養液をガラス管内の新鮮な温度調整培地(37°C、MOPSグリセロール0.4%)に希釈して、最終的なOD600 nm~0.001にしました。培養液をインキュベーター内で37°C、180 rpm(15時間から19時間の間)で一晩増殖させます。
- 翌日、OD600 nmを測定し、0.3の最終OD600 nmになるまで培養液をインキュベートした。
- OD 600 nmが0.3の状態で、培養物100 μLを回収し、スポットアッセイで得られたデータに従って希釈し(OD 600 nmが0.3で抗生物質なしの場合、10-5希釈で通常200〜300コロニーが得られる)、ステップ4.1〜4.2で調製したLB寒天プレート上に100 μLをプレートします。 ビーズが皿の端に接触しないようにプレートを静かに振ると、LB寒天培地上の細菌細胞が不均一に広がる可能性があります。抗生物質治療前のこの最初のサンプルは、t0時点(抗生物質治療前のCFU・mL-1)に対応します。
- 所望の濃度のOFXを加え、振とうしながら37°Cでインキュベートを続ける。
注:ここでは、OFXは5μg・mL-1 の濃度で使用されました(MICに83倍を掛けたものに相当)。 - 抗生物質添加後の関連する時点で、培養物100 μLを回収し、スポットアッセイで得られたデータに従って希釈し、ステップ4.1〜4.2で調製したLB寒天プレート上に100 μLをプレートします。ステップ4.7の説明に従って細胞をプレートします。
注:ここで説明する実験では、7つの時点(t0、t1h、t2h、t3h、t4h、t5h、t6h)が収集されました。 重量と比較して増加した抗生物質感受性を示す株については、残留抗生物質を除去するためにMgSO4 0.01 Mで複数回の洗浄を行うことができます。 - プレートを37°Cで一晩(15時間から19時間)インキュベートします。翌日、コロニーを検出できる2つの最も高い希釈液でコロニーの数を数えます。理想的には、プレートには、各サンプル中のCFU·mL-1 を正確に測定できるように、30〜300個のコロニーが含まれている必要があります。
- 各時点でのCFU・mL-1をt0のCFU・mL-1で正規化して生存率を計算します。log10正規化CFU・mL-1を時間の関数としてプロットします。
5. マイクロ流体タイムラプス顕微鏡イメージング
注:次のセクションでは、マイクロ流体プレートの準備、タイムラプス画像の取得および画像解析手順について説明します。この実験の目的は、単一細胞レベルで抗生物質治療時の持続性表現型を観察および分析することです。この実験中に収集されたデータは、対処された質問および/または実験中に使用された蛍光レポーターに応じて、幅広い結果を生成するために使用できます。ここで説明する実験では、細胞長およびHU-mCherry蛍光22の定量的分析を行い、持続性細胞および非持続性細胞における核様体組織を反映して、行った。
- マイクロ流体タイムラプス顕微鏡のための細菌細胞培養
- 5 mLの培地(MOPSグリセロール0.4%、必要に応じて選択的抗生物質を添加した)を単離したコロニーをガラスチューブ(≥25 mL)に接種し、チューブを37°Cおよび180 rpmに設定された振とうインキュベーターに一晩(15時間から19時間の間)入れます。
- 翌日、OD 600 nmを測定し、ガラス管で培養液を新鮮な温度調整培地(37°C、MOPSグリセロール0.4%)で希釈して、最終的なOD600 nm~0.001とした。培養液を37°C、180rpmの振とうインキュベーターで一晩(15時間から19時間の間)増殖させ、翌日に初期の指数相培養物を得ました。
- マイクロ流体プレートの作製とタイムラプス顕微鏡イメージング
注:マイクロ流体実験は、市販のマイクロ流体デバイス(ここで説明)または自社で製造されたマイクロ流体システムで実行できます。- マイクロ流体プレートのすべてのウェルから保存液(存在する場合)を取り出し、新鮮な培地と交換します。
注意: マイクロ流体プレートに廃棄物出口ウェルが含まれている場合は、出口ウェルの保存液を除去する必要がありますが、培地で交換しないでください。 - マニホールドシステムでマイクロ流体プレートをシールするには、シールボタンをクリックするか、マイクロ流体ソフトウェアを使用します(最初にツールを選択し、次にシールプレートを選択します)。
注意: プレートをシールするには、プレートをマニホールドに対して手動で絞って、プレートとマニホールドに均一な圧力をかける必要があります。正しく実行されると、「封印された」というメモがONIX2インターフェイスに表示されます。マニホールドを破損する潜在的なリスクを回避するために、スライドガラスに圧力をかけないことが重要です。 - 密封したら、最初のプライミングシーケンスを実行します(マイクロ流体ソフトウェアインターフェースの[ 液体プライミングシーケンスの実行 ]をクリックします)。
注: 液体プライミングシーケンスの実行 は、ウェル1〜5の場合は6.9 kPaで5分間の灌流に相当し、ウェル8の場合は6.9 kPaで5分間の灌流、ウェル6の場合は6.9 kPaで5分間の最終灌流ラウンドに対応します。 ランリキッドプライミングシーケンス は、異なるウェルを接続するチャネルにまだ存在する可能性のある保存溶液の除去を可能にします。 - 顕微鏡イメージングを開始する前に、顕微鏡のサーモスタット制御キャビネットで希望の温度(ここでは37°C)でプレートを最低2時間インキュベートします。
- 実験を開始する前に、2回目の 液体プライミングシーケンスの実行 を開始します。
- マイクロ流体ソフトウェアインターフェースの[シールオフ]をクリックして、マイクロ流体プレートをシールします。ウェル 1 とウェル 2 の培地を 200 μL の新しい培地に、ウェル 3 では抗生物質を含む新鮮な培地 200 μL (ここでは 5 μg·mL−1 の OFX)、ウェル 4 とウェル 5 では 200 μL のフレッシュ培地、ウェル 6 では 200 μL のフレッシュ培地、ウェル 8 では 200 μL の培養サンプル (ステップ 5.1.2 から) を外径600 nm に希釈した培地 (ここでは 5.1.2 から) を交換します。新鮮な培地で0.01の。
- 手順5.2.2の説明に従ってマイクロ流体プレートを密封し、顕微鏡キャビネット内の顕微鏡対物レンズにプレートを置きます。
注:マイクロ流体プレートを配置する前に、顕微鏡対物レンズに液浸オイルを滴下してください。 - マイクロ流体ソフトウェアで、[ セルローディング ]をクリックして、セルをマイクロ流体プレートにロードできるようにします。
注: セルローディング ステップは、ウェル8の場合は13.8 kPaで15秒の灌流、続いてウェル6とウェル8の場合は27.6 kPaで15秒の灌流、ウェル6の場合は6.9 kPaで30秒間の最終灌流ラウンドで構成されます。マイクロ流体プレート内の細胞の密度は、実験にとって重要です。このマイクロ流体プロトコルの最初の部分は、抗生物質治療の前に新鮮な培地中で6時間細菌を増殖させることからなる。6時間の増殖後、細胞密度は希少な持続性細胞を検出するのに十分でなければなりません(この研究で使用された条件では、持続性細胞は10−4の頻度で生成されます)。細胞密度が高すぎると、個々の細胞を区別することが困難になり、正確な単一細胞解析が妨げられます。増殖速度は培地に直接依存するため、実験を開始する前に顕微鏡分野の細胞の密度を評価する必要があります。 - 透過光モードを使用して最適な焦点を設定し、適切なセル数が観察されるいくつかの関心領域(ROI)を選択します(フィールドあたり最大300セル)。
注: 少なくとも 40 個の ROI を選択して、まれなパーシスタンサー セルがイメージ化されていることを確認します。 - マイクロ流体ソフトウェアで、[ プロトコルの作成]をクリックします。新鮮な培地を6.9 kPaで6時間注入し(ウェル1-2)、続いて抗生物質を含む培地を6.9 kPaで6時間注入し(ウェル3)、最後に6.9 kPaで20時間新鮮な培地を注入します(ウェル4-5)。
注:OD600 nm に0.01に希釈された細菌培養により、細菌はマイクロ流体チャンバー内で6時間増殖し、細胞が指数関数的成長段階にあることが保証されます。ローディングステップ(ステップ5.2.8を参照)中にマイクロ流体デバイスに導入された細胞の数に応じて、増殖段階の持続時間を調整して、ROIあたり最大300個の細胞を得ることができます。持続性はまれな現象であるため、ROIあたりの細胞数を増やすと、持続性細胞を観察する可能性が向上します。ただし、セル数は、シングルセル分析が面倒になるため、ROIあたり300セルを超えてはなりません。 - 透過光と蛍光レポーターの励起光源を使用して、15分ごとに1フレームのタイムラプスモードで顕微鏡イメージングを実行します。ここでは、mCherry信号用の560nm励起光源を使用しました(フィルター00[530-585 ex、615LP em、Zeiss]で10%の電力で580 nm LED、mCherryの場合は100ミリ秒の露光)。ツァイス互換のZen3.2ソフトウェアを細胞イメージングに使用しました。
- マイクロ流体プレートのすべてのウェルから保存液(存在する場合)を取り出し、新鮮な培地と交換します。
- 画像解析
注:顕微鏡画像のオープニングと視覚化は、オープンソースのImageJ/Fijiソフトウェア(https://fiji.sc/)26を使用して実行されます。定量的画像解析は、オープンソースのImageJ/Fijiソフトウェアと無料のMicrobeJプラグイン(https://microbej.com)27を使用して実行されます。このプロトコルでは、MicrobeJ 5.13I(14)バージョンが使用されました。- コンピューターでImageJ/Fijiソフトウェアを開き、ハイパースタックタイムラプス顕微鏡画像をフィジーのローディングバーにドラッグします。 イメージ>カラー>コンポジットの作成を使用して、 ハイパースタックのさまざまなチャネルを融合します。タイムラプス実験のチャンネルが目的の色に対応していない場合(たとえば、位相差が灰色ではなく赤で表示される場合)は、[ 画像>カラー]>[チャンネルの配置 ]を使用して、チャンネルに適切な色を適用します。
- MicrobeJプラグインを開き、手動編集インターフェイスを使用して細菌細胞を検出します。自動的に検出されたセルを削除し、目的の永続セルの輪郭をフレームごとに手動で作成します。
注: 個々のセルを自動的に検出するために、さまざまな設定を使用できます。ここでは、分析された持続細胞が長いフィラメントを形成し、自動検出を使用して正しく検出されることはめったにないため、手動検出を使用しました。 - 検出後、MicrobeJ 手動編集インターフェイス の結果アイコンを使用して 、ResultJ テーブルを生成します。ResultJファイルを保存し、ResultJテーブルを使用して、シングルセル解析の対象となるさまざまなパラメータに関する洞察を得ます。このプロトコルの場合、HU-mCherry強度の平均蛍光、細胞長、および個々の細胞の細胞面積をエクスポートしました。
結果
上述のように、持続性細胞の単一細胞表現型解析に用いた菌株は、MOPSグリセロール0.4%培地で特徴付けられた。経時的なOD600nm のモニタリングでは、 wt 株と hupA-mCherry株の間に差は見られませんでした(図1)。これは、HU-mCherry融合タンパク質の発現がこれらの条件下での増殖に影響を及ぼさなかったことを示している。両株の細菌細胞は、OD600 nm の0.01で最初に接種され、接種後±8時間で指数関数的段階に達した。
OFXのMICは、標準化された方法(ここでは段階寒天希釈)によって決定されました24。MICは、目に見える成長が検出されない最小濃度として定義されます。両株のOFXのMICは0.06 μg・mL−1と判定され、 hupA-mCherry 融合は同質遺伝子 重量 株と比較してOFXに対する感受性に影響を及ぼさないことが示された(図2)。
さらに、この研究で使用された両方の株の生存率に対する致命的なOFX治療(83倍MIC)の効果を決定しました。生細胞数はOFX曝露で時間の経過とともに減少するにつれて、細菌培養物の希釈率は、プレートあたり30〜300コロニーに達するように適切に調整する必要があります。経時的に適切な希釈を決定するために、スポットアッセイを実施し、マルチチャンネルピペットを使用して、0〜10−7の連続10倍希釈液10 μLを正方形のペトリ皿に置きました。適切な希釈は、単離されたクローンが見えるものであった(例えば、t0 = 10−5、t1h = 10−4/10−3、t4h = 10−2/10−1)(図3)。
スポットアッセイは、OFXを介した殺傷の動態に関する洞察を得るための簡単な方法ですが、殺傷動態を正確に決定することはできません。OFXで処理した指数関数的に増殖する細胞の生存率をタイムキルアッセイによってモニターしたところ、典型的な二相性曲線が観察されました(図4)。曲線の最初の傾きは、非持続性集団の急速な殺傷を反映しています(赤い破線)。ここでテストした条件では、最大99.9%の細胞がOFXの存在下で3時間後にコロニーを形成することができませんでした。この殺傷の第1段階の後に第2段階が続き、殺傷速度が遅くなり(青い破線)、薬剤耐性持続細胞の存在が明らかになります。テストされた条件では、OFX添加後約3時間で持続性相が始まり、持続性表現型を調べるために細胞をOFXに3時間以上さらす必要性が強調されました。重要なことに、タイムキル曲線は、 hupA-mCherry 融合タンパク質がタイムキル速度論に影響を及ぼさなかったことを示しています。したがって、翻訳蛍光融合をコードする株は、蛍光顕微鏡を用いて持続性細胞をモニターするために使用することができる。
さらに、単一細胞レベルでの持続現象を調査しました。これを行うために、hupA-mCherry株をマイクロ流体プレートに導入し、所定のROIでタイムラプス顕微鏡を実行しながら、培地条件(ここでは成長、処理、および回復)の変更を可能にしました。マイクロ流体実験の最初のステップでは、マイクロ流体デバイスに導入された細胞に増殖培地(MOPSグリセロール0.4%)を灌流し、発生時間~2時間で分割しました(図5および図6)。この成長の第1段階は、細胞が生存可能であり、OFX処理前に活発に分裂していたことを示しています。
この成長の最初の段階の後、細胞に5 μg・mL−1 OFXを添加した増殖培地を6時間灌流しました。抗生物質が細胞に到達するとすぐに、細胞分裂がブロックされました(図5 および 図6)。OFX処理の6時間後、細胞を新鮮な培地で灌流した。大多数の細胞は増殖を再開することができなかったが(図5 および 図6)、細菌の小さな亜集団は糸状細胞を伸長および生成することができた25。OFX処理後に分裂して生細胞娘細胞を生成することができたこれらの細胞は、持続性細胞として定義することができる。
この設定により、処理前、処理中、処理後のパーシスタンサー細胞の可視化が可能になるため、回復段階のパーシスタンサー表現型に関する情報だけでなく、処理前のパーシスタンサー細胞の生理学的状態に関する情報も提供されます(図6)。試験した条件において、持続性細胞はOFX処理前に非持続性細胞と同様に分裂し、観察された持続性細胞が休眠中の亜集団に由来しなかったことを示している(図6)25。
回復期における持続性細胞の細胞長分析により、各フィラメントが特定の伸長率を有することが明らかになった。最初の分割の前に各パーシスタントが到達したセルの長さは、パーシスタンサごとに異なっていました。同様に、第1分割イベントのタイミングは非常に不均一でした(図6)。分裂持続性フィラメントは複数の娘細胞を生成し、未処理の細胞と同様に、ほとんどの場合、成長と分裂を開始しました(図7)。フィラメントの連続的な分裂は、細胞長の漸進的な減少をもたらし、最終的にOFX処理前と同様の細胞長を有する娘細胞を生じさせた(図6 および 図7B)。細胞の大部分は、OFX除去後にフィラメント形成を誘導することができなかった。この大きな細胞集団は、死細胞に相当する(図5 および 図6)。
ヌクレオイド関連タンパク質HUの蛍光融合により、ヌクレオイド22のダイナミクスを可視化することができます。細胞内のHU-mCherryの総蛍光強度の分析は、DNA含量の代理として使用することができる22,25。成長期(OFX処理前)では、細胞周期中の染色体複製と分配のダイナミクスを反映して、総mCherry蛍光強度が変化しました(図8)。OFX添加後、mCherry蛍光は細胞中央で増加し、核様体圧縮を示し、これは二本鎖DNA切断の形成によって誘導されることが示されている(図5)。二本鎖DNA切断は、II型トポイソメラーゼDNAジャイレースおよびトポイソメラーゼIV29,30を破壊するOFXの作用機序の結果である。大腸菌では、DNAジャイレースがOFX29,30の主要な標的です。二本鎖継代機構の重要なステップでその標的を結合することにより、OFXは切断されたDNA鎖の降格を阻害し、最終的には二本鎖DNA切断の放出をもたらす30。上述したように、OFX処理する持続細胞は回収中にフィラメント25に開始した(図6)。細胞長の増加は、総mCherry蛍光強度の増加と相関し、これは、複製再開およびフィラメント25における核様体存在量の増加を反映している(図7aおよび図8)。死細胞の場合、総mCherry蛍光強度は処理中および回復段階で安定しており、これらの細胞がOFX除去後に染色体を複製できなかったことを示しています(図8)。オフロキサシン処理前、治療中、治療後の大腸菌HU-mCherry細胞のマイクロ流体ビデオ(ビデオ1)も示されています。
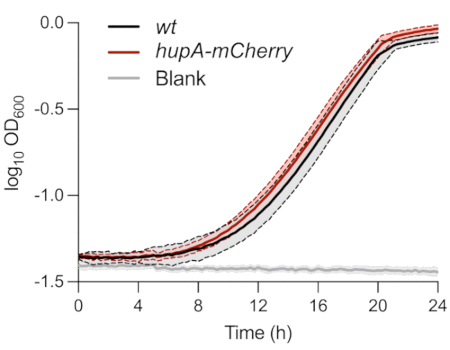
図1:wtおよびhupA-mCherry大腸菌株の増殖モニタリング。 重量(黒)とhupA-mCherry(赤)の光学密度モニタリング(OD600 nm)。陰影と破線は、生物学的三重の標準偏差を示す。この図の拡大版を表示するには、ここをクリックしてください。
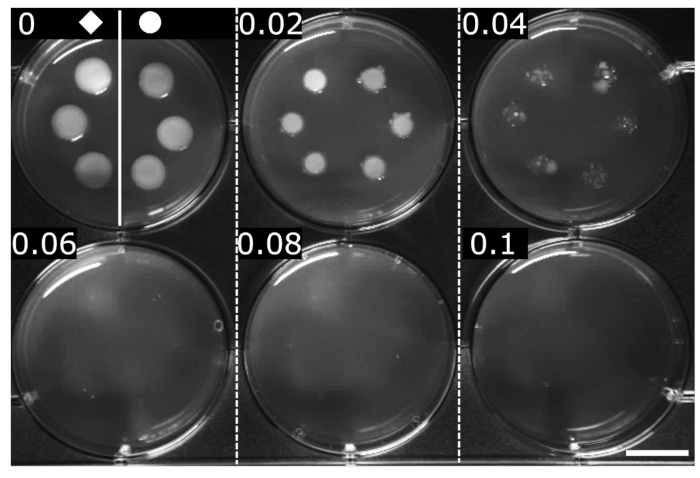
図2:wtおよびhupA-mCherry大腸菌株に対するOFXのMICの決定。 wt(♦)およびhupA-mCherry(●)をLB培地で増殖させ、2μLをOFX含有LB寒天培地の段階希釈液にスポットした(各パネルで示した濃度はμg・mL−1)。増殖阻害は、最小0.06 μg·mL−1で見られます。図は生物学的三重の代表的な実験である。スケールバー= 1 cm。 この図の拡大版を表示するには、ここをクリックしてください。
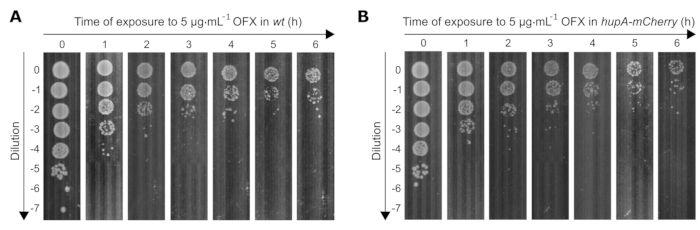
図3:OFXへの曝露時の wt および hupA-mCherry大腸菌 株のスポットアッセイ。 (A) wt および(B) hupA-mCherry 株を、プロトコル(セクション3)に記載されているようにMOPSグリセロール0.4%で増殖させ、指数関数的に増殖する細胞(OD600 nm = 0.3)を5 μg·mL−1 OFXで処理した。T0は、OFXが追加される前の時点に対応します。T1、T2、T3、T4、T5、およびT6は、OFX添加後1〜6時間に対応する。図は生物学的三重の代表的な実験である。 この図の拡大版を表示するには、ここをクリックしてください。
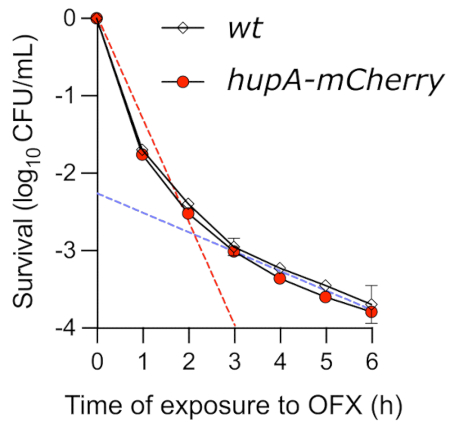
図4:OFXへの曝露時のwtおよびhupA-mCherry大腸菌株のタイムキルアッセイ。 wt(♦)およびhupA-mCherry(●)株をプロトコル(セクション4)に記載されているようにMOPSグリセロール0.4%で増殖させ、指数関数的に増殖する細胞(OD600 nm = 0.3)を5 μg·mL−1 OFXで処理した。破線は、最初の「急速な」(赤)殺戮段階と2番目の「遅い」(青)殺戮段階を示し、敏感で永続的な亜集団に対応します(それぞれT0とT2の間、およびT3とT6の間の線形回帰によって取得されます)。エラーバーは、生物学的三重の標準偏差を示します。この図の拡大版を表示するには、ここをクリックしてください。
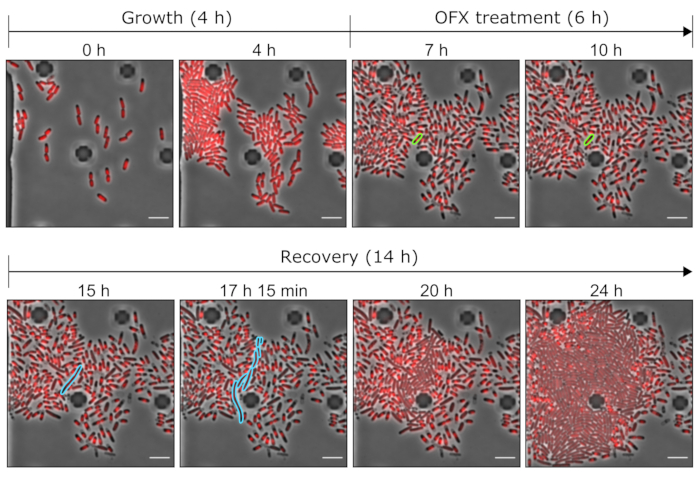
図5:マイクロ流体ツールを使用したOFXパーシスターと死細胞の代表的な画像。hupA-mCherry株を用いて実施したマイクロ流体実験の関連時点を示す代表的な顕微鏡画像(灰色は位相差、赤色はHU-mCherryシグナル)。タグ付きhupA-mCherryを発現する細胞をマイクロ流体プレートで増殖させ(ここでは4時間)、続いてOFXチャレンジ(5μg・mL−1)を行った。OFXの存在下で6時間後、細胞を新鮮な培地で灌流し、持続性細胞を回復させた。OFX処理中およびOFX除去後の持続細胞およびその子孫細胞は、それぞれ緑色および青色で強調表示される。対応する時点が各パネルに表示されます。スケールバー = 5 μm。 この図の拡大版を表示するには、ここをクリックしてください。
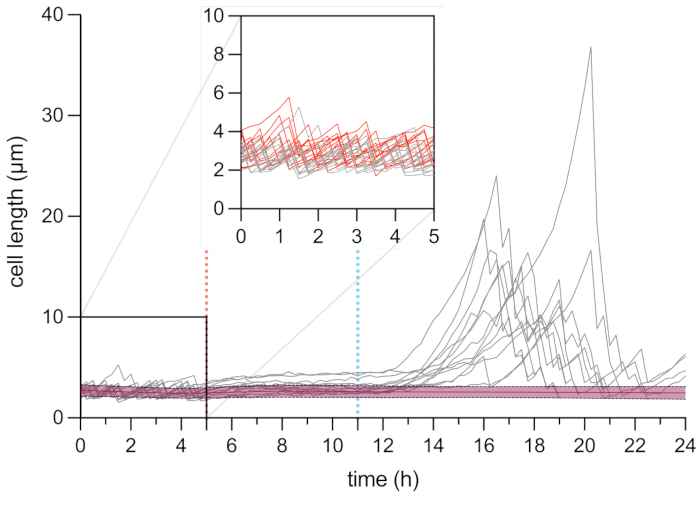
図6:パーシスターと死細胞の長さの顕微鏡タイムラプス分析。 死細胞(赤、n = 109)および持続細胞(灰色、n = 13)の細胞長分析。OFX治療の開始(5 μg・mL−1)は赤い破線(5時間)で示され、OFX除去は青い破線で示されます。挿入図は、OFX添加前の成長期に対応する。実験は3連で行った。網掛けと破線は、死細胞集団の標準偏差を示す(n = 109)。 この図の拡大版を表示するには、ここをクリックしてください。
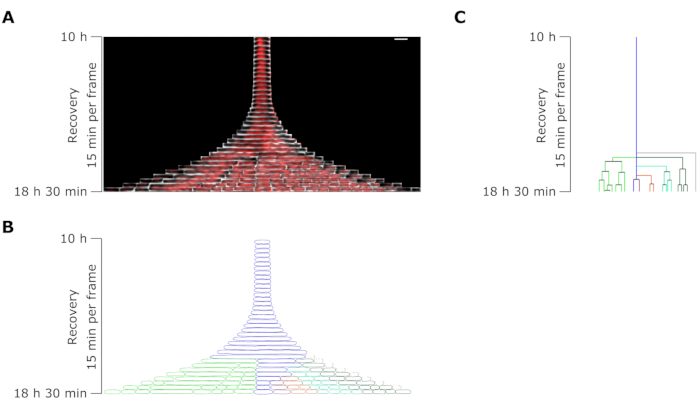
図7:OFXに対する代表的な持続性の顕微鏡タイムラプス分析。 (A)OFX除去後8.5時間(マイクロ流体実験開始後18.5時間、4時間の増殖、6時間の5μg・mL−1OFX処理、およびOFX除去後の8.5時間の回復を含む)にフィラメント分裂によって生成された代表的なOFX持続性体およびその娘細胞のキモグラフ。1フレームは15分に相当します。スケールバー = 5 μm。 (B)Aのパーシスタンターキモグラフから生成されたマスク。モニター対象のパーシスタンター・セルは青色のアウトラインで示され、ドーター・セルは異なる色で強調表示されます。(C)Bから生成された持続性細胞系譜の模式図。色分けはBと同じです。この図の拡大版を表示するには、ここをクリックしてください。
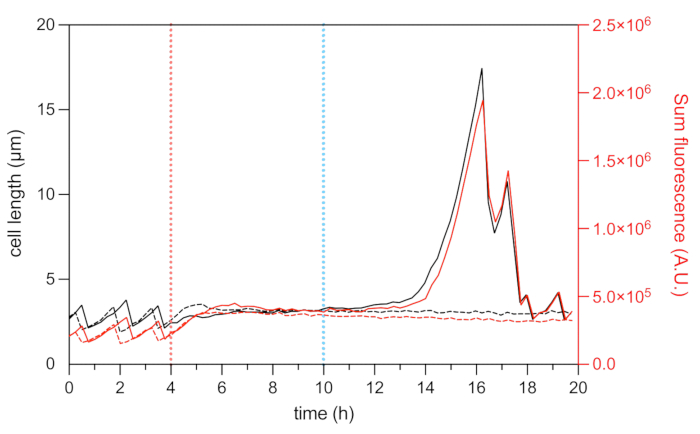
図8:代表的な持続性細胞と死細胞の細胞長とmCherry蛍光解析。 マイクロ流体タイムラプス実験中の代表的な持続性細胞(黒実線と赤線)と代表的な死細胞(黒と赤の破線)の細胞長(左軸)と総HU-mCherry蛍光強度(右軸、任意の単位で表示)の分析。OFX処理の開始(5 μg・mL−1)を赤破線で、OFX除去を青破線で示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ビデオ1:オフロキサシン治療前、治療中、治療後の 大腸菌 HU-mCherry細胞のマイクロ流体ビデオ。 HU-mCherry細胞を示すマイクロ流体タイムラプスイメージング。細胞をMOPSグリセロール0.4%中で4時間増殖させた。6時間のOFX処理(5 μg・mL−1)後、抗生物質を含まない培地をマイクロ流体プレートに灌流して、持続性細胞を回復させました。スケールバー= 5μm。時間(分単位)が表示されます。成長と回復の段階は「MOPS-Gly」で示されます。0.4%」と「OFX 5 μg/mL」によるOFX処理を行いました。 このビデオをダウンロードするには、ここをクリックしてください。
| 10x モップ | |||
| ストックソリューション | 10x MOPS 1 L分の原液量 | 10x MOPSベースでの最終濃度 | |
| モップス酸 | 1 M (KOHを使用してpH 7.4に調整) | 400ミリリットル | 0.4メートル |
| トリシン | 1 M (KOHを使用してpH 7.4に調整) | 40ミリリットル | 0.04メートル |
| FeSO4.7H2O | 0.01メートル | 10ミリリットル | 0.0001メートル |
| NH4Cl | 1.9メートル | 50ミリリットル | 0.095メートル |
| K2SO4 | 0.276メートル | 10ミリリットル | 0.00276メートル |
| CaCl2.2H 2O | 0.0005メートル | 10ミリリットル | 0.000005メートル |
| マグネシウム 2.6H2O | 0.528メートル | 10ミリリットル | 0.00528メートル |
| ナトリウム | 直接加える 29.2 g | 0.5メートル | |
| 蒸留水 | 460ミリリットル | ||
| 微量栄養素1000倍(表2を参照) | 10ミリリットル | ||
表1:10倍モップの構成。
| 微量栄養素1000x | ||
| 微量栄養素中の濃度1000xストック溶液 | 10x MOPSベースでの最終濃度 | |
| (NH4)6Mo7O24.4H2O | 0.000003メートル | 0.00000003メートル |
| H3 BO3 | 0.0004メートル | 0.000004メートル |
| CoCl2.6H 2O | 0.00003メートル | 0.0000003メートル |
| CuSO4.5H 2O | 0.00001メートル | 0.0000001メートル |
| MnCl 2.4H2 O | 0.00008メートル | 0.0000008メートル |
| ZnSO.7H2O | 0.00001メートル | 0.0000001M |
表2:1,000倍の微量栄養素の組成。
| モップスグルコース0.4%またはモップスグリセロール0.4% | |||
| ストックソリューション | 1 L MOPSグルコース0.4%またはMOPSグリセロール0.4%の容量 | MOPSグルコース0.4%またはMOPSグリセル0.4%の最終濃度 | |
| 10x モップ | 表 1 を参照してください。 | 100ミリリットル | |
| K2HPO4 | 0.132メートル | 10ミリリットル | 0.00132メートル |
| グルコース(MOPSグルコース0.4%の場合) | 20% (100 mL蒸留水に20 g) | 20ミリリットル | 0.40% |
| グリセロール(MOPSグリセロール0.4%) | ≤99% | 4ミリリットル | 0.40% |
| 蒸留水 | モワカ グルコース 0.4% の場合は 870 mL、MOPS グリセロール 0.4% の場合は 886 mL | ||
表3:MOPSグルコース0.4%およびMOPSグリセロール0.4%の組成。
ディスカッション
この論文で提示されたプロトコルは、集団および単一細胞レベルでの抗生物質治療に応答して観察された持続表現型の分析を可能にします。実験は、化学的に定義された培地(MOPSグリセロール0.4%)で増殖させた大腸菌MG1655株を用いて行った。タイムキルアッセイおよび顕微鏡実験は、指数相培養で実施した。フルオロキノロンであるOFXを5 μg・mL−1の濃度で使用し、持続性細胞を明らかにしました。ここで説明するアプローチは、他の殺菌性抗生物質、例えばβ−ラクタム、アミノグリコシド、または抗菌化合物に適用することができる31。したがって、他の細菌株、培地、または増殖条件を使用することができる。ここで説明したものと同様の設定で異なる蛍光融合をモニタリングすることは、抗生物質治療の前、最中、および後に、DNA複製32、DNA修復25、33、および細胞分裂34などの細胞プロセスを追跡するのに役立ちます。同様に、蛍光レポーターを利用して、細胞内pH35、ATP36、またはROS37レベルなどの細胞生理学の異なる側面を調べることができます。蛍光融合の代わりに、化学染料も適用できます。例えば、hupA-mCherry融合は、DNA38を染色する蛍光色素である4',6-ジアミジノ-2-フェニルインドール(DAPI)に置き換えることができます。ただし、このような蛍光色素と組み合わせてタイムラプス顕微鏡を行うことは、これらの染色技術がタイムラプス実験中の細胞周期のダイナミクスを乱す可能性があるため、避ける必要があります。あるいは、そのような実験は、関連する時点でのスナップショット画像の時間経過分析に置き換えることができる。
このような蛍光レポーターは役に立ちますが、位相差画像の解析で抽出できる情報量も無視してはなりません。ここでは、増殖、OFX処理、および回復段階を通じて細胞長の進化を監視しました。細胞幅、位相差強度、細菌細胞の曲率など、位相差画像に基づく他のパラメータも、MicrobeJ27などの適切なソフトウェアを使用して簡単に抽出できます。
要約すると、ここで説明する手順は、変化する環境またはストレッサーに対する細胞応答をモニターするために、他の条件および細菌種に適用することができる18、19。他の蛍光レポーター(転写および翻訳レポーター、化学色素)をフローサイトメトリー/FACSなどのポピュレーション解析と組み合わせて使用 することにより、興味深い質問にマルチスケールフレームワークで対処できます。
開示事項
著者は競合する利益を宣言しません。
謝辞
ヴァンメルダーレンラボでの作業は、ARCアクション2018-2023、国立科学研究センター財団(FNRS CDR J.0182.21F)によってサポートされています。T.O.はULBフェローシップによってサポートされています。T.S.はFRIAフェローシップ(FNRS)によってサポートされています。JCは、ポスドクフェローシップ「シャルジェデレシェルシュ」(FNRS)によってサポートされています。
資料
| Name | Company | Catalog Number | Comments |
| Axio Observer | Zeiss | Inverted fluorescence microscope | |
| CaCl2.2H2O | Merck | 1.02382.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CellASIC ONIX Microfluidic System | Merck | CAX2-S0000 | Microfluidic system |
| CellASIC ONIX2 FG | Merck | ONIX2 1.0.1 | Microfluidic software |
| CellASIC ONIX2 Manifold Basic | Merck | CAX2-MBC20 | Manifold system |
| CoCl2.6H2O | Merck | 1.02539.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CuSO4.5H2O | Merck | 1.02790.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| D-(+)-glucose | Sigma Aldrich | G7021-1KG | Carbon source for MOPS glucose 0.4% growth medium |
| E. coli K-12 MG1655 CF1648 (fnr+) | BE10 | wt reference strain, lab strain | |
| E. coli K-12 MG1655 CF1648 (fnr+) hupA-mCherry::FRT-kan-FRT | BE16 | HU-mCherry fusion integrated via P1 transduction at the native locus, lab strain | |
| FeSO4.7H2O | VWR Chemicals | 24244.232 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Fiji | ImageJ | https://fiji.sc/ | Image software; Schindelin et al. if used in publication |
| Glycerol | Merck | 56815 | Carbon source for MOPS glycerol 0.4% growth medium |
| Greiner CELLSTAR® multiwell culture plate | Merck | M8812-100EA | 24-well clear flat bottom 2ml volume culture plate for automated plate reader |
| H3BO3 | Sigma-Aldrich | B6768-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Hamamatsu ORCA Flash 4.0 digital camera | Hamamatsu | C13440-20CU | Digital Image Acqusition |
| K2HPO4 | Merck | 1.05099.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| KOH | Merck | 1.05029.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| K2SO4 | Merck | 1.05153.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Luria-Broth agar medium | Invitrogen | 22700041 | Growth medium for plating assay |
| Luria-Broth medium | Invitrogen | 12780029 | Growth medium for MIC determination |
| MgCl2.6H2O | Merck | 1.05832.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MgSO4 | Merck | 7487-88-9 | Dilution solution for bacterial survival assay used at 10mM |
| MicrobeJ | Imagej/Fiji plugin | https://www.microbej.com/ | Microscopy image analysis plugin. Ducret et al.for in publication; Detection settings: For bacteria : Area (μm2): 0,1-max; Length (μm): 0,5-max; Width (μm): 0,6-max; Range (μm): 0,5-max; Angularity (rad): 0-0,3; 0-max for all other parameters. |
| Microfluidic Plates CellASIC ONIX | Merck | B04A-03-5PK | Plate for microfluidic system |
| MnCl2.4H2O | Merck | 1.05927.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MOPS, Free Acid ULTROL® Grade | Merck | 475898-500GM | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NaCl | SIgma-Aldrich | S5886-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| (NH4)6Mo7O24.4H2O | Merck | 1.01180.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NH4Cl | Merck | 1.01145.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Ofloxacin | Merck | 82419-36-1 | Fluoroquinolone antibiotic used to treat the bacterial cells |
| Phosphate Buffered Saline (PBS) pH 7.4, 1x | Merck | P3813 | Dilution buffer |
| GENESYS 10S UV-Visible Spectrophotometer | Thermofisher Scientific | 840-208200 | UV-Visible Spectrophotometer, Single/Six Cell Holder with PrinterMeasurement of optical density OD600nm |
| SoftMax Pro | Molecular Devices | Microplate reader software | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| N-[Tris(hydroxyméthyl)-méthyl]-glycine | Merck | 1.08602.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Zeiss® immersion Oil 518F | Zeiss | Immersion oil to increase resolution of microscope | |
| Zen3.2 Pro | Zeiss | Microscopic image acquisition and processing software | |
| ZnSO4.7H2O | Merck | 1.08883.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
参考文献
- Balaban, N. Q., et al. Definitions and guidelines for research on antibiotic persistence. Nature Reviews Microbiology. 17 (7), 441-448 (2019).
- Brauner, A., Fridman, O., Gefen, O., Balaban, N. Q. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nature Reviews Microbiology. 14 (5), 320-330 (2016).
- Pribis, J. P., Zhai, Y., Hastings, P. J., Rosenberg, S. M. Stress-induced mutagenesis, gambler cells, and stealth targeting antibiotic-induced evolution. mBio. 13 (3), 01074 (2022).
- Molina-Quiroz, R. C., Lazinski, D. W., Camilli, A., Levy, S. B. Transposon-sequencing analysis unveils novel genes involved in the generation of persister cells in uropathogenic Escherichia coli. Antimicrobial Agents and Chemotherapy. 60 (11), 6907-6910 (2016).
- Cameron, D. R., Shan, Y., Zalis, E. A., Isabella, V., Lewis, K. A genetic determinant of persister cell formation in bacterial pathogens. Journal of Bacteriology. 200 (17), 00303-00318 (2018).
- Cui, P., et al. Identification of genes involved in bacteriostatic antibiotic-induced persister formation. Frontiers in Microbiology. 9, 413 (2018).
- Li, T., et al. Identification of novel genes involved in Escherichia coli persistence to tosufloxacin. Frontiers in Cellular and Infection Microbiology. 10, 581986 (2020).
- Verstraeten, N., et al. Obg and membrane depolarization are part of a microbial bet-hedging strategy that leads to antibiotic tolerance. Molecular Cell. 59 (1), 9-21 (2015).
- Hofsteenge, N., van Nimwegen, E., Silander, O. K. Quantitative analysis of persister fractions suggests different mechanisms of formation among environmental isolates of E. coli. BMC Microbiology. 13 (1), 25 (2013).
- Huemer, M., Mairpady Shambat, S., Brugger, S. D., Zinkernagel, A. S. Antibiotic resistance and persistence-Implications for human health and treatment perspectives. EMBO Reports. 21 (12), 51034 (2020).
- Wilmaerts, D., Windels, E. M., Verstraeten, N., Michiels, J. General mechanisms leading to persister formation and awakening. Trends in Genetics. 35 (6), 401-411 (2019).
- Murawski, A. M., Brynildsen, M. P. Ploidy is an important determinant of fluoroquinolone persister survival. Current Biology. 31 (10), 2039-2050 (2021).
- Lemma, A. S., Soto-Echevarria, N., Brynildsen, M. P. Fluoroquinolone persistence in Escherichia coli requires DNA repair despite differing between starving populations. Microorganisms. 10 (2), 286 (2022).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Morawska, L. P., Kuipers, O. P. Antibiotic tolerance in environmentally stressed Bacillus subtilis: Physical barriers and induction of a viable but nonculturable state. microLife. 3, (2022).
- Windels, E. M., et al. Enrichment of persisters enabled by a ß-lactam-induced filamentation method reveals their stochastic single-cell awakening. Communications Biology. 2 (1), 426 (2019).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-Expanding the toolbox of microfluidic single-cell cultivations. Journal of Molecular Biology. 431 (23), 4569-4588 (2019).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli growth rate to osmotic shock. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7807-7812 (2014).
- Shi, H., et al. Starvation induces shrinkage of the bacterial cytoplasm. Proceedings of the National Academy of Sciences of the United States of America. 118 (24), 2104686118 (2021).
- Goode, O., et al. Persister Escherichia coli cells have a lower intracellular pH than susceptible cells but maintain their pH in response to antibiotic treatment. mBio. 12 (4), 00909-00921 (2021).
- Manuse, S., et al. Bacterial persisters are a stochastically formed subpopulation of low-energy cells. PLoS Biology. 19 (4), 3001194 (2021).
- Fisher, J. K., et al. Four-dimensional imaging of E. coli nucleoid organization and dynamics in living cells. Cell. 153 (4), 882-895 (2013).
- Cabral, D., Wurster, J., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. Pharmaceuticals. 11 (1), 14 (2018).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2), 163-175 (2008).
- Goormaghtigh, F., Van Melderen, L. Single-cell imaging and characterization of Escherichia coli persister cells to ofloxacin in exponential cultures. Science Advances. 5 (6), (2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ducret, A., Quardokus, E. M., Brun, Y. V. MicrobeJ, a tool for high throughput bacterial cell detection and quantitative analysis. Nature Microbiology. 1 (7), 16077 (2016).
- Odsbu, I., Skarstad, K. DNA compaction in the early part of the SOS response is dependent on RecN and RecA. Microbiology. 160 (5), 872-882 (2014).
- Pham, T. D. M., Ziora, Z. M., Blaskovich, M. A. T. Quinolone antibiotics. MedChemComm. 10 (10), 1719-1739 (2019).
- Drlica, K., et al. Quinolones: Action and resistance updated. Current Topics in Medicinal Chemistry. 9 (11), 981-998 (2009).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: From targets to networks. Nature Reviews Microbiology. 8 (6), 423-435 (2010).
- Reyes-Lamothe, R., Sherratt, D. J., Leake, M. C. Stoichiometry and architecture of active DNA replication machinery in Escherichia coli. Science. 328 (5977), 498-501 (2010).
- Lesterlin, C., Ball, G., Schermelleh, L., Sherratt, D. J. RecA bundles mediate homology pairing between distant sisters during DNA break repair. Nature. 506 (7487), 249-253 (2014).
- Alexeeva, S., Gadella, T. W. J., Verheul, J., Verhoeven, G. S., Den Blaauwen, T. Direct interactions of early and late assembling division proteins in Escherichia coli cells resolved by FRET: Bacterial division studied by spectral FRET. Molecular Microbiology. 77 (2), 384-398 (2010).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522 (2014).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Kapuscinski, J. DAPI: A DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved