Method Article
ניתוח אוכלוסייה ותא בודד של התמדה אנטיביוטית ב- Escherichia coli
In This Article
Summary
התמדה אנטיביוטית מתארת את היכולת של תת-אוכלוסיות קטנות בתוך אוכלוסייה איזוגנית רגישה לסבול באופן זמני מינונים גבוהים של אנטיביוטיקה קוטלת חיידקים. הפרוטוקול הנוכחי משלב גישות לאפיון פנוטיפ ההתמדה האנטיביוטית ברמה המולקולרית והתאית לאחר חשיפת Escherichia coli למינונים קטלניים של אופלוקסצין.
Abstract
התמדה אנטיביוטית מתייחסת ליכולת של תת-אוכלוסיות חיידקים קטנות לסבול באופן זמני מינונים גבוהים של אנטיביוטיקה קוטלת חיידקים. לאחר טיפול אנטיביוטי קוטל חיידקים, רוב אוכלוסיית החיידקים מומתת במהירות. השלב המהיר הראשון של ההרג מלווה בירידה משמעותית בקצב ההרג ככל שהתאים המתמידים נשארים בני קיימא. באופן קלאסי, התמדה נקבעת ברמת האוכלוסייה על ידי בדיקות זמן/הרג המבוצעות עם מינונים גבוהים של אנטיביוטיקה ועבור זמני חשיפה מוגדרים. בעוד ששיטה זו מספקת מידע על רמת התאים המתמידים ועל קינטיקה ההורגת, היא אינה משקפת את ההטרוגניות הפנימית בין תאים העומדת בבסיס תופעת ההתמדה. הפרוטוקול המתואר כאן משלב מבחני זמן/הרג קלאסיים עם אנליזה של תא בודד באמצעות מיקרוסקופ פלואורסצנטי בזמן אמת. על ידי שימוש בכתבים פלואורסצנטיים מתאימים, הדמיה מיקרוסקופית של תאים חיים יכולה לספק מידע לגבי השפעות האנטיביוטיקה על תהליכים תאיים, כגון שכפול כרומוזומים והפרדתם, התארכות תאים וחלוקת תאים. שילוב של אוכלוסייה ואנליזה של תא בודד מאפשר אפיון מולקולרי ותאי של פנוטיפ ההתמדה.
Introduction
פרוטוקול זה נועד לנתח את פנוטיפ ההתמדה החיידקית בתגובה לטיפול אנטיביוטי ספציפי ברמת התא הבודד והאוכלוסייה. התמדה מתארת את היכולת של תת-אוכלוסיות קטנות בתוך אוכלוסייה איזוגנית לסבול מינונים גבוהים של אנטיביוטיקה חיידקית (פלואורוקינולונים, אמינוגליקוזידים, β-לקטמים וכו '), כאשר הריכוז המעכב המינימלי (MIC) של מה שמכונה תאים מתמידים זהה לזה של רוב האוכלוסייה. דינמיקת הרג ביפאזית, כאשר מודדים הישרדות חיידקים לאורך זמן בנוכחות אנטיביוטיקה, חושפת את נוכחותם של תאים עמידים לתרופות באופן חולף, עם חיסול מהיר ראשוני של התאים שאינם מתמידים, ואחריו קצב הרג איטי בהרבה של התאים המתמידים. עם הסרת אנטיביוטיקה, תאים אלה יוצרים אוכלוסייה זהה גנטית המציגה דינמיקת הרג דומה כאשר מטופלים באותה אנטיביוטיקה 1,2. בניגוד להתמדה, עמידות לאנטיביוטיקה מוגדרת ברמת האוכלוסייה והיא בדרך כלל תוצאה של מוטציות דה נובו או העברה גנטית אופקית של פלסמיד3 המעניק עמידות. בעוד שהמוטציות האחראיות לעמידות ממוקמות לרוב ביעד התרופה או באזורים הפרו-מוטוריים של משאבות השטף של התרופה, גנים המשנים את תדירות ההתמדה שזוהו על ידי גישות ניתוח מוטציות רחבות גנום וממוקדות הוכיחו את עצמם כרבים ומגוונים 2,3,4,5,6,7,8 . לכן, סביר להניח שתאי חיידקים יכולים להיכנס למצב המתמיד דרך מסלולים מרובים 9,10,11, ויש צורך בגישות לחקור את תופעת ההתמדה ברמת התא הבודד כדי לאפיין את הפיזיולוגיה של תאים מתמידים אלה.
הפיתוח האחרון של כלים מיקרופלואידים המשמשים בשילוב עם מיקרוסקופ פלואורסצנטי סלל את הדרך לאפיון פנוטיפ ההתמדה והדגיש את תפקידם של תהליכים תאיים מרכזיים, כגון שכפול כרומוזומים12, תיקון DNA 13 וחלוקת תאים14, ביצירת תאים מתמידים. במאמר זה, אנו מתארים גישה משולבת המשלבת בדיקות מיקרוביולוגיה קלאסיות עם הדמיה חיה של תא בודד כדי לאפיין תאים מתמידים שנוצרו בתרביות Escherichia coli הגדלות באופן אקספוננציאלי וטופלו במינון גבוה של אופלוקסצין. הפרוטוקול המתואר כאן יכול להיות מיושם כדי לחקור את תופעת ההתמדה האנטיביוטית במינים חיידקיים אחרים, כגון Bacillus subtilis15, או מצבים (למשל, התמדה אנטיביוטית לאחר טיפול β-lactam 16) וניתן בקלות לשנות אותו כדי לחקור את התופעות הרבות הקשורות להטרוגניות פנוטיפית17,18,19 . יתר על כן, ניתן לשלב את המערך המתואר במאמר זה עם כתבים פלואורסצנטיים אחרים כדי לחקור פרמטרים תאיים שונים בעלי עניין, כגון רמות תוך-תאיות של pH20 או ATP21 ברמת התא הבודד, אשר עשויים להפיק תובנות חדשות על תופעת ההתמדה האנטיביוטית.
Protocol
הערה: השתמש בכלי זכוכית בתרבית סטרילית, קצוות פיפטה ומדיום צמיחה. כאן, תאי E. coli גודלו בתווך אוטופלואורסצנטי נמוך המוגדר כימית (ראה טבלת חומרים). החיסונים בוצעו בנוכחות מבער בונזן כדי למזער את הסיכון לזיהום.
1. תרבית תאים ועקומת גדילה
- פזרו את הזן המעניין ממלאי גליצרול קפוא על צלחת אגר לוריא-ברטיני (LB) (בתוספת אנטיביוטיקה סלקטיבית, במידת הצורך), ודגרו בטמפרטורה של 37 מעלות צלזיוס למשך הלילה (בין 15 שעות ל -19 שעות) כדי להשיג מושבות בודדות.
הערה: הניסוי המוצג כאן משתמש בשני זנים, E. coli K-12 MG1655 המתאים לזן wt וזן איזוגני MG1655 hupA-mCherry 22. הזן האחרון מבטא את תת-היחידה α המתוייגת פלואורסצנטית של החלבון הקשור לנוקלואידים HU. כתב hupA-mCherry משולב במוקד המקורי של hupA. HU-mCherry משמש כפרוקסי לעקוב אחר דינמיקת הנוקלואידים בתאים חיים כפי שהוא נקשר לדנ"א באופן לא ספציפי. - לחסן 5 מ"ל של מדיום (כאן, 3-[N-morpholino] מדיום מבוסס חומצה פרופאן-סולפונית [MOPS]; טבלה 1, טבלה 2 וטבלה 3) בתוספת גלוקוז 0.4% ואנטיביוטיקה סלקטיבית (במידת הצורך) עם מושבה מבודדת בצינור זכוכית (≥25 מ"ל), ומניחים את הצינור באינקובטור רועד המוגדר ל-37 מעלות צלזיוס ו-180 סיבובים לדקה (סל"ד) למשך הלילה (בין 15 שעות ל-19 שעות). לחלופין, ניתן להשתמש בצינורות פלסטיק, זכוכית או צלוחיות פלסטיק (≥ 25 מ"ל) במקום צינורות זכוכית.
הערה: MOPS בינוני בתוספת גליצרול בריכוז סופי של 0.4% שימש לאורך כל הניסויים המתוארים במאמר זה, למעט תרביות לילה אשר בוצעו MOPS גלוקוז 0.4%. זמן הייצור של E. coli ב- MOPS בתוספת גלוקוז קצר יותר מזה של MOPS גליצרול. שימוש בגלוקוז MOPS 0.4% במקום MOPS גליצרול 0.4% בשלב זה מבטיח שהתאים יגיעו לשלב הנייח תוך 19 שעות. ניתן להשתמש גם באמצעי גידול אחרים, כגון M9 או מדיום מוגדר עשיר (RDM) בתוספת מקורות פחמן מובחנים. עם זאת, יש לציין כי קצב הגידול ותדירות ההתמדה שונים בהתאם למדיום ו / או לפחמן המשמש23. - למחרת בבוקר, צנטריפוגה 1 מ"ל של תרבית ב 2,300 x גרם במשך 3 דקות, להשליך את supernatant, ובעדינות resuspend את הגלולה באותו נפח של מלוחים חוצץ פוספט (PBS). מדוד את הצפיפות האופטית ב- 600 ננומטר (OD 600 ננומטר), וחשב את הנפח הדרוש ל- OD600 ננומטר התחלתי של 0.01 בנפח סופי של 2 מ"ל.
- מניחים 2 מ"ל של MOPS גליצרול 0.4% בינוני לתוך באר של צלחת תחתונה שקופה 24 בארות, ולחסן עם נפח תרבית לילה מחושב. מקם את הצלחת בעלת 24 הקידוחים בקורא מיקרו-צלחות אוטומטי (ראה טבלת חומרים) כדי לפקח על OD600 ננומטר למשך 24 שעות. הגדר את קורא המיקרו-לוחות למדוד את OD600 ננומטר כל 15 דקות בטמפרטורה של 37°C ועם סיבוב מסלול גבוה (140 סל"ד).
הערה: אם הזן המשמש בניסוי מקודד כתב פלואורסצנטי, ודא שקצב הגדילה שלו דומה לזה של wt כדי למנוע כל חפץ בניסויים הבאים, מכיוון שקצב הגדילה משפיע על תדירות ההתמדה האנטיביוטית23. בשל מגבלות הזיהוי בצפיפויות תאים נמוכות מאוד וההשפעות הפוטנציאליות הספציפיות לזן על הקשר OD600 ננומטר/יחידות יוצרות מושבה (CFU), מומלץ להעריך את קינטיקה הגדילה על ידי ניטור CFU·mL-1 בעבודה עם זנים לא מאופיינים.
2. קביעת הריכוז המעכב המינימלי של האנטיביוטיקה
הערה: הריכוז המעכב המינימלי (MIC) מוגדר כמינון הנמוך ביותר של אנטיביוטיקה שבו לא נצפתה צמיחת חיידקים. קביעת המיקרופון צריכה להתבצע עבור כל אנטיביוטיקה וזן. בניסויים המתוארים כאן, נעשה שימוש באנטיביוטיקה fluoroquinolone ofloxacin (OFX). קביעת המיקרופון מאפשרת אישור לכך שהפתרון האנטיביוטי הוכן כהלכה, האנטיביוטיקה פעילה, והזנים רגישים באותה מידה לאנטיביוטיקה. כאן, שיטת דילול אגר שפורסמה בוצעה כדי לקבוע את MIC ל OFX של הזנים השונים בשימוש24. ניתן לקבוע את המיקרופון של אנטיביוטיקה נתונה לזן חיידקי נתון גם באמצעות שיטת דילול מרק24.
- הכנת הצלחות לקביעת MIC
- הכן תמיסת מלאי אב לאנטיביוטיקה המשמשת בניסויים על ידי המסת 5 מ"ג של OFX ב 1 מ"ל של מים טהורים במיוחד. הוסף 20 μL של 37% HCl כדי להגדיל את המסיסות של OFX.
- יש להמיס 100 מ"ל של אגר LB סטרילי, ולשמור אותו בטמפרטורה של 55°C כדי למנוע התמצקות. הכינו שש צלוחיות זכוכית קטנות (25 מ"ל), ופיפט 5 מ"ל של מדיום אגר LB נוזלי לכל בקבוק באמצעות פיפטה סטרילית.
- לדלל 10 μL של 5 mg·mL-1 OFX תמיסת מלאי אב ב 90 μL של מים טהורים במיוחד (דילול 1: 10 של מלאי האב). הוסף 0 μL, 2 μL, 4 μL, 6 μL, 8 μL או 10 μL של תמיסת OFX של 500 מיקרוגרם·mL-1 לכל אחת משש צלוחיות הזכוכית המכילות 5 מ"ל של מדיום אגר LB כדי ליצור מדיום אגר LB עם ריכוזים סופיים של 0 מיקרוגרם·מ"ל−1, 0.02 מיקרוגרם·מ"ל−1, 0.04 מיקרוגרם·מ"ל−1, 0.06 מיקרוגרם·מ"ל−1, 0.08 מיקרוגרם·מ"ל−1 ו-0.1 מיקרוגרם·מ"ל-1 OFX, בהתאמה. מערבבים את התמיסה על ידי סיבוב הצלוחיות מספר פעמים.
הערה: אם המיקרופון של האנטיביוטיקה המעניינת ידוע, טווח הריכוזים צריך להגיע מלמטה מעל המיקרופון בפועל. אם המיקרופון אינו ידוע, מומלץ טווח גדול של ריכוזים עם סדרת דילול לוג2 . ודא כי מדיום אגר LB התקרר לפני הוספת אנטיביוטיקה, כמו טמפרטורות גבוהות עלול להשבית אותו. עם זאת, חשוב לא לתת למדיום אגר LB להתמצק לפני הוספת האנטיביוטיקה, שכן הדבר עלול להוביל לפיזור לא הומוגני של האנטיביוטיקה בתווך אגר LB. - יוצקים 5 מ"ל מכל אחת משש מדיות אגר LB שהוכנו בשלב 2.1.3 באופן מגדיל מינון לצלחת תרבית בת 6 בארות באמצעות פיפטה סטרילית. מניחים לאגר להתקרר עד להתמצקות, ומייבשים את הצלחת לפני השימוש.
הערה: הכינו את הפתרון האנטיביוטי, ואת צלחת התרבית ביום ביצוע הבדיקה.
- בדיקת קביעת MIC
- לחסן 5 מ"ל של LB בינוני עם מושבה מבודדת בתוך צינור זכוכית (≥25 מ"ל), ומניחים את צינור הזכוכית באינקובטור רעד מוגדר 37 ° C ו 180 סל"ד לילה (בין 15 שעות ל 19 שעות).
- למחרת בבוקר, מדדו את OD600 ננומטר, ודללו את התרבית למבחנה לצפיפות תאים סופית של 1 x 107 CFU·mL-1 ב- PBS. עבור הזנים שנבדקו כאן, 1 x 107 CFU·mL−1 מתאים OD600 ננומטר של 0.0125.
הערה: אם המתאם בין CFU·mL-1 ו- OD 600 ננומטר אינו ידוע, יש לקבוע את עקומת הצמיחה שנקבעה על ידי מדידות CFU ו- OD 600 ננומטר כדי לחשב את גורם המתאם בין CFU·mL-1 ו- OD600 ננומטר. - כתם 2 μL של התרבית המדוללת בעבר על כל באר של צלחת מיובשת 6 בארות. תן את כתמים להתייבש לפני הצבת הצלחת לתוך אינקובטור ב 37 מעלות צלזיוס ללילה (בין 15 שעות ל 19 שעות).
- למחרת, ספרו את המושבות שנוצרו בכל באר. המיקרופון מתאים לבאר עם הריכוז המינימלי של אנטיביוטיקה שבה לא מזוהה גידול חיידקי.
3. בדיקה נקודתית
הערה: שיטת בדיקת הכתמים היא גישה איכותית המאפשרת להעריך את מספר התאים בני קיימא (תאים המסוגלים ליצור מושבות לאחר לחץ אנטיביוטי). הבדיקה הנקודתית מבוצעת לפני בדיקת ה-time-kill כדי לספק תובנות לגבי הכדאיות של הזן המשמש בתנאים שנבדקו וכדי ליידע על הדילולים הדרושים במהלך בדיקת ה-time-kill (ראה סעיף 4).
- כדי להכין את צלחות אגר LB עבור בדיקות נקודתיות, יוצקים 50 מ"ל של אגר LB לתוך צלחת פטרי מרובע (144 ס"מ2). הכינו צלחת פטרי מרובעת אחת בכל נקודת זמן. תנו לאגר LB להתמצק, וייבשו את הצלחות לפני השימוש.
- יש לחסן 5 מ"ל בינוני (MOPS גלוקוז 0.4%) במושבה מבודדת בצינור זכוכית (≥25 מ"ל), ולהניח את הצינור באינקובטור רעד המוגדר ל-37 מעלות צלזיוס ו-180 סל"ד למשך הלילה (בין 15 שעות ל-19 שעות).
- למחרת, מדדו את OD 600 ננומטר, ודללו את התרבית למדיום מתוקנן טמפרטורה טרי (37°C, MOPS גליצרול 0.4%) בצינור זכוכית (≥25 מ"ל) ל-ODסופי של 600 ננומטר של ~0.001. תן לתרבות לגדול בן לילה באינקובטור ב 37 ° C ב 180 סל"ד (בין 15 שעות ל 19 שעות).
- למחרת, מדדו את OD 600 ננומטר, ודגרו על התרבית עד OD600 ננומטר סופי של 0.3.
- בזמן הדגירה, הכינו צלחות של 96 בארות על ידי הצבת 90 μL של תמיסת 0.01 M MgSO4 בכל באר למעט הבארות של השורה הראשונה (שורה A). לוחות 96 הקידוחים ישמשו לדילול סדרתי פי 10 בשלב 3.7.
הערה: בניסוי זה, שני זנים (wt ו-hupA-mCherry) נבדקו במשולש בשבע נקודות זמן שונות. מכיוון שלוח אחד מורכב מ-12 עמודים, ניתן להשתמש בלוח אחד לשתי נקודות זמן, וכך הוכנו בסך הכל ארבעה לוחות. - ב OD600 ננומטר של 0.3, למשוך 200 μL של כל תרבית חיידקים. דגימות אלה תואמות את נקודת הזמן t0 (לא מטופלת) לפני הטיפול האנטיביוטי ומאפשרות לקבוע את CFU·mL-1 לפני הטיפול האנטיביוטי.
- צנטריפוגה את הדגימות ב 2,300 x גרם במשך 3 דקות. בזמן הצנטריפוגה מוסיפים את הריכוז הרצוי של OFX לתרבית הנוזלית, וממשיכים לדגור בטמפרטורה של 37°C תוך כדי רעידה.
הערה: כאן, נעשה שימוש ב-OFX בריכוז של 5 מיקרוגרם·מ"ל-1 (המקביל למיקרופון כפול פי 83). במחקר קודם נעשה שימוש בריכוז זה כדי לאפיין את תופעת ההתמדה תחת חשיפהל-OFX 25. ריכוז האנטיביוטיקה המשמש למבחני זמן/הריגה יכול להשתנות בהתאם לאנטיביוטיקה, מדיום התרבית ומצב צמיחת החיידקים. - לאחר צנטריפוגה, להשעות מחדש את גלולת התא ב 200 μL של 0.01 M MgSO4 פתרון. מניחים 100 μL בבאר הריקה של צלחת 96 באר מוכן בשלב 3.5. בצע דילול על ידי העברת 10 μL של הבאר בשורה A לתוך הבאר בשורה B המכילה 90 μL של 0.01 M MgSO4. ממשיכים את הדילול הסדרתי על ידי העברת 10 μL של הבאר בשורה B לתוך הבאר בשורה C. חוזרים על הפעולה עד שמגיעים לדילול של 10-7 (כאשר כל העברה היא דילול של פי 10).
הערה: בניסוי זה, שש תרביות (שלוש עבור זן wt ושלוש עבור זן hupA-mCherry ) נבדקו עבור כל נקודת זמן. על פי הפרוטוקול, פיפטה מוטי תעלה משמשת לביצוע דילולים סדרתיים עבור ששת הזנים בו זמנית. כדי למזער את התקלה הטכנית, קצות פיפטה מוחלפים בין כל העברה. - נקוב 10 μL של כל דילול על לוחות אגר LB שהוכנו בשלב 3.1.
הערה: פיפטה רב-ערוצית משמשת לזיהוי סימולטני של אותו דילול (למשל, דילול של 10-4 ) עבור שש התרביות. במהלך האיתור, יש להשתמש בתחנה הראשונה של פיפטה רב ערוצית מבלי לדחוף את התחנה השנייה, מכיוון שהדבר יכול לגרום למיקרו-טיפות להיות מופצות על הצלחת. - בנקודות הזמן הרלוונטיות לאחר הוספת האנטיביוטיקה, משכו 200 מיקרוליטר של התרבית, ובצעו דילול סדרתי כמתואר בשלב 3.8. נקודתי 10 μL של כל דילול כמתואר בשלב 3.9.
הערה: עבור הניסוי המתואר כאן, נאספו שבע נקודות זמן (t0, t1h, t2h, t3h, t4h, t5h, t6h). עבור זנים המציגים רגישות מוגברת לאנטיביוטיקה בהשוואה ל - wt, ניתן לבצע שטיפות מרובות ב- MgSO4 0.01 M כדי להסיר שאריות אנטיביוטיקה. - לדגור את הצלחות ב 37 ° C בלילה (בין 15 שעות ל 19 שעות). למחרת, ספרו את מספר המושבות בשני הדילולים הגבוהים ביותר שעבורם ניתן לאתר מושבות. באופן אידיאלי, הכתמים על לוחות האגר עבור דילולים אלה מכילים בין 3 ל -30 מושבות המאפשרות קביעה מדויקת של CFU·mL-1 עבור כל דגימה.
- חשב את יחס ההישרדות על ידי חלוקת CFU·mL-1 המחושב של כל נקודת זמן ב- CFU·mL-1 של האוכלוסייה הראשונית ב- t0.
4. מבחני Time Kill
הערה: בעוד שבדיקות נקודתיות הן שיטה קלה לשימוש להערכת שיעור ההישרדות של זן נתון עבור אנטיביוטיקה נתונה, מבחני הרג בזמן נותנים שיעור הישרדות ברזולוציה גבוהה יותר ומבוצעים כדי לכמת במדויק את יכולת הקיום של החיידקים. הפרופיל של עקומת ההרג יכול לשמש כדי לקבוע אם זן חיידק נתון רגיש, סובלני או עמיד לאנטיביוטיקה במצב נתון. יתר על כן, מבחני הרג בזמן מאפשרים לקבוע את זמן החשיפה לאנטיביוטיקה הדרוש כדי לזהות את תופעת ההתמדה (תחילת השיפוע השני של עקומת ההרג הדו-פאזית) וכן את תדירות ההתמדה.
- הכינו צלחות אגר LB למבחן ציפוי הזמן. יוצקים 25 מ"ל של אגר LB לתוך צלחת פטרי (±57 ס"מ2). הכינו לפחות שתי מנות פטרי בכל נקודת זמן (שני דילולים לכל נקודת זמן לכל זן מצופים).
- תנו לאגר LB להתמצק, וייבשו את הצלחות לפני הוספת חמישה עד שמונה חרוזי זכוכית סטריליים לכל צלחת. הפוך ותייג את הלוחות בהתאם למתח/מצב/נקודת זמן.
הערה: חרוזי זכוכית מאפשרים התפשטות חיידקים על לוחות האגר במהלך שלב 4.7 ושלב 4.9. לחילופין, ניתן לפזר את התאים על צלחת האגר באמצעות מפזר. - עבור כל דגימה, להכין 10 פעמים דילול טורי צינורות זכוכית המכילים 900 μL של 0.01 M MgSO4 פתרון. מספר צינורות הזכוכית הדילול לכל דגימה שיש להכין מתאים לדילולים הדרושים לאיתור מושבות בבדיקת הספוט.
- יש לחסן 5 מ"ל בינוני (MOPS גלוקוז 0.4%) במושבה מבודדת בצינור זכוכית (≥25 מ"ל), ולהניח את הצינור באינקובטור רעד המוגדר ל-37 מעלות צלזיוס ו-180 סל"ד למשך הלילה (בין 15 שעות ל-19 שעות).
- לאחר 16 שעות של צמיחה, מדדו את OD 600 ננומטר, ודללו את התרבית למדיום טרי מותאם טמפרטורה (37°C, MOPS גליצרול 0.4%) בצינור זכוכית עד ODסופי 600 ננומטר של ~0.001. תן לתרבות לגדול בן לילה באינקובטור ב 37 ° C ב 180 סל"ד (בין 15 שעות ל 19 שעות).
- למחרת, מדדו את OD 600 ננומטר, ודגרו על התרבית עד OD600 ננומטר סופי של 0.3.
- ב OD600 ננומטר של 0.3, למשוך 100 μL של התרבית, לדלל על פי הנתונים שהתקבלו בבדיקת נקודה (ב OD600 ננומטר של 0.3 וללא אנטיביוטיקה, דילול 10-5 בדרך כלל נותן 200-300 מושבות), צלחת 100 μL על לוחות אגר LB מוכן בשלבים 4.1-4.2. נערו בעדינות את הצלחות כדי למנוע מגע של החרוזים עם קצוות המנה, מכיוון שהדבר עלול להוביל להתפשטות לא הומוגנית של תאי החיידקים על מדיום האגר LB. דגימה ראשונה זו לפני הטיפול האנטיביוטי מתאימה לנקודת הזמן t0 (CFU·mL-1 לפני הטיפול האנטיביוטי).
- מוסיפים את הריכוז הרצוי של OFX, וממשיכים לדגור בטמפרטורה של 37°C תוך כדי רעידה.
הערה: כאן, נעשה שימוש ב-OFX בריכוז של 5 מיקרוגרם·מ"ל-1 (המקביל למיקרופון כפול פי 83). - בנקודות הזמן הרלוונטיות לאחר הוספת האנטיביוטיקה, מוציאים 100 מיקרוליטר מהתרבית, מדללים בהתאם לנתונים המתקבלים בבדיקת הספוט, וצלחת 100 מיקרוליטר על צלחות אגר LB שהוכנו בשלבים 4.1-4.2. לוח התאים כמתואר בשלב 4.7.
הערה: עבור הניסוי המתואר כאן, נאספו שבע נקודות זמן (t0, t1h, t2h, t3h, t4h, t5h, t6h). עבור זנים המציגים רגישות מוגברת לאנטיביוטיקה בהשוואה ל - wt, ניתן לבצע שטיפות מרובות ב- MgSO4 0.01 M כדי להסיר שאריות אנטיביוטיקה. - לדגור את הצלחות ב 37 ° C בלילה (בין 15 שעות ל 19 שעות). למחרת, ספרו את מספר המושבות בשני הדילולים הגבוהים ביותר שעבורם ניתן לאתר מושבות. באופן אידיאלי, הלוחות צריכים להכיל 30-300 מושבות כדי לאפשר קביעה מדויקת של CFU·mL-1 בכל דגימה.
- חשב את יחס ההישרדות על ידי נרמול CFU·mL-1 בכל נקודת זמן על ידי CFU·mL-1 ב- t0. התוויית יומן10 מנורמל CFU·mL-1 כפונקציה של זמן.
5. הדמיית מיקרוסקופ מיקרופלואידית בהילוך מהיר
הערה: הסעיף הבא מתאר את הכנת הלוח המיקרופלואידי וכן את הליך רכישת התמונה וניתוח התמונה בהילוך מהיר. מטרת ניסוי זה היא לבחון ולנתח את פנוטיפ ההתמדה בטיפול אנטיביוטי ברמת התא הבודד. הנתונים שנאספו במהלך ניסוי זה יכולים לשמש ליצירת מגוון רחב של תוצאות בהתאם לשאלה שנדונה ו / או לכתבים הפלואורסצנטיים ששימשו במהלך הניסוי. בניסוי המתואר כאן בוצע ניתוח כמותי של אורך התא ושל HU-mCherry fluorescence22, המשקף את ארגון הנוקלואידים בתאים מתמידים ולא מתמידים.
- תרבית תאים חיידקית למיקרוסקופ מיקרופלואיד בהילוך מהיר
- יש לחסן 5 מ"ל מדיום (MOPS גליצרול 0.4%, בתוספת אנטיביוטיקה סלקטיבית במידת הצורך) במושבה מבודדת בצינור זכוכית (≥25 מ"ל), ולהניח את הצינור באינקובטור רועד המוגדר ל-37°C ו-180 סל"ד למשך הלילה (בין 15 שעות ל-19 שעות).
- למחרת, מדדו את OD 600 ננומטר, ודללו את התרבית בתווך טרי מותאם טמפרטורה (37°C, MOPS גליצרול 0.4%) בצינור זכוכית עד ODסופי 600 ננומטר של ~0.001. תנו לתרבית לגדול בן לילה (בין 15 שעות ל-19 שעות) באינקובטור מטלטל ב-37 מעלות צלזיוס ו-180 סל"ד כדי לקבל תרבית בשלב מעריכי מוקדם ביום המחרת.
- הכנת צלחת מיקרופלואידית והדמיית מיקרוסקופ בהילוך מהיר
הערה: ניסויים מיקרופלואידים יכולים להתבצע בהתקנים מיקרופלואידים זמינים מסחרית (כמתואר כאן) או במערכות מיקרופלואידיות המיוצרות בתוך החברה.- מוציאים את תמיסת השימור (אם קיימת) מכל באר של הצלחת המיקרופלואידית, ומחליפים אותה במדיום תרבית טרי.
הערה: אם הצלחת המיקרופלואידית מכילה באר מוצא פסולת, יש להסיר את פתרון השימור של באר המוצא אך לא להחליף אותו בתווך. - אטמו את הצלחת המיקרופלואידית עם מערכת הסעפת על ידי לחיצה על כפתור האטימה או באמצעות התוכנה המיקרופלואידית (תחילה בחרו כלי, ואחריו צלחת אטימה).
הערה: כדי לאטום את הצלחת, יש להפעיל לחץ אחיד על הצלחת ועל הסעפת על ידי סחיטה ידנית של הצלחת כנגד הסעפת. אם מבוצע כראוי, הפתק "חתום" אמור להופיע בממשק ONIX2. חשוב לא להפעיל לחץ על מגלשת הזכוכית כדי למנוע סיכון פוטנציאלי לשבירת הסעפת. - לאחר האטימה, בצע רצף ראשוני ראשון (לחץ על Run Liquid Priming Sequence בממשק התוכנה microfluidic).
הערה: Run Liquid Priming Sequence מתאים ל-5 דקות זילוח ב-6.9 kPa עבור בארות 1-5, ואחריו 5 דקות של זילוח ב-6.9 kPa עבור באר 8, וסיבוב זילוח אחרון עבור באר 6 למשך 5 דקות ב-6.9 kPa. רצף ה-Run Liquid Priming מאפשר להסיר את פתרון השימור שעדיין עשוי להימצא בתעלות המחברות בין הבארות השונות. - לדגור את הצלחת בארון מבוקר תרמוסטטית של המיקרוסקופ בטמפרטורה הרצויה (כאן, 37 מעלות צלזיוס) במשך מינימום של 2 שעות לפני תחילת הדמיה מיקרוסקופי.
- התחל רצף הפעלה נוזלי שני לפני תחילת הניסוי.
- אטמו את הצלחת המיקרופלואידית על ידי לחיצה על Seal off בממשק התוכנה המיקרופלואידית. החלף את המדיום בבאר 1 ובבאר 2 ב-200 מיקרוליטר של מדיום טרי, בבאר 3 ב-200 מיקרוליטר של מדיום טרי המכיל את האנטיביוטיקה (כאן, OFX ב-5 מיקרוגרם·מ"ל−1), בבאר 4 ובבאר 5 ב-200 מיקרוליטר של מדיום טרי, בבאר 6 עם 200 מיקרוליטר של מדיום טרי, ובבאר 8 ב-200 מיקרוליטר של דגימת התרבית (משלב 5.1.2) מדוללת ל-OD600 ננומטר של 0.01 בתווך הטרי.
- אטמו את הצלחת המיקרופלואידית כמתואר בשלב 5.2.2, והניחו אותה על מטרת המיקרוסקופ בתוך ארון המיקרוסקופ.
הערה: הקפידו להניח טיפת שמן טבילה על מטרת המיקרוסקופ לפני הנחת הצלחת המיקרופלואידית. - בתוכנה microfluidic, לחץ על Cell Loading כדי לאפשר את טעינת התא לתוך הצלחת microfluidic.
הערה: שלב טעינת התאים כולל 15 שניות של זילוח ב-13.8 kPa עבור באר 8, ואחריו 15 שניות של זילוח ב-27.6 kPa עבור באר 6 ובאר 8, וסיבוב זילוח סופי עבור באר 6 עבור 30 שניות ב-6.9 kPa. צפיפות התאים בצלחת המיקרופלואידית היא קריטית לניסוי. החלק הראשון של פרוטוקול מיקרופלואידי זה מורכב מגידול חיידקים במשך 6 שעות בתווך טרי לפני הטיפול האנטיביוטי. לאחר 6 שעות של גידול, צפיפות התאים צריכה להיות מספיקה כדי לזהות את התאים העקשניים הנדירים (בתנאים המשמשים במחקר זה, התאים המתמידים מייצרים בתדירות של 10-4). אם צפיפות התא גבוהה מדי, קשה להבחין בין התאים הבודדים, מה שמונע ניתוח מדויק של תא בודד. מכיוון שקצב הגידול תלוי ישירות בתווך, יש להעריך את צפיפות התאים בשדות המיקרוסקופ לפני תחילת הניסוי. - הגדר מיקוד מיטבי באמצעות מצב אור משודר, ובחר מספר אזורי עניין (ROI) שבהם נצפה מספר תא מתאים (עד 300 תאים לכל שדה).
הערה: בחר לפחות 40 החזר השקעה כדי לוודא שהתאים הקבועים הנדירים מצולמים. - על התוכנה microfluidic, לחץ על צור פרוטוקול. תכנת את הזרקת המדיום הטרי ב 6.9 kPa במשך 6 שעות (באר 1-2), ואחריו הזרקת המדיום המכיל את האנטיביוטיקה ב 6.9 kPa במשך 6 שעות (באר 3), ולבסוף, הזרקת מדיום טרי ב 6.9 kPa במשך 20 שעות (בארות 4-5).
הערה: תרבית חיידקים מדוללת ל-OD600 ננומטר של 0.01 מאפשרת לחיידקים לגדול בתא המיקרופלואידי במשך 6 שעות, ומבטיחה שהתאים נמצאים בשלב הגידול המעריכי. בהתאם למספר התאים שהוכנסו למכשיר המיקרופלואידי במהלך שלב הטעינה (ראה שלב 5.2.8), ניתן להתאים את משך שלב הגידול לקבלת עד 300 תאים לכל ROI. מכיוון שהתמדה היא תופעה נדירה, הגדלת מספר התאים לכל ROI משפרת את האפשרות לצפות בתאים מתמידים. עם זאת, מספר התא לא יעלה על 300 תאים לכל החזר השקעה, מכיוון שזה הופך את ניתוח התא הבודד למייגע. - בצע הדמיה מיקרוסקופית במצב קיטועי זמן עם פריים אחד בכל 15 דקות באמצעות האור המשודר ומקור אור העירור עבור כתב הפלואורסצנט. כאן, נעשה שימוש במקור אור עירור של 560 ננומטר עבור אות mCherry (580 ננומטר LED בהספק של 10% עם מסנן 00 [530-585 ex, 615LP em, Zeiss] וחשיפה של 100 ms עבור mCherry). תוכנת Zen3.2 תואמת Zeiss שימשה להדמיית תאים.
- מוציאים את תמיסת השימור (אם קיימת) מכל באר של הצלחת המיקרופלואידית, ומחליפים אותה במדיום תרבית טרי.
- ניתוח תמונות
הערה: הפתיחה וההדמיה של תמונות המיקרוסקופ מבוצעות באמצעות תוכנת הקוד הפתוח ImageJ/Fiji (https://fiji.sc/)26. ניתוח התמונה הכמותי מתבצע באמצעות תוכנת הקוד הפתוח ImageJ/Fiji והתוסף החינמי MicrobeJ (https://microbej.com)27. בפרוטוקול זה נעשה שימוש בגרסת MicrobeJ 5.13I(14).- פתח את תוכנת ImageJ/Fiji במחשב וגרור את התמונות של מיקרוסקופ קיטועי הזמן של hyperstack לסרגל הטעינה של פיג'י. השתמשו ב-Image > Color >-Make Composite כדי להתיך את הערוצים השונים של ההיפר-ערימה. אם הערוצים של ניסוי קיטועי הזמן אינם תואמים לצבע הרצוי (לדוגמה, ניגודיות הפאזה מוצגת באדום במקום באפור), השתמשו ב-Image > Color > Arrange Channels להחלת הצבע המתאים על הערוצים.
- פתחו את תוסף MicrobeJ וזהו את תאי החיידקים באמצעות ממשק העריכה הידני. מחק את התאים שזוהו באופן אוטומטי ושרטט באופן ידני את התאים המתמידים בעלי תחומי העניין מסגרת אחר מסגרת.
הערה: ניתן להשתמש בהגדרות שונות כדי לזהות תאים בודדים באופן אוטומטי. זיהוי ידני שימש כאן כמו תאים מתמידים מנותחים טופס חוטים ארוכים, אשר לעתים רחוקות מזוהים כראוי באמצעות זיהוי אוטומטי. - לאחר הזיהוי, השתמש בסמל התוצאה בממשק העריכה הידני של MicrobeJ כדי ליצור טבלת ResultJ. שמור את קובץ ResultJ והשתמש בטבלת ResultJ כדי לקבל תובנות לגבי פרמטרים שונים המעניינים את ניתוח התא הבודד. במקרה של פרוטוקול זה, יוצאו הפלואורסצנטיות הממוצעת של עוצמת HU-mCherry, אורך התא ואזור התא של תאים בודדים.
תוצאות
כפי שתואר לעיל, הזנים ששימשו לאנליזה פנוטיפית חד-תאית של תאים מתמידים התאפיינו ב-MOPS גליצרול 0.4% בינוני. הניטור של OD600nm לאורך זמן לא הראה הבדל בין הזנים wt ו-hupA-mCherry (איור 1). זה מצביע על כך שהביטוי של חלבון היתוך HU-mCherry לא השפיע על הצמיחה בתנאים אלה. תאי החיידקים של שני הזנים שחוסנו בתחילה ב-OD600 ננומטר של 0.01 הגיעו לשלב המעריכי ±8 שעות לאחר החיסון.
המיקרופון של OFX נקבע בשיטות סטנדרטיות (כאן, דילול אגר טורי)24. מיקרופון מוגדר כריכוז המינימלי שבו לא מזוהה גידול נראה לעין. המיקרופון של OFX עבור שני הזנים נקבע כ-0.06 מיקרוגרם·מ"ל−1, מה שמצביע על כך שלאיחוי hupA-mCherry לא הייתה השפעה על הרגישות ל-OFX בהשוואה לזן wt איזוגני (איור 2).
בנוסף, קבענו את ההשפעה של טיפול קטלני ב-OFX (פי 83 MIC) על הכדאיות של שני הזנים ששימשו במחקר זה. ככל שספירת התאים בת קיימא יורדת עם הזמן עם חשיפה ל- OFX, יש להתאים את דילול תרביות החיידקים כראוי כדי להגיע ל -30 עד 300 מושבות בכל צלחת. כדי לקבוע את הדילולים המתאימים לאורך זמן, בוצעה בדיקה נקודתית, שבה הונחו 10 μL מ-0 עד 10-7 דילולים סדרתיים פי 10 על צלחות פטרי מרובעות באמצעות פיפטה רב ערוצית. הדילולים המתאימים היו אלה שבהם ניתן היה לראות שיבוטים מבודדים (למשל, ב-t0 = 10−5, t1h = 10−4/10−3, t4h = 10−2/10−1) (איור 3).
בעוד שבדיקת הנקודה היא שיטה קלה להשגת תובנות לגבי הקינטיקה של הרג בתיווך OFX, היא אינה מצליחה לקבוע במדויק את דינמיקת ההרג. כאשר יכולת הקיום של תאים שגדלו באופן מעריכי וטופלו ב-OFX נוטרה על-ידי מבחן ההרג בזמן נצפתה עקומה ביפאזית טיפוסית (איור 4). השיפוע הראשון של העקומה משקף את ההרג המהיר של האוכלוסייה הלא מתמידה. בתנאים שנבדקו כאן, עד 99.9% מהתאים לא היו מסוגלים ליצור מושבות לאחר 3 שעות בנוכחות OFX. השלב הראשון של ההרג מלווה בשלב השני, המראה קצב הרג איטי יותר (קו מקווקו כחול), אשר חושף את נוכחותם של תאים מתמידים עמידים לסמים. בתנאים שנבדקו, השלב המתמיד החל כ-3 שעות לאחר הוספת ה-OFX, מה שמדגיש את הצורך לחשוף את התאים ל-OFX למשך יותר מ-3 שעות כדי לחקור את הפנוטיפים המתמידים. חשוב לציין, עקומת הזמן-הרג מראה שלחלבון ההיתוך hupA-mCherry לא הייתה השפעה על קינטיקה של הרג זמן. הזן המקודד את האיחוי הפלואורסצנטי התרגומי יכול, אם כן, לשמש לניטור התאים המתמידים באמצעות מיקרוסקופ פלואורסצנטי.
בהמשך חקרנו את תופעת ההתמדה ברמת התא הבודד. כדי לעשות זאת, זן hupA-mCherry הוכנס לתוך צלחת microfluidic, אשר אפשרה שינוי של תנאים בינוניים (כאן, צמיחה, טיפול, והתאוששות) תוך ביצוע מיקרוסקופ time-lapse על ROI נתון. במהלך השלב הראשון של הניסוי המיקרופלואידי, התאים שהוכנסו למכשיר המיקרופלואידי היו מחוררים עם מדיום גידול (MOPS גליצרול 0.4%) וחולקו עם זמן דור של ~2 שעות (איור 5 ואיור 6). שלב ראשון זה של צמיחה מצביע על כך שהתאים היו בני קיימא והתחלקו באופן פעיל לפני הטיפול ב- OFX.
לאחר שלב ראשון זה של הגדילה, התאים היו מחוררים עם מדיום גדילה בתוספת 5 מיקרוגרם·מ"ל−1 OFX במשך 6 שעות. ברגע שהאנטיביוטיקה הגיעה לתאים, חלוקת התאים נחסמה (איור 5 ואיור 6). לאחר 6 שעות של טיפול OFX, התאים היו מחוררים עם מדיום טרי. בעוד שהרוב המכריע של התאים לא היו מסוגלים לחדש את הצמיחה (איור 5 ואיור 6), תת-אוכלוסייה קטנה של חיידקים הייתה מסוגלת להאריך ולייצר תאים נימיים25. תאים אלה, שהיו מסוגלים להתחלק ולייצר תאי בת קיימא לאחר הטיפול ב- OFX, יכולים להיות מוגדרים כתאים המתמידים.
מאחר שמערך זה מאפשר הדמיה של התאים המתמידים לפני, במהלך ואחרי הטיפול, הוא לא רק מספק מידע על הפנוטיפ המתמיד במהלך שלב ההחלמה, אלא גם על המצב הפיזיולוגי של התאים המתמידים לפני הטיפול (איור 6). בתנאים שנבדקו, התאים המתמידים התחלקו באופן דומה לתאים שאינם מתמידים לפני הטיפול ב-OFX, מה שמצביע על כך שהתאים המתמידים שנצפו לא הגיעו מתת-אוכלוסייה רדומה (איור 6)25.
ניתוח אורך התא של תאים מתמידים במהלך שלב ההתאוששות גילה כי לכל חוט להט היה קצב התארכות מסוים. אורך התא אליו הגיע כל מתמיד לפני החלוקה הראשונה היה שונה ממתמיד אחד למשנהו. באופן דומה, העיתוי של אירוע הליגה הראשונה היה הטרוגני מאוד (איור 6). חוט הלהט המתמיד המתחלק יצר תאי בת מרובים, שהחלו לגדול ולהתחלק, על פי רוב, בדומה לתאים לא מטופלים (איור 7). החלוקה הרצופה של חוט הלהט הביאה לירידה הדרגתית באורך התא, ובסופו של דבר הולידה תאי בת עם אורך תאים דומה לזה שהיה לפני הטיפול ב-OFX (איור 6 ואיור 7B). הרוב המכריע של התאים לא הצליחו לגרום לנימה לאחר הסרת OFX. אוכלוסיית התאים הגדולה הזו מקבילה לתאים המתים (איור 5 ואיור 6).
ההיתוך הפלואורסצנטי של החלבון HU הקשור לנוקלואידים מאפשר הדמיה של הדינמיקה של הגרעין22. ניתוח עוצמת הפלואורסצנטיות הכוללת של HU-mCherry בתוך התא יכול לשמש כפרוקסי לתכולת ה- DNA22,25. במהלך שלב הצמיחה (לפני טיפול OFX), עוצמת הפלואורסצנטיות הכוללת של mCherry השתנתה, ומשקפת את הדינמיקה של שכפול כרומוזומים והפרדה במהלך מחזור התא (איור 8). לאחר הוספת OFX, פלואורסצנטיות mCherry גדלה במרכז התא, מה שמעיד על דחיסת נוקלאואידים, אשר הוכחה כמושרה על ידי היווצרות של שברי דנ"א דו-גדילי28 (איור 5). שברי DNA דו-גדיליים הם תוצאה של מנגנון הפעולה של OFX, אשר משחית את סוג II topoisomerases DNA-gyrase ו topoisomerase IV29,30. ב- E. coli, DNA-gyrase הוא היעד העיקרי של OFX29,30. על ידי קשירת המטרה בשלב קריטי של מנגנון המעבר הדו-גדילי, OFX מעכב את דחיקתם של גדילי הדנ"א השסעים, מה שמוביל בסופו של דבר לשחרור של שברי DNA דו-גדילי30. כפי שתואר לעיל, התאים המתמידים לטיפול ב-OFX החלו לנשנש במהלך ההתאוששות25 (איור 6). העלייה באורך התא הייתה בקורלציה עם עלייה בעוצמת הפלואורסצנטיות הכוללת של mCherry, אשר משקפת הפעלה מחדש של השכפול ועלייה בשפע הנוקלואידים בחוט הלהט25 (איור 7a ואיור 8). עבור תאים מתים, עוצמת הפלואורסצנטיות הכוללת של mCherry נשארה יציבה במהלך הטיפול ובמהלך שלב ההתאוששות, מה שמצביע על כך שתאים אלה לא היו מסוגלים לשכפל את הכרומוזומים שלהם לאחר הסרת OFX (איור 8). וידאו מיקרופלואידי (וידאו 1) של תאי E. coli HU-mCherry לפני, במהלך ואחרי טיפול ofloxacin מוצג גם.
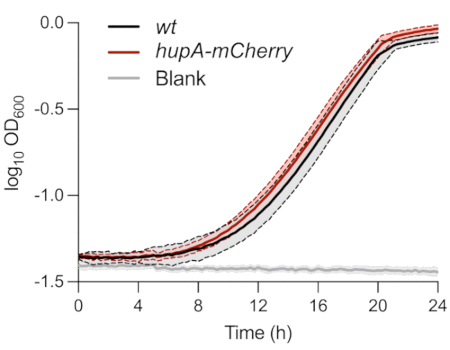
איור 1: ניטור גדילה של זני wt ו-hupA-mCherry E. coli. ניטור צפיפות אופטית (OD600 ננומטר) של wt (שחור) ו- hupA-mCherry (אדום). הגוונים והקווים המקווקווים מציינים את סטיות התקן של הטריפליקטים הביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
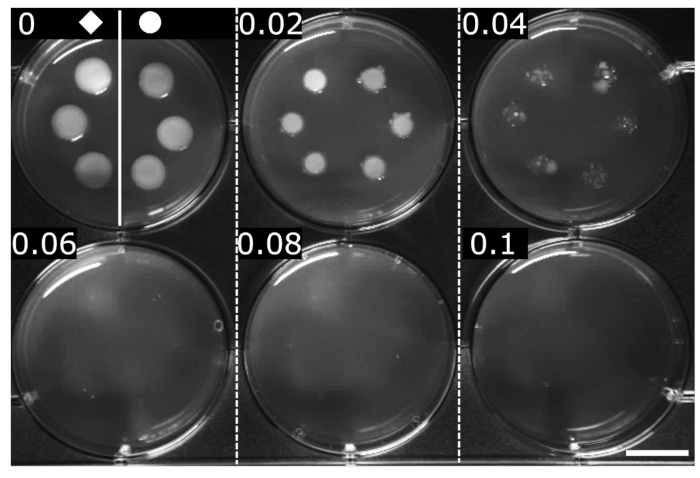
איור 2: קביעת המיקרופון של OFX עבור הזנים wt ו-hupA-mCherry E. coli. wt () ו- hupA-mCherry (●) גודלו בתווך LB, ו- 2 μL זוהו על דילולים סדרתיים של אגר LB המכיל OFX (♦ ריכוז מצוין בכל פאנל ב- μg·mL−1). עיכוב גדילה נראה במינימום של 0.06 מיקרוגרם ·מ"ל−1. האיור הוא ניסוי מייצג של טריפליקטים ביולוגיים. סרגל קנה מידה = 1 ס"מ. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
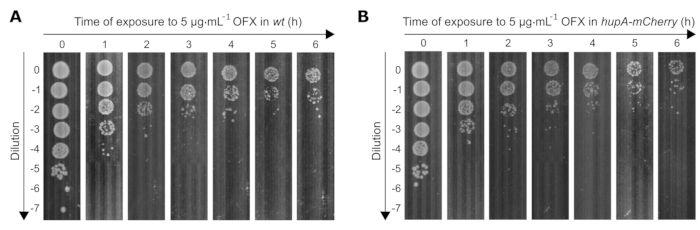
איור 3: בדיקה נקודתית של זני wt ו-hupA-mCherry E. coli לאחר חשיפה ל-OFX. הזנים (A) wt ו-(B) hupA-mCherry גודלו בגליצרול MOPS 0.4% כמתואר בפרוטוקול (סעיף 3), והתאים שגדלו באופן מעריכי (OD600 ננומטר = 0.3) טופלו ב-5 מיקרוגרם·מ"ל−1 OFX. T0 מתאים לנקודת הזמן שלפני הוספת OFX. T1, T2, T3, T4, T5 ו- T6 מתאימים ל- 1-6 שעות לאחר הוספת OFX. האיור הוא ניסוי מייצג של טריפליקטים ביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
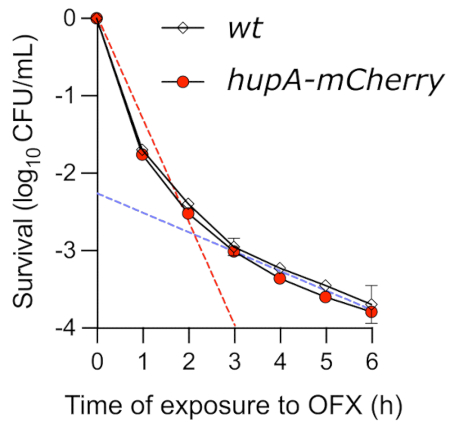
איור 4: בדיקת Time Kill של זני wt ו-hupA-mCherry E. coli לאחר חשיפה ל-OFX. הזנים wt () ו-hupA-mCherry (●) גודלו בגליצרול MOPS 0.4% כמתואר בפרוטוקול (סעיף 4), והתאים שגדלו באופן מעריכי (♦ OD600 ננומטר = 0.3) טופלו ב-5 מיקרוגרם·מ"ל−1 OFX. הקווים המקווקווים מציינים את שלב ההרג ה"מהיר" (אדום) הראשון ואת שלב ההרג השני "האיטי" (כחול), המתאים לתת-אוכלוסיות רגישות ומתמשכות (המתקבלות על ידי רגרסיה ליניארית בין T0 ו-T2, כמו גם בין T3 ל-T6, בהתאמה). פסי השגיאה מציינים את סטיות התקן של הטריפליקטים הביולוגיים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
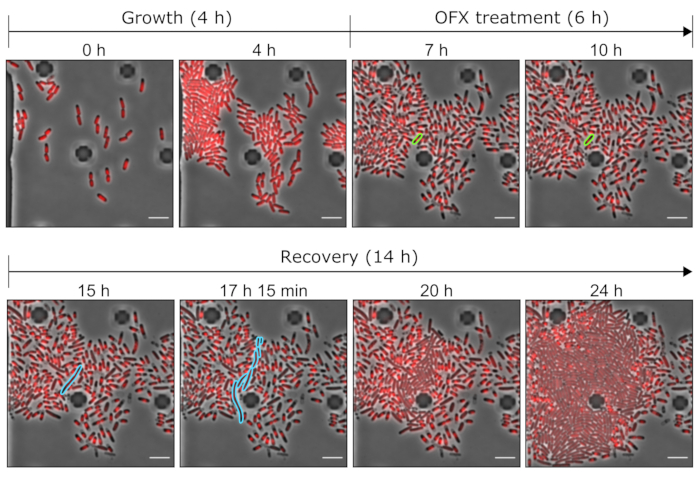
איור 5: תמונות מייצגות של תאים מתמידים ומתים של OFX באמצעות כלים מיקרופלואידים. תמונות מיקרוסקופיות מייצגות המציגות את נקודות הזמן הרלוונטיות של הניסוי המיקרופלואידי שבוצע עם זן hupA-mCherry (ניגודיות פאזה באפור, אות HU-mCherry באדום). התאים המבטאים את hupA-mCherry המתויג גודלו בצלחת מיקרופלואידית (כאן, 4 שעות), ואחריה אתגר OFX (5 מיקרוגרם·מ"ל−1). לאחר 6 שעות בנוכחות OFX, התאים היו מחוררים עם תווך טרי, המאפשר לתאים המתמידים להתאושש. התא המתמיד ותאי צאצאיו במהלך הטיפול ב-OFX ולאחר הסרת OFX מודגשים בירוק ובכחול, בהתאמה. נקודות הזמן המתאימות מצוינות בכל חלונית. סרגל קנה מידה = 5 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
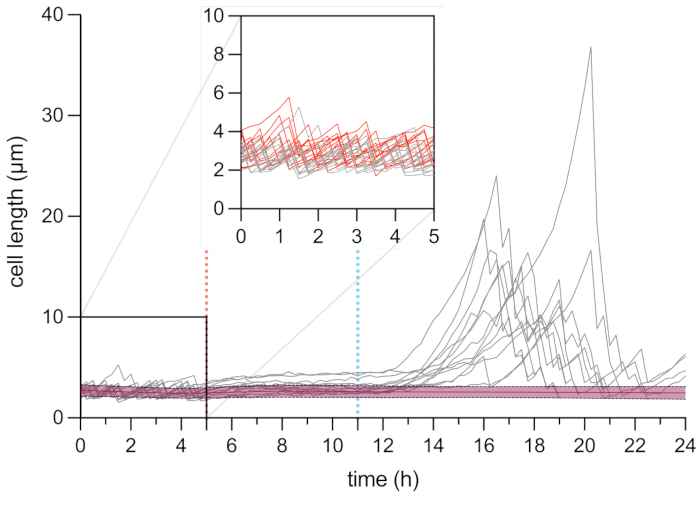
איור 6: ניתוח מיקרוסקופיה בהילוך מהיר של אורך התאים המתמידים והמתים. ניתוח אורך תאים של תאים מתים (באדום, n = 109) ותאים מתמידים (באפור, n = 13). תחילת הטיפול ב-OFX (5 מיקרוגרם·מ"ל−1) מסומנת על ידי הקו המקווקו האדום (5 שעות), והסרת ה-OFX מסומנת על ידי הקו המקווקו הכחול. הכניסה מתאימה לשלב הצמיחה לפני הוספת OFX. הניסויים בוצעו בשיטת טריפליקט. הגוונים והקווים המקווקווים מציינים את סטיות התקן של אוכלוסיית התאים המתים (n = 109). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
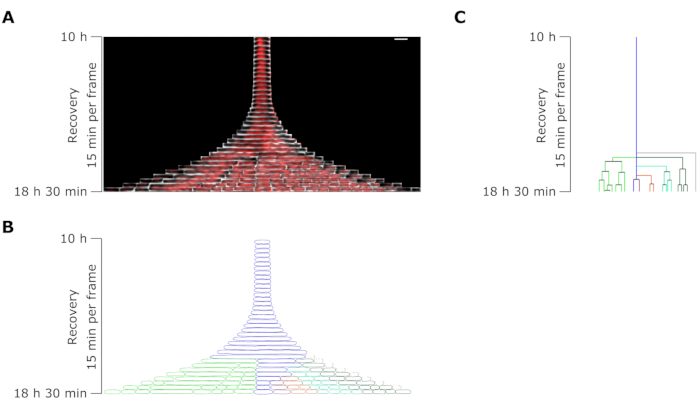
איור 7: ניתוח מיקרוסקופיה בהילוך מהיר של מתמיד מייצג ל-OFX. (A) קימוגרף של מתמיד OFX מייצג ותאי הבת שלו שנוצרו על ידי חלוקות נימה במהלך 8.5 שעות לאחר הסרת OFX (18.5 שעות לאחר תחילת הניסוי המיקרופלואידי, הכולל 4 שעות של צמיחה, 6 שעות של 5 מיקרוגרם·מ"ל−1 טיפול OFX, ו-8.5 שעות התאוששות לאחר הסרת OFX). פריים אחד מתאים ל-15 דקות. סרגל קנה מידה = 5 מיקרומטר. (B) מסיכה הנוצרת מהקימוגרף המתמיד ב-A. התא המתמיד המנוטר מסומן בקו מתאר כחול, ותאי הבת מודגשים בצבעים שונים. (C) ייצוג סכמטי של שושלת התאים המתמידים הנוצרת מ-B. קידוד הצבע זהה ל-B. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
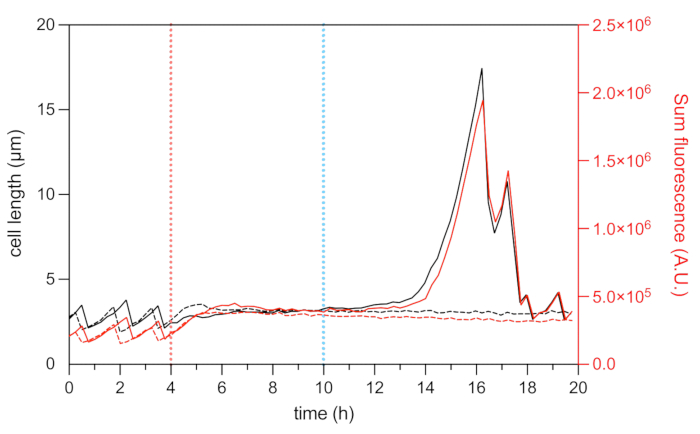
איור 8: אורך התא וניתוח פלואורסצנטי mCherry של תאים מתמידים ומתים מייצגים. ניתוח אורך התא (ציר שמאלי) ועוצמת הפלואורסצנטיות הכוללת של HU-mCherry (ציר ימין, מוצג ביחידות שרירותיות) של מתמיד מייצג (קווים שחורים ואדומים מוצקים) ותא מת מייצג (קו שחור ואדום מקווקו) במהלך ניסוי קיטועי הזמן המיקרופלואידים. תחילת הטיפול ב-OFX (5 מיקרוגרם·מ"ל−1) מסומנת על ידי הקו המקווקו האדום, והסרת ה-OFX על ידי הקו המקווקו הכחול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
וידאו 1: וידאו מיקרופלואידי של תאי E. coli HU-mCherry לפני, במהלך ואחרי טיפול ofloxacin. הדמיה מיקרופלואידית בהילוך מהיר המראה תאי HU-mCherry. התאים גודלו במשך 4 שעות בגליצרול MOPS 0.4%. לאחר 6 שעות של טיפול ב-OFX (5 מיקרוגרם·מ"ל−1), התווך נטול האנטיביוטיקה נוקב בצלחת המיקרופלואידית כדי לאפשר לתאים המתמידים להתאושש. סרגל קנה מידה = 5 מיקרומטר. הזמן (בדקה) מצוין. שלבי הצמיחה וההתאוששות מסומנים על ידי "MOPS- Gly. 0.4%" וטיפול OFX על ידי "OFX 5 מיקרוגרם / מ"ל". אנא לחץ כאן כדי להוריד סרטון זה.
| 10x MOPS | |||
| פתרון מלאי | נפח של פתרון מלאי עבור 1 L של 10x MOPS | ריכוז סופי בבסיס MOPS 10x | |
| MOPS חומצה | 1 M (מותאם ל- pH 7.4 באמצעות KOH) | 400 מ"ל | 0.4 מטר |
| טריצין | 1 M (מותאם ל- pH 7.4 באמצעות KOH) | 40 מ"ל | 0.04 מטר |
| FeSO4.7H2O | 0.01 מטר | 10 מ"ל | 0.0001 מ' |
| NH4Cl | 1.9 מ' | 50 מ"ל | 0.095 מ' |
| יא2SO4 | 0.276 מ' | 10 מ"ל | 0.00276 מ' |
| CaCl 2.2H2 O | 0.0005 מטר | 10 מ"ל | 0.000005 מטר |
| MgCl 2.6H2O | 0.528 מ' | 10 מ"ל | 0.00528 מ' |
| NaCl | יש להוסיף ישירות 29.2 גרם | 0.5 מטר | |
| מים מזוקקים | 460 מ"ל | ||
| מיקרונוטריאנטים 1000x (ראו טבלה 2) | 10 מ"ל | ||
טבלה 1: הרכב של 10x MOPS.
| מיקרונוטריאנטים 1000x | ||
| ריכוז בתמיסת מלאי Micronutriments 1000x | ריכוז סופי בבסיס MOPS 10x | |
| (NH4)6Mo7O24.4H2O | 0.000003 מטר | 0.00000003 מטר |
| ח 3בו3 | 0.0004 מטר | 0.000004 מטר |
| CoCl 2.6H2 O | 0.00003 מטר | 0.0000003 מטר |
| CuSO4.5H 2O | 0.00001 מ' | 0.0000001 מטר |
| MnCl 2.4H2 O | 0.00008 מ' | 0.0000008 מטר |
| ZnSO.7H2O | 0.00001 מ' | 0.0000001מ' |
טבלה 2: הרכב של 1,000x micronutrients.
| MOPS גלוקוז 0.4% או MOPS גליצרול 0.4% | |||
| פתרון מלאי | נפח עבור 1 L MOPS גלוקוז 0.4% או MOPS גליצרול 0.4% | ריכוז סופי ב-MOPS גלוקוז 0.4% או MOPS גליצרל 0.4% | |
| 10x MOPS | ראו טבלה 1 | 100 מ"ל | |
| K2HPO4 | 0.132 מ' | 10 מ"ל | 0.00132 מ' |
| גלוקוז (עבור MOPS גלוקוז 0.4%) | 20% (20 גרם ב-100 מ"ל מים מזוקקים) | 20 מ"ל | 0.40% |
| גליצרול (עבור MOPS גליצרול 0.4%) | ≤99% | 4 מ"ל | 0.40% |
| מים מזוקקים | 870 מ"ל עבור MOPS גלוקוז 0.4% או 886 מ"ל עבור MOPS גליצרול 0.4% | ||
טבלה 3: הרכב MOPS גלוקוז 0.4% ו MOPS גליצרול 0.4%.
Discussion
הפרוטוקול המוצג במאמר זה מאפשר ניתוח של פנוטיפ ההתמדה שנצפה בתגובה לטיפול אנטיביוטי באוכלוסייה וברמת התא הבודד. הניסויים בוצעו עם זן E. coli MG1655, אשר גדל בתווך מוגדר כימית (MOPS גליצרול 0.4%). מבחני הרג בזמן וניסויים במיקרוסקופ בוצעו על תרביות פאזה מעריכית. השתמשנו ב-OFX, פלואורוקינולון, בריכוז של 5 מיקרוגרם·מ"ל−1 כדי לחשוף את התאים המתמידים. הגישות המתוארות כאן יכולות להיות מיושמות על אנטיביוטיקה חיידקית אחרת, כגון β-lactams, aminoglycosides, או תרכובות מיקרוביאליות31. בהתאם לכך, ניתן להשתמש בזני חיידקים אחרים, מדיה או תנאי גידול. ניטור איחוי פלואורסצנטי שונה במערך דומה לזה המתואר כאן יכול להיות שימושי למעקב אחר תהליכים תאיים כגון שכפול דנ"א32, תיקון דנ"א25,33 וחלוקת תאים34 לפני, במהלך ואחרי הטיפול האנטיביוטי. באופן דומה, ניתן לנצל כתבים פלואורסצנטיים כדי לחקור היבטים שונים של פיזיולוגיה של התא, כגון רמות pH 35, ATP36 או ROS37. לחלופין לאיחוי פלואורסצנטי, ניתן ליישם גם צבעים כימיים. לדוגמה, היתוך hupA-mCherry יכול להיות מוחלף על ידי 4',6-diamidino-2-phenylindole (DAPI), צבע פלואורסצנטי שמכתים DNA38. עם זאת, יש להימנע מביצוע מיקרוסקופ בהילוך מהיר בשילוב עם צבעים פלואורסצנטיים כאלה, מכיוון שטכניקות צביעה אלה יכולות להפריע לדינמיקה של מחזור התא במהלך ניסויים בהילוך מהיר. לחלופין, ניסויים כאלה יכולים להיות מוחלפים על ידי ניתוח מסלול זמן של הדמיית בזק בנקודות זמן רלוונטיות.
בעוד שכתבים פלואורסצנטיים כאלה מועילים, אין להזניח את כמות המידע שניתן לחלץ באמצעות ניתוח תמונות עם ניגודיות פאזה. כאן, עקבנו אחר התפתחות אורך התא לאורך שלבי הגדילה, הטיפול ב-OFX וההתאוששות. פרמטרים אחרים המבוססים על תמונות עם ניגודיות פאזה, כגון רוחב התא, עוצמת ניגודיות הפאזה והעקמומיות של תאי החיידקים, יכולים גם הם להיות מופקים בקלות באמצעות תוכנה מתאימה, כגון MicrobeJ27.
לסיכום, ההליך המתואר כאן יכול להיות מיושם על תנאים אחרים ומיני חיידקים כדי לנטר תגובות תאיות לסביבות משתנות או גורמי עקה18,19. על ידי שימוש בכתבים פלואורסצנטיים אחרים (כתבי תמלול ותרגום, צבע כימי) בשילוב עם ניתוח אוכלוסייה, כגון ציטומטריית זרימה / FACS, ניתן להתייחס לשאלות מעניינות במסגרת רב-ממדית.
Disclosures
המחברים מצהירים כי אין אינטרסים מתחרים.
Acknowledgements
העבודה במעבדת ואן מלדרן נתמכת על ידי פעולות ARC 2018-2023, Fonds National de la Recherche Scientifique (FNRS CDR J.0182.21F). T.O. נתמך על ידי מלגת ULB. T.S. נתמכת על ידי מלגת FRIA (FNRS). J.C. נתמך על ידי מלגת פוסט-דוקטורט "chargé de recherches" (FNRS).
Materials
| Name | Company | Catalog Number | Comments |
| Axio Observer | Zeiss | Inverted fluorescence microscope | |
| CaCl2.2H2O | Merck | 1.02382.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CellASIC ONIX Microfluidic System | Merck | CAX2-S0000 | Microfluidic system |
| CellASIC ONIX2 FG | Merck | ONIX2 1.0.1 | Microfluidic software |
| CellASIC ONIX2 Manifold Basic | Merck | CAX2-MBC20 | Manifold system |
| CoCl2.6H2O | Merck | 1.02539.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| CuSO4.5H2O | Merck | 1.02790.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| D-(+)-glucose | Sigma Aldrich | G7021-1KG | Carbon source for MOPS glucose 0.4% growth medium |
| E. coli K-12 MG1655 CF1648 (fnr+) | BE10 | wt reference strain, lab strain | |
| E. coli K-12 MG1655 CF1648 (fnr+) hupA-mCherry::FRT-kan-FRT | BE16 | HU-mCherry fusion integrated via P1 transduction at the native locus, lab strain | |
| FeSO4.7H2O | VWR Chemicals | 24244.232 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Fiji | ImageJ | https://fiji.sc/ | Image software; Schindelin et al. if used in publication |
| Glycerol | Merck | 56815 | Carbon source for MOPS glycerol 0.4% growth medium |
| Greiner CELLSTAR® multiwell culture plate | Merck | M8812-100EA | 24-well clear flat bottom 2ml volume culture plate for automated plate reader |
| H3BO3 | Sigma-Aldrich | B6768-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Hamamatsu ORCA Flash 4.0 digital camera | Hamamatsu | C13440-20CU | Digital Image Acqusition |
| K2HPO4 | Merck | 1.05099.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| KOH | Merck | 1.05029.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| K2SO4 | Merck | 1.05153.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Luria-Broth agar medium | Invitrogen | 22700041 | Growth medium for plating assay |
| Luria-Broth medium | Invitrogen | 12780029 | Growth medium for MIC determination |
| MgCl2.6H2O | Merck | 1.05832.1000 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MgSO4 | Merck | 7487-88-9 | Dilution solution for bacterial survival assay used at 10mM |
| MicrobeJ | Imagej/Fiji plugin | https://www.microbej.com/ | Microscopy image analysis plugin. Ducret et al.for in publication; Detection settings: For bacteria : Area (μm2): 0,1-max; Length (μm): 0,5-max; Width (μm): 0,6-max; Range (μm): 0,5-max; Angularity (rad): 0-0,3; 0-max for all other parameters. |
| Microfluidic Plates CellASIC ONIX | Merck | B04A-03-5PK | Plate for microfluidic system |
| MnCl2.4H2O | Merck | 1.05927.0100 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| MOPS, Free Acid ULTROL® Grade | Merck | 475898-500GM | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NaCl | SIgma-Aldrich | S5886-1KG | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| (NH4)6Mo7O24.4H2O | Merck | 1.01180.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| NH4Cl | Merck | 1.01145.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Ofloxacin | Merck | 82419-36-1 | Fluoroquinolone antibiotic used to treat the bacterial cells |
| Phosphate Buffered Saline (PBS) pH 7.4, 1x | Merck | P3813 | Dilution buffer |
| GENESYS 10S UV-Visible Spectrophotometer | Thermofisher Scientific | 840-208200 | UV-Visible Spectrophotometer, Single/Six Cell Holder with PrinterMeasurement of optical density OD600nm |
| SoftMax Pro | Molecular Devices | Microplate reader software | |
| SpectraMax i3x | Molecular Devices | Microplate reader | |
| N-[Tris(hydroxyméthyl)-méthyl]-glycine | Merck | 1.08602.0250 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
| Zeiss® immersion Oil 518F | Zeiss | Immersion oil to increase resolution of microscope | |
| Zen3.2 Pro | Zeiss | Microscopic image acquisition and processing software | |
| ZnSO4.7H2O | Merck | 1.08883.0500 | For MOPS glucose 0.4% and MOPS glycerol 0.4% growth medium |
References
- Balaban, N. Q., et al. Definitions and guidelines for research on antibiotic persistence. Nature Reviews Microbiology. 17 (7), 441-448 (2019).
- Brauner, A., Fridman, O., Gefen, O., Balaban, N. Q. Distinguishing between resistance, tolerance and persistence to antibiotic treatment. Nature Reviews Microbiology. 14 (5), 320-330 (2016).
- Pribis, J. P., Zhai, Y., Hastings, P. J., Rosenberg, S. M. Stress-induced mutagenesis, gambler cells, and stealth targeting antibiotic-induced evolution. mBio. 13 (3), 01074 (2022).
- Molina-Quiroz, R. C., Lazinski, D. W., Camilli, A., Levy, S. B. Transposon-sequencing analysis unveils novel genes involved in the generation of persister cells in uropathogenic Escherichia coli. Antimicrobial Agents and Chemotherapy. 60 (11), 6907-6910 (2016).
- Cameron, D. R., Shan, Y., Zalis, E. A., Isabella, V., Lewis, K. A genetic determinant of persister cell formation in bacterial pathogens. Journal of Bacteriology. 200 (17), 00303-00318 (2018).
- Cui, P., et al. Identification of genes involved in bacteriostatic antibiotic-induced persister formation. Frontiers in Microbiology. 9, 413 (2018).
- Li, T., et al. Identification of novel genes involved in Escherichia coli persistence to tosufloxacin. Frontiers in Cellular and Infection Microbiology. 10, 581986 (2020).
- Verstraeten, N., et al. Obg and membrane depolarization are part of a microbial bet-hedging strategy that leads to antibiotic tolerance. Molecular Cell. 59 (1), 9-21 (2015).
- Hofsteenge, N., van Nimwegen, E., Silander, O. K. Quantitative analysis of persister fractions suggests different mechanisms of formation among environmental isolates of E. coli. BMC Microbiology. 13 (1), 25 (2013).
- Huemer, M., Mairpady Shambat, S., Brugger, S. D., Zinkernagel, A. S. Antibiotic resistance and persistence-Implications for human health and treatment perspectives. EMBO Reports. 21 (12), 51034 (2020).
- Wilmaerts, D., Windels, E. M., Verstraeten, N., Michiels, J. General mechanisms leading to persister formation and awakening. Trends in Genetics. 35 (6), 401-411 (2019).
- Murawski, A. M., Brynildsen, M. P. Ploidy is an important determinant of fluoroquinolone persister survival. Current Biology. 31 (10), 2039-2050 (2021).
- Lemma, A. S., Soto-Echevarria, N., Brynildsen, M. P. Fluoroquinolone persistence in Escherichia coli requires DNA repair despite differing between starving populations. Microorganisms. 10 (2), 286 (2022).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305 (5690), 1622-1625 (2004).
- Morawska, L. P., Kuipers, O. P. Antibiotic tolerance in environmentally stressed Bacillus subtilis: Physical barriers and induction of a viable but nonculturable state. microLife. 3, (2022).
- Windels, E. M., et al. Enrichment of persisters enabled by a ß-lactam-induced filamentation method reveals their stochastic single-cell awakening. Communications Biology. 2 (1), 426 (2019).
- Leygeber, M., et al. Analyzing microbial population heterogeneity-Expanding the toolbox of microfluidic single-cell cultivations. Journal of Molecular Biology. 431 (23), 4569-4588 (2019).
- Rojas, E., Theriot, J. A., Huang, K. C. Response of Escherichia coli growth rate to osmotic shock. Proceedings of the National Academy of Sciences of the United States of America. 111 (21), 7807-7812 (2014).
- Shi, H., et al. Starvation induces shrinkage of the bacterial cytoplasm. Proceedings of the National Academy of Sciences of the United States of America. 118 (24), 2104686118 (2021).
- Goode, O., et al. Persister Escherichia coli cells have a lower intracellular pH than susceptible cells but maintain their pH in response to antibiotic treatment. mBio. 12 (4), 00909-00921 (2021).
- Manuse, S., et al. Bacterial persisters are a stochastically formed subpopulation of low-energy cells. PLoS Biology. 19 (4), 3001194 (2021).
- Fisher, J. K., et al. Four-dimensional imaging of E. coli nucleoid organization and dynamics in living cells. Cell. 153 (4), 882-895 (2013).
- Cabral, D., Wurster, J., Belenky, P. Antibiotic persistence as a metabolic adaptation: Stress, metabolism, the host, and new directions. Pharmaceuticals. 11 (1), 14 (2018).
- Wiegand, I., Hilpert, K., Hancock, R. E. W. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2), 163-175 (2008).
- Goormaghtigh, F., Van Melderen, L. Single-cell imaging and characterization of Escherichia coli persister cells to ofloxacin in exponential cultures. Science Advances. 5 (6), (2019).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Ducret, A., Quardokus, E. M., Brun, Y. V. MicrobeJ, a tool for high throughput bacterial cell detection and quantitative analysis. Nature Microbiology. 1 (7), 16077 (2016).
- Odsbu, I., Skarstad, K. DNA compaction in the early part of the SOS response is dependent on RecN and RecA. Microbiology. 160 (5), 872-882 (2014).
- Pham, T. D. M., Ziora, Z. M., Blaskovich, M. A. T. Quinolone antibiotics. MedChemComm. 10 (10), 1719-1739 (2019).
- Drlica, K., et al. Quinolones: Action and resistance updated. Current Topics in Medicinal Chemistry. 9 (11), 981-998 (2009).
- Kohanski, M. A., Dwyer, D. J., Collins, J. J. How antibiotics kill bacteria: From targets to networks. Nature Reviews Microbiology. 8 (6), 423-435 (2010).
- Reyes-Lamothe, R., Sherratt, D. J., Leake, M. C. Stoichiometry and architecture of active DNA replication machinery in Escherichia coli. Science. 328 (5977), 498-501 (2010).
- Lesterlin, C., Ball, G., Schermelleh, L., Sherratt, D. J. RecA bundles mediate homology pairing between distant sisters during DNA break repair. Nature. 506 (7487), 249-253 (2014).
- Alexeeva, S., Gadella, T. W. J., Verheul, J., Verhoeven, G. S., Den Blaauwen, T. Direct interactions of early and late assembling division proteins in Escherichia coli cells resolved by FRET: Bacterial division studied by spectral FRET. Molecular Microbiology. 77 (2), 384-398 (2010).
- Miesenböck, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Yaginuma, H., et al. Diversity in ATP concentrations in a single bacterial cell population revealed by quantitative single-cell imaging. Scientific Reports. 4, 6522 (2014).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5, 5222 (2014).
- Kapuscinski, J. DAPI: A DNA-specific fluorescent probe. Biotechnic & Histochemistry. 70 (5), 220-233 (1995).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved