A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
الكشف عن بروتين البريون غير الطبيعي بواسطة الكيمياء الهيستولوجية المناعية
In This Article
Summary
يتطلب وضع العلامات المناعية لبروتين البريون غير الطبيعي باستخدام بروتوكولات الكيمياء الهيستولوجية المناعية عينة محددة ومنهجيات تحضير الأجسام المضادة المضادة ل PrP. يصف هذا البروتوكول الخطوات الرئيسية في إزالة الخاتمة لضمان وضع العلامات المناعية المناسبة ل PrP وتقليل تلطيخ الخلفية غير المحدد. أيضا ، يأخذ هذا النهج في الاعتبار تدابير السلامة الحيوية عند إجراء دراسات الكيمياء الهيستولوجية المناعية مع الأنسجة المصابة بالبريون.
Abstract
بروتينات البريون غير الطبيعية (PrPSc) هي الشكل المتماثل المرتبط بالمرض لبروتين البريون الخلوي والعلامات التشخيصية لاعتلال الدماغ الإسفنجي القابل للانتقال (TSEs). تؤثر هذه الأمراض التنكسية العصبية على البشر والعديد من الأنواع الحيوانية وتشمل السكراب ، والاعتلال الدماغي الإسفنجي البقري الحيواني المنشأ (BSE) ، ومرض الهزال المزمن لعنق الرحم (CWD) ، ومرض بريون الإبل (CPD) الذي تم تحديده حديثا. يعتمد تشخيص TSEs على الكشف المناعي عن PrPSc عن طريق تطبيق كل من الكيمياء الهيستولوجية المناعية (IHC) وطرق اللطخة المناعية الغربية (WB) على أنسجة الدماغ ، أي جذع الدماغ (مستوى obex). IHC هي طريقة مستخدمة على نطاق واسع تستخدم الأجسام المضادة الأولية (وحيدة النسيلة أو متعددة النسيلة) ضد المستضدات ذات الأهمية في خلايا قسم الأنسجة. يمكن تصور ارتباط الجسم المضاد ومولد الضد من خلال تفاعل اللون الذي يظل موضعيا في منطقة النسيج أو الخلية حيث تم استهداف الجسم المضاد. على هذا النحو ، في أمراض البريون ، كما هو الحال في مجالات البحث الأخرى ، لا تستخدم تقنيات الكيمياء الهيستولوجية المناعية فقط لأغراض التشخيص ولكن أيضا في دراسات الإمراض. تتضمن هذه الدراسات الكشف عن أنماط وأنواع PrPSc من تلك الموصوفة سابقا لتحديد سلالات البريون الجديدة. نظرا لأن مرض جنون البقر يمكن أن يصيب البشر ، يوصى باستخدام مرافق و / أو ممارسات مختبر السلامة الأحيائية من المستوى 3 (BSL-3) للتعامل مع الماشية والمجترات الصغيرة وعينات عنق الرحم المدرجة في مراقبة TSE. بالإضافة إلى ذلك ، يوصى باستخدام معدات الاحتواء والمعدات المخصصة للبريون ، كلما أمكن ذلك ، للحد من التلوث. يتكون إجراء PrPSc IHC من خطوة إزالة حامض الفورميك التي تعمل أيضا كإجراء لتعطيل البريون ، حيث تظل الأنسجة المثبتة بالفورمالين والأنسجة المضمنة بالبارافين المستخدمة في هذه التقنية معدية. عند تفسير النتائج ، يجب توخي الحذر للتمييز بين العلامات المناعية غير المحددة ووضع العلامات المستهدفة. لهذا الغرض ، من المهم التعرف على القطع الأثرية الخاصة بوضع العلامات المناعية التي تم الحصول عليها في التحكم السلبية المعروفة في TSE للتمييز بين تلك الأنواع المحددة من الملصقات المناعية PrPSc ، والتي يمكن أن تختلف بين سلالات TSE والأنواع المضيفة والنمط الجيني prnp ، الموصوف بمزيد من التفصيل هنا.
Introduction
وفقا لفرضية البريون ، فإن الشكل المتماثل غير الطبيعي (PrPSc) هو المكون الأساسي أو الوحيد للعامل المعدي في اعتلالات الدماغ الإسفنجية القابلة للانتقال (TSEs). يعتمد تأكيد تشخيص TSE على الكشف المناعي عن PrPSc عن طريق تطبيق بروتوكولات الكيمياء الهيستولوجية المناعية (IHC) و / أو طرق اللطخة المناعية الغربية (WB) لأنسجة الدماغ1.
IHC هي طريقة تستخدم الأجسام المضادة وحيدة النسيلة أو ، في بعض الحالات ، الأجسام المضادة متعددة النسيلة (كأجسام مضادة أولية) كخطوة أولى في التلوين المناعي للمستضدات المستهدفة على وجه التحديد ذات الأهمية الموجودة في خلايا قسم الأنسجة. ثم يتم تصور أي ارتباط فعال بين الأجسام المضادة ومولد الضد الأولي باستخدام الأجسام المضادة الثانوية الخاصة بالأجسام المضادة الأولية. يتم اقتران هذه الأجسام المضادة الثانوية بالإنزيمات ، مثل بيروكسيديز الفجل (HRP) أو الفوسفاتيز القلوي (AP). ثم يتم تحقيق التصور عن طريق إضافة ركيزة إلى هذه الإنزيمات ، مما ينتج عنه منتجات ملونة غير قابلة للذوبان موضعية في المناطق التي ترتبط فيها الأجسام المضادة الأولية بالمستضدات المستهدفة. يمكن تحقيق التصور المحسن عن طريق التلوين المضاد ، حيث يتم استخدام صبغة لخلق تباين بين الأنسجة المناعية وغير المناعية2.
مع استخدام IHC للأنسجة المدمجة في البارافين المثبتة بالفورمالين (FFPE) ، يمكن أن يؤدي تثبيت الفورمالين إلى إبطال فعالية الأجسام المضادة الأولية بسبب الارتباط المتقاطع بواسطة الفورمالديهايد والتسخين والجفاف أثناء تضمين البارافين. هذه تغير شكل البروتينات ، وتدمير ، أو تغيير طبيعة ، أو إخفاء الحواتم ، وبالتالي تقليل أو إلغاء اكتشافها3. على هذا النحو ، يتطلب هذا استرجاع المستضد (AR). تعمل تقنيات AR على تعطيل الربط المتقاطع للمجموعة الكيميائية المرتبطة بالفورمالديهايد في جزيئات المستضد ، وبالتالي استعادة أو كشف التشكل الأصلي لبروتين المستضد. ينتج عن هذا استعادة تقارب الأجسام المضادة للمستضد (epitope) لوضع العلامات المناعية. تعتمد الفعالية النهائية للواقع المعزز على صفات المستضد المستهدف و / أو الجسم المضاد الأساسي2.
استرجاع المستضد المستحث بالحرارة (HIER) هو أحد إجراءات AR3 ويستخدم بشكل روتيني للكشف عن PrPSc IHC ، كما هو موضح هنا. IHC ضروري للتشخيص ويستخدم في مختبرات الأبحاث لتحديد توزيع الأنسجة للمستضد المرتبط بالأمراض. يستخدم على نطاق واسع في تشخيص وبحث السرطان وعلم الأعصاب والأمراض المعدية4 ، من بين أمور أخرى. بالنسبة ل TSEs ، تلعب IHC دورا مهما في التشخيص والبحث لتأكيد والتحقيق في توزيع PrPSc في المضيفات الطبيعية والنماذج التجريبية. يساهم IHC في دراسات التسبب في البريون وتحليل أنواع وأنماط ترسب PrPSc ، وتحديدا في الأنسجة العصبية5 ، للكشف عن الانحرافات عن العدوى الموصوفة بشكل روتيني وتحديد سلالات البريون الجديدة المفترضة.
نظرا لأن بريونات الاعتلال الدماغي الإسفنجي البقري (BSE) يمكن أن تصيب البشر ، فقد تتطلب بعض البروتوكولات المختبرية المشاركة في العمل مع مرض جنون البقر استخدام مرافق وممارسات BSL-36. ويشمل ذلك استخدام حاوية ثانوية محكمة الغلق لنقل عينات الأنسجة المصابة بمرض جنون البقر المحتملة داخل المعهد والمختبر. ويشمل أيضا تخصيص مناطق احتواء ومعدات مخصصة للبريون لأبحاث وتحليل مرض جنون البقر كلما أمكن ذلك. يتم ذلك لمنع التلوث خارج منطقة العمل وتوفير مساحة ضيقة حيث تصبح إجراءات إزالة التلوث ضرورية.
وبناء على ذلك، يتبع مختبر علم الأمراض التابع للمعهد الدولي لبحوث الأحياء مرافق وممارسات السلامة الأحيائية-3 (BSL-3) الموصى بها6 لإدارة عينات الأنسجة المحتملة المصابة بالبريون من الماشية والمجترات الصغيرة وعنق الرحم المرتبطة بمراقبة مرض التهاب الدماغ المؤقت.
يمكن أن تكون الأنسجة المثبتة بالفورمالين والأنسجة المضمنة في البارافين المدرجة في إجراءات التشخيص أو البحث في TSE ، خاصة في الجهاز العصبي المركزي ، معدية. وبالتالي ، يجب معالجة هذه الأنسجة الثابتة بحمض الفورميك لتقليل عدوى البريونات ، إن وجدت ، قبل معالجة الأنسجة. يتم تنفيذ ذلك عن طريق وضع أنسجة ثابتة ومشذبة (سمك 2-4 مم تقريبا) في شريط معالجة. ثم يتم غمر الكاسيت في 98٪ حمض الفورميك (لمدة 1 ساعة). بعد الغمر ، يتم غسل الكاسيتات بالأنسجة في ماء الصنبور الجاري لمدة 30 دقيقة ، وإعادتها إلى المثبت قبل المعالجة الإضافية. إذا لم تتم معالجة أقسام الأنسجة قبل المعالجة ، فيجب غمر أقسام الأنسجة بعد المجهرية في حمض الفورميك غير المخفف لمدة 5 دقائق على الأقل قبل تلطيخ الأنسجة7. يتضمن بروتوكول IHC ل PrPSc خطوة روتينية لإزالة حامض الفورميك ، تعمل أيضا على تعطيل البريونات7. بعد خطوات تعطيل البريون هذه ، يمكن بعد ذلك معالجة الأنسجة الثابتة الناتجة في BSL-2 باستخدام ممارسات BSL-2 القياسية.
الحد الأدنى من متطلبات أخذ عينات الأنسجة لتشخيص TSE في أي مدرج في مراقبة TSE هو جمع جذع الدماغ (على مستوى obex). بالإضافة إلى ذلك ، للكشف عن مرض جنون البقر غير النمطي والسكرابي ، ينصح أيضا بجمع جزء من المخيخ 1,8. لتشخيص CWD ، يجب اختبار كل من جذع الدماغ (obex) والغدد الليمفاوية البلعومية حيث يمكن اكتشاف PrP Sc في الأنسجة اللمفاوية مع عدم وجود PrPSc يمكن اكتشافه في obex9 ، الذي استعرضه Machado et al.10.
يتضمن الجزء obex من جذع الدماغ مواقع مستهدفة TSE تشخيصية ، وهي النواة المبهمية الظهرية (DVN) ونواة القناة الانفرادية (STN) ونواة المسالك الشوكية للعصب الثلاثي التوائم (V). تقدم هذه المناطق باستمرار تراكم PrPSc الثنائي ، حتى في المراحل المبكرة من مرض جنون البقر والسكرابي الكلاسيكي. في الحالات السريرية ل TSE المتقدم ، تظهر جميع مناطق المادة الرمادية داخل جذع الدماغ توزيع PrPSc على نطاق واسع11.
قبل التقسيم والمعالجة ، يتم تقييم عينات الدماغ (الشكل 1) للتأكد من مستوى التحلل الذاتي ووجود أي تلف في الأنسجة يحتمل أن يضر بملاءمة العينة للتشخيص التتأكيدي القائم على IHC8. للتحقق من سلامة البروتوكولات التحضيرية والنتائج التحليلية ، يتم تضمين عينات الأنسجة الإيجابية والسلبية TSE كضوابط بالتزامن مع تحضير الأنسجة من حالات الاختبار في كل فحص.
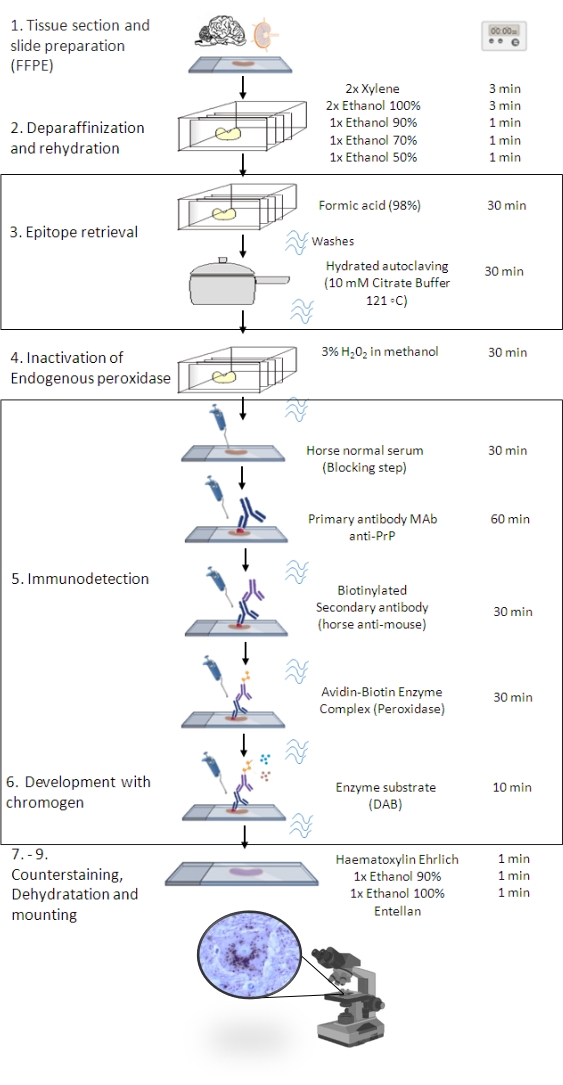
الشكل 1: إجراء PrPSc IHC. تمثيل يوضح التسلسل التدريجي لإجراء PrPSc IHC من إزالة البارافين من أقسام الأنسجة إلى التلوين المناعي والكشف في نهاية المطاف (FFPE - البارافين الثابت بالفورمالين ؛ ماب - الأجسام المضادة وحيدة النسيلة. DAB - 3،3 'ديامينوبنزيدين ). تم إنشاء هذا الرقم في عام BioRender.com. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
Protocol
إن إجراء المدينة العالمية للخدمات الإنسانية الموصوف هنا هو أحد مكونات المشروع البحثي FAIRJ-CT98-7021 ، "إنشاء شبكة أوروبية لمراقبة TSE المجترات وتوحيد وتنسيق عملية ومعايير تحديد الحالات المشتبه فيها". وهو يتبع معايير التشخيص التي حددتها المنظمة العالمية لصحة الحيوان ، WOAH (المسمى سابقا المكتب الدولي للحيوانات ، OIE) 1 والمختبر المرجعي الأوروبي ل TSEsالحيوانية 8،11. تم اعتماد إجراء IHC الموصوف أيضا وفقا ل NPISOIEC17025 (المتطلبات العامة لكفاءة مختبرات الفحص والمعايرة) منذ عام 2008. وينطوي هذا الاعتماد على نظام إدارة عالي الجودة يتضمن إجراءات تشغيلية قياسية، وموظفين مؤهلين، ومعدات معايرة بدقة، ومراقبة صارمة للبيانات والكواشف، والمشاركة في مقايسات الكفاءة بين المختبرات، والعمل غير المطابق، وتقييم المخاطر لزيادة فعالية نظام الإدارة، وتحقيق نتائج محسنة، ومنع مخاطر المختبرات. تم جمع ضوابط الأنسجة المصابة بالبريون مع مرض جنون البقر ، والسكرابي الكلاسيكي ، والسكرابي غير النمطي ، و CWD (مثبت بالفورمالين ، مضمن بالبارافين ، FFPE) من مصادر مختلفة. أقسام الأبقار والأغنام هي من الحالات التي تم تشخيصها في إطار برنامج مراقبة TSE الحيواني. أقسام CWD مأخوذة من عينات التحكم التي قدمتها البروفيسور ستيفاني تشوب (الوكالة الكندية لفحص الأغذية ، المركز الوطني للأمراض الحيوانية) في عام 2003 ومن اختبار الكفاءة CWD 2008 الذي نظمه المختبر المرجعي الأوروبي ل TSEs (APHA ، Weybridge).
1. تقسيم الأنسجة وإعداد الشرائح
- قطع مقاطع من الأنسجة المثبتة بالفورمالين والمضمنة بالبارافين (FFPE) بسمك 3-5 ميكرومتر باستخدام ميكروتوم.
- تطفو المقاطع على الماء النقي بدرجة حرارة حوالي 10 درجات مئوية تحت نقطة انصهار البارافين المستخدم. ارفع الأجزاء من الماء إلى شرائح مجهرية معالجة بشكل خاص (انظر جدول المواد). اترك الماء يستنزف جيدا من الشرائح.
- احتضان الشرائح طوال الليل عند 50 درجة مئوية لتعزيز التصاق الأنسجة بالانزلاق.
ملاحظة: يفضل تحضير مناديل مقطعة حديثا لبروتوكولات IHC ، على الرغم من أنه يمكن تحضير أقسام التحكم الإيجابية والسلبية في TSE مسبقا وتخزينها. يجب تنفيذ الخطوات من 2 إلى 4 في غطاء دخان كيميائي.
2. إزالة البارافين والإماهة
- ضع الشرائح مع أقسام الأنسجة في سلة تلطيخ من الفولاذ المقاوم للصدأ (انظر جدول المواد). اغمر السلة في حمام الزيلين (وعاء تلطيخ من الفولاذ المقاوم للصدأ) لمدة 3 دقائق ، ثم أخرجها واغمرها مرة أخرى.
- قم بإزالة مقاطع الزيلين وإعادة ترطيبها عن طريق غمرها في حمام إيثانول مطلق لمدة 3 دقائق. إزالة وتغمر مرة أخرى.
- جفف الأقسام في الهواء وضعها في حمام إيثانول بنسبة 90٪ لمدة 1 دقيقة. نقل إلى حمام الإيثانول 70 ٪ لمدة دقيقة أخرى ، تليها نقل النهائي إلى حمام الإيثانول 50 ٪ لمدة 1 دقيقة. لكل علاج حمام إيثانول ، حرك سلة الشرائح برفق مرتين وصفي السلة قبل النقل التالي.
3. استرجاع الخاتمة
- اغمر أقسام الأنسجة بعناية في 98٪ حمض الفورميك في درجة حرارة الغرفة لمدة 30 دقيقة. شطف الأجزاء في ماء الصنبور لمدة 5 دقائق ، تليها الشطف مرتين في الماء المقطر.
تنبيه: حمض الفورميك شديد التآكل. يجب ارتداء نظارات واقية وقفازات. - قم بإجراء استرجاع المستضد المستحث بالحرارة (HIER) باتباع الخطوات أدناه.
ملاحظة: يتم تنفيذ هذه الخطوة عن طريق التعقيم المائي عند 121 درجة مئوية لمدة 30 دقيقة في غرفة ضغط محددة (انظر جدول المواد).- قم بتسخين المخزن المؤقت للسيترات مسبقا (10 mM ، درجة الحموضة 6.1 ، انظر جدول المواد) عند 98 درجة مئوية لمدة 20 دقيقة تقريبا في حاوية تلطيخ من الفولاذ المقاوم للصدأ موضوعة داخل غرفة الضغط المملوءة ب 500 مل من الماء المقطر.
ملاحظة: بالنسبة للدراسة الحالية، كانت نقطة الضبط للبرنامج هي 1 (SP1) للمعدات المحددة المستخدمة. - بعد أن يشير الإنذار إلى أن الجهاز وصل إلى الوقت ودرجة الحرارة المبرمجين ، اغمر السلة بالشرائح وابدأ البرنامج في ضبط النقطة 2 (121 درجة مئوية لمدة 30 دقيقة). لأغراض مراقبة الجودة ، ضع قسما من شريط مؤشر الأوتوكلاف اللاصق على السلة لمراقبة درجة الحرارة والضغط ، وتسجيل الضغط الأولي والنهائي لهذا البرنامج.
- إذا لم يصل عدد الشرائح المراد تلوينها إلى سعة السلة ، فاستخدم شرائح نظيفة وفارغة لشغل أي مواضع فارغة. بعد انتهاء البرنامج ، اسمح بالعودة السلبية للغرفة إلى الضغط المحيط (30 دقيقة على الأقل).
ملاحظة: قد تقلل المدد الأطول من تلطيخ الخلفية غير المحدد. - انقل سلة الشرائح بعناية إلى حاوية تلطيخ من الفولاذ المقاوم للصدأ مملوءة بالماء المقطر لمدة 5 دقائق.
- قم بتسخين المخزن المؤقت للسيترات مسبقا (10 mM ، درجة الحموضة 6.1 ، انظر جدول المواد) عند 98 درجة مئوية لمدة 20 دقيقة تقريبا في حاوية تلطيخ من الفولاذ المقاوم للصدأ موضوعة داخل غرفة الضغط المملوءة ب 500 مل من الماء المقطر.
4. تعطيل البيروكسيديز الداخلي
- اغمر سلة الشرائح التي تحتوي على أقسام العينة في حمام يحتوي على 3٪ بيروكسيد الهيدروجين (H 2 O2) في الميثانول لمدة 30 دقيقة. شطف الأقسام تحت الماء الجاري (5 دقائق). صفي واغمر الأقسام في 1x محلول ملحي مخزن من Tris (TBS) لمدة 5 دقائق إضافية.
5. الكشف المناعي
ملاحظة: بالنسبة للدراسة الحالية ، تم تنفيذ الكشف المناعي باستخدام تنسيق الفجوة الشعرية7 باستخدام نظام تجميع مشبك الشريحة المتاح تجاريا (انظر جدول المواد). أنظمة شرائح الكيمياء الهيستولوجية المناعية الأخرى قابلة للتطبيق أيضا.
- ضع كل شريحة على حامل لوحة غطاء متوفر تجاريا (انظر جدول المواد) مبلل مسبقا باستخدام TBS ، وتجنب الفقاعات ، بحيث يكون جانب الأنسجة مواجها للحامل وحواف الشريحة تتزامن مع النقطتين السفليتين للحامل.
- أمسك مجموعة حامل الشريحة بين الإبهام والسبابة، بحيث يكون إصبع واحد أعلى شريحة العينة والآخر أعلى الحامل. ثم ضع التجميع في معرض النظام.
- لضمان تجميع المجموعة جيدا ، املأ البئر بين شريحة العينة والحامل باستخدام TBS ، والتي يجب ألا تفيض على الفور. من هذه النقطة فصاعدا ، تأكد من أنه يجب الاحتفاظ بحوالي 80 ميكرولتر من TBS بين الحامل والشريحة. لا تدع الأقسام تجف.
- بمجرد الدخول إلى النظام ، لتقليل تلطيخ الخلفية قبل العلاج بالجسم المضاد الأولي (مضاد PrP ، انظر جدول المواد) ، قم باحتضان شرائح العينة مسبقا بمصل طبيعي بنسبة 20٪ من نفس النوع مثل مضيف الجسم المضاد الثانوي المستخدم في التلوين المناعي (في الحالة الحالية ، مصل الحصان) لمدة 30 دقيقة في TBS.
- قم بإذابة عدد حصص الأجسام المضادة التي سيتم استخدامها وفقا للأنواع الحيوانية قيد التحليل ، وعدد أقسام العينة المراد فحصها ، ومقدار تخفيف العمل.
ملاحظة: للحصول على أفضل النتائج، استخدم مصلا طبيعيا بنسبة 10٪ من نفس النوع كمصدر لمحاليل الأجسام المضادة الثانوية والأجسام المضادة الأولية. إذا أمكن ، للحصول على أفضل النتائج ، يجب أن يكون المصدر المضيف للمصل الطبيعي والجسم المضاد الثانوي من نفس النوع. - بدون غسل الأقسام ، ضع محلول الجسم المضاد الأساسي مباشرة (200 ميكرولتر) في كل بئر من مجموعة حامل الشريحة واحتضانها لمدة 60 دقيقة في درجة حرارة الغرفة.
- للغسيل ، املأ آبار مجموعات حامل الشرائح باستخدام TBS وانتظر لمدة 5 دقائق. كرر مرتين.
- تمييع الجسم المضاد الثانوي البيوتينيل (وحيد النسيلة المضاد للفئران Horse Ab ، انظر جدول المواد) عند 1/200 في TBS مع مصل الحصان 10٪. قم بإعداد الحجم المطلوب اعتمادا على عدد الأقسام المراد معالجتها.
- ضع محلول الأجسام المضادة الثانوي (200 ميكرولتر) على كل بئر من مجموعة حامل الشريحة. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل كما هو موضح في الخطوة 5.5.
- للحضانة مع مركب البيروكسيديز avidin-biotin (مجمع ABC / HRP ، انظر جدول المواد) ، قم بإعداد الكاشف قبل 30 دقيقة من الاستخدام. قم بتطبيق محلول ABC / HRP المركب (200 ميكرولتر) في كل بئر من مجموعة حامل الألواح المنزلقة. احتضان لمدة 30 دقيقة في درجة حرارة الغرفة.
- اغسل كما هو موضح في الخطوة 5.5.
6. التطوير باستخدام كروموجين DAB
تنبيه: DAB مادة مسرطنة محتملة. نتيجة لذلك ، من الضروري توفير الرعاية المناسبة أثناء العمل مع هذا الكاشف ، بما في ذلك حماية العين ومعاطف المختبر والقفازات والإجراءات المختبرية الجيدة. تخلص من اتباع اللوائح المحلية.
- قم بتخفيف الكروم وفقا لتعليمات الشركة المصنعة (انظر جدول المواد) مباشرة قبل الاستخدام. ضع محلول الكروموجين (400 ميكرولتر) على كل بئر من مجموعة الألواح المنزلقة.
- احتضان لمدة تصل إلى 30 دقيقة في درجة حرارة الغرفة. في الأقسام الإيجابية ل PrPSc ، عادة ما تكون فترة الحضانة لمدة 10 دقائق كافية.
- قم بإزالة محلول الكروموجين المتبقي عن طريق غسل الشرائح في الماء المقطر. قم بإزالة الشرائح من حوامل غطاء الغطاء وضعها في وعاء بلاستيكي به ماء مقطر.
7. تلطيخ الهيماتوكسيلين المضاد
- اغمر سلة التلوين المصنوعة من الفولاذ المقاوم للصدأ مع الأقسام في حمام محلول الهيماتوكسيلين (انظر جدول المواد) لمدة 1 دقيقة. شطف بلطف في الماء الجاري البارد لمدة 10 دقائق أو الماء الفاتر لمدة 5 دقائق.
- قم بتجفيف الأقسام عن طريق وضعها في 90٪ من الإيثانول لمدة 1 دقيقة ، متبوعا بحمام واحد في الإيثانول المطلق لمدة 1 دقيقة. ثم ضع الشرائح في حمام الزيلين لمدة 1 دقيقة.
- قم بتركيب الأقسام بوسيط تركيب متاح تجاريا (انظر جدول المواد).
ملاحظة: يتم تنفيذ هذه الخطوات في غطاء دخان كيميائي في درجة حرارة الغرفة (19 درجة مئوية -24 درجة مئوية). يتضمن هذا الإجراء سجل اختبار (الملف التكميلي 1) لتسجيل الانتهاء من جميع الخطوات والمعدات المستخدمة وفني المختبر. بالإضافة إلى ذلك ، تم تصميم ورقة عمل (الملف التكميلي 2) لتحديد أحجام الكواشف بسهولة وفقا لعدد الأقسام في كل فحص ، وتخفيفات العمل ، وتعليمات الشركة المصنعة وكذلك لتسجيل درجة حرارة الغرفة والمعدات ودفعات الكاشف.
النتائج
بالنظر إلى أن وضع العلامات المناعية المستهدفة غير المحددة ممكن ، فمن المهم التأكد من مستوى وضع العلامات المناعية غير المحددة في التحكم السلبية المعروفة في TSE. هذه خطوة مهمة لتفسير العلامات المناعية المحددة ل PrPSc 7 بشكل صحيح (الشكل 2). لوحظ أن العلامات...
Discussion
TSEs هي أمراض حيوانية المنشأ محتملة. بعد ظهور مرض جنون البقر في عام 1986 في المملكة المتحدة ، أصبحت البرتغال واحدة من الدول الأعضاء في الاتحاد الأوروبي مع ارتفاع معدل الإصابة بهذا المرض14,15. من أجل السيطرة على هذا المرض ، تم تطوير آليات المراقبة الأخرى التي ظهرت (...
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
تم تمويل هذه المقالة من قبل مشروع POCI-01-0145-FEDER-029947 "تقييم مخاطر مرض الهزال المزمن في البرتغال" بدعم من FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020. أيضا ، تلقى مؤلفو وحدة الأبحاث CECAV تمويلا من FCT ، في إطار مشروع UIDB / CVT / 0772/2020 ، ونشكر بروس سي كامبل ، مدير الأبحاث (متقاعد) ، مركز البحوث الإقليمي الغربي ، وزارة الزراعة الأمريكية ، على مساعدته.
Materials
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
References
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved