É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Detecção de Proteína Priônica Anormal por Imunohistoquímica
Neste Artigo
Resumo
A imunomarcação de proteínas priônicas anormais usando protocolos de imunohistoquímica requer amostras específicas e metodologias de preparação de anticorpos anti-PrP. O presente protocolo descreve os principais passos na remoção de epítopos para garantir a imunomarcação adequada de PrP e minimizar a coloração de fundo inespecífica. Além disso, essa abordagem considera medidas de biossegurança ao realizar estudos imunohistoquímicos com os tecidos infectados por príons.
Resumo
As proteínas priônicas anormais (PrPSc) são a isoforma associada à doença da proteína priônica celular e marcadores diagnósticos de encefalopatias espongiformes transmissíveis (EET). Estas doenças neurodegenerativas afectam os seres humanos e várias espécies animais e incluem o tremor epizoótico, a encefalopatia espongiforme bovina zoonótica (EEB), a doença crónica dos cervídeos (CWD) e a recém-identificada doença do prião dos camelos (DPC). O diagnóstico de EET baseia-se na imunodetecção dePrP Sc pela aplicação dos métodos de imunohistoquímica (IHQ) e imunoblot ocidental (WB) em tecidos encéfalos, ou seja, o tronco cerebral (nível obex). A imunoistoquímica é um método amplamente utilizado que utiliza anticorpos primários (monoclonais ou policlonais) contra antígenos de interesse em células de um corte tecidual. A ligação anticorpo-antígeno pode ser visualizada por uma reação de cor que permanece localizada na área do tecido ou célula onde o anticorpo foi alvo. Assim, nas doenças priônicas, como em outros campos de pesquisa, as técnicas de imuno-histoquímica não são utilizadas apenas para fins diagnósticos, mas também em estudos de patogênese. Tais estudos envolvem a detecção dos padrões e tipos dePrP Sc a partir daqueles descritos anteriormente para identificar as novas cepas de príons. Uma vez que a EEB pode infectar seres humanos, recomenda-se que sejam utilizadas instalações e/ou práticas de laboratório de biossegurança nível 3 (BSL-3) para manusear bovinos, pequenos ruminantes e amostras de cervídeos incluídas na vigilância das EET. Além disso, recomendam-se, sempre que possível, equipamentos de contenção e dedicados a príons para limitar a contaminação. O procedimento de IHQPrP Sc consiste em uma etapa de desmascaramento de epítopos de ácido fórmico também atuando como uma medida de inativação do príon, uma vez que os tecidos fixados em formalina e emblocados em parafina usados nesta técnica permanecem infecciosos. Ao interpretar os resultados, deve-se ter cuidado para distinguir a imunomarcação não específica da rotulação alvo. Para esse propósito, é importante reconhecer artefatos de imunomarcação obtidos em animais controles conhecidos negativos para EET para diferenciá-los de tipos específicos de imunomarcaçãoPrP Sc , que podem variar entre cepas de EET, espécie hospedeira e genótipo prnp , descritos mais detalhadamente neste artigo.
Introdução
De acordo com a hipótese do príon, a isoforma anormal (PrP Sc) é o componente primário, ou único, do agente infeccioso nas encefalopatias espongiformes transmissíveis (EET). A confirmação para o diagnóstico de EET baseia-se na imunodetecção dePrP Sc por meio da aplicação de protocolos de imunohistoquímica (IHQ) e/ou métodos de immunoblot ocidental (WB) de tecidos encéfalos1.
A imunoistoquímica é um método que emprega anticorpos monoclonais ou, em alguns casos, policlonais (como anticorpos primários) como primeiro passo na imunomarcação de antígenos especificamente direcionados de interesse localizados em células de um corte tecidual. Qualquer ligação anticorpo-antígeno primário eficaz é então visualizada usando anticorpos secundários específicos para os anticorpos primários. Esses anticorpos secundários são conjugados a enzimas, como a peroxidase de raiz forte (HRP) ou a fosfatase alcalina (FA). A visualização é então obtida pela adição de um substrato a essas enzimas, produzindo produtos de cor insolúveis localizados em áreas onde os anticorpos primários estão ligados aos antígenos alvo. Uma melhor visualização pode ser obtida pela contracoloração, em que um corante é usado para criar um contraste entre tecido imunomarcado e não imunomarcado2.
Com a IHQ usando tecidos fixados em formalina e embebidos em parafina (FFPE), a fixação de formalina pode anular a eficácia dos anticorpos primários devido à reticulação por formaldeído e ao aquecimento e desidratação durante a inclusão da parafina. Estas alteram a conformação das proteínas, destruindo, desnaturando ou mascarando os epítopos, diminuindo ou anulando sua detecção3. Como tal, isso requer recuperação de antígeno (AR). As técnicas de RA interrompem a ligação cruzada de grupos químicos relacionados ao formaldeído nas moléculas antigênicas, restaurando ou desmascarando a conformação antígeno-proteína original. Isso resulta na recuperação da afinidade anticorpo-antígeno (epítopo) para a imunomarcação. A eventual eficácia da RA depende das qualidades do antígeno alvo e/ou do anticorpo primário2.
A recuperação do antígeno induzido pelo calor (epítopo) (HIER) é um procedimento do AR3 e é usado rotineiramente para detecção de IHQPrP Sc , conforme descrito aqui. A imunoistoquímica é essencial para o diagnóstico e utilizada em laboratórios de pesquisa para determinar a distribuição tecidual de um antígeno associado à patologia. É amplamente utilizada no diagnóstico e pesquisa de câncer, neurociências, doenças infecciosas4, entre outras. Para EET, a IHQ desempenha um papel importante no diagnóstico e na pesquisa para confirmar e investigar a distribuição dePrP Sc em hospedeiros naturais e modelos experimentais. A IHQ contribui para estudos de patogênese priônica e análise de tipos e padrões de deposição dePrP Sc , ou seja, em tecidosneurais5, para detectar desvios de infecções rotineiramente descritas e identificar possíveis novas cepas de príons.
Uma vez que os priões da encefalopatia espongiforme bovina (EEB) podem infectar seres humanos, certos protocolos laboratoriais envolvidos no trabalho com a EEB podem exigir a utilização de instalações e práticas de BSL-36. Estes incluem a utilização de um recipiente secundário selado para transportar potenciais amostras de tecidos infectados com EEB dentro do instituto e do laboratório. Inclui também a designação de áreas de contenção e de equipamento dedicado ao prião para a investigação e análise da BSE, sempre que possível. Isso é feito para evitar a contaminação fora da área de trabalho e proporcionar um espaço confinado, uma vez que os procedimentos de descontaminação se tornam necessários.
Assim, o Laboratório de Patologia do INIAV segue as instalaçõese práticas de nível de biossegurança 3 (BSL-3) recomendadas 6 para gerenciar amostras potenciais de tecidos infectados por príons de bovinos, pequenos ruminantes e cervídeos associados à vigilância de EET.
Tecidos fixados em formalina e incluídos em parafina incluídos em procedimentos de diagnóstico ou pesquisa de EET, especialmente no sistema nervoso central, podem ser potencialmente infecciosos. Assim, esses tecidos fixados devem ser tratados com ácido fórmico para reduzir a infectividade dos príons, se presentes, antes do processamento do tecido. Isso é realizado através da colocação de tecidos fixos e aparados (aproximadamente 2-4 mm de espessura) em um de processamento. O é então imerso em ácido fórmico a 98% (por 1 h). Após a imersão, os com tecidos são lavados em água corrente da torneira por 30 min e retornam ao fixador antes do processamento posterior. Se os cortes de tecido não forem tratados antes do processamento, os cortes de tecido pós-microtômicos devem ser imersos em ácido fórmico não diluído por pelo menos 5 minutos antes da coloração histológica7. O protocolo IHQ para PrPSc inclui uma etapa rotineira de desmascaramento de epítopos de ácido fórmico, servindo também para inativar príons7. Após essas etapas de inativação do príon, os tecidos fixados resultantes podem então ser processados em BSL-2 usando práticas BSL-2 padrão.
O requisito mínimo de amostragem de tecidos para o diagnóstico de EET em qualquer animal incluído na vigilância de EET é a recolha do tronco encefálico (ao nível do obex). Além disso, para a detecção de EEB e tremor epizoótico atípicos, recomenda-se que parte do cerebelo também seja coletada 1,8. Para o diagnóstico de DC, tanto os linfonodos do tronco encefálico (obex) quanto os retrofaríngeos devem ser testados, pois a PrP Sc pode ser detectada em tecidos linfoides semPrP Sc detectável no obex9, revisada por Machado et al.10.
A porção obex do tronco encefálico inclui os locais-alvo diagnósticos da EET, a saber, o núcleo vagal dorsal (DVN), o núcleo do trato solitário (NST) e o núcleo do trato espinhal do nervo trigêmeo (V). Estas zonas apresentam consistentemente acumulação bilateral dePrP Sc , mesmo nas fases iniciais da EEB e do tremor epizoótico clássico. Nos casos clínicos de EET avançada, todas as áreas de substância cinzenta no tronco encefálico apresentam ampla distribuição dePrP Sc11.
Antes da secção e processamento, as amostras de encéfalo são avaliadas (Figura 1) para verificar o grau de autólise e a presença de qualquer dano tecidual que possa comprometer a adequação da amostra para o diagnóstico confirmatório baseado em IHQ8. Para validar a integridade dos protocolos preparativos e dos resultados analíticos, as amostras de tecido positivas e negativas para EET são incluídas como controles em conjunto com a preparação de tecidos de casos de teste em cada ensaio.
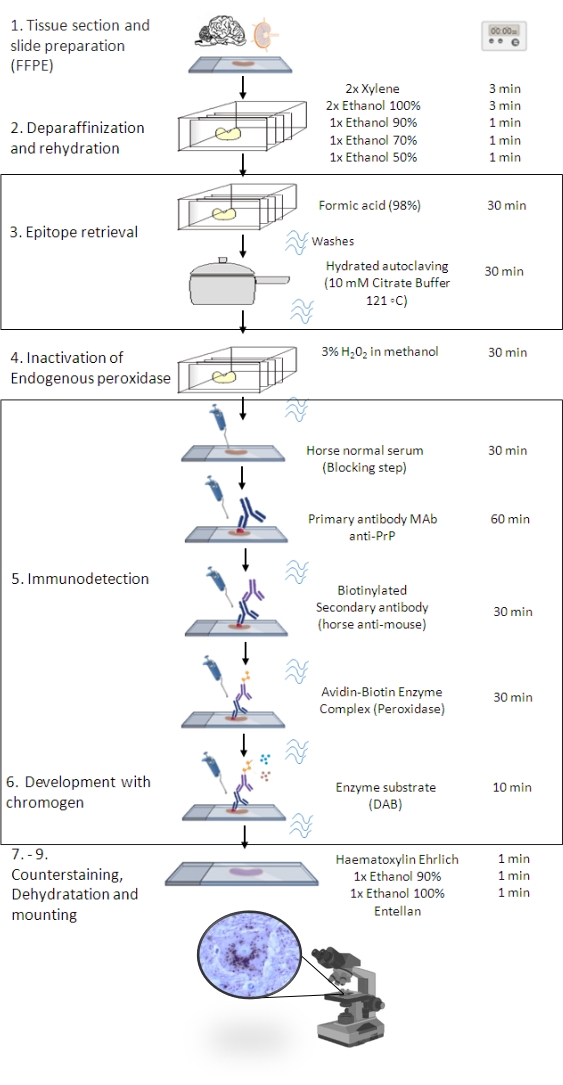
Figura 1: O procedimento de IHCPrP Sc . Representação mostrando o passo-a-passo do procedimento de IHQPrP Sc , desde a desparafinização dos cortes teciduais até a eventual imunomarcação e detecção (FFPE - Formalin-fixed paraffin-embedded; Mab - anticorpo monoclonal; DAB - 3,3' diaminobenzidina). Esta figura foi criada em BioRender.com. Clique aqui para ver uma versão maior desta figura.
Protocolo
O procedimento IHC aqui descrito é um componente do projeto de pesquisa FAIRJ-CT98-7021, "O estabelecimento de uma rede europeia para a vigilância de EET de ruminantes e a padronização e harmonização do processo e critérios para a identificação de casos suspeitos". Segue os critérios diagnósticos definidos pela Organização Mundial de Saúde Animal, WOAH (anteriormente denominado Office International des Épizooties, OIE)1 e Laboratório Europeu de Referência para EET emanimais8,11. O procedimento IHC descrito também é acreditado de acordo com NPISOIEC17025 (requisitos gerais para a competência de laboratórios de ensaio e calibração) desde 2008. Tal acreditação implica um sistema de gestão de alta qualidade incorporando procedimentos operacionais padrão, pessoal qualificado, equipamentos calibrados com precisão, controle rigoroso de dados e reagentes, participação em ensaios de proficiência interlaboratorial, trabalho não conforme e avaliação de risco para aumentar a eficácia do sistema de gestão, alcançar melhores resultados e prevenir riscos laboratoriais. Controles teciduais infectados com príons com EEB, tremor epizoótico clássico, tremor epizoótico atípico e CWD foram coletados (fixados em formalina, embebidos em parafina, FFPE) de várias fontes. As secções de bovinos e ovinos são provenientes dos casos diagnosticados no âmbito de um programa de vigilância de EET animal. As seções de CWD são provenientes das amostras de controle gentilmente fornecidas pela professora Stefanie Czub (Canadian Food Inspection Agency, National Center for Animal Diseases) em 2003 e do CWD Proficiency testing 2008 organizado pelo Laboratório Europeu de Referência para EET (APHA, Weybridge).
1. Secção dos tecidos e preparação das lâminas
- Corte cortes de tecidos fixados em formalina e embebidos em parafina (FFPE) a 3-5 μm de espessura usando um micrótomo.
- Flutuar secções em água purificada a uma temperatura aproximadamente 10 °C abaixo do ponto de fusão da parafina utilizada. Levante as seções da água para lâminas de microscópio especialmente tratadas (ver Tabela de Materiais). Deixe a água escorrer completamente das lâminas.
- Incubar as lâminas durante a noite a 50 °C para aumentar a adesão das lâminas dos tecidos.
NOTA: É preferível preparar tecidos recém-seccionados para protocolos de IHQ, embora as seções de controle positivo e negativo de EET possam ser preparadas com antecedência e armazenadas. As etapas 2 a 4 devem ser realizadas em uma capela de fumaça química.
2. Desparafinização e reidratação
- Coloque as lâminas com as seções de tecido em um cesto de coloração de aço inoxidável (consulte a Tabela de Materiais). Mergulhe o cesto em um banho de xileno (recipiente de coloração de aço inoxidável) por 3 min, retire e mergulhe novamente.
- Retire o xileno e reidrate as seções mergulhando-as em um banho absoluto de etanol por 3 min. Retire e mergulhe mais uma vez.
- Seque as seções ao ar e coloque em banho de etanol 90% por 1 min. Transfira para um banho de etanol a 70% por mais um minuto, seguido de uma transferência final para um banho de etanol a 50% por 1 min. Para cada tratamento em banho de etanol, agite suavemente o cesto deslizante duas vezes e escorra o cesto antes da próxima transferência.
3. Recuperação de epítopos
- Imergir cuidadosamente os cortes de tecido em ácido fórmico a 98% à temperatura ambiente durante 30 minutos. Enxaguar as seções em água corrente por 5 min, seguido de enxaguar duas vezes em água destilada.
CUIDADO: O ácido fórmico é altamente corrosivo. Óculos de proteção e luvas devem ser usados. - Execute a recuperação de antígeno induzida pelo calor (HIER) seguindo as etapas abaixo.
NOTA: Esta etapa é realizada por autoclavagem hidratada a 121 °C por 30 min em uma câmara de pressão específica (ver Tabela de Materiais).- Pré-aqueça o tampão citrato (10 mM, pH 6,1, ver Tabela de Materiais) a 98 °C por cerca de 20 min em um recipiente de coloração de aço inoxidável colocado dentro da câmara de pressão preenchida com 500 mL de água destilada.
OBS: Para o presente estudo, o programa Set Point foi 1 (SP1) para o equipamento específico utilizado. - Após o alarme indicar que o equipamento atingiu o tempo e a temperatura programados, mergulhe o cesto com lâminas e inicie o programa para o Set Point 2 (121°C por 30 min). Para fins de controle de qualidade, coloque uma seção de fita indicadora de autoclave adesiva no cesto para monitorar a temperatura e a pressão e registre a pressão inicial e final deste programa.
- Se o número de lâminas a serem imunomarcadas não atingir a capacidade da cesta, use lâminas limpas e em branco para ocupar as posições vazias. Após o término do programa, permitir o retorno passivo da câmara à pressão ambiente (pelo menos 30 min).
Observação : durações mais longas podem reduzir a coloração de fundo não específica. - Transfira cuidadosamente o cesto de corrediças para um recipiente de coloração de aço inoxidável cheio de água destilada por 5 minutos.
- Pré-aqueça o tampão citrato (10 mM, pH 6,1, ver Tabela de Materiais) a 98 °C por cerca de 20 min em um recipiente de coloração de aço inoxidável colocado dentro da câmara de pressão preenchida com 500 mL de água destilada.
4. Inativação da peroxidase endógena
- Imergir o cesto de lâminas contendo as seções da amostra em um banho de peróxido de hidrogênio a 3% (H 2 O2) em metanol por 30 min. Enxágue as seções em água corrente (5 min). Escorra e mergulhe as seções em 1x solução salina tamponada com Tris (TBS) por mais 5 min.
5. Imunodetecção
NOTA: Para o presente estudo, a imunodetecção foi executada usando o formato de gapcapilar 7 usando um sistema de montagem de clipe de lâmina disponível comercialmente (ver Tabela de Materiais). Outros sistemas de lâminas de imuno-histoquímica também são aplicáveis.
- Coloque cada lâmina em um suporte de placa de cobertura disponível comercialmente (consulte Tabela de Materiais) pré-umedecido com TBS, evitando bolhas, com o lado do tecido voltado para o suporte e as bordas da lâmina coincidindo com os dois pontos inferiores do suporte.
- Segure o conjunto do suporte deslizante entre o polegar e o indicador, com um dedo na parte superior da lâmina de amostra e o outro na parte inferior do suporte. Em seguida, coloque a montagem na galeria do sistema.
- Para garantir que o conjunto esteja bem montado, preencha o poço entre a lâmina de amostra e o suporte com TBS, que não deve transbordar imediatamente. A partir deste ponto, certifique-se de que aproximadamente 80 μL de TBS devem ser retidos entre o suporte e a lâmina. Não deixe as seções secarem.
- Uma vez no sistema, para diminuir a coloração de fundo antes do tratamento com anticorpo primário (anti-PrP, ver Tabela de Materiais), pré-incubar as lâminas de amostra com 20% de soro normal da mesma espécie que o hospedeiro do anticorpo secundário que está sendo usado para imunomarcação (no presente caso, soro de cavalo) por 30 minutos em TBS.
- Descongelar o número de alíquotas de anticorpos a utilizar em função da espécie animal em análise, o número de secções de amostra a examinar e a quantidade de diluição de trabalho.
NOTA: Para obter melhores resultados, use 10% de soro normal da mesma espécie que a fonte das soluções de anticorpos secundários e anticorpos primários. Se possível, para melhores resultados, a fonte hospedeira do soro normal e do anticorpo secundário deve ser da mesma espécie. - Sem lavar as seções, aplicar a solução de anticorpos primários diretamente (200 μL) em cada poço do conjunto de suporte deslizante e incubar por 60 min à temperatura ambiente.
- Para a lavagem, encha os poços dos conjuntos de suporte deslizante com TBS e aguarde 5 min.
- Diluir o anticorpo secundário biotinilado (monoclonal antimurino Horse Ab, ver Tabela de Materiais) a 1/200 em TBS com 10% de soro de cavalo. Preparar o volume necessário em função do número de secções a tratar.
- Aplicar a solução de anticorpos secundários (200 μL) em cada poço do conjunto de suporte deslizante. Incubar durante 30 min à temperatura ambiente.
- Lavar conforme descrito no passo 5.5.
- Para incubação com peroxidase do complexo avidina-biotina (complexo ABC/HRP, ver Tabela de Materiais), prepare o reagente 30 minutos antes da utilização. Aplicar a solução complexa ABC/HRP (200 μL) em cada poço do conjunto de suporte da placa deslizante. Incubar durante 30 min à temperatura ambiente.
- Lavar conforme descrito no passo 5.5.
6. Desenvolvimento com cromogênio DAB
CUIDADO: O DAB é um potencial cancerígeno. Como resultado, cuidados adequados são necessários ao trabalhar com esse reagente, incluindo proteção ocular, jalecos, luvas e bons procedimentos laboratoriais. Descarte de acordo com as normas locais.
- Diluir o cromógeno de acordo com as instruções do fabricante (ver Tabela de Materiais) imediatamente antes da utilização. Aplicar a solução de cromógeno (400 μL) em cada poço do conjunto de placas deslizantes.
- Incubar por até 30 min à temperatura ambiente. Em seções positivas paraPrP Sc , um período de incubação de 10 min é geralmente suficiente.
- Retire a solução de cromogénio residual lavando as lâminas em água destilada. Retire as lâminas dos suportes da placa de cobertura e coloque-as em um recipiente plástico com água destilada.
7. Contracoloração com hematoxilina
- Imergir o cesto de coloração de aço inoxidável com as seções no banho de solução de hematoxilina (ver Tabela de Materiais) por 1 min. Enxágue suavemente em água corrente fria por 10 min ou água morna por 5 min.
- Desidratar as seções colocando-as em etanol 90% por 1 min, seguido de um banho em etanol absoluto por 1 min. Em seguida, coloque as lâminas em um banho de xileno por 1 min.
- Monte as seções com um meio de montagem disponível comercialmente (consulte a Tabela de Materiais).
NOTA: Estas etapas são realizadas em um exaustor de fumaça química à temperatura ambiente (19 °C-24 °C). Esse procedimento inclui um registro de teste (Arquivo Suplementar 1) para registrar a conclusão de todas as etapas, o equipamento utilizado e o técnico de laboratório. Além disso, uma planilha (Arquivo Suplementar 2) foi projetada para determinar facilmente os volumes dos reagentes de acordo com o número de seções em cada ensaio, as diluições de trabalho e as instruções do fabricante, bem como para registrar a temperatura ambiente, o equipamento e os lotes de reagentes.
Resultados
Dado que a imunomarcação alvo não específica é possível, é importante determinar o nível de imunomarcação inespecífica em animais controles conhecidos negativos para EET. Esse é um passo importante para interpretar adequadamente a imunomarcação específica paraPrP Sc7 (Figura 2). Observou-se que a marcação não-alvo por anticorpos anti-PrP ocorre como discreta coloração intraneuronal de partículas finas (mais evidente no núcleo...
Discussão
As EET são doenças zoonóticas potenciais. Após o surgimento da BSE em 1986 no Reino Unido, Portugal tornou-se um dos Estados-Membros da União Europeia com maior incidência desta doença14,15. Para controlar esta doença, surgiram outras EET (tremor epizoótico clássico e atípico, variantes da EEB e, atualmente, a vigilância da doença crónica emaciante nos cervídeos), foram desenvolvidos mecanismos de vigilância pela Direção-Geral da Alimentação e...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este artigo foi financiado pelo Projeto POCI-01-0145-FEDER-029947 "Avaliação do risco de doenças crónicas em Portugal" apoiado pela FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020. Além disso, os autores da unidade de investigação CECAV receberam financiamento da FCT, no âmbito do projeto UIDB/CVT/0772/2020.Agradecemos a Bruce C. Campbell, Diretor de Investigação (aposentado), Centro Regional de Investigação do Oeste, USDA, pela sua assistência.
Materiais
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Referências
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados