Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Обнаружение аномального прионного белка методом иммуногистохимии
В этой статье
Резюме
Иммуномаркировка аномального прионного белка с использованием протоколов иммуногистохимии требует специфического образца и методологий подготовки антител против PrP. В настоящем протоколе описаны ключевые этапы демаскировки эпитопов для обеспечения надлежащей иммуномаркировки PrP и минимизации неспецифического фонового окрашивания. Также при таком подходе учитываются меры биобезопасности при проведении иммуногистохимических исследований с прион-инфицированными тканями.
Аннотация
Аномальные прионные белки (PrPSc) представляют собой ассоциированную с заболеванием изоформу клеточного прионного белка и диагностические маркеры трансмиссивных губчатых энцефалопатий (TSE). Эти нейродегенеративные заболевания поражают людей и несколько видов животных и включают скрепи, зоонозную губчатую энцефалопатию крупного рогатого скота (BSE), хроническую истощающую болезнь шейки матки (CWD) и недавно выявленную прионную болезнь верблюда (CPD). Диагностика TSE основана на иммунодетекции PrPSc с применением методов иммуногистохимии (ИГХ) и западного иммуноблоттинга (WB) на тканях головного мозга, а именно на стволе мозга (уровень obex). ИГХ является широко используемым методом, при котором используются первичные антитела (моноклональные или поликлональные) против интересующих антигенов в клетках среза ткани. Связывание антитела с антигеном может быть визуализировано с помощью цветовой реакции, которая остается локализованной в области ткани или клетки, где было нацелено антитело. Таким образом, при прионных заболеваниях, как и в других областях исследований, методы иммуногистохимии используются не только в диагностических целях, но и в исследованиях патогенеза. Такие исследования включают выявление паттернов и типов PrPSc из ранее описанных для идентификации новых прионных штаммов. Поскольку BSE может инфицировать людей, рекомендуется, чтобы лабораторные объекты биобезопасности уровня 3 (BSL-3) использовались для работы с крупным рогатым скотом, мелкими жвачными животными и образцами цервидов, включенными в эпиднадзор TSE. Кроме того, рекомендуется, когда это возможно, использовать защитную оболочку и оборудование, предназначенное для использования прионов, чтобы ограничить загрязнение. Процедура PrPSc IHC состоит из этапа демаскирования эпитопа муравьиной кислоты, который также действует как мера инактивации прионов, поскольку ткани, фиксированные формалином и залитые парафином, используемые в этом методе, остаются инфекционными. При интерпретации результатов необходимо соблюдать осторожность, чтобы отличить неспецифическую иммуномаркировку от целевой маркировки. С этой целью важно распознать артефакты иммуномаркирования, полученные у известных TSE-отрицательных контрольных животных, чтобы дифференцировать их от специфических типов иммуномечения PrPSc , которые могут варьироваться между штаммами TSE, видами-хозяевами и генотипом prnp , далее описанными в настоящем описании.
Введение
Согласно прионной гипотезе, аномальная изоформа (PrPSc) является первичным или единственным компонентом инфекционного агента при трансмиссивных губчатых энцефалопатиях (TSE). Подтверждение диагноза TSE основано на иммунодетекции PrPSc с применением протоколов иммуногистохимии (ИГХ) и/или западных иммуноблоттинговых методов (WB) тканей головного мозга1.
ИГХ представляет собой метод, использующий моноклональные или, в некоторых случаях, поликлональные антитела (в качестве первичных антител) в качестве первого шага в иммуноокрашивании специфически целевых антигенов, представляющих интерес, расположенных в клетках среза ткани. Любое эффективное первичное связывание антитело-антиген затем визуализируется с использованием вторичных антител, специфичных к первичным антителам. Эти вторичные антитела конъюгированы с ферментами, такими как пероксидаза хрена (HRP) или щелочная фосфатаза (AP). Затем визуализация достигается путем добавления субстрата к этим ферментам, образуя нерастворимые цветные продукты, локализованные в областях, где первичные антитела связаны с целевыми антигенами. Улучшенная визуализация может быть достигнута путем контрокрашивания, при котором краситель используется для создания контраста между иммуномеченой и неиммуномеченной тканью2.
При ИГХ с использованием фиксированных формалином тканей, встроенных в парафин (FFPE), фиксация формалина может свести на нет эффективность первичных антител из-за сшивания формальдегидом, а также нагревания и обезвоживания во время заделки парафина. Они изменяют конформацию белков, разрушая, денатурируя или маскируя эпитопы, тем самым уменьшая или отменяя их обнаружение3. Таким образом, это требует поиска антигена (AR). Методы AR нарушают сшивание химических групп, связанных с формальдегидом, в антигенных молекулах, тем самым восстанавливая или демаскируя исходную конформацию антиген-белок. Это приводит к восстановлению сродства антитело-антиген (эпитоп) к иммуномаркировке. Конечная эффективность АР зависит от качеств целевого антигена и/или первичного антитела2.
Термоиндуцированный поиск антигена (эпитопа) (HIER) является одной из процедур AR3 и обычно используется для обнаружения PrPSc IHC, как описано в настоящем документе. ИГХ необходим для диагностики и используется в исследовательских лабораториях для определения тканевого распределения антигена, связанного с патологией. Он широко используется, в частности, для диагностики и исследования рака, неврологии и инфекционных заболеваний4. Для TSE ИГХ играет важную роль в диагностике и исследованиях для подтверждения и исследования распределения PrPSc в естественных хозяевах и экспериментальных моделях. ИГХ способствует изучению прионного патогенеза и анализу типов и паттернов отложения PrPSc , а именно в нервных тканях5, для выявления отклонений от обычно описанных инфекций и выявления предполагаемых новых прионных штаммов.
Поскольку прионы губчатой энцефалопатии крупного рогатого скота (BSE) могут инфицировать людей, некоторые лабораторные протоколы, связанные с работой с BSE, могут потребовать использования оборудования и методов BSL-36. К ним относятся использование герметичного вторичного контейнера для транспортировки потенциальных образцов тканей, инфицированных BSE, в институте и лаборатории. Это также включает в себя обозначение зон локализации и оборудования, предназначенного для исследований и анализа BSE, когда это возможно. Это делается для предотвращения загрязнения за пределами рабочей зоны и обеспечения замкнутого пространства, поскольку процедуры дезактивации становятся необходимыми.
Соответственно, Лаборатория патологии INIAV следует рекомендуемым объектам и практикам уровнябиобезопасности 3 (BSL-3) 6 для управления потенциально инфицированными прионами образцами тканей крупного рогатого скота, мелких жвачных животных и цервидов, связанных с эпиднадзором TSE.
Ткани, закрепленные формалином и залитые парафином, включенные в диагностические или исследовательские процедуры TSE, особенно в центральной нервной системе, могут быть потенциально инфекционными. Следовательно, эти фиксированные ткани должны быть обработаны муравьиной кислотой, чтобы уменьшить инфекционность прионов, если они присутствуют, перед обработкой ткани. Это выполняется путем помещения фиксированных, обрезанных тканей (толщиной примерно 2-4 мм) в обрабатываемую кассету. Затем кассету погружают в 98% муравьиную кислоту (на 1 ч). После погружения кассеты с салфетками промывают в проточной водопроводной воде в течение 30 мин, а перед дальнейшей обработкой возвращают в фиксатор. Если срезы тканей не обработаны перед обработкой, постмикротомные срезы тканей должны быть погружены в неразбавленную муравьиную кислоту не менее чем на 5 мин перед гистологическим окрашиванием7. Протокол IHC для PrPSc включает в себя рутинную стадию демаскировки эпитопа муравьиной кислоты, также служащую для инактивации прионов7. После этих этапов инактивации прионов полученные фиксированные ткани могут быть обработаны в BSL-2 с использованием стандартных методов BSL-2.
Минимальным требованием к выборке тканей для диагностики TSE у любого животного, включенного в наблюдение TSE, является сбор ствола мозга (на уровне обекса). Кроме того, для выявления атипичных BSE и царапин рекомендуется также собрать часть мозжечка 1,8. Для диагностики CWD следует тестировать как ствол головного мозга (obex), так и ретрофарингеальные лимфатические узлы, поскольку PrP Sc может быть обнаружен в лимфоидных тканях без обнаруживаемого PrPSc в obex9, рассмотренный Machado et al.10.
Обексная часть ствола мозга включает диагностические целевые участки TSE, а именно дорсальное ядро блуждающего нерва (DVN), ядро солитарного тракта (STN) и ядро спинномозгового тракта тройничного нерва (V). В этих областях последовательно присутствует двустороннее накопление PrPSc даже на ранних стадиях BSE и классического скрепи. В клинических случаях прогрессирующей TSE все области серого вещества в стволе мозга демонстрируют широко распространенное распределение PrPSc 11.
Перед секционированием и обработкой образцы мозга оценивают (рис. 1), чтобы определить уровень аутолиза и наличие каких-либо повреждений тканей, которые могут поставить под угрозу пригодность образца для подтверждающего диагноза на основе ИГХ8. Для проверки целостности препаративных протоколов и результатов анализа положительные и отрицательные образцы тканей TSE включаются в качестве контроля в сочетании с подготовкой тканей из тестовых случаев в каждом анализе.
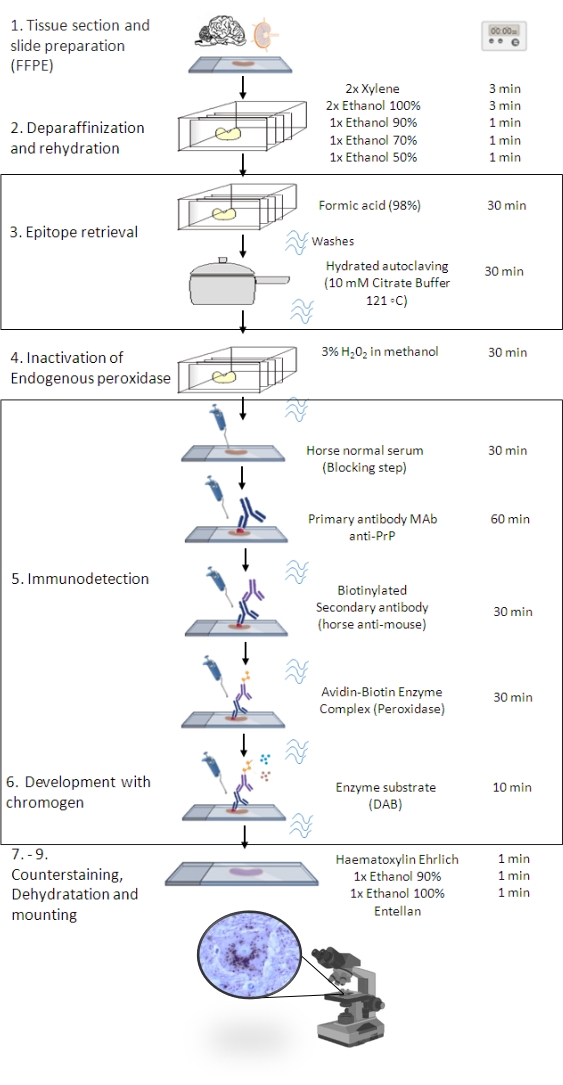
Рисунок 1: Процедура PrPSc IHC. Представление, демонстрирующее пошаговую последовательность процедуры PrPSc IHC от депарафинизации срезов ткани до возможного иммуноокрашивания и обнаружения (FFPE - Формалин-фиксированный парафин-встраиваемый; Mab - моноклональное антитело; DAB - 3,3' диаминобензидин). Эта фигура была создана в BioRender.com году. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
протокол
Описанная в настоящем документе процедура IHC является компонентом исследовательского проекта FAIRJ-CT98-7021 «Создание европейской сети по надзору за жвачными животными TSE, а также стандартизация и гармонизация процесса и критериев для выявления подозрительных случаев». Он соответствует диагностическим критериям, определенным Всемирной организацией по охране здоровья животных, WOAH (ранее называвшейся Международным бюро эпизоотий, МЭБ)1 и Европейской референс-лабораторией по TSEживотных 8,11. Описанная процедура IHC также аккредитована в соответствии с NPISOIEC17025 (общие требования к компетентности испытательных и калибровочных лабораторий) с 2008 года. Такая аккредитация подразумевает высококачественную систему менеджмента, включающую стандартные оперативные процедуры, квалифицированный персонал, точно откалиброванное оборудование, строгий контроль данных и реагентов, участие в межлабораторных квалификационных анализах, несоответствующую работу и оценку рисков для повышения эффективности системы менеджмента, достижения улучшенных результатов и предотвращения лабораторных опасностей. Контроль над инфицированными прионами тканями с BSE, классическим скрепи, атипичным скрепи и CWD собирали (фиксированные формалином, встроенные в парафин, FFPE) из различных источников. Секции крупного рогатого скота и овец взяты из случаев, диагностированных в рамках программы эпиднадзора за животными TSE. Срезы CWD взяты из контрольных образцов, любезно предоставленных профессором Стефани Цуб (Канадское агентство по инспекции пищевых продуктов, Национальный центр болезней животных) в 2003 году, и из квалификационных испытаний CWD 2008 года, организованных Европейской референс-лабораторией по TSE (APHA, Weybridge).
1. Сечение тканей и подготовка предметного стекла
- Вырезают срезы тканей, закрепленных формалином и залитых парафином (FFPE), толщиной 3-5 мкм с помощью микротома.
- Всплывают секции на очищенную воду с температурой примерно на 10 °C ниже температуры плавления используемого парафина. Поднимите срезы из воды на специально обработанные предметные стекла микроскопа (см. Таблицу материалов). Дайте воде полностью стечь с горок.
- Инкубируйте предметные стекла в течение ночи при 50 ° C, чтобы улучшить адгезию тканей к предметному стеклу.
ПРИМЕЧАНИЕ: Предпочтительно подготавливать свежесрезанные ткани для протоколов IHC, хотя положительные и отрицательные контрольные срезы TSE могут быть подготовлены заранее и сохранены. Шаги со 2 по 4 должны выполняться в химическом вытяжном шкафу.
2. Депарафинизация и регидратация
- Поместите предметные стекла с тканевыми срезами в корзину для окрашивания из нержавеющей стали (см. Таблицу материалов). Погрузите корзину в ванну с ксилолом (емкость для окрашивания из нержавеющей стали) на 3 минуты, извлеките и снова погрузите.
- Удалите ксилол и регидратируйте срезы, погрузив их в ванну с абсолютным этанолом на 3 минуты. Снимите и погрузите еще раз.
- Высушите срезы на воздухе и поместите в ванну с 90% этанолом на 1 мин. Переведите в ванну с 70% этанолом еще на минуту, а затем окончательно перенесите в ванну с 50% этанолом на 1 минуту. При каждой процедуре ванны с этанолом осторожно перемешивайте скользящую корзину дважды и сливайте воду из корзины перед следующей передачей.
3. Поиск эпитопов
- Аккуратно погрузите срезы тканей в 98% муравьиную кислоту комнатной температуры на 30 мин. Промойте срезы в водопроводной воде в течение 5 мин, после чего дважды ополосните в дистиллированной воде.
ВНИМАНИЕ: Муравьиная кислота обладает высокой коррозионной активностью. Необходимо надевать защитные очки и перчатки. - Выполните термоиндуцированное извлечение антигена (HIER), выполнив следующие действия.
ПРИМЕЧАНИЕ: Этот этап выполняется путем гидратированного автоклавирования при 121 ° C в течение 30 мин в специальной барокамере (см. Таблицу материалов).- Предварительно нагрейте цитратный буфер (10 мМ, рН 6,1, см. Таблицу материалов) при 98 ° C в течение примерно 20 мин в контейнере для окрашивания из нержавеющей стали, помещенном в барокамеру, заполненную 500 мл дистиллированной воды.
ПРИМЕЧАНИЕ: Для настоящего исследования заданное значение программы составляло 1 (SP1) для конкретного используемого оборудования. - После того, как сигнал тревоги укажет, что оборудование достигло запрограммированного времени и температуры, погрузите корзину с предметными стеклами и запустите программу до заданной точки 2 (121 ° C в течение 30 минут). В целях контроля качества поместите на корзину участок клейкой индикаторной ленты автоклава для контроля температуры и давления, а также запишите начальное и конечное давление этой программы.
- Если количество предметных стекол, подлежащих иммуноокрашиванию, не достигает емкости корзины, используйте чистые пустые предметные стекла, чтобы занять любые пустые места. После завершения программы разрешите пассивное возвращение камеры к давлению окружающей среды (не менее 30 мин).
ПРИМЕЧАНИЕ: Более длительная продолжительность может уменьшить неспецифическое окрашивание фона. - Осторожно перенесите скользящую корзину в емкость для окрашивания из нержавеющей стали, наполненную дистиллированной водой, на 5 минут.
- Предварительно нагрейте цитратный буфер (10 мМ, рН 6,1, см. Таблицу материалов) при 98 ° C в течение примерно 20 мин в контейнере для окрашивания из нержавеющей стали, помещенном в барокамеру, заполненную 500 мл дистиллированной воды.
4. Инактивация эндогенной пероксидазы
- Погрузите корзину, содержащую срезы образца, в ванну с 3% перекисью водорода (H2O2) в метаноле на 30 мин. Промойте срезы под проточной водой (5 мин). Слейте воду и погрузите срезы в 1x физиологический раствор с трис-буфером (TBS) еще на 5 минут.
5. Иммунодетекция
ПРИМЕЧАНИЕ: В настоящем исследовании иммунодетекцию проводили с использованием формата7 капиллярного промежутка с использованием коммерчески доступной системы сборки зажима слайда (см. Таблицу материалов). Также применимы другие системы иммуногистохимических слайдов.
- Поместите каждое предметное стекло на имеющийся в продаже держатель крышки (см. Таблицу материалов), предварительно смоченный TBS, избегая пузырьков, так, чтобы тканевая сторона была обращена к держателю, а края предметного стекла совпадали с двумя нижними точками держателя.
- Удерживайте узел держателя затвора между большим и указательным пальцами, один палец должен находиться поверх предметного стекла образца, а другой — в нижней части держателя. Затем поместите сборку в галерею системы.
- Чтобы убедиться, что набор хорошо собран, заполните лунку между предметным стеклом и держателем TBS, которая не должна сразу переполняться. С этого момента убедитесь, что между держателем и предметным стеклом должно удерживаться примерно 80 мкл TBS. Не допускайте высыхания срезов.
- Попав в систему, чтобы уменьшить фоновое окрашивание перед обработкой первичным антителом (анти-PrP, см. Таблицу материалов), предварительно инкубируйте предметные стекла образца с 20% нормальной сывороткой того же вида, что и вторичный хозяин антитела, используемый для иммуноокрашивания (в данном случае, лошадиная сыворотка) в течение 30 мин в TBS.
- Разморозьте количество аликвот антител, которые будут использоваться в соответствии с анализируемым видом животных, количество исследуемых срезов образца и количество рабочего разведения.
ПРИМЕЧАНИЕ: Для достижения наилучших результатов используйте 10% нормальную сыворотку того же вида, что и источник вторичных антител и первичных растворов антител. Если возможно, для достижения наилучших результатов источник хозяина нормальной сыворотки и вторичного антитела должны быть одного и того же вида. - Не промывая срезы, наносят раствор первичного антитела непосредственно (200 мкл) в каждую лунку набора предметных стекол и выдерживают в течение 60 мин при комнатной температуре.
- Для промывки заполните лунки наборов держателей слайдов TBS и подождите 5 мин. Повторите дважды.
- Разбавьте биотинилированное вторичное антитело (моноклональный антимышиный Horse Ab, см. Таблицу материалов) на 1/200 в TBS с 10% конской сывороткой. Подготовьте необходимый объем в зависимости от количества обрабатываемых участков.
- Нанесите раствор вторичных антител (200 мкл) на каждую лунку набора держателей предметных стекол. Инкубировать 30 мин при комнатной температуре.
- Постирайте, как описано в шаге 5.5.
- Для инкубации с авидин-биотиновым комплексом пероксидазой (комплекс ABC/HRP, см. Таблицу материалов) готовят реагент за 30 мин до применения. Нанесите комплексный раствор ABC/HRP (200 мкл) в каждую лунку набора держателей скользящих пластин. Инкубировать 30 мин при комнатной температуре.
- Постирайте, как описано в шаге 5.5.
6. Разработка с помощью хромогена DAB
ВНИМАНИЕ: DAB является потенциальным канцерогеном. В результате при работе с этим реагентом необходим соответствующий уход, включая защиту глаз, лабораторные халаты, перчатки и хорошие лабораторные процедуры. Утилизируйте в соответствии с местными правилами.
- Разбавляйте хромоген в соответствии с инструкциями производителя (см. Таблицу материалов) непосредственно перед использованием. Нанесите раствор хромогена (400 мкл) на каждую лунку набора слайд-пластин.
- Инкубировать до 30 мин при комнатной температуре. В положительных срезахPrP Sc обычно достаточно 10-минутного инкубационного периода.
- Удалите остаточный раствор хромогена, промыв предметные стекла в дистиллированной воде. Снимите слайды с держателей крышки и поместите их в пластиковый контейнер с дистиллированной водой.
7. Противоокрашивание гематоксилином
- Погрузите корзину для окрашивания из нержавеющей стали с секциями в ванну с раствором гематоксилина (см. Таблицу материалов) на 1 мин. Осторожно промойте в холодной проточной воде в течение 10 минут или в теплой воде в течение 5 минут.
- Обезвоживают срезы, помещая их в 90% этанол на 1 мин, а затем одну ванну в абсолютном этаноле в течение 1 мин. Затем поместите горки в ксилольную ванну на 1 мин.
- Монтируйте секции с помощью имеющегося в продаже монтажного носителя (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Эти этапы выполняются в химическом вытяжном шкафу при комнатной температуре (19 °C -24 °C). Эта процедура включает в себя протокол испытаний (дополнительный файл 1) для записи завершения всех этапов, используемого оборудования и лаборанта. Кроме того, был разработан рабочий лист (дополнительный файл 2) для простого определения объемов реагентов в соответствии с количеством секций в каждом анализе, рабочими разбавлениями и инструкциями производителя, а также для записи комнатной температуры, оборудования и партий реагентов.
Результаты
Учитывая, что неспецифическая целевая иммуномаркировка возможна, важно выяснить уровень неспецифической иммуномаркировки у известных TSE-отрицательных контрольных животных. Это важный шаг для правильной интерпретации специфической иммуномаркировки PrPSc 7 (
Обсуждение
TSE являются потенциальными зоонозными заболеваниями. После появления BSE в 1986 году в Соединенном Королевстве Португалия стала одним из государств-членов Европейского Союза с более высокой заболеваемостью этим заболеванием14,15. Для борьбы с этим заболеван...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта статья была профинансирована проектом POCI-01-0145-FEDER-029947 «Оценка риска хронического истощения в Португалии» при поддержке FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020. Кроме того, авторы исследовательского подразделения CECAV получили финансирование от FCT в рамках проекта UIDB/CVT/0772/2020.Мы благодарим Брюса К. Кэмпбелла, директора по исследованиям (в отставке), Западный региональный исследовательский центр, Министерство сельского хозяйства США, за его помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Ссылки
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены