Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
İmmünohistokimya ile Anormal Prion Proteininin Saptanması
Bu Makalede
Özet
İmmünohistokimya protokollerini kullanarak anormal prion proteininin immüno-etiketlemesi, spesifik numune ve anti-PrP antikor hazırlama metodolojileri gerektirir. Bu protokol, uygun PrP immün etiketlemesini sağlamak ve spesifik olmayan arka plan boyamasını en aza indirmek için epitop demasking işlemindeki temel adımları açıklamaktadır. Ayrıca, bu yaklaşım, prion ile enfekte olmuş dokularla immünohistokimya çalışmaları yaparken biyogüvenlik önlemlerini de göz önünde bulundurur.
Özet
Anormal prion proteinleri (PrPSc), hücresel prion proteininin hastalıkla ilişkili izoformu ve bulaşıcı süngerimsi ensefalopatilerin (TSE'ler) tanısal belirteçleridir. Bu nörodejeneratif hastalıklar insanları ve çeşitli hayvan türlerini etkiler ve scrapie, zoonotik sığır süngerimsi ensefalopati (BSE), servidlerin kronik israf hastalığı (CWD) ve yeni tanımlanan deve prion hastalığını (CPD) içerir. TSE'lerin tanısı, ensefalon dokularına, yani beyin sapına (obex seviyesi) hem immünohistokimya (IHC) hem de batı immünoblot yöntemlerinin (WB) uygulanması ile PrPSc'nin immün tespitine dayanır. IHC, bir doku kesitinin hücrelerinde tutulan antijenlere karşı primer antikorları (monoklonal veya poliklonal) kullanan yaygın olarak kullanılan bir yöntemdir. Antikor-antijen bağlanması, antikorun hedeflendiği doku veya hücre bölgesinde lokalize kalan bir renk reaksiyonu ile görselleştirilebilir. Bu nedenle prion hastalıklarında, diğer araştırma alanlarında olduğu gibi, immünohistokimya teknikleri sadece tanı amaçlı değil, patogenez çalışmalarında da kullanılmaktadır. Bu tür çalışmalar, yeni prion suşlarını tanımlamak için daha önce tarif edilenlerden PrPSc modellerini ve tiplerini tespit etmeyi içerir. BSE insanları enfekte edebileceğinden, TSE gözetimine dahil edilen sığır, küçükbaş hayvan ve servid örneklerini işlemek için biyogüvenlik laboratuvarı seviye-3 (BSL-3) tesislerinin ve/veya uygulamalarının kullanılması önerilmektedir. Ek olarak, kontaminasyonu sınırlamak için mümkün olduğunda muhafaza ve priona özel ekipman önerilir. PrPSc IHC prosedürü, bu teknikte kullanılan formalin sabit ve parafin gömülü dokular bulaşıcı kaldığı için prion inaktivasyon önlemi olarak da işlev gören bir formik asit epitop demasking adımından oluşur. Sonuçları yorumlarken, spesifik olmayan immüno-etiketlemeyi hedef etiketlemeden ayırt etmek için özen gösterilmelidir. Bu amaçla, bilinen TSE-negatif kontrol hayvanlarında elde edilen immünoetiketleme artefaktlarını, TSE suşları, konakçı türler ve prnp genotipi arasında değişebilen spesifik PrPSc immünoetiketleme tiplerinden ayırt etmek için tanımak önemlidir.
Giriş
Prion hipotezine göre, anormal izoform (PrPSc), bulaşıcı süngerimsi ensefalopatilerde (TSE'ler) enfeksiyöz ajanın birincil veya tek bileşenidir. TSE tanısının doğrulanması, ensefalon dokularının immünohistokimya (IHC) protokolleri ve/veya batı immünoblot yöntemlerinin (WB) uygulanması ile PrPSc'nin immün tespitine dayanır1.
IHC, bir doku kesitinin hücrelerinde bulunan spesifik olarak hedeflenmiş antijenlerin immünoboyanmasında ilk adım olarak monoklonal veya bazı durumlarda poliklonal antikorların (primer antikorlar olarak) kullanıldığı bir yöntemdir. Herhangi bir etkili primer antikor-antijen bağlanması daha sonra primer antikorlara özgü sekonder antikorlar kullanılarak görselleştirilir. Bu ikincil antikorlar, yaban turpu peroksidaz (HRP) veya alkalen fosfataz (AP) gibi enzimlere konjuge edilir. Görselleştirme daha sonra bu enzimlere bir substrat eklenerek elde edilir ve birincil antikorların hedeflenen antijenlere bağlandığı alanlarda lokalize çözünmeyen renk ürünleri üretilir. Geliştirilmiş görselleştirme, immüno-işaretli ve immüno-etiketsiz doku2 arasında bir kontrast oluşturmak için bir boyanın kullanıldığı karşı boyama ile elde edilebilir.
Formalin ile sabitlenmiş parafin gömülü dokular (FFPE) kullanan IHC ile, formalin fiksasyonu, formaldehit ile çapraz bağlanma ve parafin gömme sırasında ısıtma ve dehidrasyon nedeniyle primer antikorların etkinliğini geçersiz kılabilir. Bunlar proteinlerin konformasyonunu değiştirir, epitopları yok eder, denatüre eder veya maskeler, böylece tespitlerini azaltır veya iptal eder3. Bu nedenle, bu antijen geri kazanımı (AR) gerektirir. AR teknikleri, antijenik moleküllerde formaldehit ile ilişkili kimyasal grup çapraz bağlanmasını bozar, böylece orijinal antijen-protein konformasyonunu geri yükler veya maskesini çıkarır. Bu, immünoetiketleme için antikor-antijen (epitop) afinitesinin geri kazanılmasıyla sonuçlanır. AR'nin nihai etkinliği, hedeflenen antijenin ve / veya birincil antikor2'nin niteliklerine bağlıdır.
Isıya bağlı antijen (epitop) geri kazanımı (HIER), AR3'ün bir prosedürüdür ve burada açıklandığı gibi PrPSc IHC tespiti için rutin olarak kullanılır. IHC tanı için gereklidir ve patoloji ile ilişkili bir antijenin doku dağılımını belirlemek için araştırma laboratuvarlarında kullanılır. Diğerlerinin yanı sıra kanser, sinirbilim vebulaşıcı hastalıkların 4 teşhis ve araştırmalarında yaygın olarak kullanılır. TSE'ler için IHC, doğal konakçılarda ve deneysel modellerde PrPSc dağılımının doğrulanması ve araştırılması için tanı ve araştırmada önemli bir rol oynamaktadır. IHC, prion patogenezi çalışmalarına ve rutin olarak tanımlanan enfeksiyonlardan sapmaları tespit etmek ve varsayılan yeni prion suşlarını tanımlamak için prion patogenezi çalışmalarına ve PrPSc birikim tiplerinin ve paternlerinin analizine, yani sinir dokularında5'e katkıda bulunur.
Sığır süngerimsi ensefalopati prionları (BSE) insanları enfekte edebildiğinden, BSE ile yapılan çalışmalarda yer alan bazı laboratuvar protokolleri BSL-3 tesislerinin ve uygulamalarının kullanılmasını gerektirebilir6. Bunlar, potansiyel BSE ile enfekte olmuş doku örneklerini enstitü ve laboratuvar içinde taşımak için kapalı bir ikincil kap kullanmayı içerir. Ayrıca, mümkün olduğunda BSE araştırma ve analizi için muhafaza alanlarının ve priona özel ekipmanların belirlenmesini de içerir. Bu, çalışma alanı dışındaki kontaminasyonu önlemek ve dekontaminasyon prosedürleri gerekli hale geldiğinden sınırlı bir alan sağlamak için yapılır.
Buna göre, INIAV Patoloji Laboratuvarı, TSE sürveyansı ile ilişkili sığır, küçükbaş hayvan ve servidlerden potansiyel prion ile enfekte olmuş doku örnekleriniyönetmek için önerilen biyogüvenlik seviyesi-3 (BSL-3) tesislerini ve uygulamalarını 6 takip etmektedir.
TSE tanı veya araştırma prosedürlerinde yer alan formalin ile sabitlenmiş ve parafin gömülü dokular, özellikle merkezi sinir sisteminde, potansiyel olarak bulaşıcı olabilir. Bu nedenle, bu sabit dokular, eğer varsa, doku işlemeden önce prionların bulaşıcılığını azaltmak için formik asit ile muamele edilmelidir. Bu, sabit, kesilmiş dokuların (yaklaşık 2-4 mm kalınlığında) bir işleme kasetine yerleştirilmesiyle gerçekleştirilir. Kaset daha sonra% 98 formik aside batırılır (1 saat boyunca). Daldırma işleminden sonra, mendilli kasetler 30 dakika boyunca akan musluk suyunda yıkanır ve daha fazla işlemden önce fiksatife geri döndürülür. Doku kesitleri işlenmeden önce tedavi edilmezse, post-mikrotomik doku kesitleri histolojik boyamadan önce en az 5 dakika seyreltilmemiş formik aside batırılmalıdır7. PrPSc için IHC protokolü, prionları inaktive etmeye de hizmet eden rutin bir formik asit epitop demasking adımı içerir7. Bu prion inaktivasyon adımlarından sonra, elde edilen sabit dokular daha sonra standart BSL-2 uygulamaları kullanılarak BSL-2'de işlenebilir.
TSE gözetimine dahil edilen herhangi bir hayvanda TSE tanısı için minimum doku örnekleme gereksinimi beyin sapının toplanmasıdır (obex seviyesinde). Ek olarak, atipik BSE ve scrapie'yi tespit etmek için, beyinciğin bir kısmının da toplanması önerilir 1,8. CWD tanısı için, hem beyin sapı (obex) hem de retrofaringeal lenf nodları test edilmelidir, çünkü PrP Sc, obex9'da saptanabilir PrPSc olmayan lenfoid dokularda tespit edilebilir, Machado ve ark.10 tarafından gözden geçirilmiştir.
Beyin sapının obeks kısmı, tanısal TSE hedef bölgelerini, yani dorsal vagal çekirdeği (DVN), soliter sistem çekirdeğini (STN) ve trigeminal sinirin spinal sistem çekirdeğini (V) içerir. Bu alanlar, BSE ve klasik scrapie'nin erken evrelerinde bile sürekli olarak bilateral PrPSc birikimi gösterir. İleri TSE'nin klinik vakalarında, beyin sapındaki tüm gri cevher alanları yaygın PrPSc dağılımı gösterir11.
Bölümleme ve işlemeden önce, beyin örnekleri, otoliz seviyesini ve numunenin IHC tabanlı doğrulayıcı tanı için uygunluğunu potansiyel olarak tehlikeye atan herhangi bir doku hasarının varlığını belirlemek için değerlendirilir (Şekil 1)8. Hazırlayıcı protokollerin ve analitik sonuçların bütünlüğünü doğrulamak için, TSE pozitif ve negatif doku örnekleri, her tahlilde test durumlarından dokuların hazırlanması ile birlikte kontrol olarak dahil edilir.
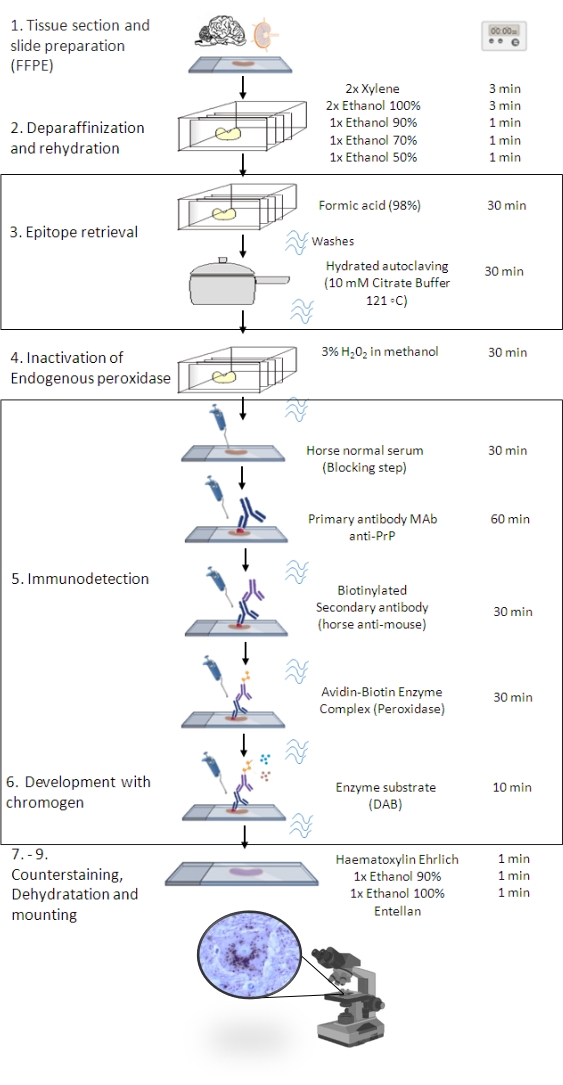
Resim 1: PrPSc IHC prosedürü. PrPSc IHC prosedürünün doku kesitlerinin deparafinizasyonundan nihai immünoboyama ve tespitine kadar adım adım sırasını gösteren gösterim (FFPE - Formalin-sabit parafin-gömülü; Mab - monoklonal antikor; DAB - 3,3' diaminobenzidin). Bu rakam BioRender.com yılında oluşturuldu. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Protokol
Burada açıklanan IHC prosedürü, FAIRJ-CT98-7021, "Ruminant TSE'nin gözetimi için bir Avrupa ağının kurulması ve şüpheli vakaların tanımlanması için süreç ve kriterlerin standardizasyonu ve uyumlaştırılması" araştırma projesinin bir bileşenidir. Dünya Hayvan Sağlığı Örgütü, WOAH (daha önce Office International des Épizooties, OIE olarak adlandırılmıştır)1 ve hayvan TSE'leri 8,11 için Avrupa Referans Laboratuvarı tarafından tanımlanan tanı kriterlerini takip etmektedir. Açıklanan IHC prosedürü ayrıca 2008 yılından beri NPISOIEC17025'e (test ve kalibrasyon laboratuvarlarının yeterliliği için genel şartlar) göre akredite edilmiştir. Bu akreditasyon, yönetim sisteminin etkinliğini artırmak, daha iyi sonuçlar elde etmek ve laboratuvar tehlikelerini önlemek için standart operasyonel prosedürleri, nitelikli personeli, doğru şekilde kalibre edilmiş ekipmanı, verilerin ve reaktiflerin sıkı kontrolünü, laboratuvarlar arası yeterlilik tahlillerine katılımı, uygun olmayan çalışmaları ve risk değerlendirmesini içeren yüksek kaliteli bir yönetim sistemi anlamına gelir. BSE, klasik scrapie, atipik scrapie ve CWD ile prion ile enfekte doku kontrolleri çeşitli kaynaklardan (formalin-sabit, parafin gömülü, FFPE) toplandı. Büyükbaş ve koyun bölümleri, bir hayvan TSE gözetim programı kapsamında teşhis edilen vakalardandır. CWD bölümleri, 2003 yılında Profesör Stefanie Czub (Kanada Gıda Denetim Ajansı, Ulusal Hayvan Hastalıkları Merkezi) tarafından sağlanan kontrol numunelerinden ve TSE'ler için Avrupa Referans Laboratuvarı (APHA, Weybridge) tarafından düzenlenen CWD Yeterlilik testi 2008'den alınmıştır.
1. Doku kesitleme ve slayt hazırlama
- Formalin ile sabitlenmiş, parafine gömülü (FFPE) dokuların kesitlerini bir mikrotom kullanarak 3-5 μm kalınlığında kesin.
- Kullanılan parafinin erime noktasının yaklaşık 10 °C altında bir sıcaklıkta arıtılmış su üzerine yüzdürülür. Bölümleri sudan özel olarak işlenmiş mikroskop slaytlarına kaldırın (bkz. Suyun slaytlardan iyice akmasına izin verin.
- Dokuların slayt yapışmasını arttırmak için slaytları gece boyunca 50 ° C'de inkübe edin.
NOT: TSE pozitif ve negatif kontrol kesitleri önceden hazırlanıp saklanabilse de, IHC protokolleri için taze kesitli dokuların hazırlanması tercih edilir. Adım 2 ila 4, kimyasal bir duman davlumbazında gerçekleştirilmelidir.
2. Deparafinizasyon ve rehidrasyon
- Slaytları doku bölümleriyle birlikte paslanmaz çelik bir boyama sepetine yerleştirin (bkz. Sepeti 3 dakika boyunca bir ksilen banyosuna (paslanmaz çelik boyama kabı) batırın, çıkarın ve bir kez daha daldırın.
- Ksilen ve rehidrat bölümlerini 3 dakika boyunca mutlak bir etanol banyosuna batırarak çıkarın. Çıkarın ve bir kez daha daldırın.
- Bölümleri hava ile kurutun ve 1 dakika boyunca% 90'lık bir etanol banyosuna yerleştirin. Bir dakika daha% 70 etanol banyosuna aktarın, ardından 1 dakika boyunca% 50 etanol banyosuna son bir transfer. Her etanol banyosu işlemi için, sürgü sepetini iki kez hafifçe çalkalayın ve bir sonraki transferden önce sepeti boşaltın.
3. Epitop geri alımı
- Doku kesitlerini oda sıcaklığında 30 dakika boyunca dikkatlice %98 formik aside batırın. Bölümleri musluk suyunda 5 dakika durulayın, ardından damıtılmış suda iki kez durulayın.
DİKKAT: Formik asit oldukça aşındırıcıdır. Koruyucu gözlük ve eldiven giyilmelidir. - Aşağıdaki adımları izleyerek Isıya Bağlı Antijen Geri Kazanımı (HIER) gerçekleştirin.
NOT: Bu adım, belirli bir basınç odasında 30 dakika boyunca 121 ° C'de hidratlanmış otoklavlama ile gerçekleştirilir ( bkz.- Sitrat tamponunu (10 mM, pH 6.1, bakınız Malzeme Tablosu) 98 °C'de, 500 mL damıtılmış su ile doldurulmuş basınç odasının içine yerleştirilmiş paslanmaz çelik bir boyama kabında yaklaşık 20 dakika önceden ısıtın.
NOT: Bu çalışma için, kullanılan belirli ekipman için program Ayar Noktası 1 (SP1) idi. - Alarm, ekipmanın programlanan zaman ve sıcaklığa ulaştığını gösterdikten sonra, sepeti slaytlarla daldırın ve programı Ayar Noktası 2'ye (30 dakika boyunca 121 ° C) başlatın. Kalite kontrol amacıyla, sıcaklık ve basıncı izlemek için sepete yapışkan otoklav gösterge bandının bir bölümünü yerleştirin ve bu programın ilk ve son basıncını kaydedin.
- İmmün boyalı slayt sayısı sepetin kapasitesine ulaşmazsa, boş pozisyonları işgal etmek için temiz, boş slaytlar kullanın. Program sona erdikten sonra, odanın ortam basıncına pasif geri dönüşüne izin verin (en az 30 dakika).
NOT: Daha uzun süreler, spesifik olmayan arka plan lekelenmesini azaltabilir. - Sürgü sepetini dikkatlice 5 dakika boyunca damıtılmış suyla doldurulmuş paslanmaz çelik bir boyama kabına aktarın.
- Sitrat tamponunu (10 mM, pH 6.1, bakınız Malzeme Tablosu) 98 °C'de, 500 mL damıtılmış su ile doldurulmuş basınç odasının içine yerleştirilmiş paslanmaz çelik bir boyama kabında yaklaşık 20 dakika önceden ısıtın.
4. Endojen peroksidazın inaktivasyonu
- Numune bölümlerini içeren sürgü sepetini 30 dakika boyunca metanol içinde% 3 hidrojen peroksit (H2O2) banyosuna batırın. Bölümleri akan su altında durulayın (5 dk). Bölümleri boşaltın ve 5 dakika daha 1x Tris tamponlu saline (TBS) batırın.
5. İmmün tespiti
NOT: Bu çalışma için, immün tespit, ticari olarak temin edilebilen bir slayt klipsi montaj sistemi kullanılarak kılcal boşluk formatı7 kullanılarak gerçekleştirilmiştir (bkz. Diğer immünohistokimya slayt sistemleri de uygulanabilir.
- Her slaytı, TBS ile önceden nemlendirilmiş ticari olarak temin edilebilen bir kapak plakası tutucusuna (bkz. Malzeme Tablosu) yerleştirin, kabarcıklardan kaçının, doku tarafı tutucuya bakacak ve sürgü kenarları tutucunun iki alt noktasıyla çakışacaktır.
- Slayt tutucu tertibatı, bir parmağınız numune slaytının üstünde, diğeri tutucunun altında olacak şekilde başparmak ile işaret parmağı arasında tutun. Ardından, montajı sistemin galerisine yerleştirin.
- Setin iyi monte edildiğinden emin olmak için, numune sürgüsü ile tutucu arasındaki kuyuyu, hemen taşmaması gereken TBS ile doldurun. Bu noktadan sonra, tutucu ile slayt arasında yaklaşık 80 μL TBS'nin tutulması gerektiğinden emin olun. Bölümlerin kurumasına izin vermeyin.
- Sisteme girdikten sonra, primer antikor (anti-PrP, bakınız Malzeme Tablosu) ile tedaviden önce arka plan boyanmasını azaltmak için, TBS'de 30 dakika boyunca immünoboyama için kullanılan sekonder antikor konakçısı ile aynı türden% 20 normal serum ile numune slaytlarını ön inkübe edin (mevcut durumda, at serumu).
- Analiz edilen hayvan türüne göre kullanılacak antikorun alikot sayısını, incelenecek örnek kesit sayısını ve çalışma seyreltme miktarını çözün.
NOT: En iyi sonuçlar için, ikincil antikor ve birincil antikor çözeltilerinin kaynağı olarak aynı türden% 10 normal serum kullanın. Mümkünse, en iyi sonuç için, normal serum ve ikincil antikorun konakçı kaynağı aynı türden olmalıdır. - Bölümleri yıkamadan, birincil antikor çözeltisini doğrudan (200 μL) sürgü tutucu setinin her bir kuyucuğuna uygulayın ve oda sıcaklığında 60 dakika boyunca inkübe edin.
- Yıkama için, sürgü tutucu setlerin kuyucuklarını TBS ile doldurun ve 5 dakika bekleyin.
- Biyotinile sekonder antikoru (monoklonal anti-murin Horse Ab, bakınız Malzeme Tablosu) TBS'de 1/200'de %10 at serumu ile seyreltin. Tedavi edilecek bölüm sayısına bağlı olarak gereken hacmi hazırlayın.
- İkincil antikor çözeltisini (200 μL) slayt tutucu setinin her bir kuyucuğuna uygulayın. Oda sıcaklığında 30 dakika inkübe edin.
- Adım 5.5'te açıklandığı gibi yıkayın.
- Avidin-biyotin kompleksi peroksidaz (ABC / HRP kompleksi, Malzeme Tablosuna bakınız) ile inkübasyon için, reaktifi kullanımdan 30 dakika önce hazırlayın. ABC/HRP kompleks çözeltisini (200 μL) kızaklı plaka tutucu setinin her bir kuyucuğuna uygulayın. Oda sıcaklığında 30 dakika inkübe edin.
- Adım 5.5'te açıklandığı gibi yıkayın.
6. DAB kromojeni ile geliştirme
DİKKAT: DAB potansiyel bir kanserojendir. Sonuç olarak, bu reaktifle çalışırken göz koruması, laboratuvar önlükleri, eldivenler ve iyi laboratuvar prosedürleri dahil olmak üzere uygun bakım gereklidir. Yerel yönetmeliklere uymayı elden çıkarın.
- Kromojeni kullanımdan hemen önce üreticinin talimatlarına göre seyreltin (bkz. Kromojen çözeltisini (400 μL) slayt plakası setinin her bir kuyucuğuna uygulayın.
- Oda sıcaklığında 30 dakikaya kadar inkübe edin. PrPSc pozitif bölümlerde genellikle 10 dakikalık bir kuluçka süresi yeterlidir.
- Slaytları damıtılmış suda yıkayarak artık kromojen çözeltisini çıkarın. Slaytları kapak plakası tutucularından çıkarın ve damıtılmış su içeren plastik bir kaba yerleştirin.
7. Hematoksilin karşı boyama
- Paslanmaz çelik boyama sepetini bölümlerle birlikte hematoksilin çözelti banyosuna (bakınız Malzeme Tablosu) 1 dakika boyunca daldırın. Soğuk akan suda 10 dakika veya ılık suda 5 dakika boyunca hafifçe durulayın.
- Bölümleri 1 dakika boyunca% 90 etanol içine yerleştirerek dehidrate edin, ardından 1 dakika boyunca mutlak etanol içinde bir banyo yapın. Ardından, slaytları 1 dakika boyunca bir ksilen banyosuna yerleştirin.
- Bölümleri ticari olarak temin edilebilen bir montaj ortamı ile monte edin (bkz.
NOT: Bu adımlar, oda sıcaklığında (19 °C-24 °C) kimyasal bir davlumbazda gerçekleştirilir. Bu prosedür, tüm adımların tamamlanmasını, kullanılan ekipmanı ve laboratuvar teknisyenini kaydetmek için bir test kaydı (Ek Dosya 1) içerir. Ek olarak, her bir tahlildeki bölüm sayısına, çalışma seyreltmelerine ve üreticinin talimatlarına göre reaktiflerin hacimlerini kolayca belirlemek ve oda sıcaklığını, ekipmanı ve reaktif partilerini kaydetmek için bir çalışma sayfası (Ek Dosya 2) tasarlanmıştır.
Sonuçlar
Spesifik olmayan hedef immünoetiketlemenin mümkün olduğu göz önüne alındığında, bilinen TSE-negatif kontrol hayvanlarında spesifik olmayan immünoetiketleme seviyesinin belirlenmesi önemlidir. Bu, spesifik PrPSc immünoetiketleme7'yi doğru bir şekilde yorumlamak için önemli bir adımdır (Şekil 2). Anti-PrP antikorları tarafından hedef dışı etiketlemenin, ayrık intranöronal ince partikül boyama (hipoglossal çekirdekte ve...
Tartışmalar
TSE'ler potansiyel zoonotik hastalıklardır. 1986 yılında Birleşik Krallık'ta BSE'nin ortaya çıkmasından sonra Portekiz, bu hastalığın görülme sıklığı14,15 olan Avrupa Birliği Üye Devletlerinden biri haline gelmiştir. Bu hastalığın kontrol altına alınması için ortaya çıkan diğer TSE'ler (klasik ve atipik scrapie, BSE varyantları ve günümüzde servidlerde kronik israf hastalığının sürveyansı), Gıda ve Veterinerlik Genel Müd...
Açıklamalar
Yazarların açıklayacak hiçbir şeyi yok.
Teşekkürler
Bu makale, FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020 tarafından desteklenen POCI-01-0145-FEDER-029947 "Portekiz'de kronik israf hastalığı risk değerlendirmesi" Projesi tarafından finanse edilmiştir. Ayrıca, CECAV araştırma biriminin yazarları, UIDB / CVT / 0772/2020 projesi kapsamında FCT'den fon aldı.Batı Bölgesel Araştırma Merkezi, USDA, Araştırma Direktörü (emekli) Bruce C. Campbell'e yardımları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Referanslar
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır