Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Détection de la protéine prion anormale par immunohistochimie
Dans cet article
Résumé
L’immunomarquage de la protéine prion anormale à l’aide de protocoles d’immunohistochimie nécessite des méthodologies spécifiques de préparation d’échantillons et d’anticorps anti-PrP. Le présent protocole décrit les étapes clés du démasquage des épitopes pour assurer un immunomarquage approprié de la PrP et minimiser la coloration de fond non spécifique. De plus, cette approche tient compte des mesures de biosécurité lors de la réalisation d’études immunohistochimiques avec les tissus infectés par des prions.
Résumé
Les protéines prions anormales (PrPSc) sont l’isoforme associée à la maladie de la protéine prion cellulaire et les marqueurs diagnostiques des encéphalopathies spongiformes transmissibles (EST). Ces maladies neurodégénératives affectent les humains et plusieurs espèces animales et comprennent la tremblante du mouton, l’encéphalopathie spongiforme bovine (ESB), la maladie débilitante chronique des cervidés (MDC) et la maladie à prions du chameau (MPC) nouvellement identifiée. Le diagnostic des EST repose sur l’immunodétection de la PrPSc par application de méthodes d’immunohistochimie (IHC) et d’immunoblot occidental (WB) sur les tissus de l’encéphale, à savoir le tronc cérébral (niveau obex). L’IHC est une méthode largement utilisée qui utilise des anticorps primaires (monoclonaux ou polyclonaux) contre les antigènes d’intérêt dans les cellules d’une section de tissu. La liaison anticorps-antigène peut être visualisée par une réaction de couleur qui reste localisée dans la zone du tissu ou de la cellule où l’anticorps a été ciblé. Ainsi, dans les maladies à prions, comme dans d’autres domaines de recherche, les techniques d’immunohistochimie ne sont pas uniquement utilisées à des fins diagnostiques, mais aussi dans les études de pathogenèse. Ces études consistent à détecter les profils et les typesPrP Sc à partir de ceux décrits précédemment afin d’identifier les nouvelles souches de prions. Comme l’ESB peut infecter les humains, il est recommandé d’utiliser des installations et/ou des pratiques de laboratoire de biosécurité de niveau 3 (BSL-3) pour manipuler des échantillons de bovins, de petits ruminants et de cervidés inclus dans la surveillance des EST. De plus, il est recommandé d’installer de l’équipement de confinement et de l’équipement dédié aux prions, dans la mesure du possible, afin de limiter la contamination. La procédurePrP Sc IHC consiste en une étape de démasquage de l’épitope de l’acide formique agissant également comme une mesure d’inactivation des prions, car les tissus fixés au formol et incorporés à la paraffine utilisés dans cette technique restent infectieux. Lors de l’interprétation des résultats, il faut veiller à distinguer l’immunomarquage non spécifique du marquage cible. À cette fin, il est important de reconnaître les artefacts d’immunomarquage obtenus chez des animaux témoins EST négatifs connus afin de les différencier des types d’immunomarquagePrP Sc spécifiques, qui peuvent varier entre les souches d’EST, les espèces hôtes et le génotype prnp , décrits plus en détail dans le présent document.
Introduction
Selon l’hypothèse du prion, l’isoforme anormale (PrPSc) est le composant principal, ou unique, de l’agent infectieux dans les encéphalopathies spongiformes transmissibles (EST). La confirmation du diagnostic des EST repose sur l’immunodétection de la PrPSc par application de protocoles d’immunohistochimie (IHC) et/ou de méthodes d’immunotransfert occidental (WB) des tissus de l’encéphale1.
L’IHC est une méthode utilisant des anticorps monoclonaux ou, dans certains cas, polyclonaux (comme anticorps primaires) comme première étape dans l’immunomarquage d’antigènes d’intérêt spécifiquement ciblés situés dans les cellules d’une section de tissu. Toute liaison anticorps-antigène primaire efficace est ensuite visualisée à l’aide d’anticorps secondaires spécifiques aux anticorps primaires. Ces anticorps secondaires sont conjugués à des enzymes, telles que la peroxydase de raifort (HRP) ou la phosphatase alcaline (AP). La visualisation est ensuite réalisée en ajoutant un substrat à ces enzymes, produisant des produits de couleur insolubles localisés dans les zones où les anticorps primaires sont liés aux antigènes ciblés. Une meilleure visualisation peut être obtenue par contre-coloration, dans laquelle un colorant est utilisé pour créer un contraste entre les tissus immunomarqués et non immunomarqués2.
Avec l’IHC utilisant des tissus incorporés à la paraffine fixés au formol (FFPE), la fixation du formol peut annuler l’efficacité des anticorps primaires en raison de la réticulation par le formaldéhyde et du chauffage et de la déshydratation pendant l’incorporation de la paraffine. Ceux-ci modifient la conformation des protéines, détruisant, dénaturant ou masquant les épitopes, diminuant ou abrogeant ainsi leur détection3. En tant que tel, cela nécessite la récupération d’antigènes (AR). Les techniques AR perturbent la réticulation du groupe chimique lié au formaldéhyde dans les molécules antigéniques, restaurant ou démasquant ainsi la conformation antigène-protéine d’origine. Il en résulte la récupération de l’affinité anticorps-antigène (épitope) pour l’immunomarquage. L’efficacité éventuelle de l’EI dépend des qualités de l’antigène ciblé et/ou de l’anticorps primaire2.
La récupération de l’antigène (épitope) induite par la chaleur (HIER) est une procédure du RA3 et est couramment utilisée pour la détection de laPrP Sc IHC, comme décrit ici. L’IHC est essentielle pour le diagnostic et utilisée dans les laboratoires de recherche pour déterminer la distribution tissulaire d’un antigène associé à une pathologie. Il est largement utilisé dans le diagnostic et la recherche sur le cancer, les neurosciences et les maladies infectieuses4, entre autres. Pour les EST, l’IHC joue un rôle important dans le diagnostic et la recherche pour confirmer et étudier la distribution dePrP Sc dans les hôtes naturels et les modèles expérimentaux. IHC contribue aux études de pathogenèse des prions et à l’analyse des types et des profils de dépôt dePrP Sc , notamment dans les tissus neuraux5, afin de détecter les écarts par rapport aux infections décrites systématiquement et d’identifier les nouvelles souches présumées de prions.
Étant donné que les prions de l’encéphalopathie spongiforme bovine (ESB) peuvent infecter les humains, certains protocoles de laboratoire impliqués dans le travail avec l’ESB peuvent nécessiter l’utilisation d’installations et de pratiques BSL-36. Il s’agit notamment de l’utilisation d’un contenant secondaire scellé pour transporter des échantillons de tissus potentiellement infectés par l’ESB à l’intérieur de l’institut et du laboratoire. Il comprend également la désignation de zones de confinement et d’équipement dédié aux prions pour la recherche et l’analyse de l’ESB, dans la mesure du possible. Ceci est fait pour prévenir la contamination à l’extérieur de la zone de travail et fournir un espace confiné puisque des procédures de décontamination deviennent nécessaires.
Par conséquent, le Laboratoire de pathologie de l’INIAV suit les installations et les pratiques recommandées de niveau de biosécurité 3 (BSL-3)6 pour gérer les échantillons potentiels de tissus infectés par des prions provenant de bovins, de petits ruminants et de cervidés associés à la surveillance des EST.
Les tissus fixés au formol et incorporés dans la paraffine inclus dans les procédures de diagnostic ou de recherche sur les EST, en particulier dans le système nerveux central, peuvent être potentiellement infectieux. Par conséquent, ces tissus fixes doivent être traités avec de l’acide formique pour réduire l’infectiosité des prions, s’ils sont présents, avant le traitement des tissus. Ceci est effectué en plaçant des tissus fixes et coupés (environ 2-4 mm d’épaisseur) dans une cassette de traitement. La cassette est ensuite immergée dans de l’acide formique à 98% (pendant 1 h). Après immersion, les cassettes avec des mouchoirs sont lavées à l’eau courante du robinet pendant 30 minutes et retournées au fixateur avant un traitement ultérieur. Si les coupes de tissus ne sont pas traitées avant le traitement, les coupes de tissus post-microtomiques doivent être immergées dans de l’acide formique non dilué pendant au moins 5 minutes avant coloration histologique7. Le protocole IHC pour PrPSc comprend une étape de démasquage systématique des épitopes de l’acide formique, servant également à inactiver les prions7. Après ces étapes d’inactivation des prions, les tissus fixes résultants peuvent ensuite être traités à BSL-2 en utilisant les pratiques standard BSL-2.
L’exigence minimale d’échantillonnage tissulaire pour le diagnostic des EST chez tout animal inclus dans la surveillance des EST est la collecte du tronc cérébral (au niveau obex). En outre, pour détecter l’ESB atypique et la tremblante, il est conseillé de prélever également une partie du cervelet 1,8. Pour le diagnostic de la MDC, les ganglions lymphatiques du tronc cérébral (obex) et du rétropharynx doivent être testés, car la PrP Sc pourrait être détectée dans les tissus lymphoïdes sans PrPSc détectable dans l’obex9, examinée par Machado et coll.10.
La partie obex du tronc cérébral comprend les sites cibles diagnostiques des EST, à savoir le noyau vagal dorsal (DVN), le noyau solitaire (STN) et le noyau du tractus rachidien du nerf trijumeau (V). Ces zones présentent systématiquement une accumulation bilatérale de PrPSc , même aux premiers stades de l’ESB et de la tremblante classique. Dans les cas cliniques d’EST avancée, toutes les zones de matière grise du tronc cérébral présentent une distribution étendue de PrPSc 11.
Avant la section et le traitement, les échantillons de cerveau sont évalués (Figure 1) pour déterminer le niveau d’autolyse et la présence de toute lésion tissulaire susceptible de compromettre l’adéquation de l’échantillon pour un diagnostic de confirmation basé sur l’IHC8. Pour valider l’intégrité des protocoles de préparation et des résultats d’analyse, les échantillons de tissus positifs et négatifs aux EST sont inclus comme témoins en conjonction avec la préparation de tissus à partir de cas d’essai dans chaque essai.
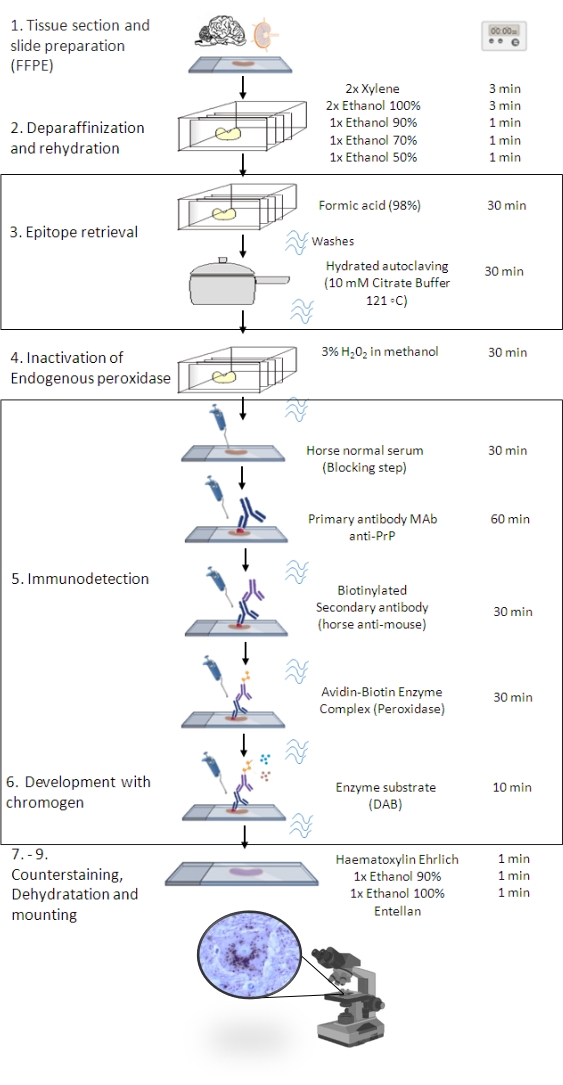
Figure 1 : La procédurePrP Sc IHC. Représentation montrant la séquence étape par étape de la procédurePrP Sc IHC depuis la déparaffinisation des coupes tissulaires jusqu’à l’immunomarquage et la détection éventuels (FFPE - Paraffine fixée au formol - Embedded de paraffine; Mab - anticorps monoclonal; DAB - 3,3' diaminobenzidine). Cette figure a été créée en BioRender.com. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
La procédure IHC décrite ici est une composante du projet de recherche FAIRJ-CT98-7021, « La création d’un réseau européen pour la surveillance des EST des ruminants et la normalisation et l’harmonisation du processus et des critères pour l’identification des cas suspects ». Il suit les critères diagnostiques définis par l’Organisation mondiale de la santé animale, WOAH (anciennement Office international des épizooties, OIE)1 et le Laboratoire européen de référence pour les EST animales 8,11. La procédure IHC décrite est également accréditée selon NPISOIEC17025 (exigences générales relatives à la compétence des laboratoires d’étalonnages et d’essais) depuis 2008. Une telle accréditation implique un système de gestion de haute qualité intégrant des procédures opérationnelles normalisées, un personnel qualifié, un équipement étalonné avec précision, un contrôle rigoureux des données et des réactifs, la participation à des essais de compétence interlaboratoires, des travaux non conformes et une évaluation des risques pour accroître l’efficacité du système de gestion, obtenir de meilleurs résultats et prévenir les risques en laboratoire. Des témoins tissulaires infectés par des prions atteints d’ESB, de tremblante classique, de tremblante atypique et de MDC ont été recueillis (fixés au formol, incorporés à la paraffine, FFPE) auprès de diverses sources. Les sections bovine et ovine proviennent des cas diagnostiqués dans le cadre d’un programme de surveillance des EST animales. Les sections de MDC proviennent des échantillons témoins aimablement fournis par le professeur Stefanie Czub (Agence canadienne d’inspection des aliments, National Center for Animal Diseases) en 2003 et des essais d’aptitude à la MDC 2008 organisés par le Laboratoire européen de référence pour les EST (APHA, Weybridge).
1. Sectionnement des tissus et préparation des lames
- Couper des sections de tissus fixés au formol et incorporés à la paraffine (FFPE) à une épaisseur de 3 à 5 μm à l’aide d’un microtome.
- Faire flotter des sections sur de l’eau purifiée à une température inférieure d’environ 10 °C au point de fusion de la paraffine utilisée. Soulevez les sections de l’eau sur des lames de microscope spécialement traitées (voir le tableau des matériaux). Laissez l’eau s’écouler complètement des glissades.
- Incuber les lames pendant une nuit à 50 °C pour améliorer l’adhérence des tissus.
REMARQUE : Il est préférable de préparer des tissus fraîchement sectionnés pour les protocoles IHC, bien que les sections de contrôle positif et négatif des EST puissent être préparées à l’avance et entreposées. Les étapes 2 à 4 doivent être effectuées dans une hotte chimique.
2. Désaffinisation et réhydratation
- Placez les lames avec les sections de tissu dans un panier de coloration en acier inoxydable (voir le tableau des matériaux). Plongez le panier dans un bain de xylène (contenant de coloration en acier inoxydable) pendant 3 min, retirez-le et plongez à nouveau.
- Enlever le xylène et réhydrater les sections en les immergeant dans un bain d’éthanol absolu pendant 3 min. Retirez et immergez à nouveau.
- Sécher les sections à l’air libre et placer dans un bain d’éthanol à 90% pendant 1 min. Transférer dans un bain d’éthanol à 70% pendant une minute, suivi d’un transfert final dans un bain d’éthanol à 50% pendant 1 min. Pour chaque traitement de bain à l’éthanol, agiter doucement le panier coulissant deux fois et égoutter le panier avant le prochain transfert.
3. Récupération des épitopes
- Immerger délicatement les coupes de tissu dans de l’acide formique à 98% à température ambiante pendant 30 min. Rincer les sections à l’eau du robinet pendant 5 min, puis rincer deux fois à l’eau distillée.
ATTENTION : L’acide formique est très corrosif. Des lunettes de protection et des gants doivent être portés. - Effectuez le prélèvement d’antigènes induits par la chaleur (HIER) en suivant les étapes ci-dessous.
NOTE: Cette étape est réalisée par autoclavage hydraté à 121 °C pendant 30 min dans une chambre de pression spécifique (voir le tableau des matériaux).- Préchauffer le tampon de citrate (10 mM, pH 6,1, voir le tableau des matériaux) à 98 °C pendant environ 20 minutes dans un récipient de coloration en acier inoxydable placé à l’intérieur de la chambre de pression remplie de 500 ml d’eau distillée.
NOTE : Pour la présente étude, le point de consigne du programme était de 1 (SP1) pour l’équipement spécifique utilisé. - Une fois que l’alarme indique que l’équipement a atteint le temps et la température programmés, immergez le panier avec des diapositives et lancez le programme jusqu’au point de consigne 2 (121 ° C pendant 30 min). À des fins de contrôle de la qualité, placez une section de ruban indicateur adhésif pour autoclave sur le panier pour surveiller la température et la pression, et notez la pression initiale et finale de ce programme.
- Si le nombre de lames à immunocolorer n’atteint pas la capacité du panier, utilisez des lames propres et vierges pour occuper les positions vides. Une fois le programme terminé, permettre le retour passif de la chambre à la pression ambiante (au moins 30 min).
REMARQUE : Des durées plus longues peuvent réduire les taches de fond non spécifiques. - Transférer délicatement le panier coulissant dans un récipient de teinture en acier inoxydable rempli d’eau distillée pendant 5 min.
- Préchauffer le tampon de citrate (10 mM, pH 6,1, voir le tableau des matériaux) à 98 °C pendant environ 20 minutes dans un récipient de coloration en acier inoxydable placé à l’intérieur de la chambre de pression remplie de 500 ml d’eau distillée.
4. Inactivation de la peroxydase endogène
- Plonger le panier à lames contenant les sections d’échantillon dans un bain de peroxyde d’hydrogène à 3 % (H2O2) dans du méthanol pendant 30 min. Rincer les sections sous l’eau courante (5 min). Égoutter et immerger les sections dans 1x solution saline tamponnée Tris (TBS) pendant 5 minutes supplémentaires.
5. Immunodétection
REMARQUE : Pour la présente étude, l’immunodétection a été réalisée à l’aide du formatd’écart capillaire 7 à l’aide d’un système d’assemblage de clips à glissière disponible dans le commerce (voir le tableau des matériaux). D’autres systèmes de lames d’immunohistochimie sont également applicables.
- Placez chaque lame sur un support de plaque de couverture disponible dans le commerce (voir le tableau des matériaux) pré-humidifié avec TBS, en évitant les bulles, avec le côté du tissu face au support et les bords de la glissière coïncidant avec les deux points inférieurs du support.
- Tenez le porte-lames entre le pouce et l’index, avec un doigt sur le dessus de la lame d’échantillon et l’autre sur le bas du support. Ensuite, placez l’assemblage dans la galerie du système.
- Pour vous assurer que l’ensemble est bien assemblé, remplissez le puits entre la lame d’échantillon et le support avec TBS, qui ne doit pas déborder immédiatement. À partir de ce moment, assurez-vous qu’environ 80 μL de TBS doivent être retenus entre le support et la lame. Ne laissez pas sécher les sections.
- Une fois dans le système, pour diminuer la coloration de fond avant le traitement avec des anticorps primaires (anti-PrP, voir le tableau des matériaux), pré-incuber les lames d’échantillon avec 20% de sérum normal de la même espèce que l’anticorps secondaire hôte utilisé pour l’immunomarquage (dans le cas présent, sérum de cheval) pendant 30 minutes dans TBS.
- Décongeler le nombre d’aliquotes d’anticorps à utiliser en fonction de l’espèce animale analysée, le nombre de sections d’échantillons à examiner et la quantité de dilution de travail.
REMARQUE: Pour de meilleurs résultats, utilisez 10% de sérum normal de la même espèce que la source de l’anticorps secondaire et des solutions d’anticorps primaires. Si possible, pour de meilleurs résultats, la source hôte du sérum normal et de l’anticorps secondaire doit provenir de la même espèce. - Sans laver les sections, appliquer la solution d’anticorps primaires directement (200 μL) dans chaque puits du jeu de porte-lames et incuber pendant 60 min à température ambiante.
- Pour le lavage, remplissez les puits des ensembles de porte-glissières avec TBS et attendez 5 minutes. Répétez deux fois.
- Diluer l’anticorps secondaire biotinylé (monoclonal anti-murin Horse Ab, voir tableau des matériaux) à 1/200 dans TBS avec 10% de sérum de cheval. Préparer le volume requis en fonction du nombre de sections à traiter.
- Appliquer la solution d’anticorps secondaires (200 μL) à chaque puits du jeu de porte-lames. Incuber pendant 30 min à température ambiante.
- Laver comme décrit à l’étape 5.5.
- Pour l’incubation avec la peroxydase du complexe avidine-biotine (complexe ABC/HRP, voir le tableau des matières), préparer le réactif 30 minutes avant utilisation. Appliquer la solution complexe ABC/HRP (200 μL) dans chaque puits du support de plaque coulissante. Incuber pendant 30 min à température ambiante.
- Laver comme décrit à l’étape 5.5.
6. Développement avec le chromogène DAB
ATTENTION : Le DAB est un cancérogène potentiel. Par conséquent, des soins appropriés sont nécessaires lors du travail avec ce réactif, y compris une protection oculaire, des blouses de laboratoire, des gants et de bonnes procédures de laboratoire. Éliminez les réglementations locales suivantes.
- Diluer le chromogène conformément aux instructions du fabricant (voir le tableau des matériaux) immédiatement avant utilisation. Appliquer la solution chromogène (400 μL) sur chaque puits du jeu de plaques coulissantes.
- Incuber jusqu’à 30 min à température ambiante. Dans les coupesPrP Sc positives, une période d’incubation de 10 minutes est généralement suffisante.
- Retirez la solution chromogène résiduelle en lavant les lames dans de l’eau distillée. Retirez les lames des supports de plaque de recouvrement et placez-les dans un récipient en plastique contenant de l’eau distillée.
7. Contre-coloration de l’hématoxyline
- Immerger le panier de coloration en acier inoxydable avec les sections dans le bain de solution d’hématoxyline (voir tableau des matériaux) pendant 1 min. Rincer doucement à l’eau courante froide pendant 10 min ou à l’eau tiède pendant 5 min.
- Déshydrater les sections en les plaçant dans de l’éthanol à 90% pendant 1 min, suivi d’un bain dans de l’éthanol absolu pendant 1 min. Ensuite, placez les lames dans un bain de xylène pendant 1 min.
- Montez les sections avec un support de montage disponible dans le commerce (voir le tableau des matériaux).
NOTE: Ces étapes sont effectuées dans une hotte chimique à température ambiante (19 °C-24 °C). Cette procédure comprend un dossier d’essai (dossier supplémentaire 1) pour consigner l’achèvement de toutes les étapes, l’équipement utilisé et le technicien de laboratoire. De plus, une feuille de travail (dossier supplémentaire 2) a été conçue pour déterminer facilement les volumes des réactifs en fonction du nombre de sections dans chaque essai, des dilutions de travail et des instructions du fabricant, ainsi que pour enregistrer la température ambiante, l’équipement et les lots de réactifs.
Résultats
Étant donné qu’un immunomarquage ciblé non spécifique est possible, il est important de déterminer le niveau d’immunomarquage non spécifique chez les animaux témoins EST négatifs connus. Il s’agit d’une étape importante pour interpréter correctement l’immunomarquage spécifique de PrPSc 7 (Figure 2). On a noté que le marquage non ciblé par les anticorps anti-PrP se présentait sous la forme d’une coloration intraneuronale d...
Discussion
Les EST sont des zoonoses potentielles. Après l’apparition de l’ESB en 1986 au Royaume-Uni, le Portugal est devenu l’un des États membres de l’Union européenne où l’incidence de cette maladie était la plus élevée14,15. Afin de lutter contre cette maladie, d’autres EST qui ont émergé (tremblante classique et atypique, variantes de l’ESB, et actuellement la surveillance de la maladie débilitante chronique chez les cervidés), des mécanismes...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cet article a été financé par le projet POCI-01-0145-FEDER-029947 « Évaluation du risque de maladie débilitante chronique au Portugal » soutenu par FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020. Aussi, les auteurs de l’unité de recherche CECAV ont reçu un financement de la FCT, dans le cadre du projet UIDB/CVT/0772/2020.Nous remercions Bruce C. Campbell, directeur de recherche (retraité), Western Regional Research Center, USDA, pour son aide.
matériels
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Références
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon