È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Rilevazione di proteine prioniche anomale mediante immunoistochimica
In questo articolo
Riepilogo
L'immunomarcatura della proteina prionica anomala utilizzando protocolli immunoistochimici richiede specifiche metodologie di preparazione di campioni e anticorpi anti-PrP. Il presente protocollo descrive i passaggi chiave del demasking degli epitopi per garantire una corretta etichettatura immunologica della PrP e per ridurre al minimo la colorazione di fondo non specifica. Inoltre, questo approccio considera le misure di biosicurezza quando si conducono studi di immunoistochimica con i tessuti infetti da prioni.
Abstract
Le proteine prioniche anomale (PrPSc) sono l'isoforma associata alla malattia della proteina prionica cellulare e i marcatori diagnostici delle encefalopatie spongiformi trasmissibili (TSE). Queste malattie neurodegenerative colpiscono l'uomo e diverse specie animali e comprendono la scrapie, l'encefalopatia spongiforme bovina zoonotica (BSE), la malattia del deperimento cronico dei cervidi (CWD) e la malattia da prioni del cammello (CPD) recentemente identificata. La diagnosi di TSE si basa sull'immunorilevazione della PrPSc mediante l'applicazione sia dell'immunoistochimica (IHC) che dei metodi immunoblot occidentali (WB) sui tessuti dell'encefalo, vale a dire il tronco cerebrale (livello obex). IHC è un metodo ampiamente utilizzato che utilizza anticorpi primari (monoclonali o policlonali) contro antigeni di interesse nelle cellule di una sezione tissutale. Il legame anticorpo-antigene può essere visualizzato da una reazione di colore che rimane localizzata nell'area del tessuto o della cellula in cui l'anticorpo è stato preso di mira. Pertanto, nelle malattie da prioni, come in altri campi di ricerca, le tecniche di immunoistochimica non sono utilizzate solo per scopi diagnostici, ma anche negli studi di patogenesi. Tali studi prevedono la rilevazione dei modelli e dei tipi di PrPSc da quelli precedentemente descritti per identificare i nuovi ceppi prionici. Poiché la BSE può infettare l'uomo, si raccomanda di utilizzare strutture e/o pratiche di laboratorio di biosicurezza di livello 3 (BSL-3) per manipolare campioni di bovini, piccoli ruminanti e cervidi inclusi nella sorveglianza delle TSE. Inoltre, si raccomandano attrezzature di contenimento e dedicate ai prioni, quando possibile, per limitare la contaminazione. La procedura PrPSc IHC consiste in una fase di epitopo dell'acido formico che agisce anche come misura di inattivazione dei prioni, poiché i tessuti fissati in formalina e incorporati in paraffina utilizzati in questa tecnica rimangono infettivi. Nell'interpretare i risultati, è necessario prestare attenzione a distinguere l'immunomarcatura non specifica dall'etichettatura target. A tal fine, è importante riconoscere gli artefatti dell'immunomarcatura ottenuti in animali di controllo TSE-negativi noti per differenziarli da specifici tipi di immunomarcatura PrPSc , che possono variare tra ceppi di TSE, specie ospiti e genotipo prnp , ulteriormente descritti nel presente documento.
Introduzione
Secondo l'ipotesi prionica, l'isoforma anomala (PrPSc) è l'unico componente primario dell'agente infettivo nelle encefalopatie spongiformi trasmissibili (TSE). La conferma per la diagnosi di TSE si basa sull'immunorilevazione della PrPSc mediante l'applicazione di protocolli immunoistochimici (IHC) e/o metodi immunoblot occidentali (WB) dei tessuti dell'encefalo1.
L'IHC è un metodo che impiega anticorpi monoclonali o, in alcuni casi, policlonali (come anticorpi primari) come primo passo nell'immunocolorazione di antigeni di interesse specificamente mirati situati nelle cellule di una sezione tissutale. Qualsiasi legame efficace anticorpo-antigene primario viene quindi visualizzato utilizzando anticorpi secondari specifici per gli anticorpi primari. Questi anticorpi secondari sono coniugati agli enzimi, come la perossidasi di rafano (HRP) o la fosfatasi alcalina (AP). La visualizzazione si ottiene quindi aggiungendo un substrato a questi enzimi, producendo prodotti di colore insolubili localizzati in aree in cui gli anticorpi primari sono legati agli antigeni bersaglio. Una migliore visualizzazione può essere ottenuta contrastando, in cui un colorante viene utilizzato per creare un contrasto tra tessuto immunomarcato e non immunomarcato2.
Con IHC che utilizza tessuti incorporati in paraffina fissati in formalina (FFPE), la fissazione della formalina può annullare l'efficacia degli anticorpi primari a causa della reticolazione mediante formaldeide e riscaldamento e disidratazione durante l'incorporazione di paraffina. Questi modificano la conformazione delle proteine, distruggendo, denaturando o mascherando gli epitopi, diminuendo o abrogando così la loro rilevazione3. Come tale, ciò richiede il recupero dell'antigene (AR). Le tecniche AR interrompono il cross-linking dei gruppi chimici correlati alla formaldeide nelle molecole antigeniche, ripristinando o smascherando così la conformazione originale antigene-proteina. Ciò si traduce nel recupero dell'affinità anticorpo-antigene (epitopo) per l'immunomarcatura. L'eventuale efficacia dell'AR dipende dalle qualità dell'antigene bersaglio e/o dell'anticorpo primario2.
Il recupero dell'antigene indotto dal calore (epitopo) (HIER) è una procedura di AR3 e viene utilizzato di routine per il rilevamento di PrPSc IHC, come descritto nel presente documento. L'IHC è essenziale per la diagnosi e viene utilizzato nei laboratori di ricerca per determinare la distribuzione tissutale di un antigene associato alla patologia. È ampiamente usato nella diagnosi e nella ricerca di cancro, neuroscienze e malattie infettive4, tra gli altri. Per le TSE, l'IHC svolge un ruolo importante nella diagnosi e nella ricerca per confermare e studiare la distribuzione di PrPSc negli ospiti naturali e nei modelli sperimentali. IHC contribuisce agli studi sulla patogenesi prionica e all'analisi dei tipi e dei modelli di deposizione di PrPSc , vale a dire, nei tessuti neurali5, per rilevare deviazioni dalle infezioni descritte di routine e identificare nuovi ceppi prionici putativi.
Poiché i prioni dell'encefalopatia spongiforme bovina (BSE) possono infettare l'uomo, alcuni protocolli di laboratorio coinvolti nel lavoro con la BSE possono richiedere l'uso di strutture e pratiche BSL-36. Questi includono l'uso di un contenitore secondario sigillato per trasportare potenziali campioni di tessuto infetto da BSE all'interno dell'istituto e del laboratorio. Comprende anche la designazione di aree di contenimento e attrezzature dedicate ai prioni per la ricerca e l'analisi della BSE ogniqualvolta possibile. Questo viene fatto per prevenire la contaminazione al di fuori dell'area di lavoro e fornire uno spazio ristretto poiché le procedure di decontaminazione diventano necessarie.
Di conseguenza, il Laboratorio di Patologia dell'INIAV segue le strutture e le pratiche raccomandate di livello 3 di biosicurezza (BSL-3)6 per gestire potenziali campioni di tessuti infetti da prioni di bovini, piccoli ruminanti e cervidi associati alla sorveglianza delle TSE.
I tessuti fissati in formalina e incorporati in paraffina inclusi nelle procedure diagnostiche o di ricerca sulle TSE, specialmente nel sistema nervoso centrale, possono essere potenzialmente infettivi. Quindi, questi tessuti fissi devono essere trattati con acido formico per ridurre l'infettività dei prioni, se presenti, prima della lavorazione dei tessuti. Questo viene eseguito posizionando tessuti fissi e rifilati (circa 2-4 mm di spessore) in una cassetta di lavorazione. La cassetta viene quindi immersa in acido formico al 98% (per 1 ora). Dopo l'immersione, le cassette con i fazzoletti vengono lavate in acqua corrente del rubinetto per 30 minuti e restituite al fissativo prima di ulteriori elaborazioni. Se le sezioni di tessuto non vengono trattate prima della lavorazione, le sezioni di tessuto post-microtomico devono essere immerse in acido formico non diluito per almeno 5 minuti prima della colorazione istologica7. Il protocollo IHC per PrPSc include una fase di routine di epitopo dell'acido formico, che serve anche a inattivare i prioni7. Dopo queste fasi di inattivazione dei prioni, i tessuti fissi risultanti possono quindi essere elaborati a BSL-2 utilizzando pratiche standard BSL-2.
Il requisito minimo di campionamento dei tessuti per la diagnosi di TSE in qualsiasi animale incluso nella sorveglianza delle TSE è la raccolta del tronco encefalico (a livello dell'obex). Inoltre, per rilevare BSE e scrapie atipiche, si consiglia di raccogliere anche una parte del cervelletto 1,8. Per la diagnosi di CWD, sia il tronco encefalico (obex) che i linfonodi retrofaringei dovrebbero essere testati poiché PrP Sc potrebbe essere rilevato nei tessuti linfoidi senza PrPSc rilevabile nell'obex9, esaminato da Machado et al.10.
La porzione obex del tronco encefalico comprende siti bersaglio diagnostici TSE, vale a dire il nucleo vagale dorsale (DVN), il nucleo del tratto solitario (STN) e il nucleo del tratto spinale del nervo trigemino (V). Queste aree presentano costantemente un accumulo bilaterale di PrPSc , anche nelle prime fasi della BSE e della scrapie classica. Nei casi clinici di TSE avanzata, tutte le aree della materia grigia all'interno del tronco encefalico mostrano una diffusa distribuzione di PrPSc 11.
Prima del sezionamento e dell'elaborazione, i campioni cerebrali vengono valutati (Figura 1) per accertare il livello di autolisi e la presenza di eventuali danni tissutali che potrebbero compromettere l'idoneità del campione per la diagnosi di conferma basata su IHC8. Per convalidare l'integrità dei protocolli preparativi e dei risultati analitici, i campioni di tessuto positivo e negativo alla TSE sono inclusi come controlli in combinazione con la preparazione dei tessuti dai casi di prova in ciascun test.
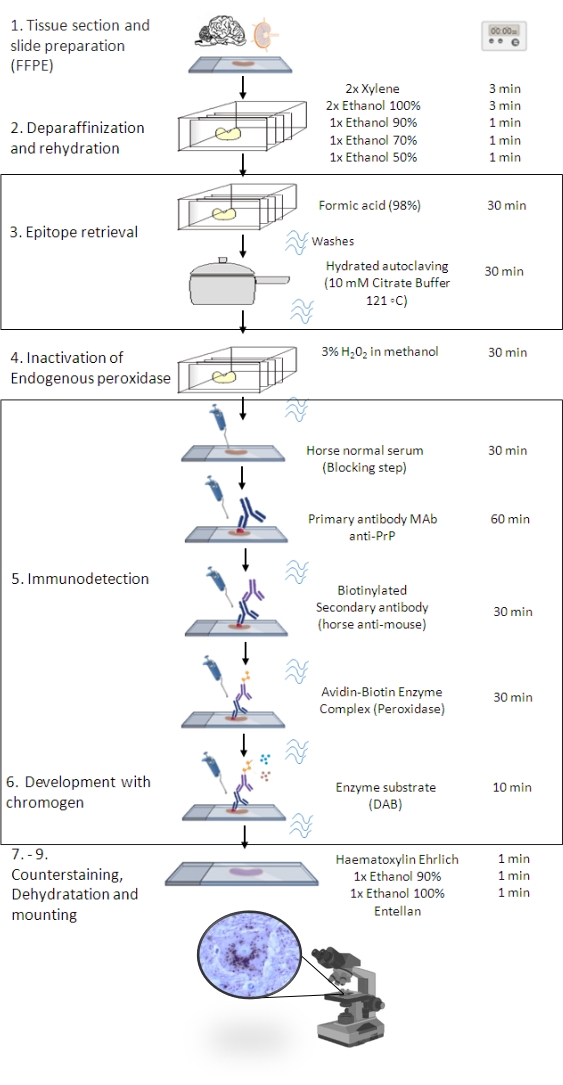
Figura 1: La procedura PrPSc IHC. Rappresentazione che mostra la sequenza passo-passo della procedura PrPSc IHC dalla deparaffinizzazione di sezioni tissutali all'eventuale immunocolorazione e rilevazione (FFPE - Formalin-fixed paraffin-embedded; Mab - anticorpo monoclonale; DAB - 3,3' diaminobenzidina). Questa figura è stata creata nel BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocollo
La procedura IHC qui descritta è una componente del progetto di ricerca FAIRJ-CT98-7021, "The establishment of a European network for the surveillance of ruminant TSE and the standardization and harmonization of the process and criteria for the identification of suspect cases". Segue i criteri diagnostici definiti dall'Organizzazione mondiale per la salute animale, WOAH (precedentemente denominato Office International des Épizooties, OIE)1 e European Reference Laboratory for animal TSE 8,11. La procedura IHC descritta è anche accreditata secondo NPISOIEC17025 (requisiti generali per la competenza dei laboratori di prova e taratura) dal 2008. Tale accreditamento implica un sistema di gestione di alta qualità che incorpori procedure operative standard, personale qualificato, attrezzature accuratamente calibrate, controllo rigoroso dei dati e dei reagenti, partecipazione a saggi di competenza interlaboratorio, lavori non conformi e valutazione dei rischi per aumentare l'efficacia del sistema di gestione, ottenere risultati migliori e prevenire i rischi di laboratorio. Sono stati raccolti controlli tissutali infettati da prioni con BSE, scrapie classica, scrapie atipica e CWD (formalina-fissata, paraffina-embedded, FFPE) da varie fonti. Le sezioni bovina e ovina provengono dai casi diagnosticati nell'ambito di un programma di sorveglianza delle TSE animali. Le sezioni CWD provengono dai campioni di controllo gentilmente forniti dalla professoressa Stefanie Czub (Canadian Food Inspection Agency, National Center for Animal Diseases) nel 2003 e dal CWD Proficiency testing 2008 organizzato dall'European Reference Laboratory for TSEs (APHA, Weybridge).
1. Sezionamento dei tessuti e preparazione dei vetrini
- Tagliare sezioni di tessuti fissati in formalina, incorporati in paraffina (FFPE) a 3-5 μm di spessore utilizzando un microtomo.
- Far galleggiare sezioni su acqua purificata con una temperatura di circa 10 °C inferiore al punto di fusione della paraffina utilizzata. Sollevare le sezioni dall'acqua su vetrini da microscopio appositamente trattati (vedi Tabella dei materiali). Lasciare che l'acqua defluisca accuratamente dagli scivoli.
- Incubare i vetrini durante la notte a 50 °C per migliorare l'adesione dei vetrini dei tessuti.
NOTA: È preferibile preparare tessuti appena sezionati per i protocolli IHC, sebbene le sezioni di controllo positivo e negativo TSE possano essere preparate in anticipo e conservate. I passaggi da 2 a 4 devono essere eseguiti in una cappa aspirante chimica.
2. Deparaffinizzazione e reidratazione
- Posizionare i vetrini con le sezioni di tessuto in un cestello colorante in acciaio inossidabile (vedere Tabella dei materiali). Immergere il cestello in un bagno di xilene (contenitore colorante in acciaio inossidabile) per 3 minuti, rimuovere e immergere ancora una volta.
- Rimuovere le sezioni di xilene e reidratarle immergendole in un bagno di etanolo assoluto per 3 minuti. Rimuovere e immergere ancora una volta.
- Asciugare all'aria le sezioni e metterle in un bagno di etanolo al 90% per 1 minuto. Trasferimento in un bagno di etanolo al 70% per un altro minuto, seguito da un trasferimento finale in un bagno di etanolo al 50% per 1 minuto. Per ogni trattamento con bagno di etanolo, agitare delicatamente il cestello di scorrimento due volte e scolare il cestello prima del trasferimento successivo.
3. Recupero dell'epitopo
- Immergere accuratamente le sezioni di tessuto in acido formico al 98% a temperatura ambiente per 30 minuti. Risciacquare le sezioni in acqua di rubinetto per 5 minuti, quindi risciacquare due volte in acqua distillata.
ATTENZIONE: L'acido formico è altamente corrosivo. Devono essere indossati occhiali protettivi e guanti. - Eseguire il recupero dell'antigene indotto dal calore (HIER) seguendo i passaggi seguenti.
NOTA: Questa fase viene eseguita mediante autoclave idratata a 121 °C per 30 minuti in una camera a pressione specifica (vedere Tabella dei materiali).- Preriscaldare il tampone citrato (10 mM, pH 6,1, vedere Tabella dei materiali) a 98 °C per circa 20 minuti in un contenitore di colorante in acciaio inossidabile posto all'interno della camera di pressione riempita con 500 ml di acqua distillata.
NOTA: Per il presente studio, il set point del programma era 1 (SP1) per l'apparecchiatura specifica utilizzata. - Dopo che l'allarme indica che l'apparecchiatura ha raggiunto il tempo e la temperatura programmati, immergere il cestello con le guide e avviare il programma al Set Point 2 (121 ° C per 30 minuti). Ai fini del controllo qualità, posizionare una sezione di nastro adesivo per autoclave sul cestello per monitorare la temperatura e la pressione e registrare la pressione iniziale e finale di questo programma.
- Se il numero di vetrini da immunocolorare non raggiunge la capacità del cestello, utilizzare vetrini puliti e vuoti per occupare eventuali posizioni vuote. Al termine del programma, consentire il ritorno passivo della camera alla pressione ambiente (almeno 30 min).
NOTA: durate più lunghe possono ridurre la colorazione dello sfondo non specifica. - Trasferire con cautela il cestello di scorrimento in un contenitore di colorazione in acciaio inossidabile riempito con acqua distillata per 5 minuti.
- Preriscaldare il tampone citrato (10 mM, pH 6,1, vedere Tabella dei materiali) a 98 °C per circa 20 minuti in un contenitore di colorante in acciaio inossidabile posto all'interno della camera di pressione riempita con 500 ml di acqua distillata.
4. Inattivazione della perossidasi endogena
- Immergere il cestello di scorrimento contenente le sezioni del campione in un bagno di perossido di idrogeno al 3% (H 2 O2) in metanolo per 30 minuti. Risciacquare le sezioni sotto l'acqua corrente (5 min). Scolare e immergere le sezioni in 1x soluzione salina Tris-buffered (TBS) per altri 5 minuti.
5. Immunorilevamento
NOTA: Per il presente studio, l'immunorilevazione è stata eseguita utilizzando il formato di gap capillare7 utilizzando un sistema di assemblaggio di clip per diapositive disponibile in commercio (vedere la tabella dei materiali). Sono applicabili anche altri sistemi di vetrini immunoistochimici.
- Posizionare ogni vetrino su un supporto per piastra di copertura disponibile in commercio (vedi Tabella dei materiali) pre-inumidito con TBS, evitando bolle, con il lato del tessuto rivolto verso il supporto e i bordi del vetrino coincidenti con i due punti inferiori del supporto.
- Tenere il gruppo portaslitta tra il pollice e l'indice, con un dito sulla parte superiore del vetrino campione e l'altro sulla parte inferiore del supporto. Quindi, posizionate l'assieme nella galleria del sistema.
- Per garantire che il set sia ben assemblato, riempire il pozzetto tra il vetrino del campione e il supporto con TBS, che non deve traboccare immediatamente. Da questo punto in poi, assicurarsi che circa 80 μL di TBS debbano essere trattenuti tra il supporto e il vetrino. Non lasciare asciugare le sezioni.
- Una volta nel sistema, per ridurre la colorazione di fondo prima del trattamento con anticorpi primari (anti-PrP, vedi Tabella dei materiali), pre-incubare i vetrini del campione con il 20% di siero normale della stessa specie dell'ospite anticorpale secondario utilizzato per l'immunocolorazione (in questo caso, siero di cavallo) per 30 minuti in TBS.
- Scongelare il numero di aliquote di anticorpi da utilizzare in funzione della specie animale in analisi, del numero di sezioni campione da esaminare e della quantità di diluizione operativa.
NOTA: Per ottenere i migliori risultati, utilizzare il 10% di siero normale della stessa specie come fonte dell'anticorpo secondario e delle soluzioni anticorpali primarie. Se possibile, per ottenere i migliori risultati, la fonte ospite del siero normale e dell'anticorpo secondario dovrebbe provenire dalla stessa specie. - Senza lavare le sezioni, applicare direttamente la soluzione anticorpale primaria (200 μL) in ciascun pozzetto del set portavetrino e incubare per 60 minuti a temperatura ambiente.
- Per il lavaggio, riempire i pozzetti dei set portaslitte con TBS e attendere 5 minuti. Ripetere due volte.
- Diluire l'anticorpo secondario biotinilato (monoclonale anti-murino Horse Ab, vedi Tabella dei materiali) a 1/200 in TBS con siero di cavallo al 10%. Preparare il volume richiesto in base al numero di sezioni da trattare.
- Applicare la soluzione anticorpale secondaria (200 μL) su ciascun pozzetto del set di portavetrini. Incubare per 30 minuti a temperatura ambiente.
- Lavare come descritto al punto 5.5.
- Per l'incubazione con perossidasi del complesso avidina-biotina (complesso ABC/HRP, vedere Tabella dei materiali), preparare il reagente 30 minuti prima dell'uso. Applicare la soluzione complessa ABC/HRP (200 μL) in ciascun pozzetto del set di portapiastre scorrevoli. Incubare per 30 minuti a temperatura ambiente.
- Lavare come descritto al punto 5.5.
6. Sviluppo con cromogeno DAB
ATTENZIONE: DAB è un potenziale cancerogeno. Di conseguenza, è necessaria una cura appropriata mentre si lavora con questo reagente, compresa la protezione degli occhi, camici da laboratorio, guanti e buone procedure di laboratorio. Smaltire le normative locali.
- Diluire il cromogeno secondo le istruzioni del produttore (vedere Tabella dei materiali) immediatamente prima dell'uso. Applicare la soluzione di cromogeno (400 μL) a ciascun pozzetto del set di piastre di scorrimento.
- Incubare fino a 30 minuti a temperatura ambiente. Nelle sezioni positive alla PrPSc , un periodo di incubazione di 10 minuti è solitamente sufficiente.
- Rimuovere la soluzione di cromogeno residua lavando i vetrini in acqua distillata. Rimuovere i vetrini dai portapiastre e metterli in un contenitore di plastica con acqua distillata.
7. Controcolorazione dell'ematossilina
- Immergere il cestello colorante in acciaio inossidabile con le sezioni nel bagno della soluzione di ematossilina (vedi Tabella dei materiali) per 1 minuto. Risciacquare delicatamente in acqua corrente fredda per 10 minuti o acqua tiepida per 5 minuti.
- Disidratare le sezioni mettendole in etanolo al 90% per 1 minuto, seguito da un bagno in etanolo assoluto per 1 minuto. Quindi, posizionare i vetrini in un bagno di xilene per 1 minuto.
- Montare le sezioni con un supporto di montaggio disponibile in commercio (vedere Tabella dei materiali).
NOTA: Questi passaggi vengono eseguiti in una cappa chimica a temperatura ambiente (19 °C-24 °C). Questa procedura include un record di prova (file supplementare 1) per registrare il completamento di tutti i passaggi, l'attrezzatura utilizzata e il tecnico di laboratorio. Inoltre, è stato progettato un foglio di lavoro (file supplementare 2) per determinare facilmente i volumi dei reagenti in base al numero di sezioni in ciascun test, alle diluizioni di lavoro e alle istruzioni del produttore, nonché per registrare la temperatura ambiente, le attrezzature e i lotti di reagenti.
Risultati
Dato che è possibile una marcatura immunomarcatrice bersaglio non specifica, è importante accertare il livello di immunomarcatura non specifica negli animali di controllo noti TSE-negativi. Questo è un passo importante per interpretare correttamente specifici immunolabeling PrPSc 7 (Figura 2). È stato notato che la marcatura non bersaglio da parte di anticorpi anti-PrP si verifica come colorazione intraneuronale discreta del particolato fine (...
Discussione
Le TSE sono potenziali malattie zoonotiche. Dopo la comparsa della BSE nel 1986 nel Regno Unito, il Portogallo è diventato uno degli Stati membri dell'Unione europea con una maggiore incidenza di questa malattia14,15. Al fine di controllare questa malattia, altre TSE che sono emerse (scrapie classica e atipica, varianti della BSE, e attualmente la sorveglianza della malattia del deperimento cronico nei cervidi), meccanismi di sorveglianza sono stati sviluppati d...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo articolo è stato finanziato dal Progetto POCI-01-0145-FEDER-029947 "Chronic wasting disease risk assessment in Portugal" sostenuto da FCT (Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020. Inoltre, gli autori dell'unità di ricerca CECAV hanno ricevuto finanziamenti dalla FCT, nell'ambito del progetto UIDB / CVT / 0772 / 2020.Ringraziamo Bruce C. Campbell, direttore della ricerca (in pensione), Western Regional Research Center, USDA, per la sua assistenza.
Materiali
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
Riferimenti
- . WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022) Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022)
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M., Oliver, C., Jamur, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466 (2021).
- . Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020 Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022)
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019)
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon