JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
면역조직화학에 의한 비정상적인 프리온 단백질 검출
요약
면역조직화학 프로토콜을 사용하여 비정상 프리온 단백질을 면역표지하려면 특정 샘플 및 항-PrP 항체 준비 방법론이 필요합니다. 본 프로토콜은 적절한 PrP 면역표지를 보장하고 비특이적 배경 염색을 최소화하기 위한 에피토프 마스킹의 주요 단계를 설명합니다. 또한, 이 접근법은 프리온 감염 조직으로 면역조직화학 연구를 수행할 때 생물학적 안전성 조치를 고려합니다.
초록
비정상 프리온 단백질(PrP,Sc)은 세포 프리온 단백질의 질병 관련 동형이며 전염성 해면상 뇌병증(TSE)의 진단 마커입니다. 이러한 신경퇴행성 질환은 인간과 여러 동물 종에 영향을 미치며 스크래피, 인수공통전염병(BSE), 만성 자궁경부 소모성 질환(CWD) 및 새로 확인된 낙타 프리온 질병(CPD)을 포함합니다. TSE의 진단은 뇌 조직, 즉 뇌간(obex 수준)에 면역조직화학(IHC)과 웨스턴 면역블롯 방법(WB)을 모두 적용하여 PrPSc의 면역검출에 의존합니다. IHC는 조직 절편의 세포에서 관심있는 항원에 대해 1 차 항체 (단일 클론 또는 폴리 클로날)를 사용하는 널리 사용되는 방법입니다. 항체-항원 결합은 항체가 표적이 된 조직 또는 세포 영역에 국한된 채로 남아 있는 색 반응에 의해 시각화될 수 있습니다. 따라서 프리온 질병에서 다른 연구 분야와 마찬가지로 면역 조직 화학 기술은 진단 목적뿐만 아니라 병인 연구에도 사용됩니다. 이러한 연구는 새로운 프리온 균주를 식별하기 위해 이전에 설명한 것에서 PrPSc 패턴 및 유형을 검출하는 것을 포함합니다. BSE는 인간을 감염시킬 수 있으므로 TSE 감시에 포함된 소, 작은 반추 동물 및 자궁경부 샘플을 처리하기 위해 생물안전 실험실 레벨 3(BSL-3) 시설 및/또는 관행을 사용하는 것이 좋습니다. 또한 오염을 제한하기 위해 가능하면 봉쇄 및 프리온 전용 장비를 권장합니다. PrPSc IHC 절차는 이 기술에 사용된 포르말린 고정 및 파라핀 포매 조직이 감염성을 유지하기 때문에 프리온 불활성화 측정으로도 작용하는 포름산 에피토프 데마스킹 단계로 구성됩니다. 결과를 해석할 때 비특이적 면역 표지와 표적 표지를 구별하기 위해 주의를 기울여야 합니다. 이러한 목적을 위해, 본원에 추가로 기술된 TSE 균주, 숙주 종 및 prnp 유전자형 간에 변할 수 있는 특정 PrPSSc 면역표지 유형으로부터 이들을 구별하기 위해 공지된 TSE-음성 대조군 동물에서 얻어진 면역표지의 인공물을 인식하는 것이 중요하다.
서문
프리온 가설에 따르면, 비정상적인 동형(PrPSc)은 전염성 해면상 뇌병증(TSE)에서 감염원의 주요 또는 유일한 구성 요소입니다. TSE 진단을 위한 확인은 면역조직화학(IHC) 프로토콜 및/또는 뇌 조직의 웨스턴 면역블롯 방법(WB)을 적용하여 PrPSc 의 면역검출에 의존합니다1.
IHC는 조직 절편의 세포에 위치하는 특이적 표적화된 관심 항원의 면역염색의 첫 번째 단계로서 단일클론 항체 또는 일부 경우에 다클론 항체(1차 항체)를 사용하는 방법입니다. 임의의 효과적인 1차 항체-항원 결합은 1차 항체에 특이적인 2차 항체를 사용하여 시각화된다. 이러한 2차 항체는 양 고추 냉이 과산화 효소 (HRP) 또는 알칼리성 포스파타제 (AP)와 같은 효소에 접합됩니다. 그런 다음 이러한 효소에 기질을 추가하여 1차 항체가 표적 항원에 결합하는 영역에 국한된 불용성 색상 제품을 생성함으로써 시각화를 달성합니다. 개선된 시각화는 대조염색에 의해 달성될 수 있으며, 여기서 염료는 면역표지된 조직과 면역표지되지 않은 조직 사이의 대조를 생성하기 위해 사용된다2.
포르말린 고정 파라핀 포매 조직 (FFPE)을 사용하는 IHC를 사용하면 포르말린 고정은 포름알데히드에 의한 가교 결합 및 파라핀 포매 동안 가열 및 탈수로 인한 1차 항체의 효과를 무효화할 수 있습니다. 이들은 단백질의 형태를 변화시켜 에피토프를 파괴, 변성 또는 마스킹하여 검출을 감소시키거나 폐지한다3. 따라서 항원 검색(AR)이 필요합니다. AR 기술은 항원 분자에서 포름알데히드 관련 화학 그룹 가교를 방해하여 원래의 항원-단백질 형태를 복원하거나 마스킹을 해제합니다. 이는 면역표지를 위한 항체-항원(에피토프) 친화도를 회복시키는 결과를 가져온다. AR의 최종 효능은 표적 항원 및/또는 1차 항체의 특성에 따라 달라집니다2.
열-유도 항원 (에피토프) 검색 (HIER)은 AR3 의 한 절차이고, 본원에 기재된 바와 같이,PrPSc IHC 검출을 위해 일상적으로 사용된다. IHC는 진단에 필수적이며 병리학 관련 항원의 조직 분포를 결정하기 위해 연구 실험실에서 사용됩니다. 암, 신경과학, 전염병4 등의 진단 및 연구에 널리 사용된다. TSE의 경우, IHC는 자연 숙주 및 실험 모델에서 PrPSSc 분포를 확인하고 조사하기 위한 진단 및 연구에서 중요한 역할을 합니다. IHC는 프리온 병인 연구와PrPSC 침착 유형 및 패턴, 즉 신경 조직5의 분석에 기여하여 일상적으로 기술되는 감염으로부터의 편차를 감지하고 추정되는 새로운 프리온 균주를 식별한다.
소 해면상 뇌병증(bovine spongiform encephalopathy, BSE)의 프리온은 인간을 감염시킬 수 있기 때문에, BSE 연구와 관련된 특정 실험실 프로토콜은 BSL-3 시설 및 관행을 사용해야 할 수 있다6. 여기에는 밀봉된 2차 용기를 사용하여 연구소 및 실험실 내에서 잠재적인 BSE 감염 조직 샘플을 운반하는 것이 포함됩니다. 또한 가능할 때마다 BSE 연구 및 분석을 위한 격리 구역과 프리온 전용 장비를 지정하는 것도 포함됩니다. 이는 작업장 외부의 오염을 방지하고 오염 제거 절차가 필요하기 때문에 밀폐된 공간을 제공하기 위해 수행됩니다.
따라서, INIAV의 병리학 실험실은 TSE 감시와 관련된 소, 작은 반추 동물 및 자궁 경부의 잠재적인 프리온 감염 조직 샘플을 관리하기 위해 권장되는 생물안전 등급-3(BSL-3) 시설 및 관행6 을 따른다.
TSE 진단 또는 연구 절차, 특히 중추 신경계에 포함 된 포르말린 고정 및 파라핀 포매 조직은 잠재적으로 전염 될 수 있습니다. 따라서 이러한 고정 조직은 조직 처리 전에 프리온의 감염성을 줄이기 위해 포름산으로 처리해야 합니다. 이것은 고정되고 손질 된 조직 (약 2-4mm 두께)을 처리 카세트에 넣어 수행됩니다. 그런 다음 카세트를 98% 포름산에 담급니다(1시간 동안). 침지 후, 티슈가 있는 카세트를 흐르는 수돗물에서 30분 동안 세척하고, 추가 처리 전에 고정액으로 되돌립니다. 조직 절편을 처리 전에 처리하지 않는 경우, 조직학적 염색 전에 최소 5분 동안 희석되지 않은 포름산에 세포 절편을 담가야 한다7. PrPSc 에 대한 IHC 프로토콜은 일상적인 포름산 에피토프-데마스킹 단계를 포함하며, 또한 프리온을 불활성화시키는 역할을 한다(7). 이러한 프리온 불활성화 단계 후, 생성된 고정 조직은 표준 BSL-2 관행을 사용하여 BSL-2에서 처리될 수 있습니다.
TSE 감시에 포함 된 모든 동물에서 TSE 진단을위한 최소 조직 샘플링 요구 사항은 뇌간을 수집하는 것입니다 (obex 수준에서). 또한, 비정형 BSE와 스크래피를 검출하기 위해서는 소뇌의 일부도 채취하는 것이 좋다 1,8. CWD 진단의 경우, Machado et al.10에 의해 검토된 obex9에서 검출 가능한 PrP Sc가 없는 림프 조직에서 PrPSc가 검출될 수 있으므로 뇌간(obex)과 후인두 림프절을 모두 검사해야 합니다.
뇌간의 obex 부분에는 진단 TSE 표적 부위, 즉 삼차 신경의 등쪽 미주 신경(DVN), 고립관 핵(STN) 및 척수 핵이 포함됩니다. 이 영역은 BSE 및 고전적 스크래피의 초기 단계에서도 일관되게 양측 PrPSc 축적을 나타냅니다. 진행성 TSE의 임상 사례에서, 뇌간 내의 모든 회백질 영역은 광범위한 PrPS분포 를 보인다11.
절편 및 처리 전에, 뇌 검체를 평가하여(그림 1) 자가분해 수준과 IHC 기반 확증 진단에 대한 검체의 적합성을 잠재적으로 손상시킬 수 있는 조직 손상의 존재를 확인한다8. 분취 프로토콜 및 분석 결과의 무결성을 검증하기 위해 TSE 양성 및 음성 조직 샘플은 각 분석에서 테스트 케이스의 조직 준비와 함께 대조군으로 포함됩니다.
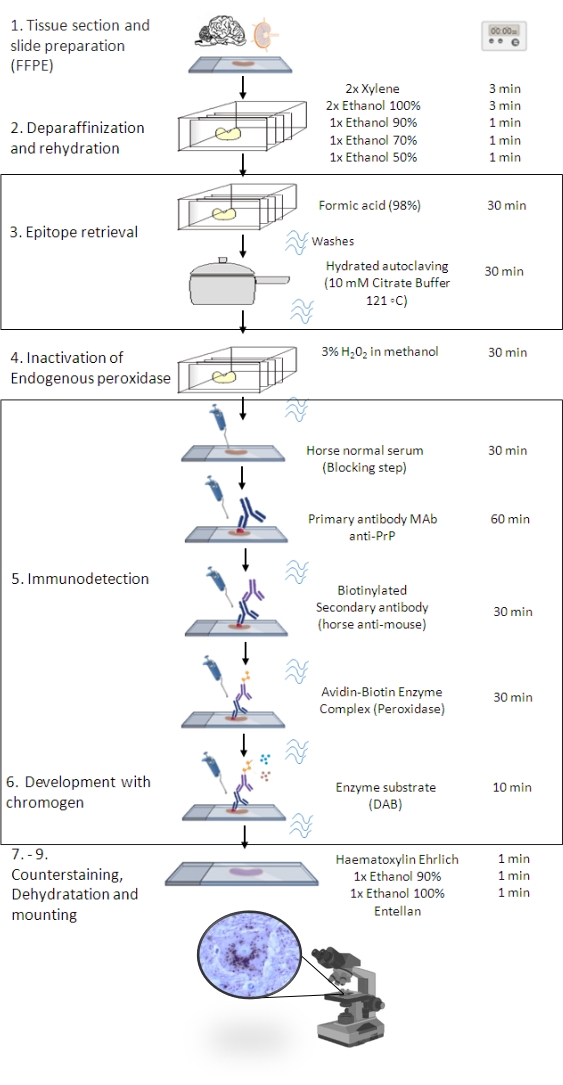
그림 1: PrPSc IHC 절차. 조직 절편의 탈파라핀화부터 최종 면역염색 및 검출까지PrPSC 의 단계별 서열을 보여주는 IHC 절차(FFPE - Formalin-fixed paraffin-embedded; Mab - 단클론 항체; DAB - 3,3' 디아미노벤지딘). 이 그림은 BioRender.com 년에 만들어졌습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
여기에 설명 된 IHC 절차는 연구 프로젝트 FAIRJ-CT98-7021, "반추 동물 TSE의 감시를위한 유럽 네트워크 구축 및 의심 사례 식별을위한 프로세스 및 기준의 표준화 및 조화"의 구성 요소입니다. 이는 세계동물보건기구(World Organization for Animal Health), WOAH(이전에는 Office International des Épizooties, OIE)1 및 동물 TSE에 대한 유럽 참조 실험실(European Reference Laboratory for animal TSEs 8,11)에서 정의한 진단 기준을 따릅니다. 설명된 IHC 절차는 2008년부터 NPISOIEC17025(테스트 및 교정 실험실의 역량에 대한 일반 요구 사항)에 따라 인증되었습니다. 이러한 인증은 표준 운영 절차, 자격을 갖춘 인력, 정확하게 보정된 장비, 데이터 및 시약의 엄격한 제어, 실험실 간 숙련도 분석 참여, 부적합 작업 및 위험 평가를 통합하여 관리 시스템의 효율성을 높이고 결과를 개선하며 실험실 위험을 방지하는 고품질 관리 시스템을 의미합니다. BSE, 고전적 스크래피, 비정형 스크래피 및 CWD를 사용한 프리온 감염 조직 대조군(포르말린 고정, 파라핀 내장, FFPE)을 다양한 출처에서 수집했습니다. 소 및 양 섹션은 동물 TSE 감시 프로그램에 따라 진단 된 사례에서 나온 것입니다. CWD 섹션은 2003 년 Stefanie Czub 교수 (캐나다 식품 검사국, 국립 동물 질병 센터)와 TSE에 대한 유럽 참조 연구소 (APHA, Weybridge)가 주최 한 CWD 숙련도 테스트 2008에서 제공 한 대조 샘플에서 가져온 것입니다.
1. 조직 절편 및 슬라이드 준비
- 마이크로톰을 사용하여 포르말린 고정, 파라핀 포매(FFPE) 조직의 절편을 3-5μm 두께로 절단합니다.
- 사용된 파라핀의 융점보다 약 10°C 낮은 온도의 정제수에 절편을 띄웁니다. 특수 처리된 현미경 슬라이드로 물에서 섹션을 들어 올립니다( 재료 표 참조). 슬라이드에서 물이 완전히 배수되도록 합니다.
- 슬라이드를 50°C에서 하룻밤 동안 인큐베이션하여 조직의 슬라이드 접착력을 향상시킵니다.
참고: TSE 양성 및 음성 대조군 섹션을 미리 준비하고 보관할 수 있지만 IHC 프로토콜을 위해 새로 절개된 조직을 준비하는 것이 바람직합니다. 2-4단계는 화학 흄 후드에서 수행해야 합니다.
2. 탈파라핀화 및 재수화
- 조직 절편이 있는 슬라이드를 스테인리스 스틸 염색 바구니에 넣습니다( 재료 표 참조). 바스켓을 크실렌 수조(스테인리스 스틸 염색 용기)에 3분 동안 담그고 제거하고 다시 한 번 담그십시오.
- 자일렌을 제거하고 절편을 무수 에탄올 수조에 3분 동안 담가 재수화합니다. 제거하고 다시 한 번 담그십시오.
- 섹션을 자연 건조하고 90% 에탄올 수조에 1분 동안 담가둡니다. 1분 동안 70% 에탄올 수조로 옮긴 다음, 1분 동안 50% 에탄올 수조로 최종 옮깁니다. 각 에탄올 수조 처리에 대해 슬라이드 바스켓을 부드럽게 두 번 저어주고 다음 이송 전에 바스켓을 비우십시오.
3. 에피토프 검색
- 조직 절편을 실온에서 30분 동안 98% 포름산에 조심스럽게 담그십시오. 섹션을 수돗물로 5분 동안 헹구고 증류수로 두 번 헹굽니다.
주의 : 포름산은 부식성이 강합니다. 보호용 고글과 장갑을 착용해야 합니다. - 아래 단계에 따라 HIER(Heat-Induced Antigen Retrieval)을 수행합니다.
참고: 이 단계는 특정 압력 챔버에서 121°C에서 30분 동안 수화된 오토클레이빙에 의해 수행됩니다( 재료 표 참조).- 500 mL의 증류수로 채워진 압력 챔버 내부에 놓인 스테인리스-스틸 염색 용기에서 시트레이트 완충액(10 mM, pH 6.1, 재료 표 참조)을 98°C에서 약 20분 동안 예열합니다.
알림: 본 연구에서 프로그램 설정값은 사용된 특정 장비에 대해 1(SP1)이었습니다. - 알람이 장비가 프로그래밍된 시간과 온도에 도달했음을 표시한 후 슬라이드로 바구니를 담그고 프로그램을 설정값 2(121분 동안 30°C)로 시작합니다. 품질 관리를 위해 접착식 오토클레이브 표시기 테이프 섹션을 바스켓에 올려 온도와 압력을 모니터링하고 이 프로그램의 초기 및 최종 압력을 기록합니다.
- 면역염색할 슬라이드의 수가 바스켓의 용량에 도달하지 않으면 깨끗하고 빈 슬라이드를 사용하여 빈 위치를 차지하십시오. 프로그램이 종료된 후 챔버가 주변 압력으로 수동적으로 복귀하도록 합니다(최소 30분).
알림: 지속 시간이 길수록 비특이적 배경 염색을 줄일 수 있습니다. - 슬라이드 바스켓을 증류수로 채워진 스테인리스 스틸 염색 용기에 5분 동안 조심스럽게 옮깁니다.
- 500 mL의 증류수로 채워진 압력 챔버 내부에 놓인 스테인리스-스틸 염색 용기에서 시트레이트 완충액(10 mM, pH 6.1, 재료 표 참조)을 98°C에서 약 20분 동안 예열합니다.
4. 내인성 과산화효소의 불활성화
- 샘플 섹션이 들어 있는 슬라이드 바스켓을 메탄올 중의 3% 과산화수소(H2O2) 수조에 30분 동안 담급니다. 흐르는 물에 섹션을 헹굽니다(5분). 섹션을 배수하고 1x Tris-buffered 식염수(TBS)에 추가로 5분 동안 담그십시오.
5. 면역 검출
참고: 본 연구를 위해, 면역검출은 상업적으로 이용 가능한 슬라이드 클립 조립 시스템을 사용하여 모세관 갭 형식7 을 사용하여 실행되었다( 재료 표 참조). 다른 면역조직화학 슬라이드 시스템도 적용가능하다.
- 기포를 피하고 조직 면이 홀더를 향하고 슬라이드 가장자리가 홀더의 두 아래쪽 지점과 일치하도록 TBS로 미리 적신 시중에서 판매되는 커버 플레이트 홀더( 재료 표 참조)에 각 슬라이드를 놓습니다.
- 엄지와 집게손가락 사이에 슬라이드 홀더 어셈블리를 잡고 한 손가락은 샘플 슬라이드 위에 놓고 다른 손가락은 홀더 하단에 놓습니다. 그런 다음 어셈블리를 시스템 갤러리에 배치합니다.
- 세트가 잘 조립되었는지 확인하려면 샘플 슬라이드와 홀더 사이의 웰을 TBS로 채우고 즉시 넘치지 않아야 합니다. 이 시점부터 홀더와 슬라이드 사이에 약 80μL의 TBS가 유지되어야 합니다. 섹션이 건조되지 않도록 하십시오.
- 일단 시스템에 들어가면, 1차 항체(항-PrP, 재료 표 참조)로 처리하기 전에 배경 염색을 감소시키기 위해, TBS에서 30분 동안 면역염색에 사용되는 2차 항체 숙주(본 경우, 말 혈청)와 동일한 종으로부터의 20% 정상 혈청으로 샘플 슬라이드를 사전 인큐베이션한다.
- 분석 중인 동물 종에 따라 사용할 항체의 분취량 수, 검사할 샘플 섹션 수 및 작업 희석량을 해동합니다.
참고: 최상의 결과를 얻으려면 2차 항체 및 1차 항체 용액의 공급원과 동일한 종의 10% 정상 혈청을 사용하십시오. 가능하면 최상의 결과를 얻으려면 정상 혈청과 2차 항체의 숙주 공급원이 동일한 종에서 유래해야 합니다. - 절편을 세척하지 않고, 1차 항체 용액을 슬라이드-홀더 세트의 각 웰에 직접 적용하고, 실온에서 60분 동안 인큐베이션한다.
- 세척을 위해 슬라이드 홀더 세트의 웰에 TBS를 채우고 5분 동안 기다립니다.
- 비오티닐화된 2차 항체(단클론 항-뮤린 Horse Ab, 재료 표 참조)를 1/200 TBS에서 10% 말 혈청으로 희석합니다. 치료할 섹션의 수에 따라 필요한 양을 준비하십시오.
- 2차 항체 용액(200 μL)을 슬라이드 홀더 세트의 각 웰에 적용한다. 실온에서 30분 동안 배양합니다.
- 5.5 단계에 설명 된대로 세척하십시오.
- 아비딘-비오틴 복합체 퍼옥시다제(ABC/HRP 복합체, 재료 표 참조)로 배양하려면 사용 30분 전에 시약을 준비하십시오. ABC/HRP 복합 용액(200μL)을 슬라이드 플레이트 홀더 세트의 각 웰에 적용합니다. 실온에서 30분 동안 배양합니다.
- 5.5 단계에 설명 된대로 세척하십시오.
6. DAB 발색겐을 이용한 개발
주의 : DAB는 잠재적인 발암 물질입니다. 결과적으로 이 시약으로 작업하는 동안 보안경, 실험실 가운, 장갑 및 우수한 실험실 절차를 포함하여 적절한 주의가 필요합니다. 다음 지역 규정에 따라 폐기하십시오.
- 사용 직전에 제조업체의 지침 ( 재료 표 참조)에 따라 발색원을 희석하십시오. 발색원 용액(400 μL)을 슬라이드 플레이트 세트의 각 웰에 적용한다.
- 실온에서 최대 30분 동안 배양합니다. PrPSc 양성 절편에서는 일반적으로 10분의 잠복기면 충분합니다.
- 슬라이드를 증류수로 세척하여 잔류 발색원 용액을 제거합니다. 커버플레이트 홀더에서 슬라이드를 제거하고 증류수가 담긴 플라스틱 용기에 넣습니다.
7. 헤마톡실린 대조염색
- 섹션이 있는 스테인리스 스틸 염색 바스켓을 헤마톡실린 용액 수조( 재료 표 참조)에 1분 동안 담그십시오. 흐르는 찬물에 10분 동안 부드럽게 헹굽니다 또는 미지근한 물에 5분 동안 헹굽니다.
- 섹션을 90% 에탄올에 1분 동안 담가 탈수한 다음 무수 에탄올에 1분 동안 수조합니다. 그런 다음 슬라이드를 크실렌 수조에 1분 동안 넣습니다.
- 시중에서 판매되는 장착 매체를 사용하여 섹션을 장착합니다( 재료 표 참조).
알림: 이 단계는 실온(19°C-24°C)의 화학 흄 후드에서 수행됩니다. 이 절차에는 모든 단계의 완료, 사용된 장비 및 실험실 기술자를 기록하기 위한 테스트 기록(보충 파일 1)이 포함됩니다. 또한 워크시트(보충 파일 2)는 각 분석의 섹션 수, 작업 희석 및 제조업체의 지침에 따라 시약의 부피를 쉽게 결정하고 실온, 장비 및 시약 배치를 기록하도록 설계되었습니다.
Access restricted. Please log in or start a trial to view this content.
결과
비특이적 표적 면역 표지가 가능하다는 점을 감안할 때, 알려진 TSE 음성 대조군 동물에서 비특이적 면역 표지의 수준을 확인하는 것이 중요합니다. 이는 특정PrPSc 면역표지를 적절하게 해석하기 위한 중요한 단계이다7(그림 2). 항-PrP 항체에 의한 비표적 표지는 별개의 신경내 미세 미립자 염색(설하 핵 및 부속 교미 핵에서 더 분명함), 신경?...
Access restricted. Please log in or start a trial to view this content.
토론
TSE는 잠재적인 인수공통전염병입니다. 영국에서 1986에서 BSE가 출현 한 후, 포르투갈은이 질병의 발병률이 높은 유럽 연합 회원국 중 하나가되었습니다14,15. 이 질병을 통제하기 위해 등장한 다른 TSE (고전적 및 비정형 스크래피, BSE 변종 및 현재 자궁 경부에서 만성 소모성 질환의 감시), 감시 메커니즘은 식품 수의학 총국 (DGAV)과 국립 농업 및 수의학 연...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 기사는 FCT(Fundação para a Ciência e a Tecnologia) - FEDER -Balcão2020이 지원하는 프로젝트 POCI-01-0145-FEDER-029947 "포르투갈의 만성 소모성 질병 위험 평가"의 자금 지원을 받았습니다. 또한 연구 단위 CECAV의 저자는 UIDB/CVT/0772/2020 프로젝트에 따라 FCT로부터 자금을 받았습니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Absolute ethanol | Labchem | LB0507-9010 | Undituled |
| Diluted 90%, 70% and 50% in distilled water | |||
| Avidin-biotin complex and peroxidase Vectastain Elite ABC kit Peroxidase | Vector Laboratories | PK-6100 | Prepare and gently mix 30 min before use according to kit instructions. Do not mix after standing. |
| Biotinylated secondary antibody (Horse anti-mouse IgG H+L) | Vector Laboratories | BA-2000-1.5 | Dilute at 1/200 in TBS with 10% horse normal serum. Prepare the volume required depending on the number of sections. |
| Chromogen Diaminobenzidine- DAB, substrate kit, Peroxidase | Vector Laboratories | SK-4100 | Prepare before use according to kit instructions. Use 400 µL of solution per section. |
| DakoCytomation Pascal pressure chamber | DAKO | S2800 | |
| Ehrlich’s Hematoxylin: | |||
| Hematoxylin | Merck | 115938 | Dissolve 2 g of hematoxylin in 100 mL of absolute ethanol. Add 100 mL of distilled water, 10 mL of glacial acetic acid and 15 g of potassium alum with constant stirring. Add 100 mL of glycerin. The natural oxidation process takes 2 months, before use. |
| Absolute ethanol | Labchem | LB0507-9010 | |
| Glacial acetic acid | Merck | 101830 | |
| Potassium alum | Merck | 1.01047.1000 | |
| Glycerin | Merck | 1.04091.1000 | |
| Endogenous Peroxidase Block solution (3% concentration H2O2): | 40 mL Hydrogen peroxide (30% w/w) in 360 mL Methanol. Prepare before use | ||
| Hydrogen peroxide (30% w/w) | Scharlau | HI0136 | |
| Methanol | Sigma Aldrich | 322415-2L | |
| Formic acid 98% | Merck | 1.00264.1000 | Undiluted |
| Microtome | Shandon-AS325 | Microtome | Shandon-AS325 |
| Mounting medium Entellan | Merck | 107960 | Ready- to- use. |
| Normal serum (20% ) block solution in TBS: Horse normal serum | Gibco | 16050-122 | Prepare final volume according to the number of sections in the assay (200 µL of solution per section). |
| Primary antibody anti-PrP Mouse MAb 2G11 | BIORAD | MCA2460 | PrP 146-R154R171182 Ovine including atypical scrapie, cervine, feline. Not suitable for bovine. According to the number of sections in the assay (200 µL of solution per section) and antibody dilution, prepare final volume in TBS supplemented with 10% of normal serum from the species the secondary antibody was raised in (horse normal serum) Usual antibody dilution: MAb 2G11 1/100 but working dilution should be established in every new batch to get the concentration to give the strongest labelling with lowest background. For storage, freeze aliquot volumes of a minimum of 10 μL into sterile microtubes. Defrost and use one aliquot at a time. |
| Primary antibody anti-PrP Mouse MAb 12F10 | Cayman Chemical Company | 189710 | PrP142-160 Bovine, not suitable for ovine Usual antibody dilution: 1/200 but working dilution should also be established. Prepare as MAb 2G11 |
| Shandon CoverplateTM chamber | Thermo Scientific | 72110017 | |
| Shandon Sequenza® Immunstaining center | Thermo Scientific | 73300001 | |
| Shandon Sequenza® Immunstaining slide rack | Thermo Scientific | 73310017 | |
| Solution Citrate Buffer (10 mM pH 6.1): | 2.55 g Tri-sodium citrate dihydrate and 0.255 g Citric acid in one litre purified water. Adjust pH of working solution to 6.1 using 10 mM citric acid solution (1.05 g citric acid in 500 mL purified water) Prepare on assay day. | ||
| Tri-sodium citrate dihydrate | Sigma-aldrich | S4641-500G | |
| Citric acid | Sigma Aldrich | C0759 | |
| Staining jar and basket | Deltalab | 19360 | |
| 19361 | |||
| Superfrost Plus microscope slides | VWR | 631-0108 | |
| Tris-Buffered Saline solution (TBS) (50 mM TRIZMA BASE; 0.8% NaCI; pH 7.6): | 10xTBS (stock solution 0.5 M TRIZMA BASE; 8% NaCI; pH 7.6): TRIZMA BASE 60,57 g and NaCl 80 g in 800 mL purified water. Adjust pH of stock solution using Hydrochloric acid 37% and final volume to one litre with purified water (keep 5± 3 °C until 2 months) Dilute TBS stock solution 1/10 on assay day. | ||
| TRIZMA BASE | Sigma Aldrich | T6066-1KG | |
| Sodium Chloride (NaCl) | Merck | 106404 | |
| Xylene | Panreac Applied Chem ITW reagents | 251769 | Undiluted |
참고문헌
- WOAH, Manual of Diagnostic Tests and Vaccines for Terrestrial Animals Online Access. Chapter 3.4.5.-Bovine Spongiform Encephalopathy (Version May 2021) and Chapter 3.8.11. - Scrapie (Version May 2022). , Available from: https://www.woah.org/en/what-we-do/standards/codes-and-manuals/terrestrial-manual-online-access/ (2022).
- Ramos-Vara, J. A. Principles and methods of immunohistochemistry. Methods in Molecular Biology. 1641, 115-128 (2017).
- Krenacs, L., Krenacs, T., Stelkovics, E., Raffeld, M. Heat-Induced antigen retrieval for immunohistochemical reactions in routinely processed paraffin sections. Immunocytochemical Methods and Protocols. Methods in Molecular Biology. Oliver, C., Jamur, M. 588, 103-119 (2010).
- Duraiyan, J., Govindarajan, R., Kaliyappan, K., Palanisamy, M. Applications of immunohistochemistry). Journal Pharmacy Bioallied Sciences. 4, Suppl 2 307-309 (2012).
- Orge, L., et al. Neuropathology of Animal Prion Diseases. Biomolecules. 11 (3), 466(2021).
- US Department of Health and Human Services Public Health Service Centres for Disease Control and Prevention National Institutes of Health. Biosafety in Microbiological and Biomedical Laboratories. 6th Edition Revised June 2020. , Available from: https://www.cdc.gov/labs/pdf/SF_19_308133-A_BMBL6_00-BOOK-WEB-final-3.pdf (2022).
- APHA. Fixation, tissue processing, histology and immunohistochemistry procedures for diagnosis of animal TSE (BSE, scrapie, atypical scrapie, CWD). Histo & IHC protocols for TSE diagnosis_Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , via.gov.uk (2022).
- Sample requirements for TSE testing and confirmation. Version 1.0. TSE EURL. , Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019).
- TSE EU Reference Laboratory Guidelines for the detection of Chronic Wasting Disease in cervids. Version 1.0. TSE EURL. , Available from: https://www.izsplv.it/it/istituto/212-centri-eccellenza/laboratori-internazionali-riferimento/422-eurl_tses.html (2019).
- Machado, C. N., et al. TSE Monitoring in Wildlife Epidemiology, Transmission, Diagnosis, Genetics and Control. Wildlife Population Monitoring. IntechOpen. , (2019).
- APHA. Neuropathology: Confirmatory diagnosis of transmissible spongiform encephalopathies (TSEs) in cattle and small ruminants. Confirmatory (Histo & IHC) diagnostic criteria Rev_Jan2019.pdf. TSEglobalNet - International Reference Laboratory for TSE. , via.gov.uk (2019).
- Ryder, S. J., Spencer, Y. I., Bellerby, P. J., March, S. A. Immunohistochemical detection of PrP in the medulla oblongata of sheep: The spectrum of staining in normal and scrapie-affected sheep. The Veterinary Record. 148 (1), 7-13 (2001).
- Simmons, M. M., et al. Experimental classical bovine spongiform encephalopathy: definition and progression of neural PrP immunolabeling in relation to diagnosis and disease controls. Veterinary Pathology. 48 (5), 948-963 (2011).
- Orge, L., et al. Identification of H-type BSE in Portugal. Prion. 9 (1), 22-28 (2015).
- Orge, L., Simas, J. P., Fernandes, A. C., Ramos, M., Galo, A. Similarity of the lesion profile of BSE in Portuguese cattle to that described in British cattle. Veterinary Record. 147 (17), 486-488 (2000).
- Pires, M. A., Travassos, F. S., Gärtner, F. Atlas of veterinary pathology. Biopathology. Lidel VII. 195 (6), 179-180 (2004).
- Pires, M. A., et al. Immunology protocols, didactic series. Applied Sciences. , 357(2010).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유